Method Article
Enriquecimento de Vesículas Extracelulares Derivadas de Astrócito a partir de Plasma Humano
Neste Artigo
Resumo
Este protocolo descreve o enriquecimento de vesículas extracelulares derivadas de astrócitos (ADEVs) a partir de plasma humano. Baseia-se na separação de EVs por precipitação de polímeros, seguida de imunocaptura de ADEVs baseada em ACSA-1. A análise de ADEVs pode oferecer pistas para estudar alterações nas vias inflamatórias de pacientes vivos, de forma não invasiva por biópsia líquida.
Resumo
As vesículas extracelulares (EVs) são nanopartículas biológicas secretadas por todas as células para comunicação celular e eliminação de resíduos. Eles participam de uma vasta gama de funções, agindo e transferindo suas cargas para outras células em condições fisiológicas e patológicas. Dada a sua presença em biofluidos, os EVs representam um excelente recurso para o estudo de processos patológicos e podem ser considerados uma biópsia líquida para a descoberta de biomarcadores. Um aspecto atraente da análise de EV é que eles podem ser selecionados com base em marcadores de sua célula de origem, refletindo assim o ambiente de um tecido específico em sua carga. No entanto, uma das principais desvantagens relacionadas aos métodos de isolamento de VE é a falta de consensos metodológicos e protocolos padronizados. Os astrócitos são células gliais com papéis essenciais no cérebro. Em doenças neurodegenerativas, a reatividade dos astrócitos pode levar a uma carga EV alterada e comunicação celular aberrante, facilitando/aumentando a progressão da doença. Assim, a análise de EVs de astrócitos pode levar à descoberta de biomarcadores e potenciais alvos de doenças. Este protocolo descreve um método de 2 etapas de enriquecimento de EVs derivados de astrócitos (ADEVs) a partir de plasma humano. Primeiro, os EVs são enriquecidos a partir de plasma desfibrinado por meio de precipitação à base de polímeros. Isso é seguido pelo enriquecimento de ADEVs por meio de imunocaptura baseada em ACSA-1 com microesferas magnéticas, onde EVs ressuspensos são carregados em uma coluna colocada em um campo magnético. Os EVs ACSA-1+ marcados magneticamente são retidos dentro da coluna, enquanto outros EVs fluem. Uma vez que a coluna é removida do ímã, os ADEVs são eluídos e estão prontos para armazenamento e análise. Para validar o enriquecimento de marcadores de astrócitos, a proteína glial fibrilar ácida (GFAP), ou outros marcadores astrocíticos específicos de origem intracelular, podem ser medidos no eluato e comparados com o fluxo. Este protocolo propõe um método fácil e eficiente em termos de tempo para enriquecer ADEVs a partir de plasma que pode ser usado como uma plataforma para examinar marcadores relevantes para astrócitos.
Introdução
As vesículas extracelulares (VEs) são um grupo heterogêneo de nanopartículas membranosas secretadas por todos os tipos de células, carregando proteínas, lipídios e ácidos nucléicos1. Microvesículas (100-1000 nm), exossomos (30-100 nm) e corpos apoptóticos (1000-5000 nm) constituem os principais tipos de EV, distinguidos por seu local de origem 2,3. As EVs regulam processos fisiológicos importantes, como apresentação de antígenos e respostas imunes4, reciclagem de receptores, eliminação de metabólitos5 e comunicação celular6. A regulação desses processos pode ocorrer por ligação direta entre proteínas enriquecidas na membrana celular EV e alvos em células receptoras e/ou pela internalização e liberação de sua carga no citoplasma da célulareceptora 7. Embora os EVs desempenhem funções celulares essenciais, eles ganharam interesse crescente de uma perspectiva patológica nos campos do câncer e da neurologia. De fato, vários estudos mostraram que as EVs podem ajudar a promover a migração de células tumorais 8,9 ou semear agregados de proteínas tóxicas em doenças neurodegenerativas, como a doença de Alzheimer10,11.
As EVs podem ser selecionadas e enriquecidas a partir de biofluidos com base em marcadores de superfície celular relacionados à sua célula de origem, refletindo assim o ambiente de um tecido específico em sua carga 12,13,14,15,16,17,18,19,20. Além disso, dada a sua presença no sangue, líquido cefalorraquidiano (LCR), saliva, urina e leite materno, as EVs representam uma excelente ferramenta não invasiva para o diagnóstico e podem ser consideradas uma biópsia líquida para a descoberta de biomarcadores. Isso é de especial interesse em neurologia, dadas as dificuldades de estudar analitos cerebrais em fluidos acessíveis que não sejam o LCR.
Os astrócitos ganharam interesse crescente, pois estão na interseção da comunicação neurovascular21. Em condições fisiológicas, são responsáveis pela preservação da barreira hematoencefálica, pela reciclagem de neurotransmissores, pelo fornecimento de nutrientes e fatores de crescimento aos neurônios e outras células gliais 22,23,24 e pela defesa neuroimune, dada a sua plasticidade metabólica de estados pró-inflamatórios a anti-inflamatórios e vice-versa 25,26,27. Um mecanismo importante pelo qual os astrócitos cumprem suas funções regulatórias é a comunicação por meio de EVs28,29. A astrocitose reativa é uma característica importante de várias doenças neurodegenerativas, como a doença de Alzheimer,30 atrofia de múltiplos sistemas (AMS), paralisia supranuclear progressiva (PSP)31 e esclerose lateral amiotrófica (ELA)32. A reatividade dos astrócitos pode levar a carga EV alterada, liberação de mediadores inflamatórios e comunicação celular aberrante, facilitando a disseminação da patologia e levando à neurodegeneração10,11. Portanto, estudar EVs derivados de astrócitos (ADEVs) e mudanças em sua carga é um recurso atraente para examinar processos neurodegenerativos de maneira não invasiva.
Atualmente, existem várias metodologias para o isolamento de VEs, cada uma com suas vantagens e desvantagens correspondentes33. É essencial considerar qual método é mais adequado para um uso específico, dependendo da aplicação final de interesse. No campo da neurologia, e mais especificamente, em estudos de astrócitos, a precipitação à base de polímeros seguida de imunocaptura tem sido o método predominantemente utilizado 12,18,19,20,34. No entanto, mesmo quando se aplica a mesma abordagem, permanece heterogeneidade entre os estudos nas diferentes etapas aplicadas para o isolamento de EV. Portanto, há necessidade de uma metodologia padronizada clara e passo a passo para facilitar os estudos de EV de astrócitos e a reprodutibilidade do estudo. A precipitação à base de polímeros facilita a triagem de biomarcadores, pois é um procedimento rápido e simples que não requer equipamentos complexos, levando a um alto rendimento de EVs sem afetar sua atividade biológica35.
O presente protocolo descreve um método detalhado, simples e de duas etapas para o enriquecimento de ADEVs a partir de plasma humano. Baseia-se em uma precipitação à base de polímero da fração EV total, seguida por uma imunocaptura de EVs de astrócitos. Dadas as importantes funções dos astrócitos, a análise de ADEVs pode lançar luz para a descoberta de biomarcadores e vias inflamatórias cerebrais que podem ser estudadas de maneira não invasiva.
Protocolo
A pesquisa descrita neste protocolo foi realizada com amostras de plasma humano de doadores adultos saudáveis de ambos os sexos (faixa etária de 65,9 a 81,3 anos, 45,5% do sexo feminino), da coorte Sant Pau Initiative on Neurodegeneration (SPIN), Barcelona, Espanha36. Os participantes deram consentimento informado. O estudo foi realizado seguindo as diretrizes éticas internacionais para pesquisa médica contidas na declaração de Helsinque e na lei espanhola. O Comitê de Ética em Pesquisa de Sant Pau (CEIC) revisou e aprovou o protocolo para coleta e armazenamento de amostras de plasma humano da coorte SPIN (#16/2013).
1. Enriquecimento de EVs de astrócitos a partir de plasma humano
NOTA: Este protocolo envolve o uso de amostras de plasma humano. Todos os detalhes sobre reagentes e material de laboratório usados neste protocolo estão incluídos na Tabela de Materiais. Nenhum equipamento especial é necessário para este procedimento, no entanto, revise as considerações de segurança de cada reagente, conforme especificado individualmente por cada fabricante.
- Coleta e armazenamento de amostras
- Coletar sangue em tubos vacutainer de EDTA lavanda, seguindo protocolos padronizados para a coleta de plasma 36,37. Centrifugue a 2000 x g por 10 min a 4 °C dentro de 30-120 min após a coleta para separação do plasma. Separe o plasma, que é o líquido claro superior que aparece como sobrenadante, em alíquotas de 500 μL.
- Para remover os detritos celulares, centrifugue as alíquotas a 3000 x g por 15 min em temperatura ambiente. Recupere o sobrenadante. Conservar o plasma a -80 °C até à análise. Como é prática comum para análises de biofluidos, alíquota das amostras antes do armazenamento e evite mais de três ciclos de congelamento e descongelamento.
- Enriquecimento total de EV
NOTA: Todos os reagentes utilizados devem ser filtrados através de um filtro de 0,22 μm.- Descongele 500 μL de amostras de plasma. Adicione trombina na proporção de 1:100 para remover os fatores de coagulação. Misture por inversão três vezes e deixe descansar por 5 min em temperatura ambiente.
- Complete o volume para atingir 1 mL com a solução salina tamponada com fosfato (DPBS) de Dulbecco: DPBS + 3x coquetel inibidor de protease concentrado (diluído a partir de 10x coquetel de inibidor de protease). Misture por inversão.
- Centrifugar as amostras a 6000 x g durante 20 min a 4 °C. Recupere o sobrenadante. Complete o volume com a solução de trabalho DBPS para atingir 1 mL.
- Adicionar 252 μL da solução de precipitação EV e misturar por inversão três vezes. Incubar a 4 °C durante 60 min.
- Centrifugar as amostras a 1500 x g durante 20 min a 4 °C para precipitar a fracção EV total (pellet). Colete 1 mL do sobrenadante. Rotular a fração como plasma empobrecido de EV para usar como controle negativo dos marcadores de enriquecimento de EV (sem EVs) e armazenar a -80 °C.
- Centrifugue o restante pellet a 1500 x g por 5 min a 4 °C. Descarte o sobrenadante restante. Ressuspenda o pellet em 500 μL de água ultrapura contendo inibidores concentrados de protease e fosfatase (concentração final 3x, diluída de um estoque de 100x, consulte a Tabela de Materiais).
- Pipete vigorosamente para cima e para baixo para soltar o pellet, evitando a formação de espuma; vórtice e agite em um agitador de tubo rotativo por 30 min em temperatura ambiente até a ressuspensão completa. Garanta a ressuspensão completa do pellet, pois é uma etapa crítica para a etapa subsequente de imunocaptura.
- Imunocaptura de ADEVs
NOTA: ADEVs carregam marcadores de astrócitos. O marcador selecionado para enriquecimento de ADEV via imunocaptura é GLAST. GLAST, que significa transportador de glutamato-aspartato (UniProtKB-P43003), é o transportador de glutamato mais abundante predominantemente expresso por astrócitos no cerebelo e no neocórtex cerebral38. O anticorpo anti-GLAST (ACSA-1, antígeno de superfície celular de astrócitos-1) é específico para um epítopo extracelular de GLAST e foi desenvolvido para a identificação de astrócitos. É o alvo mais utilizado para a imunocaptura de ADEVs do plasma humano 12,20,34.- Adicione 10 μL de anticorpo biotinilado anti-GLAST (ACSA-1) a cada amostra contendo a preparação total de EV. Misture bem e delicadamente. Incubar durante 1 h a 4 °C num agitador de tubos rotativos.
- Adicione 10 μL de microesferas magnéticas conjugadas a anticorpos monoclonais anti-biotina (IgG1 de camundongo). Misture bem e delicadamente. Incubar durante 1 h a 4 °C num agitador de tubos rotativos.
- Coloque uma microcoluna no campo magnético de um separador MACS. Preparar a coluna enxaguando-a com 500 μL de albumina de soro bovino (BSA) PBS-0,5%. Descarte o fluxo.
- Carregue a suspensão EV/ACSA-1/microesferas na coluna. Não empurre com o êmbolo nesta etapa. Colete o fluxo. Rotule isso como EVs não astrocíticos (sem ADEVs) e mantenha como controle, se necessário.
- Lave a coluna duas vezes com 500 μL de PBS-0,5% BSA. Descarte o fluxo.
- Remova a coluna do separador magnético e coloque-a em um tubo de coleta de 1,5 mL de baixa aderência. Pipetar 500 μL de PBS-0,5% BSA na coluna. Empurrar firmemente com um êmbolo para dentro da coluna e recolher o eluído.
- Rótulo como ACSA-1+ EVs (ADEVs). Armazene EVs não lisados a -20 °C por curtos períodos ou a -80 °C por períodos mais longos (>6 meses).
NOTA: Os anticorpos anti-ACSA-1 se ligarão ao epítopo GLAST-1 / EAAT-1. As microesferas magnéticas se ligam com afinidade ao complexo anti-ACSA-1-EV. As microcolunas MACS contêm uma matriz otimizada para gerar um campo magnético forte quando colocadas em um ímã, que é necessário para reter os ADEVs rotulados.
Para uma representação esquemática do procedimento de enriquecimento do ADEV, consulte a Figura 1.
- Lise de EVs
NOTA: Os EVs devem ser completamente lisados para a detecção de marcadores intravesiculares. Recomenda-se o uso de dois métodos sequenciais, como químico seguido de lise mecânica.- Realize uma lise química de EVs adicionando reagente de extração de proteínas (consulte a Tabela de Materiais) em uma proporção de 100 μL de amostra por 150 μL de reagente de extração. Adicione 100x inibidores de protease e fosfatase para atingir uma concentração final de 1x. Vortex vigorosamente e deixe descansar em temperatura ambiente por 15 min.
- Efectuar uma lise mecânica através de um procedimento em duas fases: passar a solução EV quimicamente lisada por uma seringa duas vezes (agulha G29). Em seguida, sonicar as amostras durante 45 s num banho de água fria ultrassónico. Congele os EVs lisados a -80 °C.
- Descongelar as amostras a 37 °C durante 5 min. Congele novamente a -80 °C para o armazenamento de EVs lisados. Descongele novamente por 5 min a 37 °C antes da análise.

Figura 1: Representação esquemática do procedimento de duas etapas para o enriquecimento de EVs derivados de astrócitos. Na primeira etapa, os EVs são enriquecidos a partir de plasma humano desfibrinado por etapas de precipitação e centrifugação à base de polímeros. Após a ressuspensão total do EV, os EVs de astrócitos são então selecionados por imunocaptura com anticorpos anti-GLAST biotinilados (ACSA-1) e microesferas magnéticas anti-biotina. Abreviaturas: ACSA-1 = antígeno-1 da superfície celular dos astrócitos; ADEVs = vesículas extracelulares derivadas de astrócitos; DPBS = solução salina tamponada com fosfato de Dulbecco; EVs = vesículas extracelulares; GLAST = transportador de glutamato-aspartato; Sem ADEVs = vesículas extracelulares não astrocíticas; Sem EVs = Sem vesículas extracelulares (plasma empobrecido em EV); PIC = coquetel de inibidores de protease; RT = temperatura ambiente. Figura criada com BioRender. Clique aqui para ver uma versão maior desta figura.
2. Validação do protocolo
- Caracterização da fração EV total antes da imunocaptura
- Use EVs totais lisados (pellet ressuspenso após precipitação de polímero) e amostras de plasma diluído para análise de Western blot. Complemente as amostras com 4x tampão de amostra Laemmli (5 μL para 15 μL de amostra), ferva por 10 min a 90 °C e carregue em géis de acrilamida sem manchas a 10%.
- Realize eletroforese em gel de poliacrilamida SDS (SDS-PAGE) em tampão Tris/Glicina/SDS a 80 V por 30 min, seguido de 200 V por 40 min. Após o SDS-PAGE, remova o gel das placas de vidro e visualize o conteúdo total de proteína após uma excitação UV de 1 min.
- Transfira as proteínas do gel para uma membrana de PVDF de 0,2 μm ativada por metanol através de um sistema semi-seco a 25 V, 2,5 A por 10 min (consulte a Tabela de Materiais para obter detalhes sobre o equipamento). Após a transferência, bloquear a membrana no tampão de bloqueio por 5 min à temperatura ambiente e, posteriormente, incubar durante a noite a 4 ° C com os anticorpos primários para Alix (1: 1000), CD9 (1: 1000) ou Calnexina (1: 1000); consulte a Tabela de Materiais para obter detalhes.
- Lave a membrana em solução salina tamponada com Tris com Tween 20 a 0,1% (TBST) três vezes por 10 min e incube por 1 h em temperatura ambiente com um anticorpo secundário HRP anti-coelho diluído a 1:7500 em tampão de bloqueio. Lave a membrana em TBST quatro vezes por 10 min. Execute todas as lavagens e etapas de incubação com agitação suave da membrana em um balancim de bancada.
- Misturar na proporção de 1:1 a solução quimioluminescente com o tampão peróxido e incubar as membranas durante 5 min à temperatura ambiente. Exponha e adquira bandas usando um sistema de imagem de quimioluminescência (consulte a Tabela de Materiais para obter detalhes).
- Validação do enriquecimento de marcadores específicos de astrócitos na fração ADEV
NOTA: A proteína ácida fibrilar glial (GFAP) é a principal proteína de filamento intermediário nas células astrocíticas e um elemento essencial de seu citoesqueleto durante o desenvolvimento. A GFAP pode ser detectada no tecido cerebral e nos biofluidos, sendo um conhecido marcador de astrócitos39. Portanto, esse marcador foi quantificado usando uma tecnologia comercial de detecção de biomarcadores para demonstrar o enriquecimento de marcadores derivados de astrócitos na fração ADEV. Esta tecnologia de biomarcadores é uma técnica ultrassensível que permite a medição de moléculas de proteína única com uma sensibilidade de até 1.000 vezes maior do que os imunoasays convencionais. Esta técnica é baseada no uso de micropartículas paramagnéticas acopladas a anticorpos projetados para se ligar a alvos específicos40,41 (ver Tabela de Materiais).- Use amostras EV lisadas para análise de biomarcadores. Para testar o enriquecimento de marcadores de astrócitos, compare os níveis de GFAP no eluato (ADEVs) versus o fluxo (sem ADEVs) usando um imunoensaio ultrassensível comercial.
- Dilua as amostras na proporção de 1:4 (25 μL de EVs + 75 μL de tampão de ensaio), prepare os calibradores e conduza o ensaio no equipamento de detecção de biomarcadores, conforme especificado pelas instruções do fabricante (consulte a Tabela de Materiais). As amostras podem ser diluídas diretamente na placa.
- Teste as amostras e calibradores em duplicata. A faixa de quantificação para o ensaio GFAP foi de 1,37-1000 pg/mL. Use a plataforma de análise de software do fabricante para calcular as concentrações de GFAP a partir da curva de calibração.
- Para estimar o coeficiente de variação (CV) do protocolo de enriquecimento de marcadores de astrócitos, medir os níveis de GFAP em preparações de ADEV obtidas a partir de réplicas idênticas de amostras de plasma humano agrupadas e calcular o CV como desvio-padrão/média x 100. Neste protocolo, o CV foi calculado usando N = 10 amostras de plasma idênticas.
- Validação do enriquecimento de marcadores EV na fração ADEV
- Para validar o enriquecimento dos marcadores EV, medir os níveis de Alix e CD81 por ELISA (ver Tabela de Materiais) em amostras EV não diluídas lisadas, seguindo as recomendações do fabricante. Amostras de teste e calibradores em duplicata.
- Leia as placas a 450 nm e 570 nm usando um leitor de microplacas. Use uma curva de calibração linear para calcular as concentrações de Alix e CD81. A faixa de quantificação para o ensaio de Alix foi de 47-3000 pg/mL e para CD81 foi de 0,156-10 ng/mL.
- Caracterização do tamanho e morfologia de ADEVs
- Análise de rastreamento de nanopartículas
- Use a análise de rastreamento de nanopartículas (NTA) para medir a concentração de partículas e a distribuição de tamanho de preparações EV frescas não lisadas.
- Dilua suspensões ADEV novas e não lisadas (10 μL) com PBS filtrado de acordo com a faixa de detecção do instrumento (20-100 partículas/quadro), usando o software fornecido, grave três vídeos de 60 s com as seguintes configurações: taxa de fluxo da seringa em 30 u.a., nível da câmera em 13 e o limiar de detecção em 5. Corrija as concentrações de partículas para o volume da amostra de entrada, volume de ressuspensão EV e diluição necessária para a leitura do NTA.
NOTA: Recomenda-se pré-visualizar uma amostra contendo a solução do veículo EV para verificar o efeito da matriz e a pureza do meio em que os EVs são ressuspensos.
- Microscopia crioeletrônica
- Use microscopia crioeletrônica (Cryo-EM) para confirmar a presença e morfologia de Evs em suspensões ADEV frescas e não lisadas (4 μL). Vitrificar as amostras usando um freezer de imersão comercial em grades de carbono Holey com as seguintes configurações: 3,9 μL de amostra, tempo de espera de 10 s, tempo de blot de 2 s.
- Mergulhe em etano-nitrogênio líquido em uma estação de trabalho criogênica. Transferir as grelhas para um criosuporte mantido a -179 °C para análise por microscopia electrónica de transmissão. Examine os EVs com um microscópio eletrônico de transmissão operando a uma tensão de aceleração de 200 kV e equipado com uma câmera CCD. Adquira micrografias usando software.
- Análise de rastreamento de nanopartículas
- Análise da coprecipitação de lipoproteínas
- Determine os níveis de ApoB humana em plasma não diluído, amostras EV totais lisadas e amostras ADEV lisadas com um ensaio imunoturbidimétrico usando um kit comercial adaptado para um autoanalisador comercial (consulte a Tabela de Materiais para obter mais detalhes).
- Análise de marcadores inflamatórios em ADEVs
- Use um ensaio baseado em esferas (consulte a Tabela de Materiais) para quantificar a concentração de 25 marcadores inflamatórios: eotaxina, IFN Alfa2, IFN Gama, IL-1 Alfa, IL-1 Beta, IL-3, IL-6, IL-8, IL-10, IL-12 (p40), IL-12 (p70), IL-15, IL-17A, IL-17E / IL-25, IL-17F, IL-18, IP-10, MCP-1, MCP-3, MDC, MIP-1 Alfa, MIP-1 Beta, TGF Alfa, TNF Alfa, TNF Beta.
- Utilizar preparações EV não diluídas lisadas (25 μL) e incubar as amostras com os grânulos durante a noite a 4°C, seguindo as instruções do fabricante. Lave a placa, incube com 25 μL de anticorpos de detecção e incube por 1 h com agitação à temperatura ambiente.
- Adicione 25 μL de estreptavidina-PE a cada poço e incube por 30 min em temperatura ambiente. Adicione 150 μL de fluido da bainha e incube por 5 min sob agitação. Leia a placa no leitor de placas conectado ao sistema.
NOTA: Esta técnica é baseada em imunoensaios usando anticorpos que se ligam à superfície de microesferas magnéticas revestidas com fluorescência. Essa tecnologia codifica internamente as microesferas por sua cor com diferentes corantes. Cada tipo de microesfera é revestido com um anticorpo de captura específico, de modo que vários grânulos conjugados capturam os analitos incorporados nas amostras, permitindo a detecção multiplex quantitativa de dezenas de analitos simultaneamente. O sistema usa a plataforma de imunoensaio multiplexado baseada em esferas para detecção de sinal43.
3. Análise dos dados
- Realize análises estatísticas com software comercial. Avalie a normalidade dos dados com o teste de Shapiro-Wilk. Teste comparações de dois grupos com o teste U de Mann-Whitney e comparações de três grupos com o teste de Kruskal-Wallis e correção post-hoc de Dunn. Defina a significância em p < 0,05.
Resultados
O isolamento de ADEVs do plasma coletado de doadores saudáveis foi realizado com sucesso. Um método de precipitação à base de polímero foi empregado para obter a fração EV total, seguido de uma imunocaptura com microesferas magnéticas para obter ADEVs.
A análise de Western blot da fração EV total antes da etapa de imunocaptura indicou a falta de calnexina (marcador de contaminação celular) e a presença de Alix e da proteína transmembrana CD9 nas preparações de EV (Figura 2A).
Após a imunocaptura, a presença e o enriquecimento de marcadores vesiculares e astrocíticos foram validados na fração ADEV. As concentrações de GFAP foram significativamente maiores nos ADEVs em comparação com a fração sem ADEV (flow-through), mostrando um enriquecimento de seis vezes (p = 0,008). Isso confirma a origem predominantemente astrocítica dos EVs na fração ADEV (Figura 2B). O CV da quantificação de GFAP em preparações de ADEV de 10 amostras idênticas foi de 25%.
Para confirmar a presença de marcadores vesiculares nas preparações de ADEV, dois marcadores foram examinados: Alix, um marcador vesicular citosólico clássico42, e a proteína transmembrana CD8144. Os níveis de Alix foram maiores na fração ADEV em comparação com o plasma livre (p = 0,001), bem como com o plasma depletado de EV, referido como sem EVs (p = 0,0007; Figura 2C). Os ADEVs também mostraram o enriquecimento do CD81 em comparação com o plasma livre (p = 0,03; Figura 2D).
Para caracterizar ainda mais a população de ADEV, o perfil de tamanho e contagem foi analisado por NTA e a morfologia por crio-EM. A análise NTA mostrou um perfil homogêneo de EVs com tamanho médio de 93,7 ± 2,7 nm, consistente com o tamanho de EVs pequenos (microvesículas e exossomos). Além disso, a caracterização por crio-EM confirmou ainda mais a presença e a morfologia esperada de EVs (Figura 2E).
Dado que as lipoproteínas podem co-precipitar com EVs, os níveis de ApoB foram analisados em diferentes frações. Os resultados mostram que, após a etapa de imunocaptura, os níveis de ApoB são mínimos nas preparações de ADEV, sendo maiores no plasma (p = 0,005; Figura 2F).
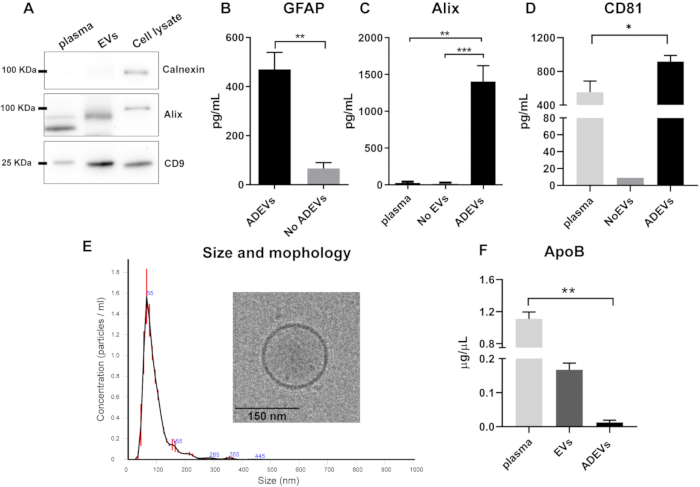
Figura 2: Caracterização das frações totais de EV e ADEV. (A) Western blot representativo mostrando falta de calnexina e presença de Alix e CD9 em preparações totais de EV. (B) A fração de ADEV apresentou níveis aumentados de GFAP em comparação com os Sem ADEVs (ADEV, n = 7; Sem ADEV, n = 7; p = 0,008). (C) Níveis mais elevados de Alix foram detectados em ADEVs em comparação com plasma (p = 0,001) e No EVs (p = 0,0007); plasma: n = 6; Sem EVs: n = 6; ADEVS: n = 16. (D) Níveis mais elevados de CD81 foram detectados na fração ADEV em comparação com o plasma (p = 0,003); plasma: n = 5; Sem EVs: n = 1 (CD81 foi indetectável em oito das nove amostras sem EV); ADEVS: n = 17. (E) A análise NTA revelou a presença de partículas com tamanho médio de 93,7 ± 2,7 nm e cuja característica vesicular foi confirmada por crio-EM. (F) A ApoB foi significativamente menor na fração ADEV em comparação com a plasmática (p = 0,005); plasma: n = 4; VEs: n = 4; ADEVS: n = 4. Abreviaturas: ADEVs = vesículas extracelulares derivadas de astrócitos; Alix = proteína de interação 6 de morte celular programada (PDCD6IP); ApoB = Apolipoproteína B; EVs = preparações totais de vesículas extracelulares após precipitação à base de polímeros; GFAP = proteína glial fibrilar ácida; Sem ADEVs = vesículas extracelulares não astrocíticas; Sem EVs = Sem vesículas extracelulares (plasma empobrecido em EV). Para (B), foi utilizado o teste de Mann Whitney bicaudal (**p < 0,01) e para (C,D,F), foram utilizados os testes de comparações múltiplas de Kluskal-Wallis e Dunn (*p < 0,05, **p < 0,01 e ***p < 0,0001). Os gráficos ilustram a média e as barras de erro mostram o erro padrão. Clique aqui para ver uma versão maior desta figura.
Finalmente, a aplicabilidade deste protocolo foi examinada usando ADEVs para quantificar marcadores inflamatórios. Todas as 25 citocinas inflamatórias no painel foram detectáveis em ADEVs obtidos de doadores saudáveis (Figura 3).

Figura 3. Quantificação de citocinas inflamatórias na fração ADEV. Um painel de 25 citocinas inflamatórias em ADEVs de doadores saudáveis revelou que todas elas eram detectáveis e expressas diferencialmente (HC, n = 3). O gráfico ilustra a média e as barras de erro mostram o erro padrão. Clique aqui para ver uma versão maior desta figura.
Discussão
Os EVs ganharam forte interesse na pesquisa biomédica devido ao seu potencial diagnóstico e terapêutico. Atualmente, uma das principais desvantagens relacionadas aos métodos de isolamento de VE é a falta de consenso metodológico e protocolos padronizados. Este estudo fornece um protocolo detalhado para o enriquecimento de EVs de astrócitos a partir de plasma humano por meio de precipitação à base de polímero e imunocaptura de GLAST.
Existem diferentes metodologias para o isolamento de EVs de fluidos corporais, cada uma com suas próprias vantagens e limitações. A abordagem baseada em polímeros foi escolhida devido à sua simplicidade, facilidade de uso, não demorada, sem necessidade de um instrumento específico, alto rendimento de EV e por ser amplamente utilizada em estudos de biomarcadores EV em neurologia 12,18,19,20, permitindo a comparação dos resultados. No entanto, métodos alternativos, como a cromatografia de exclusão de tamanho, também podem ser testados. Uma crítica comum aos métodos baseados em polímeros é a co-precipitação de lipoproteínas junto com os EVs. No entanto, a etapa adicional de imunocaptura com anticorpos ACSA-1 e lavagens subsequentes podem superar essa limitação ligando-se seletivamente a ADEVs, minimizando a contaminação com lipoproteínas, como visto com a análise de ApoB. Ao usar este protocolo para estudos quantitativos, o CV intra-ensaio deve ser considerado, particularmente com amostras pequenas. Outra limitação desse procedimento é que traços mínimos de polímero podem interferir em certas análises a jusante, como espectrometria de massa. Por conseguinte, a combinação deste protocolo com métodos analíticos subsequentes deve ser ensaiada para cada utilização específica.
O protocolo descrito neste estudo foi validado para o enriquecimento de marcadores astrocíticos e vesiculares na fração ADEV. A imunocaptura de EV de astrócitos foi conduzida usando GLAST como alvo e validou a origem astrocítica dos EVs, conforme mostrado pelo enriquecimento sêxtuplo de um marcador astrocítico adicional, GFAP. Embora este procedimento tenha sido testado e otimizado para enriquecimento de ADEV a partir de plasma humano de idosos saudáveis, certas etapas do protocolo podem ser modificadas e adaptadas de acordo com a aplicação a jusante a ser usada. Por exemplo, o uso de água ultrapura para ressuspensão de pellets é preferido para imunoprecipitação subsequente. Além disso, a etapa de incubação de anticorpos e esferas magnéticas (tempo e concentração) pode ser modificada para concentrar ou diluir ADEVs conforme desejado.
As etapas críticas do protocolo incluem a ressuspensão mecânica do pellet EV antes da etapa de imunocaptura. Os EVs peletizados devem ser tratados com muito cuidado, evitando a formação de espuma durante a ressuspensão. Deve-se atentar também para o uso de inibidores de protease concentrados 3x nos tampões, para inibir proteases ativas presentes no plasma. Além disso, é crucial não empurrar com o êmbolo para a coluna em etapas anteriores à eluição dos ADEVs retidos na coluna.
Embora existam estudos usando essa abordagem (precipitação baseada em polímero + imunoprecipitação) para isolar ADEVs de indivíduos com doença de Alzheimer e lesão cerebral traumática 12,20,34, os ADEVs permanecem pouco investigados em relação a EVs de outras origens celulares (por exemplo, neurônios) e merecem mais pesquisas.
Certas doenças neurodegenerativas, como a doença de Alzheimer e a síndrome de Down, têm sido associadas a anormalidades endossômicas e aumento da secreção de EV 45,46,47. Uma maneira de explicar a maior secreção de EV é quantificar os níveis de um marcador EV, como Alix e CD81, como feito neste estudo, ou outras tetraspaninas, como CD63 ou CD9, para normalizar os níveis do analito de interesse. Além de validar o enriquecimento de marcadores astrocíticos e EV, foi testada a utilidade do protocolo para medir citocinas inflamatórias em ADEVs. Usando uma plataforma multiplex, concentrações detectáveis e quantitativas de 25 citocinas e quimiocinas foram obtidas na fração ADEV.
Portanto, este procedimento permite a coleta de EVs que podem ser usados como uma plataforma de descoberta de biomarcadores, bem como uma ferramenta não invasiva para o estudo de mecanismos e vias moleculares relacionadas aos astrócitos. De fato, o estudo de ADEVs tem um enorme potencial nos campos de doenças neurológicas, uma vez que a carga de ADEV pode ser usada como um recurso para explorar o fenótipo dos astrócitos e as mudanças ao longo de diferentes estágios da doença.
Embora este manuscrito descreva extensivamente a metodologia, é essencial considerar as vantagens e limitações desse método e a aplicabilidade apropriada. De fato, existem importantes esforços de padronização no campo de EV, como as extensas recomendações de pesquisa e etapas de validação descritas pelas diretrizes MISEV da Sociedade Internacional de Vesículas Extracelulares48 e a plataforma EV-track para o relato de informações metodológicas sobre estudos de EV49.
Divulgações
O Dr. Belbin relatou ter recebido honorários pessoais da ADx NeuroSciences fora do trabalho enviado. O Dr. Alcolea relatou ter recebido honorários pessoais por serviços de conselho consultivo e/ou honorários de palestrante da Fujirebio-Europe, Roche, Nurtricia, Krka Farmacéutica, Zambon S.A.U. e Esteve fora do trabalho submetido. O Dr. Lleó atuou como consultor ou em conselhos consultivos da Fujirebio-Europe, Roche, Biogen, Grifols e Nutricia fora do trabalho submetido. O Dr. Fortea relatou ter recebido honorários pessoais por serviços nos conselhos consultivos, comitês de adjudicação ou honorários de palestrantes da AC Immune, Novartis, Lundbeck, Roche, Fujirebio e Biogen fora do trabalho enviado. Os Drs. Alcolea, Belbin, LLeó e Fortea relatam possuir uma patente para marcadores de sinaptopatia em doenças neurodegenerativas (licenciada para ADx, EPI8382175.0). Nenhuma outra divulgação foi relatada. Todos os outros autores não têm mais nada a divulgar.
Agradecimentos
Os autores gostariam de agradecer a ajuda de Soraya Torres, Shaimaa El Bounasri El Bennadi e Oriol Sanchez Lopez para o manuseio e preparação das amostras. Agradecemos também a colaboração de José Amable Bernabé, do ICTS "NANBIOSIS", unidade 6 (Unidade de CIBER em Bioingineering, Biomateriais e Nanomedicina) do Instituto de Ciência dos Materiais de Barcelona, Marti de Cabo Jaume da Unidade de Microscopia Eletrônica da Universitat Autonoma de Barcelona, Dra. Marta Soler Castany e Lia Ros Blanco da Plataforma de Citometria de Fluxo do Instituto de Pesquisa Biomédica de Sant Pau (IIB-Sant Pau), bem como ao Dr. Joan Carles Escolà-Gil, do grupo de Fisiopatologia de doenças relacionadas a lipídios do IIB-Sant Pau, pela ajuda nas determinações de NTA, crio-EM, Luminex e ApoB, respectivamente.
Os autores agradecem o apoio financeiro da Fundação Jérôme Lejeune (Projeto # 1941 e # 1913 para MFI e MCI), Instituto de Salud Carlos III (PI20 / 01473 para JF, PI20 / 01330 para AL, PI18 / 00435 para DA e INT19 / 00016 para DA), o Instituto Nacional de Saúde (1R01AG056850-01A1, R21AG056974 e R01AG061566 para JF), a Associação de Alzheimer e o Instituto Global de Saúde do Cérebro (GBHI_ALZ-18-543740 para MCI), a Associação para a Degeneração Frontotemporal (Bolsa de Pós-Doutorado em Pesquisa Clínica, AFTD 2019–2021) para ODI, e a Societat Catalana de Neurologia (Premi Beca Fundació SCN 2020 para MCI). Este trabalho também foi apoiado pelo programa CIBERNED (Programa 1, Doença de Alzheimer para AL e estudo SIGNAL. SS é bolsista de pós-doutorado "Juan de la Cierva-Incorporación" (IJC2019-038962-I) da Agencia Estatal de Investigación, Ministerio de Ciencia e Innovación (Gobierno de España).
Materiais
| Name | Company | Catalog Number | Comments |
| Anti-Alix primary antibody for Western blotting | EMD Millipore | ABC40 | |
| µMACS Separator | Miltenyi Biotec | 130-042-602 | The µMACS Separator is used in combination with µ Columns and MACS MicroBeads. |
| Anti-calnexin primary antibody for Western blotting | Genetex | GTX109669 | |
| Anti-CD9 primary antibody for Western blotting | Cell Signaling | 13174 | |
| Blocker BSA (10%) 200 mL | Thermo Fisher | 37525 | |
| Bransonic 1510E-MT Ultrasonic bath | Branson | ||
| COBAS 6000 autoanalyzer | Roche Diagnostics | Analyzer for immunoturbidimetric determination of ApoB; commercial autoanalyzer | |
| cOmplete Protease Inhibitor Cocktail (EDTA-free) | Roche | 11873580001 | |
| Digital Micrograph 1.8 | micrograph software | ||
| Dulbecco's PBS Mg++, Ca++ free 500 mL | Thermo Fisher | 14190144 | |
| EveryBlot Blocking Buffer | BioRad | 12010020 | |
| Exoquick (exosome precipitation solution 5 mL) + Thrombin | System Bioscience | EXOQ5TM-1 | ExoQuick 20 mL can also be purchased (EXOQ20A-1) |
| Gatan 895 USC 4000 | camera | ||
| GeneGnome XRQ chemiluminiscence imaging system | Syngene | ||
| Human CD81 antigen (CD81) ELISA kit | Cusabio | CSB-EL004960HU | |
| Human Programmed cell death 6-interacting protein (PDCD6IP) ELISA kit | Cusabio | CSB-EL017673HU | |
| Immun-Blot PVDF Membrane | BioRad | 1620177 | |
| JEOL 2011 transmission electron microscope | JEOL LTD | Equipped with a CCD Gatan 895 USC 4000 camera (Gatan 626, Gatan, Pleasanton, USA) | |
| Lavender EDTA BD Vacutainer K2E tubes | Becton dickinson | 367525 | |
| Leica EM GP | Leica Microsystem | commercial plunge freezer | |
| Low binding microtubes 1,5 mL | Deltalab | 4092.3NS | |
| MACS µ Columns with plungers | Miltenyi Biotec | 130-110-905 | µ Columns with plungers are especially designed for isolation of exosomes from body fluids |
| MACS Multistand | Miltenyi Biotec | 130-042-303 | |
| MAGPIX plate reader | Luminex Corporation | 80-073 | Luminex's xMAP multiplexing unit (Luminex xPonent v 4.3 software) |
| MicroBead Kit100 μL Anti-GLAST (ACSA-1)-Biotin, human, mouse, rat – small size; 100 μL Anti-Biotin MicroBeads | Miltenyi Biotec | 130-095- 825 | |
| MILLIPLEX MAP Kit Human cytokine/Chemokine/Growth Factor Panel A magnetic bead panel | EMD Millipore | HCYTA-60K-25 | |
| M-PER Mammalian Protein Extraction Reagent 25 mL | Thermo Fisher | 78503 | For certain applications like Western blot, more aggressive lysis buffers can be used (e.g. RIPA) |
| MultiSkan SkyHigh Microplate Spectrophotometer | Thermofisher | A51119500C | |
| NanoSight NS300 | Malvern Panalytical | NTA; 3.4 version | |
| Pierce Halt Protease and Phosphatase Inhibitor Cocktail | Thermo Fisher | 78441 | |
| Polypropylene syringe (G29) | PeroxFarma | 1mL syringe; 0.33x12mm-G29x1/2" | |
| Secondary anti-rabbit antibody | Thermo Fisher | 10794347 | |
| Simoa GFAP Discovery Kit | Quanterix | 102336 | |
| Simoa, SR-X instrument | Quanterix | SR-X Ultra-Sensitive Biomarker Detection System; commercial biomarker detection technology | |
| Specific Protein Test Apolipoprotein B - APOB (100 det) COBAS C/CI | Roche Diagnostics | 3032574122 | |
| SuperSignal West Femto | Thermo Fisher | 34095 | Ultra-sensitive enhanced chemiluminescent (ECL) HRP substrate |
| Trans-Blot Turbo Transfer System | BioRad | 1704150 |
Referências
- Pathan, M., et al. Vesiclepedia 2019: a compendium of RNA, proteins, lipids and metabolites in extracellular vesicles. Nucleic Acids Research. 47, 516-519 (2019).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Gustafson, D., Veitch, S., Fish, J. E. Extracellular vesicles as protagonists of diabetic cardiovascular pathology. Frontiers in Cardiovascular Medicine. 4, 71 (2017).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Harding, C. V., Heuser, J. E., Stahl, P. D. Exosomes: Looking back three decades and into the future. Journal of Cell Biology. 200 (4), 367-371 (2013).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Hood, J. L., San Roman, S., Wickline, S. A. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis. Cancer Research. 71 (11), 3792-3801 (2011).
- Rak, J. Microparticles in cancer. Seminars in Thrombosis and Hemostasis. 36 (8), 888-906 (2010).
- Ledreux, A., et al. Small neuron-derived extracellular vesicles from individuals with down syndrome propagate tau pathology in the wildtype mouse brain. Journal of Clinical Medicine. 10 (17), 3931 (2021).
- Winston, C. N., et al. Prediction of conversion from mild cognitive impairment to dementia with neuronally derived blood exosome protein profile. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 3, 63-72 (2016).
- Goetzl, E. J., Schwartz, J. B., Abner, E. L., Jicha, G. A., Kapogiannis, D. High complement levels in astrocyte-derived exosomes of Alzheimer's disease. Annals of Neurology. 83 (3), 544-552 (2018).
- Fiandaca, M. S., et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimer's and Dementia. 11 (6), 600-607 (2015).
- Mustapic, M., et al. Plasma extracellular vesicles enriched for neuronal origin: A potential window into brain pathologic processes. Frontiers in Neuroscience. 11, 278 (2017).
- Hamlett, E. D., et al. Neuronal exosomes reveal Alzheimer's disease biomarkers in Down syndrome. Alzheimer's and Dementia. 13 (5), 541-549 (2017).
- Goetzl, E. J., et al. Abnormal levels of mitochondrial proteins in plasma neuronal extracellular vesicles in major depressive disorder. Molecular Psychiatry. 26 (12), 7355-7362 (2021).
- Goetzl, E. J., et al. Neuron-derived exosome proteins may contribute to progression from repetitive mild traumatic brain injuries to chronic traumatic encephalopathy. Frontiers in Neuroscience. 13, 452 (2019).
- Goetzl, E. J., et al. Cargo proteins of plasma astrocyte-derived exosomes in Alzheimer's disease. FASEB Journal. 30 (11), 3853-3859 (2016).
- Goetzl, E. J., et al. Traumatic brain injury increases plasma astrocyte-derived exosome levels of neurotoxic complement proteins. FASEB Journal. 34 (2), 3359-3366 (2020).
- Nogueras-ortiz, C. J., et al. Astrocyte- and neuron-derived extracellular vesicles from Alzheimer's disease patients effect complement-mediated neurotoxicity. Cells. 9 (7), 1618 (2020).
- Haydon, P. G., Carmignoto, G. Astrocyte control of synaptic transmission and neurovascular coupling. Physiological Reviews. 86 (3), 1009-1031 (2006).
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Rothstein, J., et al. Antisense knockout of glutamate transporters reveals a predominant role for astroglial glutamate transport in excitotoxicity and clearance of extracellular glutamate. Neuron. 16 (3), 675-686 (1996).
- Vasile, F., Dossi, E., Rouach, N. Human astrocytes: structure and functions in the healthy brain. Brain Structure and Function. 222 (5), 2017-2029 (2017).
- Balu, D. T., et al. Neurotoxic astrocytes express the D-serine synthesizing enzyme, serine racemase, in Alzheimer's disease. Neurobiology of Disease. 130, 104511 (2019).
- Sofroniew, M. V. Astrocyte barriers to neurotoxic inflammation. Nature Reviews Neuroscience. 16 (5), 249-263 (2015).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24 (7), 931-938 (2018).
- Bianco, F., et al. Acid sphingomyelinase activity triggers microparticle release from glial cells. EMBO Journal. 28 (8), 1043-1054 (2009).
- Datta Chaudhuri, A., et al. Stimulus-dependent modifications in astrocyte-derived extracellular vesicle cargo regulate neuronal excitability. Glia. 68 (1), 128-144 (2020).
- Serrano-Pozo, A., Gómez-Isla, T., Growdon, J. H., Frosch, M. P., Hyman, B. T. A phenotypic change but not proliferation underlies glial responses in Alzheimer disease. American Journal of Pathology. 182 (6), 2332-2344 (2013).
- Tong, J., et al. Low levels of astroglial markers in Parkinson's Disease: relationship to α-synuclein accumulation. Neurobiology of Disease. 82, 243-253 (2015).
- Kamo, H., et al. A distinctive distribution of reactive astroglia in the precentral cortex in amyotrophic lateral sclerosis. Acta Neuropathologica. 74 (1), 33-38 (1987).
- Coumans, F. A. W., et al. Methodological guidelines to study extracellular vesicles. Circulation Research. 120 (10), 1632-1648 (2017).
- Winston, C. N., Goetzl, E. J., Schwartz, J. B., Elahi, F. M., Rissman, R. A. Complement protein levels in plasma astrocyte-derived exosomes are abnormal in conversion from mild cognitive impairment to Alzheimer's disease dementia. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 11, 61-66 (2019).
- Niu, Z., et al. Polymer-based precipitation preserves biological activities of extracellular vesicles from an endometrial cell line. PLoS ONE. 12 (10), 1-21 (2017).
- Alcolea, D., et al. The Sant Pau Initiative on Neurodegeneration (SPIN) cohort: A data set for biomarker discovery and validation in neurodegenerative disorders. Alzheimer's and Dementia: Translational Research and Clinical Interventions. 5, 597-609 (2019).
- O'Bryant, S. E., et al. Guidelines for the standardization of preanalytic variables for blood-based biomarker studies in Alzheimer's disease research. Alzheimer's and Dementia. 11 (5), 549-560 (2015).
- Kim, K., et al. Role of excitatory amino acid transporter-2 (EAAT2) and glutamate in neurodegeneration: Opportunities for developing novel therapeutics. Journal of Cellular Physiology. 226 (10), 2484-2493 (2011).
- Middeldorp, J., Hol, E. M. GFAP in health and disease. Progress in Neurobiology. 93 (3), 421-443 (2011).
- Mora, J., et al. Next generation ligand binding assays-review of emerging technologies' capabilities to enhance throughput and multiplexing. AAPS Journal. 16 (6), 1175-1184 (2014).
- Chunyk, A. G., et al. A multi-site in-depth evaluation of the quanterix simoa from a user's perspective. AAPS Journal. 20 (1), 1-12 (2018).
- Lötvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: A position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), 26913 (2014).
- Hansen, E. O., et al. Millipore xMap® Luminex (HATMAG-68K): An accurate and cost-effective method for evaluating Alzheimer's biomarkers in cerebrospinal fluid. Frontiers in Psychiatry. 12, 1-9 (2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogenous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences. 113 (8), 968-977 (2016).
- Gauthier, S. A., et al. Enhanced exosome secretion in Down syndrome brain - a protective mechanism to alleviate neuronal endosomal abnormalities. Acta Neuropathologica Communications. 5 (1), 65 (2017).
- Cataldo, A. M., et al. Endocytic pathway abnormalities precede amyloid β deposition in sporadic alzheimer's disease and down syndrome: Differential effects of APOE genotype and presenilin mutations. American Journal of Pathology. 157 (1), 277-286 (2000).
- Cataldo, A. M., et al. Down syndrome fibroblast model of Alzheimer-related endosome pathology: Accelerated endocytosis promotes late endocytic defects. American Journal of Pathology. 173 (2), 370-384 (2008).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Van Deun, J., et al. EV-TRACK: Transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados