Method Article
Arricchimento di vescicole extracellulari derivate da astrociti da plasma umano
In questo articolo
Riepilogo
Questo protocollo descrive l'arricchimento di vescicole extracellulari derivate da astrociti (ADEV) dal plasma umano. Si basa sulla separazione delle vescicole extracellulari mediante precipitazione polimerica, seguita dall'immunocattura degli ADEV basata su ACSA-1. L'analisi degli ADEV può offrire indizi per studiare i cambiamenti nelle vie infiammatorie dei pazienti viventi, in modo non invasivo mediante biopsia liquida.
Abstract
Le vescicole extracellulari (EV) sono nanoparticelle biologiche secrete da tutte le cellule per la comunicazione cellulare e l'eliminazione dei rifiuti. Partecipano a una vasta gamma di funzioni agendo e trasferendo i loro carichi ad altre cellule in condizioni fisiologiche e patologiche. Data la loro presenza nei biofluidi, le vescicole extracellulari rappresentano un'ottima risorsa per lo studio dei processi patologici e possono essere considerate una biopsia liquida per la scoperta di biomarcatori. Un aspetto interessante dell'analisi delle vescicole extracellulari è che possono essere selezionate in base ai marcatori della loro cellula di origine, riflettendo così l'ambiente di un tessuto specifico nel loro carico. Tuttavia, uno dei principali svantaggi legati ai metodi di isolamento delle vescicole extracellulari è la mancanza di consensi metodologici e protocolli standardizzati. Gli astrociti sono cellule gliali con ruoli essenziali nel cervello. Nelle malattie neurodegenerative, la reattività degli astrociti può portare a un'alterazione del carico di EV e a una comunicazione cellulare aberrante, facilitando/migliorando la progressione della malattia. Pertanto, l'analisi delle vescicole extracellulari degli astrociti può portare alla scoperta di biomarcatori e potenziali bersagli della malattia. Questo protocollo descrive un metodo in 2 fasi per l'arricchimento di EV derivate da astrociti (ADEV) da plasma umano. In primo luogo, le vescicole extracellulari sono arricchite da plasma defibrinato tramite precipitazione a base di polimeri. Segue l'arricchimento degli ADEV attraverso l'immunocattura basata su ACSA-1 con microsfere magnetiche, in cui le EV risospese vengono caricate su una colonna posta in un campo magnetico. Le EV ACSA-1+ marcate magneticamente sono trattenute all'interno della colonna, mentre altre EV fluiscono attraverso. Una volta rimossa la colonna dal magnete, gli ADEV vengono eluiti e sono pronti per la conservazione e l'analisi. Per convalidare l'arricchimento dei marcatori astrocitari, la proteina acida fibrillare gliale (GFAP), o altri marcatori astrocitici specifici di origine intracellulare, possono essere misurati nell'eluato e confrontati con il flow-through. Questo protocollo propone un metodo semplice ed efficiente in termini di tempo per arricchire gli ADEV dal plasma che può essere utilizzato come piattaforma per esaminare i marcatori rilevanti per gli astrociti.
Introduzione
Le vescicole extracellulari (EV) sono un gruppo eterogeneo di nanoparticelle membranose secrete da tutti i tipi di cellule, che trasportano proteine, lipidi e acidi nucleici1. Le microvescicole (100-1000 nm), gli esosomi (30-100 nm) e i corpi apoptotici (1000-5000 nm) costituiscono i principali tipi di EV, distinti dal loro sito di origine 2,3. Le vescicole extracellulari regolano importanti processi fisiologici, come la presentazione dell'antigene e le risposte immunitarie4, il riciclo dei recettori, l'eliminazione dei metaboliti5 e la comunicazione cellulare6. La regolazione di questi processi può avvenire attraverso il legame diretto tra le proteine arricchite nella membrana cellulare EV e i bersagli nelle cellule riceventi, e/o attraverso l'internalizzazione e il rilascio del loro carico nel citoplasma della cellula ricevente7. Sebbene le vescicole extracellulari svolgano funzioni cellulari essenziali, hanno guadagnato un crescente interesse da un punto di vista patologico nei campi del cancro e della neurologia. In effetti, diversi studi hanno dimostrato che le vescicole extracellulari possono aiutare a promuovere la migrazione delle cellule tumorali 8,9 o gli aggregati proteici tossici dei semi nelle malattie neurodegenerative, come il morbo di Alzheimer10,11.
Le vescicole extracellulari possono essere selezionate e arricchite da biofluidi in base a marcatori di superficie cellulare correlati alla loro cellula di origine, riflettendo così l'ambiente di un tessuto specifico nel loro carico 12,13,14,15,16,17,18,19,20. Inoltre, data la loro presenza nel sangue, nel liquido cerebrospinale (CSF), nella saliva, nelle urine e nel latte materno, le vescicole extracellulari rappresentano uno strumento eccellente e non invasivo per la diagnosi e possono essere considerate una biopsia liquida per la scoperta di biomarcatori. Questo è di particolare interesse in neurologia, date le difficoltà di studiare gli analiti cerebrali in fluidi accessibili diversi dal liquido cerebrospinale.
Gli astrociti hanno guadagnato un crescente interesse, poiché si trovano all'intersezione della comunicazione neuro-vascolare21. In condizioni fisiologiche, sono responsabili della conservazione della barriera emato-encefalica, del riciclaggio dei neurotrasmettitori, dell'apporto di nutrienti e fattori di crescita ai neuroni e ad altre cellule gliali 22,23,24 nonché della difesa neuroimmunitaria, data la loro plasticità metabolica da stati pro-infiammatori a stati anti-infiammatori e viceversa 25,26,27. Un importante meccanismo attraverso il quale gli astrociti svolgono le loro funzioni regolatorie è la comunicazione attraverso le EV28,29. L'astrocitosi reattiva è un segno distintivo chiave di diverse malattie neurodegenerative, come il morbo di Alzheimer,30 l'atrofia multisistemica (MSA), la paralisi sopranucleare progressiva (PSP)31 e la sclerosi laterale amiotrofica (SLA)32. La reattività degli astrociti può portare a un'alterazione del carico di EV, al rilascio di mediatori infiammatori e a una comunicazione cellulare aberrante, facilitando così la diffusione della patologia e portando alla neurodegenerazione10,11. Pertanto, lo studio delle vescicole extracellulari derivate dagli astrociti (ADEV) e dei cambiamenti nel loro carico è una risorsa interessante per esaminare i processi neurodegenerativi in modo non invasivo.
Attualmente, esistono diverse metodologie per l'isolamento delle vescicole extracellulari, ognuna con i suoi corrispondenti vantaggi e svantaggi33. È fondamentale considerare quale metodo sia più adatto ad un uso specifico, a seconda dell'applicazione finale di interesse. Nel campo della neurologia, e più specificamente, negli studi sugli astrociti, la precipitazione a base di polimeri seguita da immunocattura è stata la metodica prevalentemente utilizzata 12,18,19,20,34. Tuttavia, anche quando si applica lo stesso approccio, rimane un'eterogeneità tra gli studi nelle diverse fasi applicate per l'isolamento delle vescicole extracellulari. Pertanto, è necessaria una metodologia standardizzata chiara e graduale per facilitare gli studi sulle vescicole extracellulari degli astrociti e la riproducibilità degli studi. La precipitazione a base di polimeri facilita lo screening dei biomarcatori poiché si tratta di una procedura rapida e semplice che non richiede apparecchiature complesse, portando a un'elevata resa di vescicole extracellulari senza influire sulla loro attività biologica35.
Il presente protocollo descrive un metodo dettagliato, semplice e in due fasi per l'arricchimento di ADEV da plasma umano. Si basa su una precipitazione a base di polimeri della frazione EV totale, seguita da un'immunocattura delle EV degli astrociti. Date le importanti funzioni degli astrociti, l'analisi degli ADEV può far luce per la scoperta di biomarcatori e vie infiammatorie cerebrali che possono essere studiate in modo non invasivo.
Protocollo
La ricerca descritta in questo protocollo è stata condotta con campioni di plasma umano provenienti da donatori adulti sani di entrambi i sessi (fascia di età 65,9-81,3 anni, 45,5% femmine), provenienti dalla coorte Sant Pau Initiative on Neurodegeneration (SPIN), Barcellona, Spagna36. I partecipanti hanno dato il consenso informato. Lo studio è stato condotto seguendo le linee guida etiche internazionali per la ricerca medica contenute nella dichiarazione di Helsinki e nella legge spagnola. Il Comitato Etico per la Ricerca di Sant Pau (CEIC) ha esaminato e approvato il protocollo per la raccolta e la conservazione di campioni di plasma umano dalla coorte SPIN (#16/2013).
1. Arricchimento di vescicole extracellulari di astrociti da plasma umano
NOTA: Questo protocollo prevede l'uso di campioni di plasma umano. Tutti i dettagli sui reagenti e sul materiale di laboratorio utilizzato in questo protocollo sono inclusi nella Tabella dei materiali. Per questa procedura non è richiesta alcuna attrezzatura speciale, tuttavia, si prega di rivedere le considerazioni sulla sicurezza di ciascun reagente, come specificato individualmente da ciascun produttore.
- Raccolta e conservazione dei campioni
- Raccogliere il sangue in provette vacutainer EDTA lavanda, seguendo protocolli standardizzati per la raccolta del plasma 36,37. Centrifugare a 2000 x g per 10 minuti a 4 °C entro 30-120 minuti dopo la raccolta per la separazione al plasma. Separare il plasma, che è il liquido limpido superiore che appare come surnatante, in aliquote da 500 μl.
- Per rimuovere i detriti cellulari, centrifugare le aliquote a 3000 x g per 15 minuti a temperatura ambiente. Recupera il surnatante. Conservare il plasma a -80 °C fino all'analisi. Come è pratica comune per le analisi dei biofluidi, aliquotare i campioni prima della conservazione ed evitare più di tre cicli di congelamento-scongelamento.
- Arricchimento totale dei veicoli elettrici
NOTA: Tutti i reagenti utilizzati devono essere filtrati attraverso un filtro da 0,22 μm.- Scongelare 500 μL di campioni di plasma. Aggiungere trombina in proporzione 1:100 per rimuovere i fattori della coagulazione. Mescolate per inversione tre volte e lasciate riposare per 5 minuti a temperatura ambiente.
- Completare il volume fino a raggiungere 1 mL con la soluzione di lavoro con soluzione salina tamponata con fosfato (DPBS) di Dulbecco: DPBS + 3x cocktail di inibitori concentrati della proteasi (diluiti da 10x stock di cocktail di inibitori della proteasi). Mescolare per inversione.
- Centrifugare i campioni a 6000 x g per 20 minuti a 4 °C. Recupera il surnatante. Completare il volume con la soluzione di lavoro DBPS per raggiungere 1 mL.
- Aggiungere 252 μl della soluzione di precipitazione EV e mescolare per inversione tre volte. Incubare a 4 °C per 60 min.
- Centrifugare i campioni a 1500 x g per 20 minuti a 4 °C per far precipitare la frazione EV totale (pellet). Raccogliere 1 mL di surnatante. Etichettare la frazione come plasma impoverito di EV da utilizzare come controllo negativo dei marcatori di arricchimento EV (No EVs) e conservare a -80 °C.
- Centrifugare il pellet rimanente a 1500 x g per 5 min a 4 °C. Eliminare il surnatante rimanente. Risospendere il pellet in 500 μL di acqua ultrapura contenente inibitori concentrati della proteasi e della fosfatasi (concentrazione finale 3x, diluita da uno stock di 100x, vedi Tabella dei materiali).
- Pipettare energicamente su e giù per allentare il pellet, evitando la formazione di schiuma; agitare e agitare su un agitatore a tubo rotante per 30 minuti a temperatura ambiente fino alla completa risospensione. Garantire la completa risospensione del pellet, poiché si tratta di una fase fondamentale per la successiva fase di immunocattura.
- Immunocattura degli ADEV
NOTA: Gli ADEV portano marcatori di astrociti. Il marcatore selezionato per l'arricchimento di ADEV tramite immunocattura è GLAST. GLAST, acronimo di trasportatore glutammato-aspartato (UniProtKB-P43003), è il trasportatore di glutammato più abbondante espresso prevalentemente dagli astrociti nel cervelletto e nella neocorteccia cerebrale38. L'anticorpo anti-GLAST (ACSA-1, antigene di superficie delle cellule astrocitali) è specifico per un epitopo extracellulare di GLAST ed è stato sviluppato per l'identificazione degli astrociti. È il bersaglio più utilizzato per l'immunocattura di ADEV dal plasma umano 12,20,34.- Aggiungere 10 μl di anticorpo biotinilato anti-GLAST (ACSA-1) a ciascun campione contenente la preparazione EV totale. Mescolate bene e delicatamente. Incubare per 1 ora a 4 °C su un agitatore per provette rotante.
- Aggiungere 10 μl di microsfere magnetiche coniugate ad anticorpi monoclonali anti-biotina (IgG1 di topo). Mescolate bene e delicatamente. Incubare per 1 ora a 4 °C su un agitatore per provette rotante.
- Posizionare una micro colonna nel campo magnetico di un separatore MACS. Preparare la colonna risciacquandola con 500 μL di PBS-0,5% albumina sierica bovina (BSA). Scartare il flusso.
- Caricare la sospensione EV/ACSA-1/microsfere sul piantone. Non spingere con lo stantuffo in questo passaggio. Raccogli il flusso. Etichettalo come EV non astrocitario (No ADEV) e tienilo come controllo se necessario.
- Lavare la colonna due volte con 500 μl di PBS-0,5% BSA. Scartare il flusso.
- Rimuovere la colonna dal separatore magnetico e inserirla in una provetta di raccolta da 1,5 ml a bassa aderenza. Pipettare 500 μL di PBS-0,5% BSA sulla colonna. Spingere con decisione con uno stantuffo nella colonna e raccogliere l'eluato.
- Etichettare come ACSA-1+ EV (ADEV). Conservare le vescicole extracellulari non lisate a -20 °C per brevi periodi o a -80 °C per periodi più lunghi (>6 mesi).
NOTA: Gli anticorpi anti-ACSA-1 si legano all'epitopo GLAST-1/EAAT-1. Le microsfere magnetiche si legheranno con affinità al complesso anti-ACSA-1-EV. Le microcolonne MACS contengono una matrice ottimizzata per generare un forte campo magnetico quando vengono posizionate in un magnete, necessario per trattenere gli ADEV etichettati.
Per una rappresentazione schematica della procedura di arricchimento ADEV, vedere la Figura 1.
- Lisi delle vescicole extracellulari
NOTA: Le vescicole extracellulari devono essere completamente lisate per il rilevamento di marcatori intravescolari. Si consiglia l'uso di due metodi sequenziali, come quello chimico seguito da quello meccanico.- Eseguire una lisi chimica delle vescicole extracellulari aggiungendo il reagente di estrazione delle proteine (vedere la Tabella dei materiali) in una proporzione di 100 μl di campione per 150 μl di reagente di estrazione. Aggiungere 100 inibitori della proteasi e della fosfatasi per raggiungere una concentrazione finale di 1 volta. Agitare energicamente e lasciare riposare a temperatura ambiente per 15 min.
- Eseguire una lisi meccanica con una procedura in due fasi: passare due volte la soluzione EV lisata chimicamente attraverso una siringa (ago G29). Quindi, sonicare i campioni per 45 s in un bagno di acqua fredda ad ultrasuoni. Congelare le vescicole extracellulari lisate a -80 °C.
- Scongelare i campioni a 37 °C per 5 minuti. Congelare nuovamente a -80 °C per lo stoccaggio di vescicole extracellulari lisate. Scongelare nuovamente per 5 minuti a 37 °C prima dell'analisi.

Figura 1: Rappresentazione schematica della procedura in due fasi per l'arricchimento di vescicole extracellulari derivate da astrociti. Nella prima fase, le vescicole extracellulari vengono arricchite da plasma umano defibrinato mediante fasi di precipitazione e centrifugazione a base di polimeri. Dopo la risospensione totale delle vescicole extracellulari, le vescicole extracellulari degli astrociti vengono quindi selezionate mediante immunocattura con anticorpi anti-GLAST biotinilati (ACSA-1) e microsfere magnetiche anti-biotina. Abbreviazioni: ACSA-1 = antigene di superficie delle cellule degli astrociti-1; ADEVs = vescicole extracellulari derivate dagli astrociti; DPBS = soluzione salina tamponata con fosfato di Dulbecco; EVs = vescicole extracellulari; GLAST = trasportatore glutammato-aspartato; No ADEVs = vescicole extracellulari non astrocitiche; Nessuna vescicola extracellulare = Nessuna vescicola extracellulare (plasma impoverito di EV); PIC = cocktail di inibitori della proteasi; RT = temperatura ambiente. Figura creata con BioRender. Clicca qui per visualizzare una versione più grande di questa figura.
2. Convalida del protocollo
- Caratterizzazione della frazione EV totale prima dell'immunocattura
- Utilizzare EV totali lisati (pellet risospeso dopo precipitazione polimerica) e campioni di plasma diluito per l'analisi Western blot. Integrare i campioni con 4 tamponi Laemmli (5 μl per 15 μl di campione), far bollire per 10 minuti a 90 °C e caricare su gel di acrilammide al 10% privi di macchie.
- Eseguire l'elettroforesi su gel di poliacrilammide SDS (SDS-PAGE) in tampone Tris/Glicina/SDS a 80 V per 30 minuti, seguita da 200 V per 40 minuti. Dopo la SDS-PAGE, rimuovere il gel dalle lastre di vetro e visualizzare il contenuto proteico totale dopo un'eccitazione UV di 1 minuto.
- Trasferire le proteine dal gel a una membrana PVDF da 0,2 μm attivata con metanolo attraverso un sistema semi-secco a 25 V, 2,5 A per 10 minuti (vedere la tabella dei materiali per i dettagli sull'attrezzatura). Dopo il trasferimento, bloccare la membrana nel tampone bloccante per 5 minuti a temperatura ambiente e successivamente incubare per una notte a 4 °C con gli anticorpi primari contro Alix (1:1000), CD9 (1:1000) o Calnexin (1:1000); vedere la Tabella dei materiali per i dettagli.
- Lavare la membrana in soluzione salina tamponata con Tris con Tween 20 (TBST) allo 0,1% tre volte per 10 minuti e incubare per 1 ora a temperatura ambiente con un anticorpo secondario HRP anti-coniglio diluito a 1:7500 in tampone bloccante. Lavare la membrana in TBST quattro volte per 10 minuti. Eseguire tutti i lavaggi e le fasi di incubazione agitando delicatamente la membrana su un bilanciere da banco.
- Miscelare in rapporto 1:1 la soluzione chemiluminescente con il tampone perossido e incubare le membrane per 5 minuti a temperatura ambiente. Esporre e acquisire bande utilizzando un sistema di imaging a chemiluminescenza (vedere la Tabella dei materiali per i dettagli).
- Validazione dell'arricchimento di marcatori astrociti-specifici nella frazione ADEV
NOTA: La proteina acida fibrillare gliale (GFAP) è la principale proteina del filamento intermedio nelle cellule astrocitiche e un elemento essenziale del loro citoscheletro durante lo sviluppo. La GFAP può essere rilevata nel tessuto cerebrale e nei biofluidi, essendo un noto marcatore astrocitario39. Pertanto, questo marcatore è stato quantificato utilizzando una tecnologia commerciale di rilevamento di biomarcatori per dimostrare l'arricchimento di marcatori derivati dagli astrociti nella frazione ADEV. Questa tecnologia di biomarcatori è una tecnica ultrasensibile che consente la misurazione di singole molecole proteiche con una sensibilità fino a 1.000 volte maggiore rispetto agli immunosaggi convenzionali. Questa tecnica si basa sull'uso di microparticelle paramagnetiche accoppiate ad anticorpi progettati per legarsi a bersagli specifici40,41 (vedi Tabella dei Materiali).- Utilizzare campioni di EV lisati per l'analisi dei biomarcatori. Per testare l'arricchimento dei marcatori astrocitari, confrontare i livelli di GFAP nell'eluato (ADEV) rispetto al flusso continuo (No ADEV) utilizzando un test immunologico ultrasensibile commerciale.
- Diluire i campioni in un rapporto 1:4 (25 μL di EV + 75 μL di tampone per il test), preparare i calibratori ed eseguire il test nell'apparecchiatura di rilevamento dei biomarcatori, come specificato dalle istruzioni del produttore (vedere la Tabella dei materiali). I campioni possono essere diluiti direttamente sulla piastra.
- Testare i campioni e i calibratori in duplicato. L'intervallo di quantificazione per il test GFAP era 1,37-1000 pg/mL. Utilizza la piattaforma di analisi software del produttore per calcolare le concentrazioni di GFAP dalla curva di calibrazione.
- Per stimare il coefficiente di variazione (CV) del protocollo per l'arricchimento dei marcatori astrocitari, misurare i livelli di GFAP nelle preparazioni di ADEV ottenute da repliche identiche di campioni di plasma umano aggregato e calcolare il CV come deviazione standard/media x 100. In questo protocollo, il CV è stato calcolato utilizzando N = 10 campioni di plasma identici.
- Validazione dell'arricchimento di marcatori EV in frazione ADEV
- Per convalidare l'arricchimento dei marcatori EV, misurare i livelli di Alix e CD81 mediante ELISA (vedere la Tabella dei materiali) in campioni di EV lisati non diluiti, seguendo le raccomandazioni del produttore. Campioni di prova e calibratori in duplicato.
- Leggere le piastre a 450 nm e 570 nm utilizzando un lettore di micropiastre. Utilizzare una curva di calibrazione lineare per calcolare le concentrazioni di Alix e CD81. L'intervallo di quantificazione per il test Alix era di 47-3000 pg/mL e per CD81 era di 0,156-10 ng/mL.
- Caratterizzazione delle dimensioni e della morfologia degli ADEV
- Analisi del tracciamento delle nanoparticelle
- Utilizza l'analisi di tracciamento delle nanoparticelle (NTA) per misurare la concentrazione di particelle e la distribuzione dimensionale di preparati EV freschi non lisizzati.
- Diluire le sospensioni di ADEV fresche e non lisate (10 μL) con PBS filtrato in base all'intervallo di rilevamento dello strumento (20-100 particelle/fotogramma), utilizzando il software in dotazione, registrare tre video da 60 s con le seguenti impostazioni: portata della siringa a 30 u.a., livello della telecamera a 13 e soglia di rilevamento a 5. Correggere le concentrazioni di particelle per il volume del campione in ingresso, il volume di risospensione EV e la diluizione necessaria per la lettura dell'NTA.
NOTA: Si consiglia di visualizzare in anticipo un campione contenente la soluzione del veicolo EV per verificare l'effetto matrice e la purezza del mezzo in cui i veicoli elettrici vengono risospesi.
- Microscopia crioelettronica
- Utilizzare la microscopia crioelettronica (Cryo-EM) per confermare la presenza e la morfologia delle vescicole extracellulari in sospensioni ADEV fresche e non lisate (4 μL). Vitrificare i campioni utilizzando un congelatore ad immersione commerciale su griglie di carbonio Holey con le seguenti impostazioni: 3,9 μL di campione, tempo di attesa 10 s, tempo di tamponamento 2 s.
- Immergere in etano-azoto liquido in una crio-workstation. Trasferire le griglie in un crioportatore mantenuto a -179 °C per l'analisi al microscopio elettronico a trasmissione. Esamina le EV con un microscopio elettronico a trasmissione funzionante a una tensione di accelerazione di 200 kV e dotato di una telecamera CCD. Acquisizione di micrografie tramite software.
- Analisi del tracciamento delle nanoparticelle
- Analisi della co-precipitazione delle lipoproteine
- Determinare i livelli di ApoB umano nel plasma non diluito, nei campioni di EV totali lisati e nei campioni di ADEV lisati con un test immunoturbidimetrico utilizzando un kit commerciale adattato per un autoanalizzatore commerciale (per ulteriori dettagli, vedere la Tabella dei materiali ).
- Analisi dei marcatori infiammatori negli ADEV
- Utilizzare un saggio basato su microsfere (vedere la Tabella dei materiali) per quantificare la concentrazione di 25 marcatori infiammatori: eotaxina, IFN Alpha2, IFN Gamma, IL-1 Alpha, IL-1 Beta, IL-3, IL-6, IL-8, IL-10, IL-12 (p40), IL-12 (p70), IL-15, IL-17A, IL-17E/IL-25, IL-17F, IL-18, IP-10, MCP-1, MCP-3, MDC, MIP-1 Alpha, MIP-1 Beta, TGF Alpha, TNF Alpha, TNF Beta.
- Utilizzare preparati EV lisati non diluiti (25 μL) e incubare i campioni con le perle per una notte a 4°C, seguendo le istruzioni del produttore. Lavare la piastra, incubare con 25 μL di anticorpi di rilevazione e incubare per 1 ora agitando a temperatura ambiente.
- Aggiungere 25 μL di streptavidina-PE in ciascun pozzetto e incubare per 30 minuti a temperatura ambiente. Aggiungere 150 μl di liquido della guaina e incubare per 5 minuti sotto agitazione. Leggere la targa sul lettore di targhe collegato al sistema.
NOTA: Questa tecnica si basa su saggi immunologici che utilizzano anticorpi che si legano alla superficie di microsfere magnetiche rivestite di fluorescenza. Questa tecnologia codifica internamente le microsfere in base al loro colore con diversi coloranti. Ogni tipo di microsfera è rivestita con uno specifico anticorpo di cattura, in modo tale che più sfere coniugate catturino gli analiti incorporati nei campioni, consentendo la rilevazione quantitativa multiplex di dozzine di analiti contemporaneamente. Il sistema utilizza la piattaforma di dosaggio immunologico multiplex basata su microsfere per il rilevamento del segnale43.
3. Analisi dei dati
- Esegui analisi statistiche con software commerciali. Valutare la normalità dei dati con il test di Shapiro-Wilk. Test confronti a due gruppi con il test U di Mann-Whitney e confronti a tre gruppi con il test di Kruskal-Wallis e la correzione post-hoc di Dunn. Impostare la significatività a p < 0,05.
Risultati
L'isolamento degli ADEV dal plasma raccolto da donatori sani è stato realizzato con successo. Per ottenere la frazione EV totale è stato impiegato un metodo di precipitazione a base di polimeri, seguito da un'immunocattura con microsfere magnetiche per ottenere ADEV.
L'analisi Western blot della frazione EV totale prima della fase di immunocattura ha indicato la mancanza di calnexina (marcatore di contaminazione cellulare) e la presenza di Alix e della proteina transmembrana CD9 nelle preparazioni EV (Figura 2A).
Dopo l'immunocattura, la presenza e l'arricchimento di marcatori vescicolari e astrocitici sono stati convalidati nella frazione ADEV. Le concentrazioni di GFAP erano significativamente più elevate negli ADEV rispetto alla frazione senza ADEV (flow-through), mostrando un arricchimento di sei volte (p = 0,008). Ciò conferma l'origine prevalentemente astrocitaria delle EV nella frazione ADEV (Figura 2B). Il CV della quantificazione GFAP tra preparazioni ADEV da 10 campioni identici è stato del 25%.
Al fine di confermare la presenza di marcatori vescicolari nelle preparazioni di ADEV, sono stati esaminati due marcatori: Alix, un classico marcatore vescicolare citosolico42, e la proteina transmembrana CD8144. I livelli di Alix erano più alti nella frazione ADEV rispetto al plasma libero (p = 0,001), così come nel plasma impoverito di EV, indicato come assenza di EV (p = 0,0007; Figura 2C). Gli ADEV hanno anche mostrato l'arricchimento di CD81 rispetto al plasma libero (p = 0,03; Figura 2D).
Per caratterizzare ulteriormente la popolazione di ADEV, le dimensioni e il profilo di conteggio sono stati analizzati mediante NTA e la morfologia mediante crio-EM. L'analisi NTA ha mostrato un profilo omogeneo di EV con una dimensione media di 93,7 ± 2,7 nm, coerente con la dimensione di piccole EV (microvescicole ed esosomi). Inoltre, la caratterizzazione mediante crio-EM ha ulteriormente confermato la presenza e la morfologia attesa delle vescicole extracellulari (Figura 2E).
Dato che le lipoproteine possono co-precipitare con le vescicole extracellulari, i livelli di ApoB sono stati analizzati in diverse frazioni. I risultati mostrano che dopo la fase di immunocattura, i livelli di ApoB sono minimi nelle preparazioni di ADEV, essendo più alti nel plasma (p = 0,005; Figura 2F).
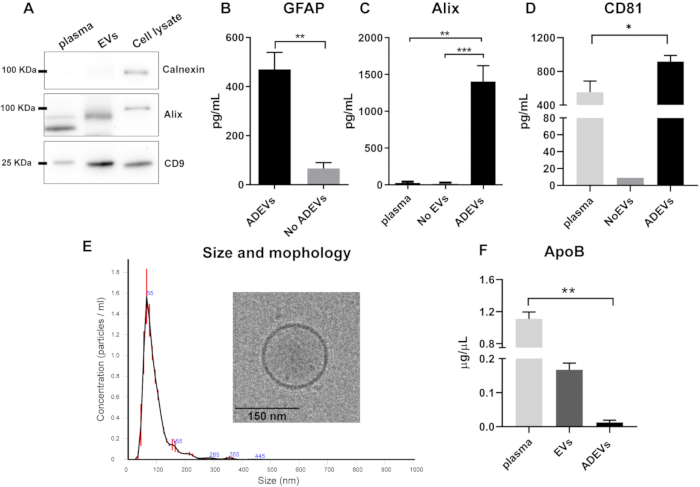
Figura 2: Caratterizzazione delle frazioni EV e ADEV totali. (A) Western blot rappresentativo che mostra la mancanza di calnexina e la presenza di Alix e CD9 nelle preparazioni EV totali. (B) La frazione ADEV ha mostrato un aumento dei livelli di GFAP rispetto a nessun ADEV (ADEV, n = 7; No ADEV, n = 7; p = 0,008). (e) Livelli più elevati di Alix sono stati rilevati negli ADEV rispetto al plasma (p = 0,001) e all'assenza di EV (p = 0,0007); plasma: n = 6; Nessun EV: n = 6; ADEVS: n = 16. (D) Livelli più elevati di CD81 sono stati rilevati nella frazione ADEV rispetto al plasma (p = 0,003); plasma: n = 5; Nessuna EV: n = 1 (CD81 non era rilevabile in otto dei nove campioni No EV); ADEVS: n = 17. (E) L'analisi NTA ha rivelato la presenza di particelle con una dimensione mediana di 93,7 ± 2,7 nm e la cui caratteristica vescicolare è stata confermata dalla crio-EM. (E) L'ApoB era significativamente più bassa nella frazione ADEV rispetto al plasma (p = 0,005); plasma: n = 4; EV: n = 4; ADEVS: n = 4. Abbreviazioni: ADEVs = vescicole extracellulari derivate dagli astrociti; Alix = proteina interagente a morte cellulare programmata 6 (PDCD6IP); ApoB = Apolipoproteina B; EVs = preparazioni totali di vescicole extracellulari dopo precipitazione a base di polimeri; GFAP = proteina acida fibrillare gliale; No ADEVs = vescicole extracellulari non astrocitiche; Nessuna vescicola extracellulare = Nessuna vescicola extracellulare (plasma impoverito di EV). Per (B) è stato utilizzato un test di Mann Whitney a due code (**p < 0,01) e per (C,D,F) sono stati utilizzati i test di confronto multiplo di Kluskal-Wallis e Dunn (*p < 0,05, **p < 0,01 e ***p < 0,0001). I grafici illustrano la media e le barre di errore mostrano l'errore standard. Clicca qui per visualizzare una versione più grande di questa figura.
Infine, l'applicabilità di questo protocollo è stata esaminata utilizzando gli ADEV per quantificare i marcatori infiammatori. Tutte le 25 citochine infiammatorie del pannello erano rilevabili in ADEV ottenuti da donatori sani (Figura 3).

Figura 3. Quantificazione delle citochine infiammatorie nella frazione ADEV. Un pannello di 25 citochine infiammatorie in ADEV di donatori sani ha rivelato che tutte erano rilevabili ed espresse in modo differenziale (HC, n = 3). Il grafico illustra la media e le barre di errore mostrano l'errore standard. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Le vescicole extracellulari hanno suscitato un forte interesse nella ricerca biomedica grazie al loro potenziale diagnostico e terapeutico. Attualmente, uno dei principali svantaggi legati ai metodi di isolamento delle vescicole extracellulari è la mancanza di consenso metodologico e di protocolli standardizzati. Questo studio fornisce un protocollo dettagliato per l'arricchimento delle vescicole extracellulari degli astrociti dal plasma umano tramite precipitazione a base di polimeri e immunocattura GLAST.
Esistono diverse metodologie per l'isolamento delle vescicole extracellulari dai fluidi corporei, ognuna con i propri vantaggi e limiti. Un approccio basato su polimeri è stato scelto per la sua semplicità, facilità d'uso, assenza di tempo, assenza di uno strumento specifico, elevata resa EV e perché è ampiamente utilizzato negli studi sui biomarcatori EV in neurologia 12,18,19,20, consentendo il confronto dei risultati. Tuttavia, potrebbero essere testati anche metodi alternativi come la cromatografia ad esclusione dimensionale. Una critica comune ai metodi basati sui polimeri è la co-precipitazione delle lipoproteine insieme alle vescicole extracellulari. Tuttavia, la fase aggiuntiva di immunocattura con anticorpi ACSA-1 e i successivi lavaggi possono superare questa limitazione legandosi selettivamente agli ADEV, minimizzando la contaminazione con le lipoproteine, come si è visto con l'analisi dell'ApoB. Quando si utilizza questo protocollo per studi quantitativi, è necessario considerare il CV intra-assay, in particolare con campioni di piccole dimensioni. Un'altra limitazione di questa procedura è che tracce minime di polimero potrebbero interferire con alcune analisi a valle, come la spettrometria di massa. Pertanto, la combinazione di questo protocollo con i successivi metodi analitici dovrebbe essere testata per ogni uso specifico.
Il protocollo descritto in questo studio è stato convalidato per l'arricchimento di marcatori astrocitici e vescicolari nella frazione ADEV. L'immunocattura delle EV negli astrociti è stata condotta utilizzando GLAST come bersaglio e ha convalidato l'origine astrocitaria delle EV, come dimostrato dall'arricchimento di sei volte di un marcatore astrocitario aggiuntivo, GFAP. Sebbene questa procedura sia stata testata e ottimizzata per l'arricchimento di ADEV da plasma umano di anziani sani, alcuni passaggi del protocollo possono essere modificati e adattati in base all'applicazione a valle da utilizzare. Ad esempio, l'uso di acqua ultrapura per la risospensione del pellet è preferito per la successiva immunoprecipitazione. Inoltre, la fase di incubazione sia dell'anticorpo che delle microsfere magnetiche (tempo e concentrazione) può essere modificata per concentrare o diluire gli ADEV a piacere.
Le fasi critiche del protocollo includono la risospensione meccanica del pellet EV prima della fase di immunocattura. I veicoli elettrici pellettati devono essere trattati con molta attenzione, evitando la formazione di schiuma durante la risospensione. Bisogna anche prestare attenzione all'uso di inibitori della proteasi concentrati 3x nei tamponi, per inibire le proteasi attive presenti nel plasma. Inoltre, è fondamentale non spingere con lo stantuffo sulla colonna in fasi successive all'eluizione degli ADEV trattenuti nella colonna.
Sebbene esistano studi che utilizzano questo approccio (precipitazione a base di polimeri + immunoprecipitazione) per isolare gli ADEV da individui con malattia di Alzheimer e lesioni cerebrali traumatiche 12,20,34, gli ADEV rimangono poco studiati rispetto alle EV di altre origini cellulari (ad esempio, neuroni) e meritano ulteriori ricerche.
Alcune malattie neurodegenerative, come il morbo di Alzheimer e la sindrome di Down, sono state associate ad anomalie endosomiali e ad un aumento della secrezione di EV 45,46,47. Un modo per tenere conto di una maggiore secrezione di EV è quantificare i livelli di un marcatore EV, come Alix e CD81, come fatto in questo studio, o di altre tetraspanine, come CD63 o CD9, per normalizzare i livelli dell'analita di interesse. Oltre a convalidare l'arricchimento di marcatori astrocitici e EV, è stata testata l'utilità del protocollo per misurare le citochine infiammatorie negli ADEV. Utilizzando una piattaforma multiplex, sono state ottenute concentrazioni rilevabili e quantitative di 25 citochine e chemochine nella frazione ADEV.
Pertanto, questa procedura consente la raccolta di vescicole extracellulari che possono essere utilizzate come piattaforma di scoperta di biomarcatori, nonché come strumento non invasivo per lo studio dei meccanismi e delle vie molecolari correlate agli astrociti. Infatti, lo studio degli ADEV ha un enorme potenziale nel campo delle malattie neurologiche, poiché il carico di ADEV può essere utilizzato come risorsa per esplorare il fenotipo degli astrociti e i cambiamenti lungo i diversi stadi della malattia.
Sebbene questo manoscritto descriva ampiamente la metodologia, è essenziale considerare i vantaggi e i limiti di questo metodo e l'applicabilità appropriata. In effetti, ci sono importanti sforzi di standardizzazione nel campo delle vescicole extracellulari, come le ampie raccomandazioni di ricerca e le fasi di convalida delineate dalle linee guida MISEV della International Society for Extracellular Vesicles48 e la piattaforma EV-track per la segnalazione di informazioni metodologiche sugli studi sulle vescicole extracellulari49.
Divulgazioni
Il Dr. Belbin ha riferito di aver ricevuto compensi personali da ADx NeuroSciences al di fuori del lavoro presentato. Il Dr. Alcolea ha riferito di aver ricevuto compensi personali per servizi di advisory board e/o onorari di relatori da Fujirebio-Europe, Roche, Nurtricia, Krka Farmacéutica, Zambon S.A.U. ed Esteve al di fuori del lavoro presentato. Il Dr. Lleó ha lavorato come consulente o presso comitati consultivi per Fujirebio-Europe, Roche, Biogen, Grifols e Nutricia al di fuori del lavoro presentato. Il Dr. Fortea ha riferito di aver ricevuto compensi personali per il servizio nei comitati consultivi, nei comitati di aggiudicazione o negli onorari dei relatori da AC Immune, Novartis, Lundbeck, Roche, Fujirebio e Biogen al di fuori del lavoro presentato. I dottori Alcolea, Belbin, LLeó e Fortea riferiscono di essere in possesso di un brevetto per marcatori di sinaptopatia nelle malattie neurodegenerative (concesso in licenza ad ADx, EPI8382175.0). Non sono state segnalate altre divulgazioni. Tutti gli altri autori non hanno nient'altro da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare Soraya Torres, Shaimaa El Bounasri El Bennadi e Oriol Sanchez Lopez per la gestione e la preparazione dei campioni. Ringraziamo anche José Amable Bernabé, dell'ICTS "NANBIOSIS", unità 6 (Unità del CIBER in Bioingineering, Biomateriali e Nanomedicina) dell'Istituto di Scienza dei Materiali di Barcellona, Marti de Cabo Jaume dell'Unità di Microscopia Elettronica dell'Universitat Autonoma de Barcelona, la Dott.ssa Marta Soler Castany e Lia Ros Blanco della Piattaforma di Citometria a Flusso dell'Istituto di Ricerca Biomedica Sant Pau (IIB-Sant Pau), così come la dottoressa Joan Carles Escolà-Gil del gruppo di fisiopatologia delle malattie correlate ai lipidi presso IIB-Sant Pau per l'aiuto con le determinazioni NTA, cryo-EM, Luminex e ApoB, rispettivamente.
Gli autori riconoscono il sostegno finanziario della Fondazione Jérôme Lejeune (Progetto #1941 e #1913 per MFI e MCI), Instituto de Salud Carlos III (PI20/01473 per JF, PI20/01330 per AL, PI18/00435 per DA e INT19/00016 per DA), l'Istituto Nazionale di Sanità (1R01AG056850-01A1, R21AG056974 e R01AG061566 per JF), l'Alzheimer's Association e il Global Brain Health Institute (GBHI_ALZ-18-543740 per MCI), l'Associazione per la Degenerazione Frontotemporale (Clinical Research Postdoctoral Fellowship, AFTD 2019-2021) all'ODI e la Societat Catalana de Neurologia (Premi Beca Fundació SCN 2020 a MCI). Questo lavoro è stato supportato anche dal programma CIBERNED (Programma 1, Alzheimer Disease to AL e SIGNAL study. SS ha ricevuto una borsa di studio post-dottorato "Juan de la Cierva-Incorporación" (IJC2019-038962-I) dall'Agencia Estatal de Investigación, Ministerio de Ciencia e Innovación (Gobierno de España).
Materiali
| Name | Company | Catalog Number | Comments |
| Anti-Alix primary antibody for Western blotting | EMD Millipore | ABC40 | |
| µMACS Separator | Miltenyi Biotec | 130-042-602 | The µMACS Separator is used in combination with µ Columns and MACS MicroBeads. |
| Anti-calnexin primary antibody for Western blotting | Genetex | GTX109669 | |
| Anti-CD9 primary antibody for Western blotting | Cell Signaling | 13174 | |
| Blocker BSA (10%) 200 mL | Thermo Fisher | 37525 | |
| Bransonic 1510E-MT Ultrasonic bath | Branson | ||
| COBAS 6000 autoanalyzer | Roche Diagnostics | Analyzer for immunoturbidimetric determination of ApoB; commercial autoanalyzer | |
| cOmplete Protease Inhibitor Cocktail (EDTA-free) | Roche | 11873580001 | |
| Digital Micrograph 1.8 | micrograph software | ||
| Dulbecco's PBS Mg++, Ca++ free 500 mL | Thermo Fisher | 14190144 | |
| EveryBlot Blocking Buffer | BioRad | 12010020 | |
| Exoquick (exosome precipitation solution 5 mL) + Thrombin | System Bioscience | EXOQ5TM-1 | ExoQuick 20 mL can also be purchased (EXOQ20A-1) |
| Gatan 895 USC 4000 | camera | ||
| GeneGnome XRQ chemiluminiscence imaging system | Syngene | ||
| Human CD81 antigen (CD81) ELISA kit | Cusabio | CSB-EL004960HU | |
| Human Programmed cell death 6-interacting protein (PDCD6IP) ELISA kit | Cusabio | CSB-EL017673HU | |
| Immun-Blot PVDF Membrane | BioRad | 1620177 | |
| JEOL 2011 transmission electron microscope | JEOL LTD | Equipped with a CCD Gatan 895 USC 4000 camera (Gatan 626, Gatan, Pleasanton, USA) | |
| Lavender EDTA BD Vacutainer K2E tubes | Becton dickinson | 367525 | |
| Leica EM GP | Leica Microsystem | commercial plunge freezer | |
| Low binding microtubes 1,5 mL | Deltalab | 4092.3NS | |
| MACS µ Columns with plungers | Miltenyi Biotec | 130-110-905 | µ Columns with plungers are especially designed for isolation of exosomes from body fluids |
| MACS Multistand | Miltenyi Biotec | 130-042-303 | |
| MAGPIX plate reader | Luminex Corporation | 80-073 | Luminex's xMAP multiplexing unit (Luminex xPonent v 4.3 software) |
| MicroBead Kit100 μL Anti-GLAST (ACSA-1)-Biotin, human, mouse, rat – small size; 100 μL Anti-Biotin MicroBeads | Miltenyi Biotec | 130-095- 825 | |
| MILLIPLEX MAP Kit Human cytokine/Chemokine/Growth Factor Panel A magnetic bead panel | EMD Millipore | HCYTA-60K-25 | |
| M-PER Mammalian Protein Extraction Reagent 25 mL | Thermo Fisher | 78503 | For certain applications like Western blot, more aggressive lysis buffers can be used (e.g. RIPA) |
| MultiSkan SkyHigh Microplate Spectrophotometer | Thermofisher | A51119500C | |
| NanoSight NS300 | Malvern Panalytical | NTA; 3.4 version | |
| Pierce Halt Protease and Phosphatase Inhibitor Cocktail | Thermo Fisher | 78441 | |
| Polypropylene syringe (G29) | PeroxFarma | 1mL syringe; 0.33x12mm-G29x1/2" | |
| Secondary anti-rabbit antibody | Thermo Fisher | 10794347 | |
| Simoa GFAP Discovery Kit | Quanterix | 102336 | |
| Simoa, SR-X instrument | Quanterix | SR-X Ultra-Sensitive Biomarker Detection System; commercial biomarker detection technology | |
| Specific Protein Test Apolipoprotein B - APOB (100 det) COBAS C/CI | Roche Diagnostics | 3032574122 | |
| SuperSignal West Femto | Thermo Fisher | 34095 | Ultra-sensitive enhanced chemiluminescent (ECL) HRP substrate |
| Trans-Blot Turbo Transfer System | BioRad | 1704150 |
Riferimenti
- Pathan, M., et al. Vesiclepedia 2019: a compendium of RNA, proteins, lipids and metabolites in extracellular vesicles. Nucleic Acids Research. 47, 516-519 (2019).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Gustafson, D., Veitch, S., Fish, J. E. Extracellular vesicles as protagonists of diabetic cardiovascular pathology. Frontiers in Cardiovascular Medicine. 4, 71 (2017).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Harding, C. V., Heuser, J. E., Stahl, P. D. Exosomes: Looking back three decades and into the future. Journal of Cell Biology. 200 (4), 367-371 (2013).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Hood, J. L., San Roman, S., Wickline, S. A. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis. Cancer Research. 71 (11), 3792-3801 (2011).
- Rak, J. Microparticles in cancer. Seminars in Thrombosis and Hemostasis. 36 (8), 888-906 (2010).
- Ledreux, A., et al. Small neuron-derived extracellular vesicles from individuals with down syndrome propagate tau pathology in the wildtype mouse brain. Journal of Clinical Medicine. 10 (17), 3931 (2021).
- Winston, C. N., et al. Prediction of conversion from mild cognitive impairment to dementia with neuronally derived blood exosome protein profile. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 3, 63-72 (2016).
- Goetzl, E. J., Schwartz, J. B., Abner, E. L., Jicha, G. A., Kapogiannis, D. High complement levels in astrocyte-derived exosomes of Alzheimer's disease. Annals of Neurology. 83 (3), 544-552 (2018).
- Fiandaca, M. S., et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimer's and Dementia. 11 (6), 600-607 (2015).
- Mustapic, M., et al. Plasma extracellular vesicles enriched for neuronal origin: A potential window into brain pathologic processes. Frontiers in Neuroscience. 11, 278 (2017).
- Hamlett, E. D., et al. Neuronal exosomes reveal Alzheimer's disease biomarkers in Down syndrome. Alzheimer's and Dementia. 13 (5), 541-549 (2017).
- Goetzl, E. J., et al. Abnormal levels of mitochondrial proteins in plasma neuronal extracellular vesicles in major depressive disorder. Molecular Psychiatry. 26 (12), 7355-7362 (2021).
- Goetzl, E. J., et al. Neuron-derived exosome proteins may contribute to progression from repetitive mild traumatic brain injuries to chronic traumatic encephalopathy. Frontiers in Neuroscience. 13, 452 (2019).
- Goetzl, E. J., et al. Cargo proteins of plasma astrocyte-derived exosomes in Alzheimer's disease. FASEB Journal. 30 (11), 3853-3859 (2016).
- Goetzl, E. J., et al. Traumatic brain injury increases plasma astrocyte-derived exosome levels of neurotoxic complement proteins. FASEB Journal. 34 (2), 3359-3366 (2020).
- Nogueras-ortiz, C. J., et al. Astrocyte- and neuron-derived extracellular vesicles from Alzheimer's disease patients effect complement-mediated neurotoxicity. Cells. 9 (7), 1618 (2020).
- Haydon, P. G., Carmignoto, G. Astrocyte control of synaptic transmission and neurovascular coupling. Physiological Reviews. 86 (3), 1009-1031 (2006).
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Rothstein, J., et al. Antisense knockout of glutamate transporters reveals a predominant role for astroglial glutamate transport in excitotoxicity and clearance of extracellular glutamate. Neuron. 16 (3), 675-686 (1996).
- Vasile, F., Dossi, E., Rouach, N. Human astrocytes: structure and functions in the healthy brain. Brain Structure and Function. 222 (5), 2017-2029 (2017).
- Balu, D. T., et al. Neurotoxic astrocytes express the D-serine synthesizing enzyme, serine racemase, in Alzheimer's disease. Neurobiology of Disease. 130, 104511 (2019).
- Sofroniew, M. V. Astrocyte barriers to neurotoxic inflammation. Nature Reviews Neuroscience. 16 (5), 249-263 (2015).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24 (7), 931-938 (2018).
- Bianco, F., et al. Acid sphingomyelinase activity triggers microparticle release from glial cells. EMBO Journal. 28 (8), 1043-1054 (2009).
- Datta Chaudhuri, A., et al. Stimulus-dependent modifications in astrocyte-derived extracellular vesicle cargo regulate neuronal excitability. Glia. 68 (1), 128-144 (2020).
- Serrano-Pozo, A., Gómez-Isla, T., Growdon, J. H., Frosch, M. P., Hyman, B. T. A phenotypic change but not proliferation underlies glial responses in Alzheimer disease. American Journal of Pathology. 182 (6), 2332-2344 (2013).
- Tong, J., et al. Low levels of astroglial markers in Parkinson's Disease: relationship to α-synuclein accumulation. Neurobiology of Disease. 82, 243-253 (2015).
- Kamo, H., et al. A distinctive distribution of reactive astroglia in the precentral cortex in amyotrophic lateral sclerosis. Acta Neuropathologica. 74 (1), 33-38 (1987).
- Coumans, F. A. W., et al. Methodological guidelines to study extracellular vesicles. Circulation Research. 120 (10), 1632-1648 (2017).
- Winston, C. N., Goetzl, E. J., Schwartz, J. B., Elahi, F. M., Rissman, R. A. Complement protein levels in plasma astrocyte-derived exosomes are abnormal in conversion from mild cognitive impairment to Alzheimer's disease dementia. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 11, 61-66 (2019).
- Niu, Z., et al. Polymer-based precipitation preserves biological activities of extracellular vesicles from an endometrial cell line. PLoS ONE. 12 (10), 1-21 (2017).
- Alcolea, D., et al. The Sant Pau Initiative on Neurodegeneration (SPIN) cohort: A data set for biomarker discovery and validation in neurodegenerative disorders. Alzheimer's and Dementia: Translational Research and Clinical Interventions. 5, 597-609 (2019).
- O'Bryant, S. E., et al. Guidelines for the standardization of preanalytic variables for blood-based biomarker studies in Alzheimer's disease research. Alzheimer's and Dementia. 11 (5), 549-560 (2015).
- Kim, K., et al. Role of excitatory amino acid transporter-2 (EAAT2) and glutamate in neurodegeneration: Opportunities for developing novel therapeutics. Journal of Cellular Physiology. 226 (10), 2484-2493 (2011).
- Middeldorp, J., Hol, E. M. GFAP in health and disease. Progress in Neurobiology. 93 (3), 421-443 (2011).
- Mora, J., et al. Next generation ligand binding assays-review of emerging technologies' capabilities to enhance throughput and multiplexing. AAPS Journal. 16 (6), 1175-1184 (2014).
- Chunyk, A. G., et al. A multi-site in-depth evaluation of the quanterix simoa from a user's perspective. AAPS Journal. 20 (1), 1-12 (2018).
- Lötvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: A position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), 26913 (2014).
- Hansen, E. O., et al. Millipore xMap® Luminex (HATMAG-68K): An accurate and cost-effective method for evaluating Alzheimer's biomarkers in cerebrospinal fluid. Frontiers in Psychiatry. 12, 1-9 (2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogenous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences. 113 (8), 968-977 (2016).
- Gauthier, S. A., et al. Enhanced exosome secretion in Down syndrome brain - a protective mechanism to alleviate neuronal endosomal abnormalities. Acta Neuropathologica Communications. 5 (1), 65 (2017).
- Cataldo, A. M., et al. Endocytic pathway abnormalities precede amyloid β deposition in sporadic alzheimer's disease and down syndrome: Differential effects of APOE genotype and presenilin mutations. American Journal of Pathology. 157 (1), 277-286 (2000).
- Cataldo, A. M., et al. Down syndrome fibroblast model of Alzheimer-related endosome pathology: Accelerated endocytosis promotes late endocytic defects. American Journal of Pathology. 173 (2), 370-384 (2008).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Van Deun, J., et al. EV-TRACK: Transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon