Method Article
Обогащение внеклеточных везикул, полученных из астроцитов из плазмы крови человека
В этой статье
Резюме
Этот протокол описывает обогащение внеклеточных везикул (ADEV), полученных из астроцитов, из плазмы крови человека. Он основан на разделении EV методом осаждения полимеров с последующим иммунозахватом ADEV на основе ACSA-1. Анализ ADEV может дать ключ к изучению изменений в воспалительных путях у живых пациентов, неинвазивно с помощью жидкой биопсии.
Аннотация
Внеклеточные везикулы (ВВ) — это биологические наночастицы, секретируемые всеми клетками для клеточной коммуникации и выведения отходов. Они участвуют в широком спектре функций, воздействуя на другие клетки и перенося их в другие клетки при физиологических и патологических состояниях. Учитывая их присутствие в биожидкостях, ВВ представляют собой отличный ресурс для изучения процессов заболевания и могут рассматриваться как жидкая биопсия для открытия биомаркеров. Привлекательным аспектом анализа ВВ является то, что они могут быть выбраны на основе маркеров их происхождения, что отражает окружающую среду конкретной ткани в их грузе. Тем не менее, одним из основных препятствий, связанных с методами изоляции электромобилей, является отсутствие методологического консенсуса и стандартизированных протоколов. Астроциты — это глиальные клетки, играющие важную роль в мозге. При нейродегенеративных заболеваниях реактивность астроцитов может привести к изменению груза EV и аберрантной клеточной коммуникации, способствуя прогрессированию заболевания. Таким образом, анализ ВВ астроцитов может привести к открытию биомаркеров и потенциальных мишеней заболеваний. Этот протокол описывает двухэтапный метод обогащения ВВ, полученных из астроцитов (ADEV) из плазмы человека. Во-первых, электромобили обогащаются из дефибринированной плазмы с помощью осаждения на основе полимеров. Затем следует обогащение ADEV с помощью иммунозахвата на основе ACSA-1 с помощью магнитных микрогранул, где ресуспендированные EV загружаются на колонку, помещенную в магнитное поле. Электромобили с магнитной маркировкой ACSA-1+ остаются внутри колонны, в то время как другие электромобили протекают через колонну. После того, как колонка снята с магнита, ADEV элюируются и готовы к хранению и анализу. Для подтверждения обогащения астроцитарных маркеров глиальный фибриллярный кислый белок (GFAP) или другие специфические астроцитарные маркеры внутриклеточного происхождения могут быть измерены в элюате и сравнены с проточным. Этот протокол предлагает простой и эффективный по времени метод обогащения ADEV из плазмы, который может быть использован в качестве платформы для изучения маркеров, относящихся к астроцитам.
Введение
Внеклеточные везикулы (ВВ) представляют собой гетерогенную группу мембранозных наночастиц, секретируемых всеми типами клеток, несущих белки, липиды и нуклеиновые кислоты1. Микровезикулы (100-1000 нм), экзосомы (30-100 нм) и апоптотические тельца (1000-5000 нм) составляют основные типы ВВ, различающиеся по месту их происхождения 2,3. ВВ регулируют важные физиологические процессы, такие как презентация антигена и иммунные реакции4, рециркуляция рецепторов, элиминация метаболитов5 и клеточная коммуникация6. Регуляция этих процессов может происходить путем прямого связывания между белками, обогащенными в мембране клетки EV, и мишенями в клетках-реципиентах и/или путем интернализации и высвобождения их груза в цитоплазме клетки-реципиента7. В то время как ВВ выполняют важные клеточные функции, они вызывают все больший интерес с патологической точки зрения в области рака и неврологии. Действительно, несколько исследований показали, что ВВ могут способствовать миграции опухолевых клеток 8,9 или семенных токсических белковых агрегатов при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера10,11.
EV могут быть выбраны и обогащены из биожидкостей на основе маркеров клеточной поверхности, связанных с клеткой их происхождения, тем самым отражая окружающую среду конкретной ткани в их грузе 12,13,14,15,16,17,18,19,20. Кроме того, учитывая их присутствие в крови, спинномозговой жидкости (СМЖ), слюне, моче и грудном молоке, ВВ представляют собой превосходный неинвазивный инструмент для диагностики и могут рассматриваться как жидкая биопсия для обнаружения биомаркеров. Это представляет особый интерес для неврологии, учитывая трудности изучения аналитов мозга в доступных жидкостях, отличных от ликвора.
Интерес к астроцитам растет, так как они находятся на пересечении нейро-сосудистой коммуникации21. В физиологических условиях они отвечают за сохранение гематоэнцефалического барьера, рециркуляцию нейротрансмиттеров, снабжение нейронов и других глиальных клеток питательными веществами и факторами роста 22,23,24, а также за нейроиммунную защиту, учитывая их метаболическую пластичность от провоспалительных до противовоспалительных состояний и наоборот 25,26,27 . Важным механизмом, с помощью которого астроциты выполняют свои регуляторные функции, является коммуникация через EVs28,29. Реактивный астроцитоз является ключевым признаком некоторых нейродегенеративных заболеваний, таких как болезнь Альцгеймера30, множественная системная атрофия (МСА), прогрессирующий надъядерный паралич (ПСП)31 и боковой амиотрофический склероз (БАС)32. Реактивность астроцитов может приводить к изменению груза ВВ, высвобождению медиаторов воспаления и аберрантной клеточной коммуникации, тем самым способствуя распространению патологии и приводя к нейродегенерации10,11. Таким образом, изучение ВВ, полученных из астроцитов (ADEV), и изменений в их грузе является привлекательным ресурсом для изучения нейродегенеративных процессов неинвазивным способом.
В настоящее время существует несколько методологий изоляции электромобилей, каждая из которых имеет свои преимущества инедостатки. Важно учитывать, какой метод больше подходит для конкретного использования, в зависимости от конечного применения. В области неврологии, в частности, в исследованиях астроцитов, преципитация на основе полимеров с последующим иммунозахватом является преимущественно используемым методом 12,18,19,20,34. Тем не менее, даже при применении одного и того же подхода остается неоднородность между исследованиями на разных этапах, применяемых для изоляции электромобилей. Таким образом, существует потребность в четкой, поэтапной стандартизированной методологии для облегчения исследований астроцитарных ВВ и воспроизводимости исследований. Осаждение на основе полимеров облегчает скрининг биомаркеров, учитывая, что это быстрая и простая процедура, не требующая сложного оборудования, что приводит к высокому выходу EV без влияния на их биологическуюактивность.
Настоящий протокол описывает подробный, простой, двухэтапный метод обогащения ADEV из плазмы человека. Он основан на осаждении общей фракции ЭВ на основе полимера с последующим иммунозахватом астроцитарных ВВ. Учитывая важные функции астроцитов, анализ ADEV может пролить свет на открытие биомаркеров и воспалительных путей мозга, которые могут быть изучены неинвазивным способом.
протокол
Исследование, описанное в этом протоколе, проводилось с образцами человеческой плазмы от здоровых взрослых доноров обоих полов (возраст 65,9-81,3 года, 45,5% женщин) из когорты Инициативы Сант-Пау по нейродегенерации (SPIN), Барселона, Испания36. Участники дали информированное согласие. Исследование проводилось в соответствии с международными этическими принципами медицинских исследований, содержащимися в Хельсинкской декларации и испанском законодательстве. Комитет по этике исследований Сант-Пау (CEIC) рассмотрел и одобрил протокол сбора и хранения образцов плазмы крови человека из когорты SPIN (#16/2013).
1. Обогащение астроцитарных EV из плазмы крови человека
ПРИМЕЧАНИЕ: Этот протокол предполагает использование образцов плазмы крови человека. Все сведения о реактивах и лабораторных материалах, используемых в этом протоколе, включены в Таблицу материалов. Для этой процедуры не требуется специального оборудования, однако, ознакомьтесь с соображениями безопасности каждого реагента, указанными индивидуально каждым производителем.
- Сбор и хранение проб
- Соберите кровь в лавандовые вакутайнерные пробирки ЭДТА, следуя стандартизированным протоколам сбора плазмы36,37. Центрифугируйте при 2000 x g в течение 10 мин при 4 °C в течение 30-120 мин после сбора для разделения плазмы. Разделите плазму, которая представляет собой верхнюю прозрачную жидкость, проявляющуюся в виде надосадочной жидкости, в аликвотах по 500 μл.
- Чтобы удалить клеточный мусор, центрифугируйте аликвоты при 3000 x g в течение 15 минут при комнатной температуре. Восстановите надосадочную жидкость. Храните плазму при температуре -80 °C до анализа. В соответствии с обычной практикой при анализе биожидкостей, проверяйте образцы перед хранением и избегайте более трех циклов замораживания-размораживания.
- Общее обогащение электромобилей
ПРИМЕЧАНИЕ: Все используемые реагенты должны быть отфильтрованы через фильтр 0,22 мкм.- Разморозьте 500 мкл образцов плазмы. Добавьте тромбин в пропорции 1:100 для удаления факторов свертывания. Перемешайте путем инверсии три раза и оставьте на 5 минут при комнатной температуре.
- Доведите объем до 1 мл с помощью рабочего раствора Дульбекко, буферизованного фосфатным раствором (DPBS): DPBS + 3x концентрированный коктейль ингибиторов протеазы (разбавленный из 10x запаса коктейлей ингибиторов протеазы). Перемешайте методом инверсии.
- Центрифугируйте образцы при 6000 x g в течение 20 минут при 4 °C. Восстановите надосадочную жидкость. Дополните объем рабочим раствором DBPS до 1 мл.
- Добавьте 252 мкл раствора для осаждения EV и перемешайте путем инверсии три раза. Выдерживать при температуре 4 °C в течение 60 минут.
- Центрифугируйте образцы при 1500 x g в течение 20 минут при 4 °C для осаждения общей фракции EV (гранулы). Соберите 1 мл надосадочной жидкости. Пометьте фракцию как обедненную EV-обедненной плазму для использования в качестве отрицательного контроля маркеров обогащения EV (No EVs) и храните при -80 °C.
- Центрифугируйте оставшуюся гранулу при 1500 x g в течение 5 минут при 4 °C. Выбросьте оставшуюся надосадочную жидкость. Ресуспендируйте гранулу в 500 мкл ультрачистой воды, содержащей концентрированные ингибиторы протеазы и фосфатазы (конечная концентрация 3x, разбавленная из запаса 100x, см. Таблицу материалов).
- Энергично проводите пипеткой вверх и вниз, чтобы ослабить гранулу, не допуская пенообразования; Вортекс и взбалтывать на встряхивателе с вращательной трубкой в течение 30 мин при комнатной температуре до полного ресуспензирования. Обеспечьте полную ресуспендию пеллет, так как это критический этап для последующего этапа иммунозахвата.
- Иммунозахват ADEV
ПРИМЕЧАНИЕ: ADEV содержат астроцитарные маркеры. Выбранным маркером для обогащения ADEV с помощью иммунозахвата является GLAST. GLAST (UniProtKB-P43003) является наиболее распространенным транспортером глутамата, преимущественно экспрессируемым астроцитами в мозжечке и неокортексе головного мозга38. Антитело анти-GLAST (ACSA-1, поверхностный антиген астроцитарной клетки-1) специфично для внеклеточного эпитопа GLAST и было разработано для идентификации астроцитов. Это наиболее широко используемая мишень для иммунозахвата ADEV из плазмы крови человека 12,20,34.- Добавьте 10 мкл биотинилированного антитела анти-GLAST (ACSA-1) в каждый образец, содержащий общий препарат EV. Хорошо и аккуратно перемешайте. Инкубировать в течение 1 ч при температуре 4 °C на вращающемся трубочном встряхивателе.
- Добавьте 10 мкл магнитных микрогранул, конъюгированных с моноклональными антителами к биотину (мышиный IgG1). Хорошо и аккуратно перемешайте. Инкубировать в течение 1 ч при температуре 4 °C на вращающемся трубочном встряхивателе.
- Поместите микроколонку в магнитное поле сепаратора MACS. Подготовьте колонку, промыв ее 500 мкл PBS-0,5% бычьего сывороточного альбумина (BSA). Откажитесь от проточного потока.
- Нагрузите на колонну суспензию EV/ACSA-1/microbead. На этом этапе не нажимайте поршнем. Соберите протекание. Пометьте их как неастроцитарные EV (без ADEV) и при необходимости сохраняйте их в качестве контроля.
- Дважды промойте колонку 500 мкл PBS-0,5% BSA. Откажитесь от проточного потока.
- Снимите колонку с магнитного сепаратора и поместите ее в пробирку для сбора объемом 1,5 мл с низкой адгезией. Пипетка 500 мкл PBS-0,5% BSA на колонку. Сильно надавите поршнем на колонну и соберите элюат.
- Маркировка как ACSA-1+ EV (ADEV). Храните нелизированные электромобили при температуре -20 °C в течение коротких периодов времени или при -80 °C в течение более длительного периода времени (>6 месяцев).
ПРИМЕЧАНИЕ: Антитела Anti-ACSA-1 будут связываться с эпитопом GLAST-1/EAAT-1. Магнитные микрогранулы будут связываться с аффинным комплексом анти-ACSA-1-EV. Микроколонки MACS содержат оптимизированную матрицу для создания сильного магнитного поля при размещении в магните, что необходимо для удержания маркированных ADEV.
Схематическое изображение процедуры обогащения ADEV приведено на рисунке 1.
- Лизис электромобилей
ПРИМЕЧАНИЕ: ВВ должны быть полностью лизированы для обнаружения внутривезикулярных маркеров. Рекомендуется использовать два последовательных метода, таких как химический с последующим механическим лизисом.- Проведите химический лизис EV путем добавления реагента для экстракции белка (см. Таблицу материалов) в пропорции 100 мкл образца на 150 мкл экстракционного реагента. Добавьте 100 ингибиторов протеазы и фосфатазы для достижения конечной концентрации в 1 раз. Энергично взбейте и дайте настояться при комнатной температуре в течение 15 минут.
- Провести механический лизис по двухэтапной процедуре: дважды пропустить химически лизированный раствор EV через шприц (игла G29). Затем облучайте образцы ультразвуком в течение 45 с в ультразвуковой ванне с холодной водой. Заморозьте лизированные электромобили при температуре -80 °C.
- Разморозьте образцы при 37 °C в течение 5 минут. Снова заморозьте при -80 °C для хранения лизированных электромобилей. Перед анализом снова разморозьте в течение 5 минут при температуре 37 °C.

Рисунок 1: Схематическое изображение двухэтапной процедуры обогащения ВВ, полученных из астроцитов. На первом этапе электромобили обогащаются из дефибринированной человеческой плазмы путем осаждения на основе полимеров и центрифугирования. После полной ресуспензии ВВ астроциты затем отбирают с помощью иммунозахвата с помощью биотинилированных антител к GLAST (ACSA-1) и магнитных микрогранул против биотина. Сокращения: ACSA-1 = поверхностный антиген астроцитарной клетки 1; ADEV = внеклеточные везикулы, полученные из астроцитов; DPBS = фосфатно-солевой буфер Дульбекко; EVs = внеклеточные везикулы; GLAST = транспортер глутамат-аспартата; Отсутствие ADEV = неастроцитарные внеклеточные везикулы; Нет EV = Нет внеклеточных везикул (EV-обедненная плазма); PIC = коктейль ингибиторов протеазы; RT = комнатная температура. Фигура создана с помощью BioRender. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Валидация протокола
- Характеристика общей фракции EV до иммунозахвата
- Используйте лизированные общие EV (ресуспендированные гранулы после осаждения полимеров) и разведенные образцы плазмы для вестерн-блоттинга. Дополните образцы 4x Laemmli буфером для образцов (5 μл на 15 μл образца), кипятите в течение 10 минут при 90 °C и загрузите 10% акриламидные гели без пятен.
- Проведите электрофорез в полиакриламидном геле SDS (SDS-PAGE) в буфере Tris/Glycine/SDS при напряжении 80 В в течение 30 минут, а затем при напряжении 200 В в течение 40 минут. Следуя SDS-PAGE, удалите гель со стеклянных пластин и визуализируйте общее содержание белка после 1-минутного УФ-возбуждения.
- Перенесите белки из геля на активированную метанолом мембрану из PVDF размером 0,2 мкм через полусухую систему при напряжении 25 В, 2,5 А в течение 10 мин (подробную информацию об оборудовании см. в Таблице материалов ). После переноса заблокируйте мембрану в блокирующем буфере на 5 минут при комнатной температуре, а затем инкубируйте в течение ночи при 4 °C с первичными антителами к Alix (1:1000), CD9 (1:1000) или Calnexin (1:1000); подробности см. в Таблице материалов .
- Промойте мембрану в трис-буферном физрастворе с 0,1% Tween 20 (TBST) три раза в течение 10 мин и инкубируйте в течение 1 ч при комнатной температуре с помощью вторичного антитела против HRP против кролика, разведенного в соотношении 1:7500 в блокирующем буфере. Промойте мембрану в TBST четыре раза в течение 10 минут. Выполняйте все промывки и этапы инкубации с легким перемешиванием мембраны на скамейке-коромысле.
- Смешайте в соотношении 1:1 хемилюминесцентный раствор с буфером перекиси и инкубируйте мембраны в течение 5 минут при комнатной температуре. Экспонируйте и получайте полосы с помощью системы хемилюминесцентной визуализации (подробнее см. Таблицу материалов ).
- Валидация обогащения астроцит-специфичных маркеров во фракции ADEV
Глиальный фибриллярный кислый белок (GFAP) является основным промежуточным филаментным белком в астроцитарных клетках и важным элементом их цитоскелета во время развития. GFAP может быть обнаружен в тканях мозга и биожидкостях, являясь хорошо известным астроцитарным маркером39. Таким образом, этот маркер был количественно определен с использованием коммерческой технологии обнаружения биомаркеров, чтобы продемонстрировать обогащение маркеров, полученных из астроцитов, во фракции ADEV. Эта технология биомаркеров представляет собой сверхчувствительный метод, который позволяет измерять отдельные белковые молекулы с чувствительностью до 1000 раз выше, чем при обычной иммунотерапии. Этот метод основан на использовании парамагнитных микрочастиц в сочетании с антителами, предназначенными для связывания с конкретными мишенями40,41 (см. таблицу материалов).- Используйте лизированные образцы EV для анализа биомаркеров. Чтобы проверить обогащение маркеров астроцитов, сравните уровни GFAP в элюате (ADEVs) с проточным (No ADEVs) с использованием коммерческого ультрачувствительного иммуноферментного анализа.
- Разбавьте образцы в соотношении 1:4 (25 мкл EV + 75 мкл буфера для анализа), подготовьте калибраторы и проведите анализ на оборудовании для детектирования биомаркеров, как указано в инструкциях производителя (см. Таблицу материалов). Образцы можно разводить непосредственно на пластине.
- Протестируйте образцы и калибраторы в двух экземплярах. Диапазон количественного определения для анализа GFAP составлял 1,37-1000 пг/мл. Используйте платформу анализа программного обеспечения производителя для расчета концентраций GFAP по калибровочной кривой.
- Чтобы оценить коэффициент вариации (CV) протокола обогащения маркеров астроцитов, измерьте уровни GFAP в препаратах ADEV, полученных из идентичных реплик объединенных образцов плазмы крови человека, и рассчитайте CV как стандартное отклонение/среднее x 100. В этом протоколе CV рассчитывали с использованием N = 10 идентичных образцов плазмы.
- Валидация обогащения маркеров EV во фракцию ADEV
- Чтобы проверить обогащение маркеров EV, измерьте уровни Alix и CD81 с помощью иммуноферментного анализа (см. Таблицу материалов) в лизированных неразбавленных образцах EV, следуя рекомендациям производителя. Тестовые образцы и калибраторы в двух экземплярах.
- Считывайте показания пластин на длинах волн 450 нм и 570 нм с помощью считывателя микропланшетов. Используйте линейную калибровочную кривую для расчета концентраций Alix и CD81. Диапазон количественного определения для анализа Alix составлял 47-3000 пг/мл, а для CD81 - 0,156-10 нг/мл.
- Характеристика размеров и морфологии ADEV
- Анализ слежения за наночастицами
- Используйте анализ с отслеживанием наночастиц (NTA) для измерения концентрации частиц и распределения по размерам свежих нелизированных препаратов EV.
- Разбавьте свежие, нелизированные суспензии ADEV (10 μл) с отфильтрованной PBS в соответствии с дальностью обнаружения прибора (20-100 частиц/кадр), используя прилагаемое программное обеспечение, запишите три видеоролика по 60 с следующими настройками: скорость потока шприца на 30 а.е., уровень камеры на 13 и порог обнаружения на 5. Скорректируйте концентрацию частиц для объема входного образца, объема ресуспензии EV и разбавления, необходимого для чтения NTA.
ПРИМЕЧАНИЕ: Рекомендуется предварительно визуализировать образец, содержащий решение для электромобиля, чтобы проверить матричный эффект и чистоту среды, в которой ресуспендируются электромобили.
- Криоэлектронная микроскопия
- Используйте криоэлектронную микроскопию (Cryo-EM) для подтверждения присутствия и морфологии Evs в свежих, нелизированных суспензиях ADEV (4 μL). Остеклование образцов с помощью коммерческого погружного морозильника на угольных решетках Holey со следующими настройками: 3,9 мкл образца, время ожидания 10 с, время блотки 2 с.
- Погружение в жидкий этан-азот в криорабочей станции. Перенесите сетки в криодержатель, поддерживаемый при температуре -179 °C для анализа с помощью просвечивающего электронного микроскопа. Осмотрите электромобили с помощью просвечивающего электронного микроскопа, работающего на ускоряющем напряжении 200 кВ и оснащенного ПЗС-камерой. Получение микрофотографий с помощью программного обеспечения.
- Анализ слежения за наночастицами
- Анализ копреципитации липопротеинов
- Определение уровней ApoB человека в неразбавленной плазме, лизированных образцах общего EV и лизированных образцах ADEV с помощью иммунотурбидиметрического анализа с использованием коммерческого набора, адаптированного для коммерческого автоанализатора (более подробную информацию см. в Таблице материалов ).
- Анализ маркеров воспаления в ADEV
- Используйте анализ на основе гранул (см. Таблицу материалов) для количественного определения концентрации 25 маркеров воспаления: эотаксина, ИФН Альфа2, ИФН Гамма, ИЛ-1 Альфа, ИЛ-1 Бета, ИЛ-3, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12 (р40), ИЛ-12 (р70), ИЛ-15, ИЛ-17А, ИЛ-17Е/ИЛ-25, ИЛ-17Ф, ИЛ-18, ИП-10, МКП-1, МЦП-3, МДХ, МИП-1 Альфа, МИП-1 Бета, ТГФ Альфа, ФНО Альфа, ФНО Бета.
- Используйте лизированные неразбавленные препараты EV (25 μл) и инкубируйте образцы с гранулами в течение ночи при температуре 4°C, следуя инструкциям производителя. Вымойте планшет, инкубируйте с 25 мкл антител для обнаружения и инкубируйте в течение 1 ч при перемешивании при комнатной температуре.
- Добавьте 25 мкл стрептавидина-ПЭ в каждую лунку и инкубируйте в течение 30 минут при комнатной температуре. Добавьте 150 μл жидкости оболочки и инкубируйте в течение 5 минут при перемешивании. Считывание показаний таблички на считывателе пластин, подключенном к системе.
ПРИМЕЧАНИЕ: Этот метод основан на иммунологических анализах с использованием антител, которые связываются с поверхностью магнитных микрогранул с флуоресцентным покрытием. Эта технология внутренне кодирует микросферы по их цвету разными красителями. Каждый тип микросфер покрыт определенным антителом захвата, так что несколько конъюгированных гранул захватывают аналиты, встроенные в образцы, что позволяет количественно мультиплексно обнаруживать десятки аналитов одновременно. В системе используется мультиплексная иммуноферментная платформа на основе бусин для обнаружения сигнала43.
3. Анализ данных
- Выполняйте статистический анализ с помощью коммерческого программного обеспечения. Оцените нормальность данных с помощью теста Шапиро-Уилка. Тестовые двухгрупповые сравнения с U-критерием Манна-Уитни и трехгрупповые сравнения с критерием Краскела-Уоллиса и апостериорной коррекцией Данна. Установите значение p < 0,05.
Результаты
Было успешно осуществлено выделение ADEV из плазмы, собранной у здоровых доноров. Для получения общей фракции EV был использован метод осаждения на основе полимеров с последующим иммунозахватом с помощью магнитных микрогранул для получения ADEV.
Вестерн-блоттинг общей фракции ВВ до этапа иммунозахвата показал отсутствие кальнексина (маркера клеточной контаминации) и присутствие Alix и трансмембранного белка CD9 в препаратах ВВ (рис. 2A).
После иммунозахвата было подтверждено наличие и обогащение везикулярных и астроцитарных маркеров во фракции ADEV. Концентрации GFAP были значительно выше в ADEV по сравнению с фракцией без ADEV (проточной), демонстрируя шестикратное обогащение (p = 0,008). Это подтверждает преимущественно астроцитарное происхождение ВВ в фракции ADEV (рис. 2B). CV количественного определения GFAP по препаратам ADEV из 10 идентичных образцов составил 25%.
С целью подтверждения наличия везикулярных маркеров в препаратах ADEV были исследованы два маркера: Alix, классический цитозольный везикулярный маркер42, и трансмембранный белок CD8144. Уровни Alix были выше во фракции ADEV по сравнению со свободной плазмой (p = 0,001), а также с обедненной EV плазмой, относящейся к отсутствию EV (p = 0,0007; Рисунок 2В). ADEV также показали обогащение CD81 по сравнению со свободной плазмой (p = 0,03; Рисунок 2D).
Для дальнейшей характеристики популяции ADEV профиль размера и численности был проанализирован с помощью NTA, а морфология — с помощью крио-ЭМ. Анализ NTA показал однородный профиль EV со средним размером 93,7 ± 2,7 нм, что согласуется с размером небольших EV (микровезикул и экзосом). Более того, характеристика с помощью крио-ЭМ еще раз подтвердила наличие и ожидаемую морфологию ВВ (рис. 2E).
Учитывая, что липопротеины могут выпадать в осадок вместе с ВВ, уровни ApoB были проанализированы в различных фракциях. Результаты показывают, что после этапа иммунозахвата уровни ApoB минимальны в препаратах ADEV, будучи выше в плазме (p = 0,005; Рисунок 2F).
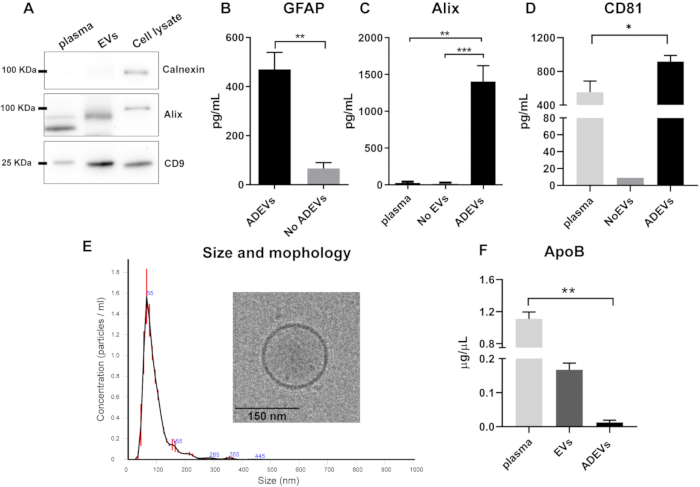
Рисунок 2: Характеристика общих фракций EV и ADEV. (A) Репрезентативный вестерн-блоттинг, показывающий недостаток кальнексина и присутствие Alix и CD9 в общих препаратах EV. (B) фракция ADEV показала повышенные уровни GFAP по сравнению с No ADEV (ADEV, n = 7; Нет ADEV, n = 7; p = 0,008). (с) Более высокие уровни Alix были обнаружены в ADEV по сравнению с плазмой (p = 0,001) и No EV (p = 0,0007); плазма: n = 6; Нет EV: n = 6; ADEVS: n = 16. (D) Более высокие уровни CD81 были обнаружены во фракции ADEV по сравнению с плазмой (p = 0,003); плазма: n = 5; No EVs: n = 1 (CD81 не обнаруживался в восьми из девяти образцов No EV); ADEVS: n = 17. (E) Анализ NTA выявил наличие частиц со средним размером 93,7 ± 2,7 нм, везикулярная характеристика которых была подтверждена крио-ЭМ. (Ф) ApoB был достоверно ниже во фракции ADEV по сравнению с плазмой (p = 0,005); плазма: n = 4; EVs: n = 4; ADEVS: n = 4. Сокращения: ADEV = внеклеточные везикулы, полученные из астроцитов; Alix = белок, взаимодействующий с запрограммированной смертью клетки 6 (PDCD6IP); ApoB = Аполипопротеин B; EVs = общие препараты внеклеточных везикул после осаждения на основе полимеров; GFAP = глиальный фибриллярный кислый белок; Отсутствие ADEV = неастроцитарные внеклеточные везикулы; Нет EV = Нет внеклеточных везикул (обедненная EV плазма). Для (B) использовался двухсторонний критерий Манна-Уитни (**p < 0,01), а для (C,D,F) использовались тесты множественных сравнений Класкала-Уоллиса и Данна (*p < 0,05, **p < 0,01 и ***p < 0,0001). Графики иллюстрируют среднее значение, а полосы погрешностей показывают стандартную ошибку. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Наконец, применимость этого протокола была изучена с использованием ADEV для количественной оценки маркеров воспаления. Все 25 воспалительных цитокинов в панели были обнаружены в ADEV, полученных от здоровых доноров (рис. 3).

Рисунок 3. Количественное определение воспалительных цитокинов во фракции ADEV. Панель из 25 воспалительных цитокинов в ADEV от здоровых доноров показала, что все они были обнаруживаемы и дифференциально экспрессировались (HC, n = 3). На графике показано среднее значение, а на полосах погрешности показана стандартная ошибка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Электромобили вызвали большой интерес в биомедицинских исследованиях благодаря своему диагностическому и терапевтическому потенциалу. В настоящее время одним из основных препятствий, связанных с методами изоляции ВВ, является отсутствие методологического консенсуса и стандартизированных протоколов. В этом исследовании представлен подробный протокол обогащения ВВ астроцитов из плазмы крови человека с помощью преципитации на основе полимеров и иммунозахвата GLAST.
Существуют различные методологии выделения электромобилей из жидкостей организма, каждая из которых имеет свои преимущества и ограничения. Подход на основе полимеров был выбран из-за его простоты, удобства использования, нетрудоемкости, отсутствия необходимости в специальном инструменте, высокого выхода EV, а также потому, что он широко используется в исследованиях биомаркеров EV в неврологии 12,18,19,20, что позволяет сравнивать результаты. Тем не менее, можно также опробовать альтернативные методы, такие как эксклюзионная хроматография. Распространенной критикой методов на основе полимеров является совместное осаждение липопротеинов вместе с EV. Тем не менее, дополнительный этап иммунозахвата антителами ACSA-1 и последующие промывки могут преодолеть это ограничение за счет селективного связывания с ADEV, сводя к минимуму контаминацию липопротеинами, как это видно при анализе ApoB. При использовании этого протокола для количественных исследований следует учитывать CV внутри анализа, особенно при небольших размерах выборки. Еще одним ограничением этой процедуры является то, что минимальные следы полимеров могут мешать некоторым последующим анализам, таким как масс-спектрометрия. Поэтому сочетание этого протокола с последующими аналитическими методами должно быть опробовано для каждого конкретного использования.
Протокол, описанный в этом исследовании, был валидирован для обогащения астроцитарных и везикулярных маркеров во фракции ADEV. Иммунозахват астроцитов EV проводился с использованием GLAST в качестве мишени и подтвердил астроцитарное происхождение EV, о чем свидетельствует шестикратное обогащение дополнительным астроцитарным маркером, GFAP. Несмотря на то, что эта процедура была протестирована и оптимизирована для обогащения ADEV из человеческой плазмы здоровых пожилых людей, некоторые шаги в протоколе могут быть изменены и адаптированы в соответствии с используемым последующим приложением. Например, использование сверхчистой воды для ресуспензии гранул является предпочтительным для последующей иммунопреципитации. Кроме того, стадия инкубации как антител, так и магнитных шариков (время и концентрация) может быть изменена для концентрации или разбавления ADEV по желанию.
Важнейшие этапы протокола включают механическую ресуспендию гранулы EV перед этапом иммунозахвата. С гранулированными электромобилями необходимо обращаться очень тщательно, не допуская пенообразования при повторной суспензии. Следует также обратить внимание на использование 3-кратных концентрированных ингибиторов протеазы в буферах, для ингибирования активных протеаз, присутствующих в плазме. Кроме того, крайне важно не нажимать поршнем на колонну с шагом до вымывания ADEV, оставшихся в колонне.
Несмотря на то, что существуют исследования, использующие этот подход (преципитация на основе полимеров + иммунопреципитация) для выделения ADEV у людей с болезнью Альцгеймера и черепно-мозговой травмой 12,20,34, ADEV остаются недостаточно изученными в отношении EV из других клеток (например, нейронов) и заслуживают дополнительных исследований.
Некоторые нейродегенеративные заболевания, такие как болезнь Альцгеймера и синдром Дауна, были связаны с эндосомальными аномалиями и повышенной секрецией EV 45,46,47. Одним из способов объяснения более высокой секреции ВВ является количественное определение уровней маркера ВВ, такого как Alix и CD81, как это было сделано в этом исследовании, или других тетраспанинов, таких как CD63 или CD9, для нормализации уровней интересующего аналита. Помимо подтверждения обогащения астроцитарных и EV-маркеров, была проверена полезность протокола для измерения воспалительных цитокинов в ADEV. С помощью мультиплексной платформы были получены детектируемые и количественные концентрации 25 цитокинов и хемокинов во фракции АДЕВ.
Таким образом, эта процедура позволяет собирать ВВ, которые могут быть использованы в качестве платформы для обнаружения биомаркеров, а также в качестве неинвазивного инструмента для изучения молекулярных механизмов и путей, связанных с астроцитами. Действительно, изучение ADEV имеет огромный потенциал в области неврологических заболеваний, поскольку груз ADEV может быть использован в качестве ресурса для изучения фенотипа астроцитов и изменений на различных стадиях заболевания.
Несмотря на то, что в данной рукописи подробно описывается методология, важно рассмотреть преимущества и ограничения этого метода, а также его применимость. Действительно, в области ВВ предпринимаются важные усилия по стандартизации, такие как обширные рекомендации по исследованиям и шаги по валидации, изложенные в руководящих принципах MISEV от Международного общества внеклеточных везикул48, а также платформа EV-track для представления методологической информации об исследованиях ВВ49.
Раскрытие информации
Доктор Белбин сообщил о получении личных гонораров от ADx NeuroSciences вне представленной работы. Д-р Алколеа сообщил о получении личных гонораров за услуги консультативного совета и/или гонорары докладчиков от Fujirebio-Europe, Roche, Nurtricia, Krka Farmacéutica, Zambon S.A.U. и Esteve вне представленной работы. Д-р Льео работал консультантом или членом консультативных советов компаний Fujirebio-Europe, Roche, Biogen, Grifols и Nutricia вне представленной работы. Д-р Фортеа сообщал о получении личных гонораров за работу в консультативных советах, судейских комитетах или гонораров докладчиков от AC Immune, Novartis, Lundbeck, Roche, Fujirebio и Biogen вне представленной работы. Доктора Алколеа, Белбин, Ллео и Фортеа сообщают о владении патентом на маркеры синаптопатии при нейродегенеративных заболеваниях (лицензирован ADx, EPI8382175.0). О других разоблачениях не сообщалось. Всем остальным авторам больше нечего раскрывать.
Благодарности
Авторы выражают признательность Сорайе Торрес, Шайме Эль Бунасри Эль Беннади и Ориолу Санчесу Лопесу за помощь в работе с образцами и их подготовке. Мы также хотели бы выразить признательность за сотрудничество Хосе Амабле Бернабе из ICTS "NANBIOSIS", подразделение 6 (подразделение CIBER по биоинженерии, биоматериалам и наномедицине) Института материаловедения Барселоны, Марти де Кабо Жауме из отделения электронной микроскопии Автономного университета Барселоны, доктора Марты Солер Кастань и Лии Рос Бланко из платформы проточной цитометрии в Институте биомедицинских исследований Сант-Пау (IIB-Sant Pau). а также доктору Джоану Карлесу Эскола-Жилю из группы патофизиологии липидных заболеваний в IIB-Sant Pau за помощь в определении NTA, крио-EM, Luminex и ApoB соответственно.
Авторы выражают признательность за финансовую поддержку со стороны Фонда Жерома Лежена (Проекты #1941 и #1913 для MFI и MCI), Instituto de Salud Carlos III (PI20/01473 для JF, PI20/01330 для AL, PI18/00435 для DA и INT19/00016 для DA), Национального института здравоохранения (1R01AG056850-01A1, R21AG056974 и R01AG061566 для JF), Ассоциации Альцгеймера и Глобального института здоровья мозга (GBHI_ALZ-18-543740 для MCI), Ассоциация лобно-височной дегенерации (Clinical Research Postdoctoral Fellowship, AFTD 2019–2021) в ODI и Societat Catalana de Neurologia (Premi Beca Fundació SCN 2020 to MCI). Эта работа также была поддержана программой CIBERNED (Программа 1, Болезнь Альцгеймера до AL и исследование SIGNAL. SS является получателем постдокторского гранта "Juan de la Cierva-Incorporación" (IJC2019-038962-I) от Agencia Estatal de Investigación, Ministerio de Ciencia e Innovación (Gobierno de España).
Материалы
| Name | Company | Catalog Number | Comments |
| Anti-Alix primary antibody for Western blotting | EMD Millipore | ABC40 | |
| µMACS Separator | Miltenyi Biotec | 130-042-602 | The µMACS Separator is used in combination with µ Columns and MACS MicroBeads. |
| Anti-calnexin primary antibody for Western blotting | Genetex | GTX109669 | |
| Anti-CD9 primary antibody for Western blotting | Cell Signaling | 13174 | |
| Blocker BSA (10%) 200 mL | Thermo Fisher | 37525 | |
| Bransonic 1510E-MT Ultrasonic bath | Branson | ||
| COBAS 6000 autoanalyzer | Roche Diagnostics | Analyzer for immunoturbidimetric determination of ApoB; commercial autoanalyzer | |
| cOmplete Protease Inhibitor Cocktail (EDTA-free) | Roche | 11873580001 | |
| Digital Micrograph 1.8 | micrograph software | ||
| Dulbecco's PBS Mg++, Ca++ free 500 mL | Thermo Fisher | 14190144 | |
| EveryBlot Blocking Buffer | BioRad | 12010020 | |
| Exoquick (exosome precipitation solution 5 mL) + Thrombin | System Bioscience | EXOQ5TM-1 | ExoQuick 20 mL can also be purchased (EXOQ20A-1) |
| Gatan 895 USC 4000 | camera | ||
| GeneGnome XRQ chemiluminiscence imaging system | Syngene | ||
| Human CD81 antigen (CD81) ELISA kit | Cusabio | CSB-EL004960HU | |
| Human Programmed cell death 6-interacting protein (PDCD6IP) ELISA kit | Cusabio | CSB-EL017673HU | |
| Immun-Blot PVDF Membrane | BioRad | 1620177 | |
| JEOL 2011 transmission electron microscope | JEOL LTD | Equipped with a CCD Gatan 895 USC 4000 camera (Gatan 626, Gatan, Pleasanton, USA) | |
| Lavender EDTA BD Vacutainer K2E tubes | Becton dickinson | 367525 | |
| Leica EM GP | Leica Microsystem | commercial plunge freezer | |
| Low binding microtubes 1,5 mL | Deltalab | 4092.3NS | |
| MACS µ Columns with plungers | Miltenyi Biotec | 130-110-905 | µ Columns with plungers are especially designed for isolation of exosomes from body fluids |
| MACS Multistand | Miltenyi Biotec | 130-042-303 | |
| MAGPIX plate reader | Luminex Corporation | 80-073 | Luminex's xMAP multiplexing unit (Luminex xPonent v 4.3 software) |
| MicroBead Kit100 μL Anti-GLAST (ACSA-1)-Biotin, human, mouse, rat – small size; 100 μL Anti-Biotin MicroBeads | Miltenyi Biotec | 130-095- 825 | |
| MILLIPLEX MAP Kit Human cytokine/Chemokine/Growth Factor Panel A magnetic bead panel | EMD Millipore | HCYTA-60K-25 | |
| M-PER Mammalian Protein Extraction Reagent 25 mL | Thermo Fisher | 78503 | For certain applications like Western blot, more aggressive lysis buffers can be used (e.g. RIPA) |
| MultiSkan SkyHigh Microplate Spectrophotometer | Thermofisher | A51119500C | |
| NanoSight NS300 | Malvern Panalytical | NTA; 3.4 version | |
| Pierce Halt Protease and Phosphatase Inhibitor Cocktail | Thermo Fisher | 78441 | |
| Polypropylene syringe (G29) | PeroxFarma | 1mL syringe; 0.33x12mm-G29x1/2" | |
| Secondary anti-rabbit antibody | Thermo Fisher | 10794347 | |
| Simoa GFAP Discovery Kit | Quanterix | 102336 | |
| Simoa, SR-X instrument | Quanterix | SR-X Ultra-Sensitive Biomarker Detection System; commercial biomarker detection technology | |
| Specific Protein Test Apolipoprotein B - APOB (100 det) COBAS C/CI | Roche Diagnostics | 3032574122 | |
| SuperSignal West Femto | Thermo Fisher | 34095 | Ultra-sensitive enhanced chemiluminescent (ECL) HRP substrate |
| Trans-Blot Turbo Transfer System | BioRad | 1704150 |
Ссылки
- Pathan, M., et al. Vesiclepedia 2019: a compendium of RNA, proteins, lipids and metabolites in extracellular vesicles. Nucleic Acids Research. 47, 516-519 (2019).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Gustafson, D., Veitch, S., Fish, J. E. Extracellular vesicles as protagonists of diabetic cardiovascular pathology. Frontiers in Cardiovascular Medicine. 4, 71 (2017).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Harding, C. V., Heuser, J. E., Stahl, P. D. Exosomes: Looking back three decades and into the future. Journal of Cell Biology. 200 (4), 367-371 (2013).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Hood, J. L., San Roman, S., Wickline, S. A. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis. Cancer Research. 71 (11), 3792-3801 (2011).
- Rak, J. Microparticles in cancer. Seminars in Thrombosis and Hemostasis. 36 (8), 888-906 (2010).
- Ledreux, A., et al. Small neuron-derived extracellular vesicles from individuals with down syndrome propagate tau pathology in the wildtype mouse brain. Journal of Clinical Medicine. 10 (17), 3931 (2021).
- Winston, C. N., et al. Prediction of conversion from mild cognitive impairment to dementia with neuronally derived blood exosome protein profile. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 3, 63-72 (2016).
- Goetzl, E. J., Schwartz, J. B., Abner, E. L., Jicha, G. A., Kapogiannis, D. High complement levels in astrocyte-derived exosomes of Alzheimer's disease. Annals of Neurology. 83 (3), 544-552 (2018).
- Fiandaca, M. S., et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimer's and Dementia. 11 (6), 600-607 (2015).
- Mustapic, M., et al. Plasma extracellular vesicles enriched for neuronal origin: A potential window into brain pathologic processes. Frontiers in Neuroscience. 11, 278 (2017).
- Hamlett, E. D., et al. Neuronal exosomes reveal Alzheimer's disease biomarkers in Down syndrome. Alzheimer's and Dementia. 13 (5), 541-549 (2017).
- Goetzl, E. J., et al. Abnormal levels of mitochondrial proteins in plasma neuronal extracellular vesicles in major depressive disorder. Molecular Psychiatry. 26 (12), 7355-7362 (2021).
- Goetzl, E. J., et al. Neuron-derived exosome proteins may contribute to progression from repetitive mild traumatic brain injuries to chronic traumatic encephalopathy. Frontiers in Neuroscience. 13, 452 (2019).
- Goetzl, E. J., et al. Cargo proteins of plasma astrocyte-derived exosomes in Alzheimer's disease. FASEB Journal. 30 (11), 3853-3859 (2016).
- Goetzl, E. J., et al. Traumatic brain injury increases plasma astrocyte-derived exosome levels of neurotoxic complement proteins. FASEB Journal. 34 (2), 3359-3366 (2020).
- Nogueras-ortiz, C. J., et al. Astrocyte- and neuron-derived extracellular vesicles from Alzheimer's disease patients effect complement-mediated neurotoxicity. Cells. 9 (7), 1618 (2020).
- Haydon, P. G., Carmignoto, G. Astrocyte control of synaptic transmission and neurovascular coupling. Physiological Reviews. 86 (3), 1009-1031 (2006).
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Rothstein, J., et al. Antisense knockout of glutamate transporters reveals a predominant role for astroglial glutamate transport in excitotoxicity and clearance of extracellular glutamate. Neuron. 16 (3), 675-686 (1996).
- Vasile, F., Dossi, E., Rouach, N. Human astrocytes: structure and functions in the healthy brain. Brain Structure and Function. 222 (5), 2017-2029 (2017).
- Balu, D. T., et al. Neurotoxic astrocytes express the D-serine synthesizing enzyme, serine racemase, in Alzheimer's disease. Neurobiology of Disease. 130, 104511 (2019).
- Sofroniew, M. V. Astrocyte barriers to neurotoxic inflammation. Nature Reviews Neuroscience. 16 (5), 249-263 (2015).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24 (7), 931-938 (2018).
- Bianco, F., et al. Acid sphingomyelinase activity triggers microparticle release from glial cells. EMBO Journal. 28 (8), 1043-1054 (2009).
- Datta Chaudhuri, A., et al. Stimulus-dependent modifications in astrocyte-derived extracellular vesicle cargo regulate neuronal excitability. Glia. 68 (1), 128-144 (2020).
- Serrano-Pozo, A., Gómez-Isla, T., Growdon, J. H., Frosch, M. P., Hyman, B. T. A phenotypic change but not proliferation underlies glial responses in Alzheimer disease. American Journal of Pathology. 182 (6), 2332-2344 (2013).
- Tong, J., et al. Low levels of astroglial markers in Parkinson's Disease: relationship to α-synuclein accumulation. Neurobiology of Disease. 82, 243-253 (2015).
- Kamo, H., et al. A distinctive distribution of reactive astroglia in the precentral cortex in amyotrophic lateral sclerosis. Acta Neuropathologica. 74 (1), 33-38 (1987).
- Coumans, F. A. W., et al. Methodological guidelines to study extracellular vesicles. Circulation Research. 120 (10), 1632-1648 (2017).
- Winston, C. N., Goetzl, E. J., Schwartz, J. B., Elahi, F. M., Rissman, R. A. Complement protein levels in plasma astrocyte-derived exosomes are abnormal in conversion from mild cognitive impairment to Alzheimer's disease dementia. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 11, 61-66 (2019).
- Niu, Z., et al. Polymer-based precipitation preserves biological activities of extracellular vesicles from an endometrial cell line. PLoS ONE. 12 (10), 1-21 (2017).
- Alcolea, D., et al. The Sant Pau Initiative on Neurodegeneration (SPIN) cohort: A data set for biomarker discovery and validation in neurodegenerative disorders. Alzheimer's and Dementia: Translational Research and Clinical Interventions. 5, 597-609 (2019).
- O'Bryant, S. E., et al. Guidelines for the standardization of preanalytic variables for blood-based biomarker studies in Alzheimer's disease research. Alzheimer's and Dementia. 11 (5), 549-560 (2015).
- Kim, K., et al. Role of excitatory amino acid transporter-2 (EAAT2) and glutamate in neurodegeneration: Opportunities for developing novel therapeutics. Journal of Cellular Physiology. 226 (10), 2484-2493 (2011).
- Middeldorp, J., Hol, E. M. GFAP in health and disease. Progress in Neurobiology. 93 (3), 421-443 (2011).
- Mora, J., et al. Next generation ligand binding assays-review of emerging technologies' capabilities to enhance throughput and multiplexing. AAPS Journal. 16 (6), 1175-1184 (2014).
- Chunyk, A. G., et al. A multi-site in-depth evaluation of the quanterix simoa from a user's perspective. AAPS Journal. 20 (1), 1-12 (2018).
- Lötvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: A position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), 26913 (2014).
- Hansen, E. O., et al. Millipore xMap® Luminex (HATMAG-68K): An accurate and cost-effective method for evaluating Alzheimer's biomarkers in cerebrospinal fluid. Frontiers in Psychiatry. 12, 1-9 (2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogenous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences. 113 (8), 968-977 (2016).
- Gauthier, S. A., et al. Enhanced exosome secretion in Down syndrome brain - a protective mechanism to alleviate neuronal endosomal abnormalities. Acta Neuropathologica Communications. 5 (1), 65 (2017).
- Cataldo, A. M., et al. Endocytic pathway abnormalities precede amyloid β deposition in sporadic alzheimer's disease and down syndrome: Differential effects of APOE genotype and presenilin mutations. American Journal of Pathology. 157 (1), 277-286 (2000).
- Cataldo, A. M., et al. Down syndrome fibroblast model of Alzheimer-related endosome pathology: Accelerated endocytosis promotes late endocytic defects. American Journal of Pathology. 173 (2), 370-384 (2008).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Van Deun, J., et al. EV-TRACK: Transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены