Method Article
从人血浆中富集星形胶质细胞衍生的细胞外囊泡
摘要
该方案描述了从人血浆中富集星形胶质细胞衍生的细胞外囊泡 (ADEV)。它基于通过聚合物沉淀分离 EV,然后基于 ACSA-1 的 ADEV 免疫捕获。ADEV 的分析可能为通过液体活检非侵入性地研究活体患者炎症通路的变化提供线索。
摘要
细胞外囊泡 (EV) 是所有细胞分泌的生物纳米颗粒,用于细胞通讯和废物消除。它们通过在生理和病理条件下作用于其他细胞并将其货物转移到其他细胞来参与广泛的功能。鉴于它们存在于生物流体中,EV 是研究疾病过程的极好资源,可以被视为用于发现生物标志物的液体活检。EV 分析的一个吸引人的方面是,可以根据其来源细胞的标记物来选择它们,从而反映其货物中特定组织的环境。然而,与 EV 分离方法相关的主要障碍之一是缺乏方法共识和标准化方案。星形胶质细胞是在大脑中起重要作用的神经胶质细胞。在神经退行性疾病中,星形胶质细胞反应性可能导致 EV 货物改变和异常的细胞通讯,从而促进/增强疾病进展。因此,星形胶质细胞 EV 的分析可能会导致发现生物标志物和潜在的疾病靶标。该方案描述了从人血浆中富集星形胶质细胞衍生的 EV (ADEV) 的 2 步方法。首先, 通过 基于聚合物的沉淀从去纤维化血浆中富集 EV。然后通过基于 ACSA-1 的磁性微珠免疫捕获富集 ADEV,其中重悬的 EV 被加载到放置在磁场中的色谱柱上。磁性标记的 ACSA-1+ EV 保留在色谱柱内,而其他 EV 则流过。从磁体中取出色谱柱后,ADEV 被洗脱并准备好用于储存和分析。为了验证星形胶质细胞标志物的富集,可以在洗脱液中测量神经胶质纤维酸性蛋白 (GFAP) 或其他细胞内来源的特异性星形胶质细胞标志物,并与流出液进行比较。该协议提出了一种简单、省时的方法,从血浆中富集 ADEV,可用作检查星形胶质细胞相关标志物的平台。
引言
细胞外囊泡 (EV) 是由所有类型的细胞分泌的一组异质膜纳米颗粒,携带蛋白质、脂质和核酸1。微泡 (100-1000 nm)、外泌体 (30-100 nm) 和凋亡小体 (1000-5000 nm) 构成了主要的 EV 类型,其起源位点可区分 2,3。EV 调节重要的生理过程,例如抗原呈递和免疫应答4、受体回收、代谢物消除5 和细胞通讯6。这些过程的调节可以通过 EV 细胞膜中富集的蛋白质与受体细胞中的靶标之间的直接结合,和/或通过它们在受体细胞的细胞质中的内化和释放其货物来实现7。虽然 EV 执行基本的细胞功能,但从病理学的角度来看,它们在癌症和神经病学领域引起了越来越多的兴趣。事实上,几项研究表明,EV 可以帮助促进肿瘤细胞迁移 8,9 或在神经退行性疾病(如阿尔茨海默病)中播种有毒蛋白质聚集体10,11。
可以根据与其来源细胞相关的细胞表面标志物从生物流体中选择和富集 EV,从而反映其货物中特定组织的环境 12,13,14,15,16,17,18,19,20.此外,鉴于它们存在于血液、脑脊液 (CSF)、唾液、尿液和母乳中,EV 是一种极好的非侵入性诊断工具,可以被认为是用于发现生物标志物的液体活检。这在神经学中特别有趣,因为很难研究 CSF 以外的可接触液体中的脑分析物。
星形胶质细胞越来越受到关注,因为它们处于神经血管通讯的交叉点21。在生理条件下,它们负责保存血脑屏障、神经递质的循环、为神经元和其他神经胶质细胞提供营养和生长因子 22,23,24 以及神经免疫防御,因为它们的代谢可塑性从促炎状态到抗炎状态,反之亦然 25,26,27.星形胶质细胞完成其调节功能的一个重要机制是通过 EV 进行通信28,29。反应性星形胶质细胞增多症是多种神经退行性疾病的关键标志,例如阿尔茨海默病30、多系统萎缩症 (MSA)、进行性核上性麻痹 (PSP)31 和肌萎缩侧索硬化症 (ALS)32。星形胶质细胞反应性可能导致 EV 货物改变、炎症介质释放和异常的细胞通讯,从而促进病理的传播并导致神经退行性变10,11。因此,研究星形胶质细胞衍生的 EV (ADEV) 及其货物的变化是一种有吸引力的资源,可以以非侵入性方式检查神经退行性过程。
目前,有几种隔离 EV 的方法,每种方法都有其相应的优点和缺点33。必须考虑哪种方法更适合特定用途,具体取决于最终感兴趣的应用。在神经学领域,更具体地说,在星形胶质细胞研究中,基于聚合物的沉淀后进行免疫捕获一直是主要使用的方法 12,18,19,20,34。然而,即使应用相同的方法,应用于 EV 分离的不同步骤中的研究之间仍然存在异质性。因此,需要一种清晰、循序渐进的标准化方法来促进星形胶质细胞 EV 研究和研究可重复性。基于聚合物的沉淀有助于生物标志物筛选,因为它是一种快速、简单的程序,不需要复杂的设备,可在不影响其生物活性的情况下获得高产量的 EV35。
本方案描述了一种详细、简单的两步法,用于从人血浆中富集 ADEV。它基于基于聚合物的 EV 总组分沉淀,然后对星形胶质细胞 EV 进行免疫捕获。鉴于星形胶质细胞的重要功能,对 ADEVs 的分析可能为发现可以以非侵入性方式研究的生物标志物和脑炎症通路提供线索。
研究方案
本协议中描述的研究是使用来自西班牙巴塞罗那36 的 Sant Pau 神经退行性疾病倡议 (SPIN) 队列的男女健康成年供体(年龄范围 65.9-81.3 岁,45.5% 女性)的人类血浆样本进行的。参与者给予了知情同意。该研究是按照赫尔辛基宣言和西班牙法律中包含的医学研究国际伦理准则进行的。Sant Pau 研究伦理委员会 (CEIC) 审查并批准了从 SPIN 队列中收集和储存人血浆样本的方案 (#16/2013)。
1. 从人血浆中富集星形胶质细胞 EV
注意:该协议涉及使用人血浆样品。有关本协议中使用的试剂和实验室材料的所有详细信息都包含在 材料表中。此程序不需要特殊设备,但是,请查看每个制造商单独指定的每种试剂的安全注意事项。
- 样本采集和储存
- 按照血浆采集的标准化方案,在薰衣草 EDTA 真空采血管中采集血液36,37。收集后 30-120 分钟内在 4 °C 下以 2000 x g 离心 10 分钟以进行血浆分离。将血浆(显示为上清液的上层透明液体)分 500 μL 等分试样分离。
- 要去除细胞碎片,请将等分试样在室温下以 3000 x g 离心 15 分钟。回收上清液。将血浆储存在 -80 °C 直至分析。与生物流体分析的通常做法一样,在储存前将样品分装,并避免超过三个冻融循环。
- 总 EV 富集
注:所有使用的试剂必须通过 0.22 μm 过滤器过滤。- 解冻 500 μL 血浆样品。以 1:100 的比例添加凝血酶以去除凝血因子。倒置混合 3 次,并在室温下静置 5 分钟。
- 用 Dulbecco 磷酸盐缓冲盐水 (DPBS) 工作溶液完成体积,达到 1 mL:DPBS + 3x 浓蛋白酶抑制剂混合物(从 10x 蛋白酶抑制剂混合物原液中稀释)。倒置混合。
- 将样品在 4 °C 下以 6000 x g 离心 20 分钟。 回收上清液。用 DBPS 工作溶液完成体积,达到 1 mL。
- 加入 252 μL EV 沉淀溶液,倒置混合 3 次。在 4 °C 下孵育 60 分钟。
- 将样品在 4 °C 下以 1500 x g 离心 20 分钟,以沉淀总 EV 馏分(沉淀)。收集 1 mL 上清液。将级分标记为EV耗尽血浆,用作EV富集标记物(无EV)的阴性对照,并储存在-80°C。
- 将剩余的沉淀在 4 °C 下以 1500 x g 离心 5 分钟。 丢弃剩余的上清液。将沉淀重悬于 500 μL 含有浓蛋白酶和磷酸酶抑制剂(终浓度 3 倍,从 100 倍原液中稀释,参见 材料表)的超纯水中。
- 用力上下移液以松开沉淀,避免起泡;在室温下在旋转管振荡器上涡旋和搅拌 30 分钟,直至完全重悬。确保沉淀物完全重悬,因为这是后续免疫捕获步骤的关键步骤。
- ADEV 的免疫捕获
注意:ADEV 带有星形胶质细胞标志物。通过免疫捕获富集 ADEV 的选定标志物是 GLAST。GLAST 代表谷氨酸-天冬氨酸转运蛋白 (UniProtKB-P43003),是主要由小脑和大脑新皮层中的星形胶质细胞表达的最丰富的谷氨酸转运蛋白38。抗 GLAST (ACSA-1, 星形胶质细胞表面抗原-1) 抗体对 GLAST 的细胞外表位具有特异性,已开发用于鉴定星形胶质细胞。它是从人血浆中免疫捕获 ADEV 的最广泛使用的靶标 12,20,34。- 向含有总 EV 制剂的每个样品中加入 10 μL 抗 GLAST (ACSA-1) 生物素化抗体。轻轻搅拌均匀。在 4 °C 下在旋转管振荡器上孵育 1 小时。
- 加入 10 μL 与单克隆抗生物素抗体 (小鼠 IgG1) 偶联的磁性微珠。轻轻搅拌均匀。在 4 °C 下在旋转管振荡器上孵育 1 小时。
- 将一根微柱放入 MACS 分离器的磁场中。用 500 μL PBS-0.5% 牛血清白蛋白 (BSA) 冲洗来制备色谱柱。丢弃流出物。
- 将 EV/ACSA-1/微珠悬浮液加载到色谱柱上。在此步骤中,请勿用柱塞推动。收集流出。将其标记为非星形胶质细胞 EV(无 ADEV),并在需要时保留为对照。
- 用 500 μL PBS-0.5% BSA 洗涤色谱柱两次。丢弃流出物。
- 从磁性分离器中取出色谱柱,并将其放入低粘附力的 1.5 mL 收集管中。在色谱柱上移液 500 μL PBS-0.5% BSA。用柱塞用力推入色谱柱并收集洗脱液。
- 标记为 ACSA-1+ EV (ADEV)。将未裂解的 EV 短期储存在 -20 °C 下,或在 -80 °C 下长期储存(>6 个月)。
注意:抗 ACSA-1 抗体将与 GLAST-1/EAAT-1 表位结合。磁性微珠将与抗 ACSA-1-EV 复合物亲和结合。MACS 微型色谱柱包含优化的基质,当放置在磁体中时会产生强磁场,这是保留标记的 ADEV 所必需的。
有关 ADEV 富集程序的示意图,请参见 图 1。
- EV 的裂解
注意:EV 必须完全裂解才能检测囊内标志物。建议使用两种连续方法,例如化学裂解后机械裂解。- 通过添加蛋白质提取试剂(参见 材料表)对 EV 进行化学裂解,每 150 μL 提取试剂添加 100 μL 样品。加入 100 倍蛋白酶和磷酸酶抑制剂以达到 1 倍终浓度。剧烈涡旋,在室温下静置 15 分钟。
- 通过两步程序进行机械裂解:将化学裂解的 EV 溶液通过注射器两次(G29 针头)。然后,在超声波冷水浴中对样品进行超声处理 45 秒。将裂解的 EV 在 -80 °C 下冷冻。
- 将样品在 37 °C 下解冻 5 分钟。在 -80 °C 下再次冷冻以储存裂解的 EV。分析前在 37 °C 下再次解冻 5 分钟。

图 1:富集星形胶质细胞衍生 EV 的两步程序的示意图。 第一步,通过基于聚合物的沉淀和离心步骤从去纤维化的人血浆中富集 EV。总 EV 重悬后,然后用生物素化抗 GLAST (ACSA-1) 抗体和抗生物素磁性微珠通过免疫捕获来选择星形胶质细胞 EV。缩写:ACSA-1 = 星形胶质细胞表面抗原-1;ADEVs = 星形胶质细胞衍生的细胞外囊泡;DPBS = Dulbecco 磷酸盐缓冲盐水;EVs = 细胞外囊泡;GLAST = 谷氨酸-天冬氨酸转运蛋白;无 ADEVs = 非星形胶质细胞外囊泡;无 EV = 无细胞外囊泡(EV 耗尽血浆);PIC = 蛋白酶抑制剂混合物;RT = 室温。使用 BioRender 创建的图。 请单击此处查看此图的较大版本。
2. 协议验证
- 免疫捕获前总 EV 组分的表征
- 使用裂解的总 EV(聚合物沉淀后重悬的沉淀)和稀释的血浆样品进行 Western 印迹分析。用 4x Laemmli 样品缓冲液(15 μL 样品为 5 μL)补充样品,在 90 °C 下煮沸 10 分钟,然后加载到 10% 无染色丙烯酰胺凝胶上。
- 在 Tris/甘氨酸/SDS 缓冲液中以 80 V 进行 SDS-聚丙烯酰胺凝胶电泳 (SDS-PAGE) 30 分钟,然后用 200 V 电泳 40 分钟。在 SDS-PAGE 之后,从玻璃板中取出凝胶,并在 UV 激发 1 分钟后观察总蛋白含量。
- 通过半干燥系统在 25 V、2.5 A 下将蛋白质从凝胶转移到甲醇活化的 0.2 μm PVDF 膜上,持续 10 分钟(有关设备的详细信息,请参阅 材料表 )。转移后,在室温下将膜在封闭缓冲液中封闭 5 分钟,然后在 4 °C 下与 Alix (1:1000)、CD9 (1:1000) 或 Calnexin (1:1000) 一抗孵育过夜;有关详细信息 ,请参阅材质表 。
- 在含 0.1% Tween 20 (TBST) 的 Tris 缓冲盐水中洗涤膜 3 次,持续 10 分钟,并在室温下与在封闭缓冲液中以 1:7500 稀释的抗兔 HRP 二抗孵育 1 小时。在 TBST 中洗涤膜 4 次,每次 10 分钟。在工作台摇床上轻轻摇动膜,执行所有洗涤和孵育步骤。
- 将化学发光溶液与过氧化物缓冲液以 1:1 的比例混合,并在室温下孵育膜 5 分钟。使用化学发光成像系统曝光和采集条带(有关详细信息 ,请参见材料表 )。
- 验证 ADEV 组分中星形胶质细胞特异性标志物的富集
注:神经胶质纤维酸性蛋白 (GFAP) 是星形胶质细胞中的主要中间丝蛋白,也是其细胞骨架发育过程中的必需元素。GFAP 可以在脑组织和生物体液中检测到,是一种众所周知的星形胶质细胞标志物39。因此,使用商业生物标志物检测技术对该标志物进行定量,以证明 ADEV 组分中星形胶质细胞衍生标志物的富集。这种生物标志物技术是一种超灵敏的技术,可以测量单个蛋白质分子,其灵敏度比传统免疫标志物高 1,000 倍。该技术基于使用顺磁性微粒与旨在与特定靶标结合的抗体40,41(参见材料表)。- 使用裂解的 EV 样品进行生物标志物分析。为了测试星形胶质细胞标志物的富集,使用市售超灵敏免疫测定法比较洗脱液中的 GFAP 水平 (ADEVs) 与流穿液 (No ADEVs)。
- 以 1:4 的比例稀释样品(25 μL EV + 75 μL 检测缓冲液),准备校准品,并按照制造商的说明在生物标志物检测设备中进行检测(参见 材料表)。样品可以直接在板上稀释。
- 一式两份测试样品和校准品。GFAP 分析的定量范围为 1.37-1000 pg/mL。使用制造商的软件分析平台从校准曲线计算 GFAP 浓度。
- 为了估计星形胶质细胞标志物富集方案的变异系数 (CV),测量从合并人血浆样品的相同重复中获得的 ADEV 制剂中的 GFAP 水平,并将 CV 计算为标准差/平均值 x 100。在该方案中,使用 N = 10 个相同的血浆样品计算 CV。
- 验证 ADEV 组分中 EV 标志物的富集
- 为了验证 EV 标志物的富集,请按照制造商的建议,通过 ELISA 测量裂解的未稀释 EV 样品中的 Alix 和 CD81 水平(参见 材料表)。测试样品和校准品一式两份。
- 使用酶标仪在 450 nm 和 570 nm 处读取板。使用线性校准曲线计算 Alix 和 CD81 浓度。Alix 分析的定量范围为 47-3000 pg/mL,CD81 的定量范围为 0.156-10 ng/mL。
- ADEV 的大小和形态特征
- 纳米粒子跟踪分析
- 使用纳米颗粒跟踪分析 (NTA) 测量新鲜未裂解 EV 制剂的颗粒浓度和粒径分布。
- 根据仪器的检测范围(20-100 个颗粒/帧),用过滤的 PBS 稀释新鲜的、未裂解的 ADEV 悬浮液 (10 μL),使用随附的软件录制三个 60 秒视频,设置如下:注射器流速为 30 A.u.,相机水平为 13,检测阈值为 5。校正输入样品体积的颗粒浓度、EV 重悬体积和 NTA 读数所需的稀释度。
注:建议对包含 EV 车辆溶液的样品进行预可视化,以验证基质效应和重悬 EV 的培养基的纯度。
- 冷冻电子显微镜
- 使用冷冻电子显微镜 (Cryo-EM) 确认新鲜、未裂解的 ADEV 悬浮液 (4 μL) 中 Evs 的存在和形态。使用 Holey 碳网格上的商用投入式冰箱对样品进行玻璃化,设置如下:3.9 μL 样品,等待时间 10 秒,印迹时间 2 秒。
- 在冷冻工作站中浸入液态乙烷-氮气中。将网格转移到保持在 -179 °C 的低温支架上进行透射电子显微镜分析。使用在 200 kV 加速电压下运行并配备 CCD 相机的透射电子显微镜检查 EV。使用软件采集显微照片。
- 纳米粒子跟踪分析
- 脂蛋白共沉淀分析
- 使用适用于商业自动分析仪的商业试剂盒,通过免疫比浊测定法测定未稀释血浆、裂解的总 EV 样品和裂解的 ADEV 样品中的人 ApoB 水平(有关详细信息,请参阅 材料表 )。
- ADEV 中炎症标志物的分析
- 使用基于磁珠的测定法(参见 材料表)定量 25 种炎症标志物的浓度:嗜酸性粒细胞趋化因子、IFN α2、IFN γ、IL-1 Alpha、IL-1 Β、IL-3、IL-6、IL-8、IL-10、IL-12 (p40)、IL-12 (p70)、IL-15、IL-17A、IL-17E/IL-25、IL-17F、IL-18、IP-10、MCP-1、MCP-3、MDC、MIP-1 Alpha、MIP-1 Beta、TGF Alpha、TNF Alpha、TNF Beta。
- 使用裂解的未稀释 EV 制剂 (25 μL),并按照制造商的说明将样品与磁珠在 4°C 下孵育过夜。洗涤板,与 25 μL 检测抗体一起孵育,并在室温下搅拌孵育 1 小时。
- 向每个孔中加入 25 μL 链霉亲和素-PE,并在室温下孵育 30 分钟。加入 150 μL 鞘液,并在搅拌下孵育 5 分钟。在连接到系统的读板器上读取板。
注:该技术基于使用与荧光包被的磁性微珠表面结合的抗体的免疫测定。该技术根据微球的颜色对不同染料进行内部编码。每种类型的微球都包被有特异性捕获抗体,因此多个偶联微球捕获包埋在样品中的分析物,从而可以同时对数十种分析物进行定量多重检测。该系统使用基于微珠的多重免疫分析平台进行信号检测43。
3. 数据分析
- 使用商业软件执行统计分析。使用 Shapiro-Wilk 检验评估数据正态性。检验 两组比较与 Mann-Whitney U 检验,三组比较 与 Kruskal-Wallis 检验和 Dunn 事后校正。将显著性设置为 p < 0.05。
结果
从健康供体采集的血浆中分离 ADEV 已成功完成。采用基于聚合物的沉淀法获得总 EV 馏分,然后用磁性微珠进行免疫捕获以获得 ADEV。
在免疫捕获步骤之前对总 EV 组分的蛋白质印迹分析表明,EV 制剂中缺乏钙联结蛋白(细胞污染标志物)并且存在 Alix 和跨膜蛋白 CD9(图 2A)。
免疫捕获后,在 ADEV 组分中验证了囊泡和星形胶质细胞标志物的存在和富集。与无 ADEV 分数 (流出) 相比,ADEV 中的 GFAP 浓度显着升高,显示出 6 倍的富集 (p = 0.008)。这证实了 ADEV 部分中 EV 的主要星形胶质细胞来源(图 2B)。来自 10 个相同样品的 ADEV 制备物的 GFAP 定量 CV 为 25%。
为了确认 ADEV 制剂中囊泡标志物的存在,检查了两个标志物:Alix,一种经典的胞质囊泡标志物42,和跨膜蛋白 CD8144。与游离血浆 (p = 0.001) 以及 EV 耗尽血浆(称为无 EV)相比,ADEV 分数中的 Alix 水平更高 (p = 0.0007; 图 2C)。与游离血浆相比,ADEV 还显示 CD81 的富集 (p = 0.03; 图 2D)。
为了进一步表征 ADEV 群体,通过 NTA 分析大小和计数曲线,通过冷冻电镜分析形态。NTA 分析显示 EV 的均匀分布,平均尺寸为 93.7 ± 2.7 nm,与小 EV(微泡和外泌体)的大小一致。此外,冷冻电镜的表征进一步证实了 EV 的存在和预期的形态(图 2E)。
鉴于脂蛋白可能与 EV 共沉淀,因此分析了不同组分的 ApoB 水平。结果表明,在免疫捕获步骤之后,ADEV 制备中的 ApoB 水平最低,血浆中的 ApoB 水平较高 (p = 0.005; 图 2F)。
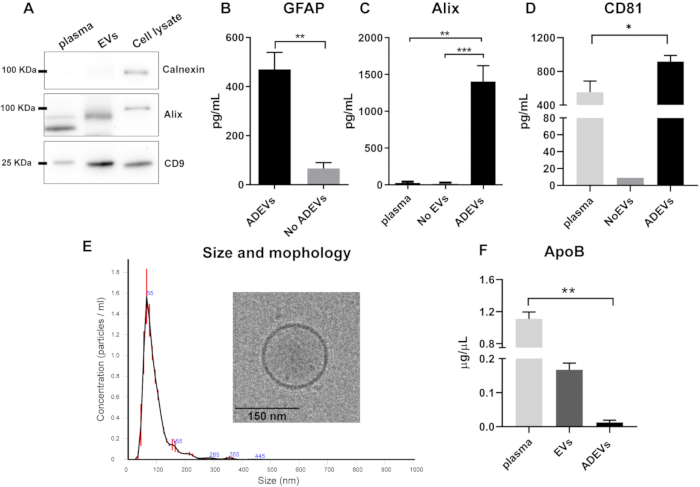
图 2:EV 和 ADEV 总馏分的表征。(A) 代表性蛋白质印迹显示 EV 总制备物中缺乏钙联接蛋白且存在 Alix 和 CD9。(B) 与无 ADEV 相比,ADEV 分数显示 GFAP 水平升高 (ADEV, n = 7;无 ADEV,n = 7;p = 0.008)。(三) 与血浆 (p = 0.001) 和无 EV (p = 0.0007) 相比,在 ADEVs 中检测到更高水平的 Alix;血浆:n = 6;无 EV:n = 6;ADEVS:n = 16。(D) 与血浆相比,在 ADEV 组分中检测到更高水平的 CD81 (p = 0.003);血浆:n = 5;无 EV:n = 1(9 个无 EV 样本中有 8 个检测不到 CD81);ADEVS:n = 17。(E) NTA 分析显示存在中位尺寸为 93.7 ± 2.7 nm 的颗粒,其泡状特征通过冷冻电镜证实。(六) 与血浆相比,ADEV 分数中的 ApoB 显着降低 (p = 0.005);血浆:n = 4;EV:n = 4;ADEVS:n = 4。 缩写:ADEVs = 星形胶质细胞衍生的细胞外囊泡;Alix = 程序性细胞死亡 6 相互作用蛋白 (PDCD6IP);ApoB = 载脂蛋白 B;EVs = 基于聚合物的沉淀后细胞外囊泡总制备物;GFAP = 神经胶质纤维酸性蛋白;无 ADEVs = 非星形胶质细胞外囊泡;无 EV = 无细胞外囊泡(EV 耗尽血浆)。对于 (B),使用双尾 Mann Whitney 检验 (**p < 0.01),对于 (C,D,F),使用 Kluskal-Wallis 和 Dunn 的多重比较检验 (*p < 0.05,**p < 0.01 和 ***p < 0.0001)。图形说明了平均值,误差线显示了标准误差。请单击此处查看此图的较大版本。
最后,通过使用 ADEVs 量化炎症标志物来检查该方案的适用性。该面板中的所有 25 种炎性细胞因子都可以在从健康供体获得的 ADEV 中检测到(图 3)。

图 3.ADEV 组分中炎性细胞因子的定量。 一组来自健康供体的 ADEV 中的 25 种炎性细胞因子显示,它们都是可检测到的并且差异表达 (HC,n = 3)。该图说明了平均值,误差线显示了标准误差。 请单击此处查看此图的较大版本。
讨论
由于其诊断和治疗潜力,电动汽车在生物医学研究中引起了浓厚的兴趣。目前,与 EV 分离方法相关的主要障碍之一是缺乏方法学共识和标准化方案。本研究为 通过 基于聚合物的沉淀和 GLAST 免疫捕获从人血浆中富集星形胶质细胞 EVs 提供了详细的方案。
存在不同的方法从体液中分离 EV,每种方法都有自己的优点和局限性。选择基于聚合物的方法是因为其简单、易于使用、不耗时、不需要特定仪器、EV 产量高,并且因为它广泛用于神经病学的 EV 生物标志物研究 12,18,19,20,允许比较结果。但是,也可以测试其他方法,例如尺寸排阻色谱。对基于聚合物的方法的一个常见批评是脂蛋白与 EV 的共沉淀。然而,使用 ACSA-1 抗体进行额外的免疫捕获步骤和随后的洗涤可以通过选择性地结合 ADEV 来克服这一限制,最大限度地减少脂蛋白的污染,如 ApoB 分析所示。当使用此方案进行定量研究时,应考虑批内 CV,尤其是小样本量。该程序的另一个限制是,极少的聚合物痕量可能会干扰某些下游分析,例如质谱分析。因此,应针对每种特定用途测试该方案与后续分析方法的组合。
本研究中描述的方案已验证可用于 ADEV 组分中星形胶质细胞和囊泡标志物的富集。以 GLAST 为靶标进行星形胶质细胞 EV 免疫捕获,并验证了 EV 的星形胶质细胞来源,如额外的星形胶质细胞标志物 GFAP 的六倍富集所示。尽管该程序已针对从健康老年人的人血浆中富集 ADEV 进行了测试和优化,但可以根据要使用的下游应用修改和调整方案中的某些步骤。例如,在随后的免疫沉淀中,首选使用超纯水进行沉淀重悬。此外,抗体和磁珠的孵育步骤(时间和浓度)均可根据需要进行修改,以浓缩或稀释 ADEV。
该方案中的关键步骤包括在免疫捕获步骤之前机械重悬 EV 沉淀。颗粒状 EV 必须经过非常仔细的处理,避免在重悬过程中起泡。还应注意在缓冲液中使用 3x 浓蛋白酶抑制剂,以抑制血浆中存在的活性蛋白酶。此外,在洗脱色谱柱中保留的 ADEV 之前,不要用柱塞逐步推入色谱柱,这一点至关重要。
虽然有研究使用这种方法(基于聚合物的沉淀 + 免疫沉淀)从阿尔茨海默病和创伤性脑损伤的个体中分离 ADEV 12,20,34,但对于来自其他细胞来源(例如神经元)的 EV,ADEV 的研究仍然不足,值得进行更多研究。
某些神经退行性疾病,如阿尔茨海默病和唐氏综合症,与内体异常和 EV 分泌增加有关 45,46,47。解释较高 EV 分泌的一种方法是定量 EV 标志物(如 Alix 和 CD81)的水平,如本研究中所做的,或其他跨膜四蛋白(如 CD63 或 CD9)的水平,以使目标分析物的水平正常化。除了验证星形胶质细胞和 EV 标志物的富集外,还测试了该方案测量 ADEVs 中炎性细胞因子的效用。使用多重平台,在 ADEV 组分中获得 25 种细胞因子和趋化因子的可检测和定量浓度。
因此,该程序允许收集可用作生物标志物发现平台的 EV,以及研究星形胶质细胞相关分子机制和途径的非侵入性工具。事实上,ADEVs 的研究在神经系统疾病领域具有巨大的潜力,因为 ADEV 货物可以用作探索星形胶质细胞表型和不同疾病阶段变化的资源。
虽然这份手稿广泛描述了该方法,但必须考虑这种方法的优点和局限性以及适当的适用性。事实上,EV 领域有一些重要的标准化工作,例如国际细胞外囊泡学会48 的 MISEV 指南概述的广泛研究建议和验证步骤,以及用于报告 EV 研究方法学信息的 EV-track 平台49。
披露声明
Belbin 博士报告说,在提交的工作之外,他从 ADx NeuroSciences 收到了个人费用。Alcolea 博士报告说,在提交的工作之外,她收到了 Fujirebio-Europe、Roche、Nurtricia、Krka Farmacéutica、Zambon S.A.U. 和 Esteve 的顾问委员会服务和/或演讲者酬金的个人费用。在提交的工作之外,Lleó 博士还曾担任 Fujirebio-Europe、Roche、Biogen、Grifols 和 Nutricia 的顾问或顾问委员会。Fortea 博士报告说,在提交的工作之外,他从 AC Immune、Novartis、Lundbeck、Roche、Fujirebio 和 Biogen 那里获得了在咨询委员会、评审委员会的服务或演讲者酬金的个人费用。Alcolea、Belbin、LLeó 和 Fortea 博士报告拥有神经退行性疾病中突触病变标志物的专利(授权给 ADx,EPI8382175.0)。没有其他披露报告。所有其他作者都没有什么可披露的。
致谢
作者要感谢 Soraya Torres、Shaimaa El Bounasri El Bennadi 和 Oriol Sanchez Lopez 在样品处理和制备方面的帮助。我们也要感谢来自巴塞罗那材料科学研究所ICTS “NANBIOSIS”的第6单元(CIBER的生物材料与纳米医学单元)的José Amable Bernabé,来自巴塞罗那自治大学电子显微镜单元的Marti de Cabo Jaume,来自Sant Pau生物医学研究所(IIB-Sant Pau)流式细胞仪平台的Marta Soler Castany博士和Lia Ros Blanco的合作, 以及 IIB-Sant Pau 脂质相关疾病病理生理学小组的 Joan Carles Escolà-Gil 博士,分别帮助进行 NTA、冷冻电镜、Luminex 和 ApoB 测定。
作者感谢 Jérôme Lejeune 基金会(MFI 和 MCI 的项目 #1941 和 #1913)、Instituto de Salud Carlos III(PI20/01473 至 JF、PI20/01330 至 AL、PI18/00435 至 DA 和 INT19/00016 至 DA)、美国国立卫生研究院(1R01AG056850-01A1、R21AG056974 和 R01AG061566 至 JF)、阿尔茨海默氏症协会和全球脑健康研究所(GBHI_ALZ-18-543740 至 MCI)、 额颞叶变性协会(临床研究博士后奖学金,AFTD 2019-2021)到 ODI,以及加泰罗尼亚神经学协会(Premi Beca Fundació SCN 2020 到 MCI)。这项工作也得到了 CIBERNED 计划(计划 1,阿尔茨海默病到 AL 和 SIGNAL 研究。SS 是 Agencia Estatal de Investigación, Ministerio de Ciencia e Innovación (Gobierno de España) 的博士后资助“Juan de la Cierva-Incorporación” (IJC2019-038962-I) 的获得者。
材料
| Name | Company | Catalog Number | Comments |
| Anti-Alix primary antibody for Western blotting | EMD Millipore | ABC40 | |
| µMACS Separator | Miltenyi Biotec | 130-042-602 | The µMACS Separator is used in combination with µ Columns and MACS MicroBeads. |
| Anti-calnexin primary antibody for Western blotting | Genetex | GTX109669 | |
| Anti-CD9 primary antibody for Western blotting | Cell Signaling | 13174 | |
| Blocker BSA (10%) 200 mL | Thermo Fisher | 37525 | |
| Bransonic 1510E-MT Ultrasonic bath | Branson | ||
| COBAS 6000 autoanalyzer | Roche Diagnostics | Analyzer for immunoturbidimetric determination of ApoB; commercial autoanalyzer | |
| cOmplete Protease Inhibitor Cocktail (EDTA-free) | Roche | 11873580001 | |
| Digital Micrograph 1.8 | micrograph software | ||
| Dulbecco's PBS Mg++, Ca++ free 500 mL | Thermo Fisher | 14190144 | |
| EveryBlot Blocking Buffer | BioRad | 12010020 | |
| Exoquick (exosome precipitation solution 5 mL) + Thrombin | System Bioscience | EXOQ5TM-1 | ExoQuick 20 mL can also be purchased (EXOQ20A-1) |
| Gatan 895 USC 4000 | camera | ||
| GeneGnome XRQ chemiluminiscence imaging system | Syngene | ||
| Human CD81 antigen (CD81) ELISA kit | Cusabio | CSB-EL004960HU | |
| Human Programmed cell death 6-interacting protein (PDCD6IP) ELISA kit | Cusabio | CSB-EL017673HU | |
| Immun-Blot PVDF Membrane | BioRad | 1620177 | |
| JEOL 2011 transmission electron microscope | JEOL LTD | Equipped with a CCD Gatan 895 USC 4000 camera (Gatan 626, Gatan, Pleasanton, USA) | |
| Lavender EDTA BD Vacutainer K2E tubes | Becton dickinson | 367525 | |
| Leica EM GP | Leica Microsystem | commercial plunge freezer | |
| Low binding microtubes 1,5 mL | Deltalab | 4092.3NS | |
| MACS µ Columns with plungers | Miltenyi Biotec | 130-110-905 | µ Columns with plungers are especially designed for isolation of exosomes from body fluids |
| MACS Multistand | Miltenyi Biotec | 130-042-303 | |
| MAGPIX plate reader | Luminex Corporation | 80-073 | Luminex's xMAP multiplexing unit (Luminex xPonent v 4.3 software) |
| MicroBead Kit100 μL Anti-GLAST (ACSA-1)-Biotin, human, mouse, rat – small size; 100 μL Anti-Biotin MicroBeads | Miltenyi Biotec | 130-095- 825 | |
| MILLIPLEX MAP Kit Human cytokine/Chemokine/Growth Factor Panel A magnetic bead panel | EMD Millipore | HCYTA-60K-25 | |
| M-PER Mammalian Protein Extraction Reagent 25 mL | Thermo Fisher | 78503 | For certain applications like Western blot, more aggressive lysis buffers can be used (e.g. RIPA) |
| MultiSkan SkyHigh Microplate Spectrophotometer | Thermofisher | A51119500C | |
| NanoSight NS300 | Malvern Panalytical | NTA; 3.4 version | |
| Pierce Halt Protease and Phosphatase Inhibitor Cocktail | Thermo Fisher | 78441 | |
| Polypropylene syringe (G29) | PeroxFarma | 1mL syringe; 0.33x12mm-G29x1/2" | |
| Secondary anti-rabbit antibody | Thermo Fisher | 10794347 | |
| Simoa GFAP Discovery Kit | Quanterix | 102336 | |
| Simoa, SR-X instrument | Quanterix | SR-X Ultra-Sensitive Biomarker Detection System; commercial biomarker detection technology | |
| Specific Protein Test Apolipoprotein B - APOB (100 det) COBAS C/CI | Roche Diagnostics | 3032574122 | |
| SuperSignal West Femto | Thermo Fisher | 34095 | Ultra-sensitive enhanced chemiluminescent (ECL) HRP substrate |
| Trans-Blot Turbo Transfer System | BioRad | 1704150 |
参考文献
- Pathan, M., et al. Vesiclepedia 2019: a compendium of RNA, proteins, lipids and metabolites in extracellular vesicles. Nucleic Acids Research. 47, 516-519 (2019).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: Exosomes, microvesicles, and friends. Journal of Cell Biology. 200 (4), 373-383 (2013).
- Gustafson, D., Veitch, S., Fish, J. E. Extracellular vesicles as protagonists of diabetic cardiovascular pathology. Frontiers in Cardiovascular Medicine. 4, 71(2017).
- Raposo, G., et al. B lymphocytes secrete antigen-presenting vesicles. The Journal of Experimental Medicine. 183 (3), 1161-1172 (1996).
- Harding, C. V., Heuser, J. E., Stahl, P. D. Exosomes: Looking back three decades and into the future. Journal of Cell Biology. 200 (4), 367-371 (2013).
- Valadi, H., et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nature Cell Biology. 9 (6), 654-659 (2007).
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews Molecular Cell Biology. 19 (4), 213-228 (2018).
- Hood, J. L., San Roman, S., Wickline, S. A. Exosomes released by melanoma cells prepare sentinel lymph nodes for tumor metastasis. Cancer Research. 71 (11), 3792-3801 (2011).
- Rak, J. Microparticles in cancer. Seminars in Thrombosis and Hemostasis. 36 (8), 888-906 (2010).
- Ledreux, A., et al. Small neuron-derived extracellular vesicles from individuals with down syndrome propagate tau pathology in the wildtype mouse brain. Journal of Clinical Medicine. 10 (17), 3931(2021).
- Winston, C. N., et al. Prediction of conversion from mild cognitive impairment to dementia with neuronally derived blood exosome protein profile. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 3, 63-72 (2016).
- Goetzl, E. J., Schwartz, J. B., Abner, E. L., Jicha, G. A., Kapogiannis, D. High complement levels in astrocyte-derived exosomes of Alzheimer's disease. Annals of Neurology. 83 (3), 544-552 (2018).
- Fiandaca, M. S., et al. Identification of preclinical Alzheimer's disease by a profile of pathogenic proteins in neurally derived blood exosomes: A case-control study. Alzheimer's and Dementia. 11 (6), 600-607 (2015).
- Mustapic, M., et al. Plasma extracellular vesicles enriched for neuronal origin: A potential window into brain pathologic processes. Frontiers in Neuroscience. 11, 278(2017).
- Hamlett, E. D., et al. Neuronal exosomes reveal Alzheimer's disease biomarkers in Down syndrome. Alzheimer's and Dementia. 13 (5), 541-549 (2017).
- Goetzl, E. J., et al. Abnormal levels of mitochondrial proteins in plasma neuronal extracellular vesicles in major depressive disorder. Molecular Psychiatry. 26 (12), 7355-7362 (2021).
- Goetzl, E. J., et al. Neuron-derived exosome proteins may contribute to progression from repetitive mild traumatic brain injuries to chronic traumatic encephalopathy. Frontiers in Neuroscience. 13, 452(2019).
- Goetzl, E. J., et al. Cargo proteins of plasma astrocyte-derived exosomes in Alzheimer's disease. FASEB Journal. 30 (11), 3853-3859 (2016).
- Goetzl, E. J., et al. Traumatic brain injury increases plasma astrocyte-derived exosome levels of neurotoxic complement proteins. FASEB Journal. 34 (2), 3359-3366 (2020).
- Nogueras-ortiz, C. J., et al. Astrocyte- and neuron-derived extracellular vesicles from Alzheimer's disease patients effect complement-mediated neurotoxicity. Cells. 9 (7), 1618(2020).
- Haydon, P. G., Carmignoto, G. Astrocyte control of synaptic transmission and neurovascular coupling. Physiological Reviews. 86 (3), 1009-1031 (2006).
- Abbott, N. J., Rönnbäck, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Rothstein, J., et al. Antisense knockout of glutamate transporters reveals a predominant role for astroglial glutamate transport in excitotoxicity and clearance of extracellular glutamate. Neuron. 16 (3), 675-686 (1996).
- Vasile, F., Dossi, E., Rouach, N. Human astrocytes: structure and functions in the healthy brain. Brain Structure and Function. 222 (5), 2017-2029 (2017).
- Balu, D. T., et al. Neurotoxic astrocytes express the D-serine synthesizing enzyme, serine racemase, in Alzheimer's disease. Neurobiology of Disease. 130, 104511(2019).
- Sofroniew, M. V. Astrocyte barriers to neurotoxic inflammation. Nature Reviews Neuroscience. 16 (5), 249-263 (2015).
- Yun, S. P., et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson's disease. Nature Medicine. 24 (7), 931-938 (2018).
- Bianco, F., et al. Acid sphingomyelinase activity triggers microparticle release from glial cells. EMBO Journal. 28 (8), 1043-1054 (2009).
- Datta Chaudhuri, A., et al. Stimulus-dependent modifications in astrocyte-derived extracellular vesicle cargo regulate neuronal excitability. Glia. 68 (1), 128-144 (2020).
- Serrano-Pozo, A., Gómez-Isla, T., Growdon, J. H., Frosch, M. P., Hyman, B. T. A phenotypic change but not proliferation underlies glial responses in Alzheimer disease. American Journal of Pathology. 182 (6), 2332-2344 (2013).
- Tong, J., et al. Low levels of astroglial markers in Parkinson's Disease: relationship to α-synuclein accumulation. Neurobiology of Disease. 82, 243-253 (2015).
- Kamo, H., et al. A distinctive distribution of reactive astroglia in the precentral cortex in amyotrophic lateral sclerosis. Acta Neuropathologica. 74 (1), 33-38 (1987).
- Coumans, F. A. W., et al. Methodological guidelines to study extracellular vesicles. Circulation Research. 120 (10), 1632-1648 (2017).
- Winston, C. N., Goetzl, E. J., Schwartz, J. B., Elahi, F. M., Rissman, R. A. Complement protein levels in plasma astrocyte-derived exosomes are abnormal in conversion from mild cognitive impairment to Alzheimer's disease dementia. Alzheimer's and Dementia: Diagnosis, Assessment and Disease Monitoring. 11, 61-66 (2019).
- Niu, Z., et al. Polymer-based precipitation preserves biological activities of extracellular vesicles from an endometrial cell line. PLoS ONE. 12 (10), 1-21 (2017).
- Alcolea, D., et al. The Sant Pau Initiative on Neurodegeneration (SPIN) cohort: A data set for biomarker discovery and validation in neurodegenerative disorders. Alzheimer's and Dementia: Translational Research and Clinical Interventions. 5, 597-609 (2019).
- O'Bryant, S. E., et al. Guidelines for the standardization of preanalytic variables for blood-based biomarker studies in Alzheimer's disease research. Alzheimer's and Dementia. 11 (5), 549-560 (2015).
- Kim, K., et al. Role of excitatory amino acid transporter-2 (EAAT2) and glutamate in neurodegeneration: Opportunities for developing novel therapeutics. Journal of Cellular Physiology. 226 (10), 2484-2493 (2011).
- Middeldorp, J., Hol, E. M. GFAP in health and disease. Progress in Neurobiology. 93 (3), 421-443 (2011).
- Mora, J., et al. Next generation ligand binding assays-review of emerging technologies' capabilities to enhance throughput and multiplexing. AAPS Journal. 16 (6), 1175-1184 (2014).
- Chunyk, A. G., et al. A multi-site in-depth evaluation of the quanterix simoa from a user's perspective. AAPS Journal. 20 (1), 1-12 (2018).
- Lötvall, J., et al. Minimal experimental requirements for definition of extracellular vesicles and their functions: A position statement from the International Society for Extracellular Vesicles. Journal of Extracellular Vesicles. 3 (1), 26913(2014).
- Hansen, E. O., et al. Millipore xMap® Luminex (HATMAG-68K): An accurate and cost-effective method for evaluating Alzheimer's biomarkers in cerebrospinal fluid. Frontiers in Psychiatry. 12, 1-9 (2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogenous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences. 113 (8), 968-977 (2016).
- Gauthier, S. A., et al. Enhanced exosome secretion in Down syndrome brain - a protective mechanism to alleviate neuronal endosomal abnormalities. Acta Neuropathologica Communications. 5 (1), 65(2017).
- Cataldo, A. M., et al. Endocytic pathway abnormalities precede amyloid β deposition in sporadic alzheimer's disease and down syndrome: Differential effects of APOE genotype and presenilin mutations. American Journal of Pathology. 157 (1), 277-286 (2000).
- Cataldo, A. M., et al. Down syndrome fibroblast model of Alzheimer-related endosome pathology: Accelerated endocytosis promotes late endocytic defects. American Journal of Pathology. 173 (2), 370-384 (2008).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Van Deun, J., et al. EV-TRACK: Transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。