Method Article
Solucan, Lumbricus Terrestris: Yeni Bir Mikroenjeksiyon Damar Sistemi İn vivo Omurgasız Modeli
Bu Makalede
Özet
Solucanlar, damar sistemi çalışmaları için in vivo tezgah üstü yeni bir omurgasız modelidir. Solucan damar sistemine etkili cerrahi ve mikroenjeksiyona izin veren teknikler ve ekipmanlar sunuyoruz. Cerrahi protokoller, mikroenjeksiyon teknikleri ve ısmarlama mikropipetlerin üretilmesi için prosedür anlatılmaktadır.
Özet
Omurgalılar biyomedikal araştırmalar için vazgeçilmez olsa da, çalışmalar genellikle maliyet, uzun iç inceleme ve etik hususlar gibi faktörlerle sınırlıdır. Solucanı, belirli ön vaskülatür çalışmalarına uygulanabilen alternatif, düşük maliyetli, omurgasız bir hayvan olarak sunuyoruz. Solucanın dorsal damarlarının, ventral damarlarının ve beş çift sahte kalbin cerrahi mevcudiyeti nedeniyle, solucanlara kolayca erişilebilir, düşük maliyetli bakım sunar ve belirli bir bileşiğin yalnızca küçük dozlarının uygulanmasını gerektirir. Solucan modeli, insan kanına benzer bir hemoglobin yapısına sahip basit bir kapalı vasküler dolaşım sistemi sağlar. Solucanların uyuşturulması ve ilgili kan damarlarını ortaya çıkarmak için cerrahi insizyonların yapılması için bir protokol sağlanmıştır. Bileşik uygulama için mikropipetler, camın bir pipet çektirme ile ısıtılması ve çekilmesi ve mikron ölçeğinde ince bir iğne ucu oluşturmak için bir eğim sistemi kullanılmasıyla oluşturulur. Uçlar daha sonra bir mikropozisyoner ve mikroenjektör ile birlikte, büyük numune boyutlarının ve küçük bileşik hacimlerinin mevcudiyeti ile tekrar tekrar bir solucanın vasküler sistemine rastgele bileşikler enjekte etmek için kullanılır. Enjeksiyon prosedürünün incelikleri ile ilgili ayrıntılar verilmiştir. Solucanın küçük damar boyutu, özellikle ventral damar söz konusu olduğunda zorlayıcıdır; Bununla birlikte, sunulan tekniklere hakimiyet, düşük maliyetli bir çözüm olarak yüksek tekrarlanabilirlik sunarak çok büyük örneklem büyüklüğündeki çalışmaları pratik hale getirir.
Giriş
Solucan, önceki bilimsel uygulamalar için önemli bir biyoindikatör ve biyo-tahlil olarak kullanılmıştır 1,2,3,4,5,6; Topraktaki biyositler (böcek öldürücüler) ve olumsuz ekotoksikolojik etkilergibi yerinde ve biyoakümülasyon çalışmaları için karasal ortamlarda tehlikeli ve toksik atıklardan kaynaklanan biyolojik riskleri değerlendirmek için ideal bir organizmadır 7,8,9,10. Ek olarak, biyoprospektif nedeniyle, solucan fibrinolitik, anti-pıhtılaştırıcı, anti-mikrobiyal ve anti-kanser moleküllerinin alternatif bir kaynağıdır11,12; 1991'de bir ekibin solucan derisinden lumbrisin çıkarıp saflaştırdığı ve SHN farelerinin meme tümörlerine yerleştirdiği ve bu da tümör büyümesinin inhibisyonuna yol açtığınoktaya kadar 13. Solucan aynı zamanda pedagojik olarak yararlı bir hayvan modelidir, çünkü öğrencileri ameliyata maruz bırakmak ve bir örneğin anatomisini anlamak için kullanılabilir; kan dolaşımını incelemekten elektrofizyolojiyekadar 14,15.
Kendi araştırmamızda, canlı solucanların damarlarının yüksek yoğunluklu ultrasona verdiği tepkiyi inceledik18. Solucandaki damar yırtılmasının, insan mikro damarlarındaki yırtılma hasarında ilişkilendirdiğimize benzer koşullar altında meydana geldiğini bulduk. Devam eden çalışmamız, solucan damar sistemine mikro kabarcıkların enjekte edilmesini içerir. Mikro kabarcıklar, bir lipit, albümin veya polimer kabuk ile kaplanmış ağır bir gazdan oluşur, bu ajanlar görüntü kontrast ajanları ve hedefe yönelik ilaç dağıtımı için araçlar olarak kullanılabilir.
Bu yeni protokol, solucanın doğal biyoindikatörlerini kullanabilecek bir bileşiğin intravenöz (IV) enjeksiyonundan fayda sağlayacak herhangi bir çalışma ile ilgilidir. Yaklaşım, solucanın beş çift yalancı kalbi, dorsal damar ve ventral damar dahil olmak üzere birkaç olası giriş noktasından birine IV mikroenjeksiyona dayanmaktadır. Prosedür, damarları ortaya çıkarmak için ayrıntılı bir cerrahi kesi ve ardından mikro konumlandırıcı kontrollü bir enjeksiyonu içerir. Bu, solucan vasküler mikroenjeksiyonu için özel olarak yapılmış özel mikropipetler kullanılarak elde edilir. Bu mikropipetler, 90 μm çapında bir ventral damar kadar küçük damarların hassas bir şekilde hedeflenmesini sağlar.
Bu protokol, solucan kanı ve idrarının çıkarılması için 1948 yılında yapılan bir çalışma da dahil olmak üzere daha önceki mikro pipetleme tekniklerini geliştirmek için tasarlanmıştır16. Şekil S1'de görüldüğü gibi, bu çıkarma işleminin kurulumu zor olabilir ve yazar tarafından belirtildiği gibi bir saat veya daha uzun sürebilir. Benzer bir yöntem 1970 yılında geliştirildi, ancak yazar, solucanın17 dev liflerine sıvı enjekte ederken çok sayıda kırık uç yaşadı. Aşağıda açıklanan mevcut yöntemde, kanın çıkarılması saniyeler ila dakikalar meselesidir ve hem bileşiklerin enjeksiyonu hem de solucan sıvılarının ekstraksiyonu ile ilgilidir. Bu özel durumda, kontrast maddeleri, mikro kabarcıkları enjekte ettik.
Protokol
1. Mikropipet hazırlama: cam ve eğim ucu çekme
- Mikropipet çekme
- Mikropipet çekiciyi açın ve solucan mikroenjeksiyonu için belirli parametreleri girmek üzere bir program seçin.
- Parametreleri Basınç=500, Çekme=75, Zaman=250, Isı=336 ve Hız=70 olarak ayarlayın. Sonuçlar çektirmeden çektirmeye değişebilir; Bu nedenle, istenen ucu elde etmek için parametrelerle denemeler yapın (boyut, keskinlik, şekil vb.).
- Mikropipetleri çekmeden önce ısı değerini belirlemek için bir RAMP testi yaptığınızdan emin olun, çünkü bunun yapılmaması oluk filamentinin yanmasına veya camın kırılmasına neden olabilir.
- Hava basıncının değiştirilmesi gerekiyorsa, temizleme düğmesine basın, tüm değerlerin silinmesi istendiğinde hayır (0) öğesini seçin ve basıncı değiştir (2) öğesini seçin. Bu işlem çektirmeden çektirmeye değişebilir; Bu nedenle, basınç ayarlarını değiştirmek için cihaz kılavuzuna bakın.
- Mikropipet çektirme kapağını açın ve çektirmeye bir mikropipet yükleyin. Kullanılan mikropipet camı, filament pipetli borosilikat camdı: 10 cm uzunluğunda, dış çapı: 1,5 mm ve iç çapı: 0,86 mm.
- Pipetin ucu pipet tutucunun ucuyla aynı hizaya gelene kadar pipeti sağdan pipet yarığı boyunca V oluğuna kaydırın. Pipetin filament boyunca karşı tarafa hareket edebilmesini sağlamak için, pipeti pipet yarığı üzerinde durduğundan emin olarak mümkün olduğunca itin.
- Pipeti kilitlemek için sağ taraftaki düğmeyi sıkın ve kilitli sistemi, filamentten çektirmenin diğer tarafına ulaşana kadar pipetle birlikte kaydırın. Son olarak, pipetin sol tarafını çektirmeye kilitleyin. Pipet filamentin ortasında olmalıdır; Pipetin nasıl düzgün şekilde hizalanacağına ilişkin talimatlar için kılavuza bakın.
- Pipet yüklendikten sonra çektirmeyi kapatın, çekme düğmesine basın ve ortaya çıkan iki pipeti çıkarmadan önce pipetin çekilmesini bekleyin.
- Pipetleri çıkarmak için düğmeleri gevşetin ve yarıktan çıkarırken pipetleri klipslememeye dikkat edin.
- Mikropipeti yerinde tutmak ve çekilen mikropipetleri kırmadan kolay döndürmeye izin vermek için çekilen mikropipetleri bir mikropipet tutucusuna veya bir tür desteğe yerleştirin. Bir makine atölyesinde oluşturulabilen ve hatta 3D olarak yazdırılabilen kendi mikropipet tutucumuzu geliştirdik.
NOT: Protokol buradan duraklatılabilir. - Mikropipet tutucuyu mikroskobun altına yerleştirin ve çekilen mikropipetlerin resmini çekmek ve uçtan ~1000 mm ve ~50 mm büyütme kullanarak uç çapını kaydetmek için bir kamera programı veya benzeri bir yazılım kullanın.
- Bir resim çekmeden önce, özellikle görüntüleme sonrası ölçümlerde doğru ölçüm yapmak için kamera ayarlarının mikroskop ayarıyla (10x) eşleştiğinden emin olun. 10x ayarı, ekranın üst kısmına yakın bir yerde bulunan yatay araç çubuğu şeridinde bulunur.
- Mikropipetin resmini görüntülemek ve çekmek için, sol üst köşede bulunan kamera yazılımında kamerayı seçin ve doğru bir okuma elde etmek için uca odaklandıktan sonra Tutturma düğmesine basın. Tutturma düğmesi, sayfanın sol tarafında, kamera sekmesinin altındaki yatay araç çubuğunda bulunur.
- İstenen uç boyutuna ve kıvamına ulaşılıp ulaşılmadığını belirlemek için çekilen mikropipetlerin ölçümlerini alın. Çektirmenin ve parametrelerinin tutarlı bir şekilde istenen boyutu üretip üretmediğini belirlemek için 5 pipete kadar çekmek yeterlidir. İstenen uç boyutuna ulaşılamadıysa, boyutlandırma pipete göre değişmeye devam ederse, araştırmacının istenen uç boyutu elde edilene kadar farklı ayarlarla denemeler yapması gerekebilir veya pipet çektirme kılavuzunun referansını gerektirebilecek filamenti ve pipet yerleşimini sabitlemek gerekebilir.
NOT: Protokol buradan duraklatılabilir.
- Mikropipeti eğim verecek şekilde ayarlama ve elektrot empedans ölçeri kullanma
- Çekilen mikropipetlere eğim vermek için, elektrot empedans ölçer ve 40x stereo mikroskop içeren bir mikropipet düzenleyici kullanın.
NOT: Diğer eğim açı açıları kullanılabilir; Şirket içi eğim verme makineleri bile başarılıdır, ayrıca eğim verme işlemini incelemek için mikroskoba bir kamera monte etmek de dahil olmak üzere farklı mikroskoplarla farklı konfigürasyonlar elde edilebilir. - Kaide/taşlama plakasını ince plaka ile iki siyah tutucu arasına monte edin.
- Alt plakayı, mıknatıslar plakadan uzağa bakacak şekilde yerleştirin.
- Üç parçayı birbirine vidalayın: (1) üst tespit halkası, (2) taşlama ince plakası ve (3) alt tespit halkası (manyetik). Taşlama plakasının aşındırıcı yüzeyini tanımlayın; İnce plaka için mor bir renktir ve camın kuvars optik düz ile temas etmesi için yukarı bakmalıdır.
- Kaynak ağzı açma aletinin kuvars optik düzlüğüne beş damla beveler kaide yağı veya gerektiği kadar damlatın ve monte edilmiş plakayı üstüne yerleştirin. Bu yağ tüm gün dayanabilir, ancak plaka sarsılırsa veya gerektiği zaman dönmezse, kuvars optik dairenin yeniden yağlanması gerekebilir.
- Yağı yaymak için plakayı birkaç kez manuel olarak döndürün ve ardından cihaz açılabilir.
- Empedans ölçeri kurmak için referans tel olan fitilin üzerine tuzlu su (%0.9 NaCl) ekleyin ve fitili eğim verme plakasına yerleştirin. Mikropipet ile bir devre yapmak için şeridi ıslatın ve plakayı ince bir tabaka tuzlu su çözeltisi ile kaplayın.
- Kurşun segmentini empedans ölçere bağlı telin ucuna takın.
- Empedans ölçerdeki "açma" düğmesini çevirin ve eğim vermeye başlamaya hazır olana kadar "beklemede" bırakın. Büyük bir açıklık yarattığımız için, eğim vermeye hazır olduğunuzda elektrot empedans ölçeri x0.1'e ayarlayın.
- Çekilen mikropipetlere eğim vermek için, elektrot empedans ölçer ve 40x stereo mikroskop içeren bir mikropipet düzenleyici kullanın.
- Mikropipetin yüklenmesi ve eğim verilmesi
- Mikropipeti manipülatör üzerinde bulunan pipet kelepçesine yükleyin ve eğim verirken yerinde tutmak için düğmeyi sıkın.
- Mikropipetin arka ucundan tüm pipeti tuzlu suyla doldurun ve mikropipette hava kabarcığı olmadığından emin olarak ucu mikropipete yerleştirin. Mikropipette hava kabarcıklarının bulunmasının ölçümlerde değişkenliğe neden olduğu fark edilmiştir.
- "Bekleme"den "x0.1"e geçerek empedans ölçeri açın. Direnç başlangıçta 100 MΩ olmalı ve mikropipet ucu tuzlu suya temas ettiğinde farklı bir okuma göstermelidir.
- Doğru uç açıklığı boyutunu eğimlendirmek için, mikropipeti indirmeden önce, tutarlı bir eğim elde etmek için manipülatördeki açıyı 35°'ye ayarlayın. 30°'lik bir açı da yeterlidir, ancak ikisi arasında 35° daha düşük bir standart sapmaya sahiptir, bu nedenle eğim vermede daha tutarlıdır ve uç daha az kırılır.
- Manipülatörü kullanarak, mikropipet ucunu öğütme plakasının dönme merkezinden yaklaşık üçte iki oranında konumlandırın.
- Kaba ayar düğmesini kullanarak, mikropipet ucu tuzlu su çözeltisine yaklaşacak şekilde mikropipeti plakaya yakın indirin. Kamera yoksa, ucun eğimini görmek için mikroskoba bakmak önemlidir.
- Mikropipet ucu tuzlu su ile temas ettiğinde, empedans ölçer okuması 100 MΩ'dan 80 ila 20 MΩ aralığında bir değere düşmelidir. Bu değer, çekilen cam açıklığı nedeniyle değişecektir.
- Bu noktada, plakadaki ucun kırılmasını önlemek için pipeti daha yavaş indirmek için kaba ayar düğmesinden ince ayar düğmesine geçin. Bu eğim verme aşamasında empedans ölçeri ve ucu aynı anda izlemek önemlidir.
- Eğim verirken, uç boyutunun değiştiğini gözlemleyin ve eğim verirken iyi bir bakış açısı oluşturmaya yardımcı olması için aydınlatmayı kullanın.
NOT: Eğim oluştukça uç son derece parlak hale gelecek ve uç açıklığı büyüyecektir. Bu aşamada mikropipeti indirmek veya yükseltmek için manipülatör üzerindeki ince ayar düğmesinin kullanılması zorunludur. Mikropipet plakadan kaldırıldıktan sonra, tekrar plakaya geri getirmek ucun kırılmasına neden olabilir. - Ucu eğim verme plakasına ulaşana kadar yavaşça indirmeye devam edin ve yaklaşık 20 MΩ'luk bir dirence ulaşılana kadar yavaşça eğim verin. Bu sürecin ustalığı, güçlü bir öğrenme eğrisi olacaktır ve ucu tutarlı bir şekilde eğmek için pratik gerektirecektir.
- 20 MΩ'luk bir dirence ulaşıldığında, mikropipeti beveler'den kaldırın.
- Kurşunu mikropipetten çıkarın ve mikropipeti beveler'dan boşaltın. Beveler üzerinde bırakılırsa, mikropipet kırılabilir veya ucunda daha büyük bir açıklık oluşturabilir; Bu nedenle, eğim verirken metreyi ve ucu izlemek önemlidir.
NOT: Protokol buradan duraklatılabilir. - Eğimli mikropipeti mikropipet tutucusuna yerleştirin ve uç açıklığı boyutunu ölçmek için mikroskop yazılımındaki 10x objektifi kullanın. Tüm eğimli uçlarda tutarlılığı kontrol etmek için 10 uçluk bir numune boyutu yeterlidir.
- Fotoğraf çekmeden önce mikroskop ayarının (10x) kamera ayarlarıyla eşleştiğini onaylayın. Uç açma ölçümlerinden sonra aykırı değerler dışarı atılabilir.
- Beveler'ı kapatmak için, hem tahrik kayışı motorunda hem de empedans ölçerde anahtarı "kapalı" konuma getirin.
- Üst tutma halkasını çıkarmak için kaide/taşlama plakasını sökün. Kaide/taşlama plakasını birbirine bağlıyken kaldırmayın çünkü oluşan vakum nedeniyle kırılabilir.
- Ataşmanın üst tespit halkasını vidalarla kaldırdıktan sonra, ince taşlama plakasını kaydırarak çıkarın ve çıkarmak için son manyetik ataşmanı kaldırın. Kuvars optik düzlük üzerindeki fazla yağı laboratuvar mendilleriyle temizleyin.
- Tuz kristali oluşumunu önlemek için üç bileşeni de deiyonize (DI) suyla temizleyin ve kurulayın. Uzun süreli kullanımdan sonra, dönen manyetik tabanda sarsıntı yaşanabilir. Böyle bir durumda, kristalleşmiş tuzu çıkarmak için tahrik kayışına az miktarda DI suyu püskürtün.
- Taşlama plakasının arkasındaki ve kuvars optik düzlükteki fazla yağı silin.
- Kristalleşmeyi önlemek için cihaz üzerinde olabilecek fazla tuzlu suyu çıkarmak için beveler platformunda DI suyu kullanın.
- Eğimli uçları yıkamak için DI su kullanın. Uçlar yıkanmazsa kristalleşirler ancak daha sonra DI su ile kolayca yıkanabilirler.
- Kili bir tabağın içine koyun ve mikropipetlerin kirlenmesini önlemek için kapak camını kullanın.
- Mikropipetleri tutmak için kilde girintiler yapın. Kullanıma hazır olduğunda, eğimli uçlar artık ilgilenilen bir bileşik ile geri doldurulmaya ve solucanın damar sistemine enjekte edilmeye hazırdır. Bu protokol örneği için, kontrast maddeler, mikro kabarcıklar, ilgilenilen bileşik olarak kullanılmıştır.
NOT: Protokol buradan duraklatılabilir.
2. Eğimli uçlu mikroenjektör kalibrasyonu
- Hidrofobik kaplı bir plaka hazırlayın.
- Bir gün önce, gece boyunca kürlenmek için yüzeyde iki plakayı hidrofobik kaplama ile kaplayın. Bu kimyasal, mağazadan satın alınan malzemelerden veya varsa kurum içi laboratuvar malzemelerinden olmalıdır ve kürlenmesi için en az 12 saat gereklidir.
- Kaplama, iki aşamalı hızlı bir işlemdir. Baz Kat ile püskürtün ve ardından Üst Kat ile püskürtün.
- Bir kapüşonda veya açık bir alanda, karıştırma topları bir dakika boyunca tıkırdadıktan sonra Taban Kat kutusunu kuvvetlice salladıktan sonra Taban Kaplamayı plakaya püskürtün.
- Plakayı kaplarken geçişler yaparak plakayı yüzeyden yaklaşık 6-12 inç uzağa Taban Kat ile püskürtün. Geçişler, sağdan sola ve ardından yukarı ve aşağı hafif geçişlerden oluşur. Plaka kaplanırken sallamaya devam edin ve ürün performansını düşüreceği için aşırı püskürtmemeye dikkat edin.
- Baz Katın başka bir kaplamasını uygulamadan önce 1-2 dakika bekleyin. Gerekli olmamakla birlikte, istenirse ek kaplama uygulanabilir.
- Baz Katın kuruması için 30 dakika bekleyin.
- Üst kat için 2.1.3 - 2.1.5 arasındaki adımları tekrarlayın.
- Plaka gece boyunca veya en az 12 saat kürlendikten sonra, plaka mineral yağ ile doldurulmaya hazırdır. Plakayı yaklaşık yarısına kadar mineral yağ ile doldurun.
- Mineral yağ içeren plakayı mikroenjektör aşamasına yerleştirin.
- Eğimli uçları mikroenjektöre yükleyin.
- Mikro enjektörü doğrudan bir laboratuvar basınçlı hava jetine bağlayın. Bu sistem için sıkıştırılmış bir nitrojen silindiri ve bir basınç regülatörü kullanılabilir, ancak diğer mikroenjektör sistemlerinin farklı bir arayüz gerektirebileceğini unutmayın.
- Basınçlı havayı açın ve düşük basınçlı hava hattı regülatörünü 70 PSI'ye açın ve mikro enjektörü açın. Sistem 80 PSI'nin üzerini işleyemeyeceği için 80 PSI'yi aşmayın.
- Metal Göbek İğneli 1 mL'lik bir şırınga kullanarak uçları suyla doldurun. Pipetin iç çapı farklıysa, onu yerleştirmek için farklı bir ölçü metal iğneye ihtiyaç duyulacaktır.
- Su ile geri doldurulduktan sonra, mikropipeti joystick mikromanipülatörünün iğne tutucusuna yükleyin. Farklı mikroenjektörler ve mikromanipülatörler kullanılabilir.
- Eğimli mikropipet ile dağıtım hacmini kalibre etmek için su kabarcıkları oluşturun.
NOT: Solucanın damar sistemine herhangi bir bileşik uygulama uygulanmadan önce, uygun hacim enjeksiyonunu belirlemek için mikroenjektör kalibre edilmelidir.- Mikroenjektör üzerindeki parametreleri 4 PSI'da basınç ve 0,5 saniyede zaman için ayarlayın. Bu parametrelerin aşılması, araştırmacının amacı damar genişlemesini incelemek olmadıkça, geminin boyutunu bozacaktır ki bu elverişsizdir.
- Pipet ucunu plakanın altına yakın olana kadar indirin, ancak ucu plakanın altından kırmamaya dikkat edin. Mineral yağın ucu ne kadar düşükse, uçta o kadar viskoz olur ve bu da kırılmaya neden olabilir.
- Kalibrasyon sırasında plakayı tam olarak kullanmak için plakanın bir kenarından başlayın.
- Bu yerine oturduğunda, yağda bir su kabarcığı dağıtmak için pedala basın.
- Kabarcık uca yapışmış kalabilir. Bunu düzeltmek için, pipet ucundan ayırmak için plakayı baloncuğun tersi yönde hızla çekin.
- Kamera yazılımını kullanarak baloncuk boyutunu ölçün ve hacmi hesaplayın. Herhangi bir kamera yazılımı mevcut değilse, alternatif yazılım kullanılabilir.
- Mikropipetin solucan damar sistemine dağıtacağı doğru hacmi belirlemek için 10 baloncuk oluşturun ve ortalama kabarcık çapını ölçün.
NOT: Araştırmacı çeşitli hacimleri dağıtmakla ilgileniyorsa, basınç ve zaman parametreleri manipüle edilebilir; 2.3.1 - 2.3.7 arasındaki adımları tekrarlayın.
3. İlgilenilen belirli solucan damar sistemini ortaya çıkarmak için solucan cerrahisi hazırlığı
- Solucan hazırlama ve ölçümleri
- Ameliyattan önce solucanları uyuşturacak %10 etanol solüsyonu hazırlayın.
- Solucanları deneyler arasında toprakla birlikte 100 mL'lik bir beherde tutun.
- Buzdolabından tezgah üstü 4 °C ila 25 °C arasındaki ani değişiklikler nedeniyle solucanların kurumasını önlemek için beherde bir seferde yalnızca 5 - 10 solucan bulundurun.
- Solucanları 30 dakika boyunca% 10 etanole koyun. Solucan 30 dakika sonra hala hareket ediyorsa, 5 dakika daha etanol çözeltisinde bırakın.
NOT: Bazen solucanın büyüklüğü nedeniyle daha fazla zamana ihtiyacı vardır; Bu nedenle, etanoldeki sürenin solucan boyutuna göre ayarlanması gerekebilir, ancak bir saati aşmamalıdır. Bir saatten fazla bir süre solucana zarar verir. - Ürettiği balçık ve etanolü çıkarmak için solucanı musluk suyunun altında durulayın.
- Fazla suyu çıkarmak için solucanı bir kağıt havlu üzerine koyun.
- Solucan uyuşturulduktan sonra, her solucanın ağırlığını (g), genişliğini (mm), uzunluğunu (mm) ve damar genişliğini (μm) kaydedin. Herhangi bir kesi yapılmadan önce ve solucanı germeden solucanın ağırlığını ve boyutlarını alın.
- Damar mikroskop altında cerrahi olarak maruz kaldıktan sonra, damarın genişliğini ölçmek için kamera yazılımını kullanın. Herhangi bir kamera yazılımı mevcut değilse, dijital bir yazılım ölçümü kadar doğru olmasa da, paslanmaz bir mikro cetvel yeterli olacaktır.
NOT: İlgilendiğiniz gemiye bağlı olarak, Adım 3.2 (ventral damar), 3.3 (sırt damarı), 3.4 (kalplerin üstten görünümü) veya 3.5'e (kalplerin yandan görünümü) atlayın.
- Solucan damar sisteminin, ventral damarın açığa çıkarılması (yöntem 1)
- Cerrahi prosedür sırasında solucanı sabitlemek için bir lastik ped kullanın, böylece ilgilenilen gemiyi araştırmacıya maruz bırakın. Cildin koyu renkli kısmı aşağı bakmalıdır.
- Solucanı cerrahi olarak açmak için, solucanın daha koyu kısmı olan sırt tarafına yerleştirin, burada bir bıçakla yaklaşık 1 mm'lik cilt üzerinde küçük bir yan kesi yapılır. Bu küçük kesi, uzun bir kesi oluşturmak için cerrahi makasın girmesine izin verir.
- Solucan derisini 33 mm aralıklarla sabitleyin, kabı ortaya çıkarmak için 27 mm'lik bir açıklık açın, kabı düzgün bir şekilde ortaya çıkarmak için yalnızca dört pim kullanın. Solucan sabitlendikten sonra, solucanın derisini manipüle etmeye yardımcı olmak için pimler eklenebilir veya taşınabilir.
- Cerrahi makasla vücudunun yan tarafındaki diğer pime ulaşmak için bir kesi yapın. Cilde doğru iterek, solucanın iç kısmına, damar sistemini veya bağırsağı kesmek gibi herhangi bir hasarı önler.
- Kesi yapıldıktan sonra, ilk kesiğin yapıldığı yeri ve ardından kesimin sonunda sabitleyin veya yeniden sabitleyin.
- Her iki cerrahi aleti de (cerrahi tutamaklar) kullanarak, solucanın içini ortaya çıkarmak için cildi hareket ettirin.
- Cilt hareket ettirilirken alttaki cildi aşağı doğru sabitleyin ve solucanı yukarı doğru hareket ettirirken cildi organlardan dikkatlice ayırmaya devam edin. En üste geldikten sonra, son pimi yerleştirin.
- Damar açıkta değilse, ventral damarı açığa çıkarmak ve cildi daha da ayırmak için solucanın elastik dokusunu ayırmak için solucan derisinin zıt taraflarını çekin.
NOT: Bu römorkör, solucanın içindeki organları tutan dokunun bir kısmını çıkaracaktır. Bu adıma dikkat edin, çünkü istemeden solucanın damarlarını yırtabilir. Ventral damar şimdi açığa çıkarılmalıdır ve sinir kordonu, damarın bir belirteci olarak işlev görebilir, çünkü sinir kordonu, ventral damarın hemen yanında ve ona paralel olarak cilt boyunca uzanır. Ventral damar bağırsağa yakınsa, cilt üzerindeki bir çekiş damarı daha da açığa çıkarabilir. Değilse, bağırsağı yana doğru itin, ancak bu dağınık bir çalışma alanına neden olabilir.
- Solucan damar sisteminin, dorsal damarın açığa çıkarılması (yöntem 2)
NOT: Dorsal damarı açığa çıkarma adımları, ventral damar maruziyetine benzer.- Adım 3.2'deki 3.2.1 - 3.2.3 adımlarını tekrarlayın. Bu adımlar için cildin koyu renkli kısmı yukarı bakmalıdır.
- Solucanın ortasına doğru karşı tarafa doğru kesmek için cerrahi makas kullanın.
- Solucanın ortasından, solucanın ön kısmına, kafasına doğru bir kesi yapın. Cilde doğru yukarı doğru itmek, solucanın iç kısmında, damarı veya bağırsağı kesmek gibi herhangi bir hasarı önler.
- Çapraz kesim yapıldıktan sonra, ilk kesi bölgesini ve ardından yapılan kesimin sonunda iğneleyin veya yeniden sabitleyin.
- Adım 3.2'deki 3.2.6 - 3.2.9 adımlarını tekrarlayın.
NOT: Sırt damarı şimdi açıkta kalmalıdır.
- Solucan damar sisteminin açığa çıkarılması, kalplerin üstten görünümü (yöntem 3)
- Cerrahi prosedür sırasında solucanı sabitlemek için bir lastik ped kullanın, böylece ilgilenilen gemiyi araştırmacıya maruz bırakın.
- Solucanı cerrahi olarak ortaya çıkarmak için, solucanın hafif kısmı olan ventral tarafına yerleştirin. Cildin koyu renkli kısmı yukarı bakmalıdır.
- Solucanın derisini tutmak ve ilgilenilen kalpleri ortaya çıkarmak için bir pencere oluşturmak için dört pim kullanın. Solucanı başının ucuna, ön ucuna yakın tutmak için toplam beş kişilik ek bir pim kullanılabilir.
- Solucanı aşağıdan yukarıya doğru sabitlemeye başlayın, sağ taraftan başlayın ve sonra sol tarafa doğru hareket edin. Solucanı, başın ucuna, ön ucuna ve klitellumun yanına iki pim yerleştirerek sabitleyin.
- Solucanın yan tarafında yaklaşık 1 mm'lik küçük bir kesi yapmak için bir bıçak kullanın.
- Solucanın ortasına doğru karşı tarafa doğru kesmek için cerrahi bir makas kullanın.
- Solucanın ortasından, solucanın ön ucu olan solucanın ağzına ulaşana kadar solucanın önüne doğru bir kesim yapın.
NOT: Damar sisteminin kesilmesini önlemek için makasın cilde karşı kaldırılması önemlidir; Makas bıçağı, deriden geçerken görülebilir. Kesiğin solucanın ön ucuna yapıldığından emin olun, çünkü bu kalplerin daha iyi görünmesini sağlayacaktır. - Sabitlendikten sonra, cilt solucanın içine kıvrılıyorsa, solucanı yeniden sabitleyin.
- Kalpleri düzgün bir şekilde ortaya çıkarmak için solucanın dokusunu düzgün bir şekilde ayırmak için bir römorkör yapın.
- Kalpler açıkta kalmazsa, beyaz seminal vezikülleri hareket ettirin, çünkü kalpler bazen bu veziküllerin altına saklanır.
NOT: Kalp maruziyeti solucandan solucana değişebilir, 10 kalbin tümü görünür olabilir veya sadece yarısı vb. Bu noktada araştırmacı, solucanın kalbini bulmak için organları ve dokuları hareket ettirip ettirmeyeceğini belirlemelidir.
- Solucan damar sisteminin açığa çıkarılması, kalplerin yandan görünümü (yöntem 4)
- Cerrahi prosedür sırasında solucanı sabitlemek için bir lastik ped kullanın, böylece ilgilenilen gemiyi araştırmacıya maruz bırakın.
- Solucanı cerrahi olarak ortaya çıkarmak için, yan tarafına yerleştirin. Solucan kendi tarafında olduğu için, solucanın hem aydınlık hem de karanlık tarafı görünür olmalıdır.
- Adım 3.4'teki 3.4.3 - 3.4.9 adımlarını tekrarlayın.
- Kalpler açıkta kalmazsa, beyaz seminal vezikülleri hareket ettirin, çünkü kalpler bazen bu veziküllerin altına saklanır.
NOT: Kalp maruziyeti solucandan solucana değişebilir, beş kalbin tümü görünür veya daha az olabilir. Bu noktada araştırmacı, solucanın kalbini bulmak için organları ve dokuları hareket ettirip ettirmeyeceğini belirlemelidir.
4. Solucan Damar Sistemine Bileşik Uygulama
- Solucanın bileşik uygulama için hazırlanması
NOT: Bu özel adımlar için, ilgilenilen bileşik olarak solucan damar sistemine kontrast maddeler, mikro kabarcıklar enjekte ettik.- Mikroenjeksiyondan önce, solucanı mikroenjeksiyon aşamasına yerleştirin ve ilgilenilen damarın etrafındaki sıvıları çıkarmak için bir laboratuvar mendili kullanın, böylece damar sistemini enjeksiyon için açığa çıkarın.
NOT: Damarın kanamasına neden olacağı için güçlü bir basınç uygulamayın. - Ventral damarın enjeksiyon için hizalanması önemli olduğundan, ilgilenilen damar sistemini mikropipetle hizalayın. Kalpler ilgi çekiyorsa, mikropipete dik olmalıdır.
- Mikroskobu ilgilenilen damar sistemine odaklayın ve mikropipeti damar sistemine indirmeye başlayın. Joystick manipülatörlerinden herhangi birini hareket ettirmeden önce, en iyi hareketliliği sağlamak için hepsinin 0 mm'ye ayarlandığını onaylayın.
- Mikropipetin ucu solucan kabı ile temas ettiğinde, kap ile mikropipet arasındaki açının 15°'den az olduğundan emin olun.
- Mikropipet damar üzerine baskı uygulamaya başladığında, damar sistemi üzerindeki baskı nedeniyle kan uçtan uzaklaşacaktır. Bu, uygun enjeksiyon yerleşiminin iyi bir göstergesidir.
- Başarılı bir enjeksiyonu sağlamak için, damar sistemi ile temas etmek üzere mikropipeti ileri doğru hareket ettirmek için joystick'i kullanın.
NOT: Damarı delmemek önemlidir. Ucun, dorsal ve ventral damar için damar sistemini mikropipetin hareket ettiği yönde hareket ettirmesi gerektiğine dikkat edin ve ardından damara tam penetrasyon sağlamak için mikropipet ucunu ileri doğru hareket ettirmek için kaba kadran kullanılmalıdır. Plaka hareketliyse, bu, mikrodenetleyicileri veya hepsini aynı anda kullanmak yerine, kabı mikropipete taşımak ve delmek için kullanılabilir. Damar hemen delinmeyecektir, ancak kabın geri tepmesi, mikropipetin uygun şekilde nüfuz ettiğinin bir göstergesidir. Uç damara girdikten sonra, damar düz olmalı ve mikropipet ile hizalanmalıdır. Değilse, ince kontrolü kullanarak mikropipeti yavaşça geri çekin. - Solucanın damar sistemini enjekte etmek için pedala basın. Kanın seyreltilmesi, pedala basıldığında uygun penetrasyonun bir başka göstergesidir.
- Mikropipeti yavaşça geri çekin ve mikropipeti çekip çıkarın.
NOT: Alternatif olarak, mikropipet hala damar içindeyken ucu kırmak, kan kaybını önlemek için etkili bir yöntemdir.
- Mikroenjeksiyondan önce, solucanı mikroenjeksiyon aşamasına yerleştirin ve ilgilenilen damarın etrafındaki sıvıları çıkarmak için bir laboratuvar mendili kullanın, böylece damar sistemini enjeksiyon için açığa çıkarın.
Sonuçlar
Aşağıdaki temsili sonuçlar, cam pipeti çekmek için kullanılan ayarları, belirli bir eğim açısından oluşturulan pipet açıklığı boyutunu ve mikroenjeksiyonların basıncını ve süresini içeren bir dizi özel parametreye dayanmaktadır. Şekil 1'de, süreci baştan sona temsil eden bir akış şeması görüntülenir.
Seçilen pipet çektirme parametrelerine bağlı olarak, çekme işleminden aşağıdaki uç çıkacaktır (Şekil 2). RAMP değerinin camın türüne ve hatta filamentin yerleşimine bağlı olarak değişebileceği belirtilmektedir. Parametreler kabul edilebilirse, ortaya çıkan uç, eğim vermek için uzun bir konik ile güçlü olacaktır. Uç çekme nedeniyle kırılırsa, çektirme yeniden ayarlanmalıdır.
Mikropipete eğim vermek için, optimum açıyı belirlemek, genel eğim verme kolaylığını değerlendirmek ve açının uç açıklığı boyutunu nasıl etkilediğini incelemek için altı eğim açısı test edildi. Eğim verme kriterlerimiz için en uygun açı, keskin bir uç sağlaması, damara kırılmadan nüfuz edebilecek kadar güçlü olması ve yüksek oranda tekrarlanabilir olması nedeniyle 35° olarak belirlenmiştir. Genel olarak, açı ne kadar küçük olursa, Şekil 3'te gösterildiği gibi uç o kadar keskin olur. Başka bir ilgi açısı, daha keskin olan 30 ° idi, ancak tekrarlanabilirliği nedeniyle 35 ° seçildi. Şekil 4'te gösterildiği gibi, mikromanipülatörün açısı, ucun hem şeklini hem de açıklık boyutunu değiştirir. Bu şekilde, en doğru ve tutarlı eğimin 30° ile 40° arasındaki bir açıyla gerçekleştiği gösterilmiştir. Eğim verme kolaylığına dayalı olarak ek bir tablo (Tablo S1) oluşturulmuştur, ancak kişiden kişiye eğim verme tekniklerinin değiştiğini ve dolayısıyla uçların değiştiğini belirtmek önemlidir. Ayrıca, mikromanipülatör çok hızlı bir şekilde indirildiğinde veya cam çok kırılgan hale geldiğinde başarısız eğimlerin meydana gelebileceği ve bunun da uç kırılmasına yol açabileceği belirtilmektedir.
Belirli bir uç boyutu için, bileşik enjeksiyonlardan önce bir kalibrasyon yapılmalıdır. Enjeksiyon hacmi, uç boyutunun yanı sıra mikroenjeksiyon basıncına ve enjeksiyon süresine bağlıdır. Örneğin, Şekil 5'te, 24,4 μm'lik uçlar için temsili hacim dağıtımları grafiklendirilmiştir. Veriler, dağıtılan hacim ile sabit enjeksiyon süreleri için basınç arasında yaklaşık olarak doğrusal bir ilişki olduğunu ortaya koymaktadır. Belirli uç tasarımları için benzer özel kalibrasyon verileri belirlenmelidir.
Mikrovasküler enjeksiyon sırasında, belirli bir ürünün başarılı bir şekilde enjekte edildiğini doğrulamak için görsel inceleme gereklidir. En iyi görünen belirteç kanın seyreltilmesidir. Ek Video ve Şekil 6'da gösterildiği gibi, kan seyreltildikçe daha berrak hale gelir ve bu, başarılı bir enjeksiyonun işaretidir. Mikropipetin damara çok derinden nüfuz etmemesi ve mikroenjeksiyonun damardan 15°'den daha büyük bir açıyla yapılmaması çok önemlidir, aksi takdirde pipet dışarı çekildiğinde, ilgilenilen bileşik büyük yaralar nedeniyle damar sisteminden dışarı akacaktır. Başarılı bir enjeksiyon ve çekme, çıkarıldıktan sonra minimum kanamaya neden olacaktır.
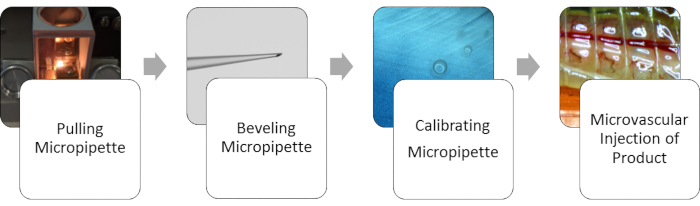
Şekil 1: Genel yöntemin akışı. Solucan damar sisteminin mikroenjeksiyonu için, uçta mikro bir açıklık elde etmek için önce pipetin çekilmesi gerekir. Daha sonra keskin bir iğne ucu elde etmek için mikropipet ucu eğimlidir. Açıklık sağlandıktan sonra, mikropipet dağıtılan uygun hacim için kalibre edilir. Kalibre edildikten sonra, damar sistemine enjeksiyonlar gerçekleştirilebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Başarılı bir şekilde çekilen mikropipet. Protokolde kullanılan parametrelere bağlı olarak, bu uç çekildikten sonra ortaya çıkacaktır. (A) Pipeti çekildikten hemen sonra gösterir. (B) Çekilen aynı pipetin yakın görüntüsü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Mikropipet Ucu Eğim Açısı Profilleri. Eğim verme için altı açı test edildi. Açı 45°'den 20°'ye düşürüldüğünde keskinlik ve uç açıklığı artar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
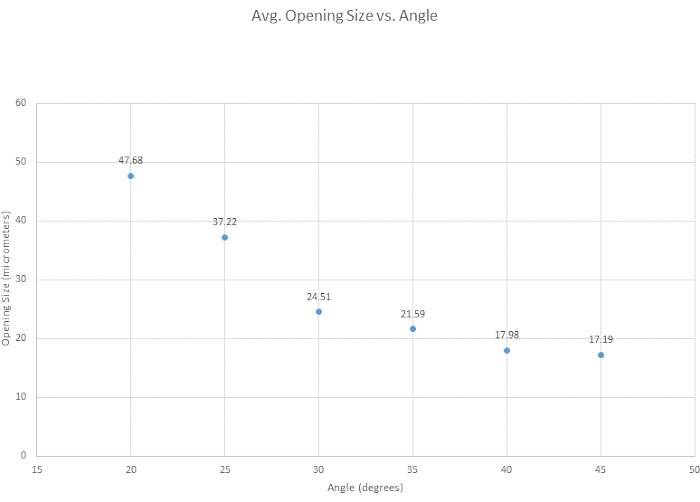
Şekil 4: Uç açıklığı artan açıyla daralır. Açının uç açıklığı boyutunu nasıl etkilediğini görmek için altı açı test edildi. Eğim açısı arttıkça uç açılma boyutu küçülür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Hacim Yönetimi için Kalibrasyon. Temsili sonuçları için 24,4 μm'lik bir uç boyutu açıklığı, zaman ve basınç için belirli parametreleri kullanarak verileri temsil etmek için kullanıldı. Artan basınçla, dağıtılan hacim artar ve azalan süre ile dağıtılan hacim azalır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Ventral Damar İçine Enjeksiyon. Başarılı bir enjeksiyon için bir görsel, bir gösterge olarak kanın seyreltilmesi ile gösterilir. Bu panele ek bir video eşlik eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil S1: Earthworm'un kan ve idrar ekstraksiyonu için kurulum. Bu dosyayı indirmek için lütfen buraya tıklayın.
Şekil S2: Şekil 4'ten standart sapmalar. Açıya bağlı olarak standart sapma değişir. 35° daha düşük bir standart sapmaya sahiptir, bu nedenle eğim vermede daha tutarlıdır ve uç daha az kırılır. Tablo S1'de gösterildiği gibi 35 ° ile 30 ° de iyiydi. Bu dosyayı indirmek için lütfen buraya tıklayın.
Şekil S3: Ameliyattan sonra solucanın hayatta kalmasını ve solucanı kapatmak için sıvı yara bandı kullanımını göstermektedir. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tablo S1: Eğim Verme Kolaylığı için açıklayıcı tablo. Eğim verme kolaylığını tanımlamak için kolaydan orta ve zora kadar değişen üç mod kullanıldı. 15°'nin test edildiği, ancak çip oluşturmayan bir mikropipet ucu üretmek için çok küçük bir açı olduğu belirtildi. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Solucan% 10 etanol içindeyken, özellikle solucan daha yaşlı ise, 30 dakikadan daha uzun maruz kalma süreleri için istenmeyen etkiler olabilir; Bağırsaklar bozulmaya başlar ve solucan cerrahi olarak açıldığında iç bağırsakları yayılır. Bu nedenle, genç ila orta yaşlı solucanların kullanılması teşvik edilir. Solucanın derisini kesme işlemi sırasında, tam bir makas kesiminin yapılmaması zorunludur, yani araştırmacı sadece yarıya kadar kesmeli ve son noktaya ulaşana kadar makası ileri itmeye devam etmelidir. Solucanı sabitlerken, solucanı germemeye veya çok sert çekmemeye dikkat edin. Bu, damarın yırtılmasına neden olabilir ve bu da kanamaya neden olur. Her enjeksiyondan sonra, özellikle başka bir enjeksiyon yapmadan önce uçtaki kanı çıkarmak için mikropipetin içinde olabilecek herhangi bir sıvıyı dağıtarak mikropipetin tıkalı olup olmadığını kontrol edin. Uçta tıkanma olup olmadığını gözlemlemenin yanı sıra, her enjeksiyondan sonra uç kırılmasını kontrol etmek için mikropipetin ucuna bakın. Mikropipetin ucu da kırılabilir ve herhangi bir kan kaybını önlemek için ucu yerinde bırakabilir. Mikroenjeksiyonlar sırasında damar dokusunun dikkatli bir şekilde gözlemlenmesi önemlidir. Mikropipet damar ile ilk temas ettiğinde, damar dokusu mikropipet ucuna yapışacaktır. Uç damara başarılı bir şekilde nüfuz ettikten sonra, damar dokusunun hızla uca doğru kaydığı görülebilir ve mikromanipülatörde de hissedilir. Başarılı bir enjeksiyondan sonra, mikropipet dokunun daha derinlerine inebileceğinden veya enjeksiyon bölgesinde daha büyük bir yara oluşturabileceğinden, mikropipeti dikkatli bir şekilde dışarı çekmek önemlidir ve bu, bileşik uygulamasının damardan dışarı sızmasına neden olabilir. Tipik olarak, damar çapı 90 μm veya daha büyük olduğunda başarılı enjeksiyonlar meydana geldi, ancak bu, araştırmacılar tarafından mikropipet ucu boyutlarının daraltılmasıyla iyileştirilebilir. Solucanın susuz kalmasını önlemek için solucan sürekli olarak su ile nemli tutulur, ancak tuzlu su çözeltisi önerilir.
Solucan Hayatta Kalma Çalışmaları
Solucanların deneyden sonra ne kadar süre hayatta kalabileceklerine dair fikir vermek için solucan hayatta kalma deneyleri yapıldı. Solucanlar% 10'luk bir etanol çözeltisine daldırıldıktan ve daha sonra deneyler sırasında olduğu gibi cerrahi olarak kesilip enjekte edildikten sonra, 27 solucan sıvı yara bandı çözeltisi ile "geri dikildi" ve deneyden 48 saat sonra gözlemlendi. Operasyondan 12 saat sonra, solucanların yaklaşık% 67'si hala hayattaydı. Ameliyattan 24 saat sonra, solucanların yaklaşık% 48'i hala hayattaydı. Ameliyattan 36 saat sonra, solucanların yaklaşık% 44'ü hala hayattaydı. Son olarak, ameliyattan 48 saat sonra, solucanların yaklaşık %22'si hala hayattaydı. Bu deneylerden elde edilen sonuçlar, solucanların çoğunluğunun deneysel cerrahi ve enjeksiyon geçirdikten sonra 12 saatlik bir gün boyunca hayatta kalabileceğini ve çok sayıda solucanın bundan daha uzun süre hayatta kalabileceğini göstermektedir (Şekil S3). Bu, istenirse her solucanın 24 saatlik çalışmalar için izlenmesi için bir fırsat sunar.
Solucan Laboratuvar Bakımı
Kanadalı gece sürüngenleri olan solucanlar, Windsor Toptan Yem'den mağazadan satın alındı ve bir Strafor kutuda (35w x 38l x 30d cm) 500 büyük solucan olarak teslim edildi ve tek tek solucanlar çıkarılıp deneyler için kullanıldığında buzdolabında saklandı. Solucan hazırlama protokolü adımlarında belirtildiği gibi, solucanın buharlaşması nedeniyle aynı anda 10'dan fazla solucan kullanılmamıştır, bu da dehidrasyonayol açabilir 16. Ek olarak, solucanların ışığa maruz kalması sınırlıydı, çünkü derilerinde ışığa duyarlı hücreler içeriyorlardı; İki saatten uzun süre ışığa maruz kalmak ölüme neden olabilir. Varıştan hemen sonra, nakliye konteynırı toprağı değiştirildi ve solucanların deneyler için kullanılmadan önce 24 saatlik bir bekleme süresi boyunca dinlenmelerine izin verildi. Bu, solucanların yeniden enerjilendirilmesini ve nakliye nedeniyle artık yorulmamasını sağladı. Bu noktada, solucan üzerinde deneyler başlayabilir.
Solucanların bilinmeyen bir ömrü vardır, ancak her gün izlendiklerinde ve doğru besinler verildiğinde laboratuvar ortamında uzun süre canlı tutulabilirler. Her iki haftada bir, solucan için daha fazla besin sağlamak için kabın içine yeni toprak eklenmelidir. Solucan, derin oyuk açan bir omurgasızdır, anekiktir ve 180 cm (6 ft) derinliğe kadar yuvalar inşa eder, bu nedenle 500 solucan için kapta en az 1 fit toprak olmalıdır. Kabın dibine eski bir gazete eklenebilir, çünkü burası bazı solucanların evlerini yaratacağı yerdir. Toprak değiştirildikten sonra, yaralı veya ölü solucanların kokusunu kontrol etmeniz ve tespit etmeniz önerilir. Ölü veya yaralı solucanları kapta bırakmayın, çünkü bunlar toprağı kirletecek ve solucan koloninizde daha fazla ölüm yaratacaktır.
Gelecek Uygulamalar
Bu protokolde, solucan kullanılarak yüksek verimli kan deneyleri yapmak için hazırlık ve prosedür sunulmaktadır. Dolaşım sistemi ile sınırlı olsa da, burada açıklanan enjeksiyon yöntemleri, solucanın sinir kordonu ventral damara paralel olduğu için potansiyel olarak sinir sistemini içeren çalışmalara genişletilebilir. Örneğin, solucanı kullanan önceki araştırmalar, terapötik ultrason uygulamalarından nöromodülasyon ve damar yırtılması çalışmaları için incelenmiştir18,19. Bu yeni kurulumla, nöromodülasyon ve damar yırtılması araştırmalarını genişletmek için daha derinlemesine ultrason + mikro kabarcık çalışmaları yapılabilir.
Ek olarak, solucandaki sölomik boşluk, bağışıklık sistemini incelemek için kullanılabilir, çünkü sölomik boşlukta bulunan sıvı, hepsi olmasa da çoğu bağışıklık tepkisine aracılık eder. Solucan, hayvanda her biri ayrı boşluklarda bulunan sadece iki sıvının bulunması, damarlardaki kan ve sölomik boşluktaki sölomik sıvının bulunması bakımından benzersizdir. Sıvıların bu şekilde ayrılması, iki boşlukta belirli araştırma türlerine izin verir. Örneğin, sölomik sıvı, bağışıklık fonksiyonları diğer hayvan modellerinin çoğunun sölositleri ile aynı özellikleri paylaşan çok sayıda sölomosit ile doludur. Hücre hedeflerini yok edebilecek fagositlerin ve diğer benzer hücrelerin araştırmaları solucanda yapılabilir ve solucan muhtemelen alternatif bir omurgasız modeli olarak kullanılabilecek birçok ek araştırma uygulamasına sahiptir.
Solucan, insan anatomik ve fizyolojik sisteminin birçok yönünü modellemek için karmaşıklıktan yoksun olsa da, mikroenjeksiyon, hemoglobin yapısı açısından insan kanına çarpıcı şekilde benzeyen kan içeren kapalı bir dolaşım sistemi sunar. Küçük kan hacimlerinin kabul edilebilir olduğu uygulamalarda, solucan, Kurumsal Hayvan Bakımı ve Kullanımı Komitelerinden muaf, düşük maliyetli, hazır bir test platformu sunar. Sonuç olarak, çeşitli bileşiklerle solucanlar üzerinde yapılan testler, tekrar tekrar ve standart laboratuvar omurgalı hayvanları kullanılarak pratik olanın çok ötesinde olabilecek numune boyutlarında yapılabilir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu çalışma, NSF-FDA Scholar-in-Residence Bursu (NSF-FDA SIR, #1641221), ABD Gıda ve İlaç İdaresi Ofisi Baş Bilim İnsanı Yarışması Hibesi (FDA OCS), Ulusal Bilim Vakfı Bütünleştirici Lisansüstü Eğitim ve Araştırma Stajı (NSF IGERT, #1144646) tarafından finanse edildi ve ABD Gıda ve İlaç Dairesi'ndeki (FDA) Bilim ve Mühendislik Laboratuvarları Ofisi (OSEL) tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3M Vetbond Tissue Adhesive | 3M Vetbond | 084-1469SB | 3mL bottle vet adhesive - liquid band-aide |
| 40x Stereo Microscope | Sutter Instrument Co. | BV-10-D | Not needed, can add on other scopes |
| 500 Large Worms | Windsor Wholesale Bait | 500 Large | |
| Beveler pedestal oil | Sutter Instrument Co. | 008 | |
| Blades | Ted Pella, Inc | 121-2 | |
| Borosilicate Glass with Filament | Sutter Instrument Co. | BF150-86-10 | |
| Camera | AmScope | MU500 | |
| Camera | AmScope | MU1803-CK | 8MP USB3.0 Microscope Digital Camera |
| Electrode Impedance Meter | Sutter Instrument Co. | BV-10-C | |
| Ethanol | Sigma Aldrich | E7023-1L | Pure ethanol |
| Filament | Sutter Instrument Co. | FT315B | trough filament |
| Grinding Plate | Sutter Instrument Co. | 104D | Fine Plate |
| Hospital Grade Saline | Baxter Healthcare Corporation | 2F7124 | 0.9% Sodium Chloride Irrigation |
| Joystick Micromanipulator | Narishige | MN-151 | |
| KimWipes Kimtech Science | Kimberly-Clark Professional | 34155 | |
| Leafgro | LeafGro | 589252 | 1.5-cu. ft. |
| Metal Hub Needle | Hamilton | 91024 | Luer Lock Metal Needle |
| Micro Vessel Clips | WPI | 501779-G | |
| Microinjector | TriTech Research | MINJ-D | |
| Micropiette Puller Model P-97 | Sutter Instrument Co. | P-97 | |
| Micropipette Beveler | Sutter Instrument Co. | BV-10-B | |
| Microscope | AmScope | SM-8TPW2-144S | 3.5X-225X Simul-Focal Articulating Microcope |
| Needle Holder | TriTech Research | MINJ-4 | |
| NeverWet | Rust-Oleum | NeverWet | |
| Pyrex Glass | Corning | 08747A | Fisher Manufacturer |
| Stainless Micro-Ruler | Ted Pella, Inc | 13635 | Micro-Ruler mounted on a Handle, 10mm scale, with lines at 0.01mm intervals |
| Surgical Grips | Ted Pella, Inc | 53073 | Forceps, Hemostat |
| Surgical scissors | Ted Pella, Inc | 1320 | Fine Iris Scissors, Straight |
| U.S.P. Mineral Oil Lubricant Laxative | Swan | Mineral Oil |
Referanslar
- Stevenson, J. The Oligochaeta. , Claredon Press. Oxford. 685(1930).
- Reynolds, J. W., Reynolds, W. M. Earthworms in medicine. American Journal of Nursing. 72 (7), 1273(1972).
- Gates, G. E. The earthworms of Rangoon. Journal of the Burma Research Society. 25, 196-221 (1926).
- Carr, L. G. K. Interesting animal foods, medicines, and omens of the eastern Indians, with comparisons to ancient European practices. Journal of the Washington Academy of Sciences. 41 (7), 229-235 (1951).
- Price, S. F. Kentucky folk-lore. The Journal of American Folklore. 14 (52), 30-38 (1901).
- Elmer, J., Palmer, A. F., Cabrales, P. Oxygen delivery during extreme anemia with ultra-pure earthworm hemoglobin. Life Sciences. 91 (17-18), 852-859 (2012).
- Eyambe, G. S., Goven, A. J., Fitzpatrick, L. C., Venables, B. J., Cooper, E. L. A non-invasive technique for sequential collection of earthworm (Lumbricus terrestris) leukocytes during subchronic immunotoxicity studies. Laboratory Animals. 25 (1), 61-67 (1991).
- Basley, K., Goulson, D. Effects of chronic exposure to clothianidin on the earthworm Lumbricus terrestris. PeerJ. 5, 3177(2017).
- Mvumi, B. M., Gwenzi, W., Mhandu, M. G. Ecotoxicological effects of citrus processing waste on earthworms. Lumbricus terrestris L. Industrial Crops and Products. 110, 123-129 (2017).
- Furst, A. My saga with earthworms. Food and Chemical Toxicology. 40 (6), 789-791 (2002).
- Cooper, E. L., Hrzenjak, T. M., Grdisa, M. Alternative sources of fibrinolytic, anticoagulative, antimicrobial and anticancer molecules. International Journal of Immunopathology and Pharmacology. 17 (3), 237-244 (2004).
- Cooper, E. L., Hirabayashi, K., Balamurugan, M. Dilong: food for thought and medicine. Journal of Traditional and Complementary Medicine. 2 (4), 242-248 (2012).
- Nagasawa, H., et al. Inhibition by lombricine from earthworm (Lumbricus terrestris) of the growth of spontaneous mammary tumours in SHN mice. Anticancer Research. 11 (3), 1061-1064 (1991).
- Shannon, K. M., Gage, G. J., Jankovic, A., Wilson, W. J., Marzullo, T. C. Portable conduction velocity experiments using earthworms for the college and high school neuroscience teaching laboratory. Advances in Physiology Education. 38 (1), 62-70 (2014).
- National Research Council. A framework for K-12 science education: Practices, crosscutting concepts, and core ideas. , National Academies Press. (2012).
- Ramsay, J. The Osmotic Relations of the Earthworm. Journal of Experimental Biology. 26 (1), 46-56 (1949).
- Mulloney, B. Structure of the Giant Fibers of Earthworms. Science. 168 (3934), 994-996 (1970).
- Kim, Y., Nabili, M., Acharya, P., Lopez, A., Myers, M. R. Microvessel rupture induced by high-intensity therapeutic ultrasound - a study of parameter sensitivity in a simple in vivo model. Journal of Therapeutic Ultrasound. 5 (1), 5(2017).
- Wahab, R. A., et al. Mechanical bioeffects of pulsed high intensity focused ultrasound on a simple neural model. Medical Physics. 39 (1), 4274-4283 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır