Method Article
Ver de terre, Lumbricus terrestris : un nouveau modèle d’invertébré in vivo de système vasculaire par micro-injection
Dans cet article
Résumé
Les vers de terre sont un nouveau modèle de paillasse in vivo pour les études vasculaires. Nous présentons des techniques et des équipements qui permettent une chirurgie efficace et une micro-injection dans le système vasculaire du ver de terre. Les protocoles chirurgicaux, les techniques de micro-injection et la procédure de production de micropipettes sur mesure sont décrits.
Résumé
Bien que les vertébrés soient indispensables à la recherche biomédicale, les études sont souvent limitées par des facteurs tels que le coût, la longueur de l’examen interne et les considérations éthiques. Nous présentons le ver de terre comme un invertébré alternatif, peu coûteux, applicable à certaines études vasculaires préliminaires. En raison de la disponibilité chirurgicale des vaisseaux dorsaux, des vaisseaux ventraux et de cinq paires de pseudo-cœurs du ver de terre, les vers de terre sont facilement accessibles, offrent un entretien peu coûteux et ne nécessitent que l’administration de petites doses d’un composé donné. Le modèle du ver de terre fournit un système circulatoire vasculaire fermé simple avec une structure d’hémoglobine similaire à celle du sang humain. Un protocole est fourni pour l’anesthésie des vers de terre et la réalisation d’incisions chirurgicales afin d’exposer les vaisseaux sanguins concernés. Les micropipettes pour l’administration de composés sont formées en chauffant et en tirant le verre à l’aide d’un extracteur de pipette et en utilisant un système de biseautage pour créer une pointe d’aiguille fine à l’échelle du micron. Les pointes sont ensuite utilisées avec un micropositionneur et un micro-injecteur pour injecter des composés arbitraires dans le système vasculaire d’un ver de terre, de manière répétée, avec la disponibilité de grandes tailles d’échantillons et de petits volumes de composés. Des détails sur les subtilités de la procédure d’injection sont fournis. La petite taille du vaisseau du ver de terre est un défi, en particulier dans le cas du vaisseau ventral ; Cependant, la maîtrise des techniques présentées offre une grande répétabilité en tant que solution peu coûteuse, ce qui rend pratiques les études d’échantillons de très grande taille.
Introduction
Le ver de terre a été utilisé comme bioindicateur et essai biologique important pour des applications scientifiques antérieures 1,2,3,4,5,6 ; C’est un organisme idéal pour évaluer les risques biologiques liés aux déchets dangereux et toxiques dans les environnements terrestres pour les études in situ et de bioaccumulation, telles que les biocides (insecticides) dans le sol et les effets écotoxicologiques néfastes 7,8,9,10. De plus, en raison de la bioprospection, le ver de terre est une source alternative de molécules fibrinolytiques, anticoagulantes, antimicrobiennes et anticancéreuses 11,12 ; au point qu’en 1991, une équipe a extrait et purifié la lumbricine de la peau du ver de terre et l’a placée sur des tumeurs mammaires de souris SHN, ce qui a conduit à l’inhibition de la croissance tumorale13. Le ver de terre est également un modèle animal utile sur le plan pédagogique, car il peut être utilisé pour exposer les étudiants à la chirurgie et à la compréhension de l’anatomie d’un spécimen ; de l’étude de la circulation sanguine à l’électrophysiologie14,15.
Dans nos propres recherches, nous avons examiné la réponse des vaisseaux de vers de terre vivants aux ultrasons de haute intensité18. Nous avons constaté que la rupture des vaisseaux chez le ver s’est produite dans des conditions similaires à celles que nous avons associées aux dommages de rupture dans les micro-vaisseaux humains. Notre travail en cours consiste à injecter des microbulles dans le système vasculaire du ver de terre. Les microbulles sont composées d’un gaz lourd enfermé dans une enveloppe lipidique, albumine ou polymère, ces agents peuvent être utilisés comme agents de contraste d’image ainsi que comme véhicules pour l’administration ciblée de médicaments.
Ce nouveau protocole est pertinent pour toute étude qui bénéficierait de l’injection intraveineuse (IV) d’un composé qui pourrait utiliser les bioindicateurs naturels du ver de terre. L’approche est basée sur la micro-injection IV dans l’un des nombreux points d’entrée possibles, y compris l’un des pseudo-cœurs à cinq paires du ver de terre, le vaisseau dorsal et le vaisseau ventral. La procédure implique une incision chirurgicale élaborée pour exposer les vaisseaux, suivie d’une injection contrôlée par un micro-positionneur. Ceci est réalisé à l’aide de micropipettes personnalisées construites spécifiquement pour la micro-injection vasculaire de vers de terre. Ces micropipettes permettent de cibler avec précision des vaisseaux aussi petits qu’un vaisseau ventral de 90 m de diamètre.
Ce protocole est conçu pour améliorer les techniques de micro-pipetage précédentes, y compris une étude de 1948 pour l’extraction de sang et d’urine de vers de terre16. Comme le montre la figure S1, la configuration de cette extraction peut être difficile et, comme l’a déclaré l’auteur, peut prendre jusqu’à une heure ou plus. Une méthode similaire a été développée en 1970, mais l’auteur a fait l’expérience de plusieurs pointes cassées lors de l’injection de fluides dans les fibres géantes du ver de terre17. Dans la méthode actuelle décrite ci-dessous, l’extraction du sang est une question de secondes à quelques minutes et est pertinente à la fois pour l’injection de composés et l’extraction de fluides de vers de terre. Dans ce cas précis, nous avons injecté des produits de contraste, des microbulles.
Protocole
1. Préparation de la micropipette : verre tirant et pointe biseautée
- Tirage de micropipette
- Allumez l’extracteur de micropipette et sélectionnez un programme pour entrer des paramètres spécifiques pour la micro-injection de vers de terre.
- Réglez les paramètres sur Pression = 500, Traction = 75, Temps = 250, Chaleur = 336 et Vitesse = 70. Les résultats peuvent varier d’un extracteur à l’autre ; Par conséquent, expérimentez avec les paramètres pour obtenir la pointe souhaitée (taille, netteté, forme, etc.).
- Assurez-vous d’effectuer un test RAMP pour déterminer la valeur thermique des micropipettes avant de les tirer, car le non-respect de cette consigne pourrait entraîner l’épuisement du filament de l’auge ou la rupture du verre.
- Si la pression d’air doit être modifiée, appuyez sur le bouton d’effacement, sélectionnez non (0) lorsqu’on vous demande d’effacer toutes les valeurs, puis sélectionnez changer la pression (2). Ce processus peut varier d’un extracteur à l’autre ; Par conséquent, consultez le manuel de l’instrument afin de modifier les paramètres de pression.
- Ouvrez le couvercle de l’extracteur de micropipette et chargez une micropipette dans l’extracteur. Le verre de la micropipette utilisé était du verre borosilicaté avec pipette à filament : 10 cm de longueur, diamètre extérieur : 1,5 mm et diamètre intérieur : 0,86 mm.
- Faites glisser la pipette dans la rainure en V par la droite le long de la fente de la pipette jusqu’à ce que l’extrémité de la pipette s’aligne avec l’extrémité du porte-pipette. Pour que la pipette puisse se déplacer sur le filament du côté opposé, poussez la pipette aussi loin que possible tout en veillant à ce qu’elle reste posée sur la fente de la pipette.
- Pour verrouiller la pipette, serrez le bouton sur le côté droit et faites glisser le système verrouillé avec la pipette jusqu’à ce qu’il atteigne l’autre côté de l’extracteur à travers le filament. Enfin, verrouillez le côté gauche de la pipette sur l’extracteur. La pipette doit être au milieu du filament ; Consultez le manuel pour obtenir des instructions sur la façon d’aligner correctement la pipette.
- Une fois la pipette chargée, fermez l’extracteur, appuyez sur le bouton de traction et attendez que la pipette soit tirée avant de retirer les deux pipettes obtenues.
- Desserrez les boutons pour retirer les pipettes et veillez à ne pas clipser les pipettes lors du retrait de la fente.
- Placez les micropipettes tirées sur un support de micropipette ou un type de support pour maintenir la micropipette en place et permettre une rotation facile sans casser les micropipettes tirées. Nous avons développé notre propre support de micropipette qui peut être créé dans un atelier d’usinage ou même imprimé en 3D.
REMARQUE : Le protocole peut être mis en pause ici. - Placez le support de micropipette sous le microscope et utilisez un programme d’appareil photo, ou un logiciel similaire, pour capturer une image des micropipettes tirées et pour enregistrer le diamètre de la pointe en utilisant un grossissement 10x ~1000 mm et ~50 mm de la pointe.
- Avant de prendre une photo, assurez-vous que les paramètres de l’appareil photo correspondent au réglage du microscope (10x), afin de mesurer avec précision, en particulier pour les mesures post-imagerie. Le paramètre 10x se trouve dans le ruban horizontal de la barre d’outils situé en haut de l’écran.
- Pour afficher et capturer une image de la micropipette, sélectionnez l’appareil photo dans le logiciel de l’appareil photo situé dans le coin supérieur gauche et appuyez sur le bouton Snap après avoir fait la mise au point sur l’embout pour obtenir une lecture précise. Le bouton Snap se trouve dans la barre d’outils horizontale sur le côté gauche de la page, sous l’onglet Appareil photo.
- Prenez des mesures des micropipettes tirées pour déterminer si la taille et la consistance de pointe souhaitées ont été atteintes. Il suffit de tirer jusqu’à 5 pipettes pour déterminer si l’extracteur et ses paramètres produisent constamment la taille souhaitée. Si la taille de pointe souhaitée n’a pas été atteinte, ou si la taille continue de varier d’une pipette à l’autre, le chercheur peut avoir besoin d’expérimenter différents réglages jusqu’à ce qu’une taille de pointe souhaitée soit atteinte, ou il peut être nécessaire de fixer le placement du filament et de la pipette, ce qui peut nécessiter la référence du manuel de l’extracteur de pipette.
REMARQUE : Le protocole peut être mis en pause ici.
- Mise en place pour biseauter la micropipette et utilisation de l’impédancemètre d’électrode
- Pour biseauter les micropipettes tirées, utilisez une chanfreineuse à micropipette avec un impédancemètre d’électrode et un stéréomicroscope 40x.
REMARQUE : D’autres chanfreins peuvent être utilisés ; Même les chanfreins internes sont couronnés de succès, et différentes configurations peuvent être réalisées avec différents microscopes pour examiner le processus de chanfreinage, y compris le montage d’une caméra sur le microscope. - Assemblez le socle/plaque de meulage avec la plaque fine entre les deux supports noirs.
- Placez la plaque inférieure avec les aimants à l’opposé de la plaque.
- Vissez les trois parties ensemble : (1) la bague de retenue supérieure, (2) la plaque fine de meulage et (3) la bague de retenue inférieure (magnétique). Identifier la surface abrasive de la plaque de meulage ; Pour la plaque fine, elle est de couleur violette et doit être orientée vers le haut afin que le verre soit en contact avec le plat optique en quartz.
- Placez cinq gouttes d’huile de socle de chanfrein, ou autant que nécessaire, sur le plat optique en quartz de l’instrument de biseautage et placez la plaque assemblée sur le dessus. Cette huile peut durer toute la journée, mais si la plaque s’agite ou ne tourne pas quand elle le devrait, le plat optique en quartz peut avoir besoin d’être huilé à nouveau.
- Faites tourner la plaque manuellement plusieurs fois pour répartir l’huile, puis l’instrument peut être allumé.
- Pour régler l’impédancemètre, ajoutez une solution saline (0,9 % NaCl) sur la mèche, qui est le fil de référence, et placez la mèche sur la plaque de biseautage. Trempez le ruban pour faire un circuit avec la micropipette, et recouvrez la plaque d’une fine couche de solution saline.
- Fixez le segment de fil à l’extrémité du fil qui est fixé au compteur d’impendence.
- Basculez l’interrupteur « on » de l’impédancemètre et laissez-le en « veille » jusqu’à ce qu’il soit prêt à commencer le biseautage. Parce que nous créons une grande ouverture, réglez l’impédancemètre d’électrode sur x0,1 lorsque vous êtes prêt à biseauter.
- Pour biseauter les micropipettes tirées, utilisez une chanfreineuse à micropipette avec un impédancemètre d’électrode et un stéréomicroscope 40x.
- Chargement de la micropipette et biseautage
- Chargez la micropipette sur la pince à pipette située sur le manipulateur et serrez le bouton pour la maintenir en place pendant le biseautage.
- Par l’extrémité arrière de la micropipette, remplissez toute la pipette de solution saline et insérez le plomb dans la micropipette, en veillant à ce qu’il n’y ait pas de bulles d’air dans la micropipette. Il a été remarqué que la présence de bulles d’air dans la micropipette provoque une variabilité dans les mesures.
- Allumez l’impendeur en passant de « veille » à « x0,1 ». La résistance doit initialement être de 100 MΩ et lorsque la pointe de la micropipette touche la solution saline, elle doit afficher une lecture différente.
- Pour biseauter la bonne taille d’ouverture de pointe, avant d’abaisser la micropipette, ajustez l’angle à 35° sur le manipulateur pour obtenir un biseautage cohérent. Un angle de 30° est également suffisant, mais entre les deux, 35° maintient un écart-type inférieur, donc plus cohérent dans le biseautage et la pointe se casse moins.
- À l’aide du manipulateur, positionnez la pointe de la micropipette à environ deux tiers du centre de rotation de la plaque de broyage.
- À l’aide du bouton de réglage grossier, abaissez la micropipette près de la plaque de sorte que la pointe de la micropipette s’approche de la solution saline. Si aucune caméra n’est disponible, il est important de regarder vers le bas du microscope pour voir le biseautage de la pointe.
- Une fois que la pointe de la micropipette entre en contact avec la solution saline, la lecture de l’impédancemètre doit passer de 100 MΩ à une valeur comprise entre 80 et 20 MΩ. Cette valeur variera en raison de l’ouverture du verre tiré.
- À ce stade, passez du bouton de réglage grossier au bouton de réglage fin pour abaisser la pipette plus lentement afin d’éviter de casser la pointe sur la plaque. Il est important de surveiller simultanément l’impédancemètre et la pointe à cette étape du chanfreinage.
- Pendant le biseautage, observez les changements de taille de la pointe et utilisez l’éclairage pour aider à créer un bon point de vue lors du biseautage.
REMARQUE : La pointe deviendra extrêmement brillante au fur et à mesure que le biseautage se produira et l’ouverture de la pointe deviendra plus grande. Il est impératif d’utiliser le bouton de réglage fin du manipulateur pour abaisser ou relever la micropipette à ce stade. Une fois que la micropipette a été retirée de la plaque, la ramener sur la plaque peut provoquer la rupture de la pointe. - Continuez à abaisser lentement la pointe jusqu’à ce qu’elle atteigne la plaque de biseautage et biseautez lentement jusqu’à ce qu’une résistance d’environ 20 MΩ soit atteinte. La maîtrise de ce processus sera une forte courbe d’apprentissage et il faudra de la pratique pour biseauter la pointe de manière constante.
- Lorsqu’une résistance de 20 MΩ est atteinte, soulevez la micropipette de la chanfreineuse.
- Retirez le plomb de la micropipette et déchargez la micropipette de la chanfreineuse. Si elle est laissée sur le biseau, la micropipette peut soit se briser, soit créer une plus grande ouverture à son extrémité ; Par conséquent, il est essentiel de surveiller le compteur et la pointe pendant le biseautage.
REMARQUE : Le protocole peut être mis en pause ici. - Placez la micropipette biseautée sur le support de micropipette et utilisez l’objectif 10x du logiciel du microscope pour mesurer la taille de l’ouverture de la pointe. Une taille d’échantillon de 10 pointes est suffisante pour vérifier la cohérence de toutes les pointes biseautées.
- Vérifiez que le réglage du microscope (10x) correspond aux paramètres de l’appareil photo avant de prendre une photo. Les valeurs aberrantes peuvent être éliminées après les mesures d’ouverture de la pointe.
- Pour éteindre le chanfrein, mettez l’interrupteur sur « off » sur le moteur de la courroie d’entraînement et sur l’impédancemètre.
- Dévissez le socle/plaque de meulage pour retirer la bague de retenue supérieure. Ne soulevez pas le socle/la plaque de meulage lorsqu’ils sont attachés l’un à l’autre, car ils peuvent se briser en raison d’un vide créé.
- Après avoir soulevé la bague de retenue supérieure de l’accessoire à l’aide des vis, faites glisser la plaque de broyage fine et soulevez le dernier accessoire magnétique afin de le retirer. Enlevez l’excès d’huile sur le plat optique en quartz avec des lingettes de laboratoire.
- Nettoyez les trois composants avec de l’eau déminéralisée (DI) et séchez-les en tapotant pour éviter la formation de cristaux de sel. Après de longues périodes d’utilisation, la base magnétique rotative peut subir des secousses. Si cela se produit, versez une petite quantité d’eau DI sur la courroie d’entraînement pour éliminer tout sel cristallisé.
- Essuyez l’excès d’huile à l’arrière de la plaque de broyage ainsi que sur le plat optique en quartz.
- Utilisez de l’eau DI sur la plate-forme du chanfreineur pour éliminer tout excès de solution saline qui pourrait se trouver sur l’instrument afin d’éviter la cristallisation.
- Utilisez de l’eau DI pour laver les pointes biseautées. Si les pointes ne sont pas lavées, elles cristallisent mais peuvent facilement être lavées avec de l’eau DI plus tard.
- Déposer de l’argile à l’intérieur d’une plaque et utiliser le verre de protection pour éviter la contamination des micropipettes.
- Faites des entailles dans l’argile pour maintenir les micropipettes. Lorsqu’elles sont prêtes à être utilisées, les pointes biseautées sont maintenant prêtes à être remblayées avec un composé d’intérêt et injectées dans le système vasculaire du ver de terre. Pour cet exemple de protocole, des agents de contraste, des microbulles, ont été utilisés comme composé d’intérêt.
REMARQUE : Le protocole peut être mis en pause ici.
2. Calibrage du micro-injecteur avec embouts biseautés
- Préparez une plaque à revêtement hydrophobe.
- La veille, enduire deux plaques d’un revêtement hydrophobe sur la surface pour durcir pendant la nuit. Ce produit chimique doit provenir de matériaux achetés en magasin ou de matériaux de laboratoire internes, le cas échéant, et au moins 12 heures de durcissement sont nécessaires.
- Le revêtement est un processus rapide en deux étapes. Vaporisez avec la couche de base, puis vaporisez avec la couche de finition.
- Dans une hotte ou dans un espace ouvert, vaporisez la couche de base sur la plaque après avoir secoué vigoureusement la boîte de couche de base une fois que les boules de mélange ont cliquetté pendant une minute.
- Vaporisez la plaque avec la couche de base à environ 6 à 12 pouces de la surface en faisant des passes tout en enduisant la plaque. Les passes consistent en des passes légères de droite à gauche, puis de haut en bas. Continuez à secouer pendant que la plaque est enduite et assurez-vous de ne pas trop pulvériser car cela diminuerait les performances du produit.
- Attendez 1 à 2 minutes avant d’appliquer une autre couche de la couche de base. Bien que cela ne soit pas nécessaire, le revêtement supplémentaire peut être appliqué si vous le souhaitez.
- Attendez 30 minutes que la couche de base sèche.
- Répétez les étapes 2.1.3 à 2.1.5 pour la couche de finition.
- Une fois que la plaque a durci pendant la nuit ou pendant au moins 12 heures, la plaque est prête à être remplie d’huile minérale. Remplissez l’assiette à moitié environ d’huile minérale.
- Placez la plaque avec de l’huile minérale sur la platine du micro-injecteur.
- Chargez les pointes biseautées sur le micro-injecteur.
- Connectez le microinjecteur directement à un jet d’air comprimé de laboratoire. Une bouteille d’azote comprimé et un régulateur de pression peuvent être utilisés pour ce système, mais notez que d’autres systèmes de micro-injecteurs peuvent nécessiter une interface différente.
- Ouvrez l’air comprimé et ouvrez le régulateur de conduite d’air basse pression à 70 PSI et allumez le micro-injecteur. Ne dépassez pas 80 PSI, car le système ne peut pas gérer plus de 80 PSI.
- Remplissez les pointes avec de l’eau à l’aide d’une seringue de 1 ml avec une aiguille à embout métallique. Si le diamètre intérieur de la pipette est différent, une aiguille métallique de calibre différent sera nécessaire pour l’accueillir.
- Une fois remplis d’eau, chargez la micropipette sur le porte-aiguille du micromanipulateur joystick. Différents micro-injecteurs et micromanipulateurs peuvent être utilisés.
- Créez des bulles d’eau pour calibrer le volume de distribution à l’aide d’une micropipette biseautée.
REMARQUE : Avant d’introduire toute administration de composé dans le système vasculaire du ver de terre, le microinjecteur doit être calibré pour déterminer le volume d’injection approprié.- Réglez les paramètres sur le micro-injecteur pour une pression à 4 PSI et un temps à 0,5 seconde. Le dépassement de ces paramètres déformera la taille du récipient, ce qui est défavorable, à moins que l’objectif du chercheur ne soit d’étudier l’expansion du récipient.
- Abaissez la pointe de la pipette jusqu’à ce qu’elle soit proche du bas de la plaque, mais veillez à ne pas casser la pointe au bas de la plaque. Plus l’embout est bas dans l’huile minérale, plus il sera visqueux sur l’embout, ce qui pourrait entraîner une casse.
- Commencez par un bord de la plaque pour utiliser pleinement la plaque lors de l’étalonnage.
- Une fois que celui-ci est en position, appuyez sur la pédale pour distribuer une bulle d’eau dans l’huile.
- La bulle peut rester collée à la pointe. Pour y remédier, retirez rapidement la plaque dans la direction opposée à la bulle pour la séparer de la pointe de la pipette.
- À l’aide du logiciel de l’appareil photo, mesurez la taille de la bulle et calculez le volume. Si aucun logiciel de caméra n’est disponible, un autre logiciel peut être utilisé.
- Créez 10 bulles et mesurez le diamètre moyen des bulles pour déterminer le volume correct que la micropipette distribuera dans le système vasculaire du ver de terre.
REMARQUE : Si le chercheur souhaite distribuer une variété de volumes, les paramètres de pression et de temps peuvent être manipulés ; Répétez les étapes 2.3.1 à 2.3.7.
3. Préparation à la chirurgie du ver de terre pour exposer le système vasculaire spécifique du ver de terre d’intérêt
- Préparation et mesures des vers de terre
- Préparez une solution d’éthanol à 10 % qui anesthésiera les vers de terre avant la chirurgie.
- Conservez les vers de terre dans un bécher de 100 ml avec de la terre entre les expériences.
- Ne gardez que 5 à 10 vers de terre à la fois dans le bécher pour éviter que les vers de terre ne se dessèchent en raison des changements brusques du réfrigérateur à la paillasse, de 4 °C à 25 °C.
- Placez les vers de terre dans de l’éthanol à 10 % pendant 30 minutes. Si le ver de terre se déplace toujours après 30 minutes, laissez-le dans la solution d’éthanol pendant 5 minutes supplémentaires.
REMARQUE : Parfois, le ver de terre a besoin de plus de temps en raison de sa taille ; Par conséquent, il peut être nécessaire d’ajuster le temps passé dans l’éthanol en fonction de la taille du ver de terre, mais pas de plus d’une heure. Plus d’une heure nuira au ver de terre. - Rincez le ver de terre sous l’eau du robinet pour éliminer la bave qu’il produit et l’éthanol.
- Placez le ver de terre sur une serviette en papier pour enlever l’excès d’eau.
- Une fois que le ver de terre est anesthésié, notez le poids (g), la largeur (mm), la longueur (mm) et la largeur du récipient (μm) de chaque ver de terre. Prenez le poids et les dimensions du ver de terre avant de faire des incisions et sans étirer le ver de terre.
- Une fois que le vaisseau est exposé chirurgicalement au microscope, utilisez le logiciel de la caméra pour mesurer la largeur du vaisseau. Si aucun logiciel de caméra n’est disponible, une micro-règle en acier inoxydable suffit, bien qu’elle ne soit pas aussi précise qu’une mesure logicielle numérique.
REMARQUE : Selon le vaisseau d’intérêt, passez à l’étape 3.2 (vaisseau ventral), 3.3 (vaisseau dorsal), 3.4 (vue de dessus des cœurs) ou 3.5 (vue latérale des cœurs).
- Exposer le système vasculaire du ver de terre, le vaisseau ventral (méthode 1)
- Utilisez un tampon en caoutchouc pendant l’intervention chirurgicale pour coincer le ver de terre, exposant ainsi le vaisseau d’intérêt au chercheur. La partie foncée de la peau doit être tournée vers le bas.
- Pour ouvrir chirurgicalement le ver de terre, placez-le sur sa face dorsale, la partie la plus foncée du ver de terre, où une petite incision latérale est pratiquée sur la peau d’environ 1 mm avec une lame. Cette petite incision permet aux ciseaux chirurgicaux d’entrer pour créer une longue incision.
- Épinglez la peau du ver de terre à 33 mm de distance, en faisant une ouverture de 27 mm pour exposer le récipient, en utilisant seulement quatre broches pour exposer correctement le récipient. Des épingles peuvent être ajoutées ou déplacées, une fois que le ver de terre a été épinglé, pour aider à manipuler la peau du ver de terre.
- Avec des ciseaux chirurgicaux, faites une incision pour atteindre l’autre goupille sur le côté de son corps. En poussant vers le haut vers la peau, il empêche tout dommage à l’intérieur du ver de terre, comme couper le système vasculaire ou l’intestin.
- Une fois l’incision faite, épinglez ou re-épinglez là où la première incision a été faite, puis à la fin de la coupe.
- À l’aide des deux outils chirurgicaux (poignées chirurgicales), déplacez la peau pour exposer l’intérieur du ver de terre.
- Fixez la peau sur le fond pendant que la peau est déplacée et, tout en remontant le ver de terre, continuez à séparer soigneusement la peau des organes. Une fois en haut, placez la dernière épingle.
- Si le vaisseau n’est pas exposé, tirez sur les côtés opposés de la peau du ver de terre pour séparer le tissu élastique du ver de terre afin d’exposer le vaisseau ventral et de séparer davantage la peau.
REMARQUE : Ce tiraillement enlèvera une partie des tissus qui retiennent les organes à l’intérieur du ver de terre. Soyez prudent avec cette étape, car elle pourrait rompre involontairement les vaisseaux du ver de terre. Le vaisseau ventral doit maintenant être exposé, et le cordon nerveux peut fonctionner comme un marqueur du vaisseau, car le cordon nerveux longe la peau juste à côté et parallèlement au vaisseau ventral. Si le vaisseau ventral est proche de l’intestin, une traction sur la peau peut exposer davantage le vaisseau. Sinon, poussez l’intestin sur le côté, mais cela peut causer une zone de travail en désordre.
- Exposition du système vasculaire du ver de terre, du vaisseau dorsal (méthode 2)
REMARQUE : Les étapes pour exposer le vaisseau dorsal sont similaires à l’exposition du vaisseau ventral.- Répétez les étapes 3.2.1 à 3.2.3 de l’étape 3.2. La partie foncée de la peau doit être tournée vers le haut pour ces étapes.
- Utilisez des ciseaux chirurgicaux pour couper vers le milieu du ver de terre du côté opposé.
- À partir du milieu du ver de terre, faites une incision vers la partie antérieure du ver de terre, la tête. En poussant vers le haut vers la peau, on évite d’endommager l’intérieur du ver de terre, comme couper le vaisseau ou l’intestin.
- Une fois la coupe diagonale effectuée, épinglez ou re-épinglez le site de la première incision, puis à la fin de la coupe qui a été faite.
- Répétez les étapes 3.2.6 à 3.2.9 à l’étape 3.2.
REMARQUE : Le vaisseau dorsal doit maintenant être exposé.
- Exposition du système vasculaire du ver de terre, vue de dessus des cœurs (méthode 3)
- Utilisez un tampon en caoutchouc pendant l’intervention chirurgicale pour coincer le ver de terre, exposant ainsi le vaisseau d’intérêt au chercheur.
- Pour exposer chirurgicalement le ver de terre, placez-le sur sa face ventrale, la partie claire du ver de terre. La partie foncée de la peau doit être tournée vers le haut.
- Utilisez quatre épingles pour maintenir la peau du ver de terre et pour créer une fenêtre afin d’exposer les cœurs d’intérêt. Une goupille supplémentaire, pour un total de cinq, peut être utilisée pour maintenir le ver de terre près de l’extrémité de sa tête, l’extrémité antérieure.
- Commencez à épingler le ver de terre de bas en haut, en commençant par le côté droit, puis en vous déplaçant vers le côté gauche. Épinglez le ver de terre, en plaçant deux épingles sur le dessus près de l’extrémité de la tête, de l’extrémité antérieure et de deux près du clitellum.
- À l’aide d’une lame, faites une petite incision d’environ 1 mm sur le côté du ver de terre.
- Utilisez des ciseaux chirurgicaux pour couper vers le milieu du ver de terre du côté opposé.
- À partir du milieu du ver de terre, faites une coupe vers l’avant du ver de terre jusqu’à ce que vous atteigniez la bouche du ver de terre, l’extrémité antérieure.
REMARQUE : Il est important que les ciseaux soient soulevés contre la peau pour éviter de couper le système vasculaire ; La lame de ciseau est visible lorsque vous traversez la peau. Assurez-vous que la coupe est faite à l’extrémité antérieure du ver de terre, car cela offrira une meilleure visibilité des cœurs. - Une fois épinglé, réépinglez le ver de terre, si la peau s’enroule dans le ver de terre.
- Faites une traction pour bien séparer le tissu du ver de terre afin d’exposer correctement les cœurs.
- Si les cœurs ne sont pas exposés, déplacez les vésicules séminales blanches, car les cœurs se cachent parfois sous ces vésicules.
REMARQUE : L’exposition du cœur peut varier d’un ver de terre à l’autre, les 10 cœurs peuvent être visibles ou seulement la moitié et ainsi de suite. À ce stade, le chercheur doit déterminer s’il doit déplacer des organes et des tissus afin de localiser le cœur du ver de terre.
- Exposition du système vasculaire du ver de terre, vue latérale des cœurs (méthode 4)
- Utilisez un tampon en caoutchouc pendant l’intervention chirurgicale pour coincer le ver de terre, exposant ainsi le vaisseau d’intérêt au chercheur.
- Pour exposer chirurgicalement le ver de terre, placez-le sur le côté. Comme le ver de terre est sur le côté, le côté clair et le côté sombre du ver de terre doivent être visibles.
- Répétez les étapes 3.4.3 à 3.4.9 à partir de l’étape 3.4.
- Si les cœurs ne sont pas exposés, déplacez les vésicules séminales blanches, car les cœurs se cachent parfois sous ces vésicules.
REMARQUE : L’exposition du cœur peut varier d’un ver de terre à l’autre, les cinq cœurs peuvent être visibles ou moins. À ce stade, le chercheur doit déterminer s’il doit déplacer des organes et des tissus afin de localiser le cœur du ver de terre.
4. Administration de composés dans le système vasculaire du ver de terre
- Préparation du ver de terre pour l’administration de composés
REMARQUE : Pour ces étapes spécifiques, nous avons injecté des agents de contraste, des microbulles, dans le système vasculaire du ver de terre en tant que composé d’intérêt.- Avant la microinjection, placez le ver de terre sur la scène de micro-injection et utilisez une lingette de laboratoire pour éliminer tout liquide autour du vaisseau d’intérêt, exposant ainsi le système vasculaire pour l’injection.
REMARQUE : N’appliquez pas de forte pression car cela provoquerait un saignement du récipient. - Alignez le système vasculaire d’intérêt sur la micropipette, car il est important que le vaisseau ventral soit aligné pour l’injection. Si les cœurs sont intéressants, ils doivent être perpendiculaires à la micropipette.
- Concentrez le microscope sur le système vasculaire d’intérêt et commencez à abaisser la micropipette jusqu’au système vasculaire. Avant de déplacer l’un des manipulateurs du joystick, vérifiez qu’ils sont tous réglés sur 0 mm pour assurer une meilleure mobilité.
- Lorsque la pointe de la micropipette est en contact avec le récipient du ver de terre, assurez-vous que l’angle entre le récipient et la micropipette est inférieur à 15°.
- Une fois que la micropipette commence à appliquer une pression sur le vaisseau, le sang s’éloigne de la pointe en raison de la pression sur le système vasculaire. C’est une bonne indication du bon placement de l’injection.
- Pour assurer une injection réussie, utilisez le joystick pour déplacer la micropipette vers l’avant afin d’entrer en contact avec le système vasculaire.
REMARQUE : Il est important de ne pas percer le récipient. Notez que la pointe doit déplacer le système vasculaire, pour le vaisseau dorsal et ventral, dans la direction où la micropipette se déplace, puis le cadran grossier doit être utilisé pour déplacer la pointe de la micropipette vers l’avant afin de permettre une pénétration complète dans le vaisseau. Si la plaque est mobile, elle peut être utilisée pour déplacer et percer le récipient dans la micropipette au lieu d’utiliser les microcontrôleurs ou tous simultanément. Le récipient ne sera pas pénétré immédiatement, mais un recul du récipient est un indicateur de la bonne pénétration de la micropipette. Une fois que la pointe a pénétré dans le récipient, celui-ci doit être droit et aligné avec la micropipette. Si ce n’est pas le cas, rétractez lentement la micropipette à l’aide du contrôle fin. - Appuyez sur la pédale pour injecter le système vasculaire du ver de terre. La dilution du sang est un autre indicateur d’une bonne pénétration une fois la pédale enfoncée.
- Rétractez lentement la micropipette et retirez-la.
REMARQUE : Alternativement, casser la pointe alors que la micropipette est encore dans le vaisseau est une méthode efficace pour éviter la perte de sang.
- Avant la microinjection, placez le ver de terre sur la scène de micro-injection et utilisez une lingette de laboratoire pour éliminer tout liquide autour du vaisseau d’intérêt, exposant ainsi le système vasculaire pour l’injection.
Résultats
Les résultats représentatifs suivants sont basés sur un ensemble de paramètres spécifiques qui incluent les paramètres utilisés pour tirer la pipette en verre, la taille de l’ouverture de la pipette formée à partir d’un angle de biseautage donné, ainsi que la pression et le temps des micro-injections. La figure 1 montre un schéma du flux représentant le processus du début à la fin.
En fonction des paramètres de l’extracteur de pipette sélectionnés, la pointe suivante émergerait de la traction (Figure 2). Il est à noter que la valeur RAMP peut changer en raison du type de verre et même de l’emplacement du filament. Si les paramètres sont acceptables, la pointe résultante sera solide, avec un long cône pour le biseautage. Si la pointe est cassée en tirant, l’extracteur doit être réajusté.
Pour le biseautage de la micropipette, six angles de biseautage ont été testés afin de déterminer l’angle optimal, d’évaluer la facilité générale de biseautage et d’examiner comment l’angle affectait la taille de l’ouverture de la pointe. L’angle optimal pour nos critères de biseautage a été déterminé à 35° car il fournit une pointe pointue, il est suffisamment solide pour pénétrer dans le récipient sans se casser et il est hautement reproductible. En général, plus l’angle est petit, plus la pointe devient tranchante, comme le montre la figure 3. Un autre angle d’intérêt était de 30°, ce qui est plus net, mais 35° a été choisi, en raison de sa reproductibilité. Comme le montre la figure 4, l’angle du micromanipulateur modifie à la fois la forme et la taille de l’ouverture de la pointe. Cette figure montre que le biseautage le plus précis et le plus cohérent se produit avec un angle compris entre 30° et 40°. Une table supplémentaire (tableau S1) a été créée en fonction de la facilité de biseautage, bien qu’il soit important de noter que, d’une personne à l’autre, les techniques de biseautage varient, et donc les pointes varient. Il est en outre noté que des biseaux infructueux peuvent se produire lorsque le micromanipulateur est abaissé trop rapidement ou lorsque le verre devient trop cassant, entraînant la rupture de la pointe.
Pour une taille d’embout donnée, un étalonnage doit être effectué avant les injections de composé. Le volume d’injection dépend de la taille de l’embout ainsi que de la pression de micro-injection et du temps d’injection. Par exemple, dans la figure 5, les distributions de volume représentatives sont représentées graphiquement pour des pointes de 24,4 μm. Les données révèlent une relation approximativement linéaire entre le volume distribué et la pression pour des temps d’injection fixes. Des données d’étalonnage personnalisées similaires doivent être déterminées pour des conceptions de pointes spécifiques.
Lors de l’injection microvasculaire, une inspection visuelle est nécessaire pour confirmer la réussite de l’injection d’un produit donné. Le marqueur le mieux visible est la dilution du sang. Comme le montrent la vidéo supplémentaire et la figure 6, le sang devient plus clair à mesure qu’il est dilué, ce qui est un signe de réussite de l’injection. Il est essentiel que la micropipette ne pénètre pas trop profondément dans le vaisseau et que la micro-injection ne soit pas effectuée à un angle supérieur à 15° par rapport au récipient, sinon lorsque la pipette est retirée, le composé d’intérêt saigne de son système vasculaire, en raison de grandes blessures. Une injection et une traction réussies entraîneront un saignement minimal lors du retrait.
Figure 1 : Déroulement de la méthode globale. Pour la micro-injection du système vasculaire du ver de terre, il faut d’abord tirer sur la pipette pour obtenir une micro-ouverture à la pointe. Ensuite, la pointe de la micropipette est biseautée pour obtenir une pointe d’aiguille pointue. Une fois l’ouverture réalisée, la micropipette est calibrée pour le volume approprié distribué. Une fois calibré, des injections dans le système vasculaire peuvent être effectuées. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Micropipette tirée réussie. Sur la base des paramètres utilisés dans le protocole, cette pointe émergerait après le tirage. (A) Fait la démonstration de la pipette immédiatement après avoir été tirée. (B) Une image rapprochée de la même pipette tirée. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Profils d’angle de biseautage de la pointe de la micropipette. Six angles ont été testés pour le biseautage. En diminuant l’angle de 45° à 20°, le tranchant et l’ouverture de la pointe augmentent. Veuillez cliquer ici pour voir une version agrandie de cette figure.
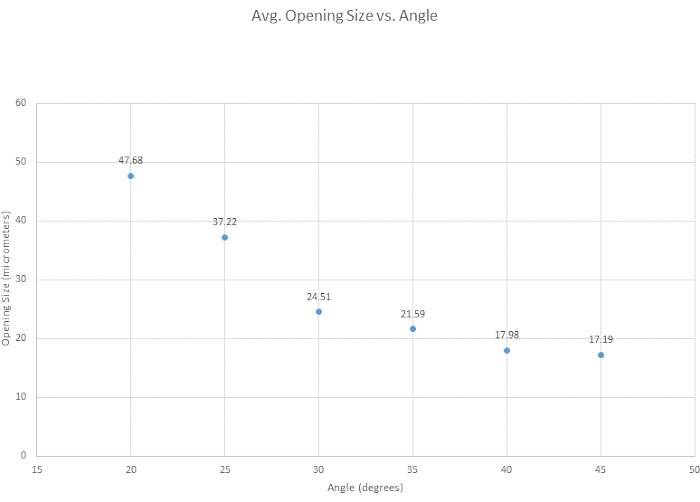
Figure 4 : L’ouverture de la pointe se rétrécit avec l’angle croissant. Six angles ont été testés pour voir comment l’angle affecte la taille de l’ouverture de la pointe. La taille de l’ouverture de la pointe diminue à mesure que l’angle de biseautage augmente. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Étalonnage pour l’administration du volume. Une ouverture de pointe de 24,4 μm a été utilisée pour ses résultats représentatifs afin de représenter les données en utilisant les paramètres spécifiques pour le temps et la pression. Avec l’augmentation de la pression, le volume distribué augmente, et avec la diminution du temps, le volume distribué diminue. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Injection dans le vaisseau ventral. Un visuel de la réussite de l’injection est démontré avec la dilution du sang comme indicateur. Une vidéo supplémentaire est accompagnée de ce panneau. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure S1 : Installation pour l’extraction du sang et de l’urine du ver de terre. Veuillez cliquer ici pour télécharger ce fichier.
Figure S2 : Écarts-types par rapport à la figure 4. En fonction de l’angle, l’écart-type change. 35° maintient un écart-type inférieur, donc plus cohérent dans le biseautage et la pointe se casse moins. 30° était également bon avec 35° comme le montre le tableau S1. Veuillez cliquer ici pour télécharger ce fichier.
Figure S3 : Démontre la survie du ver de terre après une intervention chirurgicale et l’utilisation d’un pansement liquide pour fermer le ver de terre. Veuillez cliquer ici pour télécharger ce fichier.
Tableau S1 : Tableau descriptif pour la facilité de biseautage. Trois modes ont été utilisés pour décrire la facilité de biseautage, allant de facile à modéré et difficile. Il est à noter que 15° a été testé, mais que l’angle était trop petit pour produire une pointe de micropipette qui ne s’écaillait pas. Veuillez cliquer ici pour télécharger ce tableau.
Vidéo supplémentaire. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Bien que le ver de terre soit dans de l’éthanol à 10 %, en particulier si le ver de terre est d’un âge avancé, il peut y avoir des effets indésirables pour des temps d’exposition supérieurs à 30 minutes ; Les intestins commenceront à se détériorer et, lorsque le ver de terre est ouvert chirurgicalement, ses intestins internes s’étendent. Par conséquent, il est encouragé d’utiliser des vers de terre jeunes à d’âge moyen. Au cours du processus de coupe à travers la peau du ver de terre, il est impératif qu’une coupe complète en ciseaux ne soit pas effectuée, ce qui signifie que l’enquêteur ne doit couper qu’à moitié et continuer à pousser les ciseaux vers l’avant jusqu’à ce qu’il atteigne le point final. Lorsque vous épinglez le ver de terre, veillez à ne pas étirer le ver de terre ou à ne pas le tirer trop fort. Cela pourrait provoquer la rupture du vaisseau, ce qui entraînerait des saignements. Après chaque injection, vérifiez si la micropipette n’est pas bouchée en distribuant les fluides qui peuvent se trouver à l’intérieur de la micropipette, en particulier pour retirer le sang de l’embout avant d’effectuer une autre injection. En plus d’observer l’obstruction de l’embout, après chaque injection, regardez l’embout de la micropipette pour vérifier s’il n’y a pas de casse de l’embout. L’extrémité de la micropipette peut également être cassée, en laissant l’extrémité en place pour éviter toute perte de sang. Il est important d’observer attentivement le tissu vasculaire lors des micro-injections. Lorsque la micropipette entre en contact pour la première fois avec le récipient, le tissu du récipient s’accroche à la pointe de la micropipette. Une fois que la pointe a réussi à pénétrer dans le vaisseau, on peut voir le tissu du vaisseau glisser rapidement dans la pointe et cela se fera également sentir sur le micromanipulateur. Une fois l’injection réussie, il est important de retirer la micropipette avec précaution, car elle pourrait finir par pénétrer plus profondément dans les tissus ou créer une plaie plus grande sur le site d’injection, ce qui pourrait entraîner une fuite de l’administration du composé hors du vaisseau. En règle générale, les injections réussies se produisaient lorsque le diamètre du récipient était de 90 μm ou plus, mais cela peut être amélioré en réduisant la taille des pointes de micropipette par les chercheurs. Le ver de terre est constamment maintenu humide avec de l’eau pour éviter qu’il ne se déshydrate, mais une solution saline est recommandée.
Études de survie des vers de terre
Des expériences de survie des vers de terre ont été menées pour donner un aperçu de la durée de survie des vers de terre après l’expérimentation. Après que les vers aient été immergés dans une solution d’éthanol à 10 %, puis coupés et injectés chirurgicalement, comme ils l’avaient été pendant les expériences, 27 vers ont été « recousus » via une solution liquide de pansement et observés jusqu’à 48 heures après l’expérience. 12 heures après l’opération, environ 67 % des vers étaient encore en vie. 24 heures après l’opération, environ 48 % des vers étaient encore en vie. À 36 heures après l’opération, environ 44 % des vers étaient encore en vie. Enfin, 48 heures après l’opération, environ 22 % des vers étaient encore en vie. Les résultats de ces expériences montrent que la majorité des vers peuvent survivre pendant une journée entière de 12 heures après avoir subi une intervention chirurgicale expérimentale et une injection, et qu’un grand nombre de vers peuvent survivre encore plus longtemps que cela (Figure S3). Cela offre la possibilité à chaque ver d’être surveillé pendant des études de 24 heures, si nécessaire.
Soins de laboratoire des vers de terre
Les vers de terre, des noctambules canadiens, ont été achetés en magasin chez Windsor Wholesale Bait et ont été livrés sous forme de 500 gros vers de terre dans une boîte en polystyrène (35 x 38 x 30 cm) et conservés au réfrigérateur, car les vers individuels étaient retirés et utilisés pour des expériences. Comme indiqué dans les étapes du protocole de préparation des vers de terre, pas plus de 10 vers de terre ont été utilisés à la fois en raison de l’évaporation du ver de terre, ce qui peut entraîner une déshydratation16. De plus, l’exposition des vers de terre à la lumière était limitée, car ils contiennent des cellules sensibles à la lumière sur leur peau ; Une exposition à la lumière de plus de deux heures peut entraîner la mort. Immédiatement à l’arrivée, le sol du conteneur d’expédition a été changé et les vers de terre ont été laissés au repos pendant une période d’attente de 24 heures avant d’être utilisés pour les expériences. Cela a permis de redonner de l’énergie aux vers de terre et de ne plus les fatiguer à cause du transport. À ce stade, l’expérimentation sur le ver de terre peut commencer.
Les vers de terre ont une durée de vie inconnue, mais ils peuvent être maintenus en vie en laboratoire pendant de longues périodes lorsqu’ils sont surveillés tous les jours et reçoivent les bons nutriments. Toutes les deux semaines, de la nouvelle terre doit être ajoutée dans le récipient pour fournir plus de nutriments au ver de terre. Le ver de terre est un invertébré fouisseur profond, anecique, et construira des terriers aussi profonds que 180 cm (6 pieds), il doit donc y avoir au moins 1 pied de terre dans le récipient pour 500 vers de terre. Au fond du récipient, du vieux journal peut être ajouté, car c’est là que certains des vers de terre créeront leurs maisons. Une fois le sol changé, il est recommandé de vérifier l’odeur et de repérer les vers de terre blessés ou morts. Ne laissez pas de vers de terre morts ou blessés dans le récipient, car ils contamineront le sol et créeront plus de décès au sein de votre colonie de vers de terre.
Applications futures
Dans ce protocole, la préparation et la procédure pour effectuer des expériences de sang à haut débit à l’aide du ver de terre sont présentées. Bien que limitées au système circulatoire, les méthodes d’injection décrites ici pourraient potentiellement être étendues à des études impliquant le système nerveux, car le cordon nerveux du ver de terre est parallèle au vaisseau ventral. Par exemple, des recherches antérieures utilisant le ver de terre ont été étudiées pour des études de neuromodulation et de rupture de vaisseaux à partir d’applications thérapeutiques par ultrasons18,19. Grâce à cette nouvelle configuration, d’autres études approfondies sur les ultrasons + microbulles pourraient être menées pour approfondir la recherche sur la neuromodulation et la rupture des vaisseaux.
De plus, la cavité cœlomique du ver de terre pourrait être utilisée pour étudier le système immunitaire, car le liquide qui réside dans la cavité cœlomique médie la plupart, sinon la totalité, des réponses immunitaires. Le ver de terre est unique en ce sens qu’il n’existe que deux fluides chez l’animal, chacun contenu dans des cavités distinctes, le sang dans les vaisseaux et le liquide cœlomique dans la cavité cœlomique. Cette séparation des fluides permet des types spécifiques de recherche dans deux cavités. Par exemple, le liquide cœlomique regorge de nombreux cœlomocytes, dont les fonctions immunitaires partagent des caractéristiques avec les cœlomocytes de la plupart des autres modèles animaux. Des recherches sur les phagocytes et d’autres cellules similaires qui peuvent détruire les cibles cellulaires peuvent être effectuées chez le ver de terre, et le ver de terre a probablement de nombreuses applications de recherche supplémentaires qui pourraient être utilisées comme modèle d’invertébré alternatif.
Alors que le ver de terre n’a pas la complexité nécessaire pour modéliser de nombreux aspects du système anatomique et physiologique humain, la micro-injection offre un système circulatoire contenu contenant du sang étonnamment similaire au sang humain en termes de structure de l’hémoglobine. Dans les applications où de petits volumes sanguins sont acceptables, le ver de terre offre une plate-forme de test peu coûteuse et facilement disponible, exemptée des comités institutionnels de protection et d’utilisation des animaux. Par conséquent, les essais sur les vers de terre avec divers composés peuvent être effectués à plusieurs reprises et dans des échantillons susceptibles de dépasser de loin ce qui serait pratique avec des animaux vertébrés de laboratoire standard.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été financé par la bourse NSF-FDA Scholar-in-Residence Fellowship (NSF-FDA SIR, #1641221), la subvention Chief Scientist Challenge Grant (FDA OCS de l’US Food and Drug Administration Office), l’Integrative Graduate Education and Research Traineeship de la National Science Foundation (NSF IGERT, #1144646) et soutenu par l’Office of Science and Engineering Laboratories (OSEL) de la Food and Drug Administration (FDA) des États-Unis.
matériels
| Name | Company | Catalog Number | Comments |
| 3M Vetbond Tissue Adhesive | 3M Vetbond | 084-1469SB | 3mL bottle vet adhesive - liquid band-aide |
| 40x Stereo Microscope | Sutter Instrument Co. | BV-10-D | Not needed, can add on other scopes |
| 500 Large Worms | Windsor Wholesale Bait | 500 Large | |
| Beveler pedestal oil | Sutter Instrument Co. | 008 | |
| Blades | Ted Pella, Inc | 121-2 | |
| Borosilicate Glass with Filament | Sutter Instrument Co. | BF150-86-10 | |
| Camera | AmScope | MU500 | |
| Camera | AmScope | MU1803-CK | 8MP USB3.0 Microscope Digital Camera |
| Electrode Impedance Meter | Sutter Instrument Co. | BV-10-C | |
| Ethanol | Sigma Aldrich | E7023-1L | Pure ethanol |
| Filament | Sutter Instrument Co. | FT315B | trough filament |
| Grinding Plate | Sutter Instrument Co. | 104D | Fine Plate |
| Hospital Grade Saline | Baxter Healthcare Corporation | 2F7124 | 0.9% Sodium Chloride Irrigation |
| Joystick Micromanipulator | Narishige | MN-151 | |
| KimWipes Kimtech Science | Kimberly-Clark Professional | 34155 | |
| Leafgro | LeafGro | 589252 | 1.5-cu. ft. |
| Metal Hub Needle | Hamilton | 91024 | Luer Lock Metal Needle |
| Micro Vessel Clips | WPI | 501779-G | |
| Microinjector | TriTech Research | MINJ-D | |
| Micropiette Puller Model P-97 | Sutter Instrument Co. | P-97 | |
| Micropipette Beveler | Sutter Instrument Co. | BV-10-B | |
| Microscope | AmScope | SM-8TPW2-144S | 3.5X-225X Simul-Focal Articulating Microcope |
| Needle Holder | TriTech Research | MINJ-4 | |
| NeverWet | Rust-Oleum | NeverWet | |
| Pyrex Glass | Corning | 08747A | Fisher Manufacturer |
| Stainless Micro-Ruler | Ted Pella, Inc | 13635 | Micro-Ruler mounted on a Handle, 10mm scale, with lines at 0.01mm intervals |
| Surgical Grips | Ted Pella, Inc | 53073 | Forceps, Hemostat |
| Surgical scissors | Ted Pella, Inc | 1320 | Fine Iris Scissors, Straight |
| U.S.P. Mineral Oil Lubricant Laxative | Swan | Mineral Oil |
Références
- Stevenson, J. The Oligochaeta. , Claredon Press. Oxford. 685(1930).
- Reynolds, J. W., Reynolds, W. M. Earthworms in medicine. American Journal of Nursing. 72 (7), 1273(1972).
- Gates, G. E. The earthworms of Rangoon. Journal of the Burma Research Society. 25, 196-221 (1926).
- Carr, L. G. K. Interesting animal foods, medicines, and omens of the eastern Indians, with comparisons to ancient European practices. Journal of the Washington Academy of Sciences. 41 (7), 229-235 (1951).
- Price, S. F. Kentucky folk-lore. The Journal of American Folklore. 14 (52), 30-38 (1901).
- Elmer, J., Palmer, A. F., Cabrales, P. Oxygen delivery during extreme anemia with ultra-pure earthworm hemoglobin. Life Sciences. 91 (17-18), 852-859 (2012).
- Eyambe, G. S., Goven, A. J., Fitzpatrick, L. C., Venables, B. J., Cooper, E. L. A non-invasive technique for sequential collection of earthworm (Lumbricus terrestris) leukocytes during subchronic immunotoxicity studies. Laboratory Animals. 25 (1), 61-67 (1991).
- Basley, K., Goulson, D. Effects of chronic exposure to clothianidin on the earthworm Lumbricus terrestris. PeerJ. 5, 3177(2017).
- Mvumi, B. M., Gwenzi, W., Mhandu, M. G. Ecotoxicological effects of citrus processing waste on earthworms. Lumbricus terrestris L. Industrial Crops and Products. 110, 123-129 (2017).
- Furst, A. My saga with earthworms. Food and Chemical Toxicology. 40 (6), 789-791 (2002).
- Cooper, E. L., Hrzenjak, T. M., Grdisa, M. Alternative sources of fibrinolytic, anticoagulative, antimicrobial and anticancer molecules. International Journal of Immunopathology and Pharmacology. 17 (3), 237-244 (2004).
- Cooper, E. L., Hirabayashi, K., Balamurugan, M. Dilong: food for thought and medicine. Journal of Traditional and Complementary Medicine. 2 (4), 242-248 (2012).
- Nagasawa, H., et al. Inhibition by lombricine from earthworm (Lumbricus terrestris) of the growth of spontaneous mammary tumours in SHN mice. Anticancer Research. 11 (3), 1061-1064 (1991).
- Shannon, K. M., Gage, G. J., Jankovic, A., Wilson, W. J., Marzullo, T. C. Portable conduction velocity experiments using earthworms for the college and high school neuroscience teaching laboratory. Advances in Physiology Education. 38 (1), 62-70 (2014).
- National Research Council. A framework for K-12 science education: Practices, crosscutting concepts, and core ideas. , National Academies Press. (2012).
- Ramsay, J. The Osmotic Relations of the Earthworm. Journal of Experimental Biology. 26 (1), 46-56 (1949).
- Mulloney, B. Structure of the Giant Fibers of Earthworms. Science. 168 (3934), 994-996 (1970).
- Kim, Y., Nabili, M., Acharya, P., Lopez, A., Myers, M. R. Microvessel rupture induced by high-intensity therapeutic ultrasound - a study of parameter sensitivity in a simple in vivo model. Journal of Therapeutic Ultrasound. 5 (1), 5(2017).
- Wahab, R. A., et al. Mechanical bioeffects of pulsed high intensity focused ultrasound on a simple neural model. Medical Physics. 39 (1), 4274-4283 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon