Method Article
蚯蚓,Lumbricus terrestris:一种新型显微注射脉管系统体内无脊椎动物模型
摘要
蚯蚓是一种用于脉管系统研究的新型无脊椎动物体内台式模型。我们介绍了允许高效手术和显微注射到蚯蚓脉管系统的技术和设备。描述了手术方案、显微注射技术和生产定制微量移液器的程序。
摘要
尽管脊椎动物对于生物医学研究是必不可少的,但研究往往受到成本、冗长的内部审查和伦理考虑等因素的限制。我们将蚯蚓作为一种替代的、低成本的无脊椎动物,适用于某些初步的脉管系统研究。由于蚯蚓的背血管、腹血管和五对假心的手术可用性,蚯蚓很容易接近,维护成本低,并且只需要小剂量的给定化合物。蚯蚓模型提供了一个简单的封闭血管循环系统,其血红蛋白结构类似于人类血液。提供了麻醉蚯蚓和进行手术切口以暴露相关血管的方案。用于化合物给药的微量移液器是通过用移液管拉拔器加热和拉动玻璃,并使用斜面系统形成微米级细针尖而形成的。然后将吸头与微定位器和显微注射器一起使用,以可重复的方式将任意化合物注射到蚯蚓的血管系统中,并提供大样本量和小化合物体积。提供了有关注射程序复杂性的详细信息。蚯蚓的小血管尺寸具有挑战性,尤其是在腹侧血管的情况下;然而,对所介绍技术的掌握提供了一种低成本的解决方案,具有很高的可重复性,使非常大的样本量的研究变得实用。
引言
蚯蚓已被用作先前科学应用的重要生物指示剂和生物测定法 1,2,3,4,5,6;它是评估陆地环境中有害和有毒废物的生物风险以进行原位和生物积累研究的理想生物体,例如土壤中的杀虫剂(杀虫剂)和不良的生态毒理学影响 7,8,9,10。此外,由于生物勘探,蚯蚓是纤溶、抗凝、抗微生物和抗癌分子的替代来源11,12;以至于 1991 年一个团队从蚯蚓皮肤中提取和纯化了 lumbricine 并放置在 SHN 小鼠的乳腺肿瘤上,这导致了肿瘤生长抑制13。蚯蚓也是一种具有教育意义的动物模型,因为它可以用来让学生接触手术和了解标本的解剖结构;从研究血液循环到电生理学14,15。
在我们自己的研究中,我们检查了活蚯蚓的血管对高强度超声的反应18。我们发现蠕虫的血管破裂发生在类似于我们在人类微血管破裂损伤中相关的条件下。我们正在进行的工作包括将微气泡注射到蚯蚓脉管系统中。微泡由脂质、白蛋白或聚合物外壳包裹的重气体组成,这些试剂可用作图像造影剂以及靶向药物递送的载体。
这种新颖的方案与任何受益于静脉内 (IV) 注射可以利用蚯蚓天然生物指标的化合物的研究相关。该方法基于将 IV 显微注射到几个可能的入口点之一,包括蚯蚓的五对假心、背血管和腹血管中的任何一个。该程序包括一个精心设计的手术切口以暴露血管,然后进行微定位器控制的注射。这是使用专为蚯蚓血管显微注射构建的定制微量移液器实现的。这些微量移液器可精确定位直径小至 90 μm 的腹侧血管。
该方案旨在改进早期的微量移液技术,包括 1948 年提取蚯蚓血液和尿液的研究16。如图 S1 所示,这种提取的设置可能很困难,并且正如作者所说,可能需要长达一个小时或更长时间。1970 年开发了一种类似的方法,但作者在向蚯蚓17 的巨大纤维中注射液体时遇到了多个断头。在下面描述的本方法中,血液的提取是几秒钟到几分钟的事情,并且与化合物的注射和蚯蚓液的提取有关。在这种特定情况下,我们注射了造影剂、微泡。
研究方案
1. 微量移液器准备:拉玻璃和斜面尖端
- 微量移液器拉动
- 打开微量移液器拉拔器并选择一个程序以输入蚯蚓显微注射的特定参数。
- 将参数设置为 Pressure=500、Pull=75、Time=250、Heat=336 和 Velocity=70。结果可能因拉拔器而异;因此,请尝试各种参数以获得所需的笔尖(大小、锐度、形状等)。
- 在拉动微量移液器之前,请务必进行 RAMP 测试以确定微量移液器的热值,否则可能会导致槽丝烧坏或玻璃破裂。
- 如果需要更改气压,请按清除按钮,在要求清除所有值时选择否 (0),然后选择更改压力 (2)。此过程可能因拉拔者而异;因此,请查阅仪器手册以更改压力设置。
- 打开微量移液器拉出器盖,将微量移液器装入拉出器中。使用的微量移液器玻璃是带有细丝移液器的硼硅酸盐玻璃:长 10 cm,外径:1.5 mm,内径:0.86 mm。
- 沿移液器狭缝从右侧将移液器滑入 V 形槽,直到移液器末端与移液器支架末端对齐。为确保移液器可以穿过细丝到达另一侧,请尽可能推移移液器,同时确保移液器保持在移液器狭缝上。
- 要锁定移液器,请拧紧右侧的旋钮,然后将锁定的系统与移液器一起滑动,直到它通过细丝到达拉拔器的另一侧。最后,将移液器的左侧锁定到拉拔器上。移液器应位于灯丝的中间;有关如何正确对齐移液器的说明,请参阅手册。
- 装入移液器后,关闭拉拔器,按下拉动按钮,等待拉出移液器,然后再取出两个移液器。
- 松开旋钮以取出移液器,从狭缝中取出时注意不要夹住移液器。
- 将拉出的微量移液器放在微量移液器支架或某种类型的支架上,以将微量移液器固定到位,并允许轻松旋转而不会损坏拉出的微量移液器。我们开发了自己的微量移液器支架,可以在机械车间创建,甚至可以 3D 打印。
注意:协议可以在此处暂停。 - 将微量移液器支架放在显微镜下,并使用相机程序或类似软件捕获拉动微量移液器的照片,并使用 10 倍放大倍率 ~1000 毫米和距离尖端 ~50 毫米记录尖端直径。
- 在拍摄照片之前,请确保相机设置与显微镜设置 (10x) 匹配,以便准确测量,尤其是对于成像后测量。10x 设置位于屏幕顶部附近的水平工具栏功能区中。
- 要查看和捕获微量移液器的照片,请在位于左上角的相机软件上选择相机,然后在聚焦尖端后按下 Snap 按钮以获得准确的读数。的 Snap 按钮位于页面左侧的水平工具栏上,位于 camera 选项卡下。
- 测量拉出的微量移液器,以确定是否达到了所需的吸头尺寸和稠度。最多拉取 5 支移液器就足以确定拉取器及其参数是否始终如一地产生所需的尺寸。如果尚未达到所需的吸头尺寸,或者每个移液器的尺寸仍然不同,研究人员可能需要尝试不同的设置,直到达到所需的吸头尺寸,或者可能需要固定细丝和移液器的位置,这可能需要参考移液器拉拔器手册。
注意:协议可以在此处暂停。
- 设置微量移液器斜面并使用电极阻抗计
- 要对拉出的微量移液器进行斜面处理,请使用带有电极阻抗计和 40 倍立体显微镜的微量移液器斜面器。
注意:可以使用其他斜面;即使是内部坡口机也能成功,而且可以使用不同的显微镜实现不同的配置来检查坡口过程,包括在显微镜上安装摄像头。 - 将基座/研磨板与两个黑色支架之间的细板组装在一起。
- 放置底板,使磁铁背对板。
- 将三个部分拧在一起:(1) 上挡圈,(2) 研磨细板,(3) 下挡圈(磁性)。识别磨板的磨料表面;对于细板,它是紫色的,应该朝上,以便玻璃与石英光学平面接触。
- 将五滴坡口基座油或所需的油滴在坡口仪的石英光学平面上,然后将组装好的板放在上面。这种油可以持续一整天,但如果板在应该旋转时抽搐或没有旋转,则可能需要重新给石英光学平面上油。
- 手动旋转板几次以涂抹油,然后就可以打开仪器了。
- 要设置阻抗计,请将盐水 (0.9% NaCl) 添加到灯芯(即参考线)上,然后将灯芯放在斜面上。用微量移液器浸泡丝带以形成电路,并用一层薄薄的盐水溶液覆盖板。
- 将引线段连接到连接到阻抗计的导线末端。
- 拨动阻抗计上的“on”(打开)开关,并保持“stand-by”(待机)状态,直到准备好开始斜切。因为我们要创建一个大开口,所以在准备斜面时将电极阻抗计设置为 x0.1。
- 要对拉出的微量移液器进行斜面处理,请使用带有电极阻抗计和 40 倍立体显微镜的微量移液器斜面器。
- 加载微量移液器和斜面
- 将微量移液器装入位于机械手上的移液器夹上,并在斜切时拧紧旋钮以将其固定到位。
- 通过微量移液器的后端,用生理盐水填充整个移液器,然后将导线插入微量移液器,确保微量移液器中没有气泡。已经注意到,微量移液器中存在气泡会导致测量的可变性。
- 通过从 “stand-by” 切换到 “x0.1” 来打开阻抗计。电阻最初应为 100 MΩ,当微量移液器吸头接触盐水时,它应显示不同的读数。
- 为了斜切正确的吸头开口尺寸,在降低微量移液器之前,将机械手上的角度调整到 35°,以实现一致的斜切。30° 角也足够,但在两者之间,35° 的标准偏差较低,因此斜切更一致,尖端断裂更少。
- 使用机械手,将微量移液器吸头放置在距离研磨板旋转中心约三分之二的位置。
- 使用粗调旋钮,将微量移液器降低到靠近板的位置,使微量移液器吸头接近盐水溶液。如果没有可用的摄像头,请务必向下观察显微镜以查看尖端的斜面。
- 一旦微量移液器吸头与盐水接触,阻抗计读数应从 100 MΩ 降至 80 至 20 MΩ 范围内的值。此值会因拉动的玻璃开口而异。
- 此时,从粗调旋钮切换到微调旋钮,以更缓慢地降低移液器,以避免折断板上的吸头。在这个坡口阶段同时监测阻抗计和尖端非常重要。
- 斜切时,观察尖端大小的变化,并使用照明来帮助在斜切时创建良好的有利位置。
注意: 当发生斜面时,尖端会变得非常有光泽,并且尖端开口会变得更大。在此阶段,必须使用机械手上的微调旋钮来降低或升高微量移液器。将微量移液器从板上提起后,将其放回板中可能会导致吸头断裂。 - 继续缓慢降低尖端,直到它到达斜面板,然后慢慢倾斜,直到达到大约 20 MΩ 的电阻。掌握此过程将是一个强大的学习曲线,需要练习始终如一地斜切尖端。
- 当电阻达到 20 MΩ 时,从斜口器中抬起微量移液器。
- 从微量移液器中取出导线,然后从斜口器中取出微量移液器。如果留在斜口机上,微量移液器可能会破裂或在其尖端产生更大的开口;因此,在坡口时必须监控仪表和尖端。
注意:协议可以在此处暂停。 - 将斜面微量移液器放在微量移液器支架上,并使用显微镜软件上的 10 倍物镜测量吸头开口尺寸。10 个尖端的样品量足以检查所有斜面尖端的一致性。
- 拍摄照片前,请确认显微镜设置 (10x) 与相机设置匹配。在针尖开口测量后,可能会丢弃异常值。
- 要关闭坡口器,请将驱动带电机和阻抗计上的开关转到“关闭”位置。
- 拧下底座/研磨板以卸下上固定环。当基座/研磨板相互连接时,不要抬起它们,因为它可能会因产生的真空而破裂。
- 用螺钉提起附件的上固定环后,将细磨板滑下,然后提起最后一个磁性附件以将其卸下。用实验室湿巾去除石英光学平面上多余的油。
- 用去离子 (DI) 水清洁所有三个组分并拍干以避免形成盐晶体。长时间使用后,旋转的磁性底座可能会出现抽搐。如果发生这种情况,请在传动带上喷洒少量去离子水以去除任何结晶盐。
- 擦去研磨板背面以及石英光学平面上多余的油。
- 在坡口机上使用去离子水去除仪器上可能存在的多余盐水,以避免结晶。
- 使用去离子水清洗斜面尖端。如果尖端没有清洗,它们会结晶,但以后可以很容易地用去离子水洗掉。
- 将粘土放在板内并使用盖玻片以防止微量移液器受到污染。
- 在粘土上做凹痕以固定微量移液器。当准备好使用时,斜面尖端现在可以回填感兴趣的化合物并注射到蚯蚓的脉管系统中。对于该方案示例,使用造影剂、微泡作为感兴趣的化合物。
注意:协议可以在此处暂停。
2. 使用斜面尖端进行显微注射器校准
- 准备疏水涂层板。
- 前一天,在两块板的表面涂上疏水涂层,以过夜固化。这种化学品应来自商店购买的材料或内部实验室材料(如果有),并且至少需要 12 小时固化。
- 涂层是一个快速的两步过程。喷涂底漆,然后喷涂面漆。
- 在通风橱中或开放空间中,一旦混合球发出嘎嘎声一分钟,在剧烈摇晃底漆罐后,将底漆喷洒到板上。
- 在涂布板时,在距离表面约 6-12 英寸处喷涂底漆。这些通道由从右到左,然后是上下轻通道组成。在涂布板时保持摇晃,并确保不要过度喷涂,否则会降低产品性能。
- 等待 1-2 分钟,然后再涂上另一层底漆。虽然不是必需的,但如果需要,可以应用额外的涂层。
- 等待 30 分钟,让底漆干燥。
- 对面漆重复步骤 2.1.3 - 2.1.5。
- 一旦板固化过夜或至少 12 小时,板就可以填充矿物油了。在盘子中加入大约一半的矿物油。
- 将含有矿物油的板放在显微注射器载物台上。
- 将斜面尖端装入显微注射器上。
- 将显微注射器直接连接到实验室压缩空气喷嘴。该系统可以使用压缩的氮气瓶和压力调节器,但请注意,其他显微注射器系统可能需要不同的接口。
- 打开压缩空气,将低压空气管路调节器打开至 70 PSI,然后打开显微注射器。不要超过 80 PSI,因为系统无法处理超过 80 PSI。
- 使用带有金属针座针头的 1 mL 注射器,将水回填吸头。如果移液器的内径不同,则需要不同规格的金属针来容纳它。
- 回注水后,将微量移液器装入纵杆显微作器的针架上。可以使用不同的显微注射器和显微作器。
- 创建水泡以通过斜面微量移液器校准分液体积。
注意:在将任何化合物给药引入蚯蚓的脉管系统之前,必须校准显微注射器以确定适当的注射体积。- 在显微注射器上设置压力为 4 PSI 的参数,时间为 0.5 秒。超过这些参数会扭曲血管的大小,这是不利的,除非研究人员的目标是研究血管膨胀。
- 降低移液器吸头,直到它接近板的底部,但要小心不要折断板底部的吸头。尖端在矿物油中的含量越低,它在尖端上的粘度就越高,这可能会导致破损。
- 从板的边缘开始,以便在校准期间充分利用板。
- 就位后,踩下踏板,在油中分配水泡。
- 气泡可能一直粘在尖端上。要解决此问题,请沿与气泡相反的方向快速拉开板,使其与移液器吸头分离。
- 使用相机软件,测量气泡大小并计算体积。如果没有可用的照相机软件,可以使用替代软件。
- 创建 10 个气泡并测量平均气泡直径,以确定微量移液器将分配到蚯蚓脉管系统中的正确体积。
注意:如果研究人员对分配各种体积感兴趣,则可以纵压力和时间的参数;重复步骤 2.3.1 - 2.3.7。
3. 蚯蚓手术准备,以揭示感兴趣的特定蚯蚓脉管系统
- 蚯蚓的制备和测量
- 准备 10% 乙醇溶液,在手术前麻醉蚯蚓。
- 在两次实验之间,将蚯蚓放在装有土壤的 100 mL 烧杯中。
- 一次只将 5 - 10 条蚯蚓放在烧杯中,以防止蚯蚓因从冰箱到台式(4 °C 至 25 °C)的突然变化而干涸。
- 将蚯蚓放入 10% 乙醇中 30 分钟。如果蚯蚓在 30 分钟后仍在移动,请将其在乙醇溶液中再放置 5 分钟。
注意:有时蚯蚓由于其大小需要更多时间;因此,可能需要根据蚯蚓的大小调整乙醇中的时间,但不要超过一个小时。超过一个小时会伤害蚯蚓。 - 用水龙头水冲洗蚯蚓,以去除它产生的粘液和乙醇。
- 将蚯蚓放在纸巾上以去除多余的水分。
- 麻醉蚯蚓后,记录每条蚯蚓的重量 (g)、宽度 (mm)、长度 (mm) 和血管宽度 (μm)。在做任何切口之前,先测量蚯蚓的重量和尺寸,不要拉伸蚯蚓。
- 在显微镜下手术暴露血管后,使用相机软件测量血管的宽度。如果没有可用的相机软件,不锈钢微型尺就足够了,尽管它不如数字软件测量准确。
注意:根据感兴趣的血管,跳至步骤 3.2(腹血管)、3.3(背血管)、3.4(心脏顶视图)或 3.5(心脏侧视图)。
- 暴露蚯蚓脉管系统、腹侧血管(方法 1)
- 在外科手术过程中使用橡胶垫将蚯蚓固定下来,从而将感兴趣的血管暴露给研究人员。皮肤的深色部分应朝下。
- 要通过手术打开蚯蚓,请将其放在蚯蚓的背面,即蚯蚓较暗的部分,用刀片在皮肤上做一个约 1 毫米的小侧切口。这个小切口允许手术剪刀进入以创建一个长切口。
- 将蚯蚓皮钉在相距 33 毫米的位置,开一个 27 毫米的开口以露出血管,仅使用四个针脚即可正确露出血管。固定蚯蚓后,可以添加或移动图钉,以帮助纵蚯蚓的皮肤。
- 用手术剪刀切开一个切口,以到达其身体侧面的另一个针脚。通过向上推向皮肤,它可以防止对蚯蚓内部的任何损害,例如切割脉管系统或肠道。
- 切开切口后,先固定或重新固定第一个切口的位置,然后在切口结束时固定或重新固定。
- 使用两种手术工具(手术夹具),移动皮肤以露出蚯蚓的内部。
- 当皮肤移动时,将底部的皮肤固定下来,在蚯蚓向上移动的同时,继续小心地将皮肤与器官分开。到达顶部后,放置最后一个图钉。
- 如果血管没有暴露在外,拉扯蚯蚓皮肤的相对两侧,以分离蚯蚓的弹性组织,从而暴露腹侧血管并进一步分离皮肤。
注意:这种拖拽会去除一些将蚯蚓体内器官固定的组织。请小心此步骤,因为它可能会无意中使蚯蚓的血管破裂。现在应该暴露腹血管,神经脊髓可以作为血管的标志物,因为神经脊髓沿着皮肤延伸,紧挨着腹血管并平行于腹血管。如果腹侧血管靠近肠道,拉扯皮肤会进一步暴露血管。如果没有,请将内脏推到一边,但这可能会导致工作区域凌乱。
- 暴露蚯蚓脉管系统、背血管(方法 2)
注意:暴露背血管的步骤与腹侧血管暴露相似。- 重复步骤 3.2 的步骤 3.2.1 - 3.2.3。在这些步骤中,皮肤的深色部分应朝上。
- 用手术剪刀将蚯蚓的中间切向另一侧。
- 从蚯蚓的中间开始,向蚯蚓的前部,即头部切开一个切口。向上推向皮肤可防止对蚯蚓内部造成任何损伤,例如割伤血管或肠道。
- 一旦进行了对角线切割,就固定或重新固定第一个切口的部位,然后在所做切口的末端。
- 重复步骤 3.2.6 中的步骤 3.2.6 - 3.2.9。
注意:现在应该暴露背血管。
- 暴露蚯蚓脉管系统,心脏俯视图(方法 3)
- 在外科手术过程中使用橡胶垫将蚯蚓固定下来,从而将感兴趣的血管暴露给研究人员。
- 要通过手术暴露蚯蚓,请将其放置在蚯蚓的腹侧,即蚯蚓的较轻部分。皮肤的深色部分应朝上。
- 使用四个销钉压住蚯蚓的皮肤,并创建一个窗口来露出感兴趣的心。一个额外的销钉,总共五个,可用于将蚯蚓压在靠近其头尖(前端)的位置。
- 开始从下到上固定蚯蚓,从右侧开始,然后移动到左侧。固定蚯蚓,在靠近头尖的顶部、前端放置两个针,在附近放置两个针。
- 用刀片在蚯蚓的侧面做一个约 1 毫米的小切口。
- 用手术剪刀将蚯蚓的中间切向另一侧。
- 从蚯蚓的中间开始,向蚯蚓的前部切开,直到到达蚯蚓的嘴,即前端。
注意:重要的是将剪刀抬起靠在皮肤上,以避免割伤脉管系统;当您穿过皮肤时,可以看到剪刀刀片。确保切开蚯蚓的前端,因为这样可以更好地看到心脏。 - 固定后,如果皮肤卷曲到蚯蚓中,请重新固定蚯蚓。
- 拉扯以适当分离蚯蚓的组织,以适当地暴露心脏。
- 如果心脏没有暴露,请四处移动白色精囊,因为心脏有时会隐藏在这些囊泡下面。
注意:心脏暴露可能因蚯蚓而异,所有 10 颗心可能都可见或只有一半可见,依此类推。此时,研究人员必须确定是否移动器官和组织以定位蚯蚓的心脏。
- 暴露蚯蚓脉管系统,心脏侧视图(方法 4)
- 在外科手术过程中使用橡胶垫将蚯蚓固定下来,从而将感兴趣的血管暴露给研究人员。
- 要通过手术暴露蚯蚓,请将其侧放。由于蚯蚓是侧着的,因此蚯蚓的亮面和暗面都应该可见。
- 重复步骤 3.4 中的步骤 3.4.3 - 3.4.9。
- 如果心脏没有暴露,请四处移动白色精囊,因为心脏有时会隐藏在这些囊泡下面。
注意:心脏暴露可能因蚯蚓而异,所有五个心都可能可见或更少。此时,研究人员必须确定是否移动器官和组织以定位蚯蚓的心脏。
4. 化合物给药到蚯蚓脉管系统
- 准备蚯蚓进行化合物给药
注意:对于这些特定步骤,我们将造影剂、微泡作为感兴趣的化合物注入蚯蚓脉管系统。- 在显微注射之前,将蚯蚓放在显微注射台上,并使用实验室擦拭擦去感兴趣血管周围的任何液体,从而暴露出脉管系统进行注射。
注意:不要施加强力压力,因为这会导致血管出血。 - 将感兴趣的脉管系统与微量移液器对齐,因为腹侧血管对齐以进行注射很重要。如果对心感兴趣,它们必须垂直于微量移液器。
- 将显微镜聚焦在感兴趣的脉管系统上,并开始将微量移液器降低到脉管系统。在移动任何纵杆纵器之前,请确认它们都设置为 0 毫米,以确保最佳移动性。
- 当微量移液器的尖端与蚯蚓血管接触时,确保容器与微量移液器之间的角度小于 15°。
- 一旦微量移液器开始对血管施加压力,由于脉管系统上的压力,血液将从尖端移走。这很好地表明注射位置正确。
- 为确保注射成功,使用纵杆向前移动微量移液器以接触脉管系统。
注意:重要的是不要刺穿血管。请注意,尖端应沿微量移液器移动的方向移动背侧和腹侧血管的脉管系统,然后应使用粗拨盘将微量移液器尖端向前移动,以允许完全渗透到血管中。如果板是可移动的,则可以用于将容器移动和刺穿到微量移液器中,而不是使用微控制器或同时使用所有作。血管不会立即被穿透,但血管的后坐力是微量移液器正确穿透的指标。一旦尖端穿透血管,容器应保持笔直并与微量移液器对齐。如果不是,则使用精细控制慢慢缩回微量移液器。 - 踩下踏板,注入蚯蚓的脉管系统。踩下踏板后,血液稀释是正确插入的另一个指标。
- 慢慢缩回微量移液器并将微量移液器拉开。
注意:或者,当微量移液器仍在容器中时折断吸头是避免失血的有效方法。
- 在显微注射之前,将蚯蚓放在显微注射台上,并使用实验室擦拭擦去感兴趣血管周围的任何液体,从而暴露出脉管系统进行注射。
结果
以下代表性结果基于一组特定参数,其中包括用于拉动玻璃移液器的设置、由给定斜面角度形成的移液器开口尺寸以及显微注射的压力和时间。 在图 1 中,显示了一个流程示意图,表示从开始到结束的过程。
根据所选的移液器拉拔器参数,以下尖端将从拉动中出现(图 2)。值得注意的是,RAMP 值可能会因玻璃的类型甚至灯丝的位置而变化。如果参数可接受,则生成的尖端将很坚固,斜切时具有较长的锥度。如果尖端因拉扯而折断,则必须重新调整拉拔器。
对于微量移液器的斜切,测试了六个斜切角度,以确定最佳角度,评估斜切的一般难易程度,并检查角度如何影响吸头开口尺寸。我们的坡口标准的最佳角度被确定为 35°,因为它提供了一个尖锐的尖端,它足够坚固,可以穿透容器而不会破损,并且具有高度可重复性。通常,角度越小,尖端越尖锐,如图 3 所示。另一个关注角是 30°,它更清晰,但由于其可重复性,选择了 35°。如图 4 所示,显微作器的角度会改变尖端的形状和开口大小。如图所示,最准确和一致的坡口发生在 30° 和 40° 之间的角度。根据坡口的难易程度创建了一个补充表(表 S1),但需要注意的是,坡口技术因人而异,因此尖端也各不相同。进一步指出,当显微作器下降得太快或玻璃变得太脆时,可能会出现不成功的斜面,从而导致尖端破损。
对于给定的枪头尺寸,必须在化合物进样前进行校准。注射量取决于针尖尺寸、显微注射压力和注射时间。例如,在 图 5 中,绘制了 24.4 μm 吸头的代表性体积分配。数据揭示了在固定注射时间内,分配体积和压力之间呈近似线性关系。对于特定的针尖设计,应确定类似的自定义校准数据。
在微血管注射过程中,有必要进行目视检查以确认给定产品注射成功。最明显的标志物是血液的稀释。如 补充视频 和 图 6 所示,血液稀释后变得更清澈,这是注射成功的标志。至关重要的是,微量移液器不会太深地穿透血管,并且显微注射不会与血管成大于 15° 的角度进行,否则当移液器被拉出时,由于大伤口,感兴趣的化合物会从其脉管系统中流出。成功的注射和拉动将导致移除时出血最少。
图 1:整体方法的流程。 对于蚯蚓脉管系统的显微注射,首先需要拉动移液管以在尖端实现微开口。然后对微量移液器尖端进行斜面处理,以获得锋利的针尖。一旦达到开口,微量移液器就会校准以获得适当的分配体积。校准后,即可完成对脉管系统的注射。 请单击此处查看此图的较大版本。

图 2:成功拉动微量移液器。 根据协议中使用的参数,此 tip 将在拉取后出现。(A) 演示拉动移液器后立即作。(B) 拉动同一移液器的特写图像。 请单击此处查看此图的较大版本。

图 3:微量移液器吸头斜面角度曲线。 测试了六个角度的斜面。从 45° 减小角度到 20°,锐度和尖端开口增加。 请单击此处查看此图的较大版本。
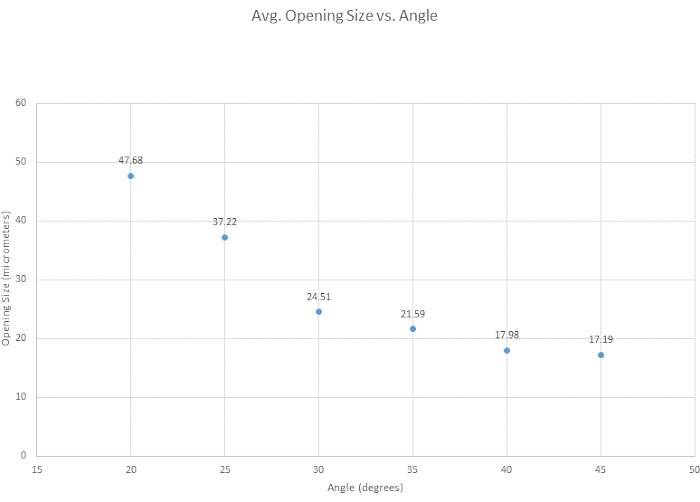
图 4:针尖开口随着角度的增加而变窄。 测试了 6 个角度,以了解角度如何影响针尖开口尺寸。尖端开口尺寸随着斜面角度的增加而减小。 请单击此处查看此图的较大版本。

图 5:卷管理的校准。 其代表性结果使用 24.4 μm 针尖尺寸的开口,以使用时间和压力的特定参数表示数据。随着压力的增加,分配的体积增加,而随着时间的推移,分配的体积减少。 请单击此处查看此图的较大版本。

图 6:注射到腹侧血管。 以血液稀释为指标,展示了注射成功的视觉。此面板附带了补充视频。 请单击此处查看此图的较大版本。
图 S1:蚯蚓的血液和尿液提取装置。 请点击此处下载此文件。
图 S2: 图 4 的标准差。 根据角度,标准差会发生变化。35° 保持较低的标准偏差,因此坡口更一致,尖端断裂更少。30° 也很好,35° 也很好,如表 S1 所示。请点击此处下载此文件。
图 S3:展示了蚯蚓在手术后使用液体创可贴闭合蚯蚓的存活率。 请点击此处下载此文件。
表 S1:易于坡口的描述性表。 使用三种模式来描述坡口的难易程度,从简单到中等和困难。值得注意的是,测试了 15°,但它的角度太小,无法产生不会碎裂的微量移液器吸头。请点击此处下载此表格。
补充视频。请点击此处下载此视频。
讨论
当蚯蚓在 10% 乙醇中时,特别是如果蚯蚓年龄较大,暴露时间超过 30 分钟可能会产生不良影响;肠道会开始恶化,当蚯蚓通过手术打开时,它的内肠会展开。因此,鼓励使用年轻到中年的蚯蚓。在切开蚯蚓皮肤的过程中,必须不要进行完全的剪刀式切割,这意味着研究人员必须只剪掉一半并继续向前推动剪刀,直到到达终点。固定蚯蚓时,注意不要拉长蚯蚓或拉得太用力。这可能会导致血管破裂,从而导致出血。每次注射后,通过分配微量移液器内部可能存在的任何液体来检查微量移液器是否堵塞,尤其是在进行另一次注射之前去除吸头上的血液。除了观察吸头是否堵塞外,每次注射后还要查看微量移液器的吸头以检查吸头是否破损。微量移液器的尖端也可能折断,将尖端留在原位以避免任何失血。在显微注射过程中仔细观察血管组织很重要。当微量移液器首次与容器接触时,容器组织会粘附在微量移液器吸头上。一旦尖端成功穿透血管,就可以看到血管组织迅速滑入尖端,显微镜作器也会感觉到。注射成功后,小心地将微量移液器拉出很重要,因为微量移液器最终可能会深入组织或在注射部位形成更大的伤口,这可能导致化合物给药从血管中泄漏。通常,当血管直径为 90 μm 或更大时,注射成功,但研究人员可以通过缩小微量移液器吸头尺寸来改善这种情况。蚯蚓始终用水保持湿润,以避免蚯蚓脱水,但建议使用盐水溶液。
蚯蚓生存研究
进行了蚯蚓生存实验,以深入了解实验后蚯蚓可以存活多长时间。将蠕虫浸入 10% 乙醇溶液中,然后手术切割和注射后,就像在实验期间一样,通过液体创可贴溶液将 27 条蠕虫“缝合”起来,并在实验后长达 48 小时内观察。术后 12 小时,大约 67% 的蠕虫仍然活着。术后 24 小时,约 48% 的蠕虫仍然存活。术后 36 小时,约 44% 的蠕虫仍然存活。最后,在术后 48 小时,大约 22% 的蠕虫仍然存活。这些实验的结果表明,大多数蠕虫在经过实验手术和注射后可以存活整整 12 小时,并且大量蠕虫的存活时间甚至更长(图 S3)。如果需要,这为每条蠕虫提供了进行长达 24 小时研究的机会。
蚯蚓实验室护理
蚯蚓是加拿大夜行者,是从 Windsor Wholesale Bait 商店购买的,并以 500 条大蚯蚓的形式装在聚苯乙烯泡沫塑料盒(35w x 38l x 30d cm)中交付,并保存在冰箱中,因为单个蠕虫被取出并用于实验。如蚯蚓制备方案步骤中所述,由于蚯蚓蒸发,一次使用不超过 10 条蚯蚓,这可能导致脱水16。此外,蚯蚓的光照受到限制,因为它们的皮肤上含有感光细胞;光照超过两小时可导致死亡。到达后,立即更换集装箱土壤,让蚯蚓静置 24 小时,然后再用于实验。这确保了蚯蚓重新通电,不再因运输而疲劳。此时,就可以开始对蚯蚓进行实验了。
蚯蚓的寿命是未知的,但如果每天监测并给予正确的营养,它们可以在实验室环境中长时间存活。每两周,应在容器中添加新土壤,为蚯蚓提供更多养分。蚯蚓是一种深穴无脊椎动物,会挖出深达 180 厘米(6 英尺)的洞穴,因此容器中必须至少有 1 英尺的土壤可供 500 条蚯蚓使用。在容器的底部,可以添加旧报纸,因为这是一些蚯蚓会在这里安家。更换土壤后,建议检查气味并发现任何受伤或死亡的蚯蚓。不要将死亡或受伤的蚯蚓留在容器中,因为它们会污染土壤并在您的蚯蚓群落中造成更多死亡。
未来应用
在该协议中,介绍了使用蚯蚓进行高通量血液实验的准备和程序。虽然仅限于循环系统,但此处描述的注射方法可能会扩展到涉及神经系统的研究,因为蚯蚓的神经索与腹血管平行。例如,先前使用蚯蚓的研究已被研究用于治疗性超声应用的神经调控和血管破裂研究18,19。有了这种新设置,可以进行进一步深入的超声 + 微泡研究,以扩展神经调控和血管破裂研究。
此外,蚯蚓的腔腔可用于研究免疫系统,因为存在于腔腔中的液体介导了大多数(如果不是全部)免疫反应。蚯蚓的独特之处在于动物体内只存在两种液体,每种液体都包含在单独的腔内,血管中的血液和腔腔中的体液。这种液体分离允许在两个腔中进行特定类型的研究。例如,体腔液中充满了许多体腔细胞,其免疫功能与大多数其他动物模型的体腔细胞具有共同的特征。可以在蚯蚓中对吞噬细胞和其他可以破坏细胞靶标的类似细胞进行研究,并且蚯蚓可能还有许多其他研究应用,可以用作替代无脊椎动物模型。
虽然蚯蚓缺乏对人体解剖和生理系统的许多方面进行建模的复杂性,但显微注射提供了一个封闭的循环系统,其中包含在血红蛋白结构方面与人类血液惊人相似的血液。在可接受小血量的应用中,蚯蚓提供了一种低成本、现成的检测平台,免于机构动物护理和使用委员会。因此,可以用各种化合物对蚯蚓进行重复测试,并且样本量可能远远超过使用标准实验室脊椎动物的实际量。
披露声明
作者没有什么可披露的。
致谢
这项工作由 NSF-FDA 常驻学者奖学金 (NSF-FDA SIR, #1641221)、美国食品和药物管理局办公室首席科学家挑战补助金 (FDA OCS)、美国国家科学基金会综合研究生教育和研究实习生 (NSF IGERT, #1144646) 资助,并得到美国食品和药物管理局 (FDA) 科学与工程实验室办公室 (OSEL) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 3M Vetbond Tissue Adhesive | 3M Vetbond | 084-1469SB | 3mL bottle vet adhesive - liquid band-aide |
| 40x Stereo Microscope | Sutter Instrument Co. | BV-10-D | Not needed, can add on other scopes |
| 500 Large Worms | Windsor Wholesale Bait | 500 Large | |
| Beveler pedestal oil | Sutter Instrument Co. | 008 | |
| Blades | Ted Pella, Inc | 121-2 | |
| Borosilicate Glass with Filament | Sutter Instrument Co. | BF150-86-10 | |
| Camera | AmScope | MU500 | |
| Camera | AmScope | MU1803-CK | 8MP USB3.0 Microscope Digital Camera |
| Electrode Impedance Meter | Sutter Instrument Co. | BV-10-C | |
| Ethanol | Sigma Aldrich | E7023-1L | Pure ethanol |
| Filament | Sutter Instrument Co. | FT315B | trough filament |
| Grinding Plate | Sutter Instrument Co. | 104D | Fine Plate |
| Hospital Grade Saline | Baxter Healthcare Corporation | 2F7124 | 0.9% Sodium Chloride Irrigation |
| Joystick Micromanipulator | Narishige | MN-151 | |
| KimWipes Kimtech Science | Kimberly-Clark Professional | 34155 | |
| Leafgro | LeafGro | 589252 | 1.5-cu. ft. |
| Metal Hub Needle | Hamilton | 91024 | Luer Lock Metal Needle |
| Micro Vessel Clips | WPI | 501779-G | |
| Microinjector | TriTech Research | MINJ-D | |
| Micropiette Puller Model P-97 | Sutter Instrument Co. | P-97 | |
| Micropipette Beveler | Sutter Instrument Co. | BV-10-B | |
| Microscope | AmScope | SM-8TPW2-144S | 3.5X-225X Simul-Focal Articulating Microcope |
| Needle Holder | TriTech Research | MINJ-4 | |
| NeverWet | Rust-Oleum | NeverWet | |
| Pyrex Glass | Corning | 08747A | Fisher Manufacturer |
| Stainless Micro-Ruler | Ted Pella, Inc | 13635 | Micro-Ruler mounted on a Handle, 10mm scale, with lines at 0.01mm intervals |
| Surgical Grips | Ted Pella, Inc | 53073 | Forceps, Hemostat |
| Surgical scissors | Ted Pella, Inc | 1320 | Fine Iris Scissors, Straight |
| U.S.P. Mineral Oil Lubricant Laxative | Swan | Mineral Oil |
参考文献
- Stevenson, J. . The Oligochaeta. , 685 (1930).
- Reynolds, J. W., Reynolds, W. M. Earthworms in medicine. American Journal of Nursing. 72 (7), 1273 (1972).
- Gates, G. E. The earthworms of Rangoon. Journal of the Burma Research Society. 25, 196-221 (1926).
- Carr, L. G. K. Interesting animal foods, medicines, and omens of the eastern Indians, with comparisons to ancient European practices. Journal of the Washington Academy of Sciences. 41 (7), 229-235 (1951).
- Price, S. F. Kentucky folk-lore. The Journal of American Folklore. 14 (52), 30-38 (1901).
- Elmer, J., Palmer, A. F., Cabrales, P. Oxygen delivery during extreme anemia with ultra-pure earthworm hemoglobin. Life Sciences. 91 (17-18), 852-859 (2012).
- Eyambe, G. S., Goven, A. J., Fitzpatrick, L. C., Venables, B. J., Cooper, E. L. A non-invasive technique for sequential collection of earthworm (Lumbricus terrestris) leukocytes during subchronic immunotoxicity studies. Laboratory Animals. 25 (1), 61-67 (1991).
- Basley, K., Goulson, D. Effects of chronic exposure to clothianidin on the earthworm Lumbricus terrestris. PeerJ. 5, 3177 (2017).
- Mvumi, B. M., Gwenzi, W., Mhandu, M. G. Ecotoxicological effects of citrus processing waste on earthworms. Lumbricus terrestris L. Industrial Crops and Products. 110, 123-129 (2017).
- Furst, A. My saga with earthworms. Food and Chemical Toxicology. 40 (6), 789-791 (2002).
- Cooper, E. L., Hrzenjak, T. M., Grdisa, M. Alternative sources of fibrinolytic, anticoagulative, antimicrobial and anticancer molecules. International Journal of Immunopathology and Pharmacology. 17 (3), 237-244 (2004).
- Cooper, E. L., Hirabayashi, K., Balamurugan, M. Dilong: food for thought and medicine. Journal of Traditional and Complementary Medicine. 2 (4), 242-248 (2012).
- Nagasawa, H., et al. Inhibition by lombricine from earthworm (Lumbricus terrestris) of the growth of spontaneous mammary tumours in SHN mice. Anticancer Research. 11 (3), 1061-1064 (1991).
- Shannon, K. M., Gage, G. J., Jankovic, A., Wilson, W. J., Marzullo, T. C. Portable conduction velocity experiments using earthworms for the college and high school neuroscience teaching laboratory. Advances in Physiology Education. 38 (1), 62-70 (2014).
- National Research Council. . A framework for K-12 science education: Practices, crosscutting concepts, and core ideas. , (2012).
- Ramsay, J. The Osmotic Relations of the Earthworm. Journal of Experimental Biology. 26 (1), 46-56 (1949).
- Mulloney, B. Structure of the Giant Fibers of Earthworms. Science. 168 (3934), 994-996 (1970).
- Kim, Y., Nabili, M., Acharya, P., Lopez, A., Myers, M. R. Microvessel rupture induced by high-intensity therapeutic ultrasound - a study of parameter sensitivity in a simple in vivo model. Journal of Therapeutic Ultrasound. 5 (1), 5 (2017).
- Wahab, R. A., et al. Mechanical bioeffects of pulsed high intensity focused ultrasound on a simple neural model. Medical Physics. 39 (1), 4274-4283 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。