Method Article
Lombriz, Lumbricus terrestris: un novedoso modelo de vasculatura de microinyección in vivo en invertebrados
En este artículo
Resumen
Las lombrices de tierra son un nuevo modelo de laboratorio in vivo de invertebrados para estudios de vasculatura. Presentamos técnicas y equipos que permiten una cirugía eficiente y microinyección en la vasculatura de la lombriz de tierra. Se describen los protocolos quirúrgicos, las técnicas de microinyección y el procedimiento para producir micropipetas a medida.
Resumen
Aunque los vertebrados son indispensables para la investigación biomédica, los estudios a menudo están limitados por factores como el costo, la revisión interna prolongada y las consideraciones éticas. Presentamos la lombriz de tierra como una alternativa de bajo costo para invertebrados aplicables a ciertos estudios preliminares de vasculatura. Debido a la disponibilidad quirúrgica de los vasos dorsales de la lombriz de tierra, los vasos ventrales y cinco pares de pseudo corazones, las lombrices de tierra son fácilmente accesibles, ofrecen un mantenimiento de bajo costo y requieren la administración de solo pequeñas dosis de un compuesto dado. El modelo de lombriz de tierra proporciona un sistema circulatorio vascular cerrado simple con una estructura de hemoglobina similar a la sangre humana. Se proporciona un protocolo para anestesiar las lombrices de tierra y realizar incisiones quirúrgicas para exponer los vasos sanguíneos relevantes. Las micropipetas para la administración de compuestos se forman calentando y tirando del vidrio con un extractor de pipetas y utilizando un sistema de biselado para crear una punta de aguja fina a escala micrométrica. A continuación, las puntas se utilizan con un microposicionador y un microinyector para inyectar compuestos arbitrarios en el sistema vascular de una lombriz de tierra, de forma repetida, con la disponibilidad de grandes tamaños de muestra y pequeños volúmenes de compuestos. Se proporcionan detalles sobre las complejidades del procedimiento de inyección. El pequeño tamaño de los vasos de la lombriz de tierra es un desafío, particularmente en el caso del vaso ventral; Sin embargo, el dominio de las técnicas presentadas ofrece una alta repetibilidad como una solución de bajo costo, lo que hace que los estudios de tamaño de muestra muy grande sean prácticos.
Introducción
La lombriz de tierra se ha utilizado como un importante bioindicador y bioensayo para aplicaciones científicas previas 1,2,3,4,5,6; Es un organismo ideal para evaluar los riesgos biológicos de los residuos peligrosos y tóxicos en ambientes terrestres para estudios in situ y de bioacumulación, como biocidas (insecticidas) en el suelo y efectos ecotoxicológicos adversos 7,8,9,10. Además, debido a la bioprospección, la lombriz de tierra es una fuente alternativa de moléculas fibrinolíticas, anticoagulantes, antimicrobianas y anticancerígenas11,12; hasta el punto de que un equipo en 1991 extrajo y purificó lumbricina de la piel de la lombriz y la colocó en tumores mamarios de ratones SHN, lo que condujo a la inhibición del crecimiento tumoral13. La lombriz de tierra también es un modelo animal pedagógicamente útil, ya que se puede utilizar para exponer a los estudiantes a la cirugía y a la comprensión de la anatomía de un espécimen; Del estudio de la circulación sanguínea a la electrofisiología14,15.
En nuestra propia investigación hemos examinado la respuesta de los vasos de lombrices de tierra vivas a los ultrasonidos de alta intensidad18. Encontramos que la ruptura de vasos en el gusano ocurrió en condiciones similares a las que asociamos en el daño por ruptura en microvasos humanos. Nuestro trabajo en curso consiste en la inyección de microburbujas en la vasculatura de la lombriz de tierra. Las microburbujas están compuestas por un gas pesado recubierto por una capa de lípidos, albúmina o polímero, estos agentes se pueden utilizar como agentes de contraste de imagen, así como vehículos para la administración dirigida de fármacos.
Este nuevo protocolo es relevante para cualquier estudio que se beneficie de la inyección intravenosa (IV) de un compuesto que podría utilizar los bioindicadores naturales de la lombriz de tierra. El enfoque se basa en la microinyección intravenosa en uno de varios puntos de entrada posibles, incluido cualquiera de los pseudo corazones de cinco pares de lombrices de tierra, el vaso dorsal y el vaso ventral. El procedimiento consiste en una incisión quirúrgica elaborada para exponer los vasos, seguida de una inyección controlada por microposicionador. Esto se logra utilizando micropipetas personalizadas construidas específicamente para la microinyección vascular de lombrices de tierra. Estas micropipetas permiten el apuntado preciso de vasos tan pequeños como un vaso ventral de 90 μm de diámetro.
Este protocolo está diseñado para mejorar las técnicas anteriores de micropipeteo, incluido un estudio de 1948 para la extracción de sangre y orina de lombricesde tierra 16. Como se ve en la Figura S1, la configuración de esta extracción puede ser difícil y, según lo declarado por el autor, puede tardar hasta una hora o más. Un método similar se desarrolló en 1970, pero el autor experimentó múltiples puntas rotas mientras inyectaba fluidos en las fibras gigantes de la lombrizde tierra 17. En el método actual que se describe a continuación, la extracción de sangre es cuestión de segundos a minutos y es relevante tanto para la inyección de compuestos como para la extracción de fluidos de lombrices de tierra. En este caso concreto, inyectamos agentes de contraste, microburbujas.
Protocolo
1. Preparación de la micropipeta: extracción del vidrio y punta de biselado
- Extracción de micropipetas
- Encienda el extractor de micropipetas y seleccione un programa para introducir parámetros específicos para la microinyección de lombrices.
- Establezca los parámetros en Presión = 500, Tracción = 75, Tiempo = 250, Calor = 336 y Velocidad = 70. Los resultados pueden variar de un tirón a otro; Por lo tanto, experimente con los parámetros para lograr la punta deseada (tamaño, nitidez, forma, etc.).
- Asegúrese de realizar una prueba RAMP para determinar el valor calorífico de las micropipetas antes de extraerlas, ya que de lo contrario podría quemarse el filamento del canal o romper el vidrio.
- Si es necesario cambiar la presión de aire, presione el botón de borrar, seleccione no (0) cuando se le pida que borre todos los valores y seleccione cambiar presión (2). Este proceso puede variar de un tirador a otro; Por lo tanto, consulte el manual del instrumento para cambiar los ajustes de presión.
- Abra la tapa del extractor de micropipetas y cargue una micropipeta en el extractor. El vidrio de micropipeta utilizado fue de vidrio de borosilicato con pipeta de filamento: 10 cm de longitud, diámetro exterior: 1,5 mm y diámetro interior: 0,86 mm.
- Deslice la pipeta en la ranura en V desde la derecha a lo largo de la ranura de la pipeta hasta que el extremo de la pipeta se alinee con el extremo del soporte de la pipeta. Para asegurarse de que la pipeta pueda desplazarse a través del filamento hasta el lado opuesto, empuje la pipeta lo más lejos posible mientras se asegura de que permanezca apoyada en la ranura de la pipeta.
- Para bloquear la pipeta, apriete el pomo del lado derecho y deslice el sistema de bloqueo junto con la pipeta hasta que llegue al otro lado del extractor a través del filamento. Por último, bloquee el lado izquierdo de la pipeta con respecto al extractor. La pipeta debe estar en el centro del filamento; Consulte el manual para obtener instrucciones sobre cómo alinear correctamente la pipeta.
- Una vez que la pipeta esté cargada, cierre el extractor, presione el botón de extracción y espere hasta que se tire de la pipeta antes de retirar las dos pipetas resultantes.
- Afloje las perillas para quitar las pipetas y tenga cuidado de no cortarlas durante la extracción de la ranura.
- Coloque las micropipetas extraídas en un soporte de micropipeta o en algún tipo de soporte para sujetar la micropipeta en su lugar y permitir una fácil rotación sin romper las micropipetas extraídas. Hemos desarrollado nuestro propio soporte para micropipetas que puede crearse en un taller mecánico o incluso imprimirse en 3D.
NOTA: El protocolo se puede pausar aquí. - Coloque el soporte de micropipetas debajo del microscopio y utilice un programa de cámara, o un software similar, para capturar una imagen de las micropipetas extraídas y registrar el diámetro de la punta con un aumento de 10x ~1000 mm y ~50 mm desde la punta.
- Antes de capturar una imagen, asegúrese de que la configuración de la cámara coincida con la configuración del microscopio (10x), para medir con precisión, especialmente para las mediciones posteriores a la imagen. La configuración 10x se encuentra en la cinta de herramientas horizontal ubicada cerca de la parte superior de la pantalla.
- Para ver y capturar una imagen de la micropipeta, seleccione la cámara en el software de la cámara ubicado en la esquina superior izquierda y presione el botón Snap después de enfocar la punta para obtener una lectura precisa. El botón Ajustar se encuentra en la barra de herramientas horizontal en el lado izquierdo de la página, debajo de la pestaña de la cámara.
- Tome medidas de las micropipetas extraídas para determinar si se han logrado el tamaño y la consistencia deseados de la punta. Extraer hasta 5 pipetas es suficiente para determinar si el extractor y sus parámetros producen constantemente el tamaño deseado. Si no se ha alcanzado el tamaño de punta deseado, o si el tamaño sigue variando según la pipeta, es posible que el investigador tenga que experimentar con diferentes ajustes hasta que se haya alcanzado el tamaño de punta deseado, o puede ser necesario fijar la colocación del filamento y la pipeta, lo que puede requerir la referencia del manual del extractor de pipetas.
NOTA: El protocolo se puede pausar aquí.
- Configuración para biselar la micropipeta y uso del medidor de impedancia de electrodo
- Para biselar las micropipetas extraídas, utilice un biselador de micropipetas con un medidor de impedancia de electrodo y un microscopio estereoscópico de 40x.
NOTA: Se pueden utilizar otras biseladoras; Incluso las biseladoras internas tienen éxito, además de que se pueden lograr diferentes configuraciones con diferentes microscopios para examinar el proceso de biselado, incluido el montaje de una cámara en el microscopio. - Ensamble el pedestal/placa de molienda con la placa fina entre los dos soportes negros.
- Coloque la placa inferior con los imanes en dirección opuesta a la placa.
- Atornille las tres partes juntas: (1) el anillo de retención superior, (2) la placa fina de molienda y (3) el anillo de retención inferior (magnético). Identifique la superficie abrasiva de la placa de molienda; Para la placa fina, es de color púrpura y debe estar hacia arriba para que el vidrio esté en contacto con el cuarzo óptico plano.
- Coloque cinco gotas de aceite de pedestal biselado, o tantas como sean necesarias, en el plano óptico de cuarzo del instrumento de biselado y coloque la placa ensamblada encima. Este aceite puede durar todo el día, pero si la placa se sacude o no gira cuando debería, es posible que sea necesario volver a engrasar el plano óptico de cuarzo.
- Gire la placa manualmente unas cuantas veces para esparcir el aceite y luego se puede encender el instrumento.
- Para configurar el medidor de impedancia, agregue solución salina (0.9% NaCl) en la mecha, que es el cable de referencia, y coloque la mecha en la placa de biselado. Remoja la cinta para hacer un circuito con la micropipeta y cubre la placa con una fina capa de solución salina.
- Conecte el segmento de cable al extremo del cable que está conectado al medidor de impedancia.
- Encienda el interruptor de "encendido" en el medidor de impedancia y déjelo en "espera" hasta que esté listo para comenzar a biselar. Debido a que estamos creando una gran abertura, configure el medidor de impedancia del electrodo en x0.1 cuando esté listo para biselar.
- Para biselar las micropipetas extraídas, utilice un biselador de micropipetas con un medidor de impedancia de electrodo y un microscopio estereoscópico de 40x.
- Carga de la micropipeta y biselado
- Cargue la micropipeta en la abrazadera de pipeta que se encuentra en el manipulador y apriete la perilla para mantenerla en su lugar mientras bisela.
- A través del extremo posterior de la micropipeta, llene toda la pipeta con solución salina e inserte el cable en la micropipeta, asegurándose de que no haya burbujas de aire en la micropipeta. Se ha observado que la presencia de burbujas de aire en la micropipeta provoca variabilidad en las mediciones.
- Encienda el medidor de impedancia cambiando de "stand-by" a "x0.1". La resistencia debe ser inicialmente de 100 MΩ y cuando la punta de la micropipeta toque la solución salina, debe mostrar una lectura diferente.
- Para biselar el tamaño correcto de la abertura de la punta, antes de bajar la micropipeta, ajuste el ángulo a 35° en el manipulador para lograr un biselado uniforme. Un ángulo de 30° también es suficiente, pero entre los dos, 35° tiene una desviación estándar más baja, por lo que es más consistente en el biselado y la punta se rompe menos.
- Con el manipulador, coloque la punta de la micropipeta aproximadamente a dos tercios del centro de rotación de la placa de molienda.
- Con la perilla de ajuste grueso, baje la micropipeta cerca de la placa para que la punta de la micropipeta se acerque a la solución salina. Si no hay una cámara disponible, es importante mirar hacia abajo en el microscopio para ver el biselado de la punta.
- Una vez que la punta de la micropipeta entra en contacto con la solución salina, la lectura del medidor de impedancia debe disminuir de 100 MΩ a un valor en el rango entre 80 y 20 MΩ. Este valor variará debido a la abertura del vidrio extraído.
- En este punto, cambie de la perilla de ajuste grueso a la perilla de ajuste fino para bajar la pipeta más lentamente y evitar romper la punta de la placa. Es importante monitorear el medidor de impedancia y la punta simultáneamente en esta etapa de biselado.
- Mientras bisela, observe cómo cambia el tamaño de la punta y use la iluminación para ayudar a crear un buen punto de vista mientras bisela .
NOTA: La punta se volverá extremadamente brillante a medida que se produzca el biselado, y la abertura de la punta se hará más grande. Es imprescindible utilizar la perilla de ajuste fino del manipulador para bajar o subir la micropipeta en esta etapa. Una vez que la micropipeta se ha levantado de la placa, volver a bajarla a la placa puede hacer que la punta se rompa. - Siga bajando la punta lentamente hasta que llegue a la placa de biselado y bisele lentamente hasta alcanzar una resistencia de aproximadamente 20 MΩ. El dominio de este proceso será una fuerte curva de aprendizaje y requerirá práctica para biselar la punta de manera consistente.
- Cuando se alcance una resistencia de 20 MΩ, levante la micropipeta de la biseladora.
- Retire el cable de la micropipeta y descargue la micropipeta de la biseladora. Si se deja en la biseladora, la micropipeta puede romperse o crear una abertura más grande en su punta; Por lo tanto, es esencial controlar el medidor y la punta mientras se bisela .
NOTA: El protocolo se puede pausar aquí. - Coloque la micropipeta biselada en el soporte de la micropipeta y utilice el objetivo 10x del software del microscopio para medir el tamaño de la abertura de la punta. Un tamaño de muestra de 10 puntas es adecuado para comprobar la consistencia de todas las puntas biseladas.
- Confirme que la configuración del microscopio (10x) coincida con la configuración de la cámara antes de tomar una fotografía. Los valores atípicos pueden descartarse después de las mediciones de apertura de la punta.
- Para apagar la biseladora, gire el interruptor a "apagado" tanto en el motor de la correa de transmisión como en el medidor de impedancia.
- Desatornille el pedestal/placa de esmerilado para quitar el anillo de retención superior. No levante el pedestal/placa de molienda mientras estén unidos entre sí porque puede romperse debido al vacío creado.
- Después de levantar el anillo de retención superior del accesorio con los tornillos, deslice la placa de esmerilado fina y levante el último accesorio magnético para quitarlo. Retire el exceso de aceite en el plano óptico de cuarzo con toallitas de laboratorio.
- Limpie los tres componentes con agua desionizada (DI) y séquelos con palmaditas para evitar la formación de cristales de sal. Después de largos períodos de uso, la base magnética giratoria puede experimentar sacudidas. Si esto ocurre, rocíe una pequeña cantidad de agua desionizada en la correa de transmisión para eliminar la sal cristalizada.
- Limpie el exceso de aceite en la parte posterior de la placa de molienda, así como en el plano óptico de cuarzo.
- Utilice agua desionizada en la plataforma biseladora para eliminar cualquier exceso de solución salina que pueda haber en el instrumento para evitar la cristalización.
- Use agua desionizada para lavar las puntas biseladas. Si las puntas no se lavan, se cristalizarán, pero se pueden lavar fácilmente con agua desionizada más tarde.
- Coloque arcilla dentro de un plato y use el cubreobjetos para evitar que las micropipetas se contaminen.
- Haz hendiduras en la arcilla para sujetar las micropipetas. Cuando están listas para ser utilizadas, las puntas biseladas están listas para ser rellenadas con un compuesto de interés e inyectadas en la vasculatura de la lombriz de tierra. Para este ejemplo de protocolo, se utilizaron agentes de contraste, microburbujas, como compuesto de interés.
NOTA: El protocolo se puede pausar aquí.
2. Calibración de microinyectores con puntas biseladas
- Prepara un plato con recubrimiento hidrofóbico.
- El día anterior, cubra dos placas con un recubrimiento hidrofóbico en la superficie para que se cure durante la noche. Este producto químico debe provenir de materiales comprados en la tienda o de materiales de laboratorio internos, si están disponibles, y se necesitan al menos 12 horas para el curado.
- El recubrimiento es un proceso rápido de dos pasos. Rocíe con la capa base y luego rocíe con la capa superior.
- En una campana o en un espacio abierto, rocíe la capa base sobre la placa después de agitar vigorosamente la lata de capa base una vez que las bolas mezcladoras hayan sonado durante un minuto.
- Rocíe la placa con la capa base aproximadamente a 6-12 pulgadas de la superficie haciendo pasadas mientras cubre la placa. Los pases consisten en pases ligeros de derecha a izquierda y luego de arriba a abajo. Siga agitando a medida que la placa está cubierta y asegúrese de no rociar en exceso, ya que disminuirá el rendimiento del producto.
- Espere 1-2 minutos antes de aplicar otra capa de la capa base. Aunque no es necesario, se puede aplicar el recubrimiento adicional si se desea.
- Espere 30 minutos para que se seque la capa base.
- Repita los pasos 2.1.3 a 2.1.5 para la capa superior.
- Una vez que la placa se ha curado durante la noche o durante al menos 12 horas, la placa está lista para ser llenada con aceite mineral. Llene el plato aproximadamente hasta la mitad con aceite mineral.
- Coloque la placa con aceite mineral en la etapa del microinyector.
- Cargue las puntas biseladas en el microinyector.
- Conecte el microinyector directamente a un chorro de aire comprimido de laboratorio. Se puede utilizar un cilindro de nitrógeno comprimido y un regulador de presión para este sistema, pero tenga en cuenta que otros sistemas de microinyectores podrían requerir una interfaz diferente.
- Abra el aire comprimido y abra el regulador de la línea de aire de baja presión a 70 PSI y encienda el microinyector. No exceda los 80 PSI, ya que el sistema no puede manejar más de 80 PSI.
- Rellene las puntas con agua con una jeringa de 1 ml con una aguja de cubo de metal. Si el diámetro interior de la pipeta es diferente, se necesitará una aguja metálica de calibre diferente para acomodarla.
- Una vez que se haya llenado con agua, cargue la micropipeta en el soporte de la aguja del micromanipulador de joystick. Se pueden utilizar diferentes microinyectores y micromanipuladores.
- Cree burbujas de agua para calibrar el volumen de dispensación a través de una micropipeta biselada.
NOTA: Antes de que se introduzca cualquier administración de compuesto en la vasculatura de la lombriz de tierra, el microinyector debe calibrarse para determinar el volumen adecuado de inyección.- Ajuste los parámetros del microinyector para la presión a 4 PSI y el tiempo a 0,5 segundos. Exceder estos parámetros distorsionará el tamaño del vaso, lo cual es desfavorable, a menos que el objetivo del investigador sea estudiar la expansión del vaso.
- Baje la punta de la pipeta hasta que esté cerca del fondo de la placa, pero tenga cuidado de no romper la punta en la parte inferior de la placa. Cuanto más baja esté la punta en el aceite mineral, más viscosa será en la punta, lo que podría provocar roturas.
- Comience en un borde de la placa para hacer un uso completo de la placa durante la calibración.
- Una vez que esté en posición, presione el pedal para dispensar una burbuja de agua en el aceite.
- Es posible que la burbuja permanezca pegada a la punta. Para remediarlo, retire rápidamente la placa en la dirección opuesta a la burbuja para separarla de la punta de la pipeta.
- Con el software de la cámara, mida el tamaño de la burbuja y calcule el volumen. Si no se dispone de un software de cámara, se puede utilizar un software alternativo.
- Cree 10 burbujas y mida el diámetro medio de la burbuja para determinar el volumen correcto que la micropipeta dispensará en la vasculatura de la lombriz de tierra.
NOTA: Si el investigador está interesado en dispensar una variedad de volúmenes, los parámetros de presión y tiempo pueden ser manipulados; Repita los pasos 2.3.1 a 2.3.7.
3. Preparación para la cirugía de lombrices de tierra para exponer la vasculatura específica de las lombrices de tierra de interés
- Preparación y mediciones de lombrices de tierra
- Prepare una solución de etanol al 10% que anestesiará a las lombrices de tierra antes de la cirugía.
- Mantenga las lombrices de tierra en un vaso de precipitados de 100 ml con tierra entre experimentos.
- Mantenga solo de 5 a 10 lombrices de tierra a la vez en el vaso de precipitados para evitar que las lombrices de tierra se sequen debido a los cambios bruscos del refrigerador a la mesa de trabajo, de 4 °C a 25 °C.
- Coloque las lombrices de tierra en etanol al 10% durante 30 minutos. Si la lombriz de tierra sigue moviéndose después de 30 minutos, déjela en la solución de etanol durante 5 minutos más.
NOTA: A veces la lombriz de tierra necesita más tiempo debido a su tamaño; Por lo tanto, es posible que sea necesario ajustar el tiempo en etanol de acuerdo con el tamaño de la lombriz de tierra, pero no exceder más de una hora. Más de una hora dañará la lombriz de tierra. - Enjuague la lombriz de tierra bajo el agua del grifo para eliminar la baba que produce y el etanol.
- Coloque la lombriz de tierra sobre una toalla de papel para eliminar el exceso de agua.
- Una vez que la lombriz de tierra esté anestesiada, registre el peso (g), el ancho (mm), la longitud (mm) y el ancho del vaso (μm) de cada lombriz de tierra. Tome el peso y las dimensiones de la lombriz de tierra antes de hacer cualquier incisión y sin estirar la lombriz de tierra.
- Una vez que el vaso se exponga quirúrgicamente bajo un microscopio, use el software de la cámara para medir el ancho del vaso. Si no se dispone de un software de cámara, bastaría con una microrregla de acero inoxidable, aunque no es tan precisa como la medición de un software digital.
NOTA: Dependiendo del vaso de interés, salte al Paso 3.2 (vaso ventral), 3.3 (vaso dorsal), 3.4 (vista superior de los corazones) o 3.5 (vista lateral de los corazones).
- Exposición de la vasculatura de la lombriz de tierra, el vaso ventral (método 1)
- Utilice una almohadilla de goma durante el procedimiento quirúrgico para sujetar la lombriz de tierra, exponiendo así el recipiente de interés para el investigador. La parte oscura de la piel debe estar hacia abajo.
- Para abrir quirúrgicamente la lombriz de tierra, colóquela en su lado dorsal, la parte más oscura de la lombriz de tierra, donde se hace una pequeña incisión lateral en la piel de aproximadamente 1 mm con una cuchilla. Esta pequeña incisión permite que las tijeras quirúrgicas entren para crear una incisión larga.
- Sujete la piel de la lombriz a 33 mm de distancia, haciendo una abertura de 27 mm para exponer el recipiente, usando solo cuatro alfileres para exponer correctamente el recipiente. Los alfileres se pueden agregar o mover, una vez que la lombriz de tierra ha sido clavada, para ayudar a manipular la piel de la lombriz de tierra.
- Con unas tijeras quirúrgicas, haga una incisión para llegar al otro alfiler en el costado de su cuerpo. Al empujar hacia la piel, evita cualquier daño en el interior de la lombriz de tierra, como cortar la vasculatura o el intestino.
- Una vez que se haya hecho la incisión, fije o vuelva a fijar donde se hizo la primera incisión y luego al final del corte.
- Usando ambas herramientas quirúrgicas (agarres quirúrgicos), mueva la piel para exponer el interior de la lombriz de tierra.
- Sujete la piel en la parte inferior a medida que se mueve la piel, y mientras sube la lombriz de tierra, continúe separando la piel de los órganos con cuidado. Una vez en la parte superior, coloca el último bolo.
- Si el vaso no está expuesto, tire de los lados opuestos de la piel de la lombriz de tierra para separar el tejido elástico de la lombriz de tierra para exponer el vaso ventral y separar aún más la piel.
NOTA: Este tirón eliminará parte del tejido que sostiene los órganos dentro de la lombriz de tierra. Tenga cuidado con este paso, ya que puede romper involuntariamente los vasos de la lombriz de tierra. El vaso ventral ahora debe estar expuesto, y el cordón nervioso puede funcionar como un marcador del vaso, porque el cordón nervioso corre a lo largo de la piel justo al lado y paralelo al vaso ventral. Si el vaso ventral está cerca del intestino, un tirón en la piel puede exponer aún más el vaso. De lo contrario, empuje la tripa hacia un lado, pero esto puede causar un área de trabajo desordenada.
- Exposición de la vasculatura de la lombriz de tierra, el vaso dorsal (método 2)
NOTA: Los pasos para exponer el vaso dorsal son similares a la exposición del vaso ventral.- Repita los pasos 3.2.1 - 3.2.3 del paso 3.2. La parte oscura de la piel debe estar hacia arriba para estos pasos.
- Usa tijeras quirúrgicas para cortar hacia el centro de la lombriz de tierra hacia el lado opuesto.
- Desde el centro de la lombriz de tierra, haga una incisión hacia la parte anterior de la lombriz de tierra, la cabeza. Empujar hacia arriba, hacia la piel, evita cualquier daño en el interior de la lombriz de tierra, como cortar el vaso o el intestino.
- Una vez que se haya hecho el corte diagonal, fije o vuelva a sujetar con alfileres el sitio de la primera incisión y luego al final del corte que se hizo.
- Repita los pasos 3.2.6 a 3.2.9 en el paso 3.2.
NOTA: El vaso dorsal ahora debe estar expuesto.
- Exponiendo la vasculatura de la lombriz de tierra, vista superior de los corazones (método 3)
- Utilice una almohadilla de goma durante el procedimiento quirúrgico para sujetar la lombriz de tierra, exponiendo así el vaso de interés para el investigador.
- Para exponer quirúrgicamente la lombriz de tierra, colóquela en su lado ventral, la parte ligera de la lombriz de tierra. La parte oscura de la piel debe estar hacia arriba.
- Use cuatro alfileres para sujetar la piel de la lombriz de tierra y crear una ventana para exponer los corazones de interés. Un alfiler adicional, para un total de cinco, se puede usar para sujetar la lombriz de tierra cerca de la punta de su cabeza, el extremo anterior.
- Comience a sujetar la lombriz de tierra de abajo hacia arriba, comenzando en el lado derecho y luego moviéndose hacia el lado izquierdo. Sujeta la lombriz de tierra, colocando dos alfileres en la parte superior cerca de la punta de la cabeza, el extremo anterior y dos cerca del clitelo.
- Con una cuchilla se hace una pequeña incisión de aproximadamente 1 mm en el costado de la lombriz de tierra.
- Use una tijera quirúrgica para cortar hacia el centro de la lombriz de tierra hacia el lado opuesto.
- Desde el centro de la lombriz de tierra, haga un corte hacia la parte delantera de la lombriz de tierra hasta llegar a la boca de la lombriz de tierra, el extremo anterior.
NOTA: Es importante que las tijeras se levanten contra la piel para evitar cortar la vasculatura; La hoja de la tijera es visible a medida que atraviesa la piel. Asegúrate de que el corte se haga en el extremo anterior de la lombriz de tierra, ya que esto proporcionará una mejor visibilidad de los corazones. - Una vez clavada, vuelve a sujetar la lombriz de tierra, si la piel se está enroscando en la lombriz de tierra.
- Haz un tirón para separar adecuadamente el tejido de la lombriz de tierra para exponer adecuadamente los corazones.
- Si los corazones no están expuestos, mueva las vesículas seminales blancas, ya que los corazones a veces se esconden debajo de estas vesículas.
NOTA: La exposición del corazón puede variar de una lombriz a otra, los 10 corazones pueden ser visibles o solo la mitad y así sucesivamente. En este punto, el investigador debe determinar si mover órganos y tejidos para localizar los corazones de la lombriz de tierra.
- Exponiendo la vasculatura de la lombriz de tierra, vista lateral de los corazones (método 4)
- Utilice una almohadilla de goma durante el procedimiento quirúrgico para sujetar la lombriz de tierra, exponiendo así el vaso de interés para el investigador.
- Para exponer quirúrgicamente la lombriz de tierra, colóquela de lado. Dado que la lombriz de tierra está de lado, tanto el lado claro como el oscuro de la lombriz de tierra deben ser visibles.
- Repita los pasos 3.4.3 - 3.4.9 del paso 3.4.
- Si los corazones no están expuestos, mueva las vesículas seminales blancas, ya que los corazones a veces se esconden debajo de estas vesículas.
NOTA: La exposición del corazón puede variar de una lombriz a otra, los cinco corazones pueden ser visibles o menos. En este punto, el investigador debe determinar si mover órganos y tejidos para localizar los corazones de la lombriz de tierra.
4. Administración de compuestos en la vasculatura de las lombrices de tierra
- Preparación de la lombriz de tierra para la administración de compuestos
NOTA: Para estos pasos específicos, inyectamos agentes de contraste, microburbujas, en la vasculatura de la lombriz de tierra como compuesto de interés.- Antes de la microinyección, coloque la lombriz de tierra en la etapa de microinyección y use una toallita de laboratorio para eliminar cualquier líquido alrededor del vaso de interés, exponiendo así la vasculatura para la inyección.
NOTA: No aplique una presión fuerte porque causará sangrado del vaso. - Alinee la vasculatura de interés con la micropipeta, ya que es importante que el vaso ventral esté alineado para la inyección. Si los corazones son de interés, deben estar perpendiculares a la micropipeta.
- Enfoque el microscopio en la vasculatura de interés y comience a bajar la micropipeta hasta la vasculatura. Antes de mover cualquiera de los manipuladores de joystick, confirme que estén todos configurados a 0 mm para garantizar la mejor movilidad.
- Cuando la punta de la micropipeta esté en contacto con el recipiente de lombrices, asegúrese de que el ángulo entre el recipiente y la micropipeta sea inferior a 15°.
- Una vez que la micropipeta comienza a aplicar presión sobre el vaso, la sangre se alejará de la punta debido a la presión sobre la vasculatura. Esta es una buena indicación de la colocación adecuada de la inyección.
- Para garantizar el éxito de la inyección, utilice el joystick para mover la micropipeta hacia delante y entrar en contacto con la vasculatura.
NOTA: Es importante no perforar el recipiente. Tenga en cuenta que la punta debe mover la vasculatura, para el vaso dorsal y ventral, en la dirección en que se mueve la micropipeta, y luego se debe usar el dial grueso para mover la punta de la micropipeta hacia adelante para permitir la penetración completa en el vaso. Si la placa es móvil, se puede utilizar para mover y perforar el recipiente en la micropipeta en lugar de utilizar los microcontroladores o todo simultáneamente. El recipiente no se penetrará inmediatamente, pero un retroceso del recipiente es un indicador de la penetración adecuada de la micropipeta. Una vez que la punta ha penetrado en el recipiente, el recipiente debe estar recto y alineado con la micropipeta. Si no es así, retraiga la micropipeta lentamente con el control fino. - Presione el pedal para inyectar la vasculatura de la lombriz de tierra. La dilución de la sangre es otro indicador de una penetración adecuada una vez que se pisa el pedal.
- Retraiga la micropipeta lentamente y tire de ella hacia atrás.
NOTA: Alternativamente, romper la punta mientras la micropipeta aún está en el recipiente es un método eficaz para evitar la pérdida de sangre.
- Antes de la microinyección, coloque la lombriz de tierra en la etapa de microinyección y use una toallita de laboratorio para eliminar cualquier líquido alrededor del vaso de interés, exponiendo así la vasculatura para la inyección.
Resultados
Los siguientes resultados representativos se basan en un conjunto de parámetros específicos que incluyen los ajustes utilizados para tirar de la pipeta de vidrio, el tamaño de la abertura de la pipeta formado a partir de un ángulo de biselado determinado y la presión y el tiempo de las microinyecciones. En la Figura 1, se muestra un esquema del flujo que representa el proceso de principio a fin.
En función de los parámetros del extractor de pipetas seleccionados, la siguiente punta saldría del tirón (Figura 2). Se observa que el valor de RAMP puede cambiar debido al tipo de vidrio e incluso a la ubicación del filamento. Si los parámetros son aceptables, la punta resultante será fuerte, con un cono largo para biselar. Si la punta se rompe por tirar, entonces el tirador debe reajustarse.
Para biselar la micropipeta, se probaron seis ángulos de biselado para determinar el ángulo óptimo, evaluar la facilidad general de biselado y examinar cómo el ángulo afectaba al tamaño de la abertura de la punta. Se determinó que el ángulo óptimo para nuestros criterios de biselado era de 35°, ya que proporciona una punta afilada, es lo suficientemente fuerte como para penetrar en el recipiente sin romperse y es altamente reproducible. Generalmente, cuanto más pequeño es el ángulo, más afilada se vuelve la punta, como se muestra en la Figura 3. Otro ángulo de interés fue el de 30°, que es más agudo, pero se eligió el de 35°, debido a su reproducibilidad. Como se muestra en la Figura 4, el ángulo del micromanipulador cambia tanto la forma como el tamaño de la abertura de la punta. En esta figura se muestra que el biselado más preciso y consistente se produce con un ángulo entre 30° y 40°. Se creó una tabla complementaria (Tabla S1) basada en la facilidad de biselado, aunque es importante tener en cuenta que, de persona a persona, las técnicas de biselado varían, y por lo tanto las puntas varían. Además, se observa que los biseles fallidos pueden ocurrir cuando el micromanipulador se baja demasiado rápido o cuando el vidrio se vuelve demasiado quebradizo, lo que provoca la rotura de la punta.
Para un tamaño de punta determinado, se debe realizar una calibración antes de las inyecciones de compuesto. El volumen de inyección depende del tamaño de la punta, así como de la presión de microinyección y del tiempo de inyección. Por ejemplo, en la Figura 5, se grafican las dispensaciones de volumen representativo para puntas de 24,4 μm. Los datos revelan una relación aproximadamente lineal entre el volumen dispensado y la presión para tiempos de inyección fijos. Se deben determinar datos de calibración personalizados similares para diseños específicos de puntas.
Durante la inyección microvascular, es necesaria una inspección visual para confirmar una inyección exitosa de un producto determinado. El mejor marcador visible es la dilución de la sangre. Como se muestra en el video complementario y en la Figura 6, la sangre se vuelve más clara a medida que se diluye, y esto es un signo de inyección exitosa. Es fundamental que la micropipeta no penetre demasiado profundamente en el vaso y que la microinyección no se realice en un ángulo superior a 15° con respecto al recipiente, de lo contrario, cuando se extraiga la pipeta, el compuesto de interés se desprenderá de su vasculatura, debido a heridas grandes. Una inyección y un tirón exitosos darán como resultado un sangrado mínimo después de la extracción.
Figura 1: Flujo del método general. Para la microinyección de la vasculatura de la lombriz de tierra, primero se debe tirar de la pipeta para lograr una micro apertura en la punta. A continuación, la punta de la micropipeta se bisela para conseguir una punta de aguja afilada. Una vez alcanzada la apertura, la micropipeta se calibra para obtener el volumen adecuado dispensado. Una vez calibrado, se pueden realizar inyecciones en la vasculatura. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Micropipeta extraída con éxito. Según los parámetros utilizados en el protocolo, esta punta surgiría después de tirar. (A) Muestra la pipeta inmediatamente después de ser extracción. (B) Una imagen de cerca de la misma pipeta extraída. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Perfiles de ángulo de biselado de la punta de la micropipeta. Se probaron seis ángulos para el biselado. Al disminuir el ángulo de 45° a 20°, aumenta la nitidez y la apertura de la punta. Haga clic aquí para ver una versión más grande de esta figura.
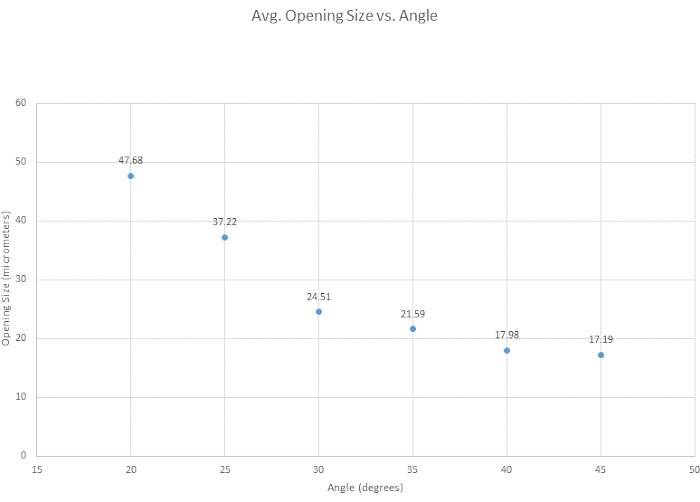
Figura 4: La abertura de la punta se estrecha con el aumento del ángulo. Se probaron seis ángulos para ver cómo el ángulo afecta el tamaño de la abertura de la punta. El tamaño de la abertura de la punta disminuye a medida que aumenta el ángulo de biselado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Calibración para la administración de volumen. Se utilizó una abertura de punta de 24,4 μm para sus resultados representativos para representar los datos utilizando los parámetros específicos de tiempo y presión. Con el aumento de la presión, el volumen dispensado aumenta, y con la disminución del tiempo, el volumen dispensado disminuye. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Inyección en el vaso ventral. Se muestra una imagen para una inyección exitosa con la dilución de la sangre como indicador. Un video complementario se acompaña de este panel. Haga clic aquí para ver una versión más grande de esta figura.
Figura S1: Configuración para la extracción de sangre y orina de lombrices de tierra. Haga clic aquí para descargar este archivo.
Figura S2: Desviaciones estándar de la Figura 4. Dependiendo del ángulo, la desviación estándar cambia. 35° tiene una desviación estándar más baja, por lo que es más consistente en el biselado y la punta se rompe menos. 30° también fue bueno con 35° como se muestra en la Tabla S1. Haga clic aquí para descargar este archivo.
Figura S3: Demuestra la supervivencia de la lombriz de tierra después de la cirugía y el uso de una curita líquida para cerrar la lombriz de tierra. Haga clic aquí para descargar este archivo.
Tabla S1: Tabla descriptiva de la facilidad de biselado. Se utilizaron tres modos para describir la facilidad de biselado, que van desde fácil hasta moderado y difícil. Cabe señalar que se probó 15°, pero era un ángulo demasiado pequeño para producir una punta de micropipeta que no se astillara. Haga clic aquí para descargar esta tabla.
Video complementario. Haga clic aquí para descargar este video.
Discusión
Mientras que la lombriz de tierra está en etanol al 10%, particularmente si la lombriz de tierra es de mayor edad, puede haber efectos no deseados para tiempos de exposición superiores a 30 minutos; Los intestinos comenzarán a deteriorarse, y cuando la lombriz de tierra se abre quirúrgicamente, sus intestinos internos se extienden. Por lo tanto, se recomienda utilizar lombrices de tierra jóvenes a medianas. Durante el proceso de cortar la piel de la lombriz de tierra, es imperativo que no se haga un corte de tijera completo, lo que significa que el investigador debe cortar solo hasta la mitad y seguir empujando las tijeras hacia adelante hasta llegar al punto final. Al sujetar la lombriz de tierra, tenga cuidado de no estirarla ni tirar demasiado fuerte. Esto podría hacer que el vaso se rompa, lo que provoca una hemorragia. Después de cada inyección, compruebe si la micropipeta está obstruida dispensando cualquier líquido que pueda haber dentro de la micropipeta, especialmente para eliminar la sangre de la punta antes de realizar otra inyección. Además de observar la obstrucción de la punta, después de cada inyección observe la punta de la micropipeta para comprobar si la punta está rota. La punta de la micropipeta también podría romperse, dejando la punta en su lugar para evitar cualquier pérdida de sangre. Es importante observar cuidadosamente el tejido del vaso durante las microinyecciones. Cuando la micropipeta entra en contacto por primera vez con el recipiente, el tejido del vaso se adhiere a la punta de la micropipeta. Una vez que la punta ha penetrado con éxito en el vaso, se puede ver que el tejido del vaso se desliza rápidamente hacia la punta y también se sentirá en el micromanipulador. Después de una inyección exitosa, es importante extraer la micropipeta con cuidado, ya que la micropipeta podría terminar penetrando más profundamente en el tejido o creando una herida más grande en el lugar de la inyección, y esto podría provocar que la administración del compuesto se filtre fuera del recipiente. Por lo general, las inyecciones exitosas ocurrieron cuando el diámetro del vaso era de 90 μm o más, pero esto se puede mejorar reduciendo el tamaño de las puntas de las micropipetas por parte de los investigadores. La lombriz de tierra se mantiene constantemente húmeda con agua para evitar que se deshidrate, pero se recomienda una solución salina.
Estudios de supervivencia de lombrices de tierra
Se llevaron a cabo experimentos de supervivencia con lombrices de tierra para dar una idea de cuánto tiempo pueden sobrevivir las lombrices de tierra después de la experimentación. Después de que los gusanos se sumergieron en una solución de etanol al 10% y luego se cortaron e inyectaron quirúrgicamente, tal como se hicieron durante los experimentos, se "cosieron de nuevo" 27 gusanos a través de una solución líquida de curita y se observaron hasta 48 horas después del experimento. A las 12 horas después de la operación, aproximadamente el 67% de los gusanos seguían vivos. A las 24 horas después de la operación, alrededor del 48% de los gusanos seguían vivos. A las 36 horas después de la operación, alrededor del 44% de los gusanos seguían vivos. Por último, a las 48 horas después de la operación, alrededor del 22% de los gusanos seguían vivos. Los resultados de estos experimentos muestran que la mayoría de los gusanos pueden sobrevivir durante un día completo de 12 horas después de haber sido sometidos a cirugía experimental e inyección, y un gran número de gusanos puede sobrevivir incluso más tiempo que eso (Figura S3). Esto presenta una oportunidad para que cada gusano sea monitoreado para estudios de 24 horas de duración, si así lo desea.
Cuidado de laboratorio de lombrices de tierra
Las lombrices de tierra, orugas nocturnas canadienses, se compraron en la tienda de Windsor Wholesale Bait y se entregaron como 500 lombrices de tierra grandes en una caja de espuma de poliestireno (35w x 38l x 30d cm) y se mantuvieron en el refrigerador, ya que las lombrices individuales se retiraron y se usaron para experimentos. Como se señaló en los pasos del protocolo de preparación de lombrices de tierra, no se usaron más de 10 lombrices de tierra a la vez debido a la evaporación de la lombriz de tierra, lo que puede conducir a la deshidratación16. Además, la exposición de las lombrices de tierra a la luz fue limitada, ya que contienen células sensibles a la luz en su piel; La exposición a la luz durante más de dos horas puede provocar la muerte. Inmediatamente después de su llegada, se cambió la tierra del contenedor de envío y se permitió que las lombrices de tierra descansaran durante un período de espera de 24 horas antes de ser utilizadas para los experimentos. Esto aseguró que las lombrices de tierra se revitalizaran y ya no se fatigaran debido al envío. En este punto, puede comenzar la experimentación con la lombriz de tierra.
Las lombrices de tierra tienen una vida útil desconocida, pero se pueden mantener vivas en un entorno de laboratorio durante largos períodos cuando se monitorean todos los días y se les administran los nutrientes adecuados. Cada dos semanas, se debe agregar tierra nueva al recipiente para proporcionar más nutrientes a la lombriz de tierra. La lombriz de tierra es un invertebrado excavador profundo, anécico, y construirá madrigueras de hasta 180 cm (6 pies), por lo que debe haber al menos 1 pie de tierra en el contenedor para 500 lombrices de tierra. En el fondo del recipiente, se puede agregar papel de periódico viejo, ya que aquí es donde algunas de las lombrices de tierra crearán sus hogares. Una vez que se ha cambiado el suelo, se recomienda verificar el olor y detectar las lombrices de tierra heridas o muertas. No dejes lombrices de tierra muertas o heridas en el recipiente, ya que contaminarán el suelo y provocarán más muertes dentro de tu colonia de lombrices de tierra.
Aplicaciones futuras
En este protocolo, se presenta la preparación y el procedimiento para realizar experimentos de sangre de alto rendimiento utilizando la lombriz de tierra. Si bien se limitan al sistema circulatorio, los métodos de inyección descritos aquí podrían ampliarse a estudios que involucren el sistema nervioso, ya que el cordón nervioso de la lombriz de tierra está en paralelo al vaso ventral. Por ejemplo, se han estudiado investigaciones previas con la lombriz de tierra para estudios de neuromodulación y ruptura de vasos a partir de aplicaciones terapéuticas de ultrasonido18,19. Con esta nueva configuración, se podrían realizar estudios más profundos de ultrasonido + microburbujas para ampliar la investigación sobre la neuromodulación y la ruptura de vasos.
Además, la cavidad celómica de la lombriz de tierra podría utilizarse para estudiar el sistema inmunitario, ya que el líquido que reside en la cavidad celómica media la mayoría, si no todas, las respuestas inmunitarias. La lombriz de tierra es única en el sentido de que solo existen dos fluidos en el animal, cada uno contenido dentro de cavidades separadas, la sangre en los vasos y el líquido celómico en la cavidad celómica. Esta separación de fluidos permite tipos específicos de investigación en dos cavidades. Por ejemplo, el líquido celómico está repleto de numerosos celomócitos, cuyas funciones inmunitarias comparten características con los celomocitos de la mayoría de los otros modelos animales. Las investigaciones de fagocitos y otras células similares que pueden destruir objetivos celulares se pueden realizar en la lombriz de tierra, y es probable que la lombriz de tierra tenga muchas aplicaciones de investigación adicionales que podrían usarse como un modelo alternativo de invertebrados.
Mientras que la lombriz de tierra carece de la complejidad necesaria para modelar muchos aspectos del sistema anatómico y fisiológico humano, la microinyección ofrece un sistema circulatorio contenido que contiene sangre sorprendentemente similar a la sangre humana en términos de estructura de hemoglobina. En aplicaciones donde se aceptan pequeños volúmenes de sangre, la lombriz de tierra ofrece una plataforma de prueba de bajo costo, fácilmente disponible, exenta de los Comités Institucionales de Cuidado y Uso de Animales. Como resultado, las pruebas en lombrices de tierra con varios compuestos se pueden realizar repetidamente y en tamaños de muestra que probablemente excedan con creces lo que sería práctico utilizando animales vertebrados de laboratorio estándar.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por la beca NSF-FDA SCHOLAR-IN-RESIDENCE FELLOWSHIP (NSF-FDA SIR, #1641221), la beca Chief Scientist Challenge de la Oficina de la Administración de Alimentos y Medicamentos de EE. UU. (FDA OCS), la National Science Foundation Integrative Graduate Education and Research Traineeship (NSF IGERT, #1144646) y apoyado por la Oficina de Laboratorios de Ciencia e Ingeniería (OSEL) de la Administración de Alimentos y Medicamentos de EE. UU. (FDA).
Materiales
| Name | Company | Catalog Number | Comments |
| 3M Vetbond Tissue Adhesive | 3M Vetbond | 084-1469SB | 3mL bottle vet adhesive - liquid band-aide |
| 40x Stereo Microscope | Sutter Instrument Co. | BV-10-D | Not needed, can add on other scopes |
| 500 Large Worms | Windsor Wholesale Bait | 500 Large | |
| Beveler pedestal oil | Sutter Instrument Co. | 008 | |
| Blades | Ted Pella, Inc | 121-2 | |
| Borosilicate Glass with Filament | Sutter Instrument Co. | BF150-86-10 | |
| Camera | AmScope | MU500 | |
| Camera | AmScope | MU1803-CK | 8MP USB3.0 Microscope Digital Camera |
| Electrode Impedance Meter | Sutter Instrument Co. | BV-10-C | |
| Ethanol | Sigma Aldrich | E7023-1L | Pure ethanol |
| Filament | Sutter Instrument Co. | FT315B | trough filament |
| Grinding Plate | Sutter Instrument Co. | 104D | Fine Plate |
| Hospital Grade Saline | Baxter Healthcare Corporation | 2F7124 | 0.9% Sodium Chloride Irrigation |
| Joystick Micromanipulator | Narishige | MN-151 | |
| KimWipes Kimtech Science | Kimberly-Clark Professional | 34155 | |
| Leafgro | LeafGro | 589252 | 1.5-cu. ft. |
| Metal Hub Needle | Hamilton | 91024 | Luer Lock Metal Needle |
| Micro Vessel Clips | WPI | 501779-G | |
| Microinjector | TriTech Research | MINJ-D | |
| Micropiette Puller Model P-97 | Sutter Instrument Co. | P-97 | |
| Micropipette Beveler | Sutter Instrument Co. | BV-10-B | |
| Microscope | AmScope | SM-8TPW2-144S | 3.5X-225X Simul-Focal Articulating Microcope |
| Needle Holder | TriTech Research | MINJ-4 | |
| NeverWet | Rust-Oleum | NeverWet | |
| Pyrex Glass | Corning | 08747A | Fisher Manufacturer |
| Stainless Micro-Ruler | Ted Pella, Inc | 13635 | Micro-Ruler mounted on a Handle, 10mm scale, with lines at 0.01mm intervals |
| Surgical Grips | Ted Pella, Inc | 53073 | Forceps, Hemostat |
| Surgical scissors | Ted Pella, Inc | 1320 | Fine Iris Scissors, Straight |
| U.S.P. Mineral Oil Lubricant Laxative | Swan | Mineral Oil |
Referencias
- Stevenson, J. . The Oligochaeta. , 685 (1930).
- Reynolds, J. W., Reynolds, W. M. Earthworms in medicine. American Journal of Nursing. 72 (7), 1273 (1972).
- Gates, G. E. The earthworms of Rangoon. Journal of the Burma Research Society. 25, 196-221 (1926).
- Carr, L. G. K. Interesting animal foods, medicines, and omens of the eastern Indians, with comparisons to ancient European practices. Journal of the Washington Academy of Sciences. 41 (7), 229-235 (1951).
- Price, S. F. Kentucky folk-lore. The Journal of American Folklore. 14 (52), 30-38 (1901).
- Elmer, J., Palmer, A. F., Cabrales, P. Oxygen delivery during extreme anemia with ultra-pure earthworm hemoglobin. Life Sciences. 91 (17-18), 852-859 (2012).
- Eyambe, G. S., Goven, A. J., Fitzpatrick, L. C., Venables, B. J., Cooper, E. L. A non-invasive technique for sequential collection of earthworm (Lumbricus terrestris) leukocytes during subchronic immunotoxicity studies. Laboratory Animals. 25 (1), 61-67 (1991).
- Basley, K., Goulson, D. Effects of chronic exposure to clothianidin on the earthworm Lumbricus terrestris. PeerJ. 5, 3177 (2017).
- Mvumi, B. M., Gwenzi, W., Mhandu, M. G. Ecotoxicological effects of citrus processing waste on earthworms. Lumbricus terrestris L. Industrial Crops and Products. 110, 123-129 (2017).
- Furst, A. My saga with earthworms. Food and Chemical Toxicology. 40 (6), 789-791 (2002).
- Cooper, E. L., Hrzenjak, T. M., Grdisa, M. Alternative sources of fibrinolytic, anticoagulative, antimicrobial and anticancer molecules. International Journal of Immunopathology and Pharmacology. 17 (3), 237-244 (2004).
- Cooper, E. L., Hirabayashi, K., Balamurugan, M. Dilong: food for thought and medicine. Journal of Traditional and Complementary Medicine. 2 (4), 242-248 (2012).
- Nagasawa, H., et al. Inhibition by lombricine from earthworm (Lumbricus terrestris) of the growth of spontaneous mammary tumours in SHN mice. Anticancer Research. 11 (3), 1061-1064 (1991).
- Shannon, K. M., Gage, G. J., Jankovic, A., Wilson, W. J., Marzullo, T. C. Portable conduction velocity experiments using earthworms for the college and high school neuroscience teaching laboratory. Advances in Physiology Education. 38 (1), 62-70 (2014).
- National Research Council. . A framework for K-12 science education: Practices, crosscutting concepts, and core ideas. , (2012).
- Ramsay, J. The Osmotic Relations of the Earthworm. Journal of Experimental Biology. 26 (1), 46-56 (1949).
- Mulloney, B. Structure of the Giant Fibers of Earthworms. Science. 168 (3934), 994-996 (1970).
- Kim, Y., Nabili, M., Acharya, P., Lopez, A., Myers, M. R. Microvessel rupture induced by high-intensity therapeutic ultrasound - a study of parameter sensitivity in a simple in vivo model. Journal of Therapeutic Ultrasound. 5 (1), 5 (2017).
- Wahab, R. A., et al. Mechanical bioeffects of pulsed high intensity focused ultrasound on a simple neural model. Medical Physics. 39 (1), 4274-4283 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados