Method Article
ミミズ、Lumbricus terestris:新しいマイクロインジェクション血管系In vivo無脊椎動物モデル
要約
ミミズは、血管系研究のための新しい無脊椎動物のin vivoベンチトップモデルです。ミミズの血管系への効率的な手術とマイクロインジェクションを可能にする技術と機器を紹介します。外科的プロトコル、マイクロインジェクション技術、およびカスタムメイドのマイクロピペットを製造するための手順について説明します。
要約
脊椎動物は生物医学研究に不可欠ですが、研究はコスト、長期にわたる内部レビュー、倫理的考慮事項などの要因によって制限されることがよくあります。ミミズは、特定の予備的な血管系研究に適用できる代替の低コストの無脊椎動物として提示します。ミミズの背側血管、腹側血管、および5対の偽心臓が外科的に利用できるため、ミミズは容易にアクセスでき、低コストのメンテナンスを提供し、特定の化合物の少量の投与のみを必要とします。ミミズモデルは、ヒトの血液に似たヘモグロビン構造を持つ単純な閉鎖型血管循環系を提供します。ミミズを麻酔し、関連する血管を露出させるために外科的切開を行うためのプロトコルが提供されています。化合物投与用のマイクロピペットは、ピペットプーラーでガラスを加熱して引っ張り、面取りシステムを使用してミクロンスケールの細い針先を作成することによって形成されます。次に、チップをマイクロポジショナーおよびマイクロインジェクターとともに使用して、ミミズの血管系に任意の化合物を繰り返し注入します。これは、大きなサンプルサイズと少量の化合物を利用できる場合に使用します。注射手順の複雑さについての詳細が提供されています。ミミズの小さな血管サイズは、特に腹側血管の場合、困難です。しかし、提示された技術を習得することで、低コストのソリューションとして高い再現性が得られ、非常に大きなサンプルサイズの研究が実用的になります。
概要
ミミズは、以前の科学的応用1,2,3,4,5,6の重要なバイオインディケーターおよびバイオアッセイとして使用されてきました。これは、土壌中の殺生物剤(殺虫剤)や有害な生態毒性学的影響7,8,9,10などのin situおよび生物蓄積研究のための陸上環境における有害および有毒廃棄物からの生物学的リスクを評価するための理想的な生物です。さらに、バイオプロスペクティングにより、ミミズは線溶性、抗凝固、抗菌、および抗癌分子の代替供給源です11,12;1991年にチームがミミズの皮膚からランブリックを抽出して精製し、SHNマウスの乳腺腫瘍に配置したところ、腫瘍の成長阻害につながった13。ミミズは、学生を手術にさらしたり、標本の解剖学的構造を理解したりするために使用できるため、教育学的にも有用な動物モデルでもあります。血液循環の研究から電気生理学まで14,15.
私たち自身の研究では、高強度超音波18に対する生きたミミズの血管の応答を調べました。私たちは、線虫の血管破裂が、ヒトの微小血管の破裂損傷に関連するのと同様の条件下で発生することを発見しました。私たちの進行中の研究は、ミミズの血管系へのマイクロバブルの注入です。マイクロバブルは、脂質、アルブミン、またはポリマーシェルに包まれた重ガスで構成されており、これらの薬剤は、画像造影剤としてだけでなく、標的薬物送達のためのビヒクルとしても使用できます。
この新しいプロトコルは、ミミズの自然な生体指標を利用できる化合物の静脈内(IV)注射の恩恵を受けるあらゆる研究に関連しています。このアプローチは、ミミズの5対の疑似心臓、背側血管、腹側血管のいずれかを含む、いくつかの可能な侵入点の1つへのIVマイクロインジェクションに基づいています。この手順では、血管を露出させるために精巧な外科的切開を行い、その後、マイクロポジショナー制御の注射を行います。これは、ミミズの血管マイクロインジェクション用に特別に作られたカスタムマイクロピペットを使用して実現されます。これらのマイクロピペットは、直径90μmの腹側血管のような小さな血管の精密なターゲティングを可能にします。
このプロトコルは、ミミズの血液と尿の抽出に関する1948年の研究を含む、以前のマイクロピペッティング技術を改善するように設計されています16。 図S1に示すように、この抽出のセットアップは難しく、著者が述べているように、最大1時間以上かかる場合があります。同様の方法が1970年に開発されましたが、著者はミミズの巨大な繊維に液体を注入する際に複数の先端の破損を経験しました17。以下に説明する本方法では、血液の抽出は数秒から数分の問題であり、化合物の注入およびミミズ液の抽出の両方に関連する。この特定のケースでは、造影剤であるマイクロバブルを注入しました。
プロトコル
1.マイクロピペットの準備:ガラスを引っ張り、先端を面取りします
- マイクロピペットの引き抜き
- マイクロピペットプーラーの電源を入れ、プログラムを選択して、ミミズマイクロインジェクションの特定のパラメータを入力します。
- パラメータを[圧力]=500、[引っ張り]=75、[時間]=250、[熱]=336、[速度]=70に設定します。結果はプーラーごとに異なる場合があります。したがって、目的の先端(サイズ、シャープネス、形状など)を達成するためのパラメーターを試してください。
- マイクロピペットを引っ張る前に、必ずRAMPテストを実施して熱量を決定してください。そうしないと、トラフフィラメントが焼損したり、ガラスが割れたりする可能性があるためです。
- 空気圧を変更する必要がある場合は、クリアボタンを押し、すべての値をクリアするように求められたら[いいえ](0)を選択し、[圧力の変更](2)を選択します。このプロセスは、プーラーごとに異なる場合があります。したがって、圧力設定を変更するには、機器のマニュアルを参照してください。
- マイクロピペットプーラーの蓋を開け、マイクロピペットをプーラーにロードします。使用したマイクロピペットガラスは、長さ10cm、外径1.5mm、内径0.86mmのフィラメントピペット付きホウケイ酸ガラスを使用しました。
- ピペットの端がピペットホルダーの端と揃うまで、ピペットをピペットのスリットに沿って右からV溝にスライドさせます。ピペットがフィラメントを横切って反対側に移動できるようにするには、ピペットがピペットのスリットに載っていることを確認しながら、ピペットをできるだけ遠くまで押します。
- ピペットを固定するには、右側のノブを締め、ロックされたシステムをピペットと一緒にスライドさせて、フィラメントを介してプーラーの反対側に到達するまでスライドさせます。最後に、ピペットの左側をプーラーに固定します。ピペットはフィラメントの中央にある必要があります。ピペットの適切な位置合わせ方法については、マニュアルを参照してください。
- ピペットがロードされたら、プーラーを閉じ、プルボタンを押し、ピペットが引かれるのを待ってから、結果として得られる2つのピペットを取り外します。
- ノブを緩めてピペットを取り外し、スリットから取り外すときにピペットをクリップしないように注意してください。
- 引っ張ったマイクロピペットをマイクロピペットホルダーまたは何らかのサポートに置いて、マイクロピペットを所定の位置に保持し、引っ張ったマイクロピペットを壊さずに簡単に回転できるようにします。私たちは、機械工場で作成したり、3Dプリントしたりできる独自のマイクロピペットホルダーを開発しました。
注:プロトコルはここで一時停止できます。 - マイクロピペットホルダーを顕微鏡の下に置き、カメラプログラムなどを使用して、引っ張られたマイクロピペットの写真を撮影し、先端から~1000mmおよび~50mmの倍率で先端径を記録します。
- 写真を撮影する前に、特にイメージング後の測定で正確に測定するために、カメラの設定が顕微鏡の設定(10倍)と一致していることを確認してください。10x 設定は、画面の上部付近にある水平ツールバー リボンにあります。
- マイクロピペットの写真を表示してキャプチャするには、左上隅にあるカメラソフトウェアでカメラを選択し、先端に焦点を合わせた後にスナップボタンを押すと、正確な読み取りが得られます。[スナップ] ボタンは、ページの左側にあるカメラ タブの下の水平ツールバーにあります。
- 引っ張ったマイクロピペットを測定して、目的のチップサイズと一貫性が達成されたかどうかを判断します。最大5本のピペットを引っ張るだけで、プーラーとそのパラメータが一貫して目的のサイズを生成しているかどうかを判断するのに十分です。目的のチップサイズが達成されない場合、またはピペットごとにサイズが異なり続ける場合、研究者は目的のチップサイズが達成されるまでさまざまな設定を試す必要があるかもしれませんし、フィラメントとピペットの配置を固定する必要があるかもしれません。
注:プロトコルはここで一時停止できます。
- マイクロピペットのベベル設定と電極インピーダンスメーターの使用
- 引っ張ったマイクロピペットを面取りするには、電極インピーダンスメーターと40倍実体顕微鏡を備えたマイクロピペットベベルを使用します。
注:他のベベラーを使用できます。社内のベベラーでも成功し、さらに、顕微鏡にカメラを取り付けるなど、さまざまな顕微鏡でさまざまな構成を実現して、面取りプロセスを調べることができます。 - 台座/研削プレートを、2つの黒いホルダーの間に細かいプレートを取り付けて組み立てます。
- 磁石がプレートの反対側を向くように底板を置きます。
- (1)上部保持リング、(2)研削用微板、(3)下部保持リング(磁気)の3つの部品を一緒にねじ込みます。研削プレートの研磨面を特定します。ファインプレートの場合、紫色で、ガラスがクォーツ光学フラットに接触するように上を向く必要があります。
- ベベラーペデスタルオイルを5滴、または必要な数だけベベルインストゥルメントのクォーツオプティカルフラットに置き、組み立てたプレートを上に置きます。このオイルは一日中持続しますが、プレートがけいれんしたり、回転しないはずのときに回転しない場合は、クォーツオプティカルフラットに再度オイルを塗る必要があるかもしれません。
- プレートを手動で数回回転させてオイルを広げると、機器の電源を入れることができます。
- インピーダンスメーターを設定するには、基準線である芯に生理食塩水(0.9%NaCl)を追加し、芯を面取りプレートに置きます。リボンを浸してマイクロピペットで回路を作り、プレートを生理食塩水の薄層で覆います。
- インペンデンスメータに接続されているワイヤの端にリードセグメントを取り付けます。
- インピーダンスメーターの「オン」スイッチを切り替え、面取りを開始する準備ができるまで「スタンバイ」のままにします。大きな開口部を作っているので、面取りの準備ができたら電極インピーダンスメーターをx0.1に設定します。
- 引っ張ったマイクロピペットを面取りするには、電極インピーダンスメーターと40倍実体顕微鏡を備えたマイクロピペットベベルを使用します。
- マイクロピペットの装填と面取り
- マイクロピペットをピペットclにロードしますamp マニピュレーターにあり、ノブを締めて所定の位置に保持しながら面取りします。
- マイクロピペットの後端から、ピペット全体に生理食塩水を入れ、リード線をマイクロピペットに挿入して、マイクロピペットに気泡がないことを確認します。マイクロピペット内の気泡の存在が測定のばらつきを引き起こすことが注目されています。
- インピーダンスメータを「スタンバイ」から「x0.1」に切り替えてオンにします。抵抗は最初は100MΩで、マイクロピペットの先端が生理食塩水に触れると、異なる読み取り値が表示されます。
- 正しい先端開口部のサイズに面取りするには、マイクロピペットを下げる前に、マニピュレーターの角度を35°に調整して、一貫した面取りを実現します。30°の角度でも十分ですが、2つの間では、35°の方が標準偏差が低く保たれるため、面取りの一貫性が高くなり、先端の破損が少なくなります。
- マニピュレーターを使用して、マイクロピペットの先端を粉砕プレートの回転中心から約3分の2の位置に配置します。
- 粗調整ノブを使用して、マイクロピペットの先端が生理食塩水に近づくように、マイクロピペットをプレートの近くに下げます。カメラがない場合は、顕微鏡を見下ろして先端の面取りを確認することが重要です。
- マイクロピペットの先端が生理食塩水に接触すると、インピーダンスメーターの読み取り値は100MΩから80〜20MΩの範囲の値に減少します。この値は、引っ張られたガラスの開口部によって異なります。
- このとき、粗調整つまみから微調整つまみに切り替えて、プレートの先端が壊れないようにピペットをゆっくり下げます。面取りのこの段階では、インピーダンスメーターとチップを同時に監視することが重要です。
- 面取り中は、先端のサイズが変化するのを観察し、照明を使用して面取り中に見晴らしの良い場所を作成します。
注:面取りが発生すると、先端は非常に光沢があり、先端の開口部が大きくなります。この段階では、マニピュレーターの微調整ノブを使用してマイクロピペットを上下させることが不可欠です。マイクロピペットをプレートから持ち上げた後、プレートに戻すと、チップが破損する可能性があります。 - 先端が面取りプレートに達するまでゆっくりと下げ続け、抵抗が約20MΩに達するまでゆっくりと面取りします。このプロセスを習得するには、強力な学習曲線が必要であり、先端を一貫して斜めに開く練習が必要になります。
- 抵抗が20MΩに達したら、マイクロピペットをベベラーから持ち上げます。
- マイクロピペットからリードを取り外し、マイクロピペットをベベラーからアンロードします。ベベラーに放置すると、マイクロピペットが壊れるか、先端に大きな開口部ができます。したがって、面取りしながらメーターとチップを監視することが不可欠です。
注:プロトコルはここで一時停止できます。 - 面取りされたマイクロピペットをマイクロピペットホルダーに置き、顕微鏡ソフトウェアの10倍対物レンズを使用して先端の開口部のサイズを測定します。10チップのサンプルサイズは、すべてのベベルチップの一貫性をチェックするのに十分です。
- 顕微鏡の設定(10倍)がカメラの設定と一致していることを確認してから撮影してください。外れ値は、チップの開口部の測定後に捨てられる場合があります。
- ベベラーをオフにするには、駆動ベルトモーターとインピーダンスメーターの両方のスイッチを「オフ」にします。
- 台座/研削プレートを緩めて、上部保持リングを取り外します。台座/研削プレートが互いに取り付けられている間は、真空によって破損する可能性があるため、持ち上げないでください。
- アタッチメントの上部保持リングをネジで持ち上げた後、細かい研削プレートをスライドさせて外し、最後の磁気アタッチメントを持ち上げて取り外します。クォーツオプティカルフラットの余分な油分をラボ用ワイプで取り除きます。
- 3つのコンポーネントすべてを脱イオン(DI)水で洗浄し、塩の結晶形成を防ぐために軽くたたいて乾かします。長期間使用すると、回転する磁気ベースがけいれんすることがあります。その場合は、ドライブベルトに少量のDI水を噴射して、結晶化した塩分を取り除いてください。
- 研削プレートの裏側とクォーツオプティカルフラットの余分な油を拭き取ります。
- ベベラープラットフォーム上のDI水を使用して、装置に付着している可能性のある余分な生理食塩水を取り除き、結晶化を回避します。
- 面取りされた先端はDI水で洗います。チップを洗わないと結晶化しますが、後でDI水で簡単に洗い流すことができます。
- プレートの内側に粘土を置き、カバーガラスを使用してマイクロピペットの汚染を防ぎます。
- マイクロピペットを保持するために粘土にくぼみを作ります。使用する準備ができたら、面取りされた先端に関心のある化合物を埋め戻し、ミミズの血管系に注入する準備が整います。このプロトコルの例では、造影剤であるマイクロバブルを目的の化合物として使用した。
注:プロトコルはここで一時停止できます。
2. マイクロインジェクターのキャリブレーション(先端部が斜めになっている)
- 疎水性コーティングプレートを準備します。
- 前日に、表面に疎水性コーティングを施した2枚のプレートをコーティングして、一晩硬化させます。この化学物質は、店で購入した材料または利用可能な場合は社内のラボ材料から作られている必要があり、硬化には少なくとも12時間必要です。
- コーティングは、2段階の簡単なプロセスです。ベースコートをスプレーしてから、トップコートをスプレーします。
- フード内またはオープンスペースで、ミキシングボールが1分間ガタガタと音を立てたら、ベースコート缶を激しく振った後、ベースコートをプレートにスプレーします。
- プレートをコーティングしながらパスを行うことにより、表面から約6〜12インチのベースコートをプレートにスプレーします。パスは、右から左へ、そして上へ下へと軽いパスで構成されます。プレートがコーティングされている間は揺れ続け、製品の性能を低下させるため、スプレーしすぎないように注意してください。
- ベースコートの別のコーティングを塗布する前に、1〜2分待ちます。必須ではありませんが、必要に応じて追加のコーティングを施すことができます。
- ベースコートが乾くまで30分待ちます。
- トップコートについて手順2.1.3〜2.1.5を繰り返します。
- プレートが一晩または少なくとも12時間硬化すると、プレートに鉱物油を充填する準備が整います。プレートの約半分を鉱物油で満たします。
- 鉱油を入れたプレートをマイクロインジェクターステージに置きます。
- 斜めの先端をマイクロインジェクターにロードします。
- マイクロインジェクターを実験室の圧縮空気ジェットに直接接続します。このシステムには、圧縮窒素ボンベと圧力調整器を使用できますが、他のマイクロインジェクターシステムでは異なるインターフェースが必要になる可能性があることに注意してください。
- 圧縮空気を開き、低圧エアラインレギュレーターを70 PSIまで開き、マイクロインジェクターをオンにします。システムは 80 PSI を超えるものを処理できないため、80 PSI を超えないようにしてください。
- 金属ハブニードル付きの1mLシリンジを使用して、チップを水で埋め戻します。ピペットの内径が異なる場合は、それを収容するために異なるゲージの金属針が必要になります。
- 水を戻したら、マイクロピペットをジョイスティックマイクロマニピュレーターのニードルホルダーにロードします。異なるマイクロインジェクターとマイクロマニピュレーターを使用することができます。
- 水の泡を作り、面取りされたマイクロピペットで分注量を校正します。
注:ミミズの血管系に化合物の投与を導入する前に、マイクロインジェクターをキャリブレーションして適切な量の注入を決定する必要があります。- マイクロインジェクターのパラメータを4 PSIの圧力と0.5秒の時間に設定します。これらのパラメータを超えると、血管のサイズが歪んでしまい、研究者の目標が血管の拡張を研究することでない限り、好ましくありません。
- ピペットチップをプレートの底に近づくまで下げますが、プレートの底でチップを壊さないように注意してください。先端が鉱物油の下位にあるほど、先端の粘性が高くなり、破損につながる可能性があります。
- プレートの端から始めて、キャリブレーション中にプレートを最大限に活用します。
- これが所定の位置になったら、ペダルを踏んでオイルに水泡を分配します。
- 気泡が先端にくっついたままになる場合があります。これを改善するには、プレートを気泡から反対方向にすばやく引き離し、ピペットの先端からプレートを分離します。
- カメラソフトウェアを使用して、気泡のサイズを測定し、体積を計算します。カメラソフトウェアがない場合は、別のソフトウェアを使用できます。
- 10個の気泡を作成し、平均気泡直径を測定して、マイクロピペットがミミズの血管系に分配する正しい量を決定します。
注:研究者がさまざまなボリュームを分注することに興味がある場合は、圧力と時間のパラメーターを操作できます。手順2.3.1〜2.3.7を繰り返します。
3.目的の特定のミミズ血管系を露出させるためのミミズ手術の準備
- ミミズの調製と測定
- 手術前にミミズに麻酔をかける10%エタノール溶液を準備します。
- 実験の合間にミミズを土を入れた100mLのビーカーに入れてください。
- ビーカーには一度に5〜10匹のミミズだけを入れておき、冷蔵庫からベンチトップへの急激な変更によるミミズの乾燥を防ぎ、4°Cから25°Cにします。
- ミミズを10%エタノールに30分間入れます。ミミズが30分経ってもまだ動いている場合は、エタノール溶液にさらに5分間放置します。
注:ミミズは、そのサイズのためにより多くの時間を必要とする場合があります。したがって、エタノール中の時間はミミズのサイズに応じて調整する必要があるかもしれませんが、1時間を超えないようにしてください。1時間以上はミミズに害を及ぼすでしょう。 - ミミズを蛇口の水ですすいで、ミミズが生成するスライムとエタノールを取り除きます。
- ミミズをペーパータオルの上に置いて、余分な水分を取り除きます。
- ミミズに麻酔をかけたら、各ミミズの重量(g)、幅(mm)、長さ(mm)、血管幅(μm)を記録します。ミミズを伸ばさずに、切開を行う前に、ミミズの重量と寸法を取ります。
- 血管を顕微鏡下で外科的に露出したら、カメラソフトウェアを使用して血管の幅を測定します。カメラソフトウェアが利用できない場合は、ステンレス製のマイクロルーラーで十分ですが、デジタルソフトウェアの測定ほど正確ではありません。
注:対象の血管に応じて、ステップ3.2(腹側血管)、3.3(背側血管)、3.4(上面図、心臓)、または3.5(側面図、心臓)にスキップします。
- ミミズの血管系、腹側血管を露出させる(方法1)
- 外科的処置中にゴム製のパッドを使用してミミズを固定し、研究者が関心のある血管を露出させます。肌の暗い部分は下を向いている必要があります。
- ミミズを外科的に開くには、ミミズの暗い部分である背側にミミズを置き、ブレードで約1 mmの皮膚に小さな側面切開を行います。この小さな切開により、手術用ハサミが入り、長い切開が可能になります。
- ミミズの皮を33mm離してピンで留め、容器を露出させるための27mmの開口部を作り、4本のピンのみを使用して容器を適切に露出させます。ミミズをピン留めした後、ピンを追加したり移動したりして、ミミズの皮膚を操作することができます。
- 手術用ハサミで、体の側面にあるもう一方のピンに到達するように切開します。皮膚に向かって押し上げることで、血管系や腸を切るなど、ミミズの内部へのダメージを防ぎます。
- 切開が完了したら、最初の切開が行われた場所をピンで留めるか、再度ピンで留め、次に切り込みの最後にピンで留めます。
- 両方の手術器具(サージカルグリップ)を使用して、皮膚を動かしてミミズの内部を露出させます。
- 皮膚を移動させながら、皮膚を底に固定し、ミミズを上に移動しながら、皮膚を臓器から慎重に分離し続けます。一番上に来たら、最後のピンを配置します。
- 血管が露出していない場合は、ミミズの皮膚の反対側を引っ張ってミミズの弾性組織を分離し、腹側血管を露出させ、さらに皮膚を分離します。
注:この引っ張りは、ミミズの内部の臓器を保持している組織の一部を取り除きます。このステップは、意図せずにミミズの血管を破裂させる可能性があるため、注意してください。腹側血管が露出し、神経索が腹側血管のすぐ隣で平行に皮膚に沿って走っているため、神経索は血管のマーカーとして機能することができます。腹側血管が腸に近い場合、皮膚を引っ張ると血管がさらに露出する可能性があります。そうでない場合は、腸を横に押しますが、これにより作業領域が乱雑になる可能性があります。
- ミミズの血管系、背側血管を露出させる(方法2)
注:背側血管を露出させる手順は、腹側血管の露出と似ています。- 手順3.2の手順3.2.1〜3.2.3を繰り返します。これらの手順では、皮膚の暗い部分が上を向いている必要があります。
- 手術用ハサミを使用して、ミミズの中央に向かって反対側に切ります。
- ミミズの中央から、ミミズの前部である頭に向かって切開します。皮膚に向かって上向きに押すと、血管や腸を切るなど、ミミズの内部への損傷を防ぐことができます。
- 斜めのカットが行われたら、最初の切開の部位をピンで留めるか、再度ピンで留め、次に行われたカットの最後にピンで留めます。
- 手順3.2の手順3.2.6〜3.2.9を繰り返します。
注:背側の血管が露出しているはずです。
- ミミズの血管系を露出させる、心臓の上面図(方法3)
- 外科的処置中にゴム製のパッドを使用してミミズを固定し、研究者が目的の血管を露出させます。
- ミミズを外科的に露出させるには、ミミズの明るい部分である腹側に置きます。肌の暗い部分は上を向いている必要があります。
- 4本のピンを使ってミミズの皮を押さえ、興味のある心を露出させる窓を作ります。合計5本のピンを追加して、ミミズの頭の先端、前端付近でミミズを押さえることができます。
- ミミズを下から上に固定し始め、右側から始めて左側に移動します。ミミズをピンで留め、頭の先端近くの上部、前端、および陰核の近くに2つのピンを配置します。
- ミミズの側面に約1mmの小さな切開を施すために刃を使用します。
- 手術用ハサミを使用して、ミミズの中央に向かって反対側に切ります。
- ミミズの中央から、ミミズの口、つまり前端に到達するまで、ミミズの正面に向かって切り込みを入れます。
注:血管系を切らないように、はさみを皮膚に対して持ち上げることが重要です。皮膚を通り抜けるとハサミの刃が見えてきます。ミミズの前端に切り込みを入れると、心臓の視認性が向上します。 - ピン留めしたら、皮膚がミミズに丸まっている場合は、ミミズを再度ピン留めします。
- ミミズの組織を適切に分離して、心臓を適切に露出させるために引っ張ります。
- 心臓が露出していない場合は、心臓がこれらの小胞の下に隠れることがあるため、白い精嚢を動かします。
注:心臓への曝露はミミズごとに異なる場合があり、10個のハートすべてが見える場合もあれば、半分だけになる場合もあります。この時点で、研究者はミミズの心臓を見つけるために臓器や組織を動かすかどうかを決定する必要があります。
- ミミズの血管系を露出させ、心臓の側面図(方法4)
- 外科的処置中にゴム製のパッドを使用してミミズを固定し、研究者が目的の血管を露出させます。
- ミミズを外科的に露出させるには、ミミズを横に置きます。ミミズが横向きになっているため、ミミズの明るい面と暗い面の両方が見えるはずです。
- 手順3.4から手順3.4.3〜3.4.9を繰り返します。
- 心臓が露出していない場合は、心臓がこれらの小胞の下に隠れることがあるため、白い精嚢を動かします。
注:心臓への曝露はミミズごとに異なる場合があり、5つの心臓すべてが見える場合もあれば、それ以下になる場合があります。この時点で、研究者はミミズの心臓を見つけるために臓器や組織を動かすかどうかを決定する必要があります。
4. ミミズ血管系への化合物投与
- ミミズの化合物投与のための準備
注:これらの特定のステップでは、造影剤であるマイクロバブルを目的の化合物としてミミズの血管系に注入しました。- マイクロインジェクションの前に、ミミズをマイクロインジェクションステージに置き、ラボワイプを使用して目的の血管の周囲の液体を取り除き、注射用の血管系を露出させます。
注意: 強い圧力をかけると血管の出血の原因になりますので、圧力をかけないでください。 - 腹側血管を注射のために位置合わせすることが重要であるため、目的の血管系をマイクロピペットに位置合わせします。心臓が興味深い場合、心臓はマイクロピペットに対して垂直でなければなりません。
- 顕微鏡を目的の血管系に焦点を合わせ、マイクロピペットを血管系まで下げ始めます。ジョイスティックマニピュレーターを移動する前に、最高の機動性を確保するために、ジョイスティックマニピュレーターがすべて0mmに設定されていることを確認してください。
- マイクロピペットの先端がミミズの容器に接触している場合は、容器とマイクロピペットの間の角度が15°未満であることを確認してください。
- マイクロピペットが血管に圧力をかけ始めると、血管系への圧力により血液が先端から離れます。これは、適切な注入配置の良い指標です。
- 注入を成功させるには、ジョイスティックを使用してマイクロピペットを前方に動かし、血管系に接触させます。
注意: 容器に穴を開けないことが重要です。先端は、マイクロピペットが動いている方向に、背側および腹側血管の血管系を動かし、次に粗いダイヤルを使用してマイクロピペットの先端を前方に動かし、血管に完全に挿入されるようにする必要があることに注意してください。プレートが可動式の場合、マイクロコントローラーまたはすべてを同時に使用する代わりに、これを使用して容器を移動させ、マイクロピペットに穴を開けることができます。血管はすぐには貫通しませんが、容器の反動はマイクロピペットの適切な浸透の指標です。先端が容器を貫通したら、容器をまっすぐにしてマイクロピペットと位置合わせする必要があります。そうでない場合は、ファインコントロールを使用してマイクロピペットをゆっくりと引っ込めます。 - ペダルを踏んで、ミミズの血管系を注入します。血液の希釈は、ペダルを踏んだ後の適切な浸透の別の指標です。
- マイクロピペットをゆっくりと引っ込め、マイクロピペットを引き離します。
注:あるいは、マイクロピペットがまだ血管内にある間に先端を壊すことは、失血を避けるための効果的な方法です。
- マイクロインジェクションの前に、ミミズをマイクロインジェクションステージに置き、ラボワイプを使用して目的の血管の周囲の液体を取り除き、注射用の血管系を露出させます。
結果
以下の代表的な結果は、ガラスピペットを引っ張るために使用される設定、特定の開先角度から形成されるピペットの開口部サイズ、およびマイクロインジェクションの圧力と時間を含む一連の特定のパラメータに基づいています。 図 1 には、開始から終了までのプロセスを表すフローの概略図が表示されています。
選択したピペットプーラーのパラメータに基づいて、次のチップがプルから出ます(図2)。RAMP値は、ガラスの種類やフィラメントの配置によっても変化する可能性があることに注意してください。パラメータが許容できる場合、結果として得られる先端は強くなり、面取り用の長いテーパーが付きます。引っ張って先端が折れた場合は、プーラーを再調整する必要があります。
マイクロピペットの面取りについては、6つの面取り角度を試験して最適な角度を決定し、面取りの一般的な容易さを評価し、角度が先端の開口部のサイズにどのように影響するかを調べました。私たちの面取り基準の最適な角度は、鋭い先端を提供し、破損することなく容器を貫通するのに十分な強度があり、再現性が高いため、35°であると決定されました。一般的には、角度が小さいほど、 図3のように先端が鋭くなります。もう1つの興味深い角度は30°で、これはよりシャープですが、再現性のために35°が選択されました。 図4に示すように、マイクロマニピュレータの角度によって、先端の形状と開口部のサイズの両方が変化します。この図では、最も正確で一貫性のある面取りは、30°から40°の間の角度で行われることが示されています。補助テーブル (表 S1) は、面取りのしやすさに基づいて作成されましたが、面取りの手法は人によって異なり、したがってヒントも異なることに注意することが重要です。さらに、マイクロマニピュレーターを急激に下げたり、ガラスがもろくなりすぎたりすると、ベベルの失敗が発生し、先端が破損する可能性があることにも注意してください。
特定のチップサイズでは、コンパウンドを注入する前にキャリブレーションを行う必要があります。注入量は、チップサイズ、マイクロインジェクション圧力、および注入時間に依存します。たとえば、 図 5 では、24.4 μm チップの代表容量ディスペンスがグラフ化されています。データは、一定の注入時間におけるディスペンス量と圧力との間にほぼ直線的な関係があることを明らかにしています。特定のチップ設計について、同様のカスタムキャリブレーションデータを決定する必要があります。
微小血管注射では、特定の製品の注入が成功したことを確認するために目視検査が必要です。目に見える最良のマーカーは、血液の希釈です。 補足動画 や 図6にあるように、血液は希釈されるほど透明感が増し、これは注射が成功した証拠です。マイクロピペットが血管に深く浸透しすぎないこと、およびマイクロインジェクションが血管から15°を超える角度で行われないことが重要であり、そうしないと、ピペットを引き抜くときに、大きな傷のために目的の化合物が血管系から出血します。注射と引っ張りが成功すると、除去時の出血が最小限に抑えられます。
図1:全体的な方法の流れ。 ミミズ血管系のマイクロインジェクションでは、まずピペットを引っ張って先端に微細な開口部を開ける必要があります。次に、マイクロピペットの先端を面取りして、針の先端を鋭くします。開口部が達成されると、マイクロピペットは分注される適切な量に較正されます。キャリブレーションが完了すると、血管系への注入を行うことができます。 この図の拡大版を表示するには、ここをクリックしてください。

図2:成功したプルドマイクロピペット。 プロトコルで使用されるパラメータに基づいて、この先端は引っ張った後に現れます。(A)引っ張られた直後のピペットを実演します。(B)同じピペットを引っ張ったところの画像。 この図の拡大版を表示するには、ここをクリックしてください。

図3:マイクロピペットチップの面取り角度プロファイル。 面取りのために6つの角度がテストされました。角度を45°から20°に小さくすると、切れ味と先端の開口部が増加します。 この図の拡大版を表示するには、ここをクリックしてください。
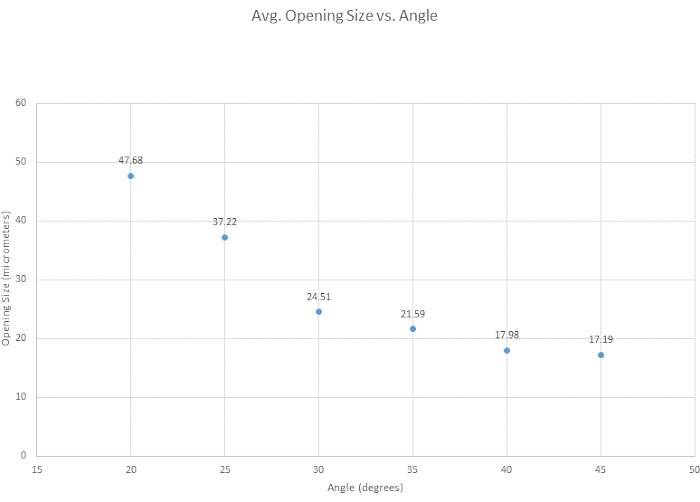
図4:角度が大きくなると先端の開口部が狭くなります。 角度が先端の開口部のサイズにどのように影響するかを確認するために、6つの角度がテストされました。先端の開口サイズは、面取り角度が大きくなると小さくなります。 この図の拡大版を表示するには、ここをクリックしてください。

図5:ボリューム管理のキャリブレーション。 24.4μmのチップサイズの開口部は、時間と圧力の特定のパラメータを使用してデータを表す代表的な結果に使用されました。圧力が増加すると、分配される量は増加し、時間が減少すると、分配される量は減少します。 この図の拡大版を表示するには、ここをクリックしてください。

図6:腹側血管への注入。 注射が成功したことを示すビジュアルは、血液の希釈を指標として示されています。このパネルには補足ビデオが添付されています。 この図の拡大版を表示するには、ここをクリックしてください。
図S1:ミミズの血液と尿の抽出のためのセットアップ。 このファイルをダウンロードするには、ここをクリックしてください。
図S2: 図4からの標準偏差。 角度によって、標準偏差は変化します。35°は標準偏差が低く保たれるため、面取りの一貫性が向上し、先端の破損が少なくなります。表S1に示すように、30°も35°で良好でした。このファイルをダウンロードするには、ここをクリックしてください。
図S3:手術後のミミズの生存を示し、液体バンドエイドを使用してミミズを閉じます。 このファイルをダウンロードするには、ここをクリックしてください。
表S1:面取りを容易にするための説明的なテーブル。 面取りのしやすさを説明するために、簡単なものから中程度、難しいものまで、3つのモードが使用されました。15°がテストされましたが、欠けないマイクロピペットチップを生成するには角度が小さすぎたことに注意してください。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
ミミズが10%エタノール中にある間、特にミミズが高齢の場合、30分を超える曝露時間には望ましくない影響が生じる可能性があります。腸が劣化し始め、ミミズを外科的に開くと、その内部腸が広がります。したがって、若年から中年のミミズを使用することをお勧めします。ミミズの皮膚を切断する過程では、完全なハサミの切断が行われないことが不可欠であり、調査員は半分だけ切断し、最終点に到達するまでハサミを前方に押し続ける必要があります。ミミズを固定するときは、ミミズを伸ばしたり、強く引っ張りすぎたりしないように注意してください。これにより血管が破裂し、出血につながる可能性があります。各注射後、マイクロピペットの内部にある可能性のある液体を分注して、マイクロピペットが詰まっていないか確認し、特に別の注射を行う前にチップから血液を取り除きます。チップの目詰まりを観察するだけでなく、注入のたびにマイクロピペットの先端を見て、チップの破損がないか確認します。マイクロピペットの先端が壊れる可能性もあり、失血を避けるために先端を所定の位置に残します。マイクロインジェクション中は血管組織を注意深く観察することが重要です。マイクロピペットが最初に血管に接触すると、血管組織がマイクロピペットの先端に付着します。先端が血管にうまく浸透すると、血管組織が先端に急速に滑り込むのが見え、マイクロマニピュレーターでも感じられます。注射が成功した後、マイクロピペットが組織の奥深くまで入り込んだり、注射部位に大きな傷ができたりして、化合物の投与が血管から漏れる可能性があるため、マイクロピペットを慎重に引き出すことが重要です。通常、注入は血管径が 90 μm 以上の場合に成功しますが、これは研究者がマイクロピペットの先端サイズを狭くすることで改善できます。ミミズは、ミミズが脱水状態になるのを防ぐために、常に水で湿った状態に保たれていますが、生理食塩水をお勧めします。
ミミズ生存研究
ミミズの生存実験は、実験後にミミズがどのくらいの期間生存できるかについての洞察を与えるために行われました。線虫を10%エタノール溶液に浸し、その後、実験時と同様に外科的に切断して注射した後、27匹の線虫を液体バンドエイド溶液で「縫い合わせ」、実験後最大48時間観察しました。術後12時間で、線虫の約67%がまだ生きていました。術後24時間で、線虫の約48%がまだ生きていました。術後36時間で、線虫の約44%がまだ生きていました。最後に、術後48時間で、線虫の約22%がまだ生きていました。これらの実験の結果は、実験的な手術と注射を受けた後、大多数の線虫が1日12時間生存でき、多数の線虫がそれよりもさらに長く生存できることを示しています(図S3)。これにより、必要に応じて、各線虫を24時間にわたる研究で監視する機会が得られます。
ミミズラボラトリーケア
カナダのナイトクローラーであるミミズは、ウィンザーホールセールベイトから店頭で購入され、発泡スチロールの箱(35w x 38l x 30d cm)に500匹の大きなミミズとして配送され、個々のミミズが取り除かれて実験に使用されました。ミミズ調製プロトコルのステップで述べたように、ミミズの蒸発により一度に使用されたのは10匹以下のミミズであり、これは脱水症16につながる可能性がある。さらに、ミミズの皮膚には光感受性細胞が含まれているため、ミミズの光への曝露は制限されていました。2時間を超える光にさらされると、死に至る可能性があります。到着後すぐに、輸送用コンテナの土壌を変更し、ミミズを24時間待つことで実験に使用しました。これにより、ミミズが再び活力を取り戻し、輸送による疲労がなくなりました。この時点で、ミミズの実験を開始できます。
ミミズの寿命は不明ですが、毎日監視され、適切な栄養素が与えられれば、実験室で長期間生き続けることができます。2週間ごとに、ミミズにより多くの栄養素を提供するために、新しい土壌を容器に追加する必要があります。ミミズは深く穴を掘る無脊椎動物で、古代的で、180 cm(6フィート)の深さの巣穴を作るため、500匹のミミズのコンテナには少なくとも1フィートの土が必要です。容器の底には、ミミズの一部が家を作る場所であるため、古い新聞紙を追加できます。土壌を変えたら、臭いをチェックし、怪我をしたミミズや死んだミミズを見つけることをお勧めします。死んだミミズや怪我をしたミミズをコンテナに入れたままにしないでください、なぜなら彼らは土壌を汚染し、あなたのミミズのコロニー内でより多くの死者を生み出すからです。
将来のアプリケーション
このプロトコルでは、ミミズを使用してハイスループット血液実験を実施するための調製と手順を示します。循環器系に限定されていますが、ここで説明する注射方法は、ミミズの神経索が腹側血管と平行であるため、神経系に関連する研究に拡大できる可能性があります。例えば、ミミズを用いた先行研究は、治療用超音波アプリケーション18,19からの神経調節および血管破裂研究のために研究されてきた。この新しいセットアップにより、さらに詳細な超音波+マイクロバブル研究を実施して、神経調節と血管破裂の研究を拡大することができます。
さらに、ミミズの体腔内腔は、体腔内に存在する体液が免疫応答のすべてではないにしてもほとんどを媒介するため、免疫系の研究に利用できる可能性があります。ミミズは、動物内に2つの体液しか存在せず、それぞれが別々の空洞内に含まれ、血管内の血液と体腔内の体腔内の体液であるという点で独特です。この流体の分離により、2つの空洞での特定の種類の研究が可能になります。例えば、体腔液には多数の体腔細胞が豊富に含まれており、その免疫機能は他のほとんどの動物モデルの体腔細胞と特徴を共有しています。ミミズでは、細胞標的を破壊する可能性のある食細胞やその他の類似細胞の研究を行うことができ、ミミズには、代替の無脊椎動物モデルとして使用できる多くの追加の研究用途がある可能性があります。
ミミズは、人間の解剖学的および生理学的システムの多くの側面をモデル化する複雑さを欠いていますが、マイクロインジェクションは、ヘモグロビン構造の点で人間の血液と驚くほど類似した血液を含む封じ込め循環系を提供します。少量の血液が許容されるアプリケーションでは、ミミズは低コストですぐに利用できる試験プラットフォームを提供し、施設の動物管理および使用委員会から免除されます。その結果、さまざまな化合物を含むミミズの試験を繰り返し行うことができ、標準的な実験脊椎動物を使用した場合の実用範囲をはるかに超えるサンプルサイズで行うことができます。
開示事項
著者は何も開示していません。
謝辞
この研究は、NSF-FDA Scholar-in-Residence Fellowship (NSF-FDA SIR, #1641221)、米国食品医薬品局 Chief Scientist Challenge Grant (FDA OCS)、National Science Foundation Integrative Graduate Education and Research Traineeship (NSF IGERT, #1144646) によって資金提供され、米国食品医薬品局 (FDA) の Office of Science and Engineering Laboratories (OSEL) によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 3M Vetbond Tissue Adhesive | 3M Vetbond | 084-1469SB | 3mL bottle vet adhesive - liquid band-aide |
| 40x Stereo Microscope | Sutter Instrument Co. | BV-10-D | Not needed, can add on other scopes |
| 500 Large Worms | Windsor Wholesale Bait | 500 Large | |
| Beveler pedestal oil | Sutter Instrument Co. | 008 | |
| Blades | Ted Pella, Inc | 121-2 | |
| Borosilicate Glass with Filament | Sutter Instrument Co. | BF150-86-10 | |
| Camera | AmScope | MU500 | |
| Camera | AmScope | MU1803-CK | 8MP USB3.0 Microscope Digital Camera |
| Electrode Impedance Meter | Sutter Instrument Co. | BV-10-C | |
| Ethanol | Sigma Aldrich | E7023-1L | Pure ethanol |
| Filament | Sutter Instrument Co. | FT315B | trough filament |
| Grinding Plate | Sutter Instrument Co. | 104D | Fine Plate |
| Hospital Grade Saline | Baxter Healthcare Corporation | 2F7124 | 0.9% Sodium Chloride Irrigation |
| Joystick Micromanipulator | Narishige | MN-151 | |
| KimWipes Kimtech Science | Kimberly-Clark Professional | 34155 | |
| Leafgro | LeafGro | 589252 | 1.5-cu. ft. |
| Metal Hub Needle | Hamilton | 91024 | Luer Lock Metal Needle |
| Micro Vessel Clips | WPI | 501779-G | |
| Microinjector | TriTech Research | MINJ-D | |
| Micropiette Puller Model P-97 | Sutter Instrument Co. | P-97 | |
| Micropipette Beveler | Sutter Instrument Co. | BV-10-B | |
| Microscope | AmScope | SM-8TPW2-144S | 3.5X-225X Simul-Focal Articulating Microcope |
| Needle Holder | TriTech Research | MINJ-4 | |
| NeverWet | Rust-Oleum | NeverWet | |
| Pyrex Glass | Corning | 08747A | Fisher Manufacturer |
| Stainless Micro-Ruler | Ted Pella, Inc | 13635 | Micro-Ruler mounted on a Handle, 10mm scale, with lines at 0.01mm intervals |
| Surgical Grips | Ted Pella, Inc | 53073 | Forceps, Hemostat |
| Surgical scissors | Ted Pella, Inc | 1320 | Fine Iris Scissors, Straight |
| U.S.P. Mineral Oil Lubricant Laxative | Swan | Mineral Oil |
参考文献
- Stevenson, J. The Oligochaeta. , Claredon Press. Oxford. 685(1930).
- Reynolds, J. W., Reynolds, W. M. Earthworms in medicine. American Journal of Nursing. 72 (7), 1273(1972).
- Gates, G. E. The earthworms of Rangoon. Journal of the Burma Research Society. 25, 196-221 (1926).
- Carr, L. G. K. Interesting animal foods, medicines, and omens of the eastern Indians, with comparisons to ancient European practices. Journal of the Washington Academy of Sciences. 41 (7), 229-235 (1951).
- Price, S. F. Kentucky folk-lore. The Journal of American Folklore. 14 (52), 30-38 (1901).
- Elmer, J., Palmer, A. F., Cabrales, P. Oxygen delivery during extreme anemia with ultra-pure earthworm hemoglobin. Life Sciences. 91 (17-18), 852-859 (2012).
- Eyambe, G. S., Goven, A. J., Fitzpatrick, L. C., Venables, B. J., Cooper, E. L. A non-invasive technique for sequential collection of earthworm (Lumbricus terrestris) leukocytes during subchronic immunotoxicity studies. Laboratory Animals. 25 (1), 61-67 (1991).
- Basley, K., Goulson, D. Effects of chronic exposure to clothianidin on the earthworm Lumbricus terrestris. PeerJ. 5, 3177(2017).
- Mvumi, B. M., Gwenzi, W., Mhandu, M. G. Ecotoxicological effects of citrus processing waste on earthworms. Lumbricus terrestris L. Industrial Crops and Products. 110, 123-129 (2017).
- Furst, A. My saga with earthworms. Food and Chemical Toxicology. 40 (6), 789-791 (2002).
- Cooper, E. L., Hrzenjak, T. M., Grdisa, M. Alternative sources of fibrinolytic, anticoagulative, antimicrobial and anticancer molecules. International Journal of Immunopathology and Pharmacology. 17 (3), 237-244 (2004).
- Cooper, E. L., Hirabayashi, K., Balamurugan, M. Dilong: food for thought and medicine. Journal of Traditional and Complementary Medicine. 2 (4), 242-248 (2012).
- Nagasawa, H., et al. Inhibition by lombricine from earthworm (Lumbricus terrestris) of the growth of spontaneous mammary tumours in SHN mice. Anticancer Research. 11 (3), 1061-1064 (1991).
- Shannon, K. M., Gage, G. J., Jankovic, A., Wilson, W. J., Marzullo, T. C. Portable conduction velocity experiments using earthworms for the college and high school neuroscience teaching laboratory. Advances in Physiology Education. 38 (1), 62-70 (2014).
- National Research Council. A framework for K-12 science education: Practices, crosscutting concepts, and core ideas. , National Academies Press. (2012).
- Ramsay, J. The Osmotic Relations of the Earthworm. Journal of Experimental Biology. 26 (1), 46-56 (1949).
- Mulloney, B. Structure of the Giant Fibers of Earthworms. Science. 168 (3934), 994-996 (1970).
- Kim, Y., Nabili, M., Acharya, P., Lopez, A., Myers, M. R. Microvessel rupture induced by high-intensity therapeutic ultrasound - a study of parameter sensitivity in a simple in vivo model. Journal of Therapeutic Ultrasound. 5 (1), 5(2017).
- Wahab, R. A., et al. Mechanical bioeffects of pulsed high intensity focused ultrasound on a simple neural model. Medical Physics. 39 (1), 4274-4283 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved