Method Article
תולעת אדמה, Lumbricus Terrestris: מודל כלי דם חדשני בהזרקת מיקרו in vivo
In This Article
Summary
תולעי אדמה הן חסרי חוליות חדשניים במודל ספסל למחקרי כלי דם. אנו מציגים טכניקות וציוד המאפשרים ניתוח יעיל והזרקת מיקרו לכלי הדם של תולעי האדמה. מתוארים פרוטוקולים כירורגיים, טכניקות מיקרו-הזרקה וההליך לייצור מיקרו-פיפטות בהתאמה אישית.
Abstract
למרות שבעלי חוליות הם הכרחיים למחקר ביו-רפואי, מחקרים מוגבלים לרוב על ידי גורמים כמו עלות, סקירה פנימית ארוכה ושיקולים אתיים. אנו מציגים את תולעת האדמה כחסר חוליות חלופי, זול, המתאים למחקרי כלי דם ראשוניים מסוימים. בשל הזמינות הניתוחית של כלי הגב, כלי הגחון וחמישה זוגות של לבבות מדומים של תולעת האדמה, תולעי אדמה נגישות בקלות, מציעות תחזוקה בעלות נמוכה ודורשות מתן של מינונים קטנים בלבד של תרכובת נתונה. מודל תולעי האדמה מספק מערכת דם סגורה פשוטה עם מבנה המוגלובין הדומה לדם אנושי. ניתן פרוטוקול להרדמת תולעי האדמה וביצוע חתכים כירורגיים לחשיפת כלי דם רלוונטיים. מיקרופיפטות למתן תרכובות נוצרות על ידי חימום ומשיכת זכוכית עם מושך פיפטה ושימוש במערכת שיפוע ליצירת קצה מחט עדין בקנה מידה מיקרוני. לאחר מכן משתמשים בקצוות עם מיקרו-פוזיציה ומיקרו-מזרק כדי להזריק תרכובות שרירותיות למערכת כלי הדם של תולעת אדמה, שוב ושוב, עם זמינות של גדלי מדגם גדולים ונפחי תרכובות קטנים. פרטים על המורכבויות של הליך ההזרקה ניתנים. גודל כלי הדם הקטן של תולעת האדמה מאתגר, במיוחד במקרה של כלי הגחון; עם זאת, שליטה בטכניקות המוצגות מציעה יכולת חזרה גבוהה כפתרון בעלות נמוכה, מה שהופך מחקרים בגודל מדגם גדול מאוד למעשיים.
Introduction
תולעת האדמה שימשה כאינדיקטור ביולוגי חשוב ובדיקה ביולוגית ליישומים מדעיים קודמים 1,2,3,4,5,6; זהו אורגניזם אידיאלי להערכת סיכונים ביולוגיים מפסולת מסוכנת ורעילה בסביבות יבשתיות למחקרי הצטברות ביולוגית באתרם, כגון ביוצידים (קוטלי חרקים) בקרקע והשפעות אקוטוקסיקולוגיות שליליות 7,8,9,10. בנוסף, בשל ביו-פרוספקטיביות, תולעת האדמה היא מקור חלופי למולקולות פיברינוליטיות, אנטי-קרישה, אנטי-מיקרוביאליות ואנטי-סרטניות11,12; עד כדי כך שצוות בשנת 1991 חילץ וטיהר לומבריצין מעור תולעי האדמה והניח על גידולי חלב של עכברי SHN, מה שהוביל לעיכוב גדילת הגידול13. תולעת האדמה היא גם מודל חי שימושי מבחינה פדגוגית, שכן ניתן להשתמש בה כדי לחשוף את התלמידים לניתוח ולהבנת האנטומיה של דגימה; מחקר זרימת הדם לאלקטרופיזיולוגיה14,15.
במחקר שלנו בחנו את התגובה של כלי הדם של תולעי אדמה חיות לאולטרסאונד בעוצמה גבוהה18. מצאנו שקרע בכלי הדם בתולעת התרחש בתנאים דומים לאלה שקישרנו לנזקי קרע במיקרו-כלי דם אנושיים. העבודה המתמשכת שלנו כוללת הזרקה של מיקרו-בועות לתוך כלי הדם של תולעי האדמה. מיקרו-בועות מורכבות מגז כבד עטוף במעטפת שומנים, אלבומין או פולימר, חומרים אלה יכולים לשמש כחומרי ניגוד תמונה כמו גם ככלי לאספקת תרופות ממוקדת.
פרוטוקול חדשני זה רלוונטי לכל מחקר שיפיק תועלת מהזרקה תוך ורידית (IV) של תרכובת שיכולה לנצל את האינדיקטורים הביולוגיים הטבעיים של תולעת האדמה. הגישה מבוססת על מיקרו-הזרקה לווריד לאחת מכמה נקודות כניסה אפשריות, כולל כל אחד מהלבבות המדומים של תולעת האדמה, כלי הגב וכלי הגחון. ההליך כולל חתך כירורגי משוכלל לחשיפת כלי הדם, ואחריו הזרקה מבוקרת מיקרו-מיקום. זה מושג באמצעות מיקרו-פיפטות מותאמות אישית שנבנו במיוחד עבור מיקרו-הזרקת כלי דם של תולעי אדמה. מיקרופיפטות אלו מאפשרות מיקוד מדויק של כלי דם קטנים כמו כלי גחון בקוטר 90 מיקרומטר.
פרוטוקול זה נועד לשפר טכניקות מיקרו-פיפטינג קודמות, כולל מחקר משנת 1948 למיצוי דם ושתן של תולעי אדמה16. כפי שניתן לראות באיור S1, ההגדרה לחילוץ זה יכולה להיות קשה, וכפי שציין המחבר, יכולה להימשך עד שעה או יותר. שיטה דומה פותחה בשנת 1970, אך המחבר חווה מספר קצוות שבורים בזמן הזרקת נוזלים לסיבי הענק של תולעת האדמה17. בשיטה הנוכחית המתוארת להלן, שאיבת דם היא עניין של שניות עד דקות והיא רלוונטית הן להזרקת תרכובות והן למיצוי נוזלי תולעי אדמה. במקרה הספציפי הזה, הזרקנו חומרי ניגוד, מיקרו-בועות.
Protocol
1. הכנת מיקרופיפטה: משיכת זכוכית וקצה משופע
- משיכת מיקרופיפטה
- הפעל את חולץ המיקרו-פיפטה ובחר תוכנית להזנת פרמטרים ספציפיים עבור מיקרו-הזרקת תולעי אדמה.
- הגדר פרמטרים ללחץ = 500, משיכה = 75, זמן = 250, חום = 336 ומהירות = 70. התוצאות עשויות להשתנות ממושך למושך; לכן, התנסו בפרמטרים כדי להשיג את הקצה הרצוי (גודל, חדות, צורה וכו').
- הקפד לבצע בדיקת RAMP כדי לקבוע את ערך החום עבור המיקרופיפטות לפני משיכתן, שכן אי ביצוע זה עלול להוביל לשריפת חוט השוקת או לשבירת הזכוכית.
- אם יש צורך לשנות את לחץ האוויר, לחץ על לחצן הניקוי, בחר לא (0) כאשר תתבקש לנקות את כל הערכים ובחר שנה לחץ (2). תהליך זה עשוי להשתנות ממושך למושך; לכן, חפש את מדריך המכשיר על מנת לשנות את הגדרות הלחץ.
- פתח את מכסה מושך המיקרופיפטה וטען מיקרופיפטה לתוך המושך. זכוכית המיקרופיפטה ששימשה הייתה זכוכית בורוסיליקט עם פיפטה נימה: 10 ס"מ אורך, קוטר חיצוני: 1.5 מ"מ וקוטר פנימי: 0.86 מ"מ.
- החלק את הפיפטה לתוך חריץ ה-V מימין לאורך חריץ הפיפטה עד שקצה הפיפטה מתיישר עם קצה מחזיק הפיפטה. כדי להבטיח שהפיפטה יכולה לנוע על פני החוט לצד הנגדי, דחוף את הפיפטה רחוק ככל האפשר תוך הקפדה שהיא תישאר מונחת על חריץ הפיפטה.
- כדי לנעול את הפיפטה, הדק את הכפתור בצד ימין והחלק את המערכת הנעולה יחד עם הפיפטה עד שהיא מגיעה לצד השני של המושך דרך הנימה. לבסוף, נעל את הצד השמאלי של הפיפטה למושך. הפיפטה צריכה להיות באמצע הנימה; עיין במדריך לקבלת הוראות כיצד ליישר נכון את הפיפטה.
- לאחר טעינת הפיפטה, סגור את המושך, לחץ על כפתור המשיכה והמתן עד למשיכת הפיפטה לפני הסרת שתי הפיפטות שנוצרו.
- שחרר את הכפתורים כדי להסיר את הפיפטות והיזהר לא לחתוך את הפיפטות במהלך ההסרה מהחריץ.
- הנח את המיקרופיפטות המשוכות על מחזיק מיקרופיפטה או סוג כלשהו של תמיכה כדי להחזיק את המיקרופיפטה במקומה ולאפשר סיבוב קל מבלי לשבור את המיקרופיפטות הנמשכות. פיתחנו מחזיק מיקרופיפטה משלנו שניתן ליצור בחנות מכונות או אפילו להדפיס בתלת מימד.
הערה: ניתן להשהות את הפרוטוקול כאן. - הנח את מחזיק המיקרופיפטה מתחת למיקרוסקופ והשתמש בתוכנת מצלמה, או בתוכנה דומה, כדי לצלם תמונה של המיקרופיפטות הנמשכות וכדי להקליט את קוטר הקצה באמצעות הגדלה של פי 10 ~1000 מ"מ ו~50 מ"מ מהקצה.
- לפני צילום תמונה, ודא שהגדרות המצלמה תואמות להגדרת המיקרוסקופ (פי 10), על מנת למדוד בדיוק, במיוחד עבור מדידות לאחר הדמיה. ההגדרה 10x נמצאת ברצועת הכלים האופקית של סרגל הכלים הממוקמת ליד החלק העליון של המסך.
- כדי view וללכוד תמונה של המיקרופיפטה, בחר את המצלמה בתוכנת המצלמה הממוקמת בפינה השמאלית העליונה ולחץ על לחצן הצמד לאחר התמקדות בקצה כדי לקבל קריאה מדויקת. לחצן הצמד ממוקם בסרגל הכלים האופקי בצד שמאל של העמוד מתחת לכרטיסיית המצלמה.
- בצע מדידות של המיקרופיפטות המשוכות כדי לקבוע אם הושגו גודל הקצה והעקביות הרצויים. משיכה של עד 5 פיפטות מספיקה כדי לקבוע אם המושך והפרמטרים שלו מייצרים באופן עקבי את הגודל הרצוי. אם גודל הקצה הרצוי לא הושג, או אם הגודל ממשיך להשתנות לכל פיפטה, ייתכן שהחוקר יצטרך להתנסות בהגדרות שונות עד להשגת גודל הקצה הרצוי, או שיהיה צורך לתקן את מיקום החוט והפיפטה, מה שעשוי לדרוש התייחסות למדריך מושך הפיפטה.
הערה: ניתן להשהות את הפרוטוקול כאן.
- הגדרה לשיפוע המיקרופיפטה ושימוש במד עכבת האלקטרודה
- כדי לשפוע את המיקרופיפטות הנמשכות, השתמש במיקרופיפטה משופעת עם מד עכבת אלקטרודה ומיקרוסקופ סטריאו פי 40.
הערה: ניתן להשתמש בשיפועים אחרים; אפילו שיפועים פנימיים מוצלחים, בנוסף ניתן להשיג תצורות שונות עם מיקרוסקופים שונים כדי לבחון את תהליך השיפוע, כולל הרכבת מצלמה על המיקרוסקופ. - הרכיבו את הכן/לוחית השחזה עם הצלחת העדינה בין שני המחזיקים השחורים.
- הנח את הצלחת התחתונה כשהמגנטים פונים הרחק מהצלחת.
- הברג את שלושת החלקים יחד: (1) טבעת השמירה העליונה, (2) צלחת השחזה העדינה ו-(3) טבעת השמירה התחתונה (מגנטית). זהה את המשטח השוחק של צלחת השחזה; עבור הצלחת העדינה, זהו צבע סגול וצריך להיות פונה כלפי מעלה כך שהזכוכית תהיה במגע עם השטוח האופטי של הקוורץ.
- הנח חמש טיפות של שמן הדום השיפוע, או כמה שצריך, על השטוח האופטי קוורץ של מכשיר השיפוי והנח את הצלחת המורכבת מעל. שמן זה יכול להחזיק מעמד כל היום, אך אם הצלחת מטלטלת או לא מסתובבת כשצריך, ייתכן שיהיה צורך לשמן מחדש את השטוח האופטי של הקוורץ.
- סובב את הצלחת ידנית כמה פעמים כדי לפזר את השמן ואז ניתן להפעיל את המכשיר.
- כדי להגדיר את מד העכבה, הוסף מי מלח (0.9% NaCl) על הפתיל, שהוא חוט הייחוס, והנח את הפתיל על צלחת השיפוע. משרים את הסרט כדי ליצור מעגל עם המיקרופיפטה, ומכסים את הצלחת בשכבה דקה של תמיסת מלח.
- חבר את קטע העופרת לקצה החוט המחובר למד העכבה.
- סובב את מתג "ההפעלה" במד העכבה והשאיר במצב "המתנה" עד שיהיה מוכן להתחיל בשיפוע. מכיוון שאנו יוצרים פתח גדול, הגדר את מד עכבת האלקטרודה ל-x0.1 כאשר הוא מוכן לשיפוע.
- כדי לשפוע את המיקרופיפטות הנמשכות, השתמש במיקרופיפטה משופעת עם מד עכבת אלקטרודה ומיקרוסקופ סטריאו פי 40.
- טעינת המיקרופיפטה ושיפוע
- טען את המיקרופיפטה על מהדק הפיפטה שנמצא על המניפולטור והדק את הכפתור כדי להחזיק אותו במקומו בזמן השיפוע.
- דרך הקצה האחורי של המיקרופיפטה, מלאו את כל הפיפטה במי מלח, והכניסו את העופרת למיקרופיפטה, כדי לוודא שאין בועות אוויר במיקרופיפטה. הבחין כי נוכחותן של בועות אוויר במיקרופיפטה גורמת לשונות במדידות.
- הפעל את מד העכבה על ידי מעבר ממצב "המתנה" ל-"x0.1". ההתנגדות צריכה להיות בתחילה 100 MΩ וכאשר קצה המיקרופיפטה נוגע במי המלח, הוא אמור להציג קריאה שונה.
- כדי לשיפוע את גודל פתח הקצה הנכון, לפני הורדת המיקרופיפטה, כוונן את הזווית ל-35° על המניפולטור כדי להשיג שיפוע עקבי. גם זווית של 30° מספיקה אך בין השניים, 35° מחזיקה בסטיית תקן נמוכה יותר, ולכן עקבית יותר בשיפוע והקצה נשבר פחות.
- בעזרת המניפולטור, מקם את קצה המיקרופיפטה כשני שליש ממרכז הסיבוב של צלחת השחזה.
- בעזרת כפתור הכוונון הגס, הורד את המיקרופיפטה קרוב לצלחת כך שקצה המיקרופיפטה יתקרב לתמיסת המלח. אם אין מצלמה זמינה, חשוב להסתכל למטה במיקרוסקופ כדי לראות את השיפוע של הקצה.
- ברגע שקצה המיקרופיפטה בא במגע עם מי המלח, קריאת מד העכבה אמורה לרדת מ-100 MΩ לערך בטווח שבין 80 ל-20 MΩ. ערך זה ישתנה עקב פתח הזכוכית הנמשך.
- בשלב זה, עבור מכפתור הכוונון הגס לכפתור הכוונון העדין כדי להוריד את הפיפטה לאט יותר כדי למנוע שבירת הקצה בצלחת. חשוב לעקוב אחר מד העכבה והקצה בו זמנית בשלב זה של השיפוע.
- בזמן שיפוע, שימו לב שגודל הקצה משתנה, והשתמשו בתאורה כדי ליצור נקודת תצפית טובה בזמן השיפוע.
הערה: הקצה יהפוך מבריק במיוחד ככל שמתרחש שיפוע, ופתח הקצה יהפוך גדול יותר. חובה להשתמש בכפתור הכוונון העדין במניפולטור כדי להוריד או להעלות את המיקרופיפטה בשלב זה. לאחר הרמת המיקרופיפטה מהצלחת, החזרתה לצלחת עלולה לגרום לשבירת הקצה. - המשך להוריד את הקצה לאט עד שהוא מגיע לצלחת המשופעת ושיפוע איטי עד שמגיעים להתנגדות של כ-20 MΩ. שליטה בתהליך זה תהיה עקומת למידה חזקה והיא תדרוש תרגול כדי לשפע את הקצה באופן עקבי.
- כאשר מגיעים להתנגדות של 20 MΩ, הרם את המיקרופיפטה מהשיפוע.
- הסר את העופרת מהמיקרופיפטה ופרוק את המיקרופיפטה מהשיפוע. אם משאירים אותו על השיפוע, המיקרופיפטה יכולה להישבר או ליצור פתח גדול יותר בקצהו; לכן, חיוני לעקוב אחר המונה והקצה בזמן השיפוע.
הערה: ניתן להשהות את הפרוטוקול כאן. - הנח את המיקרופיפטה המשופעת על מחזיק המיקרופיפטה והשתמש במטרה פי 10 בתוכנת המיקרוסקופ כדי למדוד את גודל פתח הקצה. גודל מדגם של 10 טיפים מספיק כדי לבדוק עקביות בכל הטיפים המשופעים.
- ודא שהגדרת המיקרוסקופ (10x) תואמת את הגדרות המצלמה לפני צילום תמונה. חריגים עלולים להיזרק לאחר מדידות פתיחת הקצה.
- כדי לכבות את השיפוע, סובב את המתג למצב "כבוי" הן במנוע חגורת הנהיגה והן במד העכבה.
- הברג את הכן/לוחית השחזה כדי להסיר את טבעת השמירה העליונה. אין להרים את הכן/לוחית השחזה כשהם מחוברים זה לזה מכיוון שהיא עלולה להישבר עקב ואקום שנוצר.
- לאחר הרמת טבעת השמירה העליונה של החיבור עם הברגים, החלק את לוחית השחזה העדינה והרם את החיבור המגנטי האחרון על מנת להסיר אותו. הסר את עודפי השמן על השטוח האופטי קוורץ בעזרת מגבוני מעבדה.
- נקו את כל שלושת הרכיבים במים נטולי יונים (DI) וייבשו בטפיחות כדי למנוע היווצרות גבישי מלח. לאחר תקופות ארוכות של שימוש, הבסיס המגנטי המסתובב עלול לחוות טלטול. אם זה קורה, יש להשפריץ כמות קטנה של מי DI על חגורת ההינע כדי להסיר מלח גבישי.
- נגב את עודפי השמן בגב צלחת השחזה וכן על השטוח האופטי קוורץ.
- השתמש במי DI על פלטפורמת השיפוע כדי להסיר עודפי מלח שעלולים להיות על המכשיר כדי למנוע התגבשות.
- השתמש במי DI כדי לשטוף את הקצוות המשופעים. אם הקצוות לא נשטפים, הם יתגבשו אך ניתן לשטוף אותם בקלות במי DI מאוחר יותר.
- הניחו חימר בתוך צלחת והשתמשו בזכוכית הכיסוי כדי למנוע זיהום של המיקרופיפטות.
- צור חריצים בחימר כדי להחזיק את המיקרופיפטות. כאשר הם מוכנים לשימוש, הקצוות המשופעים מוכנים כעת למילוי חוזר בתרכובת מעניינת ולהזרקה לכלי הדם של תולעת האדמה. עבור דוגמה זו לפרוטוקול, חומרי ניגוד, מיקרו-בועות, שימשו כתרכובת המעניינת.
הערה: ניתן להשהות את הפרוטוקול כאן.
2. כיול מיקרו-מזרק עם טיפים משופעים
- הכינו צלחת מצופה הידרופובית.
- יום לפני, מצפים שתי צלחות בציפוי הידרופובי על פני השטח לריפוי בן לילה. כימיקל זה צריך להיות מחומרים שנרכשו בחנות או מחומרי מעבדה פנימיים, אם זמינים, ויש צורך לפחות 12 שעות לריפוי.
- ציפוי הוא תהליך מהיר בן שני שלבים. יש לרסס עם שכבת הבסיס ולאחר מכן לרסס עם השכבה העליונה.
- במכסה המנוע, או בשטח פתוח, רססו את שכבת הבסיס על הצלחת לאחר ניעור נמרץ של פחית מעיל הבסיס לאחר שכדורי הערבוב שקשקשו במשך דקה אחת.
- רססו את הצלחת עם שכבת הבסיס כ-6-12 אינץ' מהמשטח על ידי ביצוע מעברים תוך ציפוי הצלחת. המעברים מורכבים ממעברי אור מימין לשמאל ולאחר מכן למעלה ולמטה. המשיכו לרעוד כשהצלחת מצופה והקפידו לא לרסס יתר על המידה מכיוון שזה יפחית את ביצועי המוצר.
- יש להמתין 1-2 דקות לפני מריחת ציפוי נוסף של שכבת הבסיס. למרות שאין צורך בכך, ניתן ליישם את הציפוי הנוסף במידת הצורך.
- יש להמתין 30 דקות לייבוש שכבת הבסיס.
- חזור על שלבים 2.1.3 - 2.1.5 עבור המעיל העליון.
- לאחר שהצלחת נרפאה למשך הלילה או למשך 12 שעות לפחות, הצלחת מוכנה למילוי בשמן מינרלי. מלאו את הצלחת בערך במחצית הדרך בשמן מינרלי.
- הנח את הצלחת עם שמן מינרלי על המיקרו-מזרק stage.
- טען את הקצוות המשופעים על המיקרו-מזרק.
- חבר את המיקרו-מזרק ישירות לסילון אוויר דחוס במעבדה. ניתן להשתמש בגליל חנקן דחוס ובווסת לחץ עבור מערכת זו, אך שימו לב שמערכות מיקרו-מזרקים אחרות עשויות לדרוש ממשק שונה.
- פתח את האוויר הדחוס ופתח את ווסת קו האוויר בלחץ נמוך ל-70 PSI והפעל את המיקרו-מזרק. אל תעלה על 80 PSI, מכיוון שהמערכת אינה יכולה להתמודד עם יותר מ-80 PSI.
- מלאו את הקצוות במים באמצעות מזרק של 1 מ"ל עם מחט רכזת מתכת. אם הקוטר הפנימי של הפיפטה שונה, יהיה צורך במחט מתכת אחרת כדי להכיל אותה.
- לאחר מילוי חוזר במים, טען את המיקרופיפטה על מחזיק המחט של המיקרומניפולטור של הג'ויסטיק. ניתן להשתמש במיקרו-מזרקים ומיקרומניפולטורים שונים.
- צור בועות מים כדי לכייל את נפח החלוקה באמצעות מיקרופיפטה משופעת.
הערה: לפני הכנסת תרכובת כלשהי לכלי הדם של תולעת האדמה, יש לכייל את המיקרו-מזרק כדי לקבוע הזרקת נפח נכונה.- הגדר את הפרמטרים במיקרו-מזרק ללחץ ב-4 PSI וזמן ב-0.5 שניות. חריגה מפרמטרים אלה תעוות את גודל הכלי, דבר שלילי, אלא אם מטרת החוקר היא לחקור את התרחבות הכלי.
- הורד את קצה הפיפטה עד שהוא קרוב לתחתית הצלחת אך היזהר לא לשבור את הקצה בתחתית הצלחת. ככל שהקצה נמוך יותר בשמן המינרלי, כך הוא יהיה צמיג יותר בקצה, מה שעלול להוביל לשבירה.
- התחל בקצה הצלחת כדי לנצל את הצלחת באופן מלא במהלך הכיול.
- ברגע שזה במקומו, לחץ על הדוושה כדי להוציא בועת מים בשמן.
- הבועה עשויה להישאר דבוקה לקצה. כדי לתקן זאת, משוך במהירות את הצלחת בכיוון ההפוך מהבועה כדי להפריד אותה מקצה הפיפטה.
- בעזרת תוכנת המצלמה, מדוד את גודל הבועה וחשב את עוצמת הקול. אם אין תוכנת מצלמה זמינה, ניתן להשתמש בתוכנה חלופית.
- צור 10 בועות ומדוד את קוטר הבועה הממוצע כדי לקבוע את הנפח הנכון שהמיקרופיפטה תחלק לכלי הדם של תולעי האדמה.
הערה: אם החוקר מעוניין לחלק מגוון נפחים, ניתן לתפעל את הפרמטרים של לחץ וזמן; חזור על שלבים 2.3.1 - 2.3.7.
3. הכנה לניתוח תולעי אדמה לחשיפת כלי דם ספציפיים של תולעי אדמה מעניינים
- הכנה ומדידות של תולעי אדמה
- הכינו תמיסת אתנול 10% שתרדים את תולעי האדמה לפני הניתוח.
- שמור תולעי אדמה בכוס של 100 מ"ל עם אדמה בין הניסויים.
- שמור רק 5-10 תולעי אדמה בכל פעם בכוס כדי למנוע מתולעי האדמה להתייבש עקב השינויים הפתאומיים מהמקרר לספסל, 4 מעלות צלזיוס עד 25 מעלות צלזיוס.
- מניחים את תולעי האדמה באתנול 10% למשך 30 דקות. אם תולעת האדמה עדיין נעה לאחר 30 דקות, השאירו אותה בתמיסת האתנול למשך 5 דקות נוספות.
הערה: לפעמים תולעת האדמה זקוקה לזמן רב יותר בשל גודלה; לכן, ייתכן שיהיה צורך להתאים את הזמן באתנול בהתאם לגודל תולעי האדמה, אך לא לעלות על יותר משעה. יותר משעה תפגע בתולעת האדמה. - שטפו את תולעת האדמה מתחת למי הברז כדי להסיר את הרפש שהיא מייצרת ואתנול.
- הניחו את תולעת האדמה על מגבת נייר כדי להסיר עודפי מים.
- לאחר שתולעת האדמה מורדמת, רשמו את המשקל (g), הרוחב (מ"מ), האורך (מ"מ) ורוחב הכלי (מיקרומטר) של כל תולעת אדמה. קח את המשקל והממדים של תולעת האדמה לפני ביצוע חתכים כלשהם ומבלי למתוח את תולעת האדמה.
- לאחר שכלי השיט נחשף בניתוח תחת מיקרוסקופ, השתמש בתוכנת המצלמה כדי למדוד את רוחב הכלי. אם אין תוכנת מצלמה זמינה, מיקרו-סרגל אל חלד יספיק, אם כי הוא אינו מדויק כמו מדידת תוכנה דיגיטלית.
הערה: בהתאם לכלי המבוקש, דלג לשלב 3.2 (כלי גחון), 3.3 (כלי גבי), 3.4 (מבט עליון של לבבות) או 3.5 (מבט צדדי של לבבות).
- חשיפת כלי הדם של תולעי האדמה, כלי הגחון (שיטה 1)
- השתמש בכרית גומי במהלך ההליך הכירורגי כדי להצמיד את תולעת האדמה כלפי מטה ובכך לחשוף את הכלי המעניין את החוקר. החלק הכהה של העור צריך להיות פונה כלפי מטה.
- כדי לפתוח את תולעת האדמה בניתוח, הניחו אותה על הצד הגבי שלה, החלק הכהה יותר של תולעת האדמה, שם נעשה חתך צדדי קטן על העור של כ-1 מ"מ עם להב. חתך קטן זה מאפשר למספריים הכירורגיים להיכנס ליצירת חתך ארוך.
- הצמידו את עור תולעי האדמה למרחק של 33 מ"מ זה מזה, וצרו פתח של 27 מ"מ כדי לחשוף את הכלי, רק באמצעות ארבעה סיכות כדי לחשוף כראוי את הכלי. אפשר להוסיף סיכות או להזיז אותן, אחרי שתולעת האדמה הוצמדה, כדי לסייע במניפולציה של העור של תולעת האדמה.
- בעזרת מספריים כירורגיים, בצע חתך כדי להגיע לסיכה השנייה בצד גופו. על ידי דחיפה כלפי מעלה לכיוון העור, הוא מונע כל נזק לחלק הפנימי של תולעת האדמה, כגון חיתוך כלי הדם או המעיים.
- לאחר ביצוע החתך, הצמד או הצמד מחדש למקום בו בוצע החתך הראשון ולאחר מכן בסוף החיתוך.
- באמצעות שני הכלים הכירורגיים (אחיזות כירורגיות), הזיזו את העור כדי לחשוף את החלק הפנימי של תולעת האדמה.
- הצמידו את העור בתחתית תוך כדי הזזת העור, ותוך כדי תנועה במעלה תולעת האדמה, המשיכו להפריד את העור מהאיברים בזהירות. ברגע שהגעתם למעלה, הניחו את הסיכה האחרונה.
- אם הכלי אינו חשוף, משכו בצדדים מנוגדים של העור של תולעת האדמה כדי להפריד את הרקמה האלסטית של תולעת האדמה כדי לחשוף את כלי הגחון ולהפריד עוד יותר את העור.
הערה: המשיכה הזו תסיר חלק מהרקמה שמחזיקה את האיברים בתוך תולעת האדמה. היזהר בשלב זה, מכיוון שהוא עלול לקרוע את כלי הדם של תולעת האדמה שלא במתכוון. כעת צריך לחשוף את כלי הגחון, וחוט העצב יכול לתפקד כסמן של כלי הדם, מכיוון שחוט העצב עובר לאורך העור ממש ליד כלי הגחון ובמקביל לו. אם כלי הגחון קרוב למעי, משיכה בעור עלולה לחשוף עוד יותר את הכלי. אם לא, דחוף את המעי הצידה, אך הדבר עלול לגרום לאזור עבודה מבולגן.
- חשיפת כלי הדם של תולעי האדמה, כלי הגב (שיטה 2)
הערה: שלבים לחשיפת כלי הגב דומים לחשיפת כלי הגחון.- חזור על שלבים 3.2.1 - 3.2.3 של שלב 3.2. החלק הכהה של העור צריך להיות פונה כלפי מעלה עבור שלבים אלה.
- השתמש במספריים כירורגיים כדי לחתוך לכיוון אמצע תולעת האדמה לצד הנגדי.
- מאמצע תולעת האדמה, בצעו חתך לכיוון החלק הקדמי של תולעת האדמה, הראש. דחיפה כלפי מעלה לכיוון העור מונעת כל נזק לחלק הפנימי של תולעת האדמה, כמו למשל חיתוך כלי הדם או המעיים.
- לאחר ביצוע החיתוך האלכסוני, הצמד או הצמד מחדש את מקום החתך הראשון ולאחר מכן בסוף החיתוך שנעשה.
- חזור על שלבים 3.2.6 - 3.2.9 בשלב 3.2.
הערה: כעת יש לחשוף את כלי הגב.
- חשיפת כלי הדם של תולעי האדמה, מבט מלמעלה על הלבבות (שיטה 3)
- השתמש בכרית גומי במהלך ההליך הכירורגי כדי להצמיד את תולעת האדמה כלפי מטה, ובכך לחשוף את הכלי המעניין את החוקר.
- כדי לחשוף את תולעת האדמה בניתוח, הניחו אותה על הצד הגחוני שלה, החלק הקל של תולעת האדמה. החלק הכהה של העור צריך להיות פונה כלפי מעלה.
- השתמשו בארבע סיכות כדי להחזיק את העור של תולעת האדמה וליצור חלון כדי לחשוף את לבבות העניין. סיכה נוספת, בסך הכל חמישה, יכולה לשמש כדי להחזיק את תולעת האדמה ליד קצה ראשה, הקצה הקדמי.
- התחילו להצמיד את תולעת האדמה מלמטה למעלה, התחילו בצד ימין ואז עברו לצד שמאל. הצמד את תולעת האדמה, הנח שני סיכות בחלק העליון ליד קצה הראש, הקצה הקדמי ושניים ליד הדגדגן.
- השתמש בלהב כדי לבצע חתך קטן של כ -1 מ"מ בצד תולעת האדמה.
- השתמש במספריים כירורגיים כדי לחתוך לכיוון אמצע תולעת האדמה לצד הנגדי.
- מאמצע תולעת האדמה, חתכו לכיוון החלק הקדמי של תולעת האדמה עד שתגיעו לפה של תולעת האדמה, הקצה הקדמי.
הערה: חשוב שהמספריים יורמו על העור כדי למנוע חיתוך כלי הדם; להב המספריים נראה כשאתה עובר דרך העור. ודא שהחתך נעשה בקצה הקדמי של תולעת האדמה מכיוון שזה יספק נראות טובה יותר של הלבבות. - לאחר ההצמדה, הצמידו מחדש את תולעת האדמה, אם העור מתכרבל לתוך תולעת האדמה.
- בצע משיכה כדי להפריד כראוי את רקמת תולעת האדמה כדי לחשוף כראוי את הלבבות.
- אם הלבבות אינם חשופים, הזיזו את שלפוחיות הזרע הלבנות, מכיוון שהלבבות לפעמים מסתתרים מתחת לשלפוחיות אלה.
הערה: החשיפה ללב עשויה להשתנות מתולעי אדמה לתולעי אדמה, כל 10 הלבבות עשויים להיות גלויים או רק חצי וכן הלאה. בשלב זה, החוקר צריך להחליט אם להזיז איברים ורקמות על מנת לאתר את הלבבות של תולעת האדמה.
- חשיפת כלי הדם של תולעי האדמה, מבט מהצד על הלבבות (שיטה 4)
- השתמש בכרית גומי במהלך ההליך הכירורגי כדי להצמיד את תולעת האדמה כלפי מטה, ובכך לחשוף את הכלי המעניין את החוקר.
- כדי לחשוף את תולעת האדמה בניתוח, הניחו אותה על צדה. מאחר שתולעת האדמה נמצאת בצד שלה, גם הצד הבהיר וגם הצד האפל של תולעת האדמה צריכים להיות גלויים.
- חזור על שלבים 3.4.3 - 3.4.9 משלב 3.4.
- אם הלבבות אינם חשופים, הזיזו את שלפוחיות הזרע הלבנות, מכיוון שהלבבות לפעמים מסתתרים מתחת לשלפוחיות אלה.
הערה: החשיפה ללב עשויה להשתנות מתולעי אדמה לתולעי אדמה, כל חמשת הלבבות עשויים להיות גלויים או פחות. בשלב זה, החוקר צריך להחליט אם להזיז איברים ורקמות על מנת לאתר את הלבבות של תולעת האדמה.
4. מתן תרכובת לכלי דם של תולעי אדמה
- הכנת תולעת האדמה למתן תרכובות
הערה: עבור השלבים הספציפיים האלה, הזרקנו חומרי ניגוד, מיקרו-בועות, לתוך כלי הדם של תולעי האדמה כתרכובת המעניינת.- לפני המיקרו-הזרקה, הניחו את תולעת האדמה על שלב המיקרו-הזרקה, והשתמשו במגבון מעבדה כדי להסיר את כל הנוזלים סביב כלי הדם המבוקש, ובכך לחשוף את כלי הדם להזרקה.
הערה: אל תפעיל לחץ חזק מכיוון שהוא יגרום לדימום של הכלי. - יישר את כלי הדם המעניינים למיקרופיפטה, מכיוון שחשוב שכלי הגחון יהיה מיושר להזרקה. אם הלבבות מעניינים, הם חייבים להיות בניצב למיקרופיפטה.
- מקדו את המיקרוסקופ בכלי הדם המעניינים והתחילו להוריד את המיקרופיפטה לכלי הדם. לפני הזזת כל אחד ממניפולטורי הג'ויסטיק, ודא שכולם מוגדרים ל-0 מ"מ כדי להבטיח ניידות מיטבית.
- כאשר קצה המיקרופיפטה נמצא במגע עם כלי תולעי האדמה, ודא שהזווית בין הכלי למיקרופיפטה נמוכה מ-15°.
- ברגע שהמיקרופיפטה מתחילה להפעיל לחץ על הכלי, הדם יתרחק מהקצה עקב הלחץ על כלי הדם. זוהי אינדיקציה טובה למיקום נכון של הזרקה.
- כדי להבטיח הזרקה מוצלחת, השתמש בג'ויסטיק כדי להזיז את המיקרופיפטה קדימה כדי ליצור מגע עם כלי הדם.
הערה: חשוב לא לנקב את הכלי. שימו לב שהקצה צריך להזיז את כלי הדם, עבור כלי הגב והגחון, בכיוון שבו המיקרופיפטה נעה, ואז יש להשתמש בחוגה הגסה כדי להזיז את קצה המיקרופיפטה קדימה כדי לאפשר חדירה מלאה לתוך הכלי. אם הצלחת ניתנת להזזה, ניתן להשתמש בה כדי להזיז ולנקב את הכלי לתוך המיקרו-פיפטה במקום להשתמש במיקרו-בקרים או בכולם בו זמנית. הכלי לא ייחדור מיד, אך רתיעה של הכלי היא אינדיקטור לחדירה תקינה של המיקרופיפטה. לאחר שהקצה חדר לכלי, הכלי צריך להיות ישר ומיושר עם המיקרופיפטה. אם לא, החזר את המיקרופיפטה לאט באמצעות השליטה העדינה. - לחץ על הדוושה כדי להזריק את כלי הדם של תולעת האדמה. דילול הדם הוא אינדיקטור נוסף לחדירה תקינה לאחר לחיצה על הדוושה.
- משוך את המיקרופיפטה באיטיות ומשוך את המיקרופיפטה משם.
הערה: לחלופין, שבירת הקצה בזמן שהמיקרופיפטה עדיין בכלי היא שיטה יעילה למניעת איבוד דם.
- לפני המיקרו-הזרקה, הניחו את תולעת האדמה על שלב המיקרו-הזרקה, והשתמשו במגבון מעבדה כדי להסיר את כל הנוזלים סביב כלי הדם המבוקש, ובכך לחשוף את כלי הדם להזרקה.
תוצאות
התוצאות המייצגות הבאות מבוססות על קבוצה של פרמטרים ספציפיים הכוללים את ההגדרות המשמשות למשיכת פיפטת הזכוכית, גודל פתח הפיפטה שנוצר מזווית שיפוע נתונה והלחץ והזמן של המיקרו-הזרקות באיור 1, מוצגת סכימה של הזרימה המייצגת את התהליך מתחילתו ועד סופו.
בהתבסס על הפרמטרים של מושך הפיפטות שנבחרו, הקצה הבא ייצא מהמשיכה (איור 2). יצוין כי ערך ה- RAMP עשוי להשתנות עקב סוג הזכוכית ואפילו מיקום הנימה. אם הפרמטרים מקובלים, הקצה המתקבל יהיה חזק, עם התחדדות ארוכה לשיפוע. אם הקצה נשבר ממשיכה, יש לכוונן מחדש את המושך.
עבור שיפוע המיקרופיפטה, נבדקו שש זוויות שיפוע כדי לקבוע את הזווית האופטימלית, כדי להעריך את הקלות הכללית של השיפוע ולבחון כיצד הזווית משפיעה על גודל פתיחת הקצה. הזווית האופטימלית לקריטריוני השיפוע שלנו נקבעה כ-35 מעלות מכיוון שהיא מספקת קצה חד, היא חזקה מספיק כדי לחדור לכלי ללא שבירה, והיא ניתנת לשחזור מאוד. בדרך כלל, ככל שהזווית קטנה יותר, כך הקצה הופך חד יותר כפי שמוצג באיור 3. זווית עניין נוספת הייתה 30°, שהיא חדה יותר, אך נבחרה 35°, בשל יכולת השחזור שלה. כפי שמוצג באיור 4, הזווית של המיקרומניפולטור משנה הן את הצורה והן את גודל הפתח של הקצה. באיור זה מוצג כי השיפוע המדויק והעקבי ביותר מתרחש בזווית שבין 30° ל-40°. טבלה משלימה (טבלה S1) נוצרה על סמך קלות השיפוע, אם כי חשוב לציין שטכניקות שיפוע משתנות מאדם לאדם, ולכן הטיפים משתנים. עוד יצוין כי שיפועים לא מוצלחים יכולים להתרחש כאשר המיקרומניפולטור מוריד מהר מדי או כאשר הזכוכית הופכת שבירה מדי, מה שמוביל לשבירת קצה.
עבור גודל קצה נתון, יש לבצע כיול לפני הזרקת תרכובת. נפח ההזרקה תלוי בגודל הקצה כמו גם בלחץ המיקרו-הזרקה ובזמן ההזרקה. לדוגמה, באיור 5, חלוקות נפח מייצגות משורטטות בגרף עבור קצות של 24.4 מיקרומטר. הנתונים חושפים קשר ליניארי בערך בין הנפח המחולק ללחץ עבור זמני הזרקה קבועים. יש לקבוע נתוני כיול מותאמים אישית דומים עבור עיצובי קצה ספציפיים.
במהלך הזרקה מיקרו-וסקולרית, יש צורך בבדיקה ויזואלית כדי לאשר הזרקה מוצלחת של מוצר נתון. הסמן הנראה הטוב ביותר הוא דילול הדם. כפי שמוצג בסרטון המשלים ובאיור 6, הדם נעשה צלול יותר ככל שהוא מדולל, וזה סימן להזרקה מוצלחת. זה קריטי שהמיקרופיפטה לא תחדור עמוק מדי לכלי ושהמיקרו-הזרקה לא תתבצע בזווית הגדולה מ-15 מעלות מהכלי, אחרת כאשר הפיפטה נשלפת החוצה, תרכובת העניין תדמם מכלי הדם שלה, בגלל פצעים גדולים. הזרקה ומשיכה מוצלחת יביאו לדימום מינימלי בעת ההסרה.
איור 1: זרימה של השיטה הכוללת. לצורך הזרקת מיקרו של כלי הדם של תולעי האדמה, ראשית יש למשוך את הפיפטה כדי להשיג פתח מיקרו בקצה. ואז קצה המיקרופיפטה משופע כדי להשיג קצה מחט חד. לאחר השגת הפתיחה, המיקרופיפטה מכוילת לנפח הנכון המופץ. לאחר הכיול, ניתן לבצע הזרקות לכלי הדם. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: מיקרו-פיפטה משוכה מוצלחת. בהתבסס על הפרמטרים המשמשים בפרוטוקול, קצה זה יופיע לאחר משיכה. (A) מדגים את הפיפטה מיד לאחר משיכתה. (B) תמונה מקרוב של אותה פיפטה שנמשכה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: פרופילי זווית שיפוע של קצה מיקרופיפטה. שש זוויות נבדקו לשיפוע. זווית יורדת מ-45° ל-20°, החדות ופתיחת הקצה עולות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
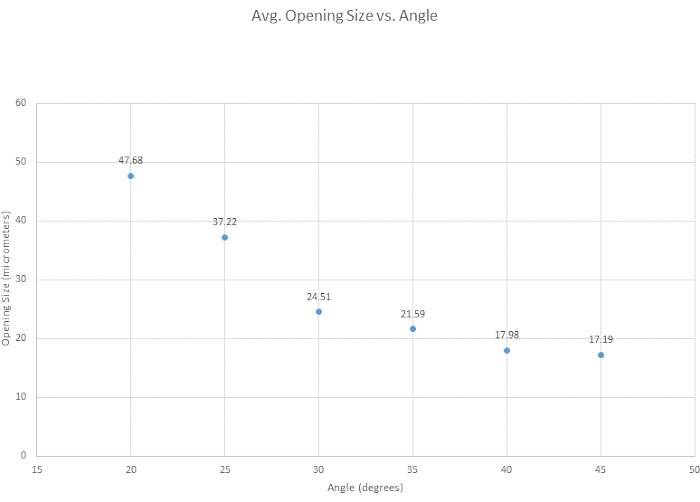
איור 4: פתח הקצה מצטמצם בזווית ההולכת וגדלה. שש זוויות נבדקו כדי לראות כיצד הזווית משפיעה על גודל פתח הקצה. גודל פתיחת הקצה קטן ככל שזווית השיקוע גדלה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: כיול עבור ניהול נפח. פתח בגודל קצה של 24.4 מיקרומטר שימש עבור התוצאות המייצגות שלו לייצוג נתונים באמצעות הפרמטרים הספציפיים לזמן ולחץ. עם עליית הלחץ, הנפח המחולק עולה, ועם ירידת הזמן, הנפח המחולק יורד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: הזרקה לכלי הגחון. חזותי להזרקה מוצלחת מודגם עם דילול הדם כאינדיקטור. סרטון משלים מלווה בפאנל זה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור S1: מערך למיצוי דם ושתן של תולעי אדמה. אנא לחץ כאן להורדת קובץ זה.
איור S2: סטיות תקן מאיור 4. בהתאם לזווית, סטיית התקן משתנה. 35° מחזיק סטיית תקן נמוכה יותר, ולכן עקבי יותר בשיפוע והקצה נשבר פחות. 30° היה טוב גם עם 35° כפי שמוצג בטבלה S1. אנא לחץ כאן להורדת קובץ זה.
איור S3: מדגים את ההישרדות של תולעת האדמה אחרי ניתוח ושימוש ברצועת נוזל כדי לסגור את תולעת האדמה. אנא לחץ כאן להורדת קובץ זה.
טבלה S1: טבלה תיאורית עבור קלות שיפוע. שלושה מצבים שימשו לתיאור קלות השיפוע שנעה בין קל, לבינוני וקשה. צוין כי 15° נבדק אך זו הייתה זווית קטנה מכדי לייצר קצה מיקרופיפטה שאינו נשבר. אנא לחץ כאן להורדת טבלה זו.
סרטון משלים. אנא לחץ כאן להורדת סרטון זה.
Discussion
בעוד שתולעת האדמה נמצאת באתנול של 10%, במיוחד אם תולעת האדמה בגיל מבוגר, ייתכנו השפעות לא רצויות לזמני חשיפה של יותר מ-30 דקות; המעיים יתחילו להידרדר, וכאשר תולעת האדמה נפתחת בניתוח, המעיים הפנימיים שלה מתפשטים. לכן, מומלץ להשתמש בתולעי אדמה צעירות עד בגיל העמידה. במהלך תהליך חיתוך העור של תולעת האדמה, הכרחי שלא יבוצע חיתוך מספריים מלא, כלומר החוקר חייב לחתוך רק באמצע הדרך ולהמשיך לדחוף את המספריים קדימה עד שיגיע לנקודה הסופית. כשאתם מצמידים את תולעת האדמה, היזהרו לא למתוח את תולעת האדמה או למשוך חזק מדי. זה עלול לגרום לקרע בכלי הדם, מה שמוביל לדימום. לאחר כל הזרקה, בדוק אם המיקרופיפטה סתומה על ידי הוצאת נוזלים שעלולים להיות בתוך המיקרופיפטה, במיוחד כדי להסיר דם מהקצה לפני ביצוע זריקה נוספת. בנוסף להתבוננות בקצה לסתימה, לאחר כל הזרקה הסתכל על קצה המיקרופיפטה כדי לבדוק אם יש שבירת קצה. קצה המיקרופיפטה יכול גם להישבר, ולהשאיר את הקצה במקומו כדי למנוע איבוד דם. חשוב להתבונן היטב ברקמת כלי הדם במהלך מיקרו-זריקות. כאשר המיקרופיפטה באה במגע ראשון עם הכלי, רקמת כלי הדם תיצמד לקצה המיקרופיפטה. לאחר שהקצה חדר בהצלחה לכלי הדם, ניתן לראות את רקמת כלי הדם מחליקה במהירות לתוך הקצה והיא תורגש גם על המיקרומניפולטור. לאחר הזרקה מוצלחת, חשוב למשוך את המיקרופיפטה החוצה בזהירות מכיוון שהמיקרופיפטה עלולה בסופו של דבר להיכנס עמוק יותר לתוך הרקמה או ליצור פצע גדול יותר באתר ההזרקה, וזה עלול להוביל למתן התרכובת לדלוף החוצה מהכלי. בדרך כלל, הזרקות מוצלחות התרחשו כאשר קוטר הכלי היה 90 מיקרומטר או יותר, אך ניתן לשפר זאת על ידי צמצום גדלי קצה המיקרופיפטה על ידי החוקרים. תולעת האדמה נשמרת לחה באופן עקבי במים כדי למנוע התייבשות של תולעת האדמה, אך מומלצת תמיסת מלח.
מחקרי הישרדות של תולעי אדמה
ניסויי הישרדות של תולעי אדמה נערכו כדי לתת תובנה לגבי כמה זמן תולעי האדמה יכולות לשרוד אחרי ניסויים. לאחר שהתולעים נטבלו בתמיסת אתנול של 10% ולאחר מכן נחתכו והוזרקו בניתוח, בדיוק כפי שהיו במהלך הניסויים, 27 תולעים "נתפרו בחזרה" באמצעות תמיסת פלסטר נוזלית ונצפו עד 48 שעות לאחר הניסוי. 12 שעות לאחר הניתוח, כ-67% מהתולעים עדיין היו בחיים. ב-24 שעות לאחר הניתוח, כ-48% מהתולעים עדיין היו בחיים. 36 שעות לאחר הניתוח, כ-44% מהתולעים עדיין היו בחיים. לבסוף, 48 שעות לאחר הניתוח, כ-22% מהתולעים עדיין היו בחיים. התוצאות מהניסויים האלה מראות שרוב התולעים יכולות לשרוד במשך 12 שעות ביום שלם אחרי שעברו ניתוח ניסיוני והזרקה, ומספר גדול של תולעים יכול לשרוד אפילו יותר מזה (איור S3). זה מהווה הזדמנות לכל תולעת להיות במעקב במשך 24 שעות, אם רוצים.
טיפול במעבדת תולעי אדמה
תולעי אדמה, זוחלי לילה קנדיים, נקנו בחנות מפיתיון סיטונאי של וינדזור ונמסרו כ-500 תולעי אדמה גדולות בקופסת קלקר (35 רוחב x 38 ליטר x 30 ס"מ) ונשמרו במקרר, כאשר תולעים בודדות הוסרו ושימשו לניסויים. כפי שצוין בשלבי פרוטוקול הכנת תולעי האדמה, לא יותר מ-10 תולעי אדמה שימשו בבת אחת עקב אידוי של תולעת האדמה, מה שעלול להוביל להתייבשות16. נוסף על כך, החשיפה של תולעי אדמה לאור הייתה מוגבלת, מאחר שהן מכילות תאים רגישים לאור על העור שלהן; חשיפה לאור יותר משעתיים עלולה להוביל למוות. מיד עם הגעתם, אדמת מכולות המשלוח הוחלפה, ותולעי אדמה הורשו לנוח לתקופת המתנה של 24 שעות לפני שהשתמשו בהן לניסויים. זה הבטיח שתולעי האדמה יקבלו אנרגיה מחודשת ולא יהיו עייפות יותר עקב המשלוח. בשלב זה, ניסויים בתולעת האדמה יכולים להתחיל.
לתולעי אדמה יש תוחלת חיים לא ידועה, אולם אפשר לשמור אותן בחיים במעבדה לתקופות ארוכות כאשר הן מנוטרות מדי יום ומקבלות את חומרי המזון הנכונים. כל שבועיים יש להוסיף אדמה חדשה למיכל כדי לספק יותר חומרי מזון לתולעת האדמה. תולעת האדמה היא חסרת חוליות שמתחפרת עמוק, אנקית, ותבנה מחילות בעומק של עד 180 ס"מ (6 רגל), כך שחייב להיות לפחות מטר אחד של אדמה במיכל עבור 500 תולעי אדמה. בתחתית המיכל אפשר להוסיף עיתון ישן, מאחר שכאן חלק מתולעי האדמה ייצרו את בתיהם. לאחר החלפת האדמה, מומלץ לבדוק אם יש ריח ולזהות תולעי אדמה פצועות או מתות. אל תשאיר תולעי אדמה מתות או פצועות במיכל, מכיוון שהן יזהמו את האדמה ויצרו מקרי מוות נוספים בתוך מושבת תולעי האדמה שלך.
יישומים עתידיים
בפרוטוקול הזה מוצגים ההכנה וההליך לביצוע ניסויי דם בתפוקה גבוהה באמצעות תולעת האדמה. בעוד ששיטות ההזרקה המתוארות כאן מוגבלות למערכת הדם, ניתן להרחיב את שיטות ההזרקה המתוארות כאן למחקרים הכוללים את מערכת העצבים, מכיוון שחוט העצב של תולעת האדמה נמצא במקביל לכלי הגחון. לדוגמה, מחקרים קודמים שהשתמשו בתולעת האדמה נחקרו עבור מחקרי נוירומודולציה וקרע כלי דם מיישומי אולטרסאונד טיפוליים18,19. עם מערך חדש זה, ניתן יהיה לערוך מחקרי אולטרסאונד + מיקרו-בועות מעמיקים נוספים כדי להרחיב את מחקר הנוירומודולציה וקרע בכלי הדם.
נוסף על כך, החלל הקולומי בתולעת האדמה יכול לשמש לחקר מערכת החיסון, מאחר שהנוזל ששוכן בחלל הקולומי מתווך את רוב התגובות החיסוניות, אם לא את כולן. תולעת האדמה ייחודית בכך שקיימים רק שני נוזלים בחיה, שכל אחד מהם נמצא בתוך חללים נפרדים, הדם בכלי הדם והנוזל הקולומי בחלל הקולומי. הפרדה זו של נוזלים מאפשרת סוגים ספציפיים של מחקר בשני חללים. לדוגמה, הנוזל הקולומי גדוש בקואלומוציטים רבים, שתפקודיהם החיסוניים חולקים מאפיינים עם קולומוציטים של רוב המודלים האחרים של בעלי חיים. חקירות של פגוציטים ותאים דומים אחרים שיכולים להרוס מטרות תאים יכולות להתבצע בתולעת האדמה, וסביר להניח שלתולעת האדמה יש יישומי מחקר רבים נוספים שיכולים לשמש כמודל חלופי של חסרי חוליות.
בעוד שתולעת האדמה חסרה את המורכבות למודל היבטים רבים של המערכת האנטומית והפיזיולוגית האנושית, מיקרו-הזרקה מציעה מערכת דם מוכלת המכילה דם הדומה להפליא לדם אנושי מבחינת מבנה ההמוגלובין. ביישומים שבהם נפחי דם קטנים מקובלים, תולעת האדמה מציעה פלטפורמת בדיקה בעלות נמוכה וזמינה, פטורה מוועדות מוסדיות לטיפול ושימוש בבעלי חיים. כתוצאה מכך, ניסויים על תולעי אדמה עם תרכובות שונות יכולים להיעשות שוב ושוב ובגדלי מדגם שסביר להניח שיעלו בהרבה על מה שיהיה מעשי באמצעות חיות מעבדה סטנדרטיות של בעלי חוליות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו מומנה על ידי מלגת NSF-FDA (NSF-FDA SIR, #1641221), מענק אתגר המדען הראשי של משרד מינהל המזון והתרופות האמריקני (FDA OCS), הקרן הלאומית למדע אינטגרטיבי ללימודים מתקדמים והכשרה מחקרית (NSF IGERT, #1144646) ונתמכה על ידי המשרד למעבדות מדע והנדסה (OSEL) במינהל המזון והתרופות האמריקני (FDA).
Materials
| Name | Company | Catalog Number | Comments |
| 3M Vetbond Tissue Adhesive | 3M Vetbond | 084-1469SB | 3mL bottle vet adhesive - liquid band-aide |
| 40x Stereo Microscope | Sutter Instrument Co. | BV-10-D | Not needed, can add on other scopes |
| 500 Large Worms | Windsor Wholesale Bait | 500 Large | |
| Beveler pedestal oil | Sutter Instrument Co. | 008 | |
| Blades | Ted Pella, Inc | 121-2 | |
| Borosilicate Glass with Filament | Sutter Instrument Co. | BF150-86-10 | |
| Camera | AmScope | MU500 | |
| Camera | AmScope | MU1803-CK | 8MP USB3.0 Microscope Digital Camera |
| Electrode Impedance Meter | Sutter Instrument Co. | BV-10-C | |
| Ethanol | Sigma Aldrich | E7023-1L | Pure ethanol |
| Filament | Sutter Instrument Co. | FT315B | trough filament |
| Grinding Plate | Sutter Instrument Co. | 104D | Fine Plate |
| Hospital Grade Saline | Baxter Healthcare Corporation | 2F7124 | 0.9% Sodium Chloride Irrigation |
| Joystick Micromanipulator | Narishige | MN-151 | |
| KimWipes Kimtech Science | Kimberly-Clark Professional | 34155 | |
| Leafgro | LeafGro | 589252 | 1.5-cu. ft. |
| Metal Hub Needle | Hamilton | 91024 | Luer Lock Metal Needle |
| Micro Vessel Clips | WPI | 501779-G | |
| Microinjector | TriTech Research | MINJ-D | |
| Micropiette Puller Model P-97 | Sutter Instrument Co. | P-97 | |
| Micropipette Beveler | Sutter Instrument Co. | BV-10-B | |
| Microscope | AmScope | SM-8TPW2-144S | 3.5X-225X Simul-Focal Articulating Microcope |
| Needle Holder | TriTech Research | MINJ-4 | |
| NeverWet | Rust-Oleum | NeverWet | |
| Pyrex Glass | Corning | 08747A | Fisher Manufacturer |
| Stainless Micro-Ruler | Ted Pella, Inc | 13635 | Micro-Ruler mounted on a Handle, 10mm scale, with lines at 0.01mm intervals |
| Surgical Grips | Ted Pella, Inc | 53073 | Forceps, Hemostat |
| Surgical scissors | Ted Pella, Inc | 1320 | Fine Iris Scissors, Straight |
| U.S.P. Mineral Oil Lubricant Laxative | Swan | Mineral Oil |
References
- Stevenson, J. The Oligochaeta. , Claredon Press. Oxford. 685(1930).
- Reynolds, J. W., Reynolds, W. M. Earthworms in medicine. American Journal of Nursing. 72 (7), 1273(1972).
- Gates, G. E. The earthworms of Rangoon. Journal of the Burma Research Society. 25, 196-221 (1926).
- Carr, L. G. K. Interesting animal foods, medicines, and omens of the eastern Indians, with comparisons to ancient European practices. Journal of the Washington Academy of Sciences. 41 (7), 229-235 (1951).
- Price, S. F. Kentucky folk-lore. The Journal of American Folklore. 14 (52), 30-38 (1901).
- Elmer, J., Palmer, A. F., Cabrales, P. Oxygen delivery during extreme anemia with ultra-pure earthworm hemoglobin. Life Sciences. 91 (17-18), 852-859 (2012).
- Eyambe, G. S., Goven, A. J., Fitzpatrick, L. C., Venables, B. J., Cooper, E. L. A non-invasive technique for sequential collection of earthworm (Lumbricus terrestris) leukocytes during subchronic immunotoxicity studies. Laboratory Animals. 25 (1), 61-67 (1991).
- Basley, K., Goulson, D. Effects of chronic exposure to clothianidin on the earthworm Lumbricus terrestris. PeerJ. 5, 3177(2017).
- Mvumi, B. M., Gwenzi, W., Mhandu, M. G. Ecotoxicological effects of citrus processing waste on earthworms. Lumbricus terrestris L. Industrial Crops and Products. 110, 123-129 (2017).
- Furst, A. My saga with earthworms. Food and Chemical Toxicology. 40 (6), 789-791 (2002).
- Cooper, E. L., Hrzenjak, T. M., Grdisa, M. Alternative sources of fibrinolytic, anticoagulative, antimicrobial and anticancer molecules. International Journal of Immunopathology and Pharmacology. 17 (3), 237-244 (2004).
- Cooper, E. L., Hirabayashi, K., Balamurugan, M. Dilong: food for thought and medicine. Journal of Traditional and Complementary Medicine. 2 (4), 242-248 (2012).
- Nagasawa, H., et al. Inhibition by lombricine from earthworm (Lumbricus terrestris) of the growth of spontaneous mammary tumours in SHN mice. Anticancer Research. 11 (3), 1061-1064 (1991).
- Shannon, K. M., Gage, G. J., Jankovic, A., Wilson, W. J., Marzullo, T. C. Portable conduction velocity experiments using earthworms for the college and high school neuroscience teaching laboratory. Advances in Physiology Education. 38 (1), 62-70 (2014).
- National Research Council. A framework for K-12 science education: Practices, crosscutting concepts, and core ideas. , National Academies Press. (2012).
- Ramsay, J. The Osmotic Relations of the Earthworm. Journal of Experimental Biology. 26 (1), 46-56 (1949).
- Mulloney, B. Structure of the Giant Fibers of Earthworms. Science. 168 (3934), 994-996 (1970).
- Kim, Y., Nabili, M., Acharya, P., Lopez, A., Myers, M. R. Microvessel rupture induced by high-intensity therapeutic ultrasound - a study of parameter sensitivity in a simple in vivo model. Journal of Therapeutic Ultrasound. 5 (1), 5(2017).
- Wahab, R. A., et al. Mechanical bioeffects of pulsed high intensity focused ultrasound on a simple neural model. Medical Physics. 39 (1), 4274-4283 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved