Method Article
Minhoca, Lumbricus Terrestris: Um Novo Modelo de Invertebrados In vivo de Vasculatura de Microinjeção
Neste Artigo
Resumo
As minhocas são um novo modelo de bancada in vivo de invertebrados para estudos de vasculatura. Apresentamos técnicas e equipamentos que permitem uma cirurgia e microinjeção eficientes na vasculatura das minhocas. São descritos protocolos cirúrgicos, técnicas de microinjeção e o procedimento para a produção de micropipetas personalizadas.
Resumo
Embora os vertebrados sejam indispensáveis para a pesquisa biomédica, os estudos são frequentemente limitados por fatores como custo, longa revisão interna e considerações éticas. Apresentamos a minhoca como um invertebrado alternativo, de baixo custo, aplicável a certos estudos preliminares de vasculatura. Devido à disponibilidade cirúrgica dos vasos dorsais da minhoca, vasos ventrais e cinco pares de pseudo-corações, as minhocas são facilmente acessíveis, oferecem manutenção de baixo custo e requerem a administração de apenas pequenas doses de um determinado composto. O modelo de minhoca fornece um sistema circulatório vascular fechado simples com uma estrutura de hemoglobina semelhante ao sangue humano. É fornecido um protocolo para anestesiar as minhocas e realizar incisões cirúrgicas para expor os vasos sanguíneos relevantes. As micropipetas para administração de compostos são formadas aquecendo e puxando o vidro com um extrator de pipetas e usando um sistema de chanfro para criar uma ponta de agulha fina em escala de mícron. As pontas são então usadas com um microposicionador e microinjetor para injetar compostos arbitrários no sistema vascular de uma minhoca, repetidamente, com a disponibilidade de grandes tamanhos de amostra e pequenos volumes de compostos. Detalhes sobre os meandros do procedimento de injeção são fornecidos. O pequeno tamanho do vaso da minhoca é desafiador, principalmente no caso do vaso ventral; no entanto, o domínio das técnicas apresentadas oferece alta repetibilidade como uma solução de baixo custo, tornando práticos estudos de tamanho amostral muito grande.
Introdução
A minhoca tem sido usada como um importante bioindicador e bioensaio para aplicações científicas anteriores 1,2,3,4,5,6; É um organismo ideal para avaliar riscos biológicos de resíduos perigosos e tóxicos em ambientes terrestres para estudos in situ e de bioacumulação, como biocidas (inseticidas) no solo e efeitos ecotoxicológicos adversos 7,8,9,10. Além disso, devido à bioprospecção, a minhoca é uma fonte alternativa de moléculas fibrinolíticas, anticoagulantes, antimicrobianas e anticancerígenas11,12; a ponto de uma equipe em 1991 extrair e purificar a lumbricina da pele da minhoca e colocá-la em tumores mamários de camundongos SHN, o que levou à inibição do crescimento tumoral13. A minhoca também é um modelo animal pedagogicamente útil, pois pode ser usada para expor os alunos à cirurgia e à compreensão da anatomia de um espécime; do estudo da circulação sanguínea à eletrofisiologia14,15.
Em nossa própria pesquisa, examinamos a resposta dos vasos de minhocas vivas ao ultrassom de alta intensidade18. Descobrimos que a ruptura do vaso no verme ocorreu em condições semelhantes às que associamos em danos por ruptura em microvasos humanos. Nosso trabalho em andamento envolve a injeção de microbolhas na vasculatura das minhocas. As microbolhas são compostas por um gás pesado envolto por um invólucro lipídico, albumina ou polímero, esses agentes podem ser usados como agentes de contraste de imagem, bem como veículos para entrega direcionada de medicamentos.
Este novo protocolo é relevante para qualquer estudo que se beneficie da injeção intravenosa (IV) de um composto que possa utilizar os bioindicadores naturais da minhoca. A abordagem é baseada na microinjeção IV em um dos vários pontos de entrada possíveis, incluindo qualquer um dos pseudo-corações de cinco pares da minhoca, o vaso dorsal e o vaso ventral. O procedimento envolve uma incisão cirúrgica elaborada para expor os vasos, seguida por uma injeção controlada por microposicionador. Isso é conseguido usando micropipetas personalizadas construídas especificamente para microinjeção vascular de minhocas. Essas micropipetas permitem o direcionamento preciso de vasos tão pequenos quanto um vaso ventral de 90 μm de diâmetro.
Este protocolo foi projetado para melhorar as técnicas anteriores de micropipetagem, incluindo um estudo de 1948 para a extração de sangue e urina de minhocas16. Como visto na Figura S1, a configuração para essa extração pode ser difícil e, conforme declarado pelo autor, pode levar até uma hora ou mais. Um método semelhante foi desenvolvido em 1970, mas o autor experimentou várias pontas quebradas ao injetar fluidos nas fibras gigantes da minhoca17. No presente método descrito abaixo, a extração de sangue é uma questão de segundos a minutos e é relevante tanto para a injeção de compostos quanto para a extração de fluidos de minhoca. Neste caso específico, injetamos agentes de contraste, microbolhas.
Protocolo
1. Preparação da micropipeta: puxando o vidro e chanfrando a ponta
- Tração de micropipeta
- Ligue o extrator de micropipeta e selecione um programa para inserir parâmetros específicos para microinjeção de minhoca.
- Defina os parâmetros para Pressão=500, Puxar=75, Tempo=250, Calor=336 e Velocidade=70. Os resultados podem variar de extrator para extrator; Portanto, experimente os parâmetros para obter a ponta desejada (tamanho, nitidez, forma, etc.).
- Certifique-se de realizar um teste RAMP para determinar o valor calorífico das micropipetas antes de puxá-las, pois não fazer isso pode levar à queima do filamento da calha ou à quebra do vidro.
- Se a pressão do ar precisar ser alterada, pressione o botão limpar, selecione não (0) quando solicitado a limpar todos os valores e selecione alterar pressão (2). Este processo pode variar de extrator para extrator; portanto, procure o manual do instrumento para alterar as configurações de pressão.
- Abra a tampa do extrator de micropipetas e coloque uma micropipeta no extrator. O vidro de micropipeta utilizado foi o vidro borossilicato com pipeta de filamento: 10 cm de comprimento, diâmetro externo: 1,5 mm e diâmetro interno: 0,86 mm.
- Deslize a pipeta na ranhura em V da direita ao longo da fenda da pipeta até que a extremidade da pipeta se alinhe com a extremidade do suporte da pipeta. Para garantir que a pipeta possa viajar através do filamento para o lado oposto, empurre a pipeta o mais longe possível, garantindo que ela permaneça apoiada na fenda da pipeta.
- Para travar a pipeta, aperte o botão do lado direito e deslize o sistema travado junto com a pipeta até chegar ao outro lado do extrator através do filamento. Por fim, trave o lado esquerdo da pipeta no extrator. A pipeta deve estar no meio do filamento; Consulte o manual para obter instruções sobre como alinhar corretamente a pipeta.
- Assim que a pipeta estiver carregada, feche o extrator, pressione o botão de tração e espere até que a pipeta seja puxada antes de remover as duas pipetas resultantes.
- Desaperte os botões para remover as pipetas e tome cuidado para não prender as pipetas durante a remoção da fenda.
- Coloque as micropipetas puxadas em um suporte de micropipeta ou algum tipo de suporte para manter a micropipeta no lugar e permitir uma rotação fácil sem quebrar as micropipetas puxadas. Desenvolvemos nosso próprio porta-micropipetas que pode ser criado em uma oficina mecânica ou até mesmo impresso em 3D.
NOTA: O protocolo pode ser pausado aqui. - Coloque o suporte da micropipeta sob o microscópio e use um programa de câmera, ou um software semelhante, para capturar uma imagem das micropipetas puxadas e registrar o diâmetro da ponta usando uma ampliação de 10x ~ 1000 mm e ~ 50 mm da ponta.
- Antes de capturar uma foto, certifique-se de que as configurações da câmera correspondam à configuração do microscópio (10x), para medir com precisão, especialmente para medições pós-imagem. A configuração de 10x é encontrada na faixa de opções da barra de ferramentas horizontal localizada perto da parte superior da tela.
- Para view e capturar uma imagem da micropipeta, selecione a câmera no software da câmera localizado no canto superior esquerdo e pressione o botão Snap depois de focar na ponta para obter uma leitura precisa. O botão Encaixar está localizado na barra de ferramentas horizontal no lado esquerdo da página, na guia da câmera.
- Faça medições das micropipetas puxadas para determinar se o tamanho e a consistência desejados da ponteira foram alcançados. Puxar até 5 pipetas é suficiente para determinar se o extrator e seus parâmetros estão produzindo consistentemente o tamanho desejado. Se o tamanho desejado da ponteira não tiver sido alcançado, ou se o dimensionamento continuar a variar por pipeta, o pesquisador pode precisar experimentar diferentes configurações até que o tamanho desejado da ponteira seja alcançado, ou pode ser necessário corrigir a colocação do filamento e da pipeta, o que pode exigir a referência do manual do extrator de pipetas.
NOTA: O protocolo pode ser pausado aqui.
- Configuração para chanfrar a micropipeta e uso do medidor de impedância do eletrodo
- Para chanfrar as micropipetas puxadas, use um chanfrador de micropipeta com um medidor de impedância de eletrodo e um microscópio estéreo de 40x.
NOTA: Outros chanfradores podem ser usados; Mesmo os chanfradores internos são bem-sucedidos, além disso, diferentes configurações podem ser alcançadas com diferentes microscópios para examinar o processo de chanfro, incluindo a montagem de uma câmera no microscópio. - Monte o pedestal/placa de moagem com a placa fina entre os dois suportes pretos.
- Coloque a placa inferior com os ímãs voltados para longe da placa.
- Aparafuse as três partes juntas: (1) o anel de retenção superior, (2) a placa fina de retificação e (3) o anel de retenção inferior (magnético). Identifique a superfície abrasiva da placa de moagem; Para a placa fina, é de cor roxa e deve estar voltada para cima para que o vidro fique em contato com o plano óptico de quartzo.
- Coloque cinco gotas de óleo de pedestal chanfrado, ou quantas forem necessárias, no plano óptico de quartzo do instrumento de chanfro e coloque a placa montada em cima. Este óleo pode durar o dia todo, mas se a placa sacudir ou não girar quando deveria, o plano óptico de quartzo pode precisar ser lubrificado novamente.
- Gire a placa manualmente algumas vezes para espalhar o óleo e, em seguida, o instrumento pode ser ligado.
- Para configurar o medidor de impedância, adicione solução salina (NaCl 0,9%) no pavio, que é o fio de referência, e coloque o pavio na placa de chanfro. Mergulhe a fita para fazer um circuito com a micropipeta e cubra a placa com uma fina camada de solução salina.
- Conecte o segmento de chumbo à extremidade do fio que está conectado ao medidor de impedência.
- Gire a chave "on" no medidor de impedância e deixe em "stand-by" até que esteja pronto para começar a chanfrar. Como estamos criando uma grande abertura, defina o medidor de impedância do eletrodo para x0,1 quando estiver pronto para chanfrar.
- Para chanfrar as micropipetas puxadas, use um chanfrador de micropipeta com um medidor de impedância de eletrodo e um microscópio estéreo de 40x.
- Carregando a micropipeta e chanfrando
- Carregue a micropipeta na pipeta clamp que está localizado no manipulador e aperte o botão para mantê-lo no lugar durante o chanfro.
- Através da extremidade traseira da micropipeta, encha toda a pipeta com solução salina e insira o eletrodo na micropipeta, garantindo que não haja bolhas de ar na micropipeta. Percebeu-se que a presença de bolhas de ar na micropipeta causa variabilidade nas medidas.
- Ligue o medidor de impedância mudando de "stand-by" para "x0.1". A resistência deve ser inicialmente de 100 MΩ e quando a ponta da micropipeta toca a solução salina, ela deve exibir uma leitura diferente.
- Para chanfrar o tamanho correto da abertura da ponteira, antes de abaixar a micropipeta, ajuste o ângulo para 35° no manipulador para obter um chanfro consistente. Um ângulo de 30° também é suficiente, mas entre os dois, 35° mantém um desvio padrão mais baixo, portanto, mais consistente no chanfro e a ponta quebra menos.
- Usando o manipulador, posicione a ponta da micropipeta a aproximadamente dois terços do centro de rotação da placa de moagem.
- Usando o botão de ajuste grosso, abaixe a micropipeta perto da placa para que a ponta da micropipeta se aproxime da solução salina. Se nenhuma câmera estiver disponível, é importante olhar para o microscópio para ver o chanfro da ponta.
- Uma vez que a ponta da micropipeta entre em contato com a solução salina, a leitura do medidor de impedância deve diminuir de 100 MΩ para um valor na faixa entre 80 e 20 MΩ. Este valor irá variar devido à abertura do vidro puxado.
- Neste ponto, mude do botão de ajuste grosso para o botão de ajuste fino para abaixar a pipeta mais lentamente para evitar quebrar a ponta da placa. É importante monitorar o medidor de impedância e a ponta simultaneamente nesta fase de chanfro.
- Durante o chanfro, observe como o tamanho da ponta muda e use a iluminação para ajudar a criar um bom ponto de vista durante o chanfro.
NOTA: A ponta ficará extremamente brilhante à medida que ocorrer o chanfro e a abertura da ponta ficará maior. É imperativo usar o botão de ajuste fino no manipulador para abaixar ou levantar a micropipeta neste estágio. Uma vez que a micropipeta tenha sido levantada da placa, trazê-la de volta para a placa pode fazer com que a ponta se quebre. - Continue abaixando a ponta lentamente até atingir a placa de chanfro e chanfre lentamente até atingir uma resistência de aproximadamente 20 MΩ. O domínio desse processo será uma forte curva de aprendizado e exigirá prática para chanfrar a ponta de forma consistente.
- Quando uma resistência de 20 MΩ for atingida, levante a micropipeta do chanfrador.
- Remova o fio da micropipeta e descarregue a micropipeta do chanfrador. Se deixada no chanfro, a micropipeta pode quebrar ou criar uma abertura maior em sua ponta; Portanto, é essencial monitorar o medidor e a ponta durante o chanfro.
NOTA: O protocolo pode ser pausado aqui. - Coloque a micropipeta chanfrada no suporte da micropipeta e use a objetiva 10x no software do microscópio para medir o tamanho da abertura da ponta. Um tamanho de amostra de 10 pontas é adequado para verificar a consistência em todas as pontas chanfradas.
- Confirme se a configuração do microscópio (10x) corresponde às configurações da câmera antes de tirar uma foto. Outliers podem ser descartados após as medições de abertura da ponta.
- Para desligar o chanfro, gire o interruptor para "off" no motor da correia motriz e no medidor de impedância.
- Desaparafuse o pedestal/placa de moagem para remover o anel de retenção superior. Não levante o pedestal/placa de moagem enquanto estiverem presos um ao outro, pois ele pode quebrar devido ao vácuo criado.
- Depois de levantar o anel de retenção superior do acessório com os parafusos, deslize a placa de moagem fina e levante o último acessório magnético para removê-lo. Remova o excesso de óleo no plano óptico de quartzo com lenços de laboratório.
- Limpe todos os três componentes com água deionizada (DI) e seque para evitar a formação de cristais de sal. Após longos períodos de uso, a base magnética rotativa pode sofrer solavancos. Se isso ocorrer, esguiche uma pequena quantidade de água DI na correia de transmissão para remover qualquer sal cristalizado.
- Limpe o excesso de óleo na parte de trás da placa de moagem, bem como no plano óptico de quartzo.
- Use água DI na plataforma do chanfrador para remover qualquer excesso de solução salina que possa estar no instrumento para evitar a cristalização.
- Use água DI para lavar as pontas chanfradas. Se as pontas não forem lavadas, elas cristalizarão, mas podem ser facilmente lavadas com água DI posteriormente.
- Coloque argila dentro de um prato e use a lamínula para evitar a contaminação das micropipetas.
- Faça recortes na argila para segurar as micropipetas. Quando prontas para serem usadas, as pontas chanfradas estão prontas para serem preenchidas com um composto de interesse e injetadas na vasculatura da minhoca. Para este exemplo de protocolo, agentes de contraste, microbolhas, foram usados como composto de interesse.
NOTA: O protocolo pode ser pausado aqui.
2. Calibração do microinjetor com pontas chanfradas
- Prepare uma placa revestida hidrofóbica.
- No dia anterior, cubra duas placas com revestimento hidrofóbico na superfície para curar durante a noite. Este produto químico deve ser de materiais comprados em lojas ou de materiais de laboratório internos, se disponíveis, e são necessárias pelo menos 12 horas para a cura.
- O revestimento é um processo rápido de duas etapas. Pulverize com a camada de base e, em seguida, pulverize com a camada superior.
- Em um capuz ou em um espaço aberto, borrife a camada de base no prato depois de agitar vigorosamente a lata de camada de base depois que as bolas de mistura chacoalharem por um minuto.
- Pulverize a placa com a camada de base a aproximadamente 6-12 polegadas da superfície, fazendo passagens enquanto reveste a placa. As passagens consistem em passagens leves da direita para a esquerda e depois para cima e para baixo. Continue agitando enquanto a placa é revestida e certifique-se de não pulverizar demais, pois isso diminuirá o desempenho do produto.
- Aguarde 1-2 minutos antes de aplicar outra camada da camada de base. Embora não seja necessário, o revestimento adicional pode ser aplicado, se desejado.
- Aguarde 30 minutos para que a camada de base seque.
- Repita as etapas 2.1.3 - 2.1.5 para o acabamento.
- Uma vez que a placa tenha curado durante a noite ou por pelo menos 12 horas, a placa está pronta para ser preenchida com óleo mineral. Encha o prato aproximadamente até a metade com óleo mineral.
- Coloque a placa com óleo mineral no microinjetor stage.
- Carregue as pontas chanfradas no microinjetor.
- Conecte o microinjetor diretamente a um jato de ar comprimido de laboratório. Um cilindro de nitrogênio comprimido e um regulador de pressão podem ser usados para este sistema, mas observe que outros sistemas de microinjetores podem exigir uma interface diferente.
- Abra o ar comprimido e abra o regulador de linha de ar de baixa pressão a 70 PSI e ligue o microinjetor. Não exceda 80 PSI, pois o sistema não pode lidar com mais de 80 PSI.
- Encha as pontas com água usando uma seringa de 1 mL com uma agulha de cubo de metal. Se o diâmetro interno da pipeta for diferente, será necessária uma agulha de metal de calibre diferente para acomodá-la.
- Depois de enchido com água, carregue a micropipeta no porta-agulha do micromanipulador joystick. Diferentes microinjetores e micromanipuladores podem ser usados.
- Crie bolhas de água para calibrar o volume de distribuição por meio de micropipeta chanfrada.
NOTA: Antes de qualquer administração de composto ser introduzida na vasculatura da minhoca, o microinjetor deve ser calibrado para determinar a injeção de volume adequada.- Defina os parâmetros no microinjetor para pressão em 4 PSI e tempo em 0.5 segundos. Exceder esses parâmetros distorcerá o tamanho do vaso, o que é desfavorável, a menos que o objetivo do pesquisador seja estudar a expansão do vaso.
- Abaixe a ponta da pipeta até que esteja perto do fundo da placa, mas tome cuidado para não quebrar a ponta na parte inferior da placa. Quanto mais baixa for a ponta do óleo mineral, mais viscosa ela será na ponta, o que pode levar à quebra.
- Comece em uma borda da placa para fazer uso completo da placa durante a calibração.
- Quando estiver na posição, pressione o pedal para dispensar uma bolha de água no óleo.
- A bolha pode permanecer presa na ponta. Para remediar isso, puxe rapidamente a placa na direção oposta da bolha para separá-la da ponta da pipeta.
- Usando o software da câmera, meça o tamanho da bolha e calcule o volume. Se nenhum software de câmera estiver disponível, um software alternativo pode ser usado.
- Crie 10 bolhas e meça o diâmetro médio da bolha para determinar o volume correto que a micropipeta dispensará na vasculatura das minhocas.
NOTA: Se o pesquisador estiver interessado em dispensar uma variedade de volumes, os parâmetros de pressão e tempo podem ser manipulados; Repita as etapas 2.3.1 a 2.3.7.
3. Preparação da cirurgia de minhoca para expor vasculatura específica de minhoca de interesse
- Preparação e medições de minhocas
- Prepare a solução de etanol a 10% que anestesiará as minhocas antes da cirurgia.
- Mantenha as minhocas em um béquer de 100 mL com solo entre os experimentos.
- Mantenha apenas 5 a 10 minhocas de cada vez no copo para evitar que as minhocas sequem devido às mudanças bruscas da geladeira para a bancada, de 4 °C a 25 °C.
- Coloque as minhocas em etanol a 10% por 30 minutos. Se a minhoca ainda estiver se movendo após 30 minutos, deixe-a na solução de etanol por mais 5 minutos.
NOTA: Às vezes, a minhoca precisa de mais tempo devido ao seu tamanho; Portanto, o tempo no etanol pode precisar ser ajustado de acordo com o tamanho da minhoca, mas não deve exceder mais de uma hora. Mais de uma hora prejudicará a minhoca. - Lave a minhoca sob a água da torneira para remover o lodo que ela produz e o etanol.
- Coloque a minhoca em uma toalha de papel para remover o excesso de água.
- Depois que a minhoca estiver anestesiada, registre o peso (g), a largura (mm), o comprimento (mm) e a largura do vaso (μm) de cada minhoca. Pegue o peso e as dimensões da minhoca antes de fazer qualquer incisão e sem esticar a minhoca.
- Uma vez que o vaso é exposto cirurgicamente ao microscópio, use o software da câmera para medir a largura do vaso. Se nenhum software de câmera estiver disponível, uma microrégua de aço inoxidável seria suficiente, embora não seja tão precisa quanto uma medição de software digital.
NOTA: Dependendo do vaso de interesse, pule para a Etapa 3.2 (vaso ventral), 3.3 (vaso dorsal), 3.4 (vista superior dos corações) ou 3.5 (vista lateral dos corações).
- Expondo a vasculatura das minhocas, o vaso ventral (método 1)
- Use uma almofada de borracha durante o procedimento cirúrgico para prender a minhoca, expondo assim o vaso de interesse do pesquisador. A parte escura da pele deve estar voltada para baixo.
- Para abrir cirurgicamente a minhoca, coloque-a em seu lado dorsal, a parte mais escura da minhoca, onde uma pequena incisão lateral é feita na pele de cerca de 1 mm com uma lâmina. Esta pequena incisão permite que a tesoura cirúrgica entre para criar uma incisão longa.
- Prenda a pele da minhoca a 33 mm de distância, fazendo uma abertura de 27 mm para expor o recipiente, usando apenas quatro pinos para expor adequadamente o recipiente. Os pinos podem ser adicionados ou movidos, uma vez que a minhoca tenha sido fixada, para ajudar a manipular a pele da minhoca.
- Com uma tesoura cirúrgica, faça uma incisão para alcançar o outro pino na lateral do corpo. Ao empurrar para cima em direção à pele, evita qualquer dano ao interior da minhoca, como cortar a vasculatura ou o intestino.
- Uma vez feita a incisão, prenda ou prenda novamente onde a primeira incisão foi feita e depois no final do corte.
- Usando ambas as ferramentas cirúrgicas (garras cirúrgicas), mova a pele para expor o interior da minhoca.
- Prenda a pele na parte inferior à medida que a pele é movida e, enquanto sobe pela minhoca, continue separando a pele dos órgãos com cuidado. Uma vez no topo, coloque o último pino.
- Se o vaso não estiver exposto, puxe os lados opostos da pele da minhoca para separar o tecido elástico da minhoca para expor o vaso ventral e separar ainda mais a pele.
NOTA: Este puxão removerá parte do tecido que está segurando os órgãos dentro da minhoca. Tenha cuidado com esta etapa, pois pode romper involuntariamente os vasos da minhoca. O vaso ventral deve agora estar exposto, e o cordão nervoso pode funcionar como um marcador do vaso, porque o cordão nervoso corre ao longo da pele ao lado e paralelo ao vaso ventral. Se o vaso ventral estiver próximo ao intestino, um puxão na pele pode expor ainda mais o vaso. Caso contrário, empurre o intestino para o lado, mas isso pode causar uma área de trabalho bagunçada.
- Expondo a vasculatura das minhocas, o vaso dorsal (método 2)
NOTA: Os passos para expor o vaso dorsal são semelhantes à exposição do vaso ventral.- Repita as etapas 3.2.1 a 3.2.3 da Etapa 3.2. A parte escura da pele deve estar voltada para cima para essas etapas.
- Use uma tesoura cirúrgica para cortar em direção ao meio da minhoca para o lado oposto.
- Do meio da minhoca, faça uma incisão em direção à porção anterior da minhoca, a cabeça. Empurrar para cima em direção à pele evita qualquer dano ao interior da minhoca, como cortar o vaso ou o intestino.
- Uma vez feito o corte diagonal, prenda ou fixe novamente o local da primeira incisão e, em seguida, no final do corte que foi feito.
- Repita as etapas 3.2.6 a 3.2.9 na etapa 3.2.
NOTA: O vaso dorsal agora deve estar exposto.
- Expondo a vasculatura das minhocas, vista superior dos corações (método 3)
- Use uma almofada de borracha durante o procedimento cirúrgico para prender a minhoca, expondo assim o vaso de interesse do pesquisador.
- Para expor cirurgicamente a minhoca, coloque-a em seu lado ventral, a parte leve da minhoca. A parte escura da pele deve estar voltada para cima.
- Use quatro alfinetes para segurar a pele da minhoca e criar uma janela para expor os corações de interesse. Um pino adicional, para um total de cinco, pode ser usado para segurar a minhoca perto da ponta de sua cabeça, a extremidade anterior.
- Comece prendendo a minhoca de baixo para cima, começando pelo lado direito e depois movendo-se para o lado esquerdo. Prenda a minhoca, colocando dois pinos no topo perto da ponta da cabeça, na extremidade anterior e dois perto do clitelo.
- Use uma lâmina para fazer uma pequena incisão de cerca de 1 mm na lateral da minhoca.
- Use uma tesoura cirúrgica para cortar em direção ao meio da minhoca para o lado oposto.
- Do meio da minhoca, faça um corte em direção à frente da minhoca até chegar à boca da minhoca, a extremidade anterior.
NOTA: É importante que a tesoura seja levantada contra a pele para evitar o corte da vasculatura; A lâmina da tesoura é visível à medida que você atravessa a pele. Certifique-se de que o corte seja feito na extremidade anterior da minhoca, pois isso proporcionará melhor visibilidade dos corações. - Uma vez fixada, fixe novamente a minhoca, se a pele estiver enrolada na minhoca.
- Faça um puxão para separar adequadamente o tecido da minhoca para expor adequadamente os corações.
- Se os corações não estiverem expostos, mova as vesículas seminais brancas, pois os corações às vezes se escondem embaixo dessas vesículas.
NOTA: A exposição do coração pode variar de minhoca para minhoca, todos os 10 corações podem ser visíveis ou apenas metade e assim por diante. Nesse ponto, o pesquisador deve determinar se deve mover órgãos e tecidos para localizar os corações da minhoca.
- Expondo a vasculatura das minhocas, vista lateral dos corações (método 4)
- Use uma almofada de borracha durante o procedimento cirúrgico para prender a minhoca, expondo assim o vaso de interesse do pesquisador.
- Para expor cirurgicamente a minhoca, coloque-a de lado. Como a minhoca está de lado, tanto o lado claro quanto o escuro da minhoca devem ser visíveis.
- Repita as etapas 3.4.3 a 3.4.9 da Etapa 3.4.
- Se os corações não estiverem expostos, mova as vesículas seminais brancas, pois os corações às vezes se escondem embaixo dessas vesículas.
NOTA: A exposição do coração pode variar de minhoca para minhoca, todos os cinco corações podem ser visíveis ou menos. Nesse ponto, o pesquisador deve determinar se deve mover órgãos e tecidos para localizar os corações da minhoca.
4. Administração de compostos na vasculatura de minhocas
- Preparando a minhoca para administração de compostos
NOTA: Para essas etapas específicas, injetamos agentes de contraste, microbolhas, na vasculatura das minhocas como o composto de interesse.- Antes da microinjeção, coloque a minhoca no estágio de microinjeção e use um lenço umedecido para remover quaisquer fluidos ao redor do vaso de interesse, expondo assim a vasculatura para injeção.
NOTA: Não aplique pressão forte, pois isso causará sangramento do vaso. - Alinhe a vasculatura de interesse à micropipeta, pois é importante que o vaso ventral esteja alinhado para injeção. Se os corações forem de interesse, eles devem ser perpendiculares à micropipeta.
- Concentre o microscópio na vasculatura de interesse e comece a abaixar a micropipeta até a vasculatura. Antes de mover qualquer um dos manipuladores de joystick, confirme se eles estão todos configurados para 0 mm para garantir a melhor mobilidade.
- Quando a ponta da micropipeta estiver em contato com o vaso de minhoca, certifique-se de que o ângulo entre o vaso e a micropipeta seja inferior a 15°.
- Uma vez que a micropipeta começa a aplicar pressão no vaso, o sangue se afasta da ponta devido à pressão na vasculatura. Esta é uma boa indicação do posicionamento adequado da injeção.
- Para garantir uma injeção bem-sucedida, use o joystick para mover a micropipeta para frente para fazer contato com a vasculatura.
NOTA: É importante não perfurar o vaso. Observe que a ponta deve estar movendo a vasculatura, para o vaso dorsal e ventral, na direção em que a micropipeta está se movendo e, em seguida, o mostrador grosso deve ser usado para mover a ponta da micropipeta para frente para permitir a penetração total no vaso. Se a placa for móvel, ela pode ser usada para mover e perfurar o vaso na micropipeta em vez de usar os microcontroladores ou todos simultaneamente. O vaso não será penetrado imediatamente, mas um recuo do vaso é um indicador da penetração adequada da micropipeta. Uma vez que a ponta tenha penetrado no vaso, o vaso deve estar reto e alinhado com a micropipeta. Se não estiver, retraia a micropipeta lentamente usando o controle fino. - Pressione o pedal para injetar a vasculatura da minhoca. A diluição do sangue é outro indicador de penetração adequada quando o pedal é pressionado.
- Retraia a micropipeta lentamente e puxe-a para fora.
NOTA: Alternativamente, quebrar a ponta enquanto a micropipeta ainda está no vaso é um método eficaz para evitar a perda de sangue.
- Antes da microinjeção, coloque a minhoca no estágio de microinjeção e use um lenço umedecido para remover quaisquer fluidos ao redor do vaso de interesse, expondo assim a vasculatura para injeção.
Resultados
Os resultados representativos a seguir são baseados em um conjunto de parâmetros específicos que incluem as configurações usadas para puxar a pipeta de vidro, o tamanho da abertura da pipeta formada a partir de um determinado ângulo de chanfro e a pressão e o tempo das microinjeções. Na Figura 1, é exibido um esquema do fluxo representando o processo do início ao fim.
Com base nos parâmetros do extrator de pipetas selecionados, a seguinte ponta emergiria da tração (Figura 2). Note-se que o valor RAMP pode mudar devido ao tipo de vidro e até mesmo à colocação do filamento. Se os parâmetros forem aceitáveis, a ponta resultante será forte, com um longo cone para chanfro. Se a ponta estiver quebrada ao puxar, o extrator deve ser reajustado.
Para chanfrar a micropipeta, seis ângulos de chanfro foram testados para determinar o ângulo ideal, avaliar a facilidade geral de chanfrar e examinar como o ângulo afetava o tamanho da abertura da ponteira. O ângulo ideal para nossos critérios de chanfro foi determinado em 35°, pois fornece uma ponta afiada, é forte o suficiente para penetrar no vaso sem quebra e é altamente reprodutível. Geralmente, quanto menor o ângulo, mais nítida a ponta se torna, conforme mostrado na Figura 3. Outro ângulo de interesse foi o de 30°, que é mais agudo, mas foi escolhido o de 35°, devido à sua reprodutibilidade. Conforme mostrado na Figura 4, o ângulo do micromanipulador altera a forma e o tamanho da abertura da ponta. É mostrado nesta figura que o chanfro mais preciso e consistente ocorre com um ângulo entre 30° e 40°. Uma tabela suplementar (Tabela S1) foi criada com base na facilidade de chanfro, embora seja importante notar que, de pessoa para pessoa, as técnicas de chanfro variam e, portanto, as pontas variam. Note-se ainda que chanfros malsucedidos podem ocorrer quando o micromanipulador é abaixado muito rapidamente ou quando o vidro se torna muito quebradiço, levando à quebra da ponta.
Para um determinado tamanho de ponta, uma calibração deve ser realizada antes das injeções de compostos. O volume de injeção depende do tamanho da ponta, bem como da pressão de microinjeção e do tempo de injeção. Por exemplo, na Figura 5, as dispensações de volume representativas são representadas graficamente para pontas de 24,4 μm. Os dados revelam uma relação aproximadamente linear entre o volume dispensado e a pressão para tempos fixos de injeção. Dados de calibração personalizados semelhantes devem ser determinados para projetos de ponteiras específicos.
Durante a injeção microvascular, a inspeção visual é necessária para confirmar uma injeção bem-sucedida de um determinado produto. O melhor marcador visível é a diluição do sangue. Conforme mostrado no Vídeo Suplementar e na Figura 6, o sangue fica mais claro à medida que é diluído, e isso é um sinal de injeção bem-sucedida. É fundamental que a micropipeta não penetre muito profundamente no vaso e que a microinjeção não seja feita em um ângulo superior a 15° do vaso, caso contrário, quando a pipeta for puxada para fora, o composto de interesse sangrará para fora de sua vasculatura, devido a grandes feridas. Uma injeção e puxão bem-sucedidos resultarão em sangramento mínimo após a remoção.
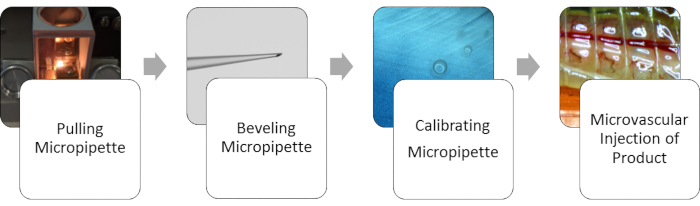
Figura 1: Fluxo do método geral. Para microinjeção da vasculatura da minhoca, primeiro a pipeta precisa ser puxada para obter uma micro abertura na ponta. Em seguida, a ponta da micropipeta é chanfrada para obter uma ponta de agulha afiada. Uma vez alcançada a abertura, a micropipeta é calibrada para o volume adequado dispensado. Uma vez calibradas, as injeções na vasculatura podem ser realizadas. Clique aqui para ver uma versão maior desta figura.

Figura 2: Micropipeta puxada bem-sucedida. Com base nos parâmetros utilizados no protocolo, essa ponta surgiria após a tração. (A) Demonstra a pipeta imediatamente após ser puxada. (B) Uma imagem de perto da mesma pipeta puxada. Clique aqui para ver uma versão maior desta figura.

Figura 3: Perfis de ângulo de chanfro da ponta da micropipeta. Seis ângulos foram testados para chanfro. Diminuindo o ângulo de 45° para 20°, a nitidez e a abertura da ponta aumentam. Clique aqui para ver uma versão maior desta figura.
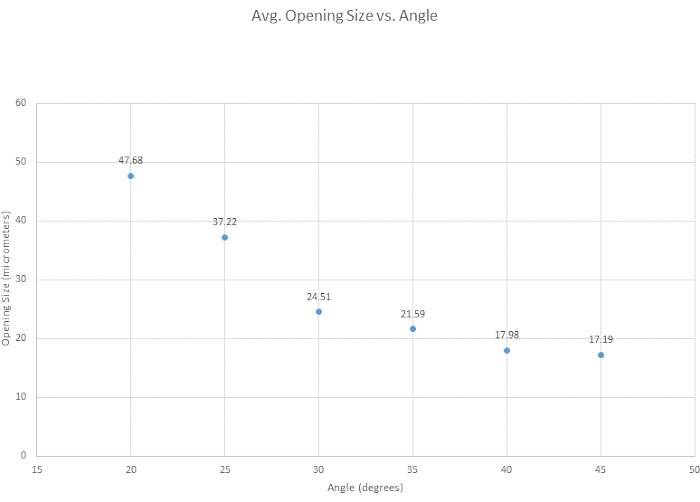
Figura 4: A abertura da ponta se estreita com o ângulo crescente. Seis ângulos foram testados para ver como o ângulo afeta o tamanho da abertura da ponta. O tamanho da abertura da ponta diminui à medida que o ângulo de chanfro aumenta. Clique aqui para ver uma versão maior desta figura.

Figura 5: Calibração para administração de volume. Uma abertura de tamanho de ponta de 24,4 μm foi usada para seus resultados representativos para representar os dados usando os parâmetros específicos de tempo e pressão. Com o aumento da pressão, o volume dispensado aumenta e, com a diminuição do tempo, o volume dispensado diminui. Clique aqui para ver uma versão maior desta figura.

Figura 6: Injeção no vaso ventral. Um visual para injeção bem-sucedida é demonstrado com a diluição do sangue como indicador. Um vídeo suplementar é acompanhado por este painel. Clique aqui para ver uma versão maior desta figura.
Figura S1: Configuração para extração de sangue e urina de minhoca. Clique aqui para baixar este arquivo.
Figura S2: Desvios padrão da Figura 4. Dependendo do ângulo, o desvio padrão muda. 35° mantém um desvio padrão mais baixo, portanto, mais consistente no chanfro e a ponta quebra menos. 30 ° também foi bom com 35 °, conforme mostrado na Tabela S1. Clique aqui para baixar este arquivo.
Figura S3: Demonstra a sobrevivência da minhoca após a cirurgia e usando band-aid líquido para fechar a minhoca. Clique aqui para baixar este arquivo.
Tabela S1: Tabela descritiva para facilidade de chanfro. Três modos foram usados para descrever a facilidade de chanfro variando de fácil a moderado e difícil. Note-se que 15 ° foi testado, mas era um ângulo muito pequeno para produzir uma ponta de micropipeta que não lascasse. Clique aqui para baixar esta tabela.
Vídeo suplementar. Clique aqui para baixar este vídeo.
Discussão
Enquanto a minhoca estiver em etanol a 10%, principalmente se a minhoca for mais velha, pode haver efeitos indesejados para tempos de exposição superiores a 30 minutos; Os intestinos começarão a se deteriorar e, quando a minhoca for aberta cirurgicamente, seus intestinos internos se espalharão. Portanto, é encorajado o uso de minhocas jovens a de meia-idade. Durante o processo de corte da pele da minhoca, é imperativo que não seja feito um corte completo em tesoura, o que significa que o investigador deve cortar apenas até a metade e continuar empurrando a tesoura para frente até chegar ao ponto final. Ao prender a minhoca, tome cuidado para não esticá-la ou puxá-la com muita força. Isso pode causar a ruptura do vaso, o que leva ao sangramento. Após cada injeção, verifique se a micropipeta está entupida, dispensando quaisquer fluidos que possam estar dentro da micropipeta, especialmente para remover o sangue da ponta antes de realizar outra injeção. Além de observar o entupimento da ponta, após cada injeção, observe a ponta da micropipeta para verificar se há quebra da ponta. A ponta da micropipeta também pode ser quebrada, deixando a ponta no lugar para evitar qualquer perda de sangue. É importante observar cuidadosamente o tecido do vaso durante as microinjeções. Quando a micropipeta entra em contato com o vaso pela primeira vez, o tecido do vaso se agarra à ponta da micropipeta. Uma vez que a ponta tenha penetrado com sucesso no vaso, o tecido do vaso pode ser visto deslizando rapidamente para dentro da ponta e também será sentido no micromanipulador. Após uma injeção bem-sucedida, é importante retirar a micropipeta com cuidado, pois a micropipeta pode acabar penetrando mais fundo no tecido ou criando uma ferida maior no local da injeção, e isso pode levar ao vazamento da administração do composto para fora do vaso. Normalmente, as injeções bem-sucedidas ocorreram quando o diâmetro do vaso era de 90 μm ou maior, mas isso pode ser melhorado estreitando o tamanho da ponta da micropipeta pelos investigadores. A minhoca é mantida consistentemente úmida com água para evitar que a minhoca fique desidratada, mas recomenda-se uma solução salina.
Estudos de sobrevivência de minhocas
Experimentos de sobrevivência de minhocas foram conduzidos para dar uma ideia de quanto tempo as minhocas podem sobreviver após a experimentação. Depois que os vermes foram imersos em uma solução de etanol a 10% e, em seguida, cortados cirurgicamente e injetados, assim como durante os experimentos, 27 vermes foram "costurados de volta" com solução líquida de band-aid e observados até 48 horas após o experimento. Às 12 horas de pós-operatório, aproximadamente 67% dos vermes ainda estavam vivos. Às 24 horas de pós-operatório, cerca de 48% dos vermes ainda estavam vivos. Às 36 horas de pós-operatório, cerca de 44% dos vermes ainda estavam vivos. Por fim, às 48 horas de pós-operatório, cerca de 22% dos vermes ainda estavam vivos. Os resultados desses experimentos mostram que a maioria dos vermes pode sobreviver por um dia inteiro de 12 horas após ter sido submetida a cirurgia experimental e injeção, e um grande número de vermes pode sobreviver por ainda mais tempo do que isso (Figura S3). Isso representa uma oportunidade para cada verme ser monitorado por estudos de 24 horas, se desejado.
Cuidados laboratoriais com minhocas
As minhocas, nightcrawlers canadenses, foram compradas em lojas da Windsor Wholesale Bait e foram entregues como 500 minhocas grandes em uma caixa de isopor (35w x 38l x 30d cm) e mantidas na geladeira, pois as minhocas individuais foram removidas e usadas para experimentos. Conforme observado nas etapas do protocolo de preparação de minhocas, não mais do que 10 minhocas foram usadas de uma só vez devido à evaporação da minhoca, o que pode levar à desidratação16. Além disso, a exposição das minhocas à luz foi limitada, uma vez que contêm células sensíveis à luz em sua pele; A exposição à luz por mais de duas horas pode levar à morte. Imediatamente após a chegada, o solo do contêiner foi trocado e as minhocas foram autorizadas a descansar por um período de espera de 24 horas antes de serem usadas para os experimentos. Isso garantiu que as minhocas fossem reenergizadas e não mais cansadas devido ao transporte. Neste ponto, a experimentação com a minhoca pode começar.
As minhocas têm uma vida útil desconhecida, mas podem ser mantidas vivas em um ambiente de laboratório por longos períodos quando são monitoradas todos os dias e recebem os nutrientes certos. A cada duas semanas, um novo solo deve ser adicionado ao recipiente para fornecer mais nutrientes para a minhoca. A minhoca é um invertebrado escavador profundo, anécico, e construirá tocas de até 180 cm (6 pés), então deve haver pelo menos 1 pé de solo no recipiente para 500 minhocas. No fundo do recipiente, pode-se adicionar jornais velhos, pois é aqui que algumas das minhocas criarão suas casas. Uma vez que o solo tenha sido alterado, é recomendável verificar o cheiro e detectar minhocas feridas ou mortas. Não deixe minhocas mortas ou feridas no recipiente, pois elas contaminarão o solo e criarão mais mortes em sua colônia de minhocas.
Aplicações futuras
Neste protocolo, é apresentada a preparação e o procedimento para a realização de experimentos de sangue de alto rendimento usando a minhoca. Embora restritos ao sistema circulatório, os métodos de injeção descritos aqui podem ser expandidos para estudos envolvendo o sistema nervoso, já que o cordão nervoso da minhoca está paralelo ao vaso ventral. Por exemplo, pesquisas anteriores usando a minhoca foram estudadas para estudos de neuromodulação e ruptura de vasos de aplicações terapêuticas de ultrassom18,19. Com essa nova configuração, estudos mais aprofundados de ultrassom + microbolhas podem ser conduzidos para expandir a pesquisa de neuromodulação e ruptura de vasos.
Além disso, a cavidade celômica na minhoca pode ser utilizada para estudar o sistema imunológico, porque o fluido que reside na cavidade celômica medeia a maioria, se não todas, as respostas imunes. A minhoca é única porque existem apenas dois fluidos no animal, cada um contido em cavidades separadas, o sangue nos vasos e o fluido celômico na cavidade celômica. Essa separação de fluidos permite tipos específicos de pesquisa em duas cavidades. Por exemplo, o fluido celômico está repleto de numerosos celomócitos, cujas funções imunológicas compartilham características com os celomócitos da maioria dos outros modelos animais. Investigações de fagócitos e outras células semelhantes que podem destruir alvos celulares podem ser realizadas na minhoca, e a minhoca provavelmente tem muitas aplicações de pesquisa adicionais que podem ser usadas como um modelo alternativo de invertebrados.
Embora a minhoca não tenha a complexidade de modelar muitos aspectos do sistema anatômico e fisiológico humano, a microinjeção oferece um sistema circulatório contido contendo sangue notavelmente semelhante ao sangue humano em termos de estrutura da hemoglobina. Em aplicações onde pequenos volumes de sangue são aceitáveis, a minhoca oferece uma plataforma de teste de baixo custo e prontamente disponível, isenta dos Comitês Institucionais de Cuidado e Uso de Animais. Como resultado, os testes em minhocas com vários compostos podem ser feitos repetidamente e em tamanhos de amostra que provavelmente excederão em muito o que seria prático usando animais vertebrados de laboratório padrão.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi financiado pela NSF-FDA Scholar-in-Residence Fellowship (NSF-FDA SIR, #1641221), US Food and Drug Administration Office Chief Scientist Challenge Grant (FDA OCS), National Science Foundation Integrative Graduate Education and Research Traineeship (NSF IGERT, # 1144646) e apoiado pelo Office of Science and Engineering Laboratories (OSEL) da Food and Drug Administration (FDA) dos EUA.
Materiais
| Name | Company | Catalog Number | Comments |
| 3M Vetbond Tissue Adhesive | 3M Vetbond | 084-1469SB | 3mL bottle vet adhesive - liquid band-aide |
| 40x Stereo Microscope | Sutter Instrument Co. | BV-10-D | Not needed, can add on other scopes |
| 500 Large Worms | Windsor Wholesale Bait | 500 Large | |
| Beveler pedestal oil | Sutter Instrument Co. | 008 | |
| Blades | Ted Pella, Inc | 121-2 | |
| Borosilicate Glass with Filament | Sutter Instrument Co. | BF150-86-10 | |
| Camera | AmScope | MU500 | |
| Camera | AmScope | MU1803-CK | 8MP USB3.0 Microscope Digital Camera |
| Electrode Impedance Meter | Sutter Instrument Co. | BV-10-C | |
| Ethanol | Sigma Aldrich | E7023-1L | Pure ethanol |
| Filament | Sutter Instrument Co. | FT315B | trough filament |
| Grinding Plate | Sutter Instrument Co. | 104D | Fine Plate |
| Hospital Grade Saline | Baxter Healthcare Corporation | 2F7124 | 0.9% Sodium Chloride Irrigation |
| Joystick Micromanipulator | Narishige | MN-151 | |
| KimWipes Kimtech Science | Kimberly-Clark Professional | 34155 | |
| Leafgro | LeafGro | 589252 | 1.5-cu. ft. |
| Metal Hub Needle | Hamilton | 91024 | Luer Lock Metal Needle |
| Micro Vessel Clips | WPI | 501779-G | |
| Microinjector | TriTech Research | MINJ-D | |
| Micropiette Puller Model P-97 | Sutter Instrument Co. | P-97 | |
| Micropipette Beveler | Sutter Instrument Co. | BV-10-B | |
| Microscope | AmScope | SM-8TPW2-144S | 3.5X-225X Simul-Focal Articulating Microcope |
| Needle Holder | TriTech Research | MINJ-4 | |
| NeverWet | Rust-Oleum | NeverWet | |
| Pyrex Glass | Corning | 08747A | Fisher Manufacturer |
| Stainless Micro-Ruler | Ted Pella, Inc | 13635 | Micro-Ruler mounted on a Handle, 10mm scale, with lines at 0.01mm intervals |
| Surgical Grips | Ted Pella, Inc | 53073 | Forceps, Hemostat |
| Surgical scissors | Ted Pella, Inc | 1320 | Fine Iris Scissors, Straight |
| U.S.P. Mineral Oil Lubricant Laxative | Swan | Mineral Oil |
Referências
- Stevenson, J. The Oligochaeta. , Claredon Press. Oxford. 685(1930).
- Reynolds, J. W., Reynolds, W. M. Earthworms in medicine. American Journal of Nursing. 72 (7), 1273(1972).
- Gates, G. E. The earthworms of Rangoon. Journal of the Burma Research Society. 25, 196-221 (1926).
- Carr, L. G. K. Interesting animal foods, medicines, and omens of the eastern Indians, with comparisons to ancient European practices. Journal of the Washington Academy of Sciences. 41 (7), 229-235 (1951).
- Price, S. F. Kentucky folk-lore. The Journal of American Folklore. 14 (52), 30-38 (1901).
- Elmer, J., Palmer, A. F., Cabrales, P. Oxygen delivery during extreme anemia with ultra-pure earthworm hemoglobin. Life Sciences. 91 (17-18), 852-859 (2012).
- Eyambe, G. S., Goven, A. J., Fitzpatrick, L. C., Venables, B. J., Cooper, E. L. A non-invasive technique for sequential collection of earthworm (Lumbricus terrestris) leukocytes during subchronic immunotoxicity studies. Laboratory Animals. 25 (1), 61-67 (1991).
- Basley, K., Goulson, D. Effects of chronic exposure to clothianidin on the earthworm Lumbricus terrestris. PeerJ. 5, 3177(2017).
- Mvumi, B. M., Gwenzi, W., Mhandu, M. G. Ecotoxicological effects of citrus processing waste on earthworms. Lumbricus terrestris L. Industrial Crops and Products. 110, 123-129 (2017).
- Furst, A. My saga with earthworms. Food and Chemical Toxicology. 40 (6), 789-791 (2002).
- Cooper, E. L., Hrzenjak, T. M., Grdisa, M. Alternative sources of fibrinolytic, anticoagulative, antimicrobial and anticancer molecules. International Journal of Immunopathology and Pharmacology. 17 (3), 237-244 (2004).
- Cooper, E. L., Hirabayashi, K., Balamurugan, M. Dilong: food for thought and medicine. Journal of Traditional and Complementary Medicine. 2 (4), 242-248 (2012).
- Nagasawa, H., et al. Inhibition by lombricine from earthworm (Lumbricus terrestris) of the growth of spontaneous mammary tumours in SHN mice. Anticancer Research. 11 (3), 1061-1064 (1991).
- Shannon, K. M., Gage, G. J., Jankovic, A., Wilson, W. J., Marzullo, T. C. Portable conduction velocity experiments using earthworms for the college and high school neuroscience teaching laboratory. Advances in Physiology Education. 38 (1), 62-70 (2014).
- National Research Council. A framework for K-12 science education: Practices, crosscutting concepts, and core ideas. , National Academies Press. (2012).
- Ramsay, J. The Osmotic Relations of the Earthworm. Journal of Experimental Biology. 26 (1), 46-56 (1949).
- Mulloney, B. Structure of the Giant Fibers of Earthworms. Science. 168 (3934), 994-996 (1970).
- Kim, Y., Nabili, M., Acharya, P., Lopez, A., Myers, M. R. Microvessel rupture induced by high-intensity therapeutic ultrasound - a study of parameter sensitivity in a simple in vivo model. Journal of Therapeutic Ultrasound. 5 (1), 5(2017).
- Wahab, R. A., et al. Mechanical bioeffects of pulsed high intensity focused ultrasound on a simple neural model. Medical Physics. 39 (1), 4274-4283 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados