Method Article
지렁이, Lumbricus Terrestris: 새로운 미세 주입 혈관 구조 생체 내 무척추 동물 모델
요약
지렁이는 혈관 구조 연구를 위한 새로운 무척추동물 in vivo bench-top 모델입니다. 우리는 지렁이 혈관 구조에 효율적인 수술과 미세 주입을 가능하게 하는 기술과 장비를 제시합니다. 수술 프로토콜, 미세 주입 기술 및 맞춤형 마이크로 피펫을 생산하는 절차에 대해 설명합니다.
초록
척추동물은 생물의학 연구에 없어서는 안 될 존재이지만, 연구는 비용, 장시간의 내부 검토, 윤리적 고려 사항 등의 요인으로 인해 제한되는 경우가 많습니다. 우리는 지렁이를 특정 예비 혈관 구조 연구에 적용할 수 있는 대안적이고 저렴한 무척추 동물로 제시합니다. 지렁이의 등쪽 혈관, 복부 혈관 및 5쌍의 유사 심장을 외과적으로 이용할 수 있기 때문에 지렁이는 쉽게 접근할 수 있고 유지 비용이 저렴하며 주어진 화합물을 소량만 투여하면 됩니다. 지렁이 모델은 인간의 혈액과 유사한 헤모글로빈 구조를 가진 단순한 폐쇄 혈관 순환계를 제공합니다. 지렁이를 마취하고 관련 혈관을 노출시키기 위해 외과적 절개를 수행하기 위한 프로토콜이 제공됩니다. 화합물 투여를 위한 마이크로피펫은 피펫 풀러로 유리를 가열 및 당기고 베벨링 시스템을 사용하여 미크론 크기의 미세한 바늘 팁을 만들어 형성됩니다. 그런 다음 팁을 마이크로 포지셔너 및 마이크로 인젝터와 함께 사용하여 큰 샘플 크기와 작은 화합물 부피를 사용하여 지렁이의 혈관 시스템에 임의의 화합물을 반복적으로 주입합니다. 주입 절차의 복잡성에 대한 세부 정보가 제공됩니다. 지렁이의 작은 혈관 크기는 특히 복부 혈관의 경우 까다롭습니다. 그러나 제시된 기술을 숙달하면 저비용 솔루션으로서 높은 반복성을 제공하므로 매우 큰 표본 크기의 연구를 실용적으로 수행할 수 있습니다.
서문
지렁이는 이전 과학적 응용 분야에서 중요한 생물 지표 및 생물학적 분석으로 사용되었습니다 1,2,3,4,5,6; 토양 내 살생물제(살충제) 및 생태독성학적 부작용 7,8,9,10과 같은 현장 및 생물 축적 연구를 위해 육상 환경에서 유해하고 독성 폐기물로 인한 생물학적 위험을 평가하는 데 이상적인 유기체입니다. 또한, 생물탐사로 인해, 지렁이는 섬유소 용해, 항응고제, 항균 및 항암 분자의 대체 공급원입니다11,12; 1991년 한 연구팀이 지렁이 피부에서 lumbricine을 추출하고 정제하여 SHN 마우스의 유방 종양에 이식하여 종양 성장 억제를 유도했습니다13. 지렁이는 또한 학생들을 수술에 노출시키고 표본의 해부학을 이해하는 데 사용할 수 있기 때문에 교육학적으로 유용한 동물 모델입니다. 혈액 순환 연구에서 전기 생리학에 이르기까지14,15.
우리 자신의 연구에서 우리는 고강도 초음파에 대한 살아있는 지렁이의 혈관의 반응을 조사했습니다18. 우리는 지렁이의 혈관 파열이 인간 미세혈관의 파열 손상과 관련된 것과 유사한 조건에서 발생한다는 것을 발견했습니다. 우리의 지속적인 연구는 지렁이 혈관 구조에 미세 기포를 주입하는 것입니다. 마이크로버블은 지질, 알부민 또는 폴리머 껍질로 둘러싸인 무거운 가스로 구성되며, 이러한 제제는 표적 약물 전달을 위한 매개체뿐만 아니라 이미지 조영제로 사용할 수 있습니다.
이 새로운 프로토콜은 지렁이의 자연적인 생물 지표를 활용할 수 있는 화합물의 정맥 주사(IV) 주사로 이점을 얻을 수 있는 모든 연구와 관련이 있습니다. 이 접근법은 지렁이의 5쌍 유사 심장, 등쪽 혈관 및 복부 혈관 중 하나를 포함하여 여러 가능한 진입점 중 하나에 IV 미세 주입을 기반으로 합니다. 이 절차에는 혈관을 노출시키기 위한 정교한 외과적 절개 후 마이크로 포지셔너 제어 주사가 포함됩니다. 이는 지렁이 혈관 미세주입을 위해 특별히 제작된 맞춤형 마이크로피펫을 사용하여 달성됩니다. 이 마이크로피펫을 사용하면 90μm 직경의 배쪽 혈관만큼 작은 혈관을 정밀하게 표적화할 수 있습니다.
이 프로토콜은 지렁이의 혈액 및 소변 추출에 대한 1948년 연구를 포함한 초기 마이크로 피펫팅 기술을 개선하기 위해 고안되었습니다16. 그림 S1에서 볼 수 있듯이 이 추출을 위한 설정은 어려울 수 있으며 저자가 말했듯이 최대 1시간 이상이 걸릴 수 있습니다. 1970년에도 비슷한 방법이 개발되었지만, 저자는 지렁이의 거대한 섬유에 액체를 주입하는 동안 팁이 여러 번 부러지는 경험을 했다17. 아래에 설명된 현재 방법에서 혈액 추출은 몇 초에서 몇 분 정도 소요되며 화합물 주입 및 지렁이 유체 추출 모두와 관련이 있습니다. 이 특별한 경우에는 조영제, 마이크로 버블을 주입했습니다.
프로토콜
1. 마이크로 피펫 준비: 유리를 당기고 팁을 베벨링합니다.
- 마이크로피펫 당기기
- 마이크로피펫 풀러를 켜고 프로그램을 선택하여 지렁이 미세주입에 대한 특정 매개변수를 입력합니다.
- 매개변수를 압력=500, 당김=75, 시간=250, 열=336 및 속도=70으로 설정합니다. 결과는 풀러마다 다를 수 있습니다. 따라서 원하는 팁(크기, 선명도, 모양 등)을 얻기 위해 매개변수를 실험해 보십시오.
- 마이크로피펫을 당기기 전에 마이크로피펫의 열 값을 결정하기 위해 RAMP 테스트를 수행해야 하며, 그렇지 않으면 트로프 필라멘트가 타거나 유리가 깨질 수 있습니다.
- 공기압을 변경해야 하는 경우 지우기 버튼을 누르고 모든 값을 지우라는 메시지가 표시되면 아니오(0)를 선택하고 압력 변경(2)을 선택합니다. 이 프로세스는 풀러마다 다를 수 있습니다. 따라서 압력 설정을 변경하려면 기기 설명서를 찾으십시오.
- 마이크로피펫 풀러 뚜껑을 열고 마이크로피펫을 풀러에 넣습니다. 사용된 마이크로피펫 유리는 필라멘트 피펫이 있는 붕규산 유리로 길이 10cm, 외경 1.5mm, 내경 0.86mm입니다.
- 피펫 끝이 피펫 홀더 끝과 정렬될 때까지 피펫 슬릿을 따라 오른쪽에서 V-홈으로 피펫을 밀어 넣습니다. 피펫이 필라멘트를 가로질러 반대쪽으로 이동할 수 있도록 하려면 피펫 슬릿에 놓여 있도록 하면서 피펫을 가능한 한 멀리 밉니다.
- 피펫을 잠그려면 오른쪽에 있는 손잡이를 조이고 잠긴 시스템이 필라멘트를 통해 풀러의 다른 쪽에 도달할 때까지 피펫과 함께 밉니다. 마지막으로 피펫의 왼쪽을 풀러에 고정합니다. 피펫은 필라멘트의 중간에 있어야 합니다. 피펫을 올바르게 정렬하는 방법에 대한 지침은 설명서를 참조하십시오.
- 피펫이 로드되면 풀러를 닫고 당김 버튼을 누른 다음 피펫이 당겨질 때까지 기다렸다가 두 개의 결과 피펫을 제거합니다.
- 손잡이를 풀어 피펫을 제거하고 슬릿에서 제거하는 동안 피펫을 자르지 않도록 주의하십시오.
- 당겨진 마이크로피펫을 마이크로피펫 홀더 또는 어떤 유형의 지지대에 올려 놓아 마이크로피펫을 제자리에 고정하고 당겨진 마이크로피펫을 부러뜨리지 않고 쉽게 회전할 수 있도록 합니다. 우리는 기계 공장에서 만들거나 3D 프린팅할 수 있는 자체 마이크로피펫 홀더를 개발했습니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다. - 마이크로피펫 홀더를 현미경 아래에 놓고 카메라 프로그램 또는 유사한 소프트웨어를 사용하여 당겨진 마이크로피펫의 사진을 캡처하고 팁에서 ~1000mm 및 ~50mm 배율을 사용하여 팁 직경을 기록합니다.
- 사진을 캡처하기 전에 특히 이미징 후 측정을 위해 정확하게 측정하기 위해 카메라 설정이 현미경 설정(10x)과 일치하는지 확인하십시오. 10x 설정은 화면 상단 근처에 있는 가로 도구 모음 리본에서 찾을 수 있습니다.
- 에 view 마이크로피펫의 사진을 캡처하려면 왼쪽 상단 모서리에 있는 카메라 소프트웨어에서 카메라를 선택하고 팁에 초점을 맞춘 후 스냅 버튼을 눌러 정확한 판독값을 얻습니다. Snap 버튼은 카메라 탭 아래 페이지 왼쪽의 가로 도구 모음에 있습니다.
- 당겨진 마이크로피펫을 측정하여 원하는 팁 크기와 일관성이 달성되었는지 확인합니다. 최대 5개의 피펫을 당기는 것만으로도 풀러와 그 매개변수가 원하는 크기를 일관되게 생산하고 있는지 확인하기에 충분합니다. 원하는 팁 크기에 도달하지 못했거나 파이펫마다 크기가 계속 달라지는 경우, 연구자는 원하는 팁 크기에 도달할 때까지 다른 설정으로 실험해야 할 수 있으며, 또는 필라멘트 및 파이펫 배치를 수정해야 할 수 있으며, 이 경우 파이펫 풀러 설명서를 참조해야 할 수 있습니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다.
- 마이크로피펫을 베벨링하도록 설정하고 전극 임피던스 미터를 사용합니다.
- 당겨진 마이크로피펫을 베벨링하려면 전극 임피던스 미터와 40x 실체 현미경이 있는 마이크로피펫 베벨러를 사용하십시오.
알림: 다른 베벨러를 사용할 수 있습니다. 사내 베벨러도 성공적일 뿐만 아니라 현미경에 카메라를 장착하는 것을 포함하여 베벨링 프로세스를 검사하기 위해 다른 현미경으로 다양한 구성을 달성할 수 있습니다. - 두 개의 검은색 홀더 사이에 있는 미세한 플레이트로 받침대/연삭 플레이트를 조립합니다.
- 자석이 플레이트에서 반대쪽을 향하도록 바닥판을 놓습니다.
- 세 부분을 함께 나사로 조입니다: (1) 상부 고정 링, (2) 연삭 미세 플레이트, (3) 하부 고정 링(자성). 연삭 플레이트의 연마 표면을 확인하십시오. Fine Plate의 경우 자주색이며 유리가 Quartz Optical flat과 접촉할 수 있도록 위쪽을 향해야 합니다.
- 베벨링 기기의 석영 광학 평면에 베벨러 받침대 오일 5방울 또는 필요한 만큼 떨어뜨리고 조립된 플레이트를 그 위에 놓습니다. 이 오일은 하루 종일 지속될 수 있지만 플레이트가 흔들리거나 회전해야 할 때 회전하지 않으면 석영 광학 플랫에 다시 오일을 발라야 할 수 있습니다.
- 플레이트를 수동으로 몇 번 돌려 오일을 펴면 기기를 켤 수 있습니다.
- 임피던스 미터를 설정하려면 기준선인 심지에 식염수(0.9% NaCl)를 추가하고 심지를 베벨링 플레이트에 놓습니다. 리본을 적셔 마이크로피펫으로 회로를 만들고 얇은 식염수 층으로 플레이트를 덮습니다.
- 임피던스 미터에 연결된 와이어 끝에 리드 세그먼트를 부착합니다.
- 임피던스 미터의 "켜기" 스위치를 뒤집고 베벨링을 시작할 준비가 될 때까지 "대기" 상태로 둡니다. 우리는 큰 개구부를 만들고 있기 때문에 베벨 할 준비가되면 전극 임피던스 미터를 x0.1로 설정하십시오.
- 당겨진 마이크로피펫을 베벨링하려면 전극 임피던스 미터와 40x 실체 현미경이 있는 마이크로피펫 베벨러를 사용하십시오.
- 마이크로피펫 장착 및 베벨링
- 매니퓰레이터에 있는 피펫 cl에 마이크로피펫을 로드하고 베벨링하는 동안 손잡이를 조여 제자리에 고정합니다.
- 마이크로피펫의 뒤쪽 끝을 통해 전체 피펫에 식염수를 채우고 리드를 마이크로피펫에 삽입하여 마이크로피펫에 기포가 없는지 확인합니다. 마이크로피펫에 기포가 존재하면 측정에 변동성이 발생하는 것으로 확인되었습니다.
- "stand-by"에서 "x0.1"로 전환하여 임피던스 미터를 켭니다. 저항은 초기에 100MΩ이어야 하며 마이크로피펫 팁이 식염수에 닿으면 다른 판독값을 표시해야 합니다.
- 올바른 팁 개구부 크기를 베벨링하려면 마이크로피펫을 내리기 전에 매니퓰레이터의 각도를 35°로 조정하여 일관된 베벨링을 달성하십시오. 30° 각도도 충분하지만 둘 사이에서 35°는 더 낮은 표준 편차를 유지하므로 베벨링에서 더 일관되고 팁이 덜 부러집니다.
- 매니퓰레이터를 사용하여 마이크로피펫 팁을 연삭 플레이트의 회전 중심에서 약 2/3 떨어진 곳에 배치합니다.
- 거친 조정 손잡이를 사용하여 마이크로피펫 팁이 식염수에 접근하도록 마이크로피펫을 플레이트 가까이로 내립니다. 사용할 수 있는 카메라가 없는 경우 현미경을 내려다보고 팁의 베벨을 확인하는 것이 중요합니다.
- 마이크로피펫 팁이 식염수와 접촉하면 임피던스 미터 판독값이 100MΩ에서 80MΩ에서 20MΩ 사이의 값으로 감소해야 합니다. 이 값은 당겨진 유리 개구부로 인해 달라집니다.
- 이 시점에서 거친 조정 손잡이에서 미세 조정 손잡이로 전환하여 플레이트의 팁이 파손되지 않도록 피펫을 더 천천히 내립니다. 이 베벨링 단계에서 임피던스 미터와 팁을 동시에 모니터링하는 것이 중요합니다.
- 베벨링하는 동안 팁 크기가 변하는 것을 관찰하고 조명을 사용하여 베벨링하는 동안 유리한 지점을 만드는 데 도움이 됩니다.
알림: 베벨링이 발생하면 팁이 매우 광택이 나고 팁 입구가 더 커집니다. 이 단계에서 마이크로피펫을 내리거나 올리기 위해 매니퓰레이터의 미세 조정 손잡이를 사용하는 것이 필수적입니다. 마이크로피펫을 플레이트에서 들어 올린 후 플레이트로 다시 가져오면 팁이 파손될 수 있습니다. - 팁이 베벨링 플레이트에 도달할 때까지 팁을 천천히 내리고 약 20MΩ의 저항에 도달할 때까지 천천히 베벨링합니다. 이 과정을 숙달하면 강력한 학습 곡선이 될 것이며 팁을 일관되게 베벨링하는 연습이 필요합니다.
- 20MΩ의 저항에 도달하면 베벨러에서 마이크로피펫을 들어 올립니다.
- 마이크로피펫에서 리드를 제거하고 베벨러에서 마이크로피펫을 내립니다. 베벨러에 남겨두면 마이크로 피펫이 부러지거나 끝에 더 큰 구멍이 생길 수 있습니다. 따라서 베벨링하는 동안 미터와 팁을 모니터링하는 것이 필수적입니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다. - 비스듬한 마이크로피펫을 마이크로피펫 홀더에 놓고 현미경 소프트웨어의 10x 대물렌즈를 사용하여 팁 개구부 크기를 측정합니다. 10개의 팁으로 구성된 샘플 크기는 모든 베벨 팁의 일관성을 확인하기에 적합합니다.
- 사진을 찍기 전에 현미경 설정(10x)이 카메라 설정과 일치하는지 확인하십시오. 팁 개방 측정 후 이상값이 버려질 수 있습니다.
- 베벨러를 끄려면 구동 벨트 모터와 임피던스 미터 모두에서 스위치를 "끄기"로 돌립니다.
- 받침대/연삭 플레이트의 나사를 풀어 상부 고정 링을 제거합니다. 받침대/연삭판이 서로 부착되어 있는 동안 진공이 생성되어 파손될 수 있으므로 들어 올리지 마십시오.
- 나사로 부착물의 상부 고정 링을 들어 올린 후 미세 연삭 플레이트를 밀어서 제거하고 마지막 자기 부착물을 들어 올려 제거합니다. 실험실용 물티슈로 quartz optical flat의 과도한 오일을 제거합니다.
- 세 가지 구성 요소를 모두 탈이온수(DI)로 세척하고 염 결정 형성을 방지하기 위해 두드려 건조시킵니다. 장기간 사용하면 회전하는 마그네틱베이스가 경련을 경험할 수 있습니다. 이 경우 구동 벨트에 소량의 DI 물을 분사하여 결정화된 염을 제거하십시오.
- 그라인딩 플레이트 뒷면과 석영 광학 평면에 있는 여분의 오일을 닦아냅니다.
- 베벨러 플랫폼에서 DI 물을 사용하여 결정화를 방지하기 위해 기기에 있을 수 있는 과도한 식염수를 제거합니다.
- DI 물을 사용하여 경사진 팁을 씻으십시오. 팁을 세척하지 않으면 결정화되지만 나중에 DI 물로 쉽게 씻어낼 수 있습니다.
- 접시 안에 점토를 놓고 커버 유리를 사용하여 마이크로피펫이 오염되는 것을 방지합니다.
- 마이크로피펫을 고정하기 위해 점토에 움푹 들어간 곳을 만듭니다. 사용할 준비가 되면 경사진 팁은 이제 관심 화합물로 다시 채워지고 지렁이의 혈관 구조에 주입될 준비가 됩니다. 이 프로토콜 예시를 위해, 조영제, 마이크로버블이 관심 화합물로 사용되었습니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다.
2. 경사진 팁을 사용한 마이크로인젝터 교정
- 소수성 코팅된 플레이트를 준비합니다.
- 그 전날, 표면에 소수성 코팅이 된 두 개의 플레이트를 코팅하여 밤새 경화시킵니다. 이 화학 물질은 매장에서 구입한 재료 또는 가능한 경우 사내 실험실 재료에서 가져와야 하며 경화를 위해 최소 12시간이 필요합니다.
- 코팅은 빠른 2단계 공정입니다. Base Coat를 분사한 후 Top Coat를 분사합니다.
- 후드 안이나 개방된 공간에서 믹싱 볼이 1분 동안 덜거덕거리면 베이스 코트 캔을 세게 흔든 후 베이스 코트를 플레이트에 뿌립니다.
- 플레이트를 코팅하는 동안 패스를 수행하여 표면에서 약 6-12인치 떨어진 곳에 Base Coat를 플레이트에 분사합니다. 패스는 라이트가 오른쪽에서 왼쪽으로, 그리고 위아래로 패스하는 것으로 구성됩니다. 플레이트가 코팅될 때 계속 흔들고 제품 성능을 저하시킬 수 있으므로 과도하게 스프레이하지 마십시오.
- 베이스 코트를 다시 코팅하기 전에 1-2분 정도 기다립니다. 필수는 아니지만 원하는 경우 추가 코팅을 적용할 수 있습니다.
- 베이스 코트가 마를 때까지 30분 동안 기다립니다.
- 탑 코트에 대해 2.1.3 - 2.1.5 단계를 반복합니다.
- 플레이트가 하룻밤 동안 또는 최소 12시간 동안 경화되면 플레이트에 미네랄 오일을 채울 준비가 된 것입니다. 플레이트에 미네랄 오일을 약 절반 정도 채웁니다.
- 미네랄 오일이 든 플레이트를 마이크로인젝터 스테이지에 놓습니다.
- 마이크로인젝터에 경사진 팁을 로드합니다.
- 마이크로인젝터를 실험실용 압축 공기 분사기에 직접 연결합니다. 이 시스템에는 압축 질소 실린더와 압력 조절기를 사용할 수 있지만 다른 마이크로 인젝터 시스템에는 다른 인터페이스가 필요할 수 있습니다.
- 압축 공기를 열고 저압 에어 라인 레귤레이터를 70PSI로 열고 마이크로인젝터를 켭니다. 시스템이 80PSI 이상을 처리할 수 없으므로 80PSI를 초과하지 마십시오.
- Metal Hub Needle이 있는 1mL 주사기를 사용하여 팁을 물로 다시 채웁니다. 피펫의 내경이 다른 경우이를 수용하기 위해 다른 게이지 금속 바늘이 필요합니다.
- 물이 다시 채워지면 마이크로피펫을 조이스틱 마이크로매니퓰레이터의 바늘 홀더에 넣습니다. 다양한 마이크로인젝터와 마이크로매니퓰레이터를 사용할 수 있습니다.
- 경사진 마이크로피펫을 통해 분주량을 보정하기 위해 물 거품을 생성합니다.
참고: 지렁이의 혈관 구조에 화합물 투여를 도입하기 전에 적절한 부피 주입을 결정하기 위해 마이크로인젝터를 보정해야 합니다.- 마이크로인젝터의 압력은 4PSI이고 시간은 0.5초로 설정합니다. 이러한 매개변수를 초과하면 선박의 크기가 왜곡되며, 이는 연구자의 목표가 선박 확장을 연구하는 것이 아닌 한 바람직하지 않습니다.
- 플레이트 바닥에 가까워질 때까지 피펫 팁을 내리되 플레이트 바닥의 팁이 부러지지 않도록 주의하십시오. 팁이 미네랄 오일에서 낮을수록 팁의 점성이 높아져 파손될 수 있습니다.
- 플레이트의 가장자리에서 시작하여 교정 중에 플레이트를 완전히 활용하십시오.
- 이것이 제자리에 고정되면 페달을 밟아 오일에 물방울을 분사합니다.
- 거품이 팁에 붙어 있을 수 있습니다. 이 문제를 해결하려면 플레이트를 기포에서 반대 방향으로 빠르게 당겨 피펫 팁에서 분리하십시오.
- 카메라 소프트웨어를 사용하여 기포 크기를 측정하고 부피를 계산합니다. 사용할 수 있는 카메라 소프트웨어가 없는 경우 대체 소프트웨어를 사용할 수 있습니다.
- 10개의 기포를 만들고 평균 기포 직경을 측정하여 마이크로피펫이 지렁이 혈관 구조에 분배할 정확한 부피를 결정합니다.
참고: 연구자가 다양한 부피를 분배하는 데 관심이 있는 경우 압력 및 시간에 대한 매개변수를 조작할 수 있습니다. 2.3.1 - 2.3.7단계를 반복합니다.
3. 관심 있는 특정 지렁이 혈관 조직을 노출시키기 위한 지렁이 수술 준비
- 지렁이 준비 및 측정
- 수술 전에 지렁이를 마취시킬 10% 에탄올 용액을 준비합니다.
- 실험 사이에 흙과 함께 100mL 비커에 지렁이를 보관하십시오.
- 한 번에 5-10마리의 지렁이만 비커에 보관하여 냉장고에서 벤치탑으로 4°C에서 25°C의 갑작스러운 변경으로 인해 지렁이가 마르는 것을 방지하십시오.
- 지렁이를 10% 에탄올에 30분 동안 넣습니다. 30분 후에도 지렁이가 계속 움직이면 에탄올 용액에 5분 더 그대로 두십시오.
참고: 때때로 지렁이는 크기 때문에 더 많은 시간이 필요합니다. 따라서 에탄올의 시간은 지렁이 크기에 따라 조정해야 할 수 있지만 한 시간을 초과해서는 안 됩니다. 한 시간 이상 지렁이에 해를 끼칠 것입니다. - 지렁이를 수도꼭지 물로 헹구어 지렁이가 생성하는 점액과 에탄올을 제거합니다.
- 종이 타월에 지렁이를 올려 여분의 물을 제거합니다.
- 지렁이가 마취되면 각 지렁이의 무게(g), 너비(mm), 길이(mm) 및 혈관 너비(μm)를 기록합니다. 절개가 이루어지기 전에 지렁이를 늘리지 않고 지렁이의 무게와 크기를 측정하십시오.
- 수술을 통해 혈관을 현미경으로 노출시킨 후 카메라 소프트웨어를 사용하여 혈관의 너비를 측정합니다. 사용할 수 있는 카메라 소프트웨어가 없는 경우 스테인리스 마이크로 눈금자로 충분하지만 디지털 소프트웨어 측정만큼 정확하지는 않습니다.
참고: 관심 혈관에 따라 3.2단계(복부 혈관), 3.3(등쪽 혈관), 3.4(심장 상단) 또는 3.5(심장 측면)로 건너뜁니다.
- 지렁이 혈관 구조, 복부 혈관 노출(방법 1)
- 수술 중에 고무 패드를 사용하여 지렁이를 고정하여 관심 혈관이 연구자에게 노출되도록 합니다. 피부의 어두운 부분이 아래를 향해야 합니다.
- 지렁이를 외과 적으로 열려면 지렁이의 어두운 부분 인 등쪽에 놓고 칼날로 약 1mm의 피부를 작은 절개로 만듭니다. 이 작은 절개는 수술용 가위가 들어가 긴 절개 부위를 만들 수 있도록 합니다.
- 지렁이 피부를 33mm 간격으로 고정하여 혈관을 노출시키기 위해 27mm의 구멍을 만들고 혈관을 적절하게 노출시키기 위해 4개의 핀만 사용합니다. 핀은 지렁이가 고정되면 지렁이의 피부를 조작하는 데 도움이 되도록 추가하거나 이동할 수 있습니다.
- 수술용 가위로 몸 옆의 다른 핀에 닿도록 절개합니다. 피부를 향해 밀어 올리면 혈관 조직이나 장을 절단하는 것과 같은 지렁이 내부의 손상을 방지합니다.
- 절개가 이루어지면 첫 번째 절개 부위와 절단 끝 부분을 핀으로 고정하거나 다시 핀으로 고정합니다.
- 두 가지 수술 도구(수술용 그립)를 사용하여 피부를 움직여 지렁이 내부를 노출시킵니다.
- 피부가 이동함에 따라 아래쪽의 피부를 고정하고 지렁이를 위로 이동하면서 장기에서 피부를 조심스럽게 분리하십시오. 맨 위에 있으면 마지막 핀을 놓습니다.
- 혈관이 노출되지 않은 경우 지렁이 피부의 반대쪽을 잡아당겨 지렁이의 탄성 조직을 분리하여 복부 혈관을 노출시키고 피부를 더 분리합니다.
알림: 이 잡아당김은 지렁이 내부의 장기를 잡고 있는 조직의 일부를 제거합니다. 이 단계는 의도하지 않게 지렁이의 혈관을 파열시킬 수 있으므로 주의하십시오. 이제 복부 혈관이 노출되어야 하며, 신경삭이 배쪽 혈관 바로 옆과 평행하게 피부를 따라 흐르기 때문에 신경삭이 혈관의 표지자로 기능할 수 있습니다. 복부 혈관이 장에 가까우면 피부를 잡아당기면 혈관이 더 노출될 수 있습니다. 그렇지 않은 경우 장을 옆으로 밀면 작업 영역이 지저분해질 수 있습니다.
- 지렁이 혈관 구조, 등쪽 혈관 노출(방법 2)
참고: 등쪽 혈관을 노출시키는 단계는 배쪽 혈관 노출과 유사합니다.- 3.2단계의 3.2.1 - 3.2.3단계를 반복합니다. 이 단계에서는 피부의 어두운 부분이 위를 향해야 합니다.
- 수술용 가위를 사용하여 지렁이의 중앙을 반대쪽으로 자릅니다.
- 지렁이의 중앙에서 지렁이의 앞쪽 부분인 머리를 향해 절개합니다. 피부를 향해 위로 밀어 올리면 혈관이나 장을 절단하는 것과 같은 지렁이 내부의 손상을 방지할 수 있습니다.
- 대각선 절단이 이루어지면 첫 번째 절개 부위를 고정하거나 다시 고정한 다음 절단된 부위의 끝 부분에 고정합니다.
- 3.2단계에서 3.2.6 - 3.2.9단계를 반복합니다.
참고: 이제 등쪽 혈관이 노출되어야 합니다.
- 지렁이 혈관 구조를 노출시키고 심장의 평면도를 보여줍니다 (방법 3)
- 수술 중에 고무 패드를 사용하여 지렁이를 고정시켜 연구자에게 관심 혈관을 노출시킵니다.
- 지렁이를 외과적으로 노출시키려면 지렁이의 밝은 부분인 복부 쪽에 놓으십시오. 피부의 어두운 부분이 위를 향해야 합니다.
- 네 개의 핀을 사용하여 지렁이의 피부를 누르고 관심 있는 마음을 드러낼 수 있는 창을 만듭니다. 총 5개의 핀을 추가로 사용하여 지렁이의 머리 끝, 앞쪽 끝 근처에 있는 지렁이를 잡을 수 있습니다.
- 지렁이를 아래에서 위로 고정하기 시작하여 오른쪽에서 시작하여 왼쪽으로 이동합니다. 지렁이를 핀으로 고정하여 머리 끝, 앞쪽 끝 근처의 상단에 두 개의 핀을 놓고 클리텔럼 근처에 두 개의 핀을 놓습니다.
- 칼날을 사용하여 지렁이 측면에 약 1mm의 작은 절개를 만듭니다.
- 수술용 가위를 사용하여 지렁이의 중앙을 반대쪽으로 자릅니다.
- 지렁이의 중앙에서 지렁이의 앞쪽 끝인 지렁이의 입에 도달할 때까지 지렁이의 앞쪽을 향해 자릅니다.
알림: 혈관 구조를 절단하지 않도록 가위를 피부에 대고 들어 올리는 것이 중요합니다. 가위날은 피부를 통과할 때 볼 수 있습니다. 지렁이의 앞쪽 끝을 자르면 심장을 더 잘 볼 수 있습니다. - 핀이 고정되면 피부가 지렁이 속으로 말리면 지렁이를 다시 고정합니다.
- 심장을 적절하게 노출시키기 위해 지렁이의 조직을 적절하게 분리하기 위해 잡아당깁니다.
- 심장이 노출되어 있지 않은 경우, 심장이 때때로 이 소포 아래에 숨어 있으므로 흰색 정낭을 이리저리 움직입니다.
참고: 심장 노출은 지렁이마다 다를 수 있으며, 10개의 심장이 모두 보이거나 절반만 보일 수 있습니다. 이 시점에서 연구자는 지렁이의 심장을 찾기 위해 장기와 조직을 이동시킬지 여부를 결정해야 합니다.
- 지렁이의 혈관 구조를 노출시켜 심장의 측면도를 (방법 4)
- 수술 중에 고무 패드를 사용하여 지렁이를 고정시켜 연구자에게 관심 혈관을 노출시킵니다.
- 수술로 지렁이를 노출시키려면 지렁이를 옆으로 눕히십시오. 지렁이는 옆으로 누워 있기 때문에 지렁이의 밝은 면과 어두운 면을 모두 볼 수 있어야 합니다.
- 3.4단계에서 3.4.3 - 3.4.9단계를 반복합니다.
- 심장이 노출되어 있지 않은 경우, 심장이 때때로 이 소포 아래에 숨어 있으므로 흰색 정낭을 이리저리 움직입니다.
참고: 심장 노출은 지렁이마다 다를 수 있으며 5개의 심장이 모두 보이거나 더 적을 수 있습니다. 이 시점에서 연구자는 지렁이의 심장을 찾기 위해 장기와 조직을 이동시킬지 여부를 결정해야 합니다.
4. 지렁이 혈관 구조에 복합 투여
- 복합 투여를 위한 지렁이 준비
참고: 이러한 특정 단계를 위해 조영제인 마이크로버블을 관심 화합물로 지렁이 혈관 구조에 주입했습니다.- 미세주입 전에 지렁이를 미세주입 단계에 놓고 실험실 물티슈를 사용하여 관심 혈관 주변의 액체를 제거하여 주입을 위해 혈관 구조를 노출시킵니다.
알림: 혈관에 출혈을 일으킬 수 있으므로 강한 압력을 가하지 마십시오. - 관심 있는 혈관 구조를 마이크로피펫에 정렬하는데, 주사를 위해 복부 혈관을 정렬하는 것이 중요하므로 합니다. 심장이 관심 대상인 경우 마이크로피펫에 수직이어야 합니다.
- 관심 있는 혈관 구조에 현미경의 초점을 맞추고 마이크로 피펫을 혈관 구조로 내리기 시작합니다. 조이스틱 매니퓰레이터를 이동하기 전에 최상의 이동성을 보장하기 위해 모두 0mm로 설정되어 있는지 확인하십시오.
- 마이크로피펫의 끝이 지렁이 용기와 접촉할 때 용기와 마이크로피펫 사이의 각도가 15° 미만인지 확인하십시오.
- 마이크로피펫이 혈관에 압력을 가하기 시작하면 혈관 조직에 가해지는 압력으로 인해 혈액이 끝에서 멀어집니다. 이것은 적절한 주입 배치를 나타내는 좋은 표시입니다.
- 성공적인 주입을 위해 조이스틱을 사용하여 마이크로피펫을 앞으로 움직여 혈관 구조와 접촉합니다.
알림: 용기에 구멍을 뚫지 않는 것이 중요합니다. 팁은 마이크로피펫이 움직이는 방향으로 등쪽 및 복부 혈관의 혈관 구조를 움직여야 하며, 그런 다음 거친 다이얼을 사용하여 마이크로피펫 팁을 앞으로 움직여 혈관 안으로 완전히 침투할 수 있도록 해야 합니다. 플레이트를 움직일 수 있는 경우, 마이크로 컨트롤러를 사용하거나 동시에 사용하는 대신 용기를 마이크로 피펫으로 이동하고 관통하는 데 사용할 수 있습니다. 혈관은 즉시 관통되지 않지만 혈관의 반동은 마이크로피펫의 적절한 침투를 나타내는 지표입니다. 팁이 용기를 관통하면 용기는 직선이 되어야 하며 마이크로피펫과 정렬되어야 합니다. 그렇지 않은 경우 미세 제어를 사용하여 마이크로 피펫을 천천히 집어넣습니다. - 페달을 밟아 지렁이의 혈관 조직을 주입하십시오. 혈액의 희석은 페달을 밟았을 때 적절한 침투를 나타내는 또 다른 지표입니다.
- 마이크로피펫을 천천히 집어넣고 마이크로피펫을 당겨 빼냅니다.
참고: 또는 마이크로피펫이 혈관 안에 있는 동안 팁을 부러뜨리는 것이 출혈을 방지하는 효과적인 방법입니다.
- 미세주입 전에 지렁이를 미세주입 단계에 놓고 실험실 물티슈를 사용하여 관심 혈관 주변의 액체를 제거하여 주입을 위해 혈관 구조를 노출시킵니다.
결과
다음 대표적인 결과는 유리 피펫을 당기는 데 사용되는 설정, 주어진 베벨링 각도에서 형성된 피펫 개구부 크기, 미세 주입의 압력 및 시간을 포함하는 일련의 특정 매개변수를 기반으로 합니다. 그림 1에는 흐름의 개략도가 표시되어 처음부터 끝까지 프로세스를 나타냅니다.
선택한 피펫 풀러 매개변수에 따라 당김에서 다음 팁이 나타납니다(그림 2). RAMP 값은 유리의 종류와 필라멘트의 배치에 따라 변경될 수 있습니다. 매개변수가 허용 가능한 경우 결과 팁은 베벨링을 위한 긴 테이퍼와 함께 강해집니다. 당기다가 팁이 부러진 경우 풀러를 다시 조정해야 합니다.
마이크로피펫을 베벨링하기 위해 최적의 각도를 결정하고, 베벨링의 일반적인 용이성을 평가하고, 각도가 팁 개구부 크기에 어떤 영향을 미치는지 조사하기 위해 6개의 베벨링 각도를 테스트했습니다. 베벨링 기준에 대한 최적 각도는 날카로운 팁을 제공하고 파손 없이 용기를 관통할 수 있을 만큼 충분히 강하며 재현성이 높기 때문에 35°로 결정되었습니다. 일반적으로 각도가 작을수록 그림 3과 같이 팁이 더 날카로워집니다. 또 다른 관심 각도는 더 선명한 30°였지만 재현성 때문에 35°가 선택되었습니다. 그림 4에서 볼 수 있듯이 마이크로 매니퓰레이터의 각도는 팁의 모양과 개구부 크기를 모두 변경합니다. 이 그림에서 가장 정확하고 일관된 베벨링이 30°와 40° 사이의 각도에서 발생한다는 것을 알 수 있습니다. 보충 표(표 S1)는 베벨링의 용이성을 기반으로 작성되었지만, 사람마다 베벨링 기술이 다르므로 팁이 다양하다는 점에 유의하는 것이 중요합니다. 또한 마이크로 매니퓰레이터를 너무 빨리 내리거나 유리가 너무 부서지기 쉬워 팁이 파손될 때 실패한 베벨이 발생할 수 있습니다.
주어진 팁 크기에 대해 화합물 주입 전에 보정을 수행해야 합니다. 주입량은 팁 크기와 미세 주입 압력 및 주입 시간에 따라 달라집니다. 예를 들어, 그림 5에서는 24.4μm 팁에 대한 대표 부피 디스펜스가 그래프로 표시되어 있습니다. 데이터는 고정된 사출 시간에 대한 디스펜싱된 부피와 압력 사이의 대략적인 선형 관계를 보여줍니다. 특정 팁 설계에 대해 유사한 맞춤형 교정 데이터를 결정해야 합니다.
미세혈관 주사 중에는 주어진 제품의 성공적인 주사를 확인하기 위해 육안 검사가 필요합니다. 가장 눈에 띄는 지표는 혈액의 희석입니다. 보충 동영상 과 그림 6에서 볼 수 있듯이 혈액이 희석됨에 따라 혈액이 더 투명해지며, 이는 성공적인 주입의 신호입니다. 마이크로피펫이 혈관에 너무 깊이 침투하지 않고 혈관에서 15° 이상의 각도로 미세주입이 이루어지지 않는 것이 중요하며, 그렇지 않으면 피펫을 빼낼 때 큰 상처로 인해 관심 화합물이 혈관 구조에서 출혈됩니다. 성공적인 주입 및 당김은 제거 시 출혈을 최소화합니다.
그림 1: 전체 방법의 흐름. 지렁이 혈관 구조를 미세 주입하려면 먼저 피펫을 당겨 팁에 미세 구멍을 만들어야 합니다. 그런 다음 마이크로피펫 팁을 비스듬히 하여 날카로운 바늘 끝을 만듭니다. 일단 개구부에 도달하면, 마이크로피펫은 분배된 적절한 부피에 대해 보정됩니다. 일단 보정이 완료되면 혈관 구조에 대한 주입이 이루어질 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 성공적인 당겨진 마이크로피펫. 프로토콜에 사용된 매개변수에 따라 이 팁은 풀링 후에 나타납니다. (A) 당긴 직후 피펫을 시연합니다. (B) 동일한 피펫을 당겨낸 클로즈업 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 마이크로피펫 팁 베벨링 각도 프로파일. 베벨링을 위해 6개의 각도를 테스트했습니다. 각도를 45°에서 20°로 줄이면 날카로움과 팁 개방이 증가합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
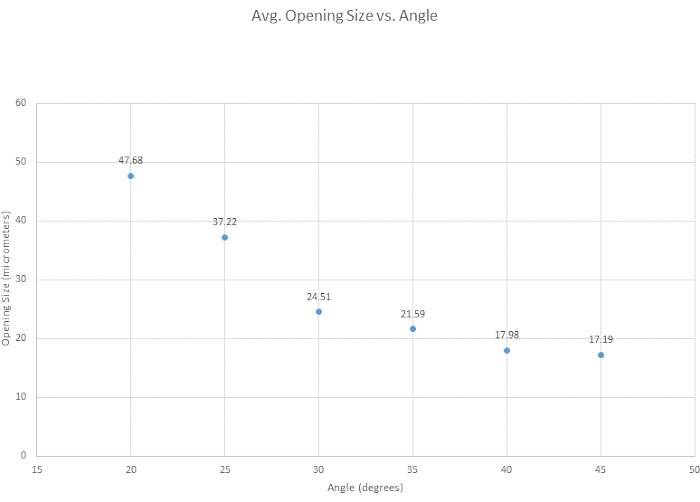
그림 4: 팁 개구부는 각도가 증가함에 따라 좁아집니다. 각도가 팁 개구부 크기에 어떤 영향을 미치는지 확인하기 위해 6개의 각도를 테스트했습니다. 팁 개구부 크기는 베벨링 각도가 증가함에 따라 감소합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 볼륨 관리를 위한 보정. 24.4μm의 팁 크기 개구부는 시간 및 압력에 대한 특정 매개변수를 사용하여 데이터를 나타내는 대표 결과에 사용되었습니다. 압력이 증가하면 분배되는 부피가 증가하고 시간이 줄어들면 분배되는 부피가 감소합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 복부 혈관으로의 주입. 성공적인 주사를 위한 시각 자료는 혈액 희석을 지표로 하여 시연됩니다. 이 패널과 함께 추가 비디오가 제공됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 S1: 지렁이의 혈액 및 소변 추출을 위한 설정. 이 파일을 다운로드하려면 여기를 클릭하십시오.
그림 S2: 그림 4의 표준 편차. 각도에 따라 표준 편차가 변경됩니다. 35°는 표준 편차가 더 낮기 때문에 베벨링이 더 일관되고 팁이 덜 부러집니다. 30°는 표 S1과 같이 35°에서도 양호했습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
그림 S3: 수술 후 액체 반창고를 사용하여 지렁이를 봉합한 후 지렁이의 생존 상태를 보여줍니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
표 S1: 베벨링의 용이성에 대한 설명 표. 베벨링의 용이성을 설명하기 위해 쉬운 것부터 보통, 어려운 것까지 세 가지 모드가 사용되었습니다. 15°를 테스트했지만 각도가 너무 작아서 부서지지 않는 마이크로피펫 팁을 생성할 수 없었습니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
추가 비디오. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
지렁이가 10% 에탄올에 함유되어 있는 동안, 특히 지렁이가 나이가 많은 경우 30분 이상의 노출 시간에 대해 원치 않는 영향이 있을 수 있습니다. 장이 악화되기 시작하고, 지렁이를 수술로 열면 내장이 펼쳐집니다. 따라서 어리거나 중년의 지렁이를 사용하는 것이 좋습니다. 지렁이의 피부를 자르는 과정에서 완전한 가위 절단이 이루어지지 않는 것이 필수적이며, 이는 조사자가 절반만 자르고 최종 지점에 도달할 때까지 가위를 계속 앞으로 밀어야 함을 의미합니다. 지렁이를 고정할 때 지렁이를 늘리거나 너무 세게 당기지 않도록 주의하세요. 이로 인해 혈관이 파열되어 출혈이 발생할 수 있습니다. 각 주사 후, 특히 다른 주사를 수행하기 전에 마이크로피펫 내부에 있을 수 있는 액체를 분배하여 마이크로피펫이 막혔는지 확인하십시오. 팁이 막혔는지 관찰하는 것 외에도 각 주입 후 마이크로피펫의 팁을 확인하여 팁이 파손되었는지 확인하십시오. 마이크로피펫의 끝이 부러져 출혈을 방지하기 위해 팁이 제자리에 남을 수도 있습니다. 미세 주입 중에는 혈관 조직을 주의 깊게 관찰하는 것이 중요합니다. 마이크로피펫이 혈관과 처음 접촉하면 혈관 조직이 마이크로피펫 팁에 달라붙습니다. 팁이 혈관을 성공적으로 관통하면 혈관 조직이 팁 안으로 빠르게 미끄러지는 것을 볼 수 있으며 미세 조작기에서도 느낄 수 있습니다. 성공적인 주입 후에는 마이크로피펫이 조직 깊숙이 들어가거나 주사 부위에 더 큰 상처를 만들 수 있으며, 이로 인해 화합물 투여제가 혈관 밖으로 누출될 수 있으므로 마이크로피펫을 조심스럽게 빼내는 것이 중요합니다. 일반적으로 성공적인 주입은 혈관 직경이 90μm 이상일 때 발생하지만, 연구자가 마이크로피펫 팁 크기를 좁히면 이를 개선할 수 있습니다. 지렁이는 지렁이가 탈수되는 것을 방지하기 위해 지속적으로 물로 촉촉하게 유지되지만 식염수를 사용하는 것이 좋습니다.
지렁이 생존 연구
실험 후 지렁이가 얼마나 오래 생존할 수 있는지에 대한 통찰력을 제공하기 위해 지렁이 생존 실험이 수행되었습니다. 지렁이를 10% 에탄올 용액에 담근 다음 실험 중과 마찬가지로 외과적으로 절단하고 주입한 후 액체 반창고 용액을 통해 27마리의 지렁이를 "다시 꿰매고" 실험 후 최대 48시간까지 관찰했습니다. 수술 후 12시간이 지났을 때, 약 67%의 지렁이가 여전히 살아 있었습니다. 수술 후 24시간이 지났을 때, 기생충의 약 48%가 여전히 살아 있었습니다. 수술 후 36시간이 지났을 때, 기생충의 약 44%가 여전히 살아 있었습니다. 마지막으로, 수술 후 48시간이 지났을 때 약 22%의 기생충이 여전히 살아 있었습니다. 이 실험의 결과는 대부분의 기생충이 실험적 수술과 주사를 받은 후 하루 12시간 동안 생존할 수 있으며 많은 수의 기생충은 그보다 훨씬 더 오래 생존할 수 있음을 보여줍니다(그림 S3). 이는 원하는 경우 24시간 동안 연구를 위해 각 기생충을 모니터링할 수 있는 기회를 제공합니다.
지렁이 실험실 관리
캐나다 나이트크롤러인 지렁이는 Windsor Wholesale Bait에서 상점에서 구입하여 스티로폼 상자(35w x 38l x 30d cm)에 500마리의 대형 지렁이로 배송되어 개별 지렁이를 제거하여 실험에 사용했기 때문에 냉장고에 보관했습니다. 지렁이 준비 프로토콜 단계에서 언급했듯이 지렁이의 증발로 인해 한 번에 10마리 이상의 지렁이가 사용되지 않았으며, 이는 탈수로 이어질 수 있습니다16. 또한 지렁이가 빛에 노출되는 것은 피부에 빛에 민감한 세포를 포함하고 있기 때문에 제한적이었습니다. 2시간 이상 빛에 노출되면 사망에 이를 수 있습니다. 도착하자마자 선적 컨테이너의 토양을 바꾸었고, 지렁이는 실험에 사용되기 전에 24시간 동안 휴식을 취할 수 있었습니다. 이를 통해 지렁이가 다시 활력을 얻고 운송으로 인해 더 이상 지치지 않도록 했습니다. 이 시점에서 지렁이에 대한 실험을 시작할 수 있습니다.
지렁이는 수명은 알 수 없지만 매일 모니터링되고 적절한 영양분이 제공되면 실험실 환경에서 장기간 생존할 수 있습니다. 2주에 한 번씩 지렁이에게 더 많은 영양분을 제공하기 위해 용기에 새로운 흙을 추가해야 합니다. 지렁이는 깊은 굴을 파는 무척추 동물이며 일화적이며 180cm(6피트) 깊이의 굴을 만들 것이므로 500마리의 지렁이를 위한 용기에 최소 1피트의 흙이 있어야 합니다. 용기 바닥에는 오래된 신문지를 추가할 수 있는데, 이곳은 일부 지렁이가 집을 만들 곳이기 때문입니다. 토양이 바뀌면 냄새를 확인하고 다치거나 죽은 지렁이를 발견하는 것이 좋습니다. 죽거나 다친 지렁이는 토양을 오염시키고 지렁이 군집 내에서 더 많은 죽음을 초래할 수 있으므로 용기에 두지 마십시오.
미래의 응용 프로그램
이 프로토콜에서는 지렁이를 사용하여 고처리량 혈액 실험을 수행하기 위한 준비 및 절차를 제시합니다. 순환계에 국한되어 있지만, 여기에 설명된 주입 방법은 지렁이의 신경삭이 복부 혈관과 평행하기 때문에 신경계와 관련된 연구로 잠재적으로 확장될 수 있습니다. 예를 들어, 지렁이를 사용한 이전 연구는 초음파 치료 응용 프로그램의 신경 조절 및 혈관 파열 연구를 위해 연구되었습니다18,19. 이 새로운 체제로, 더 심층적 인 초음파 + 마이크로 버블 연구는 신경 조절과 혈관 파열 연구를 확장하기 위해 수행될 수 있습니다.
또한, 지렁이의 coelomic cavity는 면역 체계를 연구하는 데 활용될 수 있는데, 이는 coelomic cavity에 있는 유체가 전부는 아니더라도 대부분의 면역 반응을 매개하기 때문입니다. 지렁이는 동물에 두 개의 유체 만 존재하며, 각각은 별도의 구멍 내에 있으며, 혈액은 혈관 속에, coelomic cavity에는 coelomic fluid가 포함되어 있습니다. 이러한 유체 분리를 통해 두 개의 캐비티에서 특정 유형의 연구를 수행할 수 있습니다. 예를 들어, coelomic fluid는 수많은 coelomocyte로 가득 차 있으며, 이들의 면역 기능은 대부분의 다른 동물 모델의 coelomocyte와 특성을 공유합니다. 세포 표적을 파괴할 수 있는 식세포 및 기타 유사한 세포에 대한 조사는 지렁이에서 수행될 수 있으며, 지렁이는 대체 무척추 동물 모델로 사용될 수 있는 많은 추가 연구 응용 프로그램을 가지고 있을 가능성이 높습니다.
지렁이는 인체의 해부학적 및 생리학적 시스템의 여러 측면을 모델링할 수 있는 복잡성이 부족하지만, 미세 주입은 헤모글로빈 구조 측면에서 인간의 혈액과 현저하게 유사한 혈액을 포함하는 밀폐된 순환계를 제공합니다. 소량의 혈액량이 허용되는 응용 분야에서 지렁이는 기관 동물 관리 및 사용 위원회(Institutional Animal Care and Use Committees)에서 면제되는 저렴하고 쉽게 구할 수 있는 테스트 플랫폼을 제공합니다. 그 결과, 다양한 화합물을 함유한 지렁이에 대한 실험이 반복적으로 수행될 수 있으며, 표준 실험실 척추 동물을 사용하여 사용할 수 있는 수준을 훨씬 능가하는 표본 크기로 수행할 수 있습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 연구는 NSF-FDA Scholar-in-Residence Fellowship(NSF-FDA SIR, #1641221), US Food and Drug Administration Office Chief Scientist Challenge Grant(FDA OCS), National Science Foundation Integrative Graduate Education and Research Traineeship(NSF IGERT, #1144646)의 지원을 받았으며 미국 식품의약국(FDA)의 OSEL(Office of Science and Engineering Laboratories)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 3M Vetbond Tissue Adhesive | 3M Vetbond | 084-1469SB | 3mL bottle vet adhesive - liquid band-aide |
| 40x Stereo Microscope | Sutter Instrument Co. | BV-10-D | Not needed, can add on other scopes |
| 500 Large Worms | Windsor Wholesale Bait | 500 Large | |
| Beveler pedestal oil | Sutter Instrument Co. | 008 | |
| Blades | Ted Pella, Inc | 121-2 | |
| Borosilicate Glass with Filament | Sutter Instrument Co. | BF150-86-10 | |
| Camera | AmScope | MU500 | |
| Camera | AmScope | MU1803-CK | 8MP USB3.0 Microscope Digital Camera |
| Electrode Impedance Meter | Sutter Instrument Co. | BV-10-C | |
| Ethanol | Sigma Aldrich | E7023-1L | Pure ethanol |
| Filament | Sutter Instrument Co. | FT315B | trough filament |
| Grinding Plate | Sutter Instrument Co. | 104D | Fine Plate |
| Hospital Grade Saline | Baxter Healthcare Corporation | 2F7124 | 0.9% Sodium Chloride Irrigation |
| Joystick Micromanipulator | Narishige | MN-151 | |
| KimWipes Kimtech Science | Kimberly-Clark Professional | 34155 | |
| Leafgro | LeafGro | 589252 | 1.5-cu. ft. |
| Metal Hub Needle | Hamilton | 91024 | Luer Lock Metal Needle |
| Micro Vessel Clips | WPI | 501779-G | |
| Microinjector | TriTech Research | MINJ-D | |
| Micropiette Puller Model P-97 | Sutter Instrument Co. | P-97 | |
| Micropipette Beveler | Sutter Instrument Co. | BV-10-B | |
| Microscope | AmScope | SM-8TPW2-144S | 3.5X-225X Simul-Focal Articulating Microcope |
| Needle Holder | TriTech Research | MINJ-4 | |
| NeverWet | Rust-Oleum | NeverWet | |
| Pyrex Glass | Corning | 08747A | Fisher Manufacturer |
| Stainless Micro-Ruler | Ted Pella, Inc | 13635 | Micro-Ruler mounted on a Handle, 10mm scale, with lines at 0.01mm intervals |
| Surgical Grips | Ted Pella, Inc | 53073 | Forceps, Hemostat |
| Surgical scissors | Ted Pella, Inc | 1320 | Fine Iris Scissors, Straight |
| U.S.P. Mineral Oil Lubricant Laxative | Swan | Mineral Oil |
참고문헌
- Stevenson, J. The Oligochaeta. , Claredon Press. Oxford. 685(1930).
- Reynolds, J. W., Reynolds, W. M. Earthworms in medicine. American Journal of Nursing. 72 (7), 1273(1972).
- Gates, G. E. The earthworms of Rangoon. Journal of the Burma Research Society. 25, 196-221 (1926).
- Carr, L. G. K. Interesting animal foods, medicines, and omens of the eastern Indians, with comparisons to ancient European practices. Journal of the Washington Academy of Sciences. 41 (7), 229-235 (1951).
- Price, S. F. Kentucky folk-lore. The Journal of American Folklore. 14 (52), 30-38 (1901).
- Elmer, J., Palmer, A. F., Cabrales, P. Oxygen delivery during extreme anemia with ultra-pure earthworm hemoglobin. Life Sciences. 91 (17-18), 852-859 (2012).
- Eyambe, G. S., Goven, A. J., Fitzpatrick, L. C., Venables, B. J., Cooper, E. L. A non-invasive technique for sequential collection of earthworm (Lumbricus terrestris) leukocytes during subchronic immunotoxicity studies. Laboratory Animals. 25 (1), 61-67 (1991).
- Basley, K., Goulson, D. Effects of chronic exposure to clothianidin on the earthworm Lumbricus terrestris. PeerJ. 5, 3177(2017).
- Mvumi, B. M., Gwenzi, W., Mhandu, M. G. Ecotoxicological effects of citrus processing waste on earthworms. Lumbricus terrestris L. Industrial Crops and Products. 110, 123-129 (2017).
- Furst, A. My saga with earthworms. Food and Chemical Toxicology. 40 (6), 789-791 (2002).
- Cooper, E. L., Hrzenjak, T. M., Grdisa, M. Alternative sources of fibrinolytic, anticoagulative, antimicrobial and anticancer molecules. International Journal of Immunopathology and Pharmacology. 17 (3), 237-244 (2004).
- Cooper, E. L., Hirabayashi, K., Balamurugan, M. Dilong: food for thought and medicine. Journal of Traditional and Complementary Medicine. 2 (4), 242-248 (2012).
- Nagasawa, H., et al. Inhibition by lombricine from earthworm (Lumbricus terrestris) of the growth of spontaneous mammary tumours in SHN mice. Anticancer Research. 11 (3), 1061-1064 (1991).
- Shannon, K. M., Gage, G. J., Jankovic, A., Wilson, W. J., Marzullo, T. C. Portable conduction velocity experiments using earthworms for the college and high school neuroscience teaching laboratory. Advances in Physiology Education. 38 (1), 62-70 (2014).
- National Research Council. A framework for K-12 science education: Practices, crosscutting concepts, and core ideas. , National Academies Press. (2012).
- Ramsay, J. The Osmotic Relations of the Earthworm. Journal of Experimental Biology. 26 (1), 46-56 (1949).
- Mulloney, B. Structure of the Giant Fibers of Earthworms. Science. 168 (3934), 994-996 (1970).
- Kim, Y., Nabili, M., Acharya, P., Lopez, A., Myers, M. R. Microvessel rupture induced by high-intensity therapeutic ultrasound - a study of parameter sensitivity in a simple in vivo model. Journal of Therapeutic Ultrasound. 5 (1), 5(2017).
- Wahab, R. A., et al. Mechanical bioeffects of pulsed high intensity focused ultrasound on a simple neural model. Medical Physics. 39 (1), 4274-4283 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유