Method Article
Почечная заготовка в доклинической модели крупного животного
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной статье мы представляем протокол, в котором подробно описывается хирургическая модель получения почки в доклинической модели свиньи для последующей машинной перфузии или трансплантации.
Аннотация
Машинная перфузия превратилась в жизнеспособную стратегию для оценки, мониторинга, лечения и оптимизации органов ex vivo , а также для продления срока хранения. Модели крупных животных имели первостепенное значение для развития и оптимизации этих технологий. Тем не менее, для обеспечения качества трансплантата и воспроизводимости данных следует придерживаться стандартизированных и клинически переводимых хирургических методов заготовки органов и тканей. Таким образом, здесь мы описываем оптимизированный протокол закупки почек в доклинической модели свиней. Восстановление почек проводится с использованием свиней смешанной породы (йоркширский кросс/микс). Вкратце, после стерильной дезинфекции и драпировки операционного поля, выполняется полный разрез по средней линии для обеспечения оптимального доступа к обеим почкам. Мочеточник, почечная вена и артерия рассекаются до тех пор, пока они не выйдут из нижней полой вены и аорты соответственно. После полной почечной диссекции мочеточник перевязывают и разрезают дистально. Затем донорское животное полностью гепаринизируется с концентрацией 100 МЕ на кг/массу тела. Далее почечная артерия пережимается вплотную к аорте, а почечная вена пережимается вплотную к полой вене с помощью сосудистого зажима Сатинского. Затем почечный трансплантат резецируется, а почечная артерия немедленно канюлируется на заднем столе. Затем почка будет промыта ледяным консервационным раствором и храниться на льду до аппаратной перфузии или трансплантации. Наконец, культя почечной артерии перевязывается шелковой лигатурой 2-0, а полая вена закрывается полипропиленовым швом 6-0. Этот метод восстанавливает почки и моделирует либо живого (одна почка), либо мертвого (две почки) донора. Восстановление одной почки дает преимущество для проведения последующей аутотрансплантации. В модели умершего донора кровь может быть собрана до эвтаназии путем введения игл для мешка с кровью непосредственно в аорту, тем самым обескровливая животное и обеспечивая кровь для перфузии ex vivo с помощью аппарата.
Введение
Трансплантация почки является оптимальным методом лечения терминальной стадии почечной недостаточности (ТХПН), обеспечивая улучшение качества жизни и долгосрочные результаты по сравнению с диализом1. Несмотря на достижения в области сохранения органов, десятки людей умирают каждый день от ТХПН, находясь в списке ожидания на пересадку почки. Аппаратная перфузия — это растущая область, которая увеличивает время хранения, позволяя расширить донорские сети и более эффективно распределять органы. Эта технология также позволяет осуществлять мониторинг и оптимизацию органов ex vivo, тем самым сводя к минимуму последствия ишемии-реперфузионного повреждения (ИРИ). По сравнению со статическим холодным хранением (SCS), было показано, что машинная перфузия значительно снижает частоту задержки функции трансплантата 3,4. Аппаратная перфузия также продемонстрировала оживление маргинальных графтов, которые в противном случае не соответствовали бы критериям для трансплантации5. Несмотря на технический прогресс, наиболее распространенным методом консервации остается СКС на льду. Дальнейшие доклинические эксперименты и данные могут помочь сделать машинную перфузию основой сохранения почек.
Модель трансплантации почки на свиньях хорошо известна и является неотъемлемой частью развития технологии сохранения почек, особенно машинной перфузии. В отличие от однолобулярных почек грызунов, почки свиньи и человека являются многодольчатыми, схожими по размеру и имеют аналогичную артериальную, венозную и мочевую анатомию 6,7. Таким образом, свиная почка способствует прямому переносу в клинические условия, особенно с точки зрения медицинских устройств и лекарственной терапии. Кроме того, почки свиньи демонстрируют такую же патофизиологиюIRI, как и почки человека8, что делает их идеальными для исследований по сохранению почек.
Для обеспечения качества трансплантата и воспроизводимости данных необходимо применять стандартизированные и клинически переводимые хирургические методы заготовки органов и тканей. Таким образом, здесь мы описываем оптимизированный протокол закупки почек в доклинической модели свиней. Этот протокол позволяет восстановить почки и имитирует состояние живого (одна почка) или мертвого (две почки) донора. Восстановление одной почки дает преимущество в проведении последующей аутотрансплантации. В модели восстановления двойной почки забор крови перед эвтаназией возможен путем введения игл из мешка с кровью непосредственно в аорту, тем самым обескровливая животное и обеспечивая кровь для перфузии ex vivo аппаратом.
протокол
Все описанные процедуры были одобрены Комитетом по институциональному уходу и использованию Университета Джона Хопкинса, лицензированным Министерством сельского хозяйства США (USDA), застрахованным Управлением по благополучию лабораторных животных (OLAW) и аккредитованным Ассоциацией по оценке и аккредитации ухода за лабораторными животными (AAALAC). Содержание животных осуществлялось в соответствии с Законом о защите животных Министерства сельского хозяйства США, Руководством Национальных институтов здравоохранения по уходу за лабораторными животными и их использованием, а также Политикой Службы общественного здравоохранения США по гуманному уходу за лабораторными животными и их использованию.
1. Животные и жилье
- Для этого протокола используйте 3-6-месячных клинически здоровых йоркширских свиней весом 20-40 кг (Sus scrofa domesticus) или сопоставимых.
- Размещайте животных в сетчатых ограждениях с решетчатым настилом.
2. Предоперационная процедура и анестезия
- Голодайте на животном не менее чем за 12 часов до времени седации.
- Применяйте перорально симетикон (20 мг/кг) не менее чем за 12 ч до операции и повторите прием не менее чем за 1 ч до седации для уменьшения дилатации кишечника.
- Вводите кетамин (20-30 мг/кг) и ксилазин (2-3 мг/кг) в один шприц внутримышечно, чтобы избежать многократных инъекций.
- Переведите свинью в зону предоперационной стадии. Установите внутривенный катетер в краевую ушную вену. Вводите 3-10 мг/кг/ч 0,9% физиологического раствора или раствора лактата Рингера на протяжении всей процедуры.
- После того, как свинья будет должным образом успокоена, необходимо установить эндотрахеальную трубку (эндотрахеальная трубка с манжетой 6,0-6,5 мм для животного весом 20-30 кг; 6,5-7,0 мм с манжетой для 30-40 кг) для введения газовой анестезии и искусственной вентиляции легких. При необходимости облегчить введение дозы пропофола (0,8-1,66 мг/кг) внутривенно, ввести для достижения эффекта.
- Удалите шерсть на месте операции и вокруг него с помощью машинки для стрижки, а также грязного скраба с места операции, прежде чем переместить животное в операционную.
- Перенесите животное на операционный стол. Введите цефазолин (20-22 мг/кг) внутривенно за 10 минут до начала операции и повторно каждые 90 минут интраоперационно. Введите пантопразол (0,5-1 мг/кг) внутривенно в начале операции.
- Введите местную блокаду подкожно с лидокаином (до 2 мг/кг) для облегчения дополнительной анальгезии перед разрезом.
- Асептически подготовьте место операции, чередуя хлоргексидин или бетадин с 70% этанолом или физиологическим раствором, по крайней мере, три раза.
- Непрерывно контролируйте объем жидкости, частоту сердечных сокращений, артериальное давление, пульсоксиметрию, капнографию, электрокардиографию и температуру прямой кишки. Записывайте эти значения каждые 10-15 минут. Используйте подогреваемую подушку для нижней части тела и одеяло с теплым воздухом, чтобы предотвратить переохлаждение.
- Перед началом операции убедитесь, что животное находится в подходящей плоскости хирургической анестезии, используя комбинацию тонуса челюсти, пальпебрального рефлекса и параметров, перечисленных на предыдущем этапе.
3. Процедура забора почки
- Подготовьте животное к операции, следуя шагам, описанным в разделе 2.
- После стерильной дезинфекции и драпировки операционного поля выполните срединную лапаротомию (25-30 см) для обеспечения оптимального доступа к обеим почкам. Вставьте стандартный абдоминальный ретрактор.
- Накройте толстую кишку и тонкую кишку полотенцами, смоченными в теплом физрастворе. Втяните кишечник либо в правую сторону, чтобы получить доступ к левой почке, либо в левую, чтобы получить доступ к правой почке.
- Откройте брюшину, расположенную над почкой, и рассеките вокруг почки, чтобы освободить любые спайки. Рассекайте мочеточник до тех пор, пока не получится 10-12 см длины.
- Рассекайте почечную вену и артерию до их истока из нижней полой вены и аорты соответственно.
- После полной почечной диссекции завяжите мочеточник дистально шелковой лигатурой 2-0 и разрежьте проксимально к завязке. Оставьте проксимальный конец мочеточника открытым, чтобы обеспечить отток мочи.
- Гепаринизируйте животное внутривенно гепарином (100 МЕ/кг) и подождите 2 мин для обеспечения адекватной гепаринизации почки. Этот шаг следует повторить перед резекцией каждой почки.
- Пережмите почечную артерию и почечную вену вплотную к аорте и нижней полой вене соответственно двумя сосудистыми зажимами Сатинского. Удалите почечный трансплантат, перерезав почечную артерию и вену рядом с зажимами.
- Немедленно канюлируйте почечную артерию с помощью перфузионной канюли с тупым кончиком толщиной 3 мм. Промойте почку ледяным раствором Висконсинского университета (UW) или раствором для консервации Custodiol Histidine-tryptophan-ketoglutarate (HTK).
- Извлеките перфузионную канюлю после промывания с помощью UW или HTK и поместите почку в стерильный мешок для органов, наполненный тем же раствором для консервации ледяного льда, который использовался для промывания почки. Поместите этот мешок во второй стерильный мешок для органов. Впоследствии храните орган или инициируйте аппаратную перфузию.
- Перевязать культю почечной артерии шелковой лигатурой 2-0. Закройте культю почечной вены двухслойным беговым швом с полипропиленом 6-0.
4. Процедура забора крови
- Если процедура является терминальной и все остальные хирургические вмешательства уже выполнены, приступайте к забору крови для аппаратной перфузии и эвтаназии путем обескровливания.
- Втяните кишечник в правую сторону и определите инфраренальную брюшную аорту. Освободите любые крупные спайки или ткань, покрывающую сосуд.
- Введите иглу для мешка для сбора крови непосредственно в аорту. Повесьте мешок под животное, чтобы облегчить наполнение. Как только мешок заполнится (примерно 450 мл крови), извлеките иглу из аорты и удерживайте давление на месте прокола.
- Для второго пакета с кровью введите новую иглу на 1-2 см проксимальнее предыдущего места прокола. При необходимости повторите то же самое с несколькими пакетами с кровью, перемещаясь на 1-2 см проксимально с каждой иглой.
- После сбора всей необходимой крови вызвать остановку сердца путем внутривенного введения пентобарбитала натрия/фенитоина натрия в дозе не менее 78 мг/кг компонента пентобарбитала. Если есть опасения, что пентобарбитал помешает последующим анализам почки, используйте хлорид калия (KCl) (75-100 мг/кг внутривенно) в качестве альтернативного метода химической эвтаназии, если он вводится свиньям под анестезией. Подтвердите смерть из-за отсутствия сердцебиения, отсутствия роговичного рефлекса и значительного снижения температуры тела.
ПРИМЕЧАНИЕ: Оставшиеся органы и ткани умерщвленной свиньи могут быть использованы для других исследовательских или образовательных целей в соответствии с принципами 3R.
Результаты
Наша исследовательская группа имеет обширный опыт, охватывающий почти 15 лет, с моделями свиней как трансплантации солидных органов, так и васкуляризированной композитной аллотрансплантации 9,10,11,12,13,14,15,16,17 . Здесь мы описываем результаты наших экспериментов по восстановлению почек свиньи (n = 139). Мы использовали приобретенные почки для трансплантации, аппаратной перфузии или первичной клеточной культуры и до сих пор не испытали никаких осложнений при использовании этой модели хирургической процедуры (Рисунок 1). Мы определяем успешное извлечение почки как хирургическое вмешательство без технических сбоев, а также без неблагоприятных исходов, связанных с анатомией или хирургической техникой. Примеры грубого внешнего вида почечного трансплантата показаны на рисунке 2, представляя успешную реперфузию почки с помощью аппаратной перфузии или трансплантации.
В зависимости от уровня подготовки и знакомства лаборатории с моделями свиней, мы рекомендуем провести как минимум один-три предварительных эксперимента со всем персоналом, участвующим в процедурах. В текущей серии исследований среднее общее время процедуры - от разреза по средней линии до эвтаназии - составило 88 минут (Таблица 1). Среднее время от разреза по средней линии до извлечения обоих почечных трансплантатов составило 73 мин. В дополнение к поддержке со стороны ветеринарного персонала, включая ветеринара и одного или двух ветеринарных техников, требуется как минимум три дополнительных хирурга и лабораторного персонала. В зависимости от уровня опыта, может быть рекомендован еще один ассистент хирурга и один или два дополнительных вспомогательных сотрудника, включая докторантов или лаборантов, для обеспечения эффективности забора трансплантата, промывания органов и забора крови с целью минимизации времени теплой ишемии и риска свертывания крови во время забора крови.
Как и у человека, в почках свиньи возможны анатомические вариации (рис. 3, табл. 2). Стандартная анатомия - одна почечная артерия и одна почечная вена - наблюдалась в 64% почек. Наиболее распространенными вариациями были одна артерия и две вены (26%), две артерии и одна вена (5%), одна артерия и три вены (4%), а также две артерии и две вены (1%). Примерно половина (46%) свиней имели типичную двустороннюю анатомию. Атипичная анатомия наблюдалась как односторонне (22% левых атипичных, 14% правых атипичных), так и двусторонне (19%). При выборе почки для трансплантации мы рекомендуем избегать любой атипичной анатомии. Если обе почки имеют две вены, выберите почку с более длинными венами и восстановите на задней столе до одного просвета перед трансплантацией. При выборе почки для аппаратной перфузии венозная анатомия менее важна, если в аппарате используется объединенный венозный дренаж. Мы рекомендуем избегать анатомии двух артерий при перфузии с одним насосом, так как разница в сопротивлении между артериями приведет к неравномерному кровообращению.

Рисунок 1: Краткая информация об успешном извлечении почек для трансплантации, машинной перфузии и экспериментов с первичными клеточными культурами. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Примеры грубого внешнего вида почечного трансплантата. (A) Нативная правая почка in situ. (Б) Почковый трансплантат после промывания ледяным консервирующим раствором. (В) Почечный трансплантат после аппаратной реперфузии. (D) Почечный трансплантат после трансплантации и реперфузии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
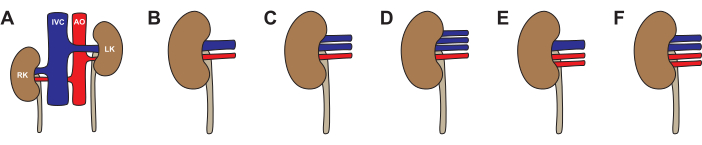
Рисунок 3: Вариации анатомии почек свиньи. (А,Б) Типичная анатомия с одной почечной артерией и одной почечной веной на каждую почку. (В) Атипичная анатомия с одной почечной артерией и двумя почечными венами. (D) Атипичная анатомия с одной почечной артерией и тремя почечными венами. (E) Атипичная анатомия с двумя почечными артериями и одной почечной веной. (F) Атипичная анатомия с двумя почечными артериями и двумя почечными венами. Используемые сокращения: РК - правая почка; IVC - нижняя полая вена; АО- аорта; LK- левая почка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Экспериментальная задача или шаг | Среднее время (мин) | Хирург | Хирургическая помощь | Ветеринар | Ветеринарный техник | Исследователь | Общая численность персонала |
| Предоперационная подготовка | 60 | 1 | 2 | 1 | 4 | ||
| Операция по извлечению трансплантата (одна почка) | 41 | 1 | 1 | 1 | 1 | 1 | 5 |
| Операция по извлечению трансплантата (обе почки) | 73 | 1 | 1 | 1 | 1 | 1 | 5 |
| Промывание органов (на почку) | 6 | 1 | 1 | 1 | 1 | 4 | |
| Сбор крови | 15 | 1 | 1 | 1 | 1 | 1 | 5 |
| Эвтаназия | Н/Д | 1 | 1 | 2 |
Таблица 1: Потребности в человеческих ресурсах и времени для проведения операции по закупке почек свиньи.
| Двусторонняя анатомия почек | Поголовье свиней | Процент свиней |
| Оба типичных | 17 | 46% |
| Правый типичный, левый нетипичный | 8 | 22% |
| Левый типичный, правый нетипичный | 5 | 14% |
| Оба нетипичных | 7 | 19% |
| 37 | 100% | |
| Односторонняя анатомия почки | Количество почек | Процент почек |
| 1 артерия, 1 вена | 47 | 64% |
| 1 артерия, 2 вены | 19 | 26% |
| 1 артерия, 3 вены | 3 | 4% |
| 2 артерии, 1 вена | 4 | 5% |
| 2 артерии, 2 вены | 1 | 1% |
| 74 | 100% |
Таблица 2: Сводка анатомических вариаций, обнаруженных в почках свиньи.
Обсуждение
Модель свиньи для трансплантации почки сыграла жизненно важную роль в развитии и оптимизации технологии машинной перфузии. Учитывая анатомическое, иммунологическое и патофизиологическое сходство с человеческими почками 6,7,8, свиные почки предлагают облегченный перенос в клинические испытания и практику.
Модель заготовки почек свиньи может быть использована для проведения различных доклинических экспериментов. В модели живого донора может быть восстановлена и сохранена одна почка с последующей аутотрансплантацией и удалением контралатеральной почки18,19. В модели умершего донора обе почки могут быть приобретены и использованы для исследований сохранения, исследований аппаратной перфузии или аллотрансплантации. Процедура забора крови, описанная в разделе 4, является ключевой для исследований аппаратной перфузии с использованием перфузата, содержащего цельную кровь или продукты крови, особенно при длительной машинной перфузии, требующей замены перфузата 20,21,22. При непосредственном канюляции аорты получается постоянный и быстрый поток крови, полностью обескровливающий животное за минимальное количество времени. Несколько мешков с кровью могут быть заполнены путем введения каждой иглы проксимально к предыдущему, тем самым сводя к минимуму утечку крови из предыдущего места прокола.
Как гипотермическая машинная перфузия (ГМП), так и нормотермическая машинная перфузия (НМП) являются новыми методами сохранения и оптимизации почек. По сравнению с SCS, было показано, что как HMP, так и NMP улучшают исходы и снижают частоту отсроченной функции трансплантата 3,4,5. Необходимы дальнейшие исследования для определения оптимального метода, но некоторые доклинические исследования показали, что NMP обеспечивает лучшие результаты23. Машинная перфузия дает возможность для тестирования жизнеспособности и прогнозирования маргинальных графтов21, а также возможности для восстановления ранее непригодных к использованиюграфтов 24. Дополнительные исследования продемонстрировали, что машинная перфузия является средством доставки лекарств и биоинженерии, включая доставку стволовых клеток25 и рецеллюляризацию почки свиньи эндотелиальными клеткамичеловека26. Ксенотрансплантация почки от свиньи к человеку является недавним прорывом27,28, и дальнейшие успехи могут заключаться в машинной перфузии.
Изменения в анатомии почек являются неизбежным препятствием при выполнении нескольких операций по восстановлению почек. Почка с двумя почечными артериями является редким вариантом. По нашему опыту, контралатеральная почка имеет нормальную артериальную анатомию и может быть использована вместо атипичной. Венозные аномалии встречаются чаще, чем артериальные, но и лучше поддаются реконструкции. Потенциальные вариации и возможности реконструкции венозной анатомии были описаны ранее19,29 и выходят за рамки данной статьи.
Несмотря на свою эффективность, вышеуказанный протокол ограничен временем и ресурсами, необходимыми для успешного завершения сложной операции на крупных животных, включая персонал, хирургическое оборудование, содержание животных, а также до- и послеоперационный уход. Кроме того, молодая, здоровая почка свиньи является ограниченной моделью для оценки пожилых взрослых доноров, доноров с основным заболеванием почек и доноров с сопутствующими заболеваниями, включая гипертонию и диабет.
Этот оптимизированный и воспроизводимый протокол для закупки почек свиньи позволяет проводить доклинические исследования в области трансплантации почек, их сохранения и машинной перфузии.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Авторы выражают признательность многим ветеринарным техникам из Медицинской школы Университета Джона Хопкинса за их техническую помощь. Мы также хотели бы выразить нашу благодарность докторам Джессике Иззи и Аманде Максвелл, а также многочисленным ветеринарным ординаторам, включая докторов Мэллори Браун, Джессику Планкард и Алексис Роуч, за предоставление нашим животным отличного клинического ухода и ветеринарного надзора. Наконец, мы хотели бы выразить признательность всем сотрудникам Лаборатории васкуляризированной композитной аллотрансплантации (VCA) Медицинской школы Джона Хопкинса, которые оказали помощь в любом качестве при заборе почек или других процедурах забора органов, выполненных в нашей лаборатории. Эта работа была поддержана грантом Национального института диабета, болезней пищеварительной системы и почек (NIDDK) R44DK136396.
Материалы
| Name | Company | Catalog Number | Comments |
| 70% Ethanol Solution | Fisher Scientific | 04-355-122 | |
| Adson Tissue ForceA2:D30ps, 4.75", 1 x 2 Teeth | Wexler Surgical | FL0081.1 | |
| Bair Hugger Animal Health Overbody Blanket | 3M | 53777 | |
| Bair Hugger Warming Unit | 3M | 77500 | |
| Balfour Abdominal Retractor w/ Fixed Side Blades, 4" Deep, 10" Maximum Spread | MPM Medical Supply | 124-7017 | |
| Betadine Solution (5% Providone-iodine) | MWI Animal Health | NDC-67618-155-01 | |
| Cefazolin for Injection, USP | MWI Animal Health | NDC-63323-237-10 | |
| Chlorhexidine Solution | MWI Animal Health | NDC-30798-624-31 | |
| Custodial HTK Organ Preservation Solution | Essential Pharmaceuticals | 25767073545 | |
| DeBakey Tissue Forceps, 7.75", 2 mm Tips | Wexler Surgical | FL0789.1 | |
| EUTHASOL (pentobarbital sodium and phenytoin sodium) | Virbac | NDC-051311-050-01 | |
| Heparin Sodium Injection, USP | MWI Animal Health | NDC-71288-402-10 | |
| Hot Dog Temperature Management Controller | Augustine Surgical Inc. | WC71V | |
| Hot Dog Veterinary Underbody Warming Mattress | Augustine Surgical Inc. | V106 | |
| Invisishield Isolation Bag, 20" x 20" | Medline | DYNJSD1003 | |
| Jacobson Micro Needle Holder, Straight Jaws, Round Handle, 7.25" | Wexler Surgical | NL0729.11 | |
| Ketamine Hydrochloride Injectable Solution | NexGen Pharmaceuticals | NC-0256 | |
| Lap Sponges 18" x 18" | Medline | MDS231318LF | |
| Metzenbaum Dissection Scissors, 7" Curved | Wexler Surgical | SL5011.1S | |
| Non-Conductive Suction Tubing with Scalloped Connectors, 1/4" x 10' | Medline | DYND50251 | |
| Pantoprazole Sodium for Injection | MWI Animal Health | NDC-55150-202-00 | |
| Perfusion Cannula, Free-Flow, 3 mm Blunt Tip | MED Alliance Solutions | PER-3003S | |
| Rigid Bulb Tip Yankauer | Medline | DYND50130 | |
| Satinsky Clamp, 30 mm Angled DeBakey Atraumatic Jaws, Curved Shanks, 10" | Wexler Surgical | AL2150.1 | |
| Scalpel Handle #3 | World Precision Instruments | 500236 | |
| Servator B UW (University of Wisconsin) | Global Transplant Solutions | JFISERB10A r2 | |
| Single Collection Unit Prefilled CPDA-1, 450 mL | Jorgensen Laboratories | JO520 | |
| Sofsilk Suture Tie, 2-0, Black, 18" | Covidien | S-195 | |
| Surgical Scalpel Blade No. 10 | World Precision Instruments | 500239 | |
| Surgipro II Suture, 6-0, Blue, 30", Double Armed, CV-22 Needle | Covidien | VP-733-X | |
| Three-Quarter Surgical Drape | Medline | DYNJP2414 | |
| Valleylab Electrosurgical Pencil with Stainless Steel Electrodes | Covidien | CVNE2516H | |
| Valleylab Force FXc Electrosurgical Generator | Covidien | MFI-MDT-FORCE-FXC | |
| Valleylab Polyhesive Adult Patient Return Electrode | Covidien | E7507-SD | |
| Xylazine Hydrochloride Injectable Solution | NexGen Pharmaceuticals | NC-0334 |
Ссылки
- Merion, R. M., et al. Deceased-donor characteristics and the survival benefit of kidney transplantation. JAMA. 294 (21), 2726-2733 (2005).
- Lentine, K. L., et al. OPTN/SRTR 2022 annual data report: Kidney. Am J Transplant. 24 (2S1), S19-S118 (2024).
- Hosgood, S. A., et al. Normothermic machine perfusion versus static cold storage in donation after circulatory death kidney transplantation: a randomized controlled trial. Nat Med. 29 (6), 1511-1519 (2023).
- Malinoski, D., et al. Hypothermia or machine perfusion in kidney donors. N Engl J Med. 388 (5), 418-426 (2023).
- Hamar, M., Selzner, M. Ex vivo machine perfusion for kidney preservation. Curr Opin Organ Transplant. 23 (3), 369-374 (2018).
- Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. Pig kidney: anatomical relationships between the intrarenal arteries and the kidney collecting system. Applied study for urological research and surgical training. J Urol. 172 (5 Pt 1), 2077-2081 (2004).
- Bagetti Filho, H. J., Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. Pig kidney: anatomical relationships between the renal venous arrangement and the kidney collecting system. J Urol. 179 (4), 1627-1630 (2008).
- Giraud, S., et al. Contribution of large pig for renal ischemia-reperfusion and transplantation studies: the preclinical model. J Biomed Biotechnol. 2011 (21), 532127 (2011).
- Girard, A. O., et al. Hickman catheter use for long-term vascular access in a preclinical swine model. J Vis Exp. (193), e65221 (2023).
- Gerling, K. A., et al. A novel sutureless anastomotic device in a swine model: A proof of concept study. J Surg Res. 291, 116-123 (2023).
- Etra, J. W., et al. Latissimus Dorsi myocutaneous flap procedure in a swine model. J Invest Surg. 34 (12), 1289-1296 (2021).
- Etra, J. W., et al. A skin rejection grading system for vascularized composite allotransplantation in a preclinical large animal model. Transplantation. 103 (7), 1385-1391 (2019).
- Al-Rakan, M., et al. Ancillary procedures necessary for translational research in experimental craniomaxillofacial surgery. J Craniofac Surg. 25 (6), 2043-2050 (2014).
- Santiago, G. F., et al. Establishing cephalometric landmarks for the translational study of Le Fort-based facial transplantation in Swine: enhanced applications using computer-assisted surgery and custom cutting guides. Plast Reconstr Surg. 133 (5), 1138-1151 (2014).
- Ibrahim, Z., et al. Cutaneous collateral axonal sprouting re-innervates the skin component and restores sensation of denervated Swine osteomyocutaneous alloflaps. PLoS One. 8 (10), e77646 (2013).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. J Vis Exp. (80), e50475 (2013).
- Wachtman, G. S., et al. Biologics and donor bone marrow cells for targeted immunomodulation in vascularized composite allotransplantation: a translational trial in swine. Transplant Proc. 43 (9), 3541-3544 (2011).
- Kaths, J. M., et al. Heterotopic renal autotransplantation in a porcine model: A step-by-step protocol. J Vis Exp. 108, e53765 (2016).
- Liu, W. J., et al. Orthotopic kidney auto-transplantation in a porcine model using 24 hours organ preservation and continuous telemetry. J Vis Exp. (162), e61591 (2020).
- Steinhauser, C., et al. Assessment of hemodynamic and blood parameters that may reflect macroscopic quality of porcine kidneys during normothermic machine perfusion using whole blood. World J Urol. 42 (1), 471 (2024).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for graft quality assessment prior to transplantation. Am J Transplant. 18 (3), 580-589 (2018).
- Urcuyo, D., et al. Development of a prolonged warm ex vivo perfusion model for kidneys donated after cardiac death. Int J Artif Organs. 40 (6), 265-271 (2017).
- Vallant, N., et al. A comparison of pulsatile hypothermic and normothermic ex vivo machine perfusion in a porcine kidney model. Transplantation. 105 (8), 1760-1770 (2021).
- Hosgood, S. A., Saeb-Parsy, K., Hamed, M. O., Nicholson, M. L. Successful transplantation of human kidneys deemed untransplantable but resuscitated by ex vivo normothermic machine perfusion. Am J Transplant. 16 (11), 3282-3285 (2016).
- Vallant, N., Wolfhagen, N., Sandhu, B., Hamaoui, K., Papalois, V. Delivery of mesenchymal stem cells during hypothermic machine perfusion in a translational kidney perfusion study. Int J Mol Sci. 25 (9), 5038 (2024).
- Uzarsk, J. S., et al. Sustained in vivo perfusion of a re-endothelialized tissue engineered kidney graft in a human-scale animal model. Front Bioeng Biotechnol. 11, 1184408 (2023).
- Anand, R. P., et al. Design and testing of a humanized porcine donor for xenotransplantation. Nature. 622 (7982), 393-401 (2023).
- Pan, W., et al. Cellular dynamics in pig-to-human kidney xenotransplantation. Med. 5 (8), 1016-1029 (2024).
- Golriz, M., et al. Pig kidney transplantation: an up-to- date guideline. Eur Surg Res. 49 (3-4), 121-129 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены