Method Article
Aquisição de rim em um modelo animal pré-clínico de grande porte
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos um protocolo que detalha um modelo cirúrgico para aquisição de rim em um modelo suíno pré-clínico para subsequente perfusão ou transplante por máquina.
Resumo
A perfusão por máquina evoluiu como uma estratégia viável para avaliação, monitoramento, tratamento, otimização de órgãos ex vivo , bem como para prolongar os tempos de preservação. Modelos animais de grande porte têm sido primordiais para o desenvolvimento e otimização dessas tecnologias. No entanto, para garantir a qualidade do enxerto e a reprodutibilidade dos dados, técnicas cirúrgicas padronizadas e clinicamente traduzíveis para a captação de órgãos e tecidos devem ser seguidas. Assim, descrevemos um protocolo otimizado para aquisição de rim em um modelo pré-clínico de suínos. A recuperação renal é realizada usando porcos de raça mista (Yorkshire cross/mix). Resumidamente, após a desinfecção estéril e o drapeado do campo cirúrgico, uma incisão completa na linha média é realizada para obter acesso ideal a ambos os rins. O ureter, a veia renal e a artéria são dissecados até sua origem da veia cava inferior e da aorta, respectivamente. Após a dissecção renal completa, o ureter é amarrado e cortado distalmente. O animal dador é então totalmente heparinizado com 100 UI por kg/peso corporal. Em seguida, a artéria renal é pinçada perto da aorta e a veia renal é pinçada perto da veia cava usando uma pinça vascular de Satinsky. O enxerto renal é então ressecado e a artéria renal é imediatamente canulada na mesa traseira. O rim será então lavado com uma solução de preservação gelada e armazenado no gelo até a perfusão da máquina ou transplante. Finalmente, o coto da artéria renal é ligado com uma ligadura de seda 2-0 e a veia cava é fechada com uma sutura de polipropileno 6-0. Essa técnica recupera rins e simula uma configuração de doador vivo (rim único) ou falecido (rim duplo). A recuperação renal única oferece a vantagem de realizar um autotransplante subsequente. No modelo de doador falecido, o sangue pode ser coletado antes da eutanásia, inserindo agulhas de bolsa de sangue diretamente na aorta, exsanguinando o animal e fornecendo sangue para perfusão ex vivo da máquina.
Introdução
O transplante renal é o tratamento ideal para a doença renal terminal (DRT), proporcionando melhor qualidade de vida e resultados a longo prazo em comparação com a diálise1. Apesar dos avanços na preservação de órgãos, dezenas de pessoas morrem todos os dias de DRT enquanto estão na lista de espera para um transplante de rim2. A perfusão por máquina é um campo em crescimento que aumenta os tempos de preservação, permitindo redes de doadores estendidas e alocação mais eficiente de órgãos. Essa tecnologia também permite o monitoramento e otimização ex vivo de órgãos, minimizando assim os efeitos da lesão de isquemia-reperfusão (IRI). Quando comparada ao armazenamento refrigerado estático (SCS), a perfusão da máquina demonstrou reduzir significativamente a incidência de função tardia do enxerto 3,4. A perfusão por máquina também demonstrou revitalização de enxertos marginais, que de outra forma não teriam atendido aos critérios para transplante5. Apesar dos avanços tecnológicos, a técnica de preservação mais comum continua sendo o SCS no gelo. Outros experimentos e dados pré-clínicos podem ajudar a tornar a perfusão da máquina um dos pilares da preservação do rim.
O modelo suíno para transplante renal está bem estabelecido e tem sido parte integrante do desenvolvimento da tecnologia de preservação renal, especialmente a perfusão por máquina. Ao contrário dos rins unilobulares de roedores, os rins suínos e humanos são multilobulares, semelhantes em tamanho e compartilham anatomia arterial, venosa e urinária análoga 6,7. Portanto, o rim suíno facilita uma tradução direta para o ambiente clínico, especialmente em termos de dispositivos médicos e terapias medicamentosas. Além disso, os rins suínos apresentam uma fisiopatologia da IRI semelhante à dos rins humanos8, tornando-os ideais para estudos de preservação renal.
Para garantir a qualidade do enxerto e a reprodutibilidade dos dados, técnicas cirúrgicas padronizadas e clinicamente traduzíveis para obtenção de órgãos e tecidos devem ser seguidas. Assim, descrevemos um protocolo otimizado para aquisição de rim em um modelo pré-clínico de suínos. Este protocolo permite a recuperação de rins e simula um ambiente de doador vivo (rim único) ou falecido (rim duplo). A recuperação renal única oferece a vantagem de realizar um autotransplante subsequente. No modelo de recuperação renal dupla, a coleta de sangue antes da eutanásia é possível inserindo agulhas de bolsa de sangue diretamente na aorta, exsanguinando o animal e fornecendo sangue para perfusão ex vivo da máquina.
Protocolo
Todos os procedimentos descritos foram aprovados pelo Comitê de Cuidados e Uso Institucional da Universidade Johns Hopkins, uma instituição credenciada pelo Departamento de Agricultura dos Estados Unidos (USDA), pelo Escritório de Bem-Estar de Animais de Laboratório (OLAW) e pela Associação para Avaliação e Acreditação de Cuidados com Animais de Laboratório (AAALAC). Os animais foram mantidos de acordo com a Lei de Bem-Estar Animal do Departamento de Agricultura dos Estados Unidos, o Guia dos Institutos Nacionais de Saúde para o Cuidado e Uso de Animais de Laboratório e a Política do Serviço de Saúde Pública dos Estados Unidos sobre Cuidados Humanos e Uso de Animais de Laboratório.
1. Animais e alojamento
- Use porcos Yorkshire (Sus scrofa domesticus) clinicamente saudáveis de 3 a 6 meses de idade e 20 a 40 kg, ou comparáveis, para este protocolo.
- Alojar os animais em cercas de arame com piso de ripas.
2. Procedimento pré-operatório e anestesia
- Jejue o animal pelo menos 12 h antes do tempo de sedação.
- Administre simeticona oral (20 mg / kg) pelo menos 12 h antes da cirurgia e repita a dosagem pelo menos 1 h antes da sedação para reduzir a dilatação intestinal.
- Administre cetamina (20-30 mg / kg) e xilazina (2-3 mg / kg) em uma única seringa por via intramuscular para evitar injeções múltiplas.
- Transfira o porco para a área de estadiamento pré-operatório. Coloque um cateter intravenoso em uma veia marginal da orelha. Administre 3-10 mg/kg/h de solução salina a 0,9% ou solução de Ringer com lactato durante todo o procedimento.
- Assim que o porco estiver adequadamente sedado, coloque um tubo endotraqueal (tubo endotraqueal com balonete de 6,0-6,5 mm para animais de 20-30 kg; 6,5-7,0 mm com balonete para 30-40 kg) para administração de anestesia gasosa e ventilação mecânica. Se necessário, facilite com uma dose de propofol (0,8-1,66 mg / kg) por via intravenosa, administrada para efeito.
- Remova os pelos no local da cirurgia e ao redor dele usando uma tesoura, bem como uma esfoliação suja do local da cirurgia, antes de mover o animal para a sala de cirurgia.
- Transfira o animal para a mesa de operação. Administre cefazolina (20-22 mg/kg) por via intravenosa 10 minutos antes do início da cirurgia e novamente a cada 90 minutos no intraoperatório. Administre pantoprazol (0,5-1 mg / kg) por via intravenosa no início da cirurgia.
- Administre um bloqueio local por via subcutânea com lidocaína (até 2 mg/kg) para facilitar a analgesia adicional antes da incisão.
- Prepare assepticamente o local da cirurgia, alternando entre clorexidina ou betadina e etanol ou solução salina a 70%, pelo menos três vezes.
- Monitore continuamente o volume de fluidos, frequência cardíaca, pressão arterial, oximetria de pulso, capnografia, eletrocardiografia e temperatura retal. Registre esses valores a cada 10-15 minutos. Use uma almofada aquecida na parte inferior da carroceria e um cobertor de ar quente para evitar hipotermia.
- Antes do início da cirurgia, confirme se o animal está dentro do plano apropriado de anestesia cirúrgica, utilizando uma combinação de tônus da mandíbula, reflexo palpebral e parâmetros listados na etapa anterior.
3. Procedimento de colheita renal
- Prepare o animal para a cirurgia, seguindo os passos descritos na Secção 2.
- Após a desinfecção estéril e o drapeado do campo cirúrgico, realize uma laparotomia mediana (25-30 cm) para obter acesso ideal a ambos os rins. Insira um afastador abdominal padrão.
- Cubra o cólon e o intestino delgado com toalhas embebidas em solução salina morna. Retraia os intestinos para o lado direito para acesso ao rim esquerdo ou para o lado esquerdo para acesso ao rim direito.
- Abra o peritônio que cobre o rim e disseque ao redor do rim para liberar quaisquer aderências. Disseque o ureter até obter 10-12 cm de comprimento.
- Dissecar a veia e a artéria renal até sua origem na veia cava inferior e na aorta, respectivamente.
- Após a dissecção renal completa, amarre o ureter distalmente com ligadura de seda 2-0 e corte proximalmente à gravata. Deixe a extremidade proximal do ureter aberta para permitir a drenagem da urina.
- Heparinizar o animal com heparina intravenosa (100 UI/kg) e aguardar 2 min para garantir a heparinização adequada do rim. Esta etapa deve ser repetida antes da ressecção de cada rim.
- Pinçar a artéria renal e a veia renal próximas à aorta e à veia cava inferior, respectivamente, com duas pinças vasculares de Satinsky. Remova o enxerto renal cortando a artéria renal e a veia perto das pinças.
- Canule imediatamente a artéria renal com uma cânula de perfusão de ponta romba de 3 mm. Lave o rim com solução gelada da Universidade de Wisconsin (UW) ou solução de preservação de Custodiol Histidina-triptofano-cetoglutarato (HTK).
- Remova a cânula de perfusão após a lavagem com UW ou HTK e coloque o rim em uma bolsa de órgãos estéril cheia da mesma solução de preservação gelada que foi usada para lavar o rim. Coloque este saco dentro de um segundo saco de órgão estéril. Posteriormente, armazene o órgão ou inicie a perfusão da máquina.
- Ligue o coto da artéria renal com uma ligadura de seda 2-0. Feche o coto da veia renal com uma sutura contínua de duas camadas com polipropileno 6-0.
4. Procedimento de colheita de sangue
- Se o procedimento for terminal e todas as outras intervenções cirúrgicas tiverem sido realizadas, prossiga com a coleta de sangue para perfusão mecânica e eutanásia por exsanguinação.
- Retraia os intestinos para o lado direito e identifique a aorta abdominal infrarrenal. Libere quaisquer aderências grandes ou tecido cobrindo o vaso.
- Insira a agulha da bolsa de coleta de sangue diretamente na aorta. Pendure o saco abaixo do animal para facilitar o enchimento. Quando a bolsa estiver cheia (aproximadamente 450 mL de sangue), remova a agulha da aorta e mantenha a pressão no local da punção.
- Para uma segunda bolsa de sangue, insira a nova agulha 1-2 cm proximalmente ao local da punção anterior. Repita com várias bolsas de sangue conforme necessário, movendo-se 1-2 cm proximalmente com cada agulha.
- Após a coleta de todo o sangue necessário, induza a parada cardíaca com injeção intravenosa de pentobarbital sódico / fenitoína sódica na dose de pelo menos 78 mg / kg do componente pentobarbital. Se houver preocupação de que o pentobarbital interfira nos ensaios subsequentes do rim, use cloreto de potássio (KCl) (75-100 mg / kg IV) como um método alternativo de eutanásia química se for administrado a porcos sob anestesia. Verifique a morte por falta de batimentos cardíacos, ausência de reflexo corneano e diminuição significativa da temperatura corporal.
NOTA: Os órgãos e tecidos restantes do porco sacrificado podem ser usados para outros fins de pesquisa ou educacionais, em conformidade com os princípios 3R.
Resultados
Nosso grupo de pesquisa tem ampla experiência de quase 15 anos com modelos suínos de transplante de órgãos sólidos e alotransplante composto vascularizado 9,10,11,12,13,14,15,16,17 . Aqui, descrevemos os resultados de nossos experimentos de recuperação renal suína (n = 139). Utilizamos os rins obtidos para transplante, perfusão mecânica ou cultura de células primárias e, até o momento, não tivemos complicações com esse modelo de procedimento cirúrgico (Figura 1). Definimos a recuperação renal bem-sucedida como uma cirurgia sem falha técnica, bem como a ausência de resultados adversos relacionados à anatomia ou técnica cirúrgica. Exemplos da aparência macroscópica de um enxerto renal são mostrados na Figura 2, representando a reperfusão renal bem-sucedida por meio de perfusão mecânica ou transplante.
Dependendo do histórico de treinamento e da familiaridade do laboratório com modelos suínos, recomendamos a realização de pelo menos um a três experimentos preliminares com todo o pessoal envolvido nos procedimentos. No presente conjunto de estudos, o tempo médio total do procedimento - desde a incisão na linha média até a eutanásia - foi de 88 min (Tabela 1). O tempo médio desde a incisão na linha média até a retirada de ambos os enxertos renais foi de 73 min. Além do apoio da equipe veterinária, incluindo um veterinário e um ou dois técnicos veterinários, são necessários no mínimo três funcionários cirúrgicos e laboratoriais adicionais. Dependendo do nível de experiência, outro assistente cirúrgico e uma ou duas equipes de apoio adicionais, incluindo estudantes de doutorado ou técnicos de laboratório, podem ser recomendados para garantir a eficiência na retirada do enxerto, lavagem de órgãos e coleta de sangue, a fim de minimizar o tempo de isquemia quente e o risco de coagulação durante a coleta de sangue.
Como em humanos, variações anatômicas são possíveis em rins suínos (Figura 3, Tabela 2). A anatomia padrão - uma artéria renal e uma veia renal - foi observada em 64% dos rins. As variações mais comuns foram uma artéria e duas veias (26%), duas artérias e uma veia (5%), uma artéria e três veias (4%) e duas artérias e duas veias (1%). Aproximadamente metade (46%) dos porcos tinha anatomia típica bilateralmente. A anatomia atípica foi observada unilateralmente (22% atípica à esquerda, 14% atípica à direita) e bilateralmente (19%). Ao escolher um rim para transplante, recomendamos evitar qualquer anatomia atípica. Se ambos os rins tiverem duas veias, opte pelo rim com veias mais longas e reconstrua na mesa traseira para um único lúmen antes do transplante. Ao escolher um rim para perfusão da máquina, a anatomia venosa é menos importante se a máquina utilizar drenagem venosa agrupada. Recomendamos evitar a anatomia de duas artérias para perfusão de máquina de bomba única, pois as diferenças de resistência entre as artérias criarão circulação desigual.

Figura 1: Resumo das taxas de recuperação renal bem-sucedidas para transplante, perfusão por máquina e experimentos de cultura de células primárias. Clique aqui para ver uma versão maior desta figura.

Figura 2: Exemplos de aparência macroscópica do enxerto renal. (A) Rim direito nativo in situ. (B) Enxerto renal após lavagem com solução de preservação gelada. (C) Enxerto renal após reperfusão da máquina. (D) Enxerto renal após transplante e reperfusão. Clique aqui para ver uma versão maior desta figura.
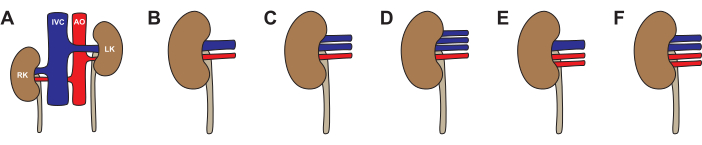
Figura 3: Variações na anatomia do rim de porco. (A, B) Anatomia típica com uma artéria renal e uma veia renal para cada rim. (C) Anatomia atípica com uma artéria renal e duas veias renais. (D) Anatomia atípica com uma artéria renal e três veias renais. (E) Anatomia atípica com duas artérias renais e uma veia renal. (F) Anatomia atípica com duas artérias renais e duas veias renais. Abreviaturas utilizadas: RK- rim direito; VCI - veia cava inferior; AO- aorta; LK- rim esquerdo. Clique aqui para ver uma versão maior desta figura.
| Tarefa ou etapa experimental | Tempo médio (min) | Cirurgião | Assistência Cirúrgica | Veterinário | Técnico Veterinário | Investigador | Número total de funcionários |
| Pré-operatório | 60 | 1 | 2 | 1 | 4 | ||
| Cirurgia de Recuperação de Enxerto (Um Rim) | 41 | 1 | 1 | 1 | 1 | 1 | 5 |
| Cirurgia de Recuperação de Enxerto (Ambos os Rins) | 73 | 1 | 1 | 1 | 1 | 1 | 5 |
| Lavagem de órgãos (por rim) | 6 | 1 | 1 | 1 | 1 | 4 | |
| Coleta de Sangue | 15 | 1 | 1 | 1 | 1 | 1 | 5 |
| Eutanásia | N/A | 1 | 1 | 2 |
Tabela 1: Recursos humanos e requisitos de tempo para a realização da cirurgia de captação de rim suíno.
| Anatomia Renal Bilateral | Número de Suínos | Porcentagem de Suínos |
| Ambos típicos | 17 | 46% |
| Direita Típica, Esquerda Atípica | 8 | 22% |
| Esquerda típica, direita atípica | 5 | 14% |
| Ambos atípicos | 7 | 19% |
| 37 | 100% | |
| Anatomia Renal Unilateral | Número de rins | Porcentagem de rins |
| 1 artéria, 1 veia | 47 | 64% |
| 1 artéria, 2 veias | 19 | 26% |
| 1 artéria, 3 veias | 3 | 4% |
| 2 artérias, 1 veia | 4 | 5% |
| 2 artérias, 2 veias | 1 | 1% |
| 74 | 100% |
Tabela 2: Resumo das variações anatômicas encontradas em rins de suínos.
Discussão
O modelo suíno para transplante renal tem sido vital para o desenvolvimento e otimização da tecnologia de perfusão por máquina. Dadas as semelhanças anatômicas, imunológicas e fisiopatológicas com os rins humanos 6,7,8, os rins suínos oferecem uma tradução facilitada para testes clínicos e práticas.
O modelo de aquisição de rim suíno pode ser utilizado para uma variedade de experimentos pré-clínicos. Em um modelo de doador vivo, um único rim pode ser recuperado e preservado, com posterior autotransplante e retirada do rim contralateral 18,19. Em um modelo de doador falecido, ambos os rins podem ser obtidos e usados para estudos de preservação, estudos de perfusão por máquina ou alotransplante. O procedimento de coleta de sangue descrito na Seção 4 é fundamental para estudos de perfusão de máquina utilizando um perfusato contendo sangue total ou hemoderivados, especialmente perfusão de máquina estendida que necessita de troca de perfusato 20,21,22. Por canulação da aorta diretamente, obtém-se um fluxo sanguíneo consistente e rápido, exsanguinando totalmente o animal em um período mínimo de tempo. Várias bolsas de sangue podem ser preenchidas inserindo cada agulha proximalmente à anterior, minimizando assim o vazamento de sangue do local da punção anterior.
Tanto a perfusão por máquina hipotérmica (HMP) quanto a perfusão por máquina normotérmica (NMP) são métodos emergentes para preservação e otimização renal. Quando comparados ao SCS, tanto o HMP quanto o NMP demonstraram melhorar os resultados e diminuir a incidência de função tardia do enxerto 3,4,5. Mais pesquisas são necessárias para determinar o método ideal, mas alguns estudos pré-clínicos indicaram que o NMP fornece melhores resultados23. A perfusão da máquina oferece uma oportunidade para testes de viabilidade e predição de enxertos marginais21, bem como o potencial de reparo de enxertos anteriormente inutilizáveis24. Estudos adicionais demonstraram a perfusão de máquina como um local para a administração de medicamentos e bioengenharia, incluindo a entrega de células-tronco25 e a recelularização de um rim suíno com células endoteliais humanas26. O xenotransplante de rim de porco para humano é um avanço recente27,28, e outros avanços podem estar na perfusão por máquina.
Variações na anatomia renal são um obstáculo inevitável ao realizar múltiplas recuperações renais. Um rim com duas artérias renais é uma variante incomum. Em nossa experiência, o rim contralateral tem anatomia arterial normal e pode ser usado no lugar do atípico. As anormalidades venosas são mais comuns que as arteriais, mas também mais passíveis de reconstrução. As potenciais variações e possibilidades de reconstrução da anatomia venosa foram descritas anteriormente 19,29 e estão além do escopo deste trabalho.
Apesar de sua eficácia, o protocolo acima é limitado pelo tempo e recursos necessários para concluir com sucesso uma cirurgia complexa de animais de grande porte, incluindo pessoal, equipamentos cirúrgicos, alojamento de animais e cuidados pré e pós-operatórios. Além disso, um rim suíno jovem e saudável é um modelo limitado para avaliar doadores adultos mais velhos, doadores com doença renal subjacente e doadores com comorbidades, incluindo hipertensão e diabetes.
Este protocolo otimizado e reprodutível para aquisição de rim suíno permite pesquisas pré-clínicas traduzíveis em transplante renal, preservação e perfusão por máquina.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Os autores gostariam de agradecer aos muitos técnicos veterinários da Escola de Medicina da Universidade Johns Hopkins por sua assistência técnica. Também gostaríamos de expressar nossa gratidão às Dras. Jessica Izzi e Amanda Maxwell, e aos numerosos residentes veterinários, incluindo os Drs. Mallory Brown, Jessica Plunkard e Alexis Roach por fornecer aos nossos animais excelentes cuidados clínicos e supervisão veterinária. Finalmente, gostaríamos de agradecer a todos os membros do Laboratório de Alotransplante Composto Vascularizado (VCA) da Johns Hopkins School of Medicine que ajudaram em qualquer capacidade com a aquisição de rins ou outros procedimentos de aquisição de órgãos realizados em nosso laboratório. Este trabalho foi apoiado pelo Instituto Nacional de Diabetes e Doenças Digestivas e Renais (NIDDK) R44DK136396.
Materiais
| Name | Company | Catalog Number | Comments |
| 70% Ethanol Solution | Fisher Scientific | 04-355-122 | |
| Adson Tissue ForceA2:D30ps, 4.75", 1 x 2 Teeth | Wexler Surgical | FL0081.1 | |
| Bair Hugger Animal Health Overbody Blanket | 3M | 53777 | |
| Bair Hugger Warming Unit | 3M | 77500 | |
| Balfour Abdominal Retractor w/ Fixed Side Blades, 4" Deep, 10" Maximum Spread | MPM Medical Supply | 124-7017 | |
| Betadine Solution (5% Providone-iodine) | MWI Animal Health | NDC-67618-155-01 | |
| Cefazolin for Injection, USP | MWI Animal Health | NDC-63323-237-10 | |
| Chlorhexidine Solution | MWI Animal Health | NDC-30798-624-31 | |
| Custodial HTK Organ Preservation Solution | Essential Pharmaceuticals | 25767073545 | |
| DeBakey Tissue Forceps, 7.75", 2 mm Tips | Wexler Surgical | FL0789.1 | |
| EUTHASOL (pentobarbital sodium and phenytoin sodium) | Virbac | NDC-051311-050-01 | |
| Heparin Sodium Injection, USP | MWI Animal Health | NDC-71288-402-10 | |
| Hot Dog Temperature Management Controller | Augustine Surgical Inc. | WC71V | |
| Hot Dog Veterinary Underbody Warming Mattress | Augustine Surgical Inc. | V106 | |
| Invisishield Isolation Bag, 20" x 20" | Medline | DYNJSD1003 | |
| Jacobson Micro Needle Holder, Straight Jaws, Round Handle, 7.25" | Wexler Surgical | NL0729.11 | |
| Ketamine Hydrochloride Injectable Solution | NexGen Pharmaceuticals | NC-0256 | |
| Lap Sponges 18" x 18" | Medline | MDS231318LF | |
| Metzenbaum Dissection Scissors, 7" Curved | Wexler Surgical | SL5011.1S | |
| Non-Conductive Suction Tubing with Scalloped Connectors, 1/4" x 10' | Medline | DYND50251 | |
| Pantoprazole Sodium for Injection | MWI Animal Health | NDC-55150-202-00 | |
| Perfusion Cannula, Free-Flow, 3 mm Blunt Tip | MED Alliance Solutions | PER-3003S | |
| Rigid Bulb Tip Yankauer | Medline | DYND50130 | |
| Satinsky Clamp, 30 mm Angled DeBakey Atraumatic Jaws, Curved Shanks, 10" | Wexler Surgical | AL2150.1 | |
| Scalpel Handle #3 | World Precision Instruments | 500236 | |
| Servator B UW (University of Wisconsin) | Global Transplant Solutions | JFISERB10A r2 | |
| Single Collection Unit Prefilled CPDA-1, 450 mL | Jorgensen Laboratories | JO520 | |
| Sofsilk Suture Tie, 2-0, Black, 18" | Covidien | S-195 | |
| Surgical Scalpel Blade No. 10 | World Precision Instruments | 500239 | |
| Surgipro II Suture, 6-0, Blue, 30", Double Armed, CV-22 Needle | Covidien | VP-733-X | |
| Three-Quarter Surgical Drape | Medline | DYNJP2414 | |
| Valleylab Electrosurgical Pencil with Stainless Steel Electrodes | Covidien | CVNE2516H | |
| Valleylab Force FXc Electrosurgical Generator | Covidien | MFI-MDT-FORCE-FXC | |
| Valleylab Polyhesive Adult Patient Return Electrode | Covidien | E7507-SD | |
| Xylazine Hydrochloride Injectable Solution | NexGen Pharmaceuticals | NC-0334 |
Referências
- Merion, R. M., et al. Deceased-donor characteristics and the survival benefit of kidney transplantation. JAMA. 294 (21), 2726-2733 (2005).
- Lentine, K. L., et al. OPTN/SRTR 2022 annual data report: Kidney. Am J Transplant. 24 (2S1), S19-S118 (2024).
- Hosgood, S. A., et al. Normothermic machine perfusion versus static cold storage in donation after circulatory death kidney transplantation: a randomized controlled trial. Nat Med. 29 (6), 1511-1519 (2023).
- Malinoski, D., et al. Hypothermia or machine perfusion in kidney donors. N Engl J Med. 388 (5), 418-426 (2023).
- Hamar, M., Selzner, M. Ex vivo machine perfusion for kidney preservation. Curr Opin Organ Transplant. 23 (3), 369-374 (2018).
- Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. Pig kidney: anatomical relationships between the intrarenal arteries and the kidney collecting system. Applied study for urological research and surgical training. J Urol. 172 (5 Pt 1), 2077-2081 (2004).
- Bagetti Filho, H. J., Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. Pig kidney: anatomical relationships between the renal venous arrangement and the kidney collecting system. J Urol. 179 (4), 1627-1630 (2008).
- Giraud, S., et al. Contribution of large pig for renal ischemia-reperfusion and transplantation studies: the preclinical model. J Biomed Biotechnol. 2011 (21), 532127 (2011).
- Girard, A. O., et al. Hickman catheter use for long-term vascular access in a preclinical swine model. J Vis Exp. (193), e65221 (2023).
- Gerling, K. A., et al. A novel sutureless anastomotic device in a swine model: A proof of concept study. J Surg Res. 291, 116-123 (2023).
- Etra, J. W., et al. Latissimus Dorsi myocutaneous flap procedure in a swine model. J Invest Surg. 34 (12), 1289-1296 (2021).
- Etra, J. W., et al. A skin rejection grading system for vascularized composite allotransplantation in a preclinical large animal model. Transplantation. 103 (7), 1385-1391 (2019).
- Al-Rakan, M., et al. Ancillary procedures necessary for translational research in experimental craniomaxillofacial surgery. J Craniofac Surg. 25 (6), 2043-2050 (2014).
- Santiago, G. F., et al. Establishing cephalometric landmarks for the translational study of Le Fort-based facial transplantation in Swine: enhanced applications using computer-assisted surgery and custom cutting guides. Plast Reconstr Surg. 133 (5), 1138-1151 (2014).
- Ibrahim, Z., et al. Cutaneous collateral axonal sprouting re-innervates the skin component and restores sensation of denervated Swine osteomyocutaneous alloflaps. PLoS One. 8 (10), e77646 (2013).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. J Vis Exp. (80), e50475 (2013).
- Wachtman, G. S., et al. Biologics and donor bone marrow cells for targeted immunomodulation in vascularized composite allotransplantation: a translational trial in swine. Transplant Proc. 43 (9), 3541-3544 (2011).
- Kaths, J. M., et al. Heterotopic renal autotransplantation in a porcine model: A step-by-step protocol. J Vis Exp. 108, e53765 (2016).
- Liu, W. J., et al. Orthotopic kidney auto-transplantation in a porcine model using 24 hours organ preservation and continuous telemetry. J Vis Exp. (162), e61591 (2020).
- Steinhauser, C., et al. Assessment of hemodynamic and blood parameters that may reflect macroscopic quality of porcine kidneys during normothermic machine perfusion using whole blood. World J Urol. 42 (1), 471 (2024).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for graft quality assessment prior to transplantation. Am J Transplant. 18 (3), 580-589 (2018).
- Urcuyo, D., et al. Development of a prolonged warm ex vivo perfusion model for kidneys donated after cardiac death. Int J Artif Organs. 40 (6), 265-271 (2017).
- Vallant, N., et al. A comparison of pulsatile hypothermic and normothermic ex vivo machine perfusion in a porcine kidney model. Transplantation. 105 (8), 1760-1770 (2021).
- Hosgood, S. A., Saeb-Parsy, K., Hamed, M. O., Nicholson, M. L. Successful transplantation of human kidneys deemed untransplantable but resuscitated by ex vivo normothermic machine perfusion. Am J Transplant. 16 (11), 3282-3285 (2016).
- Vallant, N., Wolfhagen, N., Sandhu, B., Hamaoui, K., Papalois, V. Delivery of mesenchymal stem cells during hypothermic machine perfusion in a translational kidney perfusion study. Int J Mol Sci. 25 (9), 5038 (2024).
- Uzarsk, J. S., et al. Sustained in vivo perfusion of a re-endothelialized tissue engineered kidney graft in a human-scale animal model. Front Bioeng Biotechnol. 11, 1184408 (2023).
- Anand, R. P., et al. Design and testing of a humanized porcine donor for xenotransplantation. Nature. 622 (7982), 393-401 (2023).
- Pan, W., et al. Cellular dynamics in pig-to-human kidney xenotransplantation. Med. 5 (8), 1016-1029 (2024).
- Golriz, M., et al. Pig kidney transplantation: an up-to- date guideline. Eur Surg Res. 49 (3-4), 121-129 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados