Method Article
Approvvigionamento di rene in un modello preclinico di grandi animali
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, presentiamo un protocollo che descrive in dettaglio un modello chirurgico per l'approvvigionamento del rene in un modello suino preclinico per la successiva perfusione meccanica o trapianto.
Abstract
La perfusione meccanica si è evoluta come una strategia praticabile per la valutazione, il monitoraggio, il trattamento, l'ottimizzazione degli organi ex vivo , nonché per prolungare i tempi di conservazione. I modelli di animali di grandi dimensioni sono stati fondamentali per lo sviluppo e l'ottimizzazione di queste tecnologie. Tuttavia, al fine di garantire la qualità dell'innesto e la riproducibilità dei dati, è necessario seguire tecniche chirurgiche standardizzate e clinicamente traducibili per l'approvvigionamento di organi e tessuti. Pertanto, qui, descriviamo un protocollo ottimizzato per l'approvvigionamento del rene in un modello suino preclinico. Il recupero dei reni viene eseguito utilizzando suini di razza mista (Yorkshire cross/mix). In breve, dopo la disinfezione sterile e il drappeggio del campo chirurgico, viene eseguita un'incisione completa della linea mediana per ottenere un accesso ottimale a entrambi i reni. L'uretere, la vena renale e l'arteria vengono sezionati fino alla loro origine rispettivamente dalla vena cava inferiore e dall'aorta. Dopo la dissezione renale completa, l'uretere viene legato e tagliato distalmente. L'animale donatore viene quindi completamente eparinizzato con 100 UI per kg/peso corporeo. Successivamente, l'arteria renale viene bloccata vicino all'aorta e la vena renale viene bloccata vicino alla vena cava utilizzando una pinza vascolare Satinsky. L'innesto renale viene quindi resecato e l'arteria renale viene immediatamente incannulata sul retro. Il rene verrà quindi lavato con una soluzione di conservazione ghiacciata e conservato su ghiaccio fino alla perfusione meccanica o al trapianto. Infine, il moncone dell'arteria renale viene legato con una legatura di seta 2-0 e la vena cava viene chiusa con una sutura in polipropilene 6-0. Questa tecnica recupera i reni e simula un ambiente di donatore vivente (rene singolo) o deceduto (doppio rene). Il recupero di un singolo rene offre il vantaggio di eseguire un successivo autotrapianto. Nel modello di donatore deceduto, il sangue può essere raccolto prima dell'eutanasia inserendo gli aghi della sacca di sangue direttamente nell'aorta, dissanguando così l'animale e fornendo sangue per la perfusione meccanica ex vivo .
Introduzione
Il trapianto di rene è il trattamento ottimale per la malattia renale allo stadio terminale (ESRD), in quanto fornisce una migliore qualità della vita e risultati a lungo termine rispetto alla dialisi1. Nonostante i progressi nella conservazione degli organi, dozzine di persone muoiono ogni giorno di ESRD mentre sono in lista d'attesa per un trapianto di rene2. La perfusione meccanica è un campo in crescita che aumenta i tempi di conservazione, consentendo reti di donatori estese e un'allocazione più efficiente degli organi. Questa tecnologia consente inoltre il monitoraggio e l'ottimizzazione degli organi ex vivo, riducendo così al minimo gli effetti del danno da ischemia-riperfusione (IRI). Rispetto alle celle frigorifere statiche (SCS), è stato dimostrato che la perfusione meccanica riduce significativamente l'incidenza della funzione ritardata dell'innesto 3,4. La perfusione meccanica ha anche dimostrato la rivitalizzazione di innesti marginali, che altrimenti non avrebbero soddisfatto i criteri per il trapianto5. Nonostante i progressi tecnologici, la tecnica di conservazione più comune rimane l'SCS su ghiaccio. Ulteriori esperimenti e dati preclinici possono contribuire a rendere la perfusione meccanica un pilastro della conservazione dei reni.
Il modello suino per il trapianto di rene è ben consolidato ed è stato parte integrante dello sviluppo della tecnologia di conservazione del rene, in particolare della perfusione meccanica. A differenza dei reni unilobulari dei roditori, i reni suini e umani sono entrambi multilobulari, di dimensioni simili e condividono un'analoga anatomia arteriosa, venosa e urinaria 6,7. Pertanto, il rene suino facilita una traduzione diretta in ambito clinico, soprattutto in termini di dispositivi medici e terapie farmacologiche. Inoltre, i reni suini mostrano una fisiopatologia simile all'IRI dei reni umani8, rendendoli ideali per gli studi di conservazione dei reni.
Al fine di garantire la qualità dell'innesto e la riproducibilità dei dati, è necessario seguire tecniche chirurgiche standardizzate e clinicamente traducibili per l'approvvigionamento di organi e tessuti. Pertanto, qui, descriviamo un protocollo ottimizzato per l'approvvigionamento del rene in un modello suino preclinico. Questo protocollo consente il recupero dei reni e simula un ambiente di donatore vivente (rene singolo) o deceduto (doppio rene). Il recupero di un singolo rene offre il vantaggio di eseguire un successivo autotrapianto. Nel modello a doppio recupero renale, la raccolta del sangue prima dell'eutanasia è possibile inserendo gli aghi della sacca di sangue direttamente nell'aorta, dissanguando così l'animale e fornendo sangue per la perfusione meccanica ex vivo .
Protocollo
Tutte le procedure descritte sono state approvate dal Comitato per la cura e l'uso istituzionale della Johns Hopkins University, da un Dipartimento dell'Agricoltura degli Stati Uniti (USDA) autorizzato, dall'Office of Laboratory Animal Welfare (OLAW) e dall'Association for Assessment and Accreditation of Laboratory Animal Care (AAALAC). Gli animali sono stati mantenuti in conformità con l'Animal Welfare Act del Dipartimento dell'Agricoltura degli Stati Uniti, la Guida del National Institutes of Health per la cura e l'uso degli animali da laboratorio e la Politica del Servizio di sanità pubblica degli Stati Uniti sulla cura e l'uso umano degli animali da laboratorio.
1. Animali e stabulazione
- Per questo protocollo, utilizzare maiali Yorkshire di 3-6 mesi, clinicamente sani e di 20-40 kg (Sus scrofa domesticus), o simili.
- Ospita gli animali in recinti a maglie di catena con pavimento a doghe.
2. Procedura preoperatoria e anestesia
- Digiunare l'animale almeno 12 ore prima del tempo di sedazione.
- Somministrare simeticone orale (20 mg/kg) almeno 12 ore prima dell'intervento chirurgico e ripetere la somministrazione almeno 1 ora prima della sedazione per ridurre la dilatazione intestinale.
- Somministrare ketamina (20-30 mg/kg) e xilazina (2-3 mg/kg) in un'unica siringa per via intramuscolare per evitare iniezioni multiple.
- Trasferire il maiale nell'area di stadiazione preoperatoria. Posizionare un catetere endovenoso in una vena marginale dell'orecchio. Somministrare 3-10 mg/kg/h di soluzione salina allo 0,9% o di soluzione di Ringer lattato durante tutta la procedura.
- Una volta che il suino è stato adeguatamente sedato, posizionare un tubo endotracheale (tubo endotracheale cuffiato da 6,0-6,5 mm per animali da 20-30 kg; cuffiato da 6,5-7,0 mm per 30-40 kg) per l'erogazione dell'anestesia gassosa e della ventilazione meccanica. Se necessario, facilitare con una dose di propofol (0,8-1,66 mg/kg) per via endovenosa, somministrata per effetto.
- Rimuovere i peli sopra e intorno al sito chirurgico utilizzando un tagliaunghie, nonché uno scrub sporco del sito chirurgico, prima di spostare l'animale in sala operatoria.
- Trasferire l'animale sul tavolo operatorio. Somministrare cefazolina (20-22 mg/kg) per via endovenosa 10 minuti prima dell'inizio dell'intervento chirurgico e di nuovo ogni 90 minuti durante l'intervento intraoperatorio. Somministrare pantoprazolo (0,5-1 mg/kg) per via endovenosa all'inizio dell'intervento chirurgico.
- Somministrare un blocco locale per via sottocutanea con lidocaina (fino a 2 mg/kg) per facilitare l'aggiunta di analgesia prima dell'incisione.
- Preparare asetticamente il sito chirurgico, alternando clorexidina o betadina e etanolo o soluzione fisiologica al 70%, almeno tre volte.
- Monitora continuamente il volume dei liquidi, la frequenza cardiaca, la pressione sanguigna, la pulsossimetria, la capnografia, l'elettrocardiografia e la temperatura rettale. Registrare questi valori ogni 10-15 minuti. Utilizzare un sottoscocca riscaldato e una coperta ad aria calda per prevenire l'ipotermia.
- Prima dell'inizio dell'intervento chirurgico, confermare che l'animale si trovi all'interno del piano appropriato dell'anestesia chirurgica utilizzando una combinazione di tono mascellare, riflesso palpebrale e parametri elencati nel passaggio precedente.
3. Procedura di prelievo del rene
- Preparare l'animale per l'intervento chirurgico, seguendo i passaggi descritti nella Sezione 2.
- Dopo la disinfezione sterile e il drappeggio del campo chirurgico, eseguire una laparotomia mediana (25-30 cm) per ottenere un accesso ottimale a entrambi i reni. Inserire un divaricatore addominale standard.
- Copri il colon e l'intestino tenue con asciugamani imbevuti di soluzione salina calda. Ritrarre l'intestino sul lato destro per l'accesso al rene sinistro o sul lato sinistro per l'accesso al rene destro.
- Aprire il peritoneo sovrastante il rene e sezionarlo intorno al rene per liberare eventuali aderenze. Sezionare l'uretere fino ad ottenere 10-12 cm di lunghezza.
- Sezionare la vena renale e l'arteria fino alla loro origine rispettivamente dalla vena cava inferiore e dall'aorta.
- Dopo la dissezione renale completa, legare l'uretere distalmente con una legatura di seta 2-0 e tagliarlo prossimalmente alla legatura. Lasciare aperta l'estremità prossimale dell'uretere per consentire il drenaggio dell'urina.
- Eparinizzare l'animale con eparina per via endovenosa (100 UI/kg) e attendere 2 minuti per garantire un'adeguata eparinizzazione del rene. Questo passaggio deve essere ripetuto prima della resezione di ciascun rene.
- Bloccare l'arteria renale e la vena renale vicino all'aorta e alla vena cava inferiore, rispettivamente, con due pinze vascolari Satinsky. Rimuovere l'innesto di rene tagliando l'arteria renale e la vena vicino alle pinze.
- Incannulare immediatamente l'arteria renale con una cannula di perfusione a punta smussata da 3 mm. Lavare il rene con una soluzione ghiacciata dell'Università del Wisconsin (UW) o con la soluzione di conservazione Custodiol Istidina-triptofano-chetoglutarato (HTK).
- Rimuovere la cannula di perfusione dopo il lavaggio con UW o HTK e posizionare il rene in una sacca d'organo sterile riempita con la stessa soluzione di conservazione ghiacciata utilizzata per il lavaggio del rene. Posizionare questa sacca all'interno di una seconda sacca sterile per organi. Successivamente conservare l'organo o avviare la perfusione dell'apparecchio.
- Legare il moncone dell'arteria renale con una legatura di seta 2-0. Chiudere il moncone della vena renale con una sutura a due strati con polipropilene 6-0.
4. Procedura di prelievo del sangue
- Se la procedura è terminale e tutti gli altri interventi chirurgici sono stati eseguiti, procedere con il prelievo di sangue per la perfusione meccanica e l'eutanasia per dissanguamento.
- Ritrarre l'intestino sul lato destro e identificare l'aorta addominale infrarenale. Libera eventuali grandi aderenze o tessuto che copre il vaso.
- Inserire l'ago della sacca di raccolta del sangue direttamente nell'aorta. Appendere il sacchetto sotto l'animale per facilitarne il riempimento. Una volta che la sacca è piena (circa 450 ml di sangue), rimuovere l'ago dall'aorta e mantenere la pressione sul sito di puntura.
- Per una seconda sacca di sangue, inserire il nuovo ago 1-2 cm prossimalmente al sito di puntura precedente. Ripetere con più sacche di sangue secondo necessità, muovendosi di 1-2 cm prossimalmente con ciascun ago.
- Dopo che tutto il sangue necessario è stato raccolto, indurre l'arresto cardiaco con iniezione endovenosa di pentobarbital sodico/fenitoina sodica alla dose di almeno 78 mg/kg del componente pentobarbital. Se si teme che il pentobarbital interferisca con i successivi dosaggi del rene, utilizzare il cloruro di potassio (KCl) (75-100 mg/kg EV) come metodo alternativo di eutanasia chimica se viene somministrato ai suini in anestesia. Verificare la morte per mancanza di battito cardiaco, assenza di riflesso corneale e una significativa diminuzione della temperatura corporea.
NOTA: Gli organi e i tessuti rimanenti del maiale sacrificato possono essere utilizzati per altri scopi di ricerca o educativi in conformità con i principi delle 3R.
Risultati
Il nostro gruppo di ricerca ha una vasta esperienza di quasi 15 anni con modelli suini sia di trapianto di organi solidi che di allotrapianto composito vascolarizzato 9,10,11,12,13,14,15,16,17 . Qui, descriviamo i risultati dei nostri esperimenti di recupero del rene suino (n = 139). Abbiamo utilizzato i reni prelevati per il trapianto, la perfusione meccanica o la coltura di cellule primarie e finora non abbiamo riscontrato alcuna complicanza con questo modello di procedura chirurgica (Figura 1). Definiamo il successo del recupero del rene come un intervento chirurgico senza fallimento tecnico, nonché l'assenza di esiti avversi legati all'anatomia o alla tecnica chirurgica. Esempi dell'aspetto macroscopico di un trapianto di rene sono mostrati nella Figura 2, che rappresenta il successo della riperfusione renale tramite perfusione meccanica o trapianto.
A seconda del background formativo e della familiarità del laboratorio con i modelli suini, si consiglia di eseguire almeno uno o tre esperimenti preliminari con tutto il personale coinvolto nelle procedure. Nell'attuale serie di studi, il tempo procedurale totale medio - dall'incisione della linea mediana all'eutanasia - è stato di 88 minuti (Tabella 1). Il tempo medio dall'incisione della linea mediana al recupero di entrambi gli innesti renali è stato di 73 minuti. Oltre al supporto del personale veterinario, tra cui un veterinario e uno o due tecnici veterinari, è necessario un minimo di tre operatori chirurgici e di laboratorio aggiuntivi. A seconda del livello di esperienza, un altro assistente chirurgico e uno o due membri del personale di supporto aggiuntivi, inclusi studenti di dottorato o tecnici di laboratorio, possono essere raccomandati per garantire l'efficienza del prelievo dell'innesto, il lavaggio degli organi e la raccolta del sangue al fine di ridurre al minimo il tempo di ischemia calda e il rischio di coagulazione durante la raccolta del sangue.
Come nell'uomo, sono possibili variazioni anatomiche nei reni suini (Figura 3, Tabella 2). L'anatomia standard - un'arteria renale e una vena renale - è stata osservata nel 64% dei reni. Le variazioni più comuni erano un'arteria e due vene (26%), due arterie e una vena (5%), un'arteria e tre vene (4%) e due arterie e due vene (1%). Circa la metà (46%) dei suini aveva un'anatomia tipica bilaterale. L'anatomia atipica è stata osservata sia unilateralmente (22% atipico a sinistra, 14% atipico a destra) che bilateralmente (19%). Quando si sceglie un rene per il trapianto, si consiglia di evitare qualsiasi anatomia atipica. Se entrambi i reni hanno due vene, optare per il rene con vene più lunghe e ricostruire sul tavolo posteriore a un singolo lume prima del trapianto. Quando si sceglie un rene per la perfusione meccanica, l'anatomia venosa è meno importante se la macchina utilizza il drenaggio venoso in pool. Si consiglia di evitare l'anatomia a due arterie per la perfusione con macchina a pompa singola, poiché le differenze di resistenza tra le arterie creeranno una circolazione irregolare.

Figura 1: Riepilogo dei tassi di recupero del rene riusciti per esperimenti di trapianto, perfusione meccanica e coltura cellulare primaria. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Esempi di aspetto macroscopico del trapianto di rene. (A) Rene destro nativo in situ. (B) Innesto di rene dopo il lavaggio con soluzione di conservazione ghiacciata. (C) Innesto di rene dopo riperfusione meccanica. (D) Innesto di rene dopo trapianto e riperfusione. Clicca qui per visualizzare una versione più grande di questa figura.
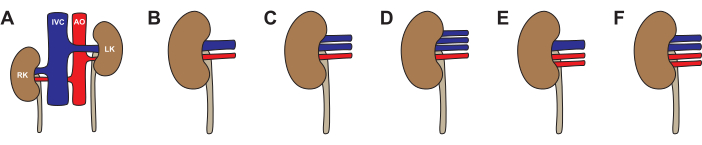
Figura 3: Variazioni nell'anatomia del rene di maiale. (A,B) Anatomia tipica con un'arteria renale e una vena renale per ogni rene. (C) Anatomia atipica con un'arteria renale e due vene renali. (D) Anatomia atipica con un'arteria renale e tre vene renali. (E) Anatomia atipica con due arterie renali e una vena renale. (F) Anatomia atipica con due arterie renali e due vene renali. Abbreviazioni utilizzate: RK- rene destro; IVC- vena cava inferiore; AO- aorta; LK- rene sinistro. Clicca qui per visualizzare una versione più grande di questa figura.
| Compito o passaggio sperimentale | Tempo medio (min) | Chirurgo | Assistenza chirurgica | Veterinario | Tecnico Veterinario | Ricercatore | Numero totale di personale |
| Pre-operatorio | 60 | 1 | 2 | 1 | 4 | ||
| Chirurgia di recupero dell'innesto (un rene) | 41 | 1 | 1 | 1 | 1 | 1 | 5 |
| Chirurgia di recupero dell'innesto (entrambi i reni) | 73 | 1 | 1 | 1 | 1 | 1 | 5 |
| Arrossamento degli organi (per rene) | 6 | 1 | 1 | 1 | 1 | 4 | |
| Raccolta del sangue | 15 | 1 | 1 | 1 | 1 | 1 | 5 |
| Eutanasia | N/A | 1 | 1 | 2 |
Tabella 1: Risorse umane e requisiti di tempo per l'esecuzione di interventi chirurgici di approvvigionamento di rene suino.
| Anatomia renale bilaterale | Numero di suini | Percentuale di suini |
| Entrambi tipici | 17 | 46% |
| Destra tipica, sinistra atipica | 8 | 22% |
| Sinistra Tipica, Destra Atipica | 5 | 14% |
| Entrambi atipici | 7 | 19% |
| 37 | 100% | |
| Anatomia renale unilaterale | Numero di reni | Percentuale di reni |
| 1 arteria, 1 vena | 47 | 64% |
| 1 arteria, 2 vene | 19 | 26% |
| 1 arteria, 3 vene | 3 | 4% |
| 2 arterie, 1 vena | 4 | 5% |
| 2 arterie, 2 vene | 1 | 1% |
| 74 | 100% |
Tabella 2: Riepilogo delle variazioni anatomiche riscontrate nei reni di maiale.
Discussione
Il modello suino per il trapianto di rene è stato fondamentale per lo sviluppo e l'ottimizzazione della tecnologia di perfusione meccanica. Date le somiglianze anatomiche, immunologiche e fisiopatologiche con i reni umani 6,7,8, i reni suini offrono una traduzione facilitata ai test clinici e alla pratica.
Il modello di approvvigionamento del rene suino può essere utilizzato per una varietà di esperimenti preclinici. In un modello da donatore vivente, un singolo rene può essere recuperato e conservato, con successivo autotrapianto e rimozione del rene controlaterale18,19. In un modello di donatore deceduto, entrambi i reni possono essere prelevati e utilizzati per studi di conservazione, studi di perfusione meccanica o allotrapianto. La procedura di raccolta del sangue descritta nella Sezione 4 è fondamentale per gli studi di perfusione meccanica che utilizzano un perfusato contenente sangue intero o emoderivati, in particolare la perfusione meccanica estesa che richiede lo scambio di perfusato 20,21,22. Con l'incannulamento diretto dell'aorta, si ottiene un flusso di sangue costante e rapido, dissanguando completamente l'animale in un tempo minimo. È possibile riempire più sacche di sangue inserendo ciascun ago prossimalmente al precedente, riducendo così al minimo le perdite di sangue dal sito di puntura precedente.
Sia la perfusione meccanica ipotermica (HMP) che la perfusione meccanica normotermica (NMP) sono metodi emergenti per la conservazione e l'ottimizzazione dei reni. Rispetto alla SCS, sia l'HMP che l'NMP hanno dimostrato di migliorare gli esiti e ridurre l'incidenza della funzione ritardata del trapianto 3,4,5. Sono necessarie ulteriori ricerche per determinare il metodo ottimale, ma alcuni studi preclinici hanno indicato che l'NMP fornisce risultati migliori23. La perfusione meccanica offre l'opportunità di testare la vitalità e la previsione di innesti marginali21, nonché il potenziale per riparare innesti precedentemente inutilizzabili24. Ulteriori studi hanno dimostrato che la perfusione meccanica è un luogo per la somministrazione di farmaci e la bioingegneria, tra cui la somministrazione di cellule staminali25 e la ricellularizzazione di un rene suino con cellule endoteliali umane26. Lo xenotrapianto di rene da maiale a umano è una recente scoperta27,28 e ulteriori progressi potrebbero risiedere nella perfusione meccanica.
Le variazioni nell'anatomia renale sono un ostacolo inevitabile quando si eseguono recuperi renali multipli. Un rene con due arterie renali è una variante rara. Nella nostra esperienza, il rene controlaterale ha un'anatomia arteriosa normale e può essere utilizzato al posto di quello atipico. Le anomalie venose sono più comuni di quelle arteriose ma anche più suscettibili di ricostruzione. Le potenziali variazioni e le possibilità di ricostruzione dell'anatomia venosa sono state precedentemente descritte19,29 e vanno oltre lo scopo di questo articolo.
Nonostante la sua efficacia, il protocollo di cui sopra è limitato dal tempo e dalle risorse necessarie per completare con successo un complesso intervento chirurgico su animali di grossa taglia, compreso il personale, le attrezzature chirurgiche, la stabulazione degli animali e le cure pre e post-operatorie. Inoltre, un rene suino giovane e sano è un modello limitato per valutare i donatori adulti più anziani, i donatori con malattia renale sottostante e i donatori con comorbidità tra cui ipertensione e diabete.
Questo protocollo ottimizzato e riproducibile per l'approvvigionamento di rene suino consente la ricerca preclinica traducibile nel trapianto, nella conservazione e nella perfusione meccanica del rene.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare i numerosi tecnici veterinari della Johns Hopkins University School of Medicine per la loro assistenza tecnica. Vorremmo anche esprimere la nostra gratitudine alle dottoresse Jessica Izzi e Amanda Maxwell e ai numerosi residenti veterinari, tra cui le dottoresse Mallory Brown, Jessica Plunkard e Alexis Roach per aver fornito ai nostri animali un'eccellente assistenza clinica e supervisione veterinaria. Infine, vorremmo ringraziare tutti i membri del laboratorio di allotrapianto composito vascolarizzato (VCA) presso la Johns Hopkins School of Medicine che hanno assistito a qualsiasi titolo con l'approvvigionamento di rene o altre procedure di approvvigionamento di organi eseguite nel nostro laboratorio. Questo lavoro è stato sostenuto dal National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK) grant R44DK136396.
Materiali
| Name | Company | Catalog Number | Comments |
| 70% Ethanol Solution | Fisher Scientific | 04-355-122 | |
| Adson Tissue ForceA2:D30ps, 4.75", 1 x 2 Teeth | Wexler Surgical | FL0081.1 | |
| Bair Hugger Animal Health Overbody Blanket | 3M | 53777 | |
| Bair Hugger Warming Unit | 3M | 77500 | |
| Balfour Abdominal Retractor w/ Fixed Side Blades, 4" Deep, 10" Maximum Spread | MPM Medical Supply | 124-7017 | |
| Betadine Solution (5% Providone-iodine) | MWI Animal Health | NDC-67618-155-01 | |
| Cefazolin for Injection, USP | MWI Animal Health | NDC-63323-237-10 | |
| Chlorhexidine Solution | MWI Animal Health | NDC-30798-624-31 | |
| Custodial HTK Organ Preservation Solution | Essential Pharmaceuticals | 25767073545 | |
| DeBakey Tissue Forceps, 7.75", 2 mm Tips | Wexler Surgical | FL0789.1 | |
| EUTHASOL (pentobarbital sodium and phenytoin sodium) | Virbac | NDC-051311-050-01 | |
| Heparin Sodium Injection, USP | MWI Animal Health | NDC-71288-402-10 | |
| Hot Dog Temperature Management Controller | Augustine Surgical Inc. | WC71V | |
| Hot Dog Veterinary Underbody Warming Mattress | Augustine Surgical Inc. | V106 | |
| Invisishield Isolation Bag, 20" x 20" | Medline | DYNJSD1003 | |
| Jacobson Micro Needle Holder, Straight Jaws, Round Handle, 7.25" | Wexler Surgical | NL0729.11 | |
| Ketamine Hydrochloride Injectable Solution | NexGen Pharmaceuticals | NC-0256 | |
| Lap Sponges 18" x 18" | Medline | MDS231318LF | |
| Metzenbaum Dissection Scissors, 7" Curved | Wexler Surgical | SL5011.1S | |
| Non-Conductive Suction Tubing with Scalloped Connectors, 1/4" x 10' | Medline | DYND50251 | |
| Pantoprazole Sodium for Injection | MWI Animal Health | NDC-55150-202-00 | |
| Perfusion Cannula, Free-Flow, 3 mm Blunt Tip | MED Alliance Solutions | PER-3003S | |
| Rigid Bulb Tip Yankauer | Medline | DYND50130 | |
| Satinsky Clamp, 30 mm Angled DeBakey Atraumatic Jaws, Curved Shanks, 10" | Wexler Surgical | AL2150.1 | |
| Scalpel Handle #3 | World Precision Instruments | 500236 | |
| Servator B UW (University of Wisconsin) | Global Transplant Solutions | JFISERB10A r2 | |
| Single Collection Unit Prefilled CPDA-1, 450 mL | Jorgensen Laboratories | JO520 | |
| Sofsilk Suture Tie, 2-0, Black, 18" | Covidien | S-195 | |
| Surgical Scalpel Blade No. 10 | World Precision Instruments | 500239 | |
| Surgipro II Suture, 6-0, Blue, 30", Double Armed, CV-22 Needle | Covidien | VP-733-X | |
| Three-Quarter Surgical Drape | Medline | DYNJP2414 | |
| Valleylab Electrosurgical Pencil with Stainless Steel Electrodes | Covidien | CVNE2516H | |
| Valleylab Force FXc Electrosurgical Generator | Covidien | MFI-MDT-FORCE-FXC | |
| Valleylab Polyhesive Adult Patient Return Electrode | Covidien | E7507-SD | |
| Xylazine Hydrochloride Injectable Solution | NexGen Pharmaceuticals | NC-0334 |
Riferimenti
- Merion, R. M., et al. Deceased-donor characteristics and the survival benefit of kidney transplantation. JAMA. 294 (21), 2726-2733 (2005).
- Lentine, K. L., et al. OPTN/SRTR 2022 annual data report: Kidney. Am J Transplant. 24 (2S1), S19-S118 (2024).
- Hosgood, S. A., et al. Normothermic machine perfusion versus static cold storage in donation after circulatory death kidney transplantation: a randomized controlled trial. Nat Med. 29 (6), 1511-1519 (2023).
- Malinoski, D., et al. Hypothermia or machine perfusion in kidney donors. N Engl J Med. 388 (5), 418-426 (2023).
- Hamar, M., Selzner, M. Ex vivo machine perfusion for kidney preservation. Curr Opin Organ Transplant. 23 (3), 369-374 (2018).
- Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. Pig kidney: anatomical relationships between the intrarenal arteries and the kidney collecting system. Applied study for urological research and surgical training. J Urol. 172 (5 Pt 1), 2077-2081 (2004).
- Bagetti Filho, H. J., Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. Pig kidney: anatomical relationships between the renal venous arrangement and the kidney collecting system. J Urol. 179 (4), 1627-1630 (2008).
- Giraud, S., et al. Contribution of large pig for renal ischemia-reperfusion and transplantation studies: the preclinical model. J Biomed Biotechnol. 2011 (21), 532127(2011).
- Girard, A. O., et al. Hickman catheter use for long-term vascular access in a preclinical swine model. J Vis Exp. (193), e65221(2023).
- Gerling, K. A., et al. A novel sutureless anastomotic device in a swine model: A proof of concept study. J Surg Res. 291, 116-123 (2023).
- Etra, J. W., et al. Latissimus Dorsi myocutaneous flap procedure in a swine model. J Invest Surg. 34 (12), 1289-1296 (2021).
- Etra, J. W., et al. A skin rejection grading system for vascularized composite allotransplantation in a preclinical large animal model. Transplantation. 103 (7), 1385-1391 (2019).
- Al-Rakan, M., et al. Ancillary procedures necessary for translational research in experimental craniomaxillofacial surgery. J Craniofac Surg. 25 (6), 2043-2050 (2014).
- Santiago, G. F., et al. Establishing cephalometric landmarks for the translational study of Le Fort-based facial transplantation in Swine: enhanced applications using computer-assisted surgery and custom cutting guides. Plast Reconstr Surg. 133 (5), 1138-1151 (2014).
- Ibrahim, Z., et al. Cutaneous collateral axonal sprouting re-innervates the skin component and restores sensation of denervated Swine osteomyocutaneous alloflaps. PLoS One. 8 (10), e77646(2013).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. J Vis Exp. (80), e50475(2013).
- Wachtman, G. S., et al. Biologics and donor bone marrow cells for targeted immunomodulation in vascularized composite allotransplantation: a translational trial in swine. Transplant Proc. 43 (9), 3541-3544 (2011).
- Kaths, J. M., et al. Heterotopic renal autotransplantation in a porcine model: A step-by-step protocol. J Vis Exp. 108, e53765(2016).
- Liu, W. J., et al. Orthotopic kidney auto-transplantation in a porcine model using 24 hours organ preservation and continuous telemetry. J Vis Exp. (162), e61591(2020).
- Steinhauser, C., et al. Assessment of hemodynamic and blood parameters that may reflect macroscopic quality of porcine kidneys during normothermic machine perfusion using whole blood. World J Urol. 42 (1), 471(2024).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for graft quality assessment prior to transplantation. Am J Transplant. 18 (3), 580-589 (2018).
- Urcuyo, D., et al. Development of a prolonged warm ex vivo perfusion model for kidneys donated after cardiac death. Int J Artif Organs. 40 (6), 265-271 (2017).
- Vallant, N., et al. A comparison of pulsatile hypothermic and normothermic ex vivo machine perfusion in a porcine kidney model. Transplantation. 105 (8), 1760-1770 (2021).
- Hosgood, S. A., Saeb-Parsy, K., Hamed, M. O., Nicholson, M. L. Successful transplantation of human kidneys deemed untransplantable but resuscitated by ex vivo normothermic machine perfusion. Am J Transplant. 16 (11), 3282-3285 (2016).
- Vallant, N., Wolfhagen, N., Sandhu, B., Hamaoui, K., Papalois, V. Delivery of mesenchymal stem cells during hypothermic machine perfusion in a translational kidney perfusion study. Int J Mol Sci. 25 (9), 5038(2024).
- Uzarsk, J. S., et al. Sustained in vivo perfusion of a re-endothelialized tissue engineered kidney graft in a human-scale animal model. Front Bioeng Biotechnol. 11, 1184408(2023).
- Anand, R. P., et al. Design and testing of a humanized porcine donor for xenotransplantation. Nature. 622 (7982), 393-401 (2023).
- Pan, W., et al. Cellular dynamics in pig-to-human kidney xenotransplantation. Med. 5 (8), 1016-1029 (2024).
- Golriz, M., et al. Pig kidney transplantation: an up-to- date guideline. Eur Surg Res. 49 (3-4), 121-129 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon