Method Article
Obtención de riñón en un modelo preclínico de animales grandes
* Estos autores han contribuido por igual
En este artículo
Resumen
En este trabajo se presenta un protocolo que detalla un modelo quirúrgico para la obtención de riñón en un modelo preclínico porcino para su posterior perfusión o trasplante con máquina.
Resumen
La perfusión mecánica ha evolucionado como una estrategia viable para la evaluación, el seguimiento, el tratamiento y la optimización de órganos ex vivo , así como para prolongar los tiempos de conservación. Los modelos de animales grandes han sido primordiales para el desarrollo y la optimización de estas tecnologías. Sin embargo, para garantizar la calidad del injerto y la reproducibilidad de los datos, se deben seguir técnicas quirúrgicas estandarizadas y clínicamente traducibles para la obtención de órganos y tejidos. Por lo tanto, aquí describimos un protocolo optimizado para la obtención de riñón en un modelo preclínico de cerdos. La recuperación del riñón se realiza utilizando cerdos de raza mixta (Yorkshire cross/mix). Brevemente, después de la desinfección estéril y el cubredo del campo quirúrgico, se realiza una incisión completa en la línea media para obtener un acceso óptimo a ambos riñones. El uréter, la vena renal y la arteria se disecan hasta su origen desde la vena cava inferior y la aorta, respectivamente. Después de la disección renal completa, el uréter se liga y se corta distalmente. A continuación, el animal donante se hepariniza completamente con 100 UI por kg/peso corporal. A continuación, la arteria renal se pinza cerca de la aorta y la vena renal se pinza cerca de la vena cava con una pinza vascular de Satinsky. A continuación, se reseca el injerto de riñón y se canulada inmediatamente la arteria renal. A continuación, se enjuagará el riñón con una solución de conservación helada y se almacenará en hielo hasta la perfusión mecánica o el trasplante. Por último, el muñón de la arteria renal se liga con una ligadura de seda 2-0 y la vena cava se cierra con una sutura de polipropileno 6-0. Esta técnica recupera riñones y simula un entorno de donante vivo (riñón único) o fallecido (riñón doble). La recuperación de un solo riñón ofrece la ventaja de realizar un autotrasplante posterior. En el modelo de donante fallecido, la sangre puede extraerse antes de la eutanasia insertando agujas de bolsa de sangre directamente en la aorta, desangrando así al animal y proporcionando sangre para la perfusión ex vivo con máquina.
Introducción
El trasplante de riñón es el tratamiento óptimo para la enfermedad renal terminal (IRT), ya que proporciona una mejor calidad de vida y resultados a largo plazo en comparación con la diálisis1. A pesar de los avances en la preservación de órganos, docenas de personas mueren cada día de ESRD mientras están en la lista de espera para un trasplante de riñón. La perfusión mecánica es un campo en crecimiento que aumenta los tiempos de conservación, lo que permite ampliar las redes de donantes y una asignación más eficiente de los órganos. Esta tecnología también permite la monitorización y optimización de órganos ex vivo, minimizando así los efectos de la lesión por isquemia-reperfusión (IRI). En comparación con el almacenamiento en frío estático (SCS), se ha demostrado que la perfusión de la máquina reduce significativamente la incidencia de retraso en la función del injerto 3,4. La perfusión mecánica también ha demostrado la revitalización de injertos marginales, que de otro modo no habrían cumplido con los criterios para el trasplante5. A pesar de los avances tecnológicos, la técnica de conservación más común sigue siendo el SCS en hielo. Otros experimentos y datos preclínicos pueden ayudar a que la perfusión con máquina sea un pilar de la preservación del riñón.
El modelo porcino para el trasplante de riñón está bien establecido y ha sido parte integral del desarrollo de la tecnología de preservación del riñón, especialmente la perfusión mecánica. A diferencia de los riñones unilobulillares de roedores, los riñones porcinos y humanos son multilobulares, de tamaño similar y comparten una anatomía arterial, venosa y urinaria análoga 6,7. Por lo tanto, el riñón porcino facilita una traducción directa al entorno clínico, especialmente en términos de dispositivos médicos y terapias farmacológicas. Además, los riñones porcinos muestran una fisiopatología de IRI similar a la de los riñones humanos8, lo que los hace ideales para estudios de preservación renal.
Con el fin de garantizar la calidad del injerto y la reproducibilidad de los datos, se deben seguir técnicas quirúrgicas estandarizadas y clínicamente traducibles para la obtención de órganos y tejidos. Por lo tanto, aquí describimos un protocolo optimizado para la obtención de riñón en un modelo preclínico de cerdos. Este protocolo permite la recuperación de riñones y simula un entorno de donante vivo (riñón único) o fallecido (riñón doble). La recuperación de un solo riñón ofrece la ventaja de realizar un autotrasplante posterior. En el modelo de recuperación renal dual, la extracción de sangre antes de la eutanasia es posible mediante la inserción de agujas de bolsa de sangre directamente en la aorta, exanguinando así al animal y proporcionando sangre para la perfusión ex vivo con máquina.
Protocolo
Todos los procedimientos descritos fueron aprobados por el Comité de Cuidado y Uso Institucional de la Universidad Johns Hopkins, una institución autorizada por el Departamento de Agricultura de los Estados Unidos (USDA), asegurada por la Oficina de Bienestar de los Animales de Laboratorio (OLAW) y acreditada por la Asociación para la Evaluación y Acreditación del Cuidado de Animales de Laboratorio (AAALAC). Los animales se mantuvieron de acuerdo con la Ley de Bienestar Animal del Departamento de Agricultura de los Estados Unidos, la Guía para el Cuidado y Uso de Animales de Laboratorio de los Institutos Nacionales de Salud y la Política del Servicio de Salud Pública de los Estados Unidos sobre el Cuidado y Uso Humanitario de los Animales de Laboratorio.
1. Animales y alojamiento
- Utilice cerdos Yorkshire (Sus scrofa domesticus) de 3 a 6 meses de edad, clínicamente sanos y de 20 a 40 kg, o similares, para este protocolo.
- Aloje a los animales en cercas de alambre con piso de listones.
2. Procedimiento preoperatorio y anestesia
- Ayunar al animal al menos 12 h antes del tiempo de sedación.
- Administrar simeticona oral (20 mg/kg) al menos 12 h antes de la cirugía y repetir la dosis al menos 1 h antes de la sedación para reducir la dilatación intestinal.
- Administrar ketamina (20-30 mg/kg) y xilacina (2-3 mg/kg) en una sola jeringa por vía intramuscular para evitar múltiples inyecciones.
- Transfiera al cerdo al área de preparación preoperatoria. Colocar un catéter intravenoso en una vena marginal del oído. Administrar 3-10 mg/kg/h de solución salina al 0,9% o de Ringer lactato durante todo el procedimiento.
- Una vez que el cerdo esté adecuadamente sedado, colocar un tubo endotraqueal (tubo endotraqueal con manguito de 6,0-6,5 mm para animales de 20-30 kg; 6,5-7,0 mm con manguito para 30-40 kg) para la administración de anestesia gaseosa y ventilación mecánica. Si es necesario, facilitar con una dosis de propofol (0,8-1,66 mg/kg) por vía intravenosa, administrada al efecto.
- Retire el pelo que se encuentra en el sitio quirúrgico y lo rodea con una maquinilla, así como un limpiador sucio del sitio quirúrgico, antes de trasladar al animal al quirófano.
- Transfiera el animal a la mesa de operaciones. Administrar cefazolina (20-22 mg/kg) por vía intravenosa 10 min antes del inicio de la cirugía y de nuevo cada 90 min intraoperatoriamente. Administrar pantoprazol (0,5-1 mg/kg) por vía intravenosa al inicio de la cirugía.
- Administrar un bloqueo local por vía subcutánea con lidocaína (hasta 2 mg/kg) para facilitar la adición de analgesia antes de la incisión.
- Prepare asépticamente el sitio quirúrgico, alternando entre clorhexidina o betadine y etanol al 70% o solución salina, al menos tres veces.
- Controle continuamente el volumen de líquidos, la frecuencia cardíaca, la presión arterial, la oximetría de pulso, la capnografía, la electrocardiografía y la temperatura rectal. Registre estos valores cada 10-15 minutos. Use una almohadilla térmica para la parte inferior del cuerpo y una manta de aire caliente para prevenir la hipotermia.
- Antes del inicio de la cirugía, confirme que el animal se encuentra dentro del plano apropiado de anestesia quirúrgica utilizando una combinación de tono de mandíbula, reflejo palpebral y parámetros enumerados en el paso anterior.
3. Procedimiento de extracción de riñón
- Preparar al animal para la cirugía, siguiendo los pasos descritos en la sección 2.
- Después de la desinfección estéril y el paño del campo quirúrgico, realizar una laparotomía mediana (25-30 cm) para obtener un acceso óptimo a ambos riñones. Inserte un retractor abdominal estándar.
- Cubra el colon y el intestino delgado con toallas empapadas en solución salina tibia. Retraiga los intestinos hacia el lado derecho para acceder al riñón izquierdo o hacia el lado izquierdo para acceder al riñón derecho.
- Abra el peritoneo que recubre el riñón y diseccione alrededor del riñón para liberar cualquier adherencia. Diseccionar el uréter hasta obtener 10-12 cm de longitud.
- Diseccionar la vena y la arteria renal hasta su origen desde la vena cava inferior y la aorta, respectivamente.
- Después de la disección renal completa, atar el uréter distalmente con una ligadura de seda 2-0 y cortar proximalmente a la ligadura. Deje abierto el extremo proximal del uréter para permitir el drenaje de la orina.
- Heparinizar al animal con heparina intravenosa (100 UI/kg) y esperar 2 min para asegurar una heparinización adecuada del riñón. Este paso debe repetirse antes de la resección de cada riñón.
- Pinzar la arteria renal y la vena renal cerca de la aorta y la vena cava inferior, respectivamente, con dos pinzas vasculares de Satinsky. Retire el injerto de riñón cortando la arteria renal y la vena cerca de las pinzas.
- Cánula inmediata de la arteria renal con una cánula de perfusión de punta roma de 3 mm. Enjuague el riñón con una solución helada de la Universidad de Wisconsin (UW) o una solución de conservación de custodiol histidina-triptófano-cetoglutarate (HTK).
- Retire la cánula de perfusión después de enjuagar con UW o HTK y coloque el riñón en una bolsa estéril llena de la misma solución de conservación helada que se usó para lavar el riñón. Coloque esta bolsa dentro de una segunda bolsa estéril para órganos. Posteriormente almacenar el órgano o iniciar la máquina de perfusión.
- Ligue el muñón de la arteria renal con una ligadura de seda 2-0. Cierre el muñón de la vena renal con una sutura continua de dos capas con polipropileno 6-0.
4. Procedimiento de extracción de sangre
- Si el procedimiento es terminal y se han realizado todas las demás intervenciones quirúrgicas, se procede a la extracción de sangre para la perfusión mecánica y a la eutanasia por exanguinación.
- Retraiga los intestinos hacia el lado derecho e identifique la aorta abdominal infrarrenal. Libere cualquier adherencia grande o tejido que cubra el vaso.
- Inserte la aguja de la bolsa de recolección de sangre directamente en la aorta. Cuelga la bolsa debajo del animal para facilitar el llenado. Una vez que la bolsa esté llena (aproximadamente 450 ml de sangre), retire la aguja de la aorta y mantenga la presión en el sitio de la punción.
- Para una segunda bolsa de sangre, inserte la nueva aguja 1-2 cm proximalmente al sitio de punción anterior. Repita con varias bolsas de sangre según sea necesario, moviendo 1-2 cm proximalmente con cada aguja.
- Una vez que se haya recolectado toda la sangre necesaria, induzca un paro cardíaco con inyección intravenosa de pentobarbital sódico/fenitoína sódica a una dosis de al menos 78 mg/kg del componente pentobarbital. Si existe la preocupación de que el pentobarbital interfiera con las pruebas posteriores del riñón, utilice cloruro de potasio (KCl) (75-100 mg/kg IV) como método químico alternativo de eutanasia si se administra a cerdos bajo anestesia. Verificar la muerte por falta de latidos cardíacos, ausencia de reflejo corneal y una disminución significativa de la temperatura corporal.
NOTA: Los órganos y tejidos restantes del cerdo sacrificado se pueden utilizar para otros fines de investigación o educativos de acuerdo con los principios de las 3R.
Resultados
Nuestro grupo de investigación tiene una amplia experiencia de casi 15 años con modelos porcinos tanto de trasplante de órganos sólidos como de alotrasplante compuesto vascularizado 9,10,11,12,13,14,15,16,17 . Aquí, describimos los resultados de nuestros experimentos de recuperación de riñón porcino (n = 139). Hemos utilizado los riñones obtenidos para trasplante, perfusión mecánica o cultivo primario de células y hasta ahora no hemos experimentado ninguna complicación con este modelo de procedimiento quirúrgico (Figura 1). Definimos la recuperación renal exitosa como una cirugía sin fracaso técnico, así como la ausencia de resultados adversos relacionados con la anatomía o la técnica quirúrgica. En la Figura 2 se muestran ejemplos de la apariencia macroscópica de un injerto renal, que representa una reperfusión renal exitosa a través de la perfusión mecánica o el trasplante.
Dependiendo de la formación y de la familiaridad del laboratorio con los modelos porcinos, recomendamos realizar al menos uno a tres experimentos preliminares con todo el personal involucrado en los procedimientos. En el conjunto actual de estudios, el tiempo total promedio del procedimiento, desde la incisión en la línea media hasta la eutanasia, fue de 88 minutos (Tabla 1). El tiempo promedio desde la incisión en la línea media hasta la extracción de ambos injertos renales fue de 73 min. Además del apoyo del personal veterinario, incluido un veterinario y uno o dos técnicos veterinarios, se requiere un mínimo de tres miembros adicionales del personal quirúrgico y de laboratorio. Dependiendo del nivel de experiencia, se puede recomendar otro asistente quirúrgico y uno o dos miembros del personal de apoyo adicionales, incluidos estudiantes de doctorado o técnicos de laboratorio, para garantizar la eficiencia con la extracción del injerto, el lavado de órganos y la extracción de sangre para minimizar el tiempo de isquemia caliente y el riesgo de coagulación durante la extracción de sangre.
Al igual que en los humanos, en los riñones porcinos son posibles variaciones anatómicas (Figura 3, Tabla 2). La anatomía estándar (una arteria renal y una vena renal) se observó en el 64% de los riñones. Las variaciones más comunes fueron una arteria y dos venas (26%), dos arterias y una vena (5%), una arteria y tres venas (4%) y dos arterias y dos venas (1%). Aproximadamente la mitad (46%) de los cerdos tenían una anatomía típica bilateral. La anatomía atípica se observó tanto unilateralmente (22% atípica a la izquierda, 14% atípica a la derecha) como bilateral (19%). A la hora de elegir un riñón para trasplante, recomendamos evitar cualquier anatomía atípica. Si ambos riñones tienen dos venas, opte por el riñón con venas más largas y reconstruya en la mesa posterior a un solo lumen antes del trasplante. Al elegir un riñón para la perfusión con máquina, la anatomía venosa es menos importante si la máquina utiliza drenaje venoso agrupado. Recomendamos evitar la anatomía de dos arterias para la perfusión de una sola bomba, ya que las diferencias de resistencia entre las arterias crearán una circulación desigual.

Figura 1: Resumen de las tasas de recuperación exitosa de riñón para trasplante, perfusión mecánica y experimentos de cultivo celular primario. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Ejemplos de aspecto macroscópico del injerto renal. (A) Riñón derecho nativo in situ. (B) Injerto de riñón después de lavarlo con una solución de conservación helada. (C) Injerto de riñón después de la reperfusión con máquina. (D) Injerto de riñón después del trasplante y la reperfusión. Haga clic aquí para ver una versión más grande de esta figura.
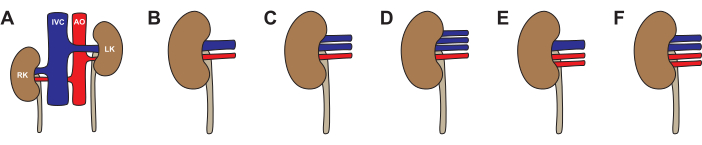
Figura 3: Variaciones en la anatomía del riñón de cerdo. (A,B) Anatomía típica con una arteria renal y una vena renal para cada riñón. (C) Anatomía atípica con una arteria renal y dos venas renales. (D) Anatomía atípica con una arteria renal y tres venas renales. (E) Anatomía atípica con dos arterias renales y una vena renal. (F) Anatomía atípica con dos arterias renales y dos venas renales. Abreviaturas utilizadas: RK- riñón derecho; IVC- vena cava inferior; AO- aorta; LK- riñón izquierdo. Haga clic aquí para ver una versión más grande de esta figura.
| Tarea o paso experimental | Tiempo medio (min) | Cirujano | Asistencia quirúrgica | Veterinario | Técnico Veterinario | Investigador | Número total de personal |
| Preoperatorio | 60 | 1 | 2 | 1 | 4 | ||
| Cirugía de recuperación de injertos (un riñón) | 41 | 1 | 1 | 1 | 1 | 1 | 5 |
| Cirugía de extracción de injertos (ambos riñones) | 73 | 1 | 1 | 1 | 1 | 1 | 5 |
| Lavado de órganos (por riñón) | 6 | 1 | 1 | 1 | 1 | 4 | |
| Recolección de sangre | 15 | 1 | 1 | 1 | 1 | 1 | 5 |
| Eutanasia | N/A | 1 | 1 | 2 |
Tabla 1: Recursos humanos y tiempo requerido para la realización de la cirugía de procuración de riñón porcino.
| Anatomía renal bilateral | Número de cerdos | Porcentaje de cerdos |
| Ambas características | 17 | 46% |
| Derecha típica, izquierda atípica | 8 | 22% |
| Izquierda típica, derecha atípica | 5 | 14% |
| Ambos atípicos | 7 | 19% |
| 37 | 100% | |
| Anatomía renal unilateral | Número de riñones | Porcentaje de riñones |
| 1 arteria, 1 vena | 47 | 64% |
| 1 arteria, 2 venas | 19 | 26% |
| 1 arteria, 3 venas | 3 | 4% |
| 2 arterias, 1 vena | 4 | 5% |
| 2 arterias, 2 venas | 1 | 1% |
| 74 | 100% |
Tabla 2: Resumen de las variaciones anatómicas encontradas en los riñones de cerdo.
Discusión
El modelo porcino para el trasplante de riñón ha sido vital para el desarrollo y la optimización de la tecnología de perfusión mecánica. Dadas las similitudes anatómicas, inmunológicas y fisiopatológicas con los riñones humanos 6,7,8, los riñones porcinos ofrecen una traducción facilitada a las pruebas clínicas y a la práctica.
El modelo de obtención de riñón porcino se puede utilizar para una variedad de experimentos preclínicos. En un modelo de donante vivo, se puede recuperar y preservar un solo riñón, con posterior autotrasplante y extirpación del riñón contralateral18,19. En un modelo de donante fallecido, se pueden obtener ambos riñones y utilizarlos para estudios de preservación, estudios de perfusión con máquinas o alotrasplantes. El procedimiento de extracción de sangre descrito en la Sección 4 es clave para los estudios de perfusión con máquina que utilizan una perfusión que contiene sangre total o productos sanguíneos, especialmente la perfusión prolongada con máquina que requiere el intercambio de perfusión 20,21,22. Mediante la canulación directa de la aorta se obtiene un flujo sanguíneo constante y rápido, desangrando completamente al animal en un tiempo mínimo. Se pueden llenar varias bolsas de sangre insertando cada aguja proximalmente a la anterior, minimizando así la fuga de sangre del sitio de punción anterior.
Tanto la máquina de perfusión hipotérmica (HMP) como la máquina de perfusión normotérmica (NMP) son métodos emergentes para la preservación y optimización del riñón. En comparación con el SCS, se ha demostrado que tanto la HMP como la NMP mejoran los resultados y disminuyen la incidencia de retraso en la función del injerto 3,4,5. Se necesita más investigación para determinar el método óptimo, pero algunos estudios preclínicos han indicado que la NMP proporciona mejores resultados23. La perfusión con máquina ofrece una oportunidad para realizar pruebas de viabilidad y predicción de injertos marginales21, así como el potencial para reparar injertos previamente inutilizables24. Estudios adicionales han demostrado que la perfusión mecánica es un lugar para la administración de fármacos y la bioingeniería, incluida la administración de células madre25 y la recelularización de un riñón porcino con células endoteliales humanas26. El xenotrasplante de riñón de cerdo a humano es un avance reciente27,28, y otros avances pueden residir en la perfusión mecánica.
Las variaciones en la anatomía renal son un obstáculo inevitable cuando se realizan recuperaciones renales múltiples. Un riñón con dos arterias renales es una variante poco común. En nuestra experiencia, el riñón contralateral tiene una anatomía arterial normal y se puede utilizar en lugar del atípico. Las anomalías venosas son más comunes que las arteriales, pero también más susceptibles de reconstrucción. Las posibles variaciones y posibilidades de reconstrucción de la anatomía venosa han sido descritas previamente19,29 y están fuera del alcance de este trabajo.
A pesar de su eficacia, el protocolo anterior está limitado por el tiempo y los recursos necesarios para completar con éxito una cirugía compleja de animales grandes, incluido el personal, el equipo quirúrgico, el alojamiento de los animales y los cuidados pre y postoperatorios. Además, un riñón porcino joven y sano es un modelo limitado para evaluar a donantes adultos mayores, donantes con enfermedad renal subyacente y donantes con comorbilidades que incluyen hipertensión y diabetes.
Este protocolo optimizado y reproducible para la obtención de riñón porcino permite la investigación preclínica traducible en trasplante de riñón, preservación y perfusión mecánica.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Los autores desean agradecer a los numerosos técnicos veterinarios de la Facultad de Medicina de la Universidad Johns Hopkins por su asistencia técnica. También nos gustaría expresar nuestro agradecimiento a las Dras. Jessica Izzi y Amanda Maxwell, y a los numerosos residentes veterinarios, incluidos los Dres. Mallory Brown, Jessica Plunkard y Alexis Roach por brindar a nuestros animales una excelente atención clínica y supervisión veterinaria. Finalmente, nos gustaría agradecer a todos los miembros del Laboratorio de Alotrasplante Compuesto Vascularizado (VCA) de la Facultad de Medicina Johns Hopkins que han ayudado en cualquier capacidad con la obtención de riñón u otros procedimientos de obtención de órganos realizados en nuestro laboratorio. Este trabajo fue apoyado por el Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales (NIDDK, por sus siglas en inglés) R44DK136396.
Materiales
| Name | Company | Catalog Number | Comments |
| 70% Ethanol Solution | Fisher Scientific | 04-355-122 | |
| Adson Tissue ForceA2:D30ps, 4.75", 1 x 2 Teeth | Wexler Surgical | FL0081.1 | |
| Bair Hugger Animal Health Overbody Blanket | 3M | 53777 | |
| Bair Hugger Warming Unit | 3M | 77500 | |
| Balfour Abdominal Retractor w/ Fixed Side Blades, 4" Deep, 10" Maximum Spread | MPM Medical Supply | 124-7017 | |
| Betadine Solution (5% Providone-iodine) | MWI Animal Health | NDC-67618-155-01 | |
| Cefazolin for Injection, USP | MWI Animal Health | NDC-63323-237-10 | |
| Chlorhexidine Solution | MWI Animal Health | NDC-30798-624-31 | |
| Custodial HTK Organ Preservation Solution | Essential Pharmaceuticals | 25767073545 | |
| DeBakey Tissue Forceps, 7.75", 2 mm Tips | Wexler Surgical | FL0789.1 | |
| EUTHASOL (pentobarbital sodium and phenytoin sodium) | Virbac | NDC-051311-050-01 | |
| Heparin Sodium Injection, USP | MWI Animal Health | NDC-71288-402-10 | |
| Hot Dog Temperature Management Controller | Augustine Surgical Inc. | WC71V | |
| Hot Dog Veterinary Underbody Warming Mattress | Augustine Surgical Inc. | V106 | |
| Invisishield Isolation Bag, 20" x 20" | Medline | DYNJSD1003 | |
| Jacobson Micro Needle Holder, Straight Jaws, Round Handle, 7.25" | Wexler Surgical | NL0729.11 | |
| Ketamine Hydrochloride Injectable Solution | NexGen Pharmaceuticals | NC-0256 | |
| Lap Sponges 18" x 18" | Medline | MDS231318LF | |
| Metzenbaum Dissection Scissors, 7" Curved | Wexler Surgical | SL5011.1S | |
| Non-Conductive Suction Tubing with Scalloped Connectors, 1/4" x 10' | Medline | DYND50251 | |
| Pantoprazole Sodium for Injection | MWI Animal Health | NDC-55150-202-00 | |
| Perfusion Cannula, Free-Flow, 3 mm Blunt Tip | MED Alliance Solutions | PER-3003S | |
| Rigid Bulb Tip Yankauer | Medline | DYND50130 | |
| Satinsky Clamp, 30 mm Angled DeBakey Atraumatic Jaws, Curved Shanks, 10" | Wexler Surgical | AL2150.1 | |
| Scalpel Handle #3 | World Precision Instruments | 500236 | |
| Servator B UW (University of Wisconsin) | Global Transplant Solutions | JFISERB10A r2 | |
| Single Collection Unit Prefilled CPDA-1, 450 mL | Jorgensen Laboratories | JO520 | |
| Sofsilk Suture Tie, 2-0, Black, 18" | Covidien | S-195 | |
| Surgical Scalpel Blade No. 10 | World Precision Instruments | 500239 | |
| Surgipro II Suture, 6-0, Blue, 30", Double Armed, CV-22 Needle | Covidien | VP-733-X | |
| Three-Quarter Surgical Drape | Medline | DYNJP2414 | |
| Valleylab Electrosurgical Pencil with Stainless Steel Electrodes | Covidien | CVNE2516H | |
| Valleylab Force FXc Electrosurgical Generator | Covidien | MFI-MDT-FORCE-FXC | |
| Valleylab Polyhesive Adult Patient Return Electrode | Covidien | E7507-SD | |
| Xylazine Hydrochloride Injectable Solution | NexGen Pharmaceuticals | NC-0334 |
Referencias
- Merion, R. M., et al. Deceased-donor characteristics and the survival benefit of kidney transplantation. JAMA. 294 (21), 2726-2733 (2005).
- Lentine, K. L., et al. OPTN/SRTR 2022 annual data report: Kidney. Am J Transplant. 24 (2S1), S19-S118 (2024).
- Hosgood, S. A., et al. Normothermic machine perfusion versus static cold storage in donation after circulatory death kidney transplantation: a randomized controlled trial. Nat Med. 29 (6), 1511-1519 (2023).
- Malinoski, D., et al. Hypothermia or machine perfusion in kidney donors. N Engl J Med. 388 (5), 418-426 (2023).
- Hamar, M., Selzner, M. Ex vivo machine perfusion for kidney preservation. Curr Opin Organ Transplant. 23 (3), 369-374 (2018).
- Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. Pig kidney: anatomical relationships between the intrarenal arteries and the kidney collecting system. Applied study for urological research and surgical training. J Urol. 172 (5 Pt 1), 2077-2081 (2004).
- Bagetti Filho, H. J., Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. Pig kidney: anatomical relationships between the renal venous arrangement and the kidney collecting system. J Urol. 179 (4), 1627-1630 (2008).
- Giraud, S., et al. Contribution of large pig for renal ischemia-reperfusion and transplantation studies: the preclinical model. J Biomed Biotechnol. 2011 (21), 532127 (2011).
- Girard, A. O., et al. Hickman catheter use for long-term vascular access in a preclinical swine model. J Vis Exp. (193), e65221 (2023).
- Gerling, K. A., et al. A novel sutureless anastomotic device in a swine model: A proof of concept study. J Surg Res. 291, 116-123 (2023).
- Etra, J. W., et al. Latissimus Dorsi myocutaneous flap procedure in a swine model. J Invest Surg. 34 (12), 1289-1296 (2021).
- Etra, J. W., et al. A skin rejection grading system for vascularized composite allotransplantation in a preclinical large animal model. Transplantation. 103 (7), 1385-1391 (2019).
- Al-Rakan, M., et al. Ancillary procedures necessary for translational research in experimental craniomaxillofacial surgery. J Craniofac Surg. 25 (6), 2043-2050 (2014).
- Santiago, G. F., et al. Establishing cephalometric landmarks for the translational study of Le Fort-based facial transplantation in Swine: enhanced applications using computer-assisted surgery and custom cutting guides. Plast Reconstr Surg. 133 (5), 1138-1151 (2014).
- Ibrahim, Z., et al. Cutaneous collateral axonal sprouting re-innervates the skin component and restores sensation of denervated Swine osteomyocutaneous alloflaps. PLoS One. 8 (10), e77646 (2013).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. J Vis Exp. (80), e50475 (2013).
- Wachtman, G. S., et al. Biologics and donor bone marrow cells for targeted immunomodulation in vascularized composite allotransplantation: a translational trial in swine. Transplant Proc. 43 (9), 3541-3544 (2011).
- Kaths, J. M., et al. Heterotopic renal autotransplantation in a porcine model: A step-by-step protocol. J Vis Exp. 108, e53765 (2016).
- Liu, W. J., et al. Orthotopic kidney auto-transplantation in a porcine model using 24 hours organ preservation and continuous telemetry. J Vis Exp. (162), e61591 (2020).
- Steinhauser, C., et al. Assessment of hemodynamic and blood parameters that may reflect macroscopic quality of porcine kidneys during normothermic machine perfusion using whole blood. World J Urol. 42 (1), 471 (2024).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for graft quality assessment prior to transplantation. Am J Transplant. 18 (3), 580-589 (2018).
- Urcuyo, D., et al. Development of a prolonged warm ex vivo perfusion model for kidneys donated after cardiac death. Int J Artif Organs. 40 (6), 265-271 (2017).
- Vallant, N., et al. A comparison of pulsatile hypothermic and normothermic ex vivo machine perfusion in a porcine kidney model. Transplantation. 105 (8), 1760-1770 (2021).
- Hosgood, S. A., Saeb-Parsy, K., Hamed, M. O., Nicholson, M. L. Successful transplantation of human kidneys deemed untransplantable but resuscitated by ex vivo normothermic machine perfusion. Am J Transplant. 16 (11), 3282-3285 (2016).
- Vallant, N., Wolfhagen, N., Sandhu, B., Hamaoui, K., Papalois, V. Delivery of mesenchymal stem cells during hypothermic machine perfusion in a translational kidney perfusion study. Int J Mol Sci. 25 (9), 5038 (2024).
- Uzarsk, J. S., et al. Sustained in vivo perfusion of a re-endothelialized tissue engineered kidney graft in a human-scale animal model. Front Bioeng Biotechnol. 11, 1184408 (2023).
- Anand, R. P., et al. Design and testing of a humanized porcine donor for xenotransplantation. Nature. 622 (7982), 393-401 (2023).
- Pan, W., et al. Cellular dynamics in pig-to-human kidney xenotransplantation. Med. 5 (8), 1016-1029 (2024).
- Golriz, M., et al. Pig kidney transplantation: an up-to- date guideline. Eur Surg Res. 49 (3-4), 121-129 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados