Method Article
شراء الكلى في نموذج حيواني كبير قبل السريري
* These authors contributed equally
In This Article
Summary
هنا ، نقدم بروتوكولا يوضح بالتفصيل نموذجا جراحيا لشراء الكلى في نموذج الخنازير قبل السريرية للتروية أو الزرع الآلي اللاحق.
Abstract
تطورت التروية الآلية كاستراتيجية قابلة للتطبيق لتقييم الأعضاء خارج الجسم الحي ومراقبتها وعلاجها وتحسينها ، بالإضافة إلى إطالة أوقات الحفظ. كانت النماذج الحيوانية الكبيرة ذات أهمية قصوى لتطوير هذه التقنيات وتحسينها. ومع ذلك ، من أجل ضمان جودة الكسب غير المشروع وقابلية استنساخ البيانات ، يجب اتباع التقنيات الجراحية الموحدة والقابلة للترجمة سريريا لشراء الأعضاء والأنسجة. وبالتالي ، هنا ، نصف بروتوكولا محسنا لشراء الكلى في نموذج الخنازير قبل السريرية. يتم إجراء استعادة الكلى باستخدام خنازير السلالات المختلطة (يوركشاير كروس / ميكس). باختصار ، بعد التطهير المعقم ولفة المجال الجراحي ، يتم إجراء شق كامل في خط الوسط للحصول على الوصول الأمثل إلى كلتا الكليتين. يتم تشريح الحالب والوريد الكلوي والشريان حتى أصلهم من الوريد الأجوف السفلي والشريان الأورطي ، على التوالي. بعد التشريح الكلوي الكامل ، يتم ربط الحالب وقطعه بعيدا. ثم يتم إضفاء الطابع الهباريني على المتبرع بالكامل ب 100 وحدة دولية لكل كيلوغرام / وزن الجسم. بعد ذلك ، يتم تثبيت الشريان الكلوي بالقرب من الشريان الأورطي ، ويتم تثبيت الوريد الكلوي بالقرب من الوريد الأجوف باستخدام مشبك الأوعية الدموية ساتينسكي. ثم يتم استئصال الطعم الكلوي ، ويتم تقشير الشريان الكلوي على الفور على الطاولة الخلفية. سيتم بعد ذلك شطف الكلية بمحلول حفظ مثلج وتخزينها على الثلج حتى يتم التروية أو الزرع. أخيرا ، يتم ربط جذع الشريان الكلوي برباط حريري 2-0 ، ويتم إغلاق الوريد الأجوف بخياطة 6-0 من مادة البولي بروبلين. تستعيد هذه التقنية الكلى وتحاكي إما بيئة متبرع حي (كلية واحدة) أو متبرع متوفى (كلية مزدوجة). يوفر التعافي من الكلى الفردية ميزة إجراء عملية زرع ذاتي لاحقة. في نموذج المتبرع المتوفى ، يمكن جمع الدم قبل القتل الرحيم عن طريق إدخال إبر كيس الدم مباشرة في الشريان الأورطي ، وبالتالي إخراج وتوفير الدم لتروية آلة خارج الجسم الحي .
Introduction
زراعة الكلى هي العلاج الأمثل لمرض الكلى في المرحلة النهائية (ESRD) ، مما يوفر نوعية حياة محسنة ونتائج طويلة المدى مقارنة بغسيلالكلى 1. على الرغم من التقدم في الحفاظ على الأعضاء ، يموت عشرات الأشخاص كل يوم من ESRD أثناء وجودهم في قائمة الانتظار لزراعة الكلى2. التروية الآلية هي مجال متنام يزيد من أوقات الحفظ ، مما يتيح شبكات المتبرعين الموسعة وتخصيص الأعضاء بشكل أكثر كفاءة. تسمح هذه التقنية أيضا بمراقبة الأعضاء خارج الجسم الحي وتحسينها ، وبالتالي تقليل آثار إصابة نقص التروية وإعادة التروية (IRI). عند مقارنتها بالتخزين البارد الثابت (SCS) ، فقد ثبت أن نضح الماكينة يقلل بشكل كبير من حدوث وظيفة الكسب غير المشروع المتأخرة3،4. أظهر التروية الآلية أيضا تنشيط الطعوم الهامشية ، والتي لم تكن لتفي بمعايير الزرع5. على الرغم من التقدم التكنولوجي ، تظل تقنية الحفظ الأكثر شيوعا SCS على الجليد. يمكن أن تساعد المزيد من التجارب والبيانات قبل السريرية في جعل التروية الآلية الدعامة الأساسية للحفاظ على الكلى.
نموذج الخنازير لزراعة الكلى راسخ وكان جزءا لا يتجزأ من تطوير تقنية الحفاظ على الكلى ، وخاصة نضح الآلة. على عكس الكلى القوارض غير الضاربة ، فإن الخنازير والكلى البشرية كلاهما متعدد الفصوص ، ومتشابهة في الحجم ، ويشتركان في تشريح الشرياني والوريدي والبولالمماثل 6،7. لذلك ، تسهل كلية الخنازير الترجمة المباشرة إلى البيئة السريرية ، خاصة فيما يتعلق بالأجهزة الطبية والعلاجات الدوائية. بالإضافة إلى ذلك ، تظهر كلى الخنازير فيزيولوجيا مرضية مماثلة للكلى البشرية8 ، مما يجعلها مثالية لدراسات الحفاظ على الكلى.
من أجل ضمان جودة الكسب غير المشروع وقابلية تكرار البيانات ، يجب اتباع التقنيات الجراحية الموحدة والقابلة للترجمة سريريا لشراء الأعضاء والأنسجة. وبالتالي ، هنا ، نصف بروتوكولا محسنا لشراء الكلى في نموذج الخنازير قبل السريرية. يسمح هذا البروتوكول باستعادة الكلى ويحاكي إما بيئة متبرع حي (كلية واحدة) أو متبرع متوفى (كلية مزدوجة). يوفر التعافي الكلوي الفردي ميزة إجراء عملية زرع ذاتي لاحقة. في نموذج استعادة الكلى المزدوجة ، يمكن جمع الدم قبل القتل الرحيم عن طريق إدخال إبر كيس الدم مباشرة في الشريان الأورطي ، وبالتالي إخراج وتوفير الدم لتروية آلة خارج الجسم الحي .
Protocol
تمت الموافقة على جميع الإجراءات الموضحة من قبل لجنة الرعاية المؤسسية والاستخدام بجامعة جونز هوبكنز ، وهي مؤسسة مرخصة من وزارة الزراعة الأمريكية (USDA) ، ومكتب رعاية المختبر (OLAW) المضمونة ، وجمعية تقييم واعتماد رعاية المختبر (AAALAC) مؤسسة معتمدة. تم الحفاظ على وفقا لقانون رعاية الصادر عن وزارة الزراعة الأمريكية ، ودليل المعاهد الوطنية للصحة لرعاية واستخدام المختبر ، وسياسة خدمة الصحة العامة الأمريكية بشأن الرعاية الإنسانية واستخدام المختبر.
1. والسكن
- استخدم خنازير يوركشاير البالغة من العمر 3-6 أشهر وعمرها 20-40 كجم (Sus scrofa domesticus) ، أو قابلة للمقارنة ، لهذا البروتوكول.
- ضع في سياج ربط سلسلة مع أرضيات شرائحية.
2. إجراء ما قبل الجراحة والتخدير
- صيام قبل 12 ساعة على الأقل من وقت التخدير.
- يجب تطبيق سيميثيكون عن طريق الفم (20 ملغ/كغ) قبل 12 ساعة على الأقل من الجراحة وتكرار الجرعات قبل 1 ساعة على الأقل من التخدير لتقليل تمدد الأمعاء.
- يتم تطبيق الكيتامين (20-30 ملغ/كغ) والزيلازين (2-3 ملغ/كغ) في حقنة واحدة في الحقن العضلية لتجنب الحقن المتعددة.
- انقل الخنزير إلى منطقة التدريج قبل الجراحة. ضع قسطرة وريدية في وريد الأذن الهامشية. تطبيق 3-10 ملغ/كغ/ساعة من محلول ملحي 0.9٪ أو محلول رينجر مرهب طوال العملية.
- بمجرد تخدير الخنزير بشكل كاف ، ضع أنبوبا قصغايا (أنبوب بطاني قصغامي 6.0-6.5 مم لحيوان 20-30 كجم ؛ 6.5-7.0 مم مكبل لمدة 30-40 كجم) لتوصيل التخدير بالغاز والتهوية الميكانيكية. إذا لزم الأمر، يتم تسهيل جرعة البروبوفول (0.8-1.66 ملغم/كغ) عن طريق الوريد، تدار لتأثيرها.
- قم بإزالة الشعر الموجود على موقع الجراحة ومحيطه باستخدام المقص ، بالإضافة إلى فرك متسخ لموقع الجراحة ، قبل نقل إلى غرفة العمليات.
- انقل إلى طاولة العمليات. يجب تطبيق سيفازولين (20-22 مجم / كغ) عن طريق الوريد قبل 10 دقائق من بدء الجراحة ومرة أخرى كل 90 دقيقة أثناء الجراحة. يتم تطبيق بانتوبرازول (0.5-1 مجم / كجم) عن طريق الوريد في بداية الجراحة.
- يتم تطبيق إحصاد موضعي تحت الجلد مع الليدوكائين (حتى 2 ملغ/كغ) لتسهيل التسكين الإضافي قبل الشق.
- قم بإعداد موقع الجراحة بشكل معقم ، بالتناوب بين الكلورهيكسيدين أو البيتادين و 70٪ من الإيثانول أو المحلول الملحي ، ثلاث مرات على الأقل.
- مراقبة حجم السوائل ومعدل ضربات القلب وضغط الدم وقياس التأكسج النبضي وتصوير الكبنومات وتخطيط كهربية القلب ودرجة حرارة المستقيم باستمرار. سجل هذه القيم كل 10-15 دقيقة. استخدم وسادة سفلية ساخنة وبطانية بالهواء الدافئ لمنع انخفاض حرارة الجسم.
- قبل بدء الجراحة ، تأكد من أن ضمن المستوى المناسب للتخدير الجراحي من خلال استخدام مزيج من نغمة الفك ، وانعكاس الجفن ، والمعلمات المذكورة في الخطوة السابقة.
3. إجراء حصاد الكلى
- جهز للجراحة باتباع الخطوات الموضحة في القسم 2.
- بعد التطهير المعقم ولفة المجال الجراحي ، قم بإجراء بضع البطن المتوسط (25-30 سم) للوصول الأمثل إلى كلتا الكليتين. أدخل ضام بطن قياسي.
- غطي القولون والأمعاء الدقيقة بمناشف مبللة بمحلول ملحي دافئ. اسحب الأمعاء إلى الجانب الأيمن للوصول إلى الكلية اليسرى أو إلى الجانب الأيسر للوصول إلى الكلية اليمنى.
- افتح الصفاق المغطى بالكلى وقم بتشريح حول الكلى لتحرير أي التصاقات. تشريح الحالب حتى يتم الحصول على طول 10-12 سم.
- تشريح الوريد الكلوي والشريان حتى أصلهما من الوريد الأجوف السفلي والشريان الأورطي ، على التوالي.
- بعد التشريح الكلوي الكامل ، اربط الحالب بعيدا برباط حريري 2-0 واقطع بالقرب من ربطة العنق. اترك طرف الحالب القريب مفتوحا للسماح بتصريف البول.
- هيبارين بالهيبارين الوريدي (100 وحدة دولية / كجم) وانتظر لمدة دقيقتين لضمان الهيبارين الكافي للكلى. يجب تكرار هذه الخطوة قبل استئصال كل كلية.
- قم بتثبيت الشريان الكلوي والوريد الكلوي بالقرب من الشريان الأورطي والوريد الأجوف السفلي ، على التوالي ، باستخدام مشابك الأوعية الدموية ساتينسكي. قم بإزالة طعم الكلى عن طريق قطع الشريان الكلوي والوريد بالقرب من المشابك.
- قم بتقشير الشريان الكلوي على الفور باستخدام قنية نضحية ذات طرف حاد 3 مم. اغسل الكلى بمحلول جامعة ويسكونسن المثلج (UW) أو محلول الحفاظ على Custodiol Histidine-tryptophan-ketoglutarate (HTK).
- قم بإزالة قنية التروية بعد التنظيف باستخدام UW أو HTK وضع الكلية في كيس معقم مملوء بنفس محلول الحفظ المثلج الذي تم استخدامه لتنظيف الكلى. ضع هذا الكيس داخل كيس عضو معقم ثان. بعد ذلك قم بتخزين العضو أو بدء تروية الجهاز.
- اربط جذع الشريان الكلوي برباط حريري 2-0. أغلق جذع الوريد الكلوي بخياطة جري من طبقتين ب 6-0 بولي بروبيلين.
4. إجراء حصاد الدم
- إذا كان الإجراء نهائيا وتم إجراء جميع التدخلات الجراحية الأخرى ، فاستمر في حصاد الدم من أجل التروية الآلية والقتل الرحيم عن طريق الاستئصال.
- اسحب الأمعاء إلى الجانب الأيمن وحدد الشريان الأورطي البطني تحت الكلى. حرر أي التصاقات كبيرة أو أنسجة تغطي الوعاء.
- أدخل إبرة كيس جمع الدم مباشرة في الشريان الأورطي. الكيس أسفل لتسهيل التعبئة. بمجرد امتلاء الكيس (حوالي 450 مل من الدم) ، قم بإزالة الإبرة من الشريان الأورطي واضغط على موقع البزل.
- للحصول على كيس دم ثان ، أدخل الإبرة الجديدة على بعد 1-2 سم بالقرب من موقع البزل السابق. كرر العملية باستخدام أكياس دم متعددة حسب الحاجة ، مع تحريك 1-2 سم بالقرب من كل إبرة.
- بعد جمع جميع الدم اللازم ، قم بتحفيز السكتة القلبية بالحقن الوريدي من الصوديوم البنتوباربيتال / الفينيتوين الصوديوم بجرعة لا تقل عن 78 مجم / كجم من مكون البنتوباربيتال. إذا كان هناك قلق من أن البنتوباربيتال سيتداخل مع المقايسات اللاحقة للكلى ، فاستخدم كلوريد البوتاسيوم (KCl) (75-100 مجم / كجم IV) كطريقة بديلة للقتل الرحيم الكيميائي إذا تم إعطاؤه للخنازير تحت التخدير. تحقق من الوفاة بسبب قلة ضربات القلب ، وغياب منعكس القرنية ، وانخفاض كبير في درجة حرارة الجسم.
ملاحظة: يمكن استخدام الأعضاء والأنسجة المتبقية من الخنزير المضحى به لأغراض بحثية أو تعليمية أخرى وفقا لمبادئ 3R.
النتائج
تتمتع مجموعتنا البحثية بخبرة واسعة تمتد لما يقرب من 15 عاما مع نماذج الخنازير لكل من زراعة الأعضاء الصلبة وزرع الأوعية الدموية المركبة9،10،11،12،13،14،15،16،17. هنا ، نصف نتائج تجارب استعادة الكلى الخنازير (ن = 139). لقد استخدمنا الكلى المشتراة للزرع أو التروية الآلية أو زراعة الخلايا الأولية ولم نواجه حتى الآن أي مضاعفات مع نموذج الإجراء الجراحي هذا (الشكل 1). نعرف استرجاع الكلى الناجح على أنه عملية جراحية بدون فشل تقني ، فضلا عن عدم وجود نتائج سلبية تتعلق بالتشريح أو التقنية الجراحية. تظهر أمثلة على المظهر الإجمالي لطعم الكلى في الشكل 2 ، والتي تمثل إعادة تروية الكلى الناجحة عن طريق التروية الآلية أو الزرع.
اعتمادا على خلفية التدريب ومعرفة المختبر بنماذج الخنازير ، نوصي بإجراء تجربة أولية واحدة إلى ثلاث تجارب أولية على الأقل مع جميع الموظفين المشاركين في الإجراءات. في المجموعة الحالية من الدراسات ، كان متوسط الوقت الإجرائي الإجمالي - من شق خط الوسط إلى القتل الرحيم - 88 دقيقة (الجدول 1). كان متوسط الوقت من شق خط الوسط إلى استرجاع كل من ترقيع الكلى 73 دقيقة. بالإضافة إلى الدعم المقدم من الموظفين البيطريين ، بما في ذلك طبيب بيطري وواحد أو اثنين من الفنيين البيطريين ، هناك حاجة إلى ما لا يقل عن ثلاثة موظفين جراحيين ومختبريين إضافيين. اعتمادا على مستوى الخبرة ، قد يوصى بمساعد جراحي آخر وواحد أو اثنين من موظفي الدعم الإضافيين ، بما في ذلك طلاب الدكتوراه أو فنيي المختبرات ، لضمان الكفاءة في استرجاع الكسب غير المشروع ، وتنظيف الأعضاء ، وجمع الدم من أجل تقليل وقت نقص التروية الدافئ وخطر التخثر أثناء جمع الدم.
كما هو الحال في البشر ، من الممكن حدوث اختلافات تشريحية في كلى الخنازير (الشكل 3 ، الجدول 2). شوهد التشريح القياسي - شريان كلوي واحد ووريد كلوي واحد - في 64٪ من الكلى. كانت الاختلافات الأكثر شيوعا هي شريان واحد ووريد (26٪) ، وشرايين ووريد واحد (5٪) ، وشرايين واحد وثلاثة أوردة (4٪) ، وشرايين ووريدين (1٪). ما يقرب من نصف (46٪) الخنازير كان لديهم تشريح نموذجي ثنائي. شوهد التشريح غير النمطي من جانب واحد (22٪ يسار غير نمطي ، 14٪ غير نمطي يمين) وثنائي (19٪). عند اختيار كلية للزرع ، نوصي بتجنب أي تشريح غير نمطي. إذا كانت كلتا الكليتين لهما وريدان ، فاختر الكلى ذات الأوردة الأطول وأعد بناءها على الطاولة الخلفية إلى تجويف واحد قبل الزرع. عند اختيار كلية للنضح الآلي ، يكون التشريح الوريدي أقل أهمية إذا كان الجهاز يستخدم تصريفا وريديا مجمعا. نوصي بتجنب تشريح الشريان لتروية آلة المضخة الواحدة ، لأن الاختلافات في المقاومة بين الشرايين ستؤدي إلى عدم تكافؤ الدورة الدموية.

الشكل 1: ملخص لمعدلات استرجاع الكلى الناجحة لزراعة الأعضاء ، والتروية الآلية ، وتجارب زراعة الخلايا الأولية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: أمثلة على المظهر الإجمالي للطعم الكلى. (أ) الكلية اليمنى الأصلية في الموقع. (ب) ترقيع الكلى بعد التنظيف بمحلول الحفظ المثلج. (ج) ترقيع الكلى بعد إعادة تروية الآلة. (د) ترقيع الكلى بعد الزرع وإعادة التروية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
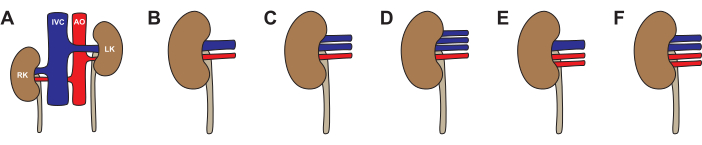
الشكل 3: الاختلافات في تشريح كلى الخنازير. (أ ، ب) تشريح نموذجي بشريان كلوي واحد ووريد كلوي واحد لكل كلية. (ج) تشريح غير نمطي بشريان كلوي واحد ووردين كلويين. (د) تشريح غير نمطي بشريان كلوي واحد وثلاثة أوردة كلوية. (ه) تشريح غير نمطي مع شريانين كلويين ووريد كلوي واحد. (و) تشريح غير نمطي مع شريانين كلويين ووردين كلويين. الاختصارات المستخدمة: RK- الكلية اليمنى. IVC- الوريد الأجوف السفلي; AO- الشريان الأورطي. LK- الكلية اليسرى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مهمة أو خطوة تجريبية | متوسط الوقت (دقيقة) | جراح | المساعدة الجراحية | بيطار | فني بيطري | باحث | إجمالي عدد الموظفين |
| ما قبل الجراحة | 60 | 1 | 2 | 1 | 4 | ||
| جراحة استرجاع الكسب غير المشروع (كلية واحدة) | 41 | 1 | 1 | 1 | 1 | 1 | 5 |
| جراحة استرجاع الكسب غير المشروع (كلتا الكليتين) | 73 | 1 | 1 | 1 | 1 | 1 | 5 |
| تنظيف الأعضاء (لكل كلى) | 6 | 1 | 1 | 1 | 1 | 4 | |
| جمع الدم | 15 | 1 | 1 | 1 | 1 | 1 | 5 |
| القتل الرحيم | غير متاح | 1 | 1 | 2 |
الجدول 1: الموارد البشرية ومتطلبات الوقت لإجراء جراحة شراء كلى الخنازير.
| تشريح الكلى الثنائي | عدد الخنازير | نسبة الخنازير |
| كلاهما نموذجي | 17 | 46% |
| اليمين النموذجي ، اليسار غير نمطي | 8 | 22% |
| يسار نموذجي ، يمين غير نمطي | 5 | 14% |
| كلاهما غير نمطي | 7 | 19% |
| 37 | 100% | |
| تشريح الكلى من جانب واحد | عدد الكلى | نسبة الكلى |
| 1 شريان ، 1 وريد | 47 | 64% |
| 1 شريان ، 2 أوريد | 19 | 26% |
| 1 شريان ، 3 أوردة | 3 | 4% |
| 2 الشرايين, 1 الوريد | 4 | 5% |
| 2 الشرايين ، 2 الأوردة | 1 | 1% |
| 74 | 100% |
الجدول 2: ملخص الاختلافات التشريحية الموجودة في كلى الخنازير.
Discussion
كان نموذج الخنازير لزراعة الكلى أمرا حيويا لتطوير وتحسين تقنية التروية الآلية. بالنظر إلى أوجه التشابه التشريحية والمناعية والفيزيولوجية المرضية مع الكلى البشرية6،7،8 ، تقدم كلى الخنازير ترجمة ميسرة للاختبارات السريرية والممارسة.
يمكن استخدام نموذج شراء كلى الخنازير لمجموعة متنوعة من التجارب قبل السريرية. في نموذج المتبرع الحي ، يمكن استعادة كلية واحدة والحفاظ عليها ، مع الزرع الذاتي اللاحق وإزالة الكلية المقابلة18،19. في نموذج المتبرع المتوفى ، يمكن شراء كلتا الكليتين ، واستخدامهما لدراسات الحفظ أو دراسات التروية الآلية أو زرع الزرع. يعد إجراء جمع الدم الموضح في القسم 4 مفتاحا لدراسات التروية الآلية باستخدام مادة كريهة تحتوي على دم كامل أو منتجات دم ، وخاصة تروية الماكينة الممتدة التي تتطلب تبادل النشوات20،21،22. عن طريق قنية الشريان الأورطي مباشرة ، يتم الحصول على تدفق ثابت وسريع للدم ، مما يؤدي إلى استخلاص بالكامل في أقل فترة زمنية. يمكن ملء أكياس دم متعددة عن طريق إدخال كل إبرة بالقرب من الإبرة السابقة ، وبالتالي تقليل تسرب الدم من موقع البزل السابق.
يعد كل من نضح الآلة الخافضة للحرارة (HMP) والتروية الآلية القياسية (NMP) طرقا ناشئة للحفاظ على الكلى وتحسينها. عند مقارنتها ب SCS ، فقد ثبت أن كلا من HMP و NMP يحسنان النتائج ويقللان من حدوث وظيفة الكسب غير المشروعالمتأخرة 3،4،5. هناك حاجة إلى مزيد من البحث لتحديد الطريقة المثلى ، لكن بعض الدراسات قبل السريرية أشارت إلى أن NMP يوفر نتائج أفضل23. يوفر التروية الآلية فرصة لاختبار الجدوى والتنبؤ بالطعوم الهامشية21 ، بالإضافة إلى إمكانية إصلاح الطعوم غير القابلة للاستخدام سابقا24. أظهرت دراسات إضافية التروية الآلية كمكان لتوصيل الأدوية والهندسة الحيوية ، بما في ذلك توصيل الخلايا الجذعية25 وإعادة خلية كلية الخنازير بالخلايا البطانية البشرية26. يعد زرع الكلى من خنزير إلى إنسان اختراقا حديثا27،28 ، وقد يكمن المزيد من التقدم في نضح الآلة.
تعد الاختلافات في تشريح الكلى عقبة لا مفر منها عند إجراء عمليات استرداد متعددة للكلى. الكلى التي تحتوي على شريانين كلويين هي نوع غير شائع. في تجربتنا ، فإن الكلية المقابلة لها تشريح شرياني طبيعي ويمكن استخدامها بدلا من الكلية غير النمطية. التشوهات الوريدية أكثر شيوعا من التشوهات الشريانية ولكنها أيضا أكثر قابلية لإعادة البناء. تم وصف الاختلافات المحتملة وإمكانيات إعادة بناء التشريح الوريدي سابقا19،29وهي خارج نطاق هذه الورقة.
على الرغم من فعاليته ، إلا أن البروتوكول أعلاه محدود بالوقت والموارد المطلوبة لإكمال جراحة كبيرة معقدة بنجاح ، بما في ذلك الموظفين والمعدات الجراحية وإسكان والرعاية قبل الجراحة وبعدها. بالإضافة إلى ذلك ، تعد كلية الخنازير الشابة والصحية نموذجا محدودا لتقييم المتبرعين الأكبر سنا ، والمتبرعين الذين يعانون من أمراض كلوية كامنة ، والمتبرعين الذين يعانون من أمراض مصاحبة بما في ذلك ارتفاع ضغط الدم والسكري.
يسمح هذا البروتوكول المحسن والقابل للتكرار لشراء كلى الخنازير بإجراء أبحاث ما قبل السريرية القابلة للترجمة في زراعة الكلى والحفاظ عليها والتروية الآلية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
يود المؤلفون أن يعرب عن تقديرهم للعديد من الفنيين البيطريين في كلية الطب بجامعة جونز هوبكنز لمساعدتهم الفنية. نود أيضا أن نعرب عن امتناننا للدكتورة جيسيكا إيزي وأماندا ماكسويل ، والعديد من المقيمين البيطريين ، بما في ذلك الدكتورة مالوري براون وجيسيكا بلونكارد وأليكسيس روتش لتزويد حيواناتنا برعاية سريرية ممتازة وإشراف بيطري. أخيرا ، نود أن نتوجه بخالص الشكر إلى جميع أعضاء مختبر زراعة الأوعية الدموية المركبة (VCA) في كلية الطب بجامعة جونز هوبكنز الذين ساعدوا بأي صفة في شراء الكلى أو إجراءات شراء الأعضاء الأخرى التي يتم إجراؤها في مختبرنا. تم دعم هذا العمل من قبل منحة المعهد الوطني للسكري وأمراض الجهاز الهضمي والكلى (NIDDK) R44DK136396.
Materials
| Name | Company | Catalog Number | Comments |
| 70% Ethanol Solution | Fisher Scientific | 04-355-122 | |
| Adson Tissue ForceA2:D30ps, 4.75", 1 x 2 Teeth | Wexler Surgical | FL0081.1 | |
| Bair Hugger Animal Health Overbody Blanket | 3M | 53777 | |
| Bair Hugger Warming Unit | 3M | 77500 | |
| Balfour Abdominal Retractor w/ Fixed Side Blades, 4" Deep, 10" Maximum Spread | MPM Medical Supply | 124-7017 | |
| Betadine Solution (5% Providone-iodine) | MWI Animal Health | NDC-67618-155-01 | |
| Cefazolin for Injection, USP | MWI Animal Health | NDC-63323-237-10 | |
| Chlorhexidine Solution | MWI Animal Health | NDC-30798-624-31 | |
| Custodial HTK Organ Preservation Solution | Essential Pharmaceuticals | 25767073545 | |
| DeBakey Tissue Forceps, 7.75", 2 mm Tips | Wexler Surgical | FL0789.1 | |
| EUTHASOL (pentobarbital sodium and phenytoin sodium) | Virbac | NDC-051311-050-01 | |
| Heparin Sodium Injection, USP | MWI Animal Health | NDC-71288-402-10 | |
| Hot Dog Temperature Management Controller | Augustine Surgical Inc. | WC71V | |
| Hot Dog Veterinary Underbody Warming Mattress | Augustine Surgical Inc. | V106 | |
| Invisishield Isolation Bag, 20" x 20" | Medline | DYNJSD1003 | |
| Jacobson Micro Needle Holder, Straight Jaws, Round Handle, 7.25" | Wexler Surgical | NL0729.11 | |
| Ketamine Hydrochloride Injectable Solution | NexGen Pharmaceuticals | NC-0256 | |
| Lap Sponges 18" x 18" | Medline | MDS231318LF | |
| Metzenbaum Dissection Scissors, 7" Curved | Wexler Surgical | SL5011.1S | |
| Non-Conductive Suction Tubing with Scalloped Connectors, 1/4" x 10' | Medline | DYND50251 | |
| Pantoprazole Sodium for Injection | MWI Animal Health | NDC-55150-202-00 | |
| Perfusion Cannula, Free-Flow, 3 mm Blunt Tip | MED Alliance Solutions | PER-3003S | |
| Rigid Bulb Tip Yankauer | Medline | DYND50130 | |
| Satinsky Clamp, 30 mm Angled DeBakey Atraumatic Jaws, Curved Shanks, 10" | Wexler Surgical | AL2150.1 | |
| Scalpel Handle #3 | World Precision Instruments | 500236 | |
| Servator B UW (University of Wisconsin) | Global Transplant Solutions | JFISERB10A r2 | |
| Single Collection Unit Prefilled CPDA-1, 450 mL | Jorgensen Laboratories | JO520 | |
| Sofsilk Suture Tie, 2-0, Black, 18" | Covidien | S-195 | |
| Surgical Scalpel Blade No. 10 | World Precision Instruments | 500239 | |
| Surgipro II Suture, 6-0, Blue, 30", Double Armed, CV-22 Needle | Covidien | VP-733-X | |
| Three-Quarter Surgical Drape | Medline | DYNJP2414 | |
| Valleylab Electrosurgical Pencil with Stainless Steel Electrodes | Covidien | CVNE2516H | |
| Valleylab Force FXc Electrosurgical Generator | Covidien | MFI-MDT-FORCE-FXC | |
| Valleylab Polyhesive Adult Patient Return Electrode | Covidien | E7507-SD | |
| Xylazine Hydrochloride Injectable Solution | NexGen Pharmaceuticals | NC-0334 |
References
- Merion, R. M., et al. Deceased-donor characteristics and the survival benefit of kidney transplantation. JAMA. 294 (21), 2726-2733 (2005).
- Lentine, K. L., et al. OPTN/SRTR 2022 annual data report: Kidney. Am J Transplant. 24 (2S1), S19-S118 (2024).
- Hosgood, S. A., et al. Normothermic machine perfusion versus static cold storage in donation after circulatory death kidney transplantation: a randomized controlled trial. Nat Med. 29 (6), 1511-1519 (2023).
- Malinoski, D., et al. Hypothermia or machine perfusion in kidney donors. N Engl J Med. 388 (5), 418-426 (2023).
- Hamar, M., Selzner, M. Ex vivo machine perfusion for kidney preservation. Curr Opin Organ Transplant. 23 (3), 369-374 (2018).
- Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. Pig kidney: anatomical relationships between the intrarenal arteries and the kidney collecting system. Applied study for urological research and surgical training. J Urol. 172 (5 Pt 1), 2077-2081 (2004).
- Bagetti Filho, H. J., Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. Pig kidney: anatomical relationships between the renal venous arrangement and the kidney collecting system. J Urol. 179 (4), 1627-1630 (2008).
- Giraud, S., et al. Contribution of large pig for renal ischemia-reperfusion and transplantation studies: the preclinical model. J Biomed Biotechnol. 2011 (21), 532127 (2011).
- Girard, A. O., et al. Hickman catheter use for long-term vascular access in a preclinical swine model. J Vis Exp. (193), e65221 (2023).
- Gerling, K. A., et al. A novel sutureless anastomotic device in a swine model: A proof of concept study. J Surg Res. 291, 116-123 (2023).
- Etra, J. W., et al. Latissimus Dorsi myocutaneous flap procedure in a swine model. J Invest Surg. 34 (12), 1289-1296 (2021).
- Etra, J. W., et al. A skin rejection grading system for vascularized composite allotransplantation in a preclinical large animal model. Transplantation. 103 (7), 1385-1391 (2019).
- Al-Rakan, M., et al. Ancillary procedures necessary for translational research in experimental craniomaxillofacial surgery. J Craniofac Surg. 25 (6), 2043-2050 (2014).
- Santiago, G. F., et al. Establishing cephalometric landmarks for the translational study of Le Fort-based facial transplantation in Swine: enhanced applications using computer-assisted surgery and custom cutting guides. Plast Reconstr Surg. 133 (5), 1138-1151 (2014).
- Ibrahim, Z., et al. Cutaneous collateral axonal sprouting re-innervates the skin component and restores sensation of denervated Swine osteomyocutaneous alloflaps. PLoS One. 8 (10), e77646 (2013).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. J Vis Exp. (80), e50475 (2013).
- Wachtman, G. S., et al. Biologics and donor bone marrow cells for targeted immunomodulation in vascularized composite allotransplantation: a translational trial in swine. Transplant Proc. 43 (9), 3541-3544 (2011).
- Kaths, J. M., et al. Heterotopic renal autotransplantation in a porcine model: A step-by-step protocol. J Vis Exp. 108, e53765 (2016).
- Liu, W. J., et al. Orthotopic kidney auto-transplantation in a porcine model using 24 hours organ preservation and continuous telemetry. J Vis Exp. (162), e61591 (2020).
- Steinhauser, C., et al. Assessment of hemodynamic and blood parameters that may reflect macroscopic quality of porcine kidneys during normothermic machine perfusion using whole blood. World J Urol. 42 (1), 471 (2024).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for graft quality assessment prior to transplantation. Am J Transplant. 18 (3), 580-589 (2018).
- Urcuyo, D., et al. Development of a prolonged warm ex vivo perfusion model for kidneys donated after cardiac death. Int J Artif Organs. 40 (6), 265-271 (2017).
- Vallant, N., et al. A comparison of pulsatile hypothermic and normothermic ex vivo machine perfusion in a porcine kidney model. Transplantation. 105 (8), 1760-1770 (2021).
- Hosgood, S. A., Saeb-Parsy, K., Hamed, M. O., Nicholson, M. L. Successful transplantation of human kidneys deemed untransplantable but resuscitated by ex vivo normothermic machine perfusion. Am J Transplant. 16 (11), 3282-3285 (2016).
- Vallant, N., Wolfhagen, N., Sandhu, B., Hamaoui, K., Papalois, V. Delivery of mesenchymal stem cells during hypothermic machine perfusion in a translational kidney perfusion study. Int J Mol Sci. 25 (9), 5038 (2024).
- Uzarsk, J. S., et al. Sustained in vivo perfusion of a re-endothelialized tissue engineered kidney graft in a human-scale animal model. Front Bioeng Biotechnol. 11, 1184408 (2023).
- Anand, R. P., et al. Design and testing of a humanized porcine donor for xenotransplantation. Nature. 622 (7982), 393-401 (2023).
- Pan, W., et al. Cellular dynamics in pig-to-human kidney xenotransplantation. Med. 5 (8), 1016-1029 (2024).
- Golriz, M., et al. Pig kidney transplantation: an up-to- date guideline. Eur Surg Res. 49 (3-4), 121-129 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved