Method Article
רכישת כליות במודל פרה-קליני של בעלי חיים גדולים
* These authors contributed equally
In This Article
Summary
כאן, אנו מציגים פרוטוקול המפרט מודל כירורגי לרכישת כליות במודל חזירים פרה-קליני לזלוף מכונה או השתלה לאחר מכן.
Abstract
זלוף מכונה התפתח כאסטרטגיה בת קיימא להערכה, ניטור, טיפול, אופטימיזציה של איברים מחוץ לגוף , כמו גם להארכת זמני השימור. מודלים של בעלי חיים גדולים היו בעלי חשיבות עליונה לפיתוח ואופטימיזציה של טכנולוגיות אלה. עם זאת, על מנת להבטיח את איכות השתל ושחזור הנתונים, יש לעקוב אחר טכניקות כירורגיות סטנדרטיות וניתנות לתרגום קליני לרכישת איברים ורקמות. לפיכך, כאן, אנו מתארים פרוטוקול אופטימלי לרכישת כליות במודל חזירים פרה-קליני. התאוששות הכליות מתבצעת באמצעות חזירים מגזע מעורב (יורקשייר קרוס/מיקס). בקצרה, לאחר חיטוי סטרילי ועטיפה של שדה הניתוח, מבוצע חתך שלם בקו האמצע כדי לקבל גישה אופטימלית לשתי הכליות. השופכן, וריד הכליה והעורק מנותחים עד שמקורם בווריד הנבוב התחתון ובאבי העורקים, בהתאמה. לאחר דיסקציה מלאה של הכליה, השופכן נקשר ונחתך דיסטלי. לאחר מכן החיה התורמת עוברת הפרין מלא עם 100 יחב"ל לק"ג/משקל גוף. לאחר מכן, עורק הכליה מהודק קרוב לאבי העורקים, ווריד הכליה מהודק קרוב לווריד הנבוב באמצעות מהדק כלי דם של סטינסקי. לאחר מכן כורתים את שתל הכליה, ועורק הכליה מועבר מיד לשולחן האחורי. לאחר מכן הכליה תישטף בתמיסת שימור קרה כקרח ותאוחסן על קרח עד לזלוף מכונה או השתלה. לבסוף, גדם עורק הכליה נקשר בקשירה של משי 2-0, והווריד הנבוב נסגר בתפר פוליפרופילן 6-0. טכניקה זו משחזרת כליות ומדמה הגדרת תורם חי (כליה יחידה) או נפטר (כליה כפולה). התאוששות הכליה הבודדת מציעה את היתרון לביצוע השתלה אוטומטית לאחר מכן. במודל התורם שנפטר, ניתן לאסוף דם לפני המתת חסד על ידי החדרת מחטי שקיות דם ישירות לתוך אבי העורקים, ובכך להוציא את בעל החיים ולספק דם לזלוף מכונה ex vivo .
Introduction
השתלת כליה היא הטיפול האופטימלי למחלת כליות סופנית (ESRD), ומספקת איכות חיים משופרת ותוצאות ארוכות טווח בהשוואה לדיאליזה1. למרות ההתקדמות בשימור איברים, עשרות אנשים מתים מדי יום מ-ESRD בעודם ברשימת ההמתנה להשתלת כליה2. זלוף מכונה הוא תחום צומח המגדיל את זמני השימור, ומאפשר רשתות תורמים מורחבות והקצאת איברים יעילה יותר. טכנולוגיה זו מאפשרת גם ניטור ואופטימיזציה של איברים מחוץ לגוף, ובכך למזער את ההשפעות של פגיעה באיסכמיה-רפרפוזיה (IRI). בהשוואה לאחסון קר סטטי (SCS), הוכח כי זלוף מכונה מפחית משמעותית את השכיחות של תפקוד השתל המושהה 3,4. זלוף מכונה הוכיח גם החייאת שתלים שוליים, שאחרת לא היו עומדים בקריטריונים להשתלה5. למרות ההתקדמות הטכנולוגית, טכניקת השימור הנפוצה ביותר נותרה SCS על קרח. ניסויים ונתונים פרה-קליניים נוספים יכולים לעזור להפוך את זלוף המכונה לעמוד התווך של שימור הכליות.
מודל החזיר להשתלת כליה מבוסס היטב והיה חלק בלתי נפרד מפיתוח טכנולוגיית שימור הכליות, במיוחד זלוף מכונות. בניגוד לכליות מכרסמים לא אילובולריות, כליות חזיר ואדם הן שתיהן רב-לוליות, דומות בגודלן, וחולקות אנטומיה מקבילה של העורקים, הוורידים והשתן 6,7. לכן, הכליה החזירית מאפשרת תרגום ישיר למסגרת הקלינית, במיוחד במונחים של מכשירים רפואיים וטיפולים תרופתיים. בנוסף, כליות חזיר מראות פתופיזיולוגיה דומה של IRI כמו כליות אנושיות8, מה שהופך אותן לאידיאליות למחקרי שימור כליות.
על מנת להבטיח את איכות השתל ושחזור הנתונים, יש להקפיד על טכניקות כירורגיות סטנדרטיות וניתנות לתרגום קליני לרכישת איברים ורקמות. לפיכך, כאן, אנו מתארים פרוטוקול אופטימלי לרכישת כליות במודל חזירים פרה-קליני. פרוטוקול זה מאפשר התאוששות של כליות ומדמה מסגרת של תורם חי (כליה יחידה) או מת (כליה כפולה). התאוששות הכליה הבודדת מציעה את היתרון של ביצוע השתלה אוטומטית לאחר מכן. במודל התאוששות הכליה הכפולה, איסוף דם לפני המתת חסד אפשרי על ידי החדרת מחטי שקיות דם ישירות לתוך אבי העורקים, ובכך להוציא את בעל החיים ולספק דם לזלוף במכונה ex vivo .
Protocol
כל ההליכים המתוארים אושרו על ידי ועדת הטיפול והשימוש המוסדיים של אוניברסיטת ג'ונס הופקינס, מוסד מוסמך של משרד החקלאות של ארצות הברית (USDA), המשרד לרווחת חיות מעבדה (OLAW) ומוסד מוסמך של האגודה להערכה והסמכה של טיפול בחיות מעבדה (AAALAC). בעלי החיים הוחזקו בהתאם לחוק רווחת בעלי החיים של משרד החקלאות של ארצות הברית, המדריך של המכונים הלאומיים לבריאות לטיפול ושימוש בחיות מעבדה, ומדיניות שירות בריאות הציבור של ארצות הברית בנושא טיפול ושימוש הומני בחיות מעבדה.
1. בעלי חיים ודיור
- השתמש בחזירי יורקשייר בריאים קלינית בני 3-6 חודשים במשקל 20-40 ק"ג (Sus scrofa domesticus), או דומה, לפרוטוקול זה.
- שיכנו את בעלי החיים במסלולי גידור שרשרת עם ריצוף דקים.
2. הליך טרום ניתוחי והרדמה
- צמו את בעל החיים לפחות 12 שעות לפני זמן ההרגעה.
- יש לתת סימטיקון דרך הפה (20 מ"ג/ק"ג) לפחות 12 שעות לפני הניתוח ולחזור על המינון לפחות שעה אחת לפני הטשטוש כדי להפחית את התרחבות המעי.
- יש לתת קטמין (20-30 מ"ג/ק"ג) וקסילזין (2-3 מ"ג/ק"ג) במזרק יחיד תוך שרירי כדי למנוע זריקות מרובות.
- העבירו את החזיר לאזור ההיערכות לפני הניתוח. הנח קטטר תוך ורידי בווריד אוזן שולי. יש לתת 3-10 מ"ג/ק"ג/שעה של 0.9% תמיסת מלח או תמיסת רינגר חלב לאורך כל ההליך.
- לאחר שהחזיר מקבל הרדמה מספקת, הנח צינור אנדוטרכיאלי (צינור אנדוטרכאלי אזוק 6.0-6.5 מ"מ לבעל חיים במשקל 20-30 ק"ג; 6.5-7.0 מ"מ אזוק ל-30-40 ק"ג) למתן הרדמה בגז והנשמה מכנית. במידת הצורך, יש להקל על מינון של פרופופול (0.8-1.66 מ"ג/ק"ג) תוך ורידי, הניתן ביעילות.
- הסר את השיער על ומסביב לאתר הניתוח באמצעות קוצץ, כמו גם קרצוף מלוכלך של אתר הניתוח, לפני העברת החיה לחדר הניתוח.
- העבירו את החיה לשולחן הניתוחים. יש לתת צפזולין (20-22 מ"ג/ק"ג) תוך ורידי 10 דקות לפני תחילת הניתוח ושוב כל 90 דקות תוך כדי הניתוח. מתן פנטופרזול (0.5-1 מ"ג/ק"ג) תוך ורידי בתחילת הניתוח.
- יש לתת בלוק מקומי תת עורי עם לידוקאין (עד 2 מ"ג/ק"ג) כדי להקל על תוספת משככי כאבים לפני החתך.
- הכינו אספטית את מקום הניתוח, לסירוגין בין כלורהקסידין או בטדין ל-70% אתנול או מי מלח, לפחות שלוש פעמים.
- עקוב באופן רציף אחר נפח הנוזלים, קצב הלב, לחץ הדם, אוקסימטריית הדופק, קפנוגרפיה, אלקטרוקרדיוגרפיה וטמפרטורת פי הטבעת. רשום ערכים אלה כל 10-15 דקות. השתמשו בפד תחתון מחומם ובשמיכת אוויר חם כדי למנוע היפותרמיה.
- לפני תחילת הניתוח, ודא שהחיה נמצאת במישור המתאים של הרדמה כירורגית על ידי שימוש בשילוב של טונוס הלסת, רפלקס פלפברלי ופרמטרים המפורטים בשלב הקודם.
3. הליך קצירת כליות
- הכן את בעל החיים לניתוח, לפי השלבים המתוארים בסעיף 2.
- לאחר חיטוי סטרילי ועטיפה של שדה הניתוח, בצע לפרוטומיה חציונית (25-30 ס"מ) כדי לקבל גישה אופטימלית לשתי הכליות. הכנס מפסק בטן רגיל.
- מכסים את המעי הגס והמעי הדק במגבות ספוגות במי מלח חמים. משוך את המעיים לצד ימין לגישה לכליה השמאלית או לצד שמאל לגישה לכליה הימנית.
- פתח את הצפק המכסה את הכליה ונתח סביב הכליה כדי לשחרר הידבקויות. נתח את השופכן עד לקבלת אורך של 10-12 ס"מ.
- לנתח את וריד הכליה והעורק עד למקורם מהווריד הנבוב התחתון ומאבי העורקים, בהתאמה.
- לאחר דיסקציה מלאה של הכליה, קושרים את השופכן דיסטלי עם קשירה משי 2-0 וחותכים קרוב לעניבה. השאר את קצה השופכן הפרוקסימלי פתוח כדי לאפשר ניקוז שתן.
- יש להפרין את בעל החיים בהפרין תוך ורידי (100 יחב"ל/ק"ג) ולהמתין 2 דקות כדי להבטיח הפריניזציה מספקת של הכליה. יש לחזור על שלב זה לפני כריתת כל כליה.
- מהדקים את עורק הכליה ווריד הכליה קרוב לאבי העורקים ולווריד הנבוב התחתון, בהתאמה, בעזרת שני מהדקי כלי דם של סטינסקי. הסר את שתל הכליה על ידי חיתוך עורק הכליה והווריד קרוב למהדקים.
- קנולציה מיידית של עורק הכליה עם צינורית זלוף קצה קהה של 3 מ"מ. שטפו את הכליה בתמיסה קרה כקרח של אוניברסיטת ויסקונסין (UW) או בתמיסת שימור Custodiol Histidine-tryptophan-ketoglutarate (HTK).
- הסר את צינורית הזלוף לאחר שטיפה עם UW או HTK והנח את הכליה בשקית איברים סטרילית מלאה באותה תמיסת שימור קרה כקרח ששימשה לשטיפת הכליה. הניחו את השקית הזו בתוך שקית איברים סטרילית שנייה. לאחר מכן אחסן את האיבר או התחל זלוף מכונה.
- קשרו את גדם עורק הכליה עם קשירה של משי 2-0. סגור את גדם וריד הכליה עם תפר ריצה דו שכבתי עם 6-0 פוליפרופילן.
4. הליך קצירת דם
- אם ההליך הוא סופני וכל ההתערבויות הכירורגיות האחרות בוצעו, המשך בקצירת דם לזלוף מכונה והמתת חסד על ידי הוצאה.
- החזירו את המעיים לצד ימין וזהו את אבי העורקים הבטני האינפרא-כליה. שחרר הידבקויות גדולות או רקמות המכסות את הכלי.
- הכנס את מחט שקית איסוף הדם ישירות לתוך אבי העורקים. תלו את השקית מתחת לבעל החיים כדי להקל על המילוי. לאחר שהשקית מלאה (כ-450 מ"ל דם), הוציאו את המחט מאבי העורקים והחזיקו לחץ על מקום הניקוב.
- לשקית דם שנייה, הכנס את המחט החדשה 1-2 ס"מ קרוב לאתר הניקוב הקודם. חזור על הפעולה עם שקיות דם מרובות לפי הצורך, נע 1-2 ס"מ קרוב עם כל מחט.
- לאחר איסוף כל הדם הדרוש, יש לגרום לדום לב עם הזרקה תוך ורידית של נתרן פנטוברביטל/פניטואין במינון של לפחות 78 מ"ג/ק"ג של מרכיב הפנטוברביטל. אם יש חשש שפנטוברביטל יפריע לבדיקות הבאות של הכליה, השתמש באשלגן כלורי (KCl) (75-100 מ"ג/ק"ג IV) כשיטת המתת חסד כימית חלופית אם הוא ניתן לחזירים בהרדמה. ודא מוות על ידי חוסר דופק, היעדר רפלקס קרנית וירידה משמעותית בטמפרטורת הגוף.
הערה: ניתן להשתמש באיברים וברקמות הנותרים של החזיר המוקרב למטרות מחקר או חינוך אחרות בהתאם לעקרונות 3R.
תוצאות
לקבוצת המחקר שלנו ניסיון רחב המשתרע על פני כמעט 15 שנים עם מודלים חזיריים של השתלת איברים מוצקים והשתלת אלוקולריות מרוכבות 9,10,11,12,13,14,15,16,17 . כאן, אנו מתארים את התוצאות של ניסויי התאוששות כליות החזיר שלנו (n = 139). השתמשנו בכליות שנרכשו להשתלה, זלוף מכונה או תרבית תאים ראשונית ועד כה לא חווינו סיבוכים כלשהם עם מודל הליך כירורגי זה (איור 1). אנו מגדירים שאיבת כליה מוצלחת כניתוח ללא כשל טכני, כמו גם היעדר תוצאות שליליות הקשורות לאנטומיה או לטכניקה כירורגית. דוגמאות למראה הגס של השתלת כליה מוצגות באיור 2, המייצגות רפרפוזיה מוצלחת של כליה באמצעות זלוף מכונה או השתלה.
בהתאם לרקע ההכשרה והיכרות המעבדה עם מודלים של חזירים, אנו ממליצים לבצע לפחות ניסוי מקדים אחד עד שלושה עם כל הצוות המעורב בהליכים. בקבוצת המחקרים הנוכחית, הזמן הפרוצדורלי הכולל הממוצע - מחתך בקו האמצע ועד להמתת חסד - היה 88 דקות (טבלה 1). הזמן הממוצע מהחתך בקו האמצע ועד לאחזור שתי השתלות הכליה היה 73 דקות. בנוסף לתמיכה מהצוות הווטרינרי, כולל וטרינר וטכנאי וטרינרי אחד או שניים, נדרשים לפחות שלושה אנשי צוות כירורגיים ומעבדתיים נוספים. בהתאם לרמת הניסיון, ניתן להמליץ על עוזר כירורגי נוסף וצוות תמיכה אחד או שניים נוספים, כולל דוקטורנטים או טכנאי מעבדה, כדי להבטיח יעילות בשליפת השתל, שטיפת איברים ואיסוף דם על מנת למזער את זמן האיסכמיה החמה ואת הסיכון לקרישה במהלך איסוף הדם.
כמו בבני אדם, וריאציות אנטומיות אפשריות בכליות חזיריות (איור 3, טבלה 2). האנטומיה הסטנדרטית - עורק כליה אחד ווריד כליה אחד - נצפתה ב-64% מהכליות. הווריאציות השכיחות ביותר היו עורק אחד ושני ורידים (26%), שני עורקים ווריד אחד (5%), עורק אחד ושלושה ורידים (4%), ושני עורקים ושני ורידים (1%). לכמחצית (46%) מהחזירים הייתה אנטומיה טיפוסית דו-צדדית. אנטומיה לא טיפוסית נצפתה הן באופן חד צדדי (22% שמאל לא טיפוסי, 14% ימין לא טיפוסי) והן דו-צדדית (19%). בבחירת כליה להשתלה, אנו ממליצים להימנע מכל אנטומיה לא טיפוסית. אם לשתי הכליות יש שני ורידים, בחר בכליה עם ורידים ארוכים יותר ושחזר על השולחן האחורי לומן יחיד לפני ההשתלה. בבחירת כליה לזלוף מכונה, האנטומיה הוורידית פחות חשובה אם המכונה משתמשת בניקוז ורידי מאוחד. אנו ממליצים להימנע מאנטומיה של שני עורקים לזלוף מכונה במשאבה אחת, מכיוון שהבדלי ההתנגדות בין העורקים ייצרו זרימת דם לא אחידה.

איור 1: סיכום של שיעורי אחזור כליות מוצלחים עבור השתלות, זלוף מכונה וניסויים ראשוניים בתרבית תאים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: דוגמאות למראה גס של השתלת כליה. (A) כליה ימנית ילידית באתרה. (B) השתלת כליה לאחר שטיפה בתמיסת שימור קרה כקרח. (ג) השתלת כליה לאחר זלוף מכונה. (ד) השתלת כליה לאחר השתלה ורפרפוזיה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
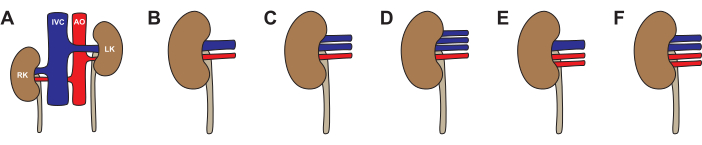
איור 3: וריאציות באנטומיה של כליות חזירים. (א,ב) אנטומיה טיפוסית עם עורק כליה אחד ווריד כליה אחד לכל כליה. (C) אנטומיה לא טיפוסית עם עורק כליה אחד ושני ורידים כליים. (D) אנטומיה לא טיפוסית עם עורק כליה אחד ושלושה ורידים כלייתיים. (E) אנטומיה לא טיפוסית עם שני עורקי כליה ווריד כליה אחד. (F) אנטומיה לא טיפוסית עם שני עורקי כליה ושני ורידים כלייתיים. קיצורים בשימוש: RK- כליה ימנית; IVC- וריד נבוב נחות; AO- אבי העורקים; LK- כליה שמאלית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| משימה או שלב ניסיוני | זמן ממוצע (דקות) | מנתח | סיוע כירורגי | וטרינר | טכנאי וטרינרי | חוקר | מספר כוח אדם כולל |
| טרום ניתוח | 60 | 1 | 2 | 1 | 4 | ||
| ניתוח אחזור שתלים (כליה אחת) | 41 | 1 | 1 | 1 | 1 | 1 | 5 |
| ניתוח אחזור שתלים (שתי הכליות) | 73 | 1 | 1 | 1 | 1 | 1 | 5 |
| שטיפת איברים (לכל כליה) | 6 | 1 | 1 | 1 | 1 | 4 | |
| איסוף דם | 15 | 1 | 1 | 1 | 1 | 1 | 5 |
| המתת חסד | לא ישים | 1 | 1 | 2 |
טבלה 1: משאבי אנוש ודרישות זמן לביצוע ניתוחי רכש כליות חזיר.
| אנטומיה דו-צדדית של הכליות | מספר חזירים | אחוז החזירים |
| שניהם אופייניים | 17 | 46% |
| ימין טיפוסי, שמאל לא טיפוסי | 8 | 22% |
| שמאל אופייני, ימין לא טיפוסי | 5 | 14% |
| שניהם לא טיפוסיים | 7 | 19% |
| 37 | 100% | |
| אנטומיה חד צדדית של הכליות | מספר כליות | אחוז הכליות |
| 1 עורק, 1 וריד | 47 | 64% |
| עורק אחד, 2 ורידים | 19 | 26% |
| עורק אחד, 3 ורידים | 3 | 4% |
| 2 עורקים, 1 וריד | 4 | 5% |
| 2 עורקים, 2 ורידים | 1 | 1% |
| 74 | 100% |
טבלה 2: סיכום של וריאציות אנטומיות שנמצאו בכליות חזירים.
Discussion
מודל החזיר להשתלת כליה היה חיוני לפיתוח ואופטימיזציה של טכנולוגיית זלוף מכונות. בהתחשב בדמיון האנטומי, האימונולוגי והפתופיזיולוגי לכליות אנושיות 6,7,8, כליות חזיר מציעות תרגום קל לבדיקות קליניות ולתרגול.
ניתן להשתמש במודל של רכישת כליות חזיר למגוון ניסויים פרה-קליניים. במודל של תורם חי, ניתן לשחזר ולשמר כליה בודדת, עם השתלה עצמית והסרה של הכליה הנגדית 18,19. במודל של תורם שנפטר, ניתן לרכוש את שתי הכליות ולהשתמש בהן למחקרי שימור, מחקרי זלוף מכונה או השתלה. הליך איסוף הדם המתואר בסעיף 4 הוא המפתח למחקרי זלוף מכונה המשתמשים בפרפוזה המכילה דם מלא או מוצרי דם, במיוחד זלוף מכונה ממושך המחייב החלפת פרפוזה 20,21,22. על ידי קנולציה ישירה של אבי העורקים, מתקבלת זרימת דם עקבית ומהירה, המוציאה את בעל החיים באופן מלא בפרק זמן מינימלי. ניתן למלא שקיות דם מרובות על ידי החדרת כל מחט בסמיכות לקודמתה, ובכך למזער את דליפת הדם מאתר הניקוב הקודם.
גם זלוף מכונה היפותרמית (HMP) וגם זלוף מכונה נורמותרמית (NMP) הן שיטות מתפתחות לשימור ואופטימיזציה של כליות. בהשוואה ל-SCS, הוכח כי גם HMP וגם NMP משפרים את התוצאות ומפחיתים את השכיחות של תפקוד השתל המושהה 3,4,5. יש צורך במחקר נוסף כדי לקבוע את השיטה האופטימלית, אך כמה מחקרים פרה-קליניים הצביעו על כך ש-NMP מספק תוצאות טובות יותר23. זלוף מכונה מספק הזדמנות לבדיקת כדאיות וחיזוי של שתלים שוליים21, כמו גם פוטנציאל לתיקון שתלים שלא היו שמישים בעבר24. מחקרים נוספים הוכיחו זלוף מכונה כמקום להעברת תרופות וביו-הנדסה, כולל אספקת תאי גזע25 ותאית מחדש של כליה חזירית עם תאי אנדותל אנושיים26. השתלת כליה מחזיר לאדם היא פריצת דרך לאחרונה27,28, והתקדמות נוספת עשויה להיות טמונה בזילוף מכונות.
וריאציות באנטומיה הכלייתית הן מכשול בלתי נמנע בעת ביצוע התאוששות כליות מרובה. כליה עם שני עורקי כליה היא גרסה נדירה. מניסיוננו, לכליה הנגדית יש אנטומיה עורקית תקינה וניתן להשתמש בה במקום זו הלא טיפוסית. הפרעות ורידיות שכיחות יותר מאלה העורקיות אך גם ניתנות יותר לשחזור. הווריאציות הפוטנציאליות ואפשרויות השחזור של אנטומיה ורידית תוארו בעבר19,29 והן מחוץ לתחום מאמר זה.
למרות יעילותו, הפרוטוקול הנ"ל מוגבל על ידי הזמן והמשאבים הנדרשים להשלמת ניתוח מורכב בבעלי חיים גדולים, כולל כוח אדם, ציוד כירורגי, דיור לבעלי חיים וטיפול לפני ואחרי הניתוח. בנוסף, כליה חזירית צעירה ובריאה היא מודל מוגבל להערכת תורמים מבוגרים, תורמים עם מחלת כליות בסיסית ותורמים עם מחלות נלוות כולל יתר לחץ דם וסוכרת.
פרוטוקול אופטימלי וניתן לשחזור זה לרכש כליות חזיר מאפשר מחקר פרה-קליני הניתן לתרגום בהשתלת כליה, שימור וזילוף מכונות.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
המחברים רוצים להודות לטכנאים הווטרינריים הרבים בבית הספר לרפואה של אוניברסיטת ג'ונס הופקינס על הסיוע הטכני שלהם. ברצוננו גם להביע את תודתנו לד"ר ג'סיקה איזי ואמנדה מקסוול, ולמתמחים הווטרינריים הרבים, כולל ד"ר מלורי בראון, ג'סיקה פלנקרד ואלכסיס רואץ' על שסיפקו לבעלי החיים שלנו טיפול קליני ופיקוח וטרינרי מעולה. לבסוף, ברצוננו להודות לכל חברי המעבדה להשתלה מרוכבת של כלי דם (VCA) בבית הספר לרפואה של ג'ונס הופקינס שסייעו בכל תפקיד ברכישת כליות או בהליכי רכישת איברים אחרים שבוצעו במעבדה שלנו. עבודה זו נתמכה על ידי מענק המכון הלאומי לסוכרת ומחלות עיכול וכליות (NIDDK) R44DK136396.
Materials
| Name | Company | Catalog Number | Comments |
| 70% Ethanol Solution | Fisher Scientific | 04-355-122 | |
| Adson Tissue ForceA2:D30ps, 4.75", 1 x 2 Teeth | Wexler Surgical | FL0081.1 | |
| Bair Hugger Animal Health Overbody Blanket | 3M | 53777 | |
| Bair Hugger Warming Unit | 3M | 77500 | |
| Balfour Abdominal Retractor w/ Fixed Side Blades, 4" Deep, 10" Maximum Spread | MPM Medical Supply | 124-7017 | |
| Betadine Solution (5% Providone-iodine) | MWI Animal Health | NDC-67618-155-01 | |
| Cefazolin for Injection, USP | MWI Animal Health | NDC-63323-237-10 | |
| Chlorhexidine Solution | MWI Animal Health | NDC-30798-624-31 | |
| Custodial HTK Organ Preservation Solution | Essential Pharmaceuticals | 25767073545 | |
| DeBakey Tissue Forceps, 7.75", 2 mm Tips | Wexler Surgical | FL0789.1 | |
| EUTHASOL (pentobarbital sodium and phenytoin sodium) | Virbac | NDC-051311-050-01 | |
| Heparin Sodium Injection, USP | MWI Animal Health | NDC-71288-402-10 | |
| Hot Dog Temperature Management Controller | Augustine Surgical Inc. | WC71V | |
| Hot Dog Veterinary Underbody Warming Mattress | Augustine Surgical Inc. | V106 | |
| Invisishield Isolation Bag, 20" x 20" | Medline | DYNJSD1003 | |
| Jacobson Micro Needle Holder, Straight Jaws, Round Handle, 7.25" | Wexler Surgical | NL0729.11 | |
| Ketamine Hydrochloride Injectable Solution | NexGen Pharmaceuticals | NC-0256 | |
| Lap Sponges 18" x 18" | Medline | MDS231318LF | |
| Metzenbaum Dissection Scissors, 7" Curved | Wexler Surgical | SL5011.1S | |
| Non-Conductive Suction Tubing with Scalloped Connectors, 1/4" x 10' | Medline | DYND50251 | |
| Pantoprazole Sodium for Injection | MWI Animal Health | NDC-55150-202-00 | |
| Perfusion Cannula, Free-Flow, 3 mm Blunt Tip | MED Alliance Solutions | PER-3003S | |
| Rigid Bulb Tip Yankauer | Medline | DYND50130 | |
| Satinsky Clamp, 30 mm Angled DeBakey Atraumatic Jaws, Curved Shanks, 10" | Wexler Surgical | AL2150.1 | |
| Scalpel Handle #3 | World Precision Instruments | 500236 | |
| Servator B UW (University of Wisconsin) | Global Transplant Solutions | JFISERB10A r2 | |
| Single Collection Unit Prefilled CPDA-1, 450 mL | Jorgensen Laboratories | JO520 | |
| Sofsilk Suture Tie, 2-0, Black, 18" | Covidien | S-195 | |
| Surgical Scalpel Blade No. 10 | World Precision Instruments | 500239 | |
| Surgipro II Suture, 6-0, Blue, 30", Double Armed, CV-22 Needle | Covidien | VP-733-X | |
| Three-Quarter Surgical Drape | Medline | DYNJP2414 | |
| Valleylab Electrosurgical Pencil with Stainless Steel Electrodes | Covidien | CVNE2516H | |
| Valleylab Force FXc Electrosurgical Generator | Covidien | MFI-MDT-FORCE-FXC | |
| Valleylab Polyhesive Adult Patient Return Electrode | Covidien | E7507-SD | |
| Xylazine Hydrochloride Injectable Solution | NexGen Pharmaceuticals | NC-0334 |
References
- Merion, R. M., et al. Deceased-donor characteristics and the survival benefit of kidney transplantation. JAMA. 294 (21), 2726-2733 (2005).
- Lentine, K. L., et al. OPTN/SRTR 2022 annual data report: Kidney. Am J Transplant. 24 (2S1), S19-S118 (2024).
- Hosgood, S. A., et al. Normothermic machine perfusion versus static cold storage in donation after circulatory death kidney transplantation: a randomized controlled trial. Nat Med. 29 (6), 1511-1519 (2023).
- Malinoski, D., et al. Hypothermia or machine perfusion in kidney donors. N Engl J Med. 388 (5), 418-426 (2023).
- Hamar, M., Selzner, M. Ex vivo machine perfusion for kidney preservation. Curr Opin Organ Transplant. 23 (3), 369-374 (2018).
- Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. Pig kidney: anatomical relationships between the intrarenal arteries and the kidney collecting system. Applied study for urological research and surgical training. J Urol. 172 (5 Pt 1), 2077-2081 (2004).
- Bagetti Filho, H. J., Pereira-Sampaio, M. A., Favorito, L. A., Sampaio, F. J. Pig kidney: anatomical relationships between the renal venous arrangement and the kidney collecting system. J Urol. 179 (4), 1627-1630 (2008).
- Giraud, S., et al. Contribution of large pig for renal ischemia-reperfusion and transplantation studies: the preclinical model. J Biomed Biotechnol. 2011 (21), 532127 (2011).
- Girard, A. O., et al. Hickman catheter use for long-term vascular access in a preclinical swine model. J Vis Exp. (193), e65221 (2023).
- Gerling, K. A., et al. A novel sutureless anastomotic device in a swine model: A proof of concept study. J Surg Res. 291, 116-123 (2023).
- Etra, J. W., et al. Latissimus Dorsi myocutaneous flap procedure in a swine model. J Invest Surg. 34 (12), 1289-1296 (2021).
- Etra, J. W., et al. A skin rejection grading system for vascularized composite allotransplantation in a preclinical large animal model. Transplantation. 103 (7), 1385-1391 (2019).
- Al-Rakan, M., et al. Ancillary procedures necessary for translational research in experimental craniomaxillofacial surgery. J Craniofac Surg. 25 (6), 2043-2050 (2014).
- Santiago, G. F., et al. Establishing cephalometric landmarks for the translational study of Le Fort-based facial transplantation in Swine: enhanced applications using computer-assisted surgery and custom cutting guides. Plast Reconstr Surg. 133 (5), 1138-1151 (2014).
- Ibrahim, Z., et al. Cutaneous collateral axonal sprouting re-innervates the skin component and restores sensation of denervated Swine osteomyocutaneous alloflaps. PLoS One. 8 (10), e77646 (2013).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. J Vis Exp. (80), e50475 (2013).
- Wachtman, G. S., et al. Biologics and donor bone marrow cells for targeted immunomodulation in vascularized composite allotransplantation: a translational trial in swine. Transplant Proc. 43 (9), 3541-3544 (2011).
- Kaths, J. M., et al. Heterotopic renal autotransplantation in a porcine model: A step-by-step protocol. J Vis Exp. 108, e53765 (2016).
- Liu, W. J., et al. Orthotopic kidney auto-transplantation in a porcine model using 24 hours organ preservation and continuous telemetry. J Vis Exp. (162), e61591 (2020).
- Steinhauser, C., et al. Assessment of hemodynamic and blood parameters that may reflect macroscopic quality of porcine kidneys during normothermic machine perfusion using whole blood. World J Urol. 42 (1), 471 (2024).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for graft quality assessment prior to transplantation. Am J Transplant. 18 (3), 580-589 (2018).
- Urcuyo, D., et al. Development of a prolonged warm ex vivo perfusion model for kidneys donated after cardiac death. Int J Artif Organs. 40 (6), 265-271 (2017).
- Vallant, N., et al. A comparison of pulsatile hypothermic and normothermic ex vivo machine perfusion in a porcine kidney model. Transplantation. 105 (8), 1760-1770 (2021).
- Hosgood, S. A., Saeb-Parsy, K., Hamed, M. O., Nicholson, M. L. Successful transplantation of human kidneys deemed untransplantable but resuscitated by ex vivo normothermic machine perfusion. Am J Transplant. 16 (11), 3282-3285 (2016).
- Vallant, N., Wolfhagen, N., Sandhu, B., Hamaoui, K., Papalois, V. Delivery of mesenchymal stem cells during hypothermic machine perfusion in a translational kidney perfusion study. Int J Mol Sci. 25 (9), 5038 (2024).
- Uzarsk, J. S., et al. Sustained in vivo perfusion of a re-endothelialized tissue engineered kidney graft in a human-scale animal model. Front Bioeng Biotechnol. 11, 1184408 (2023).
- Anand, R. P., et al. Design and testing of a humanized porcine donor for xenotransplantation. Nature. 622 (7982), 393-401 (2023).
- Pan, W., et al. Cellular dynamics in pig-to-human kidney xenotransplantation. Med. 5 (8), 1016-1029 (2024).
- Golriz, M., et al. Pig kidney transplantation: an up-to- date guideline. Eur Surg Res. 49 (3-4), 121-129 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved