Method Article
Гибридная ПЭТ/МРТ визуализация болезни Альцгеймера на основе 18F-AV-1451
В этой статье
Резюме
Этот протокол описывает использование 18F-AV-1451 ПЭТ/МРТ для выявления патологии тау-белка и нейродегенерации, помогая неврологам диагностировать болезнь Альцгеймера, оценивать ее тяжесть и получать представление о ее прогрессировании и основных патологических механизмах.
Аннотация
Болезнь Альцгеймера (БА) — это прогрессирующее и необратимое нейродегенеративное расстройство, характеризующееся когнитивной дисфункцией, снижением повседневных жизненных способностей и поведенческими изменениями, что накладывает значительное экономическое и социальное бремя во всем мире. Одним из основных патологических признаков БА является накопление нейрофибриллярных клубков, образованных гиперфосфорилированным тау-белком. Позитронно-эмиссионная томография/магнитно-резонансная томография (ПЭТ/МРТ) предоставляет подробную структурную и функциональную информацию, а также конкретные распределения белков, что делает ее все более ценным инструментом для диагностики и исследования болезни Альцгеймера. 18F-AV-1451 — это радиоиндикатор, специально разработанный для обнаружения тау-белка при ПЭТ-визуализации тканей головного мозга. В этом исследовании представлен подробный протокол радиосинтеза 18F-AV-1451, подготовки пациента, методов получения изображений ПЭТ/МРТ и его потенциального применения в оценке болезни Альцгеймера. 18ПЭТ/МРТ F-AV-1451 может помочь неврологам в диагностике болезни Альцгеймера, оценке тяжести заболевания и получении представления о его патологических механизмах. В заключение, этот протокол обеспечивает чувствительный, всеобъемлющий и неинвазивный подход к оценке болезни Альцгеймера, предлагая ценную информацию о прогрессировании заболевания и патологии.
Введение
Болезнь Альцгеймера (БА) – это прогрессирующее и необратимое нейродегенеративное заболевание. Пациенты обычно испытывают когнитивную дисфункцию, снижение способности к повседневной жизни и поведенческие изменения. В связи с ускорением старения населения во всем мире болезнь Альцгеймера стала серьезной проблемой общественного здравоохранения. В настоящее время более 50 миллионов человек во всем мире живут с болезнью Альцгеймера. Ожидается, что к 2050 году распространенность деменции во всем мире увеличится в трираза1. Примерно 10,8% людей в возрасте 65 лет и старше страдают деменцией Альцгеймера. Распространенность болезни Альцгеймера составляет около 5% у лиц в возрасте от 65 до 74 лет, увеличиваясь до 33,3% у лиц в возрасте 85 лет и старше, что делает ее одной из ведущих причин смерти среди пожилыхлюдей2. Как только у пациента развивается болезнь Альцгеймера, это ложится значительным бременем на семью3. Из-за его коварного начала пациенты часто упускают оптимальное окно для лечения после постановки диагноза. Его раннее выявление остается глобальной проблемой4, так как точная этиология до сих пор до конца не изучена 5,6. Учитывая сложную этиологию и пути влияния на болезнь Альцгеймера, существует острая необходимость в более точных и ранних стратегиях диагностики.
Традиционные методы визуализации, такие как компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), используются для наблюдения за атрофией или другими структурными изменениями в мозге, которые могут способствовать когнитивным нарушениям. МРТ, в частности, обеспечивает лучший контраст мягких тканей, чем КТ, и предоставляет информацию о биологии опухоли, не подвергая пациентов воздействию ионизирующего излучения, что делает ее предпочтительным методом визуализации для большинства неврологических расстройств6. МРТ является мощным методом визуализации, который не только предоставляет подробную макроскопическую анатомическую информацию, но и включает в себя различные методы функциональной визуализации, такие как функциональная магнитно-резонансная томография в крови, зависящая от уровня кислорода в крови (БОЛД фМРТ), которая может быть использована для наблюдения за функциональнойактивностью мозга. Позитронно-эмиссионная томография (ПЭТ) — это неинвазивный метод молекулярной визуализации, который позволяет проводить обширный полуколичественный анализ биологических процессов в мозге человека. Гибридная ПЭТ/МРТ может иметь преимущества по сравнению с другими методами визуализации для диагностики болезни Альцгеймера7, поскольку использование широкого спектра индикаторов ПЭТ может предоставить дополнительную физиологическую информацию в дополнение к анатомическим изображениям МРТ 8,9.
Нейрофибриллярные клубки, образованные гиперфосфорилированием тау-белка, являются одним из патологических признаков БА, тесно связанных с началом нейродегенерации и проявлением клинических симптомов как в пространственном, так и во временном плане6. Тау-белок является наиболее распространенным белком, ассоциированным с микротрубочками, in vivo и преобладает как в периферической, так и в центральной нервной системе. Патологическое прогрессирование тау-белка сильно коррелирует со степенью когнитивных нарушений и может служить терапевтической мишенью для пациентов с БА7. Неинвазивное обнаружение отложения тау-белка в определенных областях мозга имеет важное значение для раннего прогнозирования и диагностики заболевания. Использование тау-радиоиндикаторов позволяет визуализировать и локализовать отложения тау-белка в головном мозге, обеспечивая своевременную и точную дифференциальную диагностику, а также оказывать ценную поддержку в отслеживании прогрессирования заболевания и оценке экспериментальных клинических методов лечения 8,9.
Несколько исследований продемонстрировали связь между изменениями в конкретных белках и функциональными или морфологическими результатами МРТ10,11. Тем не менее, имеются ограниченные сообщения о комбинированных анализах с использованием амилоидной/тау-визуализации и функциональной МРТ12. Новый молекулярный диагностический препарат 18F-AV-1451 (7-(6-[18F]фторпиридин-3ил)-5H-пиридо[4,3-b]индол) был использован в качестве радиодиагностического средства для обнаружения тау-белка в ткани головного мозга, полученной с помощью ПЭТ. Исследования в области визуализации тау-ПЭТ все еще находятся на стадии разработки, и в настоящее время оцениваются лишь некоторые индикаторы, в том числе 18F-T807 (18F-AV-1451), 18F-T808 (18F-AV-680)13, 11C-PBB314, 18F-THK-511715, 18F-THK-52316 и 18F-THK-510517,18. 18F-AV-1451 был коммерчески разработан19и, как сообщалось, используется у пациентов с AD20, прогрессирующим надъядерным параличом21 и деменцией с тельцами Леви22. Процесс радиосинтеза F-AV-1451 требует сложной стадии очистки, чтобы гарантировать, что конечный продукт соответствует требованиям к дозировке для клинических визуализирующих исследований23. В связи с расширением применения 18F-меченых радиоиндикаторов в технологии ПЭТ-визуализации растет спрос на синтез и разработку новых 18F-меченых радиоиндикаторов. В данном исследовании представлен метод тау-визуализации ПЭТ/МРТ, направленный на предоставление более подробной информации для диагностики пациентов с болезнью Альцгеймера.
протокол
Исследование было одобрено местным Комитетом по медицинской этике, и все испытуемые предоставили письменное информированное согласие до начала участия. Все исследования проводились в соответствии с принципами Хельсинкской декларации. Все субъекты прошли неврологические и нейропсихологические обследования со стороны медицинского работника в течение трех месяцев до и после визуализации. Пациенты были включены в исследование на основе критериев24 Национального института по проблемам старения и Ассоциации болезни Альцгеймера (NINCDS-ADRDA) и25 критериев Национального института по проблемам старения и Ассоциации Альцгеймера (NAA). Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Синтез 18F-AV-1451
ПРИМЕЧАНИЕ: Соблюдайте принципы биологической и радиологической защиты труда, а также принципы утилизации медицинских и радиоактивных отходов во время производственной деятельности.
- Синтетические детали
- Синтезировать 2,5 мл фторида [18F] с помощью ядерной реакции 18O(p, n)18F с помощью ускорителя частиц, при этом протоны с интегральными токами до 45 мкА бомбардируют в течение 40 мин. Добавьте фторид [18F] в модуль автоматизированного синтеза через передаточный трубопровод, чему способствует избыточное давление газообразного гелия. Управляйте модулем синтеза в порядке, показанном на рисунке 1.
- Улавливайте фторид [18F] в ионообменной колонке (предварительно активируйте 1 мл этанола и 2 мл воды) с сохранением 18O воды в резервуаре для восстановления.
- Дайте раствору карбоната калия из сосуда No 1 (рис. 1) протечь через специальные клапаны и ионообменную колонну для обмена с фторидом [18F], затем вымывайте в реакционный сосуд. В таблице 1 приведены решения для различных судов.
- Растворите фторид [18F] и катализатор фазового переноса на основе криптанда, предварительно загруженные в сосуд No 2 в реакционном сосуде.
- Откройте предназначенный для этого клапан. Подвергнуть реакционную смесь вакуумной дистилляции под обдувом азотом при 85 °C в течение 8 мин с последующей обдувкой азотом при 110 °C в течение 4 мин для удаления остатков воды.
- Добавьте прекурсор из сосуда No 3 в сосуд No 12 и нагревайте до 130 °C в течение 10 минут. Радиосинтез 18F-AV-1451 показан на рисунке 2.
- Охладите реакционную смесь до 50 °C, затем откройте предназначенные для этого клапаны для восстановления атмосферного давления.
- Промыть реакционную смесь в сосуд No14 объемом 3 мл подвижной фазы ВЭЖХ (25% водный раствор этанола, pH отрегулирован до 2,0), полученной из сосудов No5 и No6. Откройте специальные клапаны, чтобы обеспечить попадание смеси в контур ВЭЖХ под давлением гелия.
- Ввести продукт в полупрепаративную колонну ВЭЖХ и элюировать подвижной фазой со скоростью потока 5 мл/мин. Наблюдайте за элюентом с помощью УФ-излучения (λ = 254 нм) и счетчиков радиоактивности.
- Соберите продукт в колбу с круглым дном с помощью специального клапана.
- Захватите и удерживайте продукт в колонке C18 (активируется 5 мл этанола и 10 мл воды).
- Откройте предназначенный клапан, промойте колонну водой из емкости No9 в контейнер для отходов, а затем промойте в бутылку с продуктом раствором из емкостей No8 и No7.
- Пропустите 18F-AV-1451 через фильтрующую мембрану жидкости 0,22 мкм в сборный флакон в дозирующей горячей камере под давлением гелия.
- Контроль качества
ПРИМЕЧАНИЕ: Выполните контроль качества трех последовательных партий продукта. Убедитесь, что контроль качества продукта соответствует критериям Фармакопеи Китайской Народной Республики издания 2020 года (см. Таблицу материалов).- Проведите визуальный осмотр, поместив изделие за свинцовое стекло и проверив цвет и прозрачность.
- Определите значение pH продукта с помощью прецизионной бумаги для измерения pH.
- Используйте ВЭЖХ для анализа радиохимической чистоты продукта 8,16.
- Анализ радиоактивной ядерной чистоты изделия с помощью метода гамма-спектрометра17.
- Точно измерьте период полувыведения продукта в соответствии с Фармакопеей Китайской Народной Республики13.
- Подайте давление 0,34 МПа на стерильную фильтрующую мембрану (шаг 1.1.12) для проверки ее герметичности и целостности.
- Проведение тестов на стерильность и эндотоксины с использованием бактериальной культуры и метода реагентов мечехвоста23.
- Испытайте остаток катализатора фазового переноса на основе криптанда методом йодоплатината калия. Анализ содержания ацетона, ацетонитрила и ДМСО в продукте проводят с помощью газового хроматографа 8,16.
ПРИМЕЧАНИЕ: Убедитесь, что нет других пиков, кроме 0,511 МэВ и 1,022 МэВ.
2. Рекомендации по предварительному обследованию
Примечание: Участники включались в исследование в том случае, если у них были опасения по поводу изменения когнитивных способностей и они проявляли нарушения в одной или нескольких когнитивных областях, сохраняя при этом независимость вфункциональных способностях. Для участия в программе необходимо набрать от 0 до 20 баллов по результатам мини-обследования психического состояния (MMSE) и положительный результат на амилоидный белок, подтвержденный аномальным соотношением Aβ42 или Aβ42/Aβ40 в спинномозговой жидкости (СМЖ) или положительным результатом амилоидной позитронно-эмиссионной томографии (ПЭТ) 6,20. Критерии исключения включали диагноз сосудистых заболеваний, депрессии, черепно-мозговой травмы, психотических расстройств или других состояний, связанныхсо снижением когнитивных функций. Участники с противопоказаниями к кардиостимуляторам, ферромагнитным веществам или инородным телам, представляющим опасность для подвижности, а также те, кто не смог пройти МРТ, были исключены. Дополнительные критерии исключения включали непереносимость гадолиниевых контрастных веществ и наличие тяжелой почечной недостаточности21.
- Проинструктируйте испытуемых воздерживаться от алкоголя, кофеина, лекарств или любых интенсивных физических упражнений или активности в течение 24 часов до исследования. Поддерживайте стабильное физиологическое состояние (например, биоритмы, задачи функции мозга) для обеспечения точности данных.
- Перед исследованием позвольте пациентам употреблять воду и пищу, так как они не мешают проведению ПЭТ/МРТ тау-инфекции.
- Перед визуализацией следует прекратить прием неврологических препаратов не менее чем за 12 часов.
- Посоветуйте субъектам избегать ношения металлических украшений или одежды с металлическими пуговицами или молниями в день обследования.
ПРИМЕЧАНИЕ: Убедитесь, что пациента сопровождает член семьи, он имеет при себе записи о предыдущих обследованиях и информирует медицинский персонал об использовании лекарств.
3. Подготовка к сканированию
- Проверьте форму заявки, чтобы подтвердить общую информацию, цель экзамена и программу. Убедитесь, что все необходимые приготовления завершены. Зарегистрируйтесь и сохраните данные.
- Получите информированное согласие на проведение ПЭТ/МРТ визуализации от пациента или члена его семьи. Проинформируйте субъекта о цели, процедуре, рисках и преимуществах.
- Провести подробный обзор истории болезни, зафиксировать рост, вес и концентрацию крови субъекта, подтвердить отсутствие противопоказаний к МР-обследованию.
- Установите внутривенную капельницу в периферической поверхностной вене или получите доступ к порт-катетеру.
- Перед введением 18F-AV-1451 еще раз проверьте всю информацию, чтобы избежать ошибок.
- Медленно введите 18F-AV-1451 в дозе 3,7-5,5 МБк/кг через внутривенный доступ. Промойте трубку соответствующим количеством физиологического раствора, чтобы свести к минимуму остаток радиоактивных индикаторов. Нанесите компрессию на место инъекции, чтобы предотвратить утечку жидкости.
- Запишите время инъекции, место и действия.
- После завершения инъекции инициируйте аудиовизуальное закрытие. Приглушите свет в ожидании
комнате и установите температуру примерно 22 °C. Проинструктируйте субъекта отдохнуть в постели с закрытыми глазами в течение 80 минут, избегая разговоров, еды или жевания в течение этого периода.
4. ПЭТ/МРТ сканирование
- Проинструктируйте испытуемого и сопровождающего убрать все металлические предметы, включая мобильные телефоны, головные уборы, зубные протезы, очки, часы, кошельки и монеты, перед обследованием. Не допускайте в смотровой кабинет инвалидных колясок, носилок, смотровых кроватей, кислородных баллонов или оборудования для мониторинга.
- Предоставьте испытуемому беруши и расположите их лежа на столе для ПЭТ/МРТ с катушкой для головы/шеи, охватывающей шейный отдел. Используйте специализированный подголовник или губчатую подушечку, чтобы стабилизировать голову, сводя к минимуму движения и обеспечивая комфорт.
ПРИМЕЧАНИЕ: При необходимости введите соответствующую дозу седативного препарата на основании неврологической оценки. - Расположите субъекта с опущенными руками и проинструктируйте его использовать сигнализатор в случае дискомфорта.
- Просмотрите изображения, чтобы убедиться, что головка в сканере центрирована, выровнена по центру катушки и расположена последовательно относительно шеи.
- Используйте 8-канальную соединительную катушку головы и шеи для визуализации.
- Получение объемных T1-взвешенных последовательностей 3D-мозга с высоким разрешением и высоким отношением сигнал/шум (SNR) с использованием испорченной последовательности с градиентным вызовом. Задайте следующие параметры:
- Время повторения (TR) = 8,5 мс; Время эхо-сигнала (TE) = 3,2 мс; Время инверсии (TI) = 450 мс; Угол откидывания = 12°; Размер вокселя = 1 × 1 × 1 мм³; Поле зрения (FOV) = 256 мм; Размер матрицы = 256 × 256; Толщина ломтика = 1 мм.
- Получение осевых Т2-взвешенных последовательностей PROPELLER со следующими параметрами: TR = 6837 мс; TE = 132 мс; Угол откидывания = 142°; FOV = 240 мм; Размер матрицы = 416 × 416; Толщина ломтика = 5 мм.
ПРИМЕЧАНИЕ: При ПЭТ-сканировании используется односпальное положение, охватывающее весь мозг от большого затылочного отверстия до верхней части черепа.
- Одновременная съемка 20-минутных изображений ПЭТ.
- Выполняйте сканирование ПЭТ в режиме 3D-сканирования.
- Используйте объемное сканирование для ПЭТ-визуализации.
- Выполняйте коррекцию затухания с помощью МР-томографии с использованием последовательности импульсов с нулевым временем эха (ZTE) для сегментации костей, воздуха и мягких тканей.
- Получение данных ПЭТ с использованием упорядоченного подмножества максимизации времени пролета (OSEM) для реконструкции изображений20,23. Используйте следующие параметры:
- Размер матрицы = 192 × 192; 28 подмножеств с 6 итерациями; FOV = 350 × 350 мм; По всей ширине в половину максимума (FWHM) = 3,0 мм.
- Рассчитаем нормированное значение поглощения (SUV) по формуле 20,23:
SUV = (Активность сферы (Бк/мл) × Масса тела (кг)) / Введенная доза.
5. Интерпретация изображений
- Визуальная оценка всех изображений ПЭТ/МРТ независимо друг от друга, по крайней мере, двумя опытными врачами ядерной медицины, слепыми к клиническому диагнозу.
- Определите доли мозга с аномальными структурными изменениями и отложением белка.
- Повторяйте визуальную оценку до тех пор, пока не будет достигнут окончательный консенсус.
- Определите «положительное сканирование» как повышенное поглощение 18F-AV-1451 в любой или во всех областях коры головного мозга. Определите «отрицательное сканирование» как отсутствие поглощения 18F-AV-1451 во всех областях коры головного мозга.
- Определите атрофию в медиальной височной доле, в частности в гиппокампе на МРТ, как нейродегенерацию20,25.
Результаты
18Результаты синтеза F-AV-1451
Одностадийный синтез 18F-AV-1451 в оптимизированных условиях реакции позволил увеличить выход синтеза до 25,7% ± 5,8%. Общее время реакции составило 70 мин. Типичный полупрепаративный спектр ВЭЖХ и УФ-излучения показан на рисунке 3, где пик 2 представляет собой пик продукта.
Результаты испытаний качества
Для трех последовательных партий результаты контроля качества были следующими: раствор был бесцветным, визуально прозрачным и без явных примесей. pH колебался от 4,5 до 7,5. Анализы ВЭЖХ и ТСХ показали, что химическая чистота составила >95%, а радиохимическая – >95%. Энергия первичного фотона составляла 0,511 МэВ. Период полураспада соответствовал требуемым техническим характеристикам, за исключением изотопов с длительным периодом полураспада (t1/2 > 5 суток). Стерильная фильтрующая мембрана подвергалась давлению до 0,34 МПа без утечки воздуха. Уровень эндотоксина составил <15 ЕС на 1 мл продукта. Бактериальный посев подтвердил стерильность. К2. 2. 2 концентрация составила ≤50 мкг/мл. Кроме того, остаточные растворители, такие как ацетон, ацетонитрил и ДМСО, соответствовали стандартам Фармакопеи Китайской Народной Республики (см. Таблицу материалов).
18F-AV-1451 Результаты ПЭТ/МРТ
На рисунке 4 представлен пример ПЭТ/МРТ у 69-летнего мужчины со стойким снижением когнитивных функций (оценка по MMSE: 19/30) с положительным отложением тау-белка. Изображения показывают значительную атрофию мозга, в первую очередь характеризующуюся расширением и углублением извилин серого вещества и увеличенными желудочками. В подгруппах AD наблюдалось значительное связывание 18F-AV-1451 с различным региональным распределением. Накопление тау-белка началось в энторинальной коре и гиппокампе, затем распространилось на височную и теменную кору и в конечном итоге распространилось по всей коре головного мозга.
На рисунке 5 представлен пример ПЭТ/МРТ визуализации у 68-летнего мужчины со снижением когнитивных функций (оценка по шкале MMSE: 24/30) с отрицательным отложением тау-белка. Изображения показывают нормальную морфологию паренхимы мозга с обеих сторон, с равномерным и симметричным поглощением радиоактивности 18F-AV-1451. МРТ того же сеанса визуализации показала нормальный размер и морфологию желудочков, без смещения средней линии и аномальных сигналов в паренхиме мозга. Наблюдалось неспецифическое поглощение в базальных ганглиях и стволе мозга.
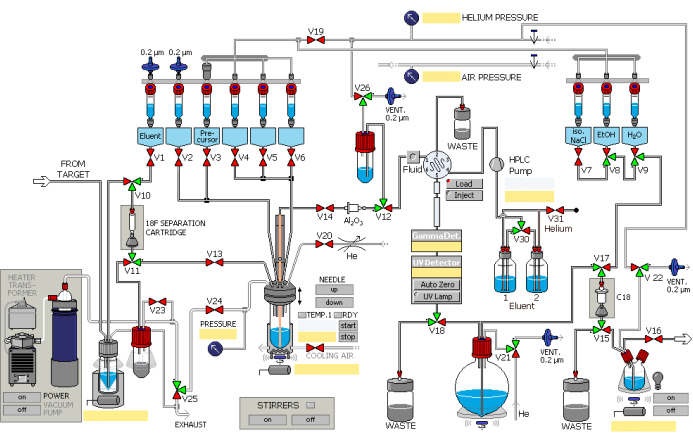
Рисунок 1: Принципиальная схема модуля радиосинтеза. Модуль синтеза работает последовательно в соответствии с назначенными этапами. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
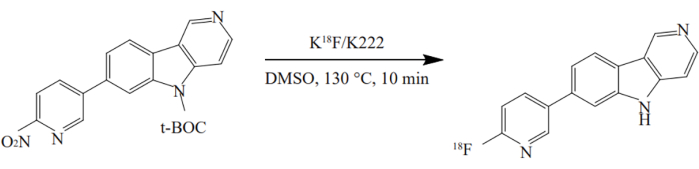
Рисунок 2: Радиосинтез 18F-AV-1451. Соединение синтезировали методом одного горшка в оптимизированных условиях. Нитропрекурсор взаимодействовали с K[18F]/K2.2.2 в ДМСО при 130 °C в течение 10 мин . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
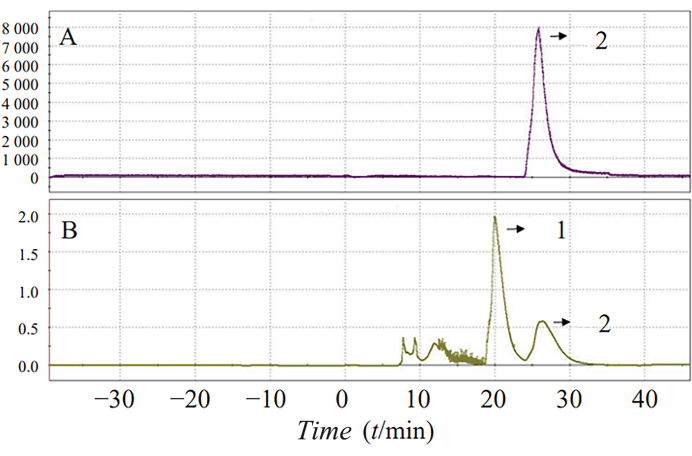
Иллюстрация 3: Разделение ВЭЖХ (А) и УФ-излучения (В) радиоактивности 18F-AV-1451. Показаны полупрепаративные спектры ВЭЖХ и УФ-спектры. Пик 2 представляет пик продукта. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Репрезентативные данные визуализации пациента с положительным отложением тау-белка. (A) 18изображений из ПЭТ с помощью F-AV-1451. (B) Аксиальные T1-взвешенные изображения (T1WI). (C) Аксиальные T2-взвешенные изображения (T2WI). (D) Аксиальные 18F-AV-1451 ПЭТ/МРТ изображения для сварки. Изображения T1WI и T2WI показывают двустороннее уменьшение объема гиппокампа, расширение желудочков, расширение и углубление бороздовых трещин и отсутствие смещения срединной структуры. 18F-AV-1451 Изображения ПЭТ/МРТ спондилодеза показывают положительное тау-сканирование ПЭТ с захватом в медиальной лобной извилине, передней кунеевой извилине, нижней височной извилине и латеральной затылочной коре. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
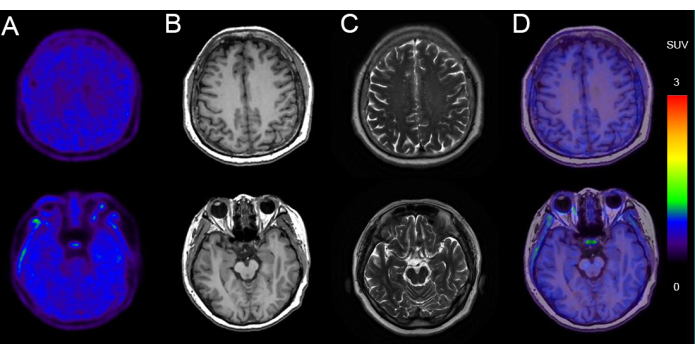
Рисунок 5: Репрезентативные данные визуализации пациента с отрицательным отложением тау. (A) 18изображений F-AV-1451 ПЭТ. (B) Аксиальные T1-взвешенные изображения (T1WI). (C) Аксиальные T2-взвешенные изображения (T2WI). (D) Аксиальные 18F-AV-1451 ПЭТ/МРТ изображения для сварки. Изображения T1WI и T2WI показывают нормальную МРТ головного мозга без значительной атрофии височной доли, указывающей на нейродегенерацию. 18F-AV-1451 Изображения слияния ПЭТ/МРТ демонстрируют нормальное тау-сканирование ПЭТ без специфического захвата коры головного мозга, указывающего на таупатию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Бутылка с растворителем | растворитель |
| No1 | 1,5 мг K2CO3 на 0,5 мл воды |
| No2 | 1,5 мг К2,2,2. в 1 мл ацетонитрила |
| No3 | 1 мг прекурсора в 1,2 мл растворителя ДМСО |
| No5 | 1,5 мл подвижной фазы ВЭЖХ |
| No6 | 1,5 мл подвижной фазы ВЭЖХ |
| Фляга с круглым дном | 2 мл 84% водного раствора NaHCO3 и 30 мл воды |
| No7 | 9 мл 0,9% физиологического раствора |
| No8 | 1 мл EtOH |
| No9 | 10 мл воды |
Таблица 1: Растворы, присутствующие в различных сосудах модуля радиосинтеза.
Обсуждение
В данной методической рукописи мы представили обновленный радиосинтез 18F-AV-1451 для визуализации тау-ПЭТ и методы получения изображений ПЭТ/МРТ 18F-AV-1451, а также показали потенциальную полезность 18F-AV-1451 ПЭТ/МРТ для оценки болезни Альцгеймера. Традиционная КТ или МРТ головного мозга обычно обеспечивает макроскопическую анатомическую структурную оценку, что ограничивает оценку прогрессирования заболевания и прогнозирование прогноза. ПЭТ — это инструмент нейровизуализации, который позволяет измерять молекулярные процессы in vivo . Радиолиганды ПЭТ могут связываться с мишенями, включая рецепторы, белки-транспортеры или ферменты26. Технология используется для диагностики неврологических расстройств, разработки программ и оценки прогрессирования заболевания. ПЭТ/МРТ — это новая гибридная функциональная система визуализации мозга, которая сочетает в себе позитронно-эмиссионную томографию (ПЭТ) и МРТ. Благодаря широкому разнообразию индикаторов ПЭТ, ПЭТ/МРТ может предоставить дополнительную физиологическую информацию, выходящую за рамки анатомических изображений МРТ. Одновременный сбор данных ПЭТ и МРТ поможет воспользоваться преимуществами, присущими обеим технологиям, и устранить потенциальную задержку двух отдельных обследований, а также повысить эффективность и удобство для пациента. ПЭТ/МРТ устраняет дополнительное излучение, необходимое для коррекции затухания и анатомической корреляции в КТ-части ПЭТ/КТ, что может быть большим преимуществом для особых пациентов, таких как беременные женщины, маленькие дети и пациенты, которым требуется несколько исследований ПЭТ-визуализации.
В 2011 году Национальный институт по проблемам старения и Ассоциации Альцгеймера (NIA-AA) предложил диагностическую систему (A/T/N) на основе биологических маркеров27, включая отложение β-амилоида (Aβ), патологический тау (T) и нейродегенерацию (N)28,29. Aβ является компонентом старческих бляшек, маркеры которых включают измерения сниженных уровней Aβ42 в спинномозговой жидкости (СМЖ) и отложения Aβ, демонстрируемые с помощью ПЭТ. Патологический тау является основным компонентом фиброфибриллярного клубка фиброза, маркеры которого включают повышенный общий тау или фосфорилированный тау (p-tau) в спинномозговой жидкости 30,31,32,33. Показатели нейродегенерации включают показатели атрофии мозга34,35 и атрофию гиппокампа или медиальной височной доли36,37, обнаруженные с помощью МРТ, а также гипометаболизм или гипоперфузию, полученные с помощью ПЭТ и однофотонной эмиссионной компьютерной томографии (ОФЭКТ)38,39. ПЭТ/МРТ может иметь преимущества по сравнению с другими методами визуализации в диагностике болезни Альцгеймера, обеспечивая одновременное патологическое отложение белка и атрофию в области гиппокампа за одно сканирование.
Недавно были доступны новые ПЭТ-индикаторы для неинвазивного обнаружения тау-белка in vivo , накопление которого является определяющей характеристикой патологии БА40. 18F-AV1451 проявляет мощное связывание и селективность в отношении тау в тканях мозга41 пациента с болезнью Альцгеймера, с относительно более медленной кинетикой. Мы использовали 18F-AV1451 для изучения распределения тау-белков в мозге пациентов с болезнью Альцгеймера. 18F-AV-1451 был синтезирован несколькими методами. В данном исследовании был автоматизирован синтез 18F-AV-1451 на синтезаторе TRACERlab FXFN методом одного реактора с оптимизированными условиями. Дозировка прекурсора изменилась до 1 мг42. Одновременно с этим условия разделения ВЭЖХ были скорректированы до 25% водного раствора EtOH с pH до 2,0 для снятия защиты BOC в режиме реального времени. Проводили конверсию растворителя и повторную очистку на колонне С18. Выход синтеза увеличен с 20,5% ± 6,1% до 25,7% ±5,8% за счет применения усовершенствованного метода синтеза. Этот метод позволил повысить выход продукта. Различные тесты контроля качества, проведенные после синтеза, показали, что продукт соответствует стандартам контроля качества.
Результаты показали, что у пациентов с болезнью Альцгеймера наблюдалась явная атрофия мозга со значительным связыванием 18F-AV-1451. Накопление тау начинается в энторинальной коре и гиппокампе, затем распространяется на височную и теменную кору и, наконец, широко распространяется по всей коре головного мозга. Тау-ПЭТ является многообещающим инструментом, и в нескольких исследованиях уже была оценена диагностическая ценность тау-ПЭТ. Исследования показали, что тау-ПЭТ, паттерны связывания, хорошо согласуются с гистопатологическими описаниямиБраака 43,44, которые представляют собой основу стадии, которая хорошо соответствует клиническому статусу по всему спектру БА45,46. Тау-нагрузка и топография лучше коррелируют с клиническими симптомами, чем амилоидная нагрузка47.
В 2011 году NIA-AA классифицировала позитивность «А» как «континуум Альцгеймера». В 2018 году была создана и уточнена структура исследования БА на основе биомаркеров, в которой указано, что пациенты на этой стадии имеют патологические изменения БА27. В пересмотренных критериях стадии AD, опубликованных в 2024 году, отмечается, что A+T- являются начальной стадией48. В некоторых случаях может пройти много лет, прежде чем у них появятся клинические симптомы. Лица с положительным результатом на биомаркеры в категориях «А» и «Т» классифицируются как имеющие БА. Предыдущие исследования показали, что у тау-отрицательных лиц реже проявляются признаки болезни Альцгеймера, и что у большинства пациентов деменция не прогрессирует в течение как минимум 5 летнаблюдения. У пациентов с тау-положительным ЛКН может развиться болезнь Альцгеймера. Если у пациента наблюдается широкое поглощение тестостерона и положительный результат на N, это означает, что он находится на поздней стадии заболевания. Таким образом, выявление патологии тау-белка и нейродегенерации имеет важное значение для точного ведения пациента. Предыдущие исследования показали, что люди с отрицательным уровнем тау-белка с меньшей вероятностью проявляли клинические признаки, связанные с болезнью Альцгеймера, и у большинства из них не развивалась деменция в течение периода наблюдения, по крайней мере, в течениепяти лет. Ранняя диагностика in vivo легких когнитивных нарушений с тау-положительным результатом, которые могут прогрессировать до болезни Альцгеймера, имеет важное значение для точного ведения пациента.
Ранее информация, полученная с помощью ПЭТ и МРТ, требовала параллельного анализа последовательно полученных данных с последующим апостериорным слиянием для обеспечения хорошей пространственной регистрации. Тем не менее, психическое состояние и физиологические или когнитивные состояния субъекта могут меняться между обследованиями. Гибридная ПЭТ/МРТ отображает различную физиологическую и метаболическую информацию о процессе заболевания путем временного и пространственного сопоставления наборов данных.
Раскрытие информации
Авторы не могут заявить о конфликте интересов.
Благодарности
Эта работа была поддержана грантами от Ключевого плана исследований и разработок провинции Ляонин (2019JH/10300010) и Программы прикладных фундаментальных исследований провинции Ляонин (2022JH2/101500011).
Материалы
| Name | Company | Catalog Number | Comments |
| 18O-rich water | Taiyo Nippon Sanso,Japan | 24-0091 | |
| 2020 edition of Pharmacopoeia of the People's Republic of China | NA | https://english.nmpa.gov.cn/2020-07/03/c_538689.htm | |
| Acetonitrile | ABX,Germany | TF-A1-231207002 | |
| air filter membrane (Millex-25) | Merck,Germany | SLFGN25VS | |
| Boc-protected-precursor | Huayi,Jiangsu,China | NPPI-95-0001A | |
| C18 column | Waters,USA | 186004770 | |
| Cyclotron | GE,USA | MINITRACE | |
| Dimethyl sulfoxide (DMSO) | Bailing Wei Technology,Beijing,China | 984549 | |
| EtOH | ABX,Germany | 10009216 | |
| EtOH for isolation | Sinopharm Chemical Reagent,Shanghai,China | 400212682 | |
| Gas chromatography | Tianmei,Shanghai,China | GC-7900 | |
| HPLC | SYKNM,Germany | S-1122 | |
| Hydrochloric acid | Sinopharm Chemical Reagent,Shanghai,China | 10011018 | |
| K2CO3 Solution | ABX,Germany | TF-K1-230724001 | |
| Kryptofix[2.2.2](K222) | ABX,Germany | 800 | |
| liquid filter membrane (Millex-GV) | Merck,Germany | SLGVR33RB | |
| Oasis HLB solid-phase extraction (SPE) column | Waters,USA | 186003908 | |
| PET/MR | GE,USA | Signa | |
| QMA column | Waters,USA | 186002350 | |
| Radionuclide activity | Capintec,USA | CRC-25R |
Ссылки
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Rajan, K. B., et al. Population estimate of people with clinical AD and mild cognitive impairment in the United States (2020-2060). Alzheimers Dement. 17 (12), 1966-1975 (2021).
- U.S. Burden of Disease Collaborators. The state of U.S. health, 1990-2016: Burden of diseases, injuries, and risk factors among U.S. states. JAMA. 319 (14), 1444-1472 (2018).
- Bhatt, J., et al. The World Alzheimer Report 2019: Attitudes to dementia. , (2019).
- Rostagno, A. A. Pathogenesis of Alzheimer's disease. Int J Mol Sci. 24 (1), 107(2022).
- Ossenkoppele, R., van der Kant, R., Hansson, O. Tau biomarkers in Alzheimer's disease: Towards implementation in clinical practice and trials. Lancet Neurol. 21 (8), 726-734 (2022).
- Abbott, A. Conquering Alzheimer's: A look at the therapies of the future. Nature. 616 (7955), 26-28 (2023).
- Politis, M., Piccini, P. Positron emission tomography imaging in neurological disorders. J Neurol. 259 (9), 1769-1780 (2012).
- Okamura, N., et al. Tau PET imaging in Alzheimer's disease. Curr Neurol Neurosci Rep. 14 (11), 500(2014).
- Holland, N., et al. Differential synaptic loss in β-amyloid positive versus β-amyloid negative corticobasal syndrome. Mov Disord. 39 (7), 1166-1178 (2024).
- Nicastro, N., et al. 18F-AV1451 PET imaging and multimodal MRI changes in progressive supranuclear palsy. J Neurol. 267 (2), 341-349 (2020).
- Cousins, O., et al. Microglial activation, tau and amyloid deposition in TREM2 p.R47H carriers and mild cognitive impairment patients: A multi-modal/multi-tracer PET/MRI imaging study with influenza vaccine immune challenge. J Neuroinflammation. 20 (1), 272(2023).
- Chien, D., et al. Early clinical PET imaging results with the novel PHF-tau radioligand [F18]-T808. J Alzheimers Dis. 38 (1), 171-184 (2014).
- Maruyama, M., et al. Imaging of tau pathology in a tauopathy mouse model and in Alzheimer patients compared to normal controls. Neuron. 79 (6), 1094-1108 (2013).
- Li, Y., et al. Cortical laminar binding of PET amyloid and tau tracers in Alzheimer disease. J Nucl Med. 56 (2), 270-273 (2015).
- Fodero-Tavoletti, M. T., et al. 18F-THK523: A novel in vivo tau imaging ligand for Alzheimer's disease. Brain. 134 (4), 1089-1100 (2011).
- Okamura, N., et al. Non-invasive assessment of Alzheimer's disease neurofibrillary pathology using 18F-THK5105 PET. Brain. 137 (Pt 6), 1762-1771 (2014).
- Tago, T., et al. Preclinical evaluation of [(18)F]THK-5105 enantiomers: Effects of chirality on its effectiveness as a tau imaging radiotracer. Mol Imaging Biol. 18 (2), 258-266 (2016).
- Xia, C. F., et al. [18F]T807, a novel tau positron emission tomography imaging agent for Alzheimer's disease. Alzheimers Dement. 9, 666-676 (2013).
- Fleisher, A. S., et al. Positron emission tomography imaging with [18F]flortaucipir and postmortem assessment of Alzheimer disease neuropathologic changes. JAMA Neurol. 77 (7), 829-839 (2020).
- Whitwell, J., et al. [18F]AV-1451 tau positron emission tomography in progressive supranuclear palsy. Mov Disord. 32 (1), 124-133 (2017).
- Kantarci, K., et al. AV-1451 Tau and β-amyloid positron emission tomography imaging in dementia with Lewy bodies. Ann Neurol. 81 (1), 58-67 (2017).
- Mossine, A. V., et al. An updated radiosynthesis of [18F]AV1451 for tau PET imaging. EJNMMI Radiopharm Chem. 2 (1), 7(2017).
- McKhann, G., et al. Clinical diagnosis of Alzheimer's disease: Report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology. 34 (7), 939-944 (1984).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 7 (3), 263-269 (2011).
- Chandra, A., et al. Alzheimer's Disease Neuroimaging Initiative. Applications of amyloid, Tau, and neuroinflammation PET imaging to Alzheimer's disease and mild cognitive impairment. Hum Brain Mapp. 40 (18), 5424-5442 (2019).
- Jack, C. R., et al. NIA-AA research framework: Toward a biological definition of Alzheimer's disease. Alzheimers Dement. 14 (4), 535-562 (2018).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging and the Alzheimer's Association Workgroup. Alzheimers Dement. 7, 263-269 (2011).
- Albert, M. S., et al. The diagnosis of mild cognitive impairment due to Alzheimer's disease: Recommendations from the National Institute on Aging and Alzheimer's Association Workgroup. Alzheimers Dement. 7, 270-279 (2011).
- Simrén, J., Elmgren, A., Blennow, K., Zetterberg, H. Fluid biomarkers in Alzheimer's disease. Adv Clin Chem. 112, 249-281 (2023).
- Molinuevo, J. L., et al. Current state of Alzheimer's fluid biomarkers. Acta Neuropathol. 136, 821-853 (2018).
- Alcolea, D., et al. Amyloid precursor protein metabolism and inflammation markers in preclinical Alzheimer disease. Neurology. 85, 626-633 (2015).
- Ia, J., et al. Biomarker changes during 20 years preceding Alzheimer's disease. N Engl J Med. 390 (8), 712-722 (2024).
- Leung, K. K., et al. Cerebral atrophy in mild cognitive impairment and Alzheimer disease: Rates and acceleration. Neurology. 80 (7), 648-654 (2013).
- Contador, J., et al. Longitudinal brain atrophy and CSF biomarkers in early-onset Alzheimer's disease. Neuroimage Clin. 32, 102804(2021).
- Menéndez-González, M., de Celis Alonso, B., Salas-Pacheco, J., Arias-Carrión, O. Structural neuroimaging of the medial temporal lobe in Alzheimer's disease clinical trials. J Alzheimers Dis. 48 (3), 581-589 (2015).
- van Oostveen, W. M., de Lange, E. C. M. Imaging techniques in Alzheimer's disease: A review of applications in early diagnosis and longitudinal monitoring. Int J Mol Sci. 22 (4), 2110(2021).
- Reiman, E. M., Jagust, W. J. Brain imaging in the study of Alzheimer's disease. Neuroimage. 61 (2), 505-516 (2012).
- Herholz, K. Perfusion SPECT and FDG-PET. Int Psychogeriatr. 23 (Suppl 2), S25-S31 (2011).
- Lamontagne-Kam, D., et al. Implication of tau propagation on neurodegeneration in Alzheimer's disease. Front Neurosci. 17, 1219299(2023).
- Gomar, J. J., et al. Increased retention of tau PET ligand [18F]-AV1451 in Alzheimer's disease psychosis. Transl Psychiatry. 12 (1), 82(2022).
- Shoup, T. M., et al. A concise radiosynthesis of the tau radiopharmaceutical [(18)F]T807. J Labelled Compd Radiopharm. 56 (14), 736-740 (2013).
- Schwarz, A. J., et al. Regional profiles of the candidate tau PET ligand 18F-AV-1451 recapitulate key features of Braak histopathological stages. Brain. 139, 1539-1550 (2016).
- Pascoal, T. A., et al. Longitudinal 18F-MK-6240 tau tangles accumulation follows Braak stages. Brain. 144, 3517-3528 (2021).
- Braak, H., Braak, E. Neuropathological staging of Alzheimer-related changes. Acta Neuropathol. 82, 239-259 (1991).
- Braak, H., et al. Staging of Alzheimer disease-associated neurofibrillary pathology using paraffin sections and immunocytochemistry. Acta Neuropathol. 112, 389-404 (2006).
- Ossenkoppele, R., et al. Associations between Tau, Aβ, and cortical thickness with cognition in Alzheimer disease. Neurology. 92, e601-e612 (2019).
- Jack, C. R., et al. Revised criteria for diagnosis and staging of Alzheimer's disease: Alzheimer's Association Workgroup. Alzheimers Dement. 20 (8), 5143-5169 (2024).
- Josephs, K. A., Weigand, S. D., Whitwell, J. L. Characterizing amyloid-positive individuals with normal tau PET levels after 5 years. Neurology. 98, e2282-e2292 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены