Method Article
Imaging ibrido PET/MRI della malattia di Alzheimer basato su 18F-AV-1451
In questo articolo
Riepilogo
Questo protocollo descrive l'uso di 18F-AV-1451 PET/MRI per rivelare la patologia tau e la neurodegenerazione, aiutando i neurologi a diagnosticare la malattia di Alzheimer, valutarne la gravità e ottenere informazioni sulla sua progressione e sui meccanismi patologici sottostanti.
Abstract
La malattia di Alzheimer (AD) è una malattia neurodegenerativa progressiva e irreversibile caratterizzata da disfunzione cognitiva, declino delle capacità di vita quotidiana e cambiamenti comportamentali, che impone un significativo onere economico e sociale in tutto il mondo. Uno dei principali segni patologici dell'AD è l'accumulo di grovigli neurofibrillari formati dalla proteina tau iperfosforilata. La tomografia a emissione di positroni/risonanza magnetica (PET/MRI) fornisce informazioni strutturali e funzionali dettagliate insieme a specifiche distribuzioni proteiche, rendendola uno strumento sempre più prezioso per la diagnosi e la ricerca sull'AD. 18F-AV-1451 è un radiotracciante specificamente progettato per il rilevamento della proteina tau nell'imaging PET del tessuto cerebrale. Questo studio presenta un protocollo dettagliato per la radiosintesi di 18F-AV-1451, la preparazione del paziente, le tecniche di acquisizione delle immagini PET/MRI e le sue potenziali applicazioni nella valutazione dell'AD. 18La PET/MRI F-AV-1451 potrebbe aiutare i neurologi a diagnosticare l'AD, valutare la gravità della malattia e ottenere informazioni sui suoi meccanismi patologici. In conclusione, questo protocollo fornisce un approccio sensibile, completo e non invasivo per la valutazione dell'AD, offrendo preziose informazioni sulla progressione della malattia e sulla patologia.
Introduzione
La malattia di Alzheimer (AD) è una malattia neurodegenerativa progressiva e irreversibile. I pazienti in genere sperimentano disfunzione cognitiva, un declino delle capacità di vita quotidiana e cambiamenti comportamentali. Con l'accelerazione dell'invecchiamento della popolazione globale, il morbo di Alzheimer è diventato una delle principali preoccupazioni per la salute pubblica. Attualmente, più di 50 milioni di persone in tutto il mondo vivono con l'AD. Entro il 2050, si prevede che la prevalenza della demenza triplicherà a livello globale1. Circa il 10,8% degli individui di età pari o superiore a 65 anni ha la demenza di Alzheimer. La prevalenza dell'AD è di circa il 5% negli individui di età compresa tra 65 e 74 anni, aumentando al 33,3% in quelli di età pari o superiore a 85 anni, il che lo rende una delle principali cause di morte tra gli anziani2. Una volta che un paziente sviluppa l'AD, pone un onere significativo sulla famiglia3. A causa della sua insorgenza insidiosa, i pazienti spesso perdono la finestra ottimale per il trattamento dopo la diagnosi. La sua diagnosi precoce rimane una sfida globale4, poiché l'eziologia esatta non è ancora completamente compresa 5,6. Data la complessità dell'eziologia e dei percorsi che influenzano l'AD, c'è un urgente bisogno di strategie diagnostiche più accurate e precoci.
I metodi di imaging convenzionali come la tomografia computerizzata (TC) e la risonanza magnetica per immagini (MRI) vengono utilizzati per osservare l'atrofia o altri cambiamenti strutturali nel cervello, che possono contribuire al deterioramento cognitivo. La risonanza magnetica, in particolare, fornisce un migliore contrasto dei tessuti molli rispetto alla TC e offre informazioni sulla biologia del tumore senza esporre i pazienti a radiazioni ionizzanti, rendendola la modalità di imaging preferita per la maggior parte dei disturbi neurologici6. La risonanza magnetica è una potente tecnica di imaging che non solo fornisce informazioni anatomiche macroscopiche dettagliate, ma include anche vari metodi di imaging funzionale, come la risonanza magnetica funzionale dipendente dal livello di ossigeno nel sangue (BOLD fMRI), che può essere utilizzata per osservare l'attività cerebrale funzionale6. La tomografia a emissione di positroni (PET) è un metodo di imaging molecolare non invasivo che consente un'analisi semiquantitativa approfondita dei processi biologici nel cervello umano. La PET/MRI ibrida può offrire vantaggi rispetto ad altre tecniche di imaging per la diagnosi di AD7, poiché l'uso di un'ampia varietà di traccianti PET può fornire ulteriori informazioni fisiologiche per integrare le immagini anatomiche MRI 8,9.
I grovigli neurofibrillari formati dall'iperfosforilazione della proteina tau sono una delle caratteristiche patologiche dell'AD, strettamente associati all'insorgenza della neurodegenerazione e alla manifestazione dei sintomi clinici sia spazialmente che temporalmente6. La proteina tau è la proteina associata ai microtubuli più abbondante in vivo ed è prevalente sia nel sistema nervoso periferico che in quello centrale. La progressione patologica della tau è fortemente correlata con il grado di deterioramento cognitivo e ha il potenziale per fungere da bersaglio terapeutico per i pazienti con AD7. Il rilevamento non invasivo della deposizione di proteina tau in specifiche regioni cerebrali è prezioso per la previsione e la diagnosi precoce della malattia. L'uso di radiotraccianti tau consente la visualizzazione e la localizzazione dei depositi di proteina tau nel cervello, fornendo una diagnosi differenziale tempestiva e accurata, nonché un valido supporto nel monitoraggio della progressione della malattia e nella valutazione dei trattamenti clinici sperimentali 8,9.
Diversi studi hanno dimostrato una relazione tra i cambiamenti in proteine specifiche e i risultati della risonanza magnetica funzionale o morfologica10,11. Tuttavia, ci sono rapporti limitati sulle analisi combinate che utilizzano l'imaging amiloide/tau e la risonanza magnetica funzionale12. Il nuovo farmaco diagnostico molecolare 18F-AV-1451 (7-(6-[18F]fluoropiridin-3il)-5H-pirido[4,3-b]indolo) è stato utilizzato come agente radiodiagnostico per la rilevazione della proteina tau nel tessuto cerebrale con imaging PET. La ricerca sull'imaging PET tau è ancora in fase di sviluppo, con solo pochi traccianti attualmente valutati, tra cui 18F-T807 (18F-AV-1451), 18F-T808 (18F-AV-680)13, 11C-PBB314, 18F-THK-511715, 18F-THK-52316 e 18F-THK-510517,18. 18F-AV-1451 è stato sviluppato commercialmente19ed è stato riportato per l'uso in pazienti con AD20, paralisi sopranucleare progressiva21 e demenza con corpi di Lewy22. Il processo di radiosintesi di 18F-AV-1451 richiede una complessa fase di purificazione per garantire che il prodotto finale soddisfi i requisiti di dosaggio per gli studi di imaging clinico23. Con la crescente applicazione di 18radiotraccianti marcati con F nella tecnologia di imaging PET, c'è una crescente domanda per la sintesi e lo sviluppo di nuovi radiotraccianti marcati con 18F. Questo studio presenta un metodo di imaging tau PET/MRI volto a fornire informazioni più dettagliate per la diagnosi dei pazienti con malattia di Alzheimer.
Protocollo
Lo studio è stato approvato dal Comitato Etico Medico locale e tutti i soggetti hanno fornito il consenso informato scritto prima della partecipazione. Tutti gli studi sono stati condotti in conformità con i principi della Dichiarazione di Helsinki. Tutti i soggetti sono stati sottoposti a valutazioni neurologiche e neuropsicologiche da parte di un operatore sanitario entro tre mesi prima e dopo l'imaging. I pazienti sono stati inclusi in base ai criteri24 del National Institute on Aging-Alzheimer's Disease Association (NINCDS-ADRDA) e ai criteri25 del National Institute on Aging-Alzheimer's Association (NAA). I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. 18Sintesi F-AV-1451
NOTA: Seguire i principi della protezione biologica e radiologica sul lavoro, nonché i principi dello smaltimento dei rifiuti medici e radioattivi, durante le operazioni.
- Dettagli sintetici
- Sintetizzare 2,5 mL di fluoruro [18F] utilizzando la reazione nucleare 18O(p, n)18F impiegando un acceleratore di particelle, con protoni a correnti integrate fino a 45 μA che bombardano per 40 minuti. Aggiungere fluoruro [18F] al modulo di sintesi automatizzato tramite la tubazione di trasferimento, facilitato dalla sovrapressione del gas elio. Utilizzare il modulo di sintesi nell'ordine mostrato nella Figura 1.
- Intrappolare il fluoruro [18F] su una colonna a scambio ionico (pre-attivare con 1 mL di etanolo e 2 mL di acqua) mantenendo l'acqua 18O nel recipiente di recupero.
- Lasciare che la soluzione di carbonato di potassio dal recipiente n. 1 (Figura 1) scorra attraverso le valvole designate e la colonna a scambio ionico per scambiarla con il fluoruro [18F], quindi eluire nel recipiente di reazione. Vedere la Tabella 1 per le soluzioni nei diversi recipienti.
- Sciogliere il fluoruro [18F] e un catalizzatore a trasferimento di fase a base di critande precaricato nel recipiente n. 2 nel recipiente di reazione.
- Aprire la valvola designata. Sottoporre la miscela di reazione a distillazione sotto vuoto con soffiaggio di azoto a 85 °C per 8 minuti, seguita da soffiaggio di azoto a 110 °C per 4 minuti per eliminare l'acqua residua.
- Aggiungere il precursore del recipiente n. 3 nel recipiente n. 12 e riscaldare a 130 °C per 10 minuti. La radiosintesi di 18F-AV-1451 è mostrata nella Figura 2.
- Raffreddare la miscela di reazione a 50 °C, quindi aprire le valvole designate per ripristinare la pressione atmosferica.
- Lavare la miscela di reazione nel recipiente n. 14 utilizzando un volume di 3 mL di fase mobile HPLC (soluzione acquosa di etanolo al 25%, pH regolato a 2,0) proveniente dai recipienti n. 5 e n. 6. Aprire le valvole designate per consentire l'ingresso della miscela nel circuito HPLC sotto pressione di elio.
- Introdurre il prodotto nella colonna semi-preparativa HPLC ed eluire con la fase mobile a una velocità di flusso di 5 mL/min. Osservare l'eluente utilizzando i contatori UV (λ = 254 nm) e radioattività.
- Raccogliere il prodotto nel pallone a fondo tondo tramite l'apposita valvola.
- Intrappolare e trattenere il prodotto all'interno della colonna C18 (attivata da 5 mL di etanolo e 10 mL di acqua).
- Aprire la valvola designata, lavare la colonna con acqua dal recipiente n. 9 nel contenitore dei rifiuti, quindi risciacquare nel flacone del prodotto con la soluzione dei recipienti n. 8 e n. 7.
- Far passare 18F-AV-1451 attraverso una membrana filtrante per liquidi da 0,22 μm nel flacone di raccolta nella cella calda di erogazione a pressione di elio.
- Controllo qualità
NOTA: Eseguire il controllo qualità su tre lotti consecutivi del prodotto. Assicurarsi che il controllo di qualità del prodotto soddisfi i criteri dell'edizione 2020 della Farmacopea della Repubblica Popolare Cinese (vedi Tabella dei materiali).- Condurre l'ispezione visiva posizionando il prodotto dietro il vetro al piombo e ispezionando il colore e la chiarezza.
- Determinare il valore del pH del prodotto utilizzando la carta per test di pH di precisione.
- Utilizzare l'HPLC per analizzare la purezza radiochimica del prodotto 8,16.
- Analizzare la purezza nucleare radioattiva del prodotto utilizzando il metodo dello spettrometro gamma17.
- Misurare accuratamente l'emivita del prodotto secondo la Farmacopea della Repubblica Popolare Cinese13.
- Applicare una pressione di 0,34 MPa alla membrana del filtro sterile (passaggio 1.1.12) per testarne la tenuta e l'integrità.
- Eseguire test di sterilità ed endotossine utilizzando la coltura batterica e il metodo23 del reagente del granchio a ferro di cavallo.
- Testare il residuo del catalizzatore a trasferimento di fase a base di criptando utilizzando il metodo dello iodoplatinato di potassio. Analizzare il contenuto di acetone, acetonitrile e DMSO nel prodotto utilizzando un gascromatografo 8,16.
NOTA: Assicurarsi che non appaiano altri picchi, ad eccezione di 0,511 MeV e 1,022 MeV.
2. Linee guida per l'esame preliminare
NOTA: I partecipanti sono stati inclusi se avevano una preoccupazione attuale riguardo a un cambiamento nella cognizione e mostravano una compromissione in uno o più domini cognitivi pur mantenendo l'indipendenza nelle abilità funzionali25. L'idoneità richiedeva un punteggio del Mini-Mental State Examination (MMSE) compreso tra 0 e 20 e la positività della proteina amiloide, confermata attraverso un rapporto Aβ42 o Aβ42/Aβ40 anomalo del liquido cerebrospinale (CSF) o una tomografia a emissione di positroni amiloide (PET) positiva 6,20. I criteri di esclusione comprendevano una diagnosi di malattia vascolare, depressione, lesione cerebrale traumatica, disturbi psicotici o altre condizioni associate al declino cognitivo5. Sono stati esclusi i partecipanti con controindicazioni a pacemaker, sostanze ferromagnetiche o corpi estranei che rappresentano un pericolo per la mobilità, nonché quelli che non sono stati in grado di sottoporsi a risonanza magnetica. Ulteriori criteri di esclusione includevano l'intolleranza ai mezzi di contrasto al gadolinio e la presenza di grave insufficienza renale21.
- Istruire i soggetti ad astenersi da alcol, caffeina, farmaci o qualsiasi esercizio o attività faticosa per 24 ore prima dello studio. Mantenere uno stato fisiologico stabile (ad esempio, bioritmi, attività di funzione cerebrale) per garantire l'accuratezza dei dati.
- Consentire ai soggetti di consumare acqua e cibo prima dell'esame, poiché questi non interferiscono con l'imaging PET/RM tau.
- Interrompere i farmaci neurologici per almeno 12 ore prima dell'imaging.
- Consigliare ai soggetti di evitare di indossare gioielli in metallo o indumenti con bottoni o cerniere in metallo il giorno dell'esame.
NOTA: Assicurarsi che il paziente sia accompagnato da un familiare, porti con sé i registri degli esami precedenti e informi il personale medico sull'uso dei farmaci.
3. Preparazione per la scansione
- Verificare il modulo di domanda per confermare le informazioni generali, lo scopo dell'esame e il programma. Assicurarsi che tutti i preparativi necessari siano stati completati. Registrati e archivia i dettagli.
- Ottenere il consenso informato per l'imaging PET/RM dal soggetto o da un familiare. Informare il soggetto dello scopo, della procedura, dei rischi e dei benefici.
- Condurre una revisione dettagliata dell'anamnesi, registrare l'altezza, il peso e la concentrazione ematica del soggetto e confermare l'assenza di controindicazioni all'esame RM.
- Stabilire una linea endovenosa in una vena superficiale periferica o accedere a un catetere di porta.
- Prima di somministrare 18F-AV-1451, verificare nuovamente tutte le informazioni per evitare errori.
- Iniettare lentamente 18F-AV-1451 a 3,7-5,5 MBq/kg attraverso l'accesso endovenoso. Sciacquare la provetta con una quantità adeguata di soluzione fisiologica per ridurre al minimo i residui di tracciante radioattivo. Applicare una compressione sul sito di iniezione per evitare perdite di liquido.
- Registrare l'ora, il sito e l'attività dell'iniezione.
- Dopo aver completato l'iniezione, iniziare la chiusura audiovisiva. Abbassa le luci nell'attesa
ambiente e impostare la temperatura a circa 22 °C. Istruire il soggetto a riposare a letto con gli occhi chiusi per 80 minuti, evitando di parlare, mangiare o masticare durante questo periodo.
4. Scansione PET/MRI
- Istruire il soggetto e il compagno a rimuovere tutti gli oggetti metallici, inclusi telefoni cellulari, copricapi, protesi dentarie, occhiali, orologi, portafogli e monete, prima dell'esame. Non consentire l'ingresso di sedie a rotelle, barelle, lettini da visita, bombole di ossigeno o apparecchiature di monitoraggio nella sala d'esame.
- Fornire tappi per le orecchie al soggetto e posizionarlo supino sul tavolo PET/MRI con una spirale testa/collo che racchiude la regione cervicale. Utilizzare un poggiatesta specializzato o un cuscinetto in spugna per stabilizzare la testa, riducendo al minimo i movimenti e garantendo il comfort.
NOTA: Somministrare una dose appropriata di farmaco sedativo, se necessario, sulla base di una valutazione neurologica. - Posizionare il soggetto con le braccia abbassate e istruirlo a utilizzare il dispositivo di allarme in caso di disagio.
- Esaminare le immagini per verificare che la testa sia centrata nello scanner, allineata con il centro della bobina e posizionata in modo coerente rispetto al collo.
- Utilizzare una bobina di unione testa e collo a 8 canali per l'imaging.
- Acquisisci sequenze volumetriche T1 3D cerebrali con alta risoluzione e un elevato rapporto segnale/rumore (SNR) utilizzando una sequenza richiamata in gradiente viziato. Impostare i seguenti parametri:
- Tempo di ripetizione (TR) = 8,5 ms; Tempo di eco (TE) = 3,2 ms; Tempo di inversione (TI) = 450 ms; Angolo di ribaltamento = 12°; Dimensione voxel = 1 × 1 × 1 mm³; Campo visivo (FOV) = 256 mm; Dimensione della matrice = 256 × 256; Spessore fetta = 1 mm.
- Acquisire sequenze assiali pesate PROPELLER T2 con i seguenti parametri: TR = 6837 ms; TE = 132 ms; Angolo di ribaltamento = 142°; Campo visivo = 240 mm; Dimensione della matrice = 416 × 416; Spessore fetta = 5 mm.
NOTA: La scansione PET utilizza una posizione a letto singolo, coprendo l'intero cervello dal forame magno alla parte superiore del cranio.
- Acquisizione simultanea di immagini PET di 20 minuti.
- Esegui la scansione PET in modalità di acquisizione 3D.
- Utilizzare la scansione volumetrica per l'imaging PET.
- Eseguire la correzione dell'attenuazione dell'imaging RM utilizzando una sequenza di impulsi ZTE (Zero Echo Time) per segmentare ossa, aria e tessuti molli.
- Acquisire dati PET utilizzando l'OSEM (Time-of-Flight Ordered Subset Expectation Maximization) per la ricostruzione dell'immagine20,23. Utilizzare i seguenti parametri:
- Dimensione della matrice = 192 × 192; 28 sottoinsiemi con 6 iterazioni; FOV = 350 × 350 mm; Larghezza totale a metà massimo (FWHM) = 3,0 mm.
- Calcolare il valore di assorbimento standardizzato (SUV) utilizzando la formula20,23:
SUV = (Attività della sfera (Bq/ml) × Peso corporeo (kg)) / Dose iniettata.
5. Interpretazione dell'immagine
- Valutare visivamente tutte le immagini PET/RM in modo indipendente da almeno due medici esperti di medicina nucleare all'oscuro della diagnosi clinica.
- Identificare i lobi cerebrali che presentano cambiamenti strutturali anomali e deposizione di proteine.
- Ripetere la valutazione visiva fino al raggiungimento di un consenso finale.
- Definisci una "scansione positiva" come un aumento dell'assorbimento di 18F-AV-1451 in una o tutte le regioni corticali. Definire una "scansione negativa" come l'assenza di captazione di 18F-AV-1451 in tutte le regioni corticali.
- Definire l'atrofia nel lobo temporale mediale, in particolare nell'ippocampo alla risonanza magnetica, come neurodegenerazione20,25.
Risultati
18Risultati della sintesi di F-AV-1451
La sintesi in un solo passaggio di 18F-AV-1451 in condizioni di reazione ottimizzate ha aumentato la resa di sintesi al 25,7% ± al 5,8%. Il tempo di reazione totale è stato di 70 minuti. Nella Figura 3 è mostrato un tipico spettro HPLC e UV semi-preparativo, dove il picco 2 rappresenta il picco del prodotto.
Risultati dei test di qualità
Per tre lotti consecutivi, i risultati del controllo di qualità sono stati i seguenti: la soluzione era incolore, visivamente trasparente e priva di impurità evidenti. Il pH variava da 4,5 a 7,5. Le analisi HPLC e TLC hanno dimostrato che la purezza chimica era del >95% e la purezza radiochimica del >95%. L'energia del fotone primario era di 0,511 MeV. L'emivita soddisfaceva le specifiche richieste, esclusi gli isotopi a lunga emivita (t1/2 > 5 giorni). La membrana del filtro sterile è stata pressurizzata a 0,34 MPa senza perdite d'aria. I livelli di endotossine erano di <15 EU per 1 ml di prodotto. La coltura batterica ha confermato la sterilità. K2. 2. 2 è stata di ≤50 μg/mL. Inoltre, i solventi residui come acetone, acetonitrile e DMSO soddisfacevano gli standard della Farmacopea della Repubblica Popolare Cinese (vedi Tabella dei materiali).
18Risultati PET/MR F-AV-1451
La Figura 4 presenta un esempio di imaging PET/RM in un uomo di 69 anni con declino cognitivo persistente (punteggio MMSE: 19/30) con deposizione di tau positiva. Le immagini mostrano una significativa atrofia cerebrale, caratterizzata principalmente da un giro della sostanza grigia allargato e approfondito e da ventricoli allargati. I sottogruppi AD hanno mostrato un significativo legame con 18F-AV-1451 con la varia distribuzione regionale. L'accumulo di tau è iniziato nella corteccia entorinale e nell'ippocampo, poi si è diffuso alla corteccia temporale e parietale e alla fine si è esteso ampiamente in tutta la corteccia cerebrale.
La Figura 5 presenta un esempio di imaging PET/RM in un uomo di 68 anni con declino cognitivo (punteggio MMSE: 24/30) con deposizione di tau negativa. Le immagini mostrano una normale morfologia del parenchima cerebrale bilateralmente, con captazione uniforme e simmetrica della radioattività di 18F-AV-1451. La risonanza magnetica della stessa sessione di imaging ha mostrato dimensioni e morfologia ventricolare normali, senza spostamento della linea mediana e senza segnali anomali rilevati nel parenchima cerebrale. C'è stata una captazione aspecifica nei gangli della base e nel tronco encefalico.
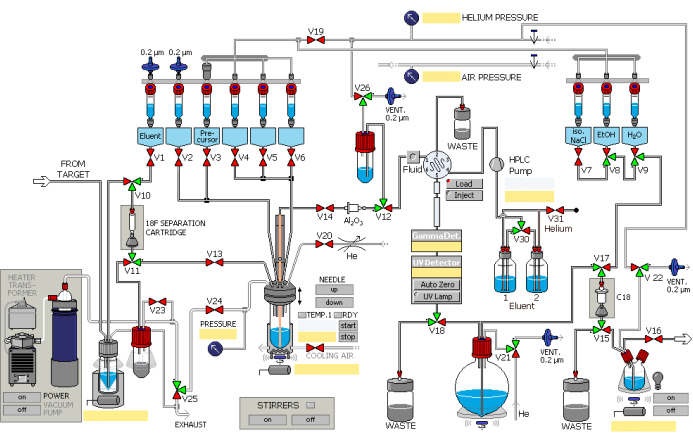
Figura 1: Schema schematico del modulo di radiosintesi. Il modulo di sintesi funziona in sequenza secondo i passaggi designati. Clicca qui per visualizzare una versione più grande di questa figura.
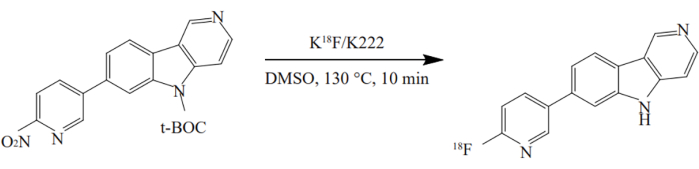
Figura 2: Radiosintesi di 18F-AV-1451. Il composto è stato sintetizzato utilizzando un metodo one-pot in condizioni ottimizzate. Il nitro-precursore è stato fatto reagire con K[18F]/K2.2.2 in DMSO a 130 °C per 10 minuti. Clicca qui per vedere una versione più grande di questa figura.
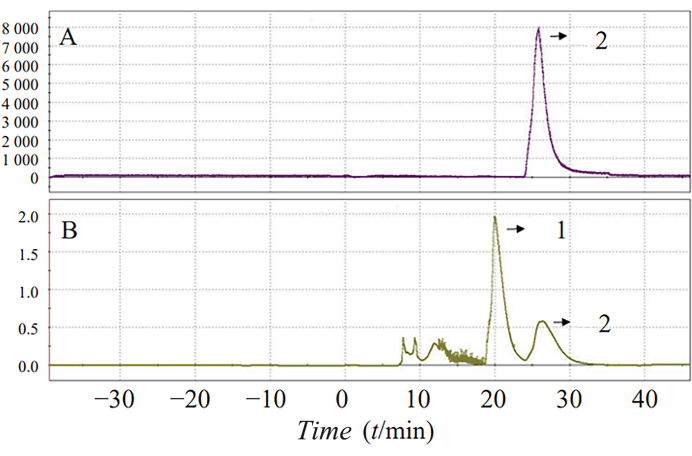
Figura 3: Separazione HPLC (A) e UV (B) della radioattività 18F-AV-1451. Vengono mostrati gli spettri HPLC e UV semi-preparativi. Il picco 2 rappresenta il picco del prodotto. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Dati di imaging rappresentativi di un paziente con deposizione di tau positiva. (A) 18immagini PET F-AV-1451. (B) Immagini assiali pesate in T1 (T1WI). (C) Immagini assiali pesate in T2 (T2WI). (D) Immagini assiali di fusione PET/MR 18F-AV-1451. Le immagini T1WI e T2WI mostrano una riduzione bilaterale del volume dell'ippocampo, dilatazione ventricolare, allargamento e approfondimento delle fessure sulcali e nessuno spostamento della struttura della linea mediana. 18Le immagini di fusione PET/RM F-AV-1451 rivelano una scansione PET tau positiva, con captazione nel giro frontale mediale, nel cuneo anteriore, nel giro temporale inferiore e nella corteccia occipitale laterale. Clicca qui per visualizzare una versione più grande di questa figura.
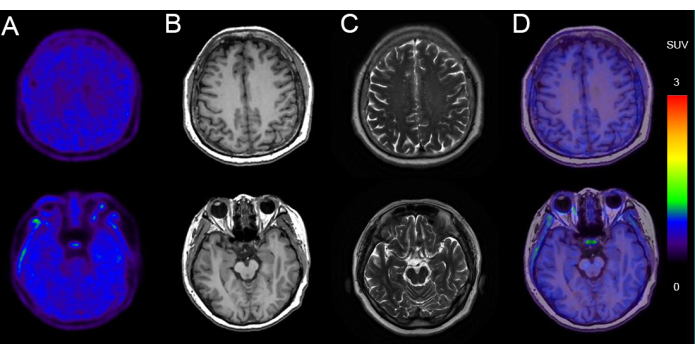
Figura 5: Dati di imaging rappresentativi di un paziente con deposizione di tau negativa. (A) 18immagini PET F-AV-1451. (B) Immagini assiali pesate in T1 (T1WI). (C) Immagini assiali pesate in T2 (T2WI). (D) Immagini assiali di fusione PET/MR 18F-AV-1451. Le immagini T1WI e T2WI mostrano una risonanza magnetica cerebrale normale, senza atrofia significativa del lobo temporale indicativa di neurodegenerazione. 18Le immagini di fusione PET/RM F-AV-1451 mostrano una scansione PET tau normale, senza alcuna captazione corticale specifica indicativa di taupatia. Clicca qui per visualizzare una versione più grande di questa figura.
| Flacone solvente | solvente |
| No.1 | 1,5 mg di K2CO3 in 0,5 ml di acqua |
| No.2 | 1,5 mg di K2.2.2. in 1 ml di acetonitrile |
| n.3 | 1 mg di precursore in 1,2 ml di solvente DMSO |
| No.5 | 1,5 ml di HPLC in fase mobile |
| No.6 | 1,5 ml di HPLC in fase mobile |
| Pallone a fondo tondo | 2 ml di soluzione acquosa di NaHCO3 all'84% e 30 ml di acqua |
| No.7 | 9 ml di soluzione fisiologica allo 0,9% |
| No.8 | 1 ml di EtOH |
| No.9 | 10 ml di acqua |
Tabella 1: Soluzioni presenti in diversi recipienti del modulo di radiosintesi.
Discussione
In questo manoscritto metodologico, abbiamo introdotto una radiosintesi aggiornata di 18F-AV-1451 per l'imaging PET tau e le tecniche per l'acquisizione di immagini PET/MRI 18F-AV-1451, e abbiamo fornito la potenziale utilità di 18F-AV-1451 PET/MR per la valutazione dell'AD. La TC o la risonanza magnetica cerebrale convenzionale di solito fornisce una valutazione strutturale anatomica macroscopica, che limita la valutazione della progressione della malattia e la previsione della prognosi. La PET è uno strumento di neuroimaging che consente di misurare i processi molecolari in vivo . I radioligandi PET possono legare bersagli, inclusi recettori, proteine trasportatrici o enzimi26. La tecnologia è stata utilizzata nella diagnosi di disturbi neurologici, nello sviluppo di programmi e nella valutazione della progressione della malattia. La PET/MRI è un nuovo sistema ibrido di imaging cerebrale funzionale che combina la tomografia a emissione di positroni (PET) e la risonanza magnetica. A causa dell'ampia varietà di traccianti PET, la PET/RM può fornire ulteriori informazioni fisiologiche oltre alle immagini anatomiche della risonanza magnetica. L'acquisizione simultanea dei dati PET e MRI aiuterà a sfruttare i vantaggi intrinseci di entrambe le tecnologie ed eliminare il potenziale ritardo di due ispezioni separate, aumentando al contempo l'efficienza e la comodità per il paziente. La PET/MRI rimuove le radiazioni aggiuntive necessarie per la correzione dell'attenuazione e la correlazione anatomica nella parte TC di una PET/TC, il che può essere un grande vantaggio per pazienti speciali come donne in gravidanza, bambini piccoli e pazienti che necessitano di più esami di imaging PET.
Nel 2011 il National Institute on Aging and Alzheimer's Association (NIA-AA) ha proposto un quadro diagnostico (quadro A/T/N) basato su marcatori biologici27, tra cui la deposizione di β-amiloide (Aβ), la tau patologica (T) e la neurodegenerazione (N)28,29. Aβ è il componente delle placche senili, i cui marcatori includono misurazioni di livelli ridotti di Aβ42 nel liquido cerebrospinale (CSF) e la deposizione di Aβ dimostrata dalla PET. La tau patologica è il componente principale della fibrosi dei grovigli neurofibrillari, i cui marcatori includono l'aumento della tau totale o la tau fosforilata (p-tau) nel liquidocerebrospinale 30,31,32,33. Le misure della neurodegenerazione includono i tassi di atrofia cerebrale34,35 e il volume ippocampale o atrofia del lobo temporale mediale36,37 rilevati dalla risonanza magnetica e l'ipometabolismo o l'ipoperfusione ottenuti con la PET e la tomografia computerizzata a emissione di fotoni singoli (SPECT)38,39. La PET/MRI può offrire vantaggi rispetto ad altri metodi di imaging nella diagnosi di AD nel fornire simultaneamente la deposizione patologica di proteine e l'atrofia nella regione ippocampale in un'unica scansione.
Recentemente, sono stati resi disponibili nuovi traccianti PET per la rilevazione non invasiva in vivo della tau, il cui accumulo è una caratteristica distintiva della patologia AD40. 18F-AV1451 mostra un potente legame e selettività per la tau nel tessuto cerebrale dei pazienti con AD41, con una cinetica relativamente più lenta. Abbiamo usato 18F-AV1451 per esaminare la distribuzione delle proteine tau nel cervello dei pazienti con AD. 18F-AV-1451 è stato sintetizzato in diversi metodi. Questo studio ha automatizzato la sintesi di 18F-AV-1451 sul sintetizzatore TRACERlab FXFN utilizzando un metodo one-pot con condizioni ottimizzate. Il dosaggio del precursore è cambiato a 1 mg42. Contemporaneamente, le condizioni di separazione HPLC sono state regolate su una soluzione acquosa di EtOH al 25% con pH regolato a 2,0 per la deprotezione online della BOC. Sono state eseguite la conversione e la ripurificazione del solvente su una colonna C18. La resa della sintesi è stata aumentata dal 20,5% ± 6,1% al 25,7% ±5,8% applicando il metodo di sintesi migliorato. Il metodo ha migliorato la resa del prodotto. Vari test di controllo qualità eseguiti dopo la sintesi hanno dimostrato che il prodotto soddisfaceva gli standard di controllo qualità.
I risultati hanno mostrato che i pazienti con AD avevano un'evidente atrofia cerebrale, con un legame significativo di 18F-AV-1451. L'accumulo di tau inizia nella corteccia entorinale e nell'ippocampo, poi si diffonde alle cortecce temporale e parietale, e infine rimane ampiamente in tutta la corteccia cerebrale. La tau PET è uno strumento promettente e diversi studi hanno già valutato il valore diagnostico della tau-PET. Gli studi hanno dimostrato che la tau-PET, i modelli di legame, corrisponde bene alle descrizioni istopatologiche di Braak43,44, che è un quadro di stadiazione che corrisponde bene con lo stato clinico in tutto lo spettro AD45,46. Il carico di tau e la topografia si correlano meglio con i sintomi clinici rispetto al carico amiloide47.
Il NIA-AA ha classificato la positività "A" come "Alzheimer's Continuum" nel 201129. Nel 2018, è stato stabilito e perfezionato il quadro per la ricerca sull'AD basata su biomarcatori, affermando che i pazienti in questa fase presentano i cambiamenti patologici dell'AD27. Nei criteri rivisti per la stadiazione dell'AD, pubblicati nel 2024, si nota che A+T- sono allo stadio iniziale48. In alcuni casi, possono passare molti anni prima che compaiano i sintomi clinici. Gli individui che sono positivi ai biomarcatori in entrambe le categorie "A" e "T" sono classificati come affetti da AD. Studi precedenti hanno dimostrato che gli individui tau-negativi avevano meno probabilità di presentare caratteristiche di AD e che la maggior parte dei pazienti non progredisce verso la demenza durante almeno 5 anni di follow-up49. I pazienti con MCI tau-positivo possono evolvere in AD. Se il paziente ha un'ampia captazione di T ed è positivo per N, significa che si trova in uno stadio avanzato della malattia. Pertanto, il rilevamento della patologia tau e della neurodegenerazione è essenziale per una gestione accurata del paziente. Studi precedenti hanno indicato che gli individui con tau negatività avevano meno probabilità di mostrare caratteristiche cliniche associate all'Alzheimer e la maggior parte non ha sviluppato demenza in un periodo di follow-up di almenocinque anni. La diagnosi precoce in vivo di un lieve deterioramento cognitivo con tau positività, che può progredire verso la malattia di Alzheimer, è essenziale per una gestione precisa del paziente.
In precedenza, le informazioni ottenute con la PET e la risonanza magnetica richiedevano un'analisi parallela dei dati acquisiti in sequenza seguita da una fusione post hoc per fornire una buona registrazione spaziale. Tuttavia, lo stato mentale e le condizioni fisiologiche o cognitive di un soggetto possono cambiare tra un esame e l'altro. La PET/RM ibrida visualizza diverse informazioni fisiologiche e metaboliche sul processo patologico grazie a set di dati temporalmente e spazialmente corrispondenti.
Divulgazioni
Gli autori non hanno alcun conflitto di interessi da dichiarare.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni del Piano chiave di ricerca e sviluppo della provincia di Liaoning (2019JH/10300010) e del Programma di ricerca di base applicata della provincia di Liaoning (2022JH2/101500011).
Materiali
| Name | Company | Catalog Number | Comments |
| 18O-rich water | Taiyo Nippon Sanso,Japan | 24-0091 | |
| 2020 edition of Pharmacopoeia of the People's Republic of China | NA | https://english.nmpa.gov.cn/2020-07/03/c_538689.htm | |
| Acetonitrile | ABX,Germany | TF-A1-231207002 | |
| air filter membrane (Millex-25) | Merck,Germany | SLFGN25VS | |
| Boc-protected-precursor | Huayi,Jiangsu,China | NPPI-95-0001A | |
| C18 column | Waters,USA | 186004770 | |
| Cyclotron | GE,USA | MINITRACE | |
| Dimethyl sulfoxide (DMSO) | Bailing Wei Technology,Beijing,China | 984549 | |
| EtOH | ABX,Germany | 10009216 | |
| EtOH for isolation | Sinopharm Chemical Reagent,Shanghai,China | 400212682 | |
| Gas chromatography | Tianmei,Shanghai,China | GC-7900 | |
| HPLC | SYKNM,Germany | S-1122 | |
| Hydrochloric acid | Sinopharm Chemical Reagent,Shanghai,China | 10011018 | |
| K2CO3 Solution | ABX,Germany | TF-K1-230724001 | |
| Kryptofix[2.2.2](K222) | ABX,Germany | 800 | |
| liquid filter membrane (Millex-GV) | Merck,Germany | SLGVR33RB | |
| Oasis HLB solid-phase extraction (SPE) column | Waters,USA | 186003908 | |
| PET/MR | GE,USA | Signa | |
| QMA column | Waters,USA | 186002350 | |
| Radionuclide activity | Capintec,USA | CRC-25R |
Riferimenti
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Rajan, K. B., et al. Population estimate of people with clinical AD and mild cognitive impairment in the United States (2020-2060). Alzheimers Dement. 17 (12), 1966-1975 (2021).
- U.S. Burden of Disease Collaborators. The state of U.S. health, 1990-2016: Burden of diseases, injuries, and risk factors among U.S. states. JAMA. 319 (14), 1444-1472 (2018).
- Bhatt, J., et al. The World Alzheimer Report 2019: Attitudes to dementia. , (2019).
- Rostagno, A. A. Pathogenesis of Alzheimer's disease. Int J Mol Sci. 24 (1), 107(2022).
- Ossenkoppele, R., van der Kant, R., Hansson, O. Tau biomarkers in Alzheimer's disease: Towards implementation in clinical practice and trials. Lancet Neurol. 21 (8), 726-734 (2022).
- Abbott, A. Conquering Alzheimer's: A look at the therapies of the future. Nature. 616 (7955), 26-28 (2023).
- Politis, M., Piccini, P. Positron emission tomography imaging in neurological disorders. J Neurol. 259 (9), 1769-1780 (2012).
- Okamura, N., et al. Tau PET imaging in Alzheimer's disease. Curr Neurol Neurosci Rep. 14 (11), 500(2014).
- Holland, N., et al. Differential synaptic loss in β-amyloid positive versus β-amyloid negative corticobasal syndrome. Mov Disord. 39 (7), 1166-1178 (2024).
- Nicastro, N., et al. 18F-AV1451 PET imaging and multimodal MRI changes in progressive supranuclear palsy. J Neurol. 267 (2), 341-349 (2020).
- Cousins, O., et al. Microglial activation, tau and amyloid deposition in TREM2 p.R47H carriers and mild cognitive impairment patients: A multi-modal/multi-tracer PET/MRI imaging study with influenza vaccine immune challenge. J Neuroinflammation. 20 (1), 272(2023).
- Chien, D., et al. Early clinical PET imaging results with the novel PHF-tau radioligand [F18]-T808. J Alzheimers Dis. 38 (1), 171-184 (2014).
- Maruyama, M., et al. Imaging of tau pathology in a tauopathy mouse model and in Alzheimer patients compared to normal controls. Neuron. 79 (6), 1094-1108 (2013).
- Li, Y., et al. Cortical laminar binding of PET amyloid and tau tracers in Alzheimer disease. J Nucl Med. 56 (2), 270-273 (2015).
- Fodero-Tavoletti, M. T., et al. 18F-THK523: A novel in vivo tau imaging ligand for Alzheimer's disease. Brain. 134 (4), 1089-1100 (2011).
- Okamura, N., et al. Non-invasive assessment of Alzheimer's disease neurofibrillary pathology using 18F-THK5105 PET. Brain. 137 (Pt 6), 1762-1771 (2014).
- Tago, T., et al. Preclinical evaluation of [(18)F]THK-5105 enantiomers: Effects of chirality on its effectiveness as a tau imaging radiotracer. Mol Imaging Biol. 18 (2), 258-266 (2016).
- Xia, C. F., et al. [18F]T807, a novel tau positron emission tomography imaging agent for Alzheimer's disease. Alzheimers Dement. 9, 666-676 (2013).
- Fleisher, A. S., et al. Positron emission tomography imaging with [18F]flortaucipir and postmortem assessment of Alzheimer disease neuropathologic changes. JAMA Neurol. 77 (7), 829-839 (2020).
- Whitwell, J., et al. [18F]AV-1451 tau positron emission tomography in progressive supranuclear palsy. Mov Disord. 32 (1), 124-133 (2017).
- Kantarci, K., et al. AV-1451 Tau and β-amyloid positron emission tomography imaging in dementia with Lewy bodies. Ann Neurol. 81 (1), 58-67 (2017).
- Mossine, A. V., et al. An updated radiosynthesis of [18F]AV1451 for tau PET imaging. EJNMMI Radiopharm Chem. 2 (1), 7(2017).
- McKhann, G., et al. Clinical diagnosis of Alzheimer's disease: Report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology. 34 (7), 939-944 (1984).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 7 (3), 263-269 (2011).
- Chandra, A., et al. Alzheimer's Disease Neuroimaging Initiative. Applications of amyloid, Tau, and neuroinflammation PET imaging to Alzheimer's disease and mild cognitive impairment. Hum Brain Mapp. 40 (18), 5424-5442 (2019).
- Jack, C. R., et al. NIA-AA research framework: Toward a biological definition of Alzheimer's disease. Alzheimers Dement. 14 (4), 535-562 (2018).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging and the Alzheimer's Association Workgroup. Alzheimers Dement. 7, 263-269 (2011).
- Albert, M. S., et al. The diagnosis of mild cognitive impairment due to Alzheimer's disease: Recommendations from the National Institute on Aging and Alzheimer's Association Workgroup. Alzheimers Dement. 7, 270-279 (2011).
- Simrén, J., Elmgren, A., Blennow, K., Zetterberg, H. Fluid biomarkers in Alzheimer's disease. Adv Clin Chem. 112, 249-281 (2023).
- Molinuevo, J. L., et al. Current state of Alzheimer's fluid biomarkers. Acta Neuropathol. 136, 821-853 (2018).
- Alcolea, D., et al. Amyloid precursor protein metabolism and inflammation markers in preclinical Alzheimer disease. Neurology. 85, 626-633 (2015).
- Ia, J., et al. Biomarker changes during 20 years preceding Alzheimer's disease. N Engl J Med. 390 (8), 712-722 (2024).
- Leung, K. K., et al. Cerebral atrophy in mild cognitive impairment and Alzheimer disease: Rates and acceleration. Neurology. 80 (7), 648-654 (2013).
- Contador, J., et al. Longitudinal brain atrophy and CSF biomarkers in early-onset Alzheimer's disease. Neuroimage Clin. 32, 102804(2021).
- Menéndez-González, M., de Celis Alonso, B., Salas-Pacheco, J., Arias-Carrión, O. Structural neuroimaging of the medial temporal lobe in Alzheimer's disease clinical trials. J Alzheimers Dis. 48 (3), 581-589 (2015).
- van Oostveen, W. M., de Lange, E. C. M. Imaging techniques in Alzheimer's disease: A review of applications in early diagnosis and longitudinal monitoring. Int J Mol Sci. 22 (4), 2110(2021).
- Reiman, E. M., Jagust, W. J. Brain imaging in the study of Alzheimer's disease. Neuroimage. 61 (2), 505-516 (2012).
- Herholz, K. Perfusion SPECT and FDG-PET. Int Psychogeriatr. 23 (Suppl 2), S25-S31 (2011).
- Lamontagne-Kam, D., et al. Implication of tau propagation on neurodegeneration in Alzheimer's disease. Front Neurosci. 17, 1219299(2023).
- Gomar, J. J., et al. Increased retention of tau PET ligand [18F]-AV1451 in Alzheimer's disease psychosis. Transl Psychiatry. 12 (1), 82(2022).
- Shoup, T. M., et al. A concise radiosynthesis of the tau radiopharmaceutical [(18)F]T807. J Labelled Compd Radiopharm. 56 (14), 736-740 (2013).
- Schwarz, A. J., et al. Regional profiles of the candidate tau PET ligand 18F-AV-1451 recapitulate key features of Braak histopathological stages. Brain. 139, 1539-1550 (2016).
- Pascoal, T. A., et al. Longitudinal 18F-MK-6240 tau tangles accumulation follows Braak stages. Brain. 144, 3517-3528 (2021).
- Braak, H., Braak, E. Neuropathological staging of Alzheimer-related changes. Acta Neuropathol. 82, 239-259 (1991).
- Braak, H., et al. Staging of Alzheimer disease-associated neurofibrillary pathology using paraffin sections and immunocytochemistry. Acta Neuropathol. 112, 389-404 (2006).
- Ossenkoppele, R., et al. Associations between Tau, Aβ, and cortical thickness with cognition in Alzheimer disease. Neurology. 92, e601-e612 (2019).
- Jack, C. R., et al. Revised criteria for diagnosis and staging of Alzheimer's disease: Alzheimer's Association Workgroup. Alzheimers Dement. 20 (8), 5143-5169 (2024).
- Josephs, K. A., Weigand, S. D., Whitwell, J. L. Characterizing amyloid-positive individuals with normal tau PET levels after 5 years. Neurology. 98, e2282-e2292 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon