Method Article
Imagem híbrida de PET/MRI da doença de Alzheimer com base em 18F-AV-1451
Neste Artigo
Resumo
Este protocolo descreve o uso de 18F-AV-1451 PET/MRI para revelar patologia tau e neurodegeneração, auxiliando os neurologistas no diagnóstico da doença de Alzheimer, avaliando sua gravidade e obtendo informações sobre sua progressão e mecanismos patológicos subjacentes.
Resumo
A doença de Alzheimer (DA) é um distúrbio neurodegenerativo progressivo e irreversível caracterizado por disfunção cognitiva, declínio nas habilidades de vida diária e alterações comportamentais, impondo um ônus econômico e social significativo em todo o mundo. Uma das principais características patológicas da DA é o acúmulo de emaranhados neurofibrilares formados pela proteína tau hiperfosforilada. A tomografia por emissão de pósitrons/ressonância magnética (PET/MRI) fornece informações estruturais e funcionais detalhadas, juntamente com distribuições específicas de proteínas, tornando-se uma ferramenta cada vez mais valiosa para o diagnóstico e pesquisa da DA. 18O F-AV-1451 é um radiotraçador projetado especificamente para detecção de proteína tau em imagens PET do tecido cerebral. Este estudo apresenta um protocolo detalhado para a radiossíntese de 18F-AV-1451, preparação do paciente, técnicas de aquisição de imagens PET/RM e suas potenciais aplicações na avaliação da DA. 18O F-AV-1451 PET/MRI pode ajudar os neurologistas a diagnosticar a DA, avaliar a gravidade da doença e obter informações sobre seus mecanismos patológicos. Em conclusão, este protocolo fornece uma abordagem sensível, abrangente e não invasiva para a avaliação da DA, oferecendo informações valiosas sobre a progressão da doença e a patologia.
Introdução
A doença de Alzheimer (DA) é uma doença neurodegenerativa progressiva e irreversível. Os pacientes geralmente apresentam disfunção cognitiva, declínio nas habilidades da vida diária e alterações comportamentais. Com o envelhecimento acelerado da população global, a doença de Alzheimer tornou-se uma grande preocupação de saúde pública. Atualmente, mais de 50 milhões de pessoas em todo o mundo vivem com DA. Até 2050, espera-se que a prevalência de demência triplique globalmente1. Aproximadamente 10,8% dos indivíduos com 65 anos ou mais têm demência de Alzheimer. A prevalência de DA é de cerca de 5% em indivíduos de 65 a 74 anos, aumentando para 33,3% naqueles com 85 anos ou mais, tornando-se uma das principais causas de morte entre os idosos2. Uma vez que um paciente desenvolve DA, isso representa um fardo significativo para a família3. Devido ao seu início insidioso, os pacientes muitas vezes perdem a janela ideal para o tratamento após o diagnóstico. Sua detecção precoce continua sendo um desafio global4, pois a etiologia exata ainda não é completamente compreendida 5,6. Dada a etiologia complexa e as vias que influenciam a DA, há uma necessidade urgente de estratégias diagnósticas mais precisas e precoces.
Métodos convencionais de imagem, como tomografia computadorizada (TC) e ressonância magnética (RM), são usados para observar atrofia ou outras alterações estruturais no cérebro, que podem contribuir para o comprometimento cognitivo. A ressonância magnética, em particular, fornece melhor contraste de tecidos moles do que a TC e oferece informações sobre a biologia do tumor sem expor os pacientes à radiação ionizante, tornando-se a modalidade de imagem preferida para a maioria dos distúrbios neurológicos6. A ressonância magnética é uma poderosa técnica de imagem que não apenas fornece informações anatômicas macroscópicas detalhadas, mas também inclui vários métodos de imagem funcional, como ressonância magnética funcional dependente do nível de oxigênio no sangue (BOLD fMRI), que pode ser usada para observar a atividade cerebral funcional6. A tomografia por emissão de pósitrons (PET) é um método de imagem molecular não invasivo que permite uma extensa análise semiquantitativa de processos biológicos no cérebro humano. A PET/RM híbrida pode oferecer vantagens sobre outras técnicas de imagem para o diagnóstico de DA7, pois o uso de uma ampla variedade de traçadores de PET pode fornecer informações fisiológicas adicionais para complementar as imagens anatômicas de RM 8,9.
Os emaranhados neurofibrilares formados pela hiperfosforilação da proteína tau são uma das características patológicas da DA, intimamente associados ao aparecimento da neurodegeneração e à manifestação de sintomas clínicos tanto espacial quanto temporalmente6. A proteína Tau é a proteína associada a microtúbulos mais abundante in vivo e é prevalente nos sistemas nervosos periférico e central. A progressão patológica da tau está fortemente correlacionada com o grau de comprometimento cognitivo e tem potencial para servir como alvo terapêutico para pacientes com DA7. A detecção não invasiva da deposição de proteína tau em regiões cerebrais específicas é valiosa para a previsão e diagnóstico precoce da doença. O uso de radiotraçadores tau permite a visualização e localização dos depósitos de proteína tau no cérebro, fornecendo diagnóstico diferencial oportuno e preciso, bem como suporte valioso no rastreamento da progressão da doença e na avaliação de tratamentos clínicos experimentais 8,9.
Vários estudos têm demonstrado uma relação entre alterações em proteínas específicas e achados funcionais ou morfológicos daRM10,11. No entanto, há relatos limitados sobre análises combinadas usando imagens de amiloide/tau e ressonância magnética funcional12. O novo medicamento de diagnóstico molecular 18F-AV-1451 (7-(6-[18F]fluoropiridin-3yl)-5H-pirido[4,3-b]indol) tem sido usado como agente radiodiagnóstico para detecção de proteína tau em tecido cerebral com imagem de PET. A pesquisa em imagens de PET tau ainda está em seu estágio de desenvolvimento, com apenas alguns traçadores avaliados atualmente, incluindo 18F-T807 (18F-AV-1451), 18F-T808 (18F-AV-680)13, 11C-PBB314, 18F-THK-511715, 18F-THK-52316 e 18F-THK-510517,18. 18O F-AV-1451 foi desenvolvido comercialmente19e foi relatado para uso em pacientes com DA20, paralisia supranuclear progressiva21 e demência com corpos de Lewy22. O processo de radiossíntese de 18F-AV-1451 requer uma etapa de purificação complexa para garantir que o produto final atenda aos requisitos de dosagem para estudos de imagem clínica23. Com a crescente aplicação de radiotraçadores marcados com 18F na tecnologia de imagem PET, há uma demanda crescente pela síntese e desenvolvimento de novos radiotraçadores marcados com 18F. Este estudo apresenta um método de imagem tau PET/MRI com o objetivo de fornecer informações mais detalhadas para o diagnóstico de pacientes com doença de Alzheimer.
Protocolo
O estudo foi aprovado pelo Comitê de Ética Médica local, e todos os indivíduos forneceram consentimento informado por escrito antes da participação. Todos os estudos foram conduzidos de acordo com os princípios da Declaração de Helsinque. Todos os indivíduos foram submetidos a avaliações neurológicas e neuropsicológicas por um profissional de saúde dentro de três meses antes e após a realização da imagem. Os pacientes foram incluídos com base nos critérios do National Institute on Aging-Alzheimer's Disease Association (NINCDS-ADRDA)24 e dos critérios do National Institute on Aging-Alzheimer's Association (NAA)25. Os detalhes dos reagentes e equipamentos usados estão listados na Tabela de Materiais.
1. 18Síntese F-AV-1451
NOTA: Siga os princípios de proteção ocupacional biológica e radiológica, bem como os princípios de descarte de resíduos médicos e radioativos, durante as operações.
- Detalhes sintéticos
- Sintetize 2,5 mL de fluoreto [18F] usando a reação nuclear 18O(p, n)18F empregando um acelerador de partículas, com prótons em correntes integradas de até 45 μA bombardeando por 40 min. Adicione fluoreto [18F] ao módulo de síntese automatizada através do gasoduto de transferência, facilitado pela sobrepressão do gás hélio. Opere o módulo de síntese na ordem mostrada na Figura 1.
- Prenda o fluoreto [18F] em uma coluna de troca iônica (pré-ative com 1 mL de etanol e 2 mL de água) enquanto retém a água de 18O no recipiente de recuperação.
- Permitir que a solução de carbonato de potássio do recipiente nº 1 (Figura 1) flua através das válvulas designadas e da coluna de permuta iónica para trocar com o fluoreto [18F] e, em seguida, eluir para o recipiente de reacção. Consulte a Tabela 1 para soluções nos diferentes recipientes.
- Dissolva o fluoreto [18F] e um catalisador de transferência de fase à base de criptanda pré-carregado no recipiente nº 2 no recipiente de reação.
- Abra a válvula designada. Submeter a mistura de reação a destilação a vácuo sob sopro de nitrogênio a 85 °C por 8 min, seguido de sopro de nitrogênio a 110 °C por 4 min para eliminar a água residual.
- Adicione o precursor do recipiente nº 3 ao recipiente nº 12 e aqueça a 130 °C por 10 min. A radiossíntese de 18F-AV-1451 é mostrada na Figura 2.
- Resfrie a mistura de reação a 50 °C e, em seguida, abra as válvulas designadas para restaurar a pressão atmosférica.
- Lave a mistura de reação no recipiente nº 14 usando um volume de 3 mL de fase móvel de HPLC (solução aquosa de etanol a 25%, pH ajustado para 2,0) proveniente dos recipientes nº 5 e nº 6. Abra as válvulas designadas para permitir a entrada da mistura no circuito de HPLC sob pressão de hélio.
- Introduzir o produto na coluna semi-preparativa de HPLC e eluir com a fase móvel a um caudal de 5 ml/min. Observar o eluente utilizando contadores UV (λ = 254 nm) e de radioactividade.
- Recolha o produto no balão de fundo redondo através da válvula designada.
- Aprisionar e reter o produto dentro da coluna C18 (ativado por 5 mL de etanol e 10 mL de água).
- Abra a válvula designada, lave a coluna com água do recipiente nº 9 no recipiente de resíduos e, em seguida, enxágue no frasco do produto com a solução dos recipientes nº 8 e nº 7.
- Passe 18F-AV-1451 através de uma membrana de filtro de líquido de 0.22 μm para o frasco de coleta na célula quente dispensadora sob pressão de hélio.
- Controle de qualidade
NOTA: Realize o controle de qualidade em três lotes consecutivos do produto. Certifique-se de que o controle de qualidade do produto atenda aos critérios da edição de 2020 da Farmacopeia da República Popular da China (consulte a Tabela de Materiais).- Realize uma inspeção visual colocando o produto atrás do vidro de chumbo e inspecionando a cor e a clareza.
- Determine o valor do pH do produto usando papel de teste de pH de precisão.
- Utilizar HPLC para analisar a pureza radioquímica do produto 8,16.
- Analisar a pureza nuclear radioativa do produto utilizando o método do espectrômetro gama17.
- Medir a meia-vida do produto com precisão de acordo com a Farmacopeia da República Popular da China13.
- Aplique uma pressão de 0.34 MPa na membrana do filtro estéril (etapa 1.1.12) para testar sua vedação e integridade.
- Realize testes de esterilidade e endotoxina usando cultura bacteriana e o método do reagente do caranguejo-ferradura23.
- Testar o resíduo do catalisador de transferência de fase baseado em criptandos utilizando o método do iodoplatinato de potássio. Analisar o teor de acetona, acetonitrila e DMSO no produto por meio de cromatógrafo gasoso 8,16.
NOTA: Certifique-se de que nenhum outro pico apareça, exceto 0.511 MeV e 1.022 MeV.
2. Diretrizes de pré-exame
NOTA: Os participantes foram incluídos se tivessem uma preocupação atual em relação a uma mudança na cognição e exibissem comprometimento em um ou mais domínios cognitivos, mantendo a independência nas habilidades funcionais25. A elegibilidade exigia uma pontuação no Mini-Exame do Estado Mental (MEEM) entre 0 e 20 e positividade para proteína amiloide, confirmada por uma relação Aβ42 ou Aβ42/Aβ40 anormal do líquido cefalorraquidiano (LCR) ou uma tomografia por emissão de pósitrons (PET) amilóide positiva 6,20. Os critérios de exclusão abrangeram o diagnóstico de doença vascular, depressão, traumatismo cranioencefálico, transtornos psicóticos ou outras condições associadas ao declínio cognitivo5. Participantes com contraindicações a marca-passos, substâncias ferromagnéticas ou objetos estranhos que representassem risco de mobilidade, bem como aqueles incapazes de se submeter a imagens de ressonância magnética, foram excluídos. Critérios de exclusão adicionais incluíram intolerância ao contraste de gadolínio e presença de insuficiência renal grave21.
- Instrua os indivíduos a abster-se de álcool, cafeína, medicação ou qualquer exercício ou atividade extenuante por 24 horas antes do estudo. Mantenha um estado fisiológico estável (por exemplo, biorritmos, tarefas de função cerebral) para garantir a precisão dos dados.
- Permita que os indivíduos consumam água e alimentos antes do exame, pois eles não interferem na imagem tau PET/RM.
- Interrompa os medicamentos relacionados à neurologia por pelo menos 12 h antes da aquisição de imagens.
- Aconselhe os sujeitos a evitar o uso de joias de metal ou roupas com botões ou zíperes de metal no dia do exame.
NOTA: Certifique-se de que o paciente esteja acompanhado por um membro da família, traga registros de exames anteriores e informe a equipe médica sobre o uso de medicamentos.
3. Preparação para digitalização
- Verifique o formulário de inscrição para confirmar as informações gerais, a finalidade do exame e o programa. Certifique-se de que todos os preparativos necessários foram concluídos. Registre-se e arquive os detalhes.
- Obtenha consentimento informado para imagens PET/RM do sujeito ou de um membro da família. Informe o sujeito sobre o propósito, procedimento, riscos e benefícios.
- Realize uma revisão detalhada do histórico médico, registre a altura, o peso e a concentração sanguínea do sujeito e confirme a ausência de contra-indicações ao exame de ressonância magnética.
- Estabeleça uma linha intravenosa em uma veia superficial periférica ou acesse um cateter de porta.
- Antes de administrar 18F-AV-1451, verifique todas as informações novamente para evitar erros.
- Injete 18F-AV-1451 a 3,7-5,5 MBq/kg lentamente através do acesso intravenoso. Lave o tubo com uma quantidade adequada de solução salina para minimizar o resíduo do traçador radioativo. Aplique compressão no local da injeção para evitar vazamento de fluido.
- Registre o tempo de injeção, local e atividade.
- Depois de completar a injeção, inicie o fechamento audiovisual. Diminua as luzes na espera
e regular a temperatura para cerca de 22 °C. Instrua o sujeito a descansar na cama com os olhos fechados por 80 min, evitando falar, comer ou mastigar durante esse período.
4. Varredura PET/MRI
- Instrua o sujeito e o acompanhante a remover todos os objetos metálicos, incluindo telefones celulares, capacetes, dentaduras, óculos, relógios, carteiras e moedas, antes do exame. Não permita cadeiras de rodas, macas, camas de exame, cilindros de oxigênio ou equipamentos de monitoramento na sala de exames.
- Forneça tampões de ouvido ao sujeito e posicione-o em decúbito dorsal na mesa de PET/MRI com uma bobina de cabeça/pescoço envolvendo a região cervical. Use um apoio de cabeça especializado ou esponja para estabilizar a cabeça, minimizando o movimento e garantindo conforto.
NOTA: Administre uma dose apropriada de medicação sedativa, se necessário, com base na avaliação neurológica. - Posicione o assunto com os braços para baixo e instrua-o a usar o dispositivo de alarme em caso de desconforto.
- Revise as imagens para confirmar se a cabeça está centralizada no scanner, alinhada com o centro da bobina e posicionada consistentemente em relação ao pescoço.
- Use uma bobina de união de cabeça e pescoço de 8 canais para geração de imagens.
- Adquira sequências volumétricas cerebrais 3D ponderadas em T1 com alta resolução e alta relação sinal-ruído (SNR) usando uma sequência recuperada de gradiente estragado. Defina os seguintes parâmetros:
- Tempo de repetição (TR) = 8,5 ms; Tempo de eco (TE) = 3,2 ms; Tempo de inversão (TI) = 450 ms; Ângulo de inversão = 12°; Tamanho do voxel = 1 × 1 × 1 mm³; Campo de visão (FOV) = 256 mm; Tamanho da matriz = 256 × 256; Espessura da fatia = 1 mm.
- Adquira sequências axiais ponderadas em T2 do PROHLER com os seguintes parâmetros: TR = 6837 ms; TE = 132 ms; Ângulo de inversão = 142°; FOV = 240 mm; Tamanho da matriz = 416 × 416; Espessura da fatia = 5 mm.
NOTA: A tomografia por emissão de pósitrons usa uma única posição de leito, cobrindo todo o cérebro, desde o forame magno até o topo do crânio.
- Adquira imagens PET de 20 minutos simultaneamente.
- Execute a digitalização PET no modo de aquisição 3D.
- Use varredura volumétrica para imagens PET.
- Realize a correção da atenuação da imagem de RM usando uma sequência de pulso de tempo de eco zero (ZTE) para segmentar osso, ar e tecidos moles.
- Adquira dados PET usando a maximização da expectativa de subconjunto ordenado por tempo de voo (OSEM) para reconstrução de imagens20,23. Use os seguintes parâmetros:
- Tamanho da matriz = 192 × 192; 28 subconjuntos com 6 iterações; FOV = 350 × 350 mm; Largura total na metade do máximo (FWHM) = 3,0 mm.
- Calcular o valor de absorção normalizado (SUV) utilizando a fórmula20,23:
SUV = (Atividade da esfera (Bq/ml) × Peso corporal (kg)) / Dose injetada.
5. Interpretação de imagem
- Avalie visualmente todas as imagens de PET/RM de forma independente por pelo menos dois médicos experientes em medicina nuclear cegos para o diagnóstico clínico.
- Identifique os lobos cerebrais que exibem alterações estruturais anormais e deposição de proteínas.
- Repita a avaliação visual até que um consenso final seja alcançado.
- Defina uma "varredura positiva" como um aumento da captação de 18F-AV-1451 em qualquer ou todas as regiões corticais. Defina uma "varredura negativa" como a ausência de captação de 18F-AV-1451 em todas as regiões corticais.
- Definir atrofia no lobo temporal medial, particularmente no hipocampo na RM, como neurodegeneração20,25.
Resultados
18Resultados da síntese do F-AV-1451
A síntese em uma etapa de 18F-AV-1451 sob condições de reação otimizadas aumentou o rendimento de síntese para 25,7% ± 5,8%. O tempo total de reação foi de 70 min. Um espectro típico de HPLC e UV semipreparativo é mostrado na Figura 3, onde o pico 2 representa o pico do produto.
Resultados do teste de qualidade
Por três lotes consecutivos, os resultados do controle de qualidade foram os seguintes: A solução era incolor, visualmente transparente e livre de impurezas óbvias. O pH variou de 4,5 a 7,5. As análises de HPLC e TLC mostraram que a pureza química foi de >95% e a pureza radioquímica foi de >95%. A energia primária do fóton foi de 0,511 MeV. A meia-vida atendeu às especificações exigidas, excluindo isótopos de meia-vida longa (t1/2 > 5 dias). A membrana do filtro estéril foi pressurizada a 0,34 MPa sem vazamento de ar. Os níveis de endotoxina foram de <15 UE por 1 mL do produto. A cultura bacteriana confirmou a esterilidade. K2. 2. 2 foi de ≤50 μg/mL. Além disso, solventes residuais como acetona, acetonitrila e DMSO atenderam aos padrões da Farmacopeia da República Popular da China (ver Tabela de Materiais).
18F-AV-1451 Resultados PET/MR
A Figura 4 apresenta um exemplo de imagem PET/RM em um homem de 69 anos com declínio cognitivo persistente (pontuação do MEEM: 19/30) com deposição positiva de tau. As imagens mostram atrofia cerebral significativa, caracterizada principalmente por giros de substância cinzenta alargados e aprofundados e ventrículos aumentados. Os subgrupos AD exibiram ligação significativa de 18F-AV-1451 com a distribuição regional variada. O acúmulo de tau começou no córtex entorrinal e no hipocampo, depois se espalhou para os córtices temporal e parietal e, eventualmente, se estendeu extensivamente por todo o córtex cerebral.
A Figura 5 apresenta um exemplo de imagem de PET/RM em um homem de 68 anos com declínio cognitivo (escore MEEM: 24/30) com deposição de tau negativa. As imagens mostram morfologia normal do parênquima cerebral bilateralmente, com captação uniforme e simétrica da radioatividade 18F-AV-1451. A ressonância magnética da mesma sessão de imagem mostrou tamanho e morfologia ventricular normais, sem deslocamento da linha média e sem sinais anormais detectados no parênquima cerebral. Houve captação inespecífica nos gânglios da base e no tronco encefálico.
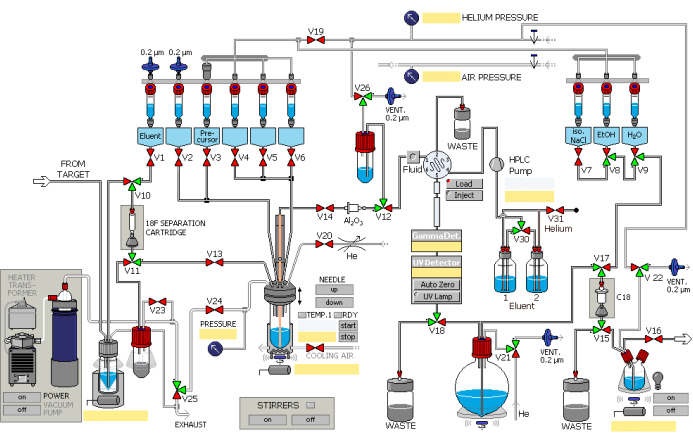
Figura 1: Diagrama esquemático do módulo de radiossíntese. O módulo de síntese opera sequencialmente de acordo com as etapas designadas. Clique aqui para ver uma versão maior desta figura.
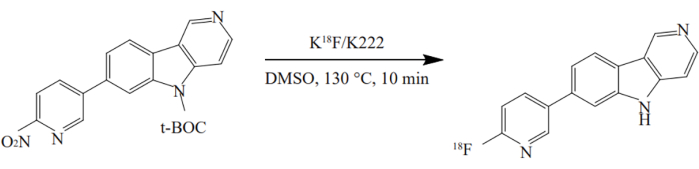
Figura 2: Radiossíntese de 18F-AV-1451. O composto foi sintetizado usando um método de um pote sob condições otimizadas. O nitro-precursor reagiu com K [18F] / K2.2.2 em DMSO a 130 ° C por 10 min. Clique aqui para ver uma versão maior desta figura.
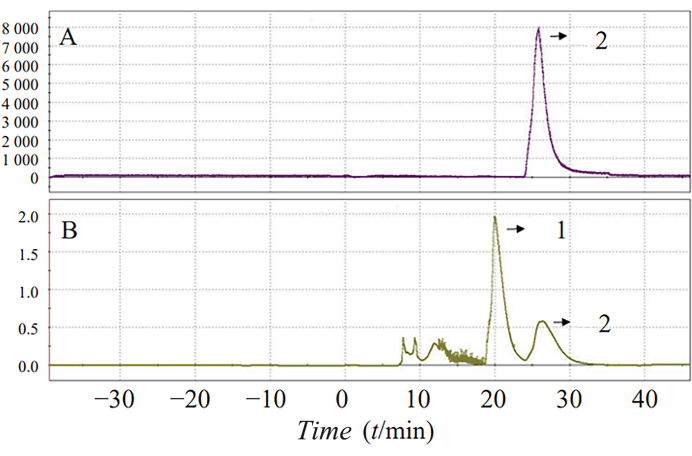
Figura 3: Separação por HPLC (A) e UV (B) da radioatividade de 18F-AV-1451. Os espectros semi-preparativos de HPLC e UV são mostrados. O pico 2 representa o pico do produto. Clique aqui para ver uma versão maior desta figura.

Figura 4: Dados de imagem representativos de um paciente com deposição de tau positiva. (A) 18imagens PET F-AV-1451. (B) Imagens axiais ponderadas em T1 (T1WI). (C) Imagens axiais ponderadas em T2 (T2WI). (D) Imagens axiais de fusão 18F-AV-1451 PET/MR. As imagens T1WI e T2WI mostram redução bilateral do volume hipocampal, dilatação ventricular, alargamento e aprofundamento das fissuras sulcais e nenhum deslocamento da estrutura da linha média. 18As imagens de fusão PET/RM F-AV-1451 revelam uma TAU PET scan positiva, com captação no giro frontal medial, cúneo anterior, giro temporal inferior e córtex occipital lateral. Clique aqui para ver uma versão maior desta figura.
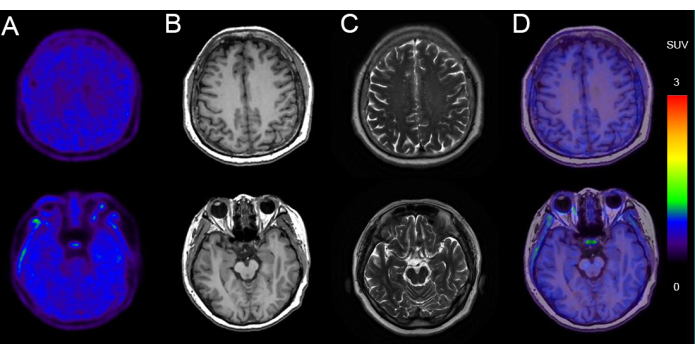
Figura 5: Dados de imagem representativos de um paciente com deposição negativa de tau. (A) 18imagens PET F-AV-1451. (B) Imagens axiais ponderadas em T1 (T1WI). (C) Imagens axiais ponderadas em T2 (T2WI). (D) Imagens axiais de fusão 18F-AV-1451 PET/MR. As imagens T1WI e T2WI mostram uma ressonância nuclear magnética (RNM) cranioencefálica normal, sem atrofia significativa do lobo temporal indicativa de neurodegeneração. 18As imagens de fusão PET/RM F-AV-1451 demonstram uma tomografia por emissão de pósitrons tau normal, sem captação cortical específica sugestiva de tauopatia. Clique aqui para ver uma versão maior desta figura.
| Frasco de solvente | solvente |
| Nº 1 | 1,5 mg de K2CO3 em 0,5 ml de água |
| Nº 2 | 1,5 mg de K2.2.2. em 1 ml de acetonitrilo |
| Nº 3 | 1 mg de precursor em 1,2 ml de solvente DMSO |
| No.5 | 1,5 ml de fase móvel para HPLC |
| Nº 6 | 1,5 ml de fase móvel para HPLC |
| Balão de fundo redondo | 2 ml de solução aquosa de NaHCO3 a 84% e 30 ml de água |
| Nº 7 | 9 ml de soro fisiológico a 0,9% |
| Nº 8 | 1 ml de EtOH |
| Nº 9 | 10 ml de água |
Tabela 1: Soluções presentes em diferentes vasos do módulo de radiossíntese.
Discussão
Neste manuscrito metodológico, introduzimos uma radiossíntese atualizada de 18F-AV-1451 para imagens de PET tau e as técnicas para aquisição de imagens de PET/MRI de 18F-AV-1451, e fornecemos a utilidade potencial de 18F-AV-1451 PET/MR para avaliar a DA. A TC ou RM convencional do cérebro geralmente fornece avaliação estrutural anatômica macroscópica, o que limita a avaliação da progressão da doença e a previsão do prognóstico. O PET é uma ferramenta de neuroimagem que possibilita a medição de processos moleculares in vivo . Os radioligantes PET podem se ligar a alvos, incluindo receptores, proteínas transportadoras ou enzimas26. A tecnologia tem sido usada no diagnóstico de distúrbios neurológicos, no desenvolvimento de programas e na avaliação da progressão da doença. PET/MRI é um novo sistema híbrido de imagem cerebral funcional que combina tomografia por emissão de pósitrons (PET) e ressonância magnética. Devido à grande variedade de traçadores de PET, a PET/RM pode fornecer informações fisiológicas adicionais além das imagens anatômicas de ressonância magnética. A aquisição simultânea de dados de PET e ressonância magnética ajudará a aproveitar as vantagens inerentes de ambas as tecnologias e eliminar o atraso potencial de duas inspeções separadas, além de aumentar a eficiência e a conveniência para o paciente. A PET/RM remove a radiação adicional necessária para correção de atenuação e correlação anatômica na porção de TC de uma PET/CT, o que pode ser uma grande vantagem para pacientes especiais, como mulheres grávidas, crianças pequenas e pacientes que precisam de vários exames de imagem PET.
O National Institute on Aging and Alzheimer's Association (NIA-AA) propôs uma estrutura diagnóstica (estrutura A/T/N) em 2011 com base em marcadores biológicos27, incluindo deposição de β-amilóide (Aβ) (A), tau patológica (T) e neurodegeneração (N)28,29. Aβ é o componente das placas senis, cujos marcadores incluem medidas de níveis reduzidos de Aβ42 no líquido cefalorraquidiano (LCR) e deposição de Aβ demonstrada por PET. A tau patológica é o principal componente da fibrose dos emaranhados neurofibrilares, cujos marcadores incluem aumento da tau total ou tau fosforilada (p-tau) no LCR 30,31,32,33. As medidas de neurodegeneração incluem taxas de atrofia cerebral34,35 e volume hipocampal ou atrofia do lobo temporal medial36,37 detectada por ressonância magnética e hipometabolismo ou hipoperfusão obtidos com PET e tomografia computadorizada por emissão de fóton único (SPECT)38,39. A PET/RM pode oferecer vantagens sobre outros métodos de imagem no diagnóstico da DA, fornecendo deposição patológica simultânea de proteínas e atrofia na região do hipocampo em um único exame.
Recentemente, novos traçadores de PET foram disponibilizados para detecção não invasiva in vivo de tau, cujo acúmulo é uma característica definidora da patologia da DA40. 18O F-AV1451 exibe potente ligação e seletividade para tau no tecido cerebral de pacientes com DA41, com cinética relativamente mais lenta. Usamos 18F-AV1451 para examinar a distribuição das proteínas tau no cérebro de pacientes com DA. 18O F-AV-1451 foi sintetizado em vários métodos. Este estudo automatizou a síntese de 18F-AV-1451 no sintetizador TRACERlab FXFN usando um método de um pote com condições otimizadas. A dosagem do precursor mudou para 1 mg42. Simultaneamente, as condições de separação por HPLC foram ajustadas para uma solução aquosa de EtOH a 25% com pH ajustado para 2,0 para desproteção online de BOC. A conversão e repurificação do solvente em uma coluna C18 foram realizadas. O rendimento da síntese foi aumentado de 20,5% ± 6,1% para 25,7% ±5,8% pela aplicação do método de síntese melhorado. O método melhorou o rendimento do produto. Vários testes de controle de qualidade realizados após a síntese mostraram que o produto atendia aos padrões de controle de qualidade.
Os resultados mostraram que os pacientes com DA apresentavam atrofia cerebral óbvia, com ligação significativa de 18F-AV-1451. O acúmulo de tau começa no córtex entorrinal e no hipocampo, depois se espalha para os córtices temporal e parietal e, finalmente, permanece extensivamente por todo o córtex cerebral. O TAU PET é uma ferramenta promissora, e vários estudos já avaliaram o valor diagnóstico do tau-PET. Estudos mostraram que o tau-PET, os padrões de ligação, correspondem bem às descrições histopatológicas de Braak43,44, que é uma estrutura de estadiamento que corresponde bem ao estado clínico em todo o espectro da DA45,46. A carga tau e a topografia se correlacionam melhor com os sintomas clínicos do que a carga amiloide47.
O NIA-AA classificou a positividade "A" como "Continuum de Alzheimer" em 201129. Em 2018, a estrutura para pesquisa de DA baseada em biomarcadores foi estabelecida e refinada, afirmando que os pacientes neste estágio apresentam as alterações patológicas da DA27. Nos critérios revisados para o estadiamento da DA, publicados em 2024, nota-se que A+T- são estágio inicial48. Em alguns casos, pode levar muitos anos até que apareçam sintomas clínicos. Indivíduos positivos para biomarcadores nas categorias "A" e "T" são classificados como portadores de DA. Estudos anteriores mostraram que indivíduos tau-negativos eram menos propensos a apresentar características de DA e que a maioria dos pacientes não progride para demência durante pelo menos 5 anos de acompanhamento49. Pacientes com CCL tau positivo podem evoluir para DA. Se o paciente tiver uma ampla captação de T e for positivo para N, isso significa que ele está em um estágio avançado da doença. Portanto, a detecção de patologia tau e neurodegeneração é essencial para o manejo preciso do paciente. Estudos anteriores indicaram que indivíduos com negatividade tau eram menos propensos a apresentar características clínicas associadas à doença de Alzheimer, e a maioria não desenvolveu demência durante um período de acompanhamento de pelo menos cinco anos49. O diagnóstico precoce in vivo de comprometimento cognitivo leve com positividade para tau, que pode progredir para a doença de Alzheimer, é essencial para o manejo preciso do paciente.
Anteriormente, as informações obtidas com PET e RM exigiam análise paralela de dados adquiridos sequencialmente seguida de fusão post hoc para fornecer um bom registro espacial. No entanto, o estado mental e as condições fisiológicas ou cognitivas de um sujeito podem mudar entre os exames. O PET/MR híbrido exibe diferentes informações fisiológicas e metabólicas sobre o processo da doença por meio de conjuntos de dados temporais e espacialmente correspondentes.
Divulgações
Os autores declaram não haver conflito de interesses.
Agradecimentos
Este trabalho foi apoiado por doações do Plano Chave de Pesquisa e Desenvolvimento da Província de Liaoning (2019JH/10300010) e do Programa de Pesquisa Básica Aplicada da Província de Liaoning (2022JH2/101500011).
Materiais
| Name | Company | Catalog Number | Comments |
| 18O-rich water | Taiyo Nippon Sanso,Japan | 24-0091 | |
| 2020 edition of Pharmacopoeia of the People's Republic of China | NA | https://english.nmpa.gov.cn/2020-07/03/c_538689.htm | |
| Acetonitrile | ABX,Germany | TF-A1-231207002 | |
| air filter membrane (Millex-25) | Merck,Germany | SLFGN25VS | |
| Boc-protected-precursor | Huayi,Jiangsu,China | NPPI-95-0001A | |
| C18 column | Waters,USA | 186004770 | |
| Cyclotron | GE,USA | MINITRACE | |
| Dimethyl sulfoxide (DMSO) | Bailing Wei Technology,Beijing,China | 984549 | |
| EtOH | ABX,Germany | 10009216 | |
| EtOH for isolation | Sinopharm Chemical Reagent,Shanghai,China | 400212682 | |
| Gas chromatography | Tianmei,Shanghai,China | GC-7900 | |
| HPLC | SYKNM,Germany | S-1122 | |
| Hydrochloric acid | Sinopharm Chemical Reagent,Shanghai,China | 10011018 | |
| K2CO3 Solution | ABX,Germany | TF-K1-230724001 | |
| Kryptofix[2.2.2](K222) | ABX,Germany | 800 | |
| liquid filter membrane (Millex-GV) | Merck,Germany | SLGVR33RB | |
| Oasis HLB solid-phase extraction (SPE) column | Waters,USA | 186003908 | |
| PET/MR | GE,USA | Signa | |
| QMA column | Waters,USA | 186002350 | |
| Radionuclide activity | Capintec,USA | CRC-25R |
Referências
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Rajan, K. B., et al. Population estimate of people with clinical AD and mild cognitive impairment in the United States (2020-2060). Alzheimers Dement. 17 (12), 1966-1975 (2021).
- U.S. Burden of Disease Collaborators. The state of U.S. health, 1990-2016: Burden of diseases, injuries, and risk factors among U.S. states. JAMA. 319 (14), 1444-1472 (2018).
- Bhatt, J., et al. . The World Alzheimer Report 2019: Attitudes to dementia. , (2019).
- Rostagno, A. A. Pathogenesis of Alzheimer's disease. Int J Mol Sci. 24 (1), 107 (2022).
- Ossenkoppele, R., van der Kant, R., Hansson, O. Tau biomarkers in Alzheimer's disease: Towards implementation in clinical practice and trials. Lancet Neurol. 21 (8), 726-734 (2022).
- Abbott, A. Conquering Alzheimer's: A look at the therapies of the future. Nature. 616 (7955), 26-28 (2023).
- Politis, M., Piccini, P. Positron emission tomography imaging in neurological disorders. J Neurol. 259 (9), 1769-1780 (2012).
- Okamura, N., et al. Tau PET imaging in Alzheimer's disease. Curr Neurol Neurosci Rep. 14 (11), 500 (2014).
- Holland, N., et al. Differential synaptic loss in β-amyloid positive versus β-amyloid negative corticobasal syndrome. Mov Disord. 39 (7), 1166-1178 (2024).
- Nicastro, N., et al. 18F-AV1451 PET imaging and multimodal MRI changes in progressive supranuclear palsy. J Neurol. 267 (2), 341-349 (2020).
- Cousins, O., et al. Microglial activation, tau and amyloid deposition in TREM2 p.R47H carriers and mild cognitive impairment patients: A multi-modal/multi-tracer PET/MRI imaging study with influenza vaccine immune challenge. J Neuroinflammation. 20 (1), 272 (2023).
- Chien, D., et al. Early clinical PET imaging results with the novel PHF-tau radioligand [F18]-T808. J Alzheimers Dis. 38 (1), 171-184 (2014).
- Maruyama, M., et al. Imaging of tau pathology in a tauopathy mouse model and in Alzheimer patients compared to normal controls. Neuron. 79 (6), 1094-1108 (2013).
- Li, Y., et al. Cortical laminar binding of PET amyloid and tau tracers in Alzheimer disease. J Nucl Med. 56 (2), 270-273 (2015).
- Fodero-Tavoletti, M. T., et al. 18F-THK523: A novel in vivo tau imaging ligand for Alzheimer's disease. Brain. 134 (4), 1089-1100 (2011).
- Okamura, N., et al. Non-invasive assessment of Alzheimer's disease neurofibrillary pathology using 18F-THK5105 PET. Brain. 137 (Pt 6), 1762-1771 (2014).
- Tago, T., et al. Preclinical evaluation of [(18)F]THK-5105 enantiomers: Effects of chirality on its effectiveness as a tau imaging radiotracer. Mol Imaging Biol. 18 (2), 258-266 (2016).
- Xia, C. F., et al. [18F]T807, a novel tau positron emission tomography imaging agent for Alzheimer's disease. Alzheimers Dement. 9, 666-676 (2013).
- Fleisher, A. S., et al. Positron emission tomography imaging with [18F]flortaucipir and postmortem assessment of Alzheimer disease neuropathologic changes. JAMA Neurol. 77 (7), 829-839 (2020).
- Whitwell, J., et al. [18F]AV-1451 tau positron emission tomography in progressive supranuclear palsy. Mov Disord. 32 (1), 124-133 (2017).
- Kantarci, K., et al. AV-1451 Tau and β-amyloid positron emission tomography imaging in dementia with Lewy bodies. Ann Neurol. 81 (1), 58-67 (2017).
- Mossine, A. V., et al. An updated radiosynthesis of [18F]AV1451 for tau PET imaging. EJNMMI Radiopharm Chem. 2 (1), 7 (2017).
- McKhann, G., et al. Clinical diagnosis of Alzheimer's disease: Report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology. 34 (7), 939-944 (1984).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 7 (3), 263-269 (2011).
- Chandra, A., et al. Alzheimer's Disease Neuroimaging Initiative. Applications of amyloid, Tau, and neuroinflammation PET imaging to Alzheimer's disease and mild cognitive impairment. Hum Brain Mapp. 40 (18), 5424-5442 (2019).
- Jack, C. R., et al. NIA-AA research framework: Toward a biological definition of Alzheimer's disease. Alzheimers Dement. 14 (4), 535-562 (2018).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging and the Alzheimer's Association Workgroup. Alzheimers Dement. 7, 263-269 (2011).
- Albert, M. S., et al. The diagnosis of mild cognitive impairment due to Alzheimer's disease: Recommendations from the National Institute on Aging and Alzheimer's Association Workgroup. Alzheimers Dement. 7, 270-279 (2011).
- Simrén, J., Elmgren, A., Blennow, K., Zetterberg, H. Fluid biomarkers in Alzheimer's disease. Adv Clin Chem. 112, 249-281 (2023).
- Molinuevo, J. L., et al. Current state of Alzheimer's fluid biomarkers. Acta Neuropathol. 136, 821-853 (2018).
- Alcolea, D., et al. Amyloid precursor protein metabolism and inflammation markers in preclinical Alzheimer disease. Neurology. 85, 626-633 (2015).
- Ia, J., et al. Biomarker changes during 20 years preceding Alzheimer's disease. N Engl J Med. 390 (8), 712-722 (2024).
- Leung, K. K., et al. Cerebral atrophy in mild cognitive impairment and Alzheimer disease: Rates and acceleration. Neurology. 80 (7), 648-654 (2013).
- Contador, J., et al. Longitudinal brain atrophy and CSF biomarkers in early-onset Alzheimer's disease. Neuroimage Clin. 32, 102804 (2021).
- Menéndez-González, M., de Celis Alonso, B., Salas-Pacheco, J., Arias-Carrión, O. Structural neuroimaging of the medial temporal lobe in Alzheimer's disease clinical trials. J Alzheimers Dis. 48 (3), 581-589 (2015).
- van Oostveen, W. M., de Lange, E. C. M. Imaging techniques in Alzheimer's disease: A review of applications in early diagnosis and longitudinal monitoring. Int J Mol Sci. 22 (4), 2110 (2021).
- Reiman, E. M., Jagust, W. J. Brain imaging in the study of Alzheimer's disease. Neuroimage. 61 (2), 505-516 (2012).
- Herholz, K. Perfusion SPECT and FDG-PET. Int Psychogeriatr. 23 (Suppl 2), S25-S31 (2011).
- Lamontagne-Kam, D., et al. Implication of tau propagation on neurodegeneration in Alzheimer's disease. Front Neurosci. 17, 1219299 (2023).
- Gomar, J. J., et al. Increased retention of tau PET ligand [18F]-AV1451 in Alzheimer's disease psychosis. Transl Psychiatry. 12 (1), 82 (2022).
- Shoup, T. M., et al. A concise radiosynthesis of the tau radiopharmaceutical [(18)F]T807. J Labelled Compd Radiopharm. 56 (14), 736-740 (2013).
- Schwarz, A. J., et al. Regional profiles of the candidate tau PET ligand 18F-AV-1451 recapitulate key features of Braak histopathological stages. Brain. 139, 1539-1550 (2016).
- Pascoal, T. A., et al. Longitudinal 18F-MK-6240 tau tangles accumulation follows Braak stages. Brain. 144, 3517-3528 (2021).
- Braak, H., Braak, E. Neuropathological staging of Alzheimer-related changes. Acta Neuropathol. 82, 239-259 (1991).
- Braak, H., et al. Staging of Alzheimer disease-associated neurofibrillary pathology using paraffin sections and immunocytochemistry. Acta Neuropathol. 112, 389-404 (2006).
- Ossenkoppele, R., et al. Associations between Tau, Aβ, and cortical thickness with cognition in Alzheimer disease. Neurology. 92, e601-e612 (2019).
- Jack, C. R., et al. Revised criteria for diagnosis and staging of Alzheimer's disease: Alzheimer's Association Workgroup. Alzheimers Dement. 20 (8), 5143-5169 (2024).
- Josephs, K. A., Weigand, S. D., Whitwell, J. L. Characterizing amyloid-positive individuals with normal tau PET levels after 5 years. Neurology. 98, e2282-e2292 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados