Method Article
Imagerie hybride TEP/IRM de la maladie d’Alzheimer basée sur 18F-AV-1451
Dans cet article
Résumé
Ce protocole décrit l’utilisation de 18appareils de TEP/IRM F-AV-1451 pour révéler la pathologie tau et la neurodégénérescence, aidant les neurologues à diagnostiquer la maladie d’Alzheimer, à évaluer sa gravité et à mieux comprendre sa progression et les mécanismes pathologiques sous-jacents.
Résumé
La maladie d’Alzheimer (MA) est une maladie neurodégénérative progressive et irréversible caractérisée par un dysfonctionnement cognitif, un déclin des capacités de la vie quotidienne et des changements de comportement, imposant un fardeau économique et social important dans le monde entier. L’une des principales caractéristiques pathologiques de la MA est l’accumulation d’enchevêtrements neurofibrillaires formés par la protéine tau hyperphosphorylée. La tomographie par émission de positons et l’imagerie par résonance magnétique (TEP/IRM) fournissent des informations structurelles et fonctionnelles détaillées ainsi que des distributions spécifiques de protéines, ce qui en fait un outil de plus en plus précieux pour le diagnostic et la recherche sur la MA. 18Le F-AV-1451 est un radiotraceur spécialement conçu pour la détection de la protéine tau dans l’imagerie TEP du tissu cérébral. Cette étude présente un protocole détaillé pour la radiosynthèse de 18F-AV-1451, la préparation des patients, les techniques d’acquisition d’images TEP/IRM et ses applications potentielles dans l’évaluation de la MA. 18La TEP/IRM F-AV-1451 pourrait aider les neurologues à diagnostiquer la MA, à évaluer la gravité de la maladie et à mieux comprendre ses mécanismes pathologiques. En conclusion, ce protocole fournit une approche sensible, complète et non invasive pour l’évaluation de la MA, offrant des informations précieuses sur la progression de la maladie et la pathologie.
Introduction
La maladie d’Alzheimer (MA) est une maladie neurodégénérative progressive et irréversible. Les patients présentent généralement un dysfonctionnement cognitif, un déclin des capacités de la vie quotidienne et des changements de comportement. Avec l’accélération du vieillissement de la population mondiale, la maladie d’Alzheimer est devenue un problème de santé publique majeur. À l’heure actuelle, plus de 50 millions de personnes dans le monde vivent avec la maladie d’Alzheimer. D’ici 2050, la prévalence de la démence devrait tripler à l’échelle mondiale1. Environ 10,8 % des personnes âgées de 65 ans et plus sont atteintes de démence d’Alzheimer. La prévalence de la MA est d’environ 5 % chez les personnes âgées de 65 à 74 ans, passant à 33,3 % chez les personnes âgées de 85 ans et plus, ce qui en fait l’une des principales causes de décès chez les personnes âgées2. Une fois qu’un patient développe la maladie d’Alzheimer, celle-ci impose un fardeau important à la famille3. En raison de son apparition insidieuse, les patients manquent souvent la fenêtre optimale pour le traitement après le diagnostic. Sa détection précoce reste un défi mondial4, car l’étiologie exacte n’est pas encore complètement comprise 5,6. Compte tenu de la complexité de l’étiologie et des voies influençant la MA, il est urgent de mettre en place des stratégies de diagnostic plus précises et plus précoces.
Les méthodes d’imagerie conventionnelles telles que la tomodensitométrie (TDM) et l’imagerie par résonance magnétique (IRM) sont utilisées pour observer l’atrophie ou d’autres changements structurels dans le cerveau, qui peuvent contribuer à des troubles cognitifs. L’IRM, en particulier, offre un meilleur contraste des tissus mous que la TDM et fournit des informations sur la biologie tumorale sans exposer les patients aux rayonnements ionisants, ce qui en fait la modalité d’imagerie préférée pour laplupart des troubles neurologiques6. L’IRM est une technique d’imagerie puissante qui fournit non seulement des informations anatomiques macroscopiques détaillées, mais comprend également diverses méthodes d’imagerie fonctionnelle, telles que l’imagerie par résonance magnétique fonctionnelle dépendante du niveau d’oxygène dans le sang (BOLD fMRI), qui peut être utilisée pour observer l’activité cérébrale fonctionnelle6. La tomographie par émission de positons (TEP) est une méthode d’imagerie moléculaire non invasive qui permet une analyse semi-quantitative approfondie des processus biologiques dans le cerveau humain. La TEP/IRM hybride peut offrir des avantages par rapport à d’autres techniques d’imagerie pour le diagnostic de la MA7, car l’utilisation d’une grande variété de traceurs TEP peut fournir des informations physiologiques supplémentaires pour compléter les images anatomiques IRM 8,9.
Les enchevêtrements neurofibrillaires formés par l’hyperphosphorylation de la protéine tau sont l’une des caractéristiques pathologiques de la MA, étroitement associée au début de la neurodégénérescence et à la manifestation des symptômes cliniques à la fois spatialement et temporellement6. La protéine tau est la protéine associée aux microtubules la plus abondante in vivo et est répandue dans les systèmes nerveux périphérique et central. La progression pathologique de la protéine tau est fortement corrélée au degré de déficience cognitive et a le potentiel de servir de cible thérapeutique pour les patients atteints de la maladie d’Alzheimer7. La détection non invasive du dépôt de la protéine tau dans des régions cérébrales spécifiques est précieuse pour la prédiction et le diagnostic précoces de la maladie. L’utilisation de radiotraceurs tau permet de visualiser et de localiser les dépôts de protéines tau dans le cerveau, fournissant un diagnostic différentiel rapide et précis, ainsi qu’un soutien précieux dans le suivi de la progression de la maladie et l’évaluation des traitements cliniques expérimentaux 8,9.
Plusieurs études ont démontré une relation entre les modifications de protéines spécifiques et les résultats fonctionnels ou morphologiques de l’IRM10,11. Cependant, il existe peu de rapports sur les analyses combinées utilisant l’imagerie amyloïde/tau et l’IRM fonctionnelle12. Le nouveau médicament de diagnostic moléculaire 18F-AV-1451 (7-(6-[18F]fluoropyridin-3yl)-5H-pyrido[4,3-b]indole) a été utilisé comme agent de radiodiagnostic pour la détection de la protéine tau dans le tissu cérébral imagé par TEP. La recherche sur l’imagerie TEP tau est encore à son stade de développement, avec seulement quelques traceurs actuellement évalués, notamment 18F-T807 (18F-AV-1451), 18F-T808 (18F-AV-680)13, 11C-PBB314, 18F-THK-511715, 18F-THK-52316 et 18F-THK-510517,18. 18Le F-AV-1451 a été mis au point commercialement19et a été signalé pour être utilisé chez des patients atteints de la MA20, de la paralysie supranucléaire progressive21 et de la démence à corps de Lewy22. Le processus de radiosynthèse du 18F-AV-1451 nécessite une étape de purification complexe pour s’assurer que le produit final répond aux exigences posologiques pour les études d’imagerie clinique23. Avec l’application croissante des radiotraceurs marqués 18F dans la technologie d’imagerie TEP, il existe une demande croissante pour la synthèse et le développement de nouveaux radiotraceurs marqués 18F. Cette étude présente une méthode d’imagerie TEP/IRM tau visant à fournir des informations plus détaillées pour le diagnostic des patients atteints de la maladie d’Alzheimer.
Protocole
L’étude a été approuvée par le comité d’éthique médicale local, et tous les sujets ont fourni un consentement éclairé écrit avant de participer. Toutes les études ont été menées dans le respect des principes de la Déclaration d’Helsinki. Tous les sujets ont subi des évaluations neurologiques et neuropsychologiques par un professionnel de la santé dans les trois mois précédant et suivant l’imagerie. Les patients ont été inclus sur la base du critère24 de l’Association de l’Institut national sur le vieillissement-Alzheimer (NINCDS-ADRDA) et du critère25 de l’Association de l’Alzheimer de l’Institut national sur le vieillissement. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans le tableau des matériaux.
1. 18Synthèse du F-AV-1451
REMARQUE : Suivre les principes de protection biologique et radiologique au travail, ainsi que les principes d’élimination des déchets médicaux et radioactifs, pendant les opérations.
- Détails synthétiques
- Synthétisez 2,5 mL de fluorure [18F] à l’aide de la réaction nucléaire 18O(p, n)18F à l’aide d’un accélérateur de particules, avec des protons à des courants intégrés allant jusqu’à 45 μA bombardant pendant 40 min. Ajoutez du fluorure [18F] au module de synthèse automatisé via la canalisation de transfert, facilitée par la surpression d’hélium gazeux. Faites fonctionner le module de synthèse dans l’ordre indiqué à la figure 1.
- Piéger le fluorure [18F] sur une colonne échangeuse d’ions (pré-activer avec 1 mL d’éthanol et 2 mL d’eau) tout en retenant l’eau 18O dans le récipient de récupération.
- Laisser la solution de carbonate de potassium du récipient n° 1 (Figure 1) s’écouler à travers les vannes désignées et la colonne d’échange d’ions pour être remplacée par le fluorure [18F], puis éluer dans le récipient de réaction. Voir le tableau 1 pour les solutions dans les différents navires.
- Dissoudre le fluorure [18F] et un catalyseur de transfert de phase à base de cryptand préchargé dans le récipient n° 2 du récipient de réaction.
- Ouvrez la vanne désignée. Soumettre le mélange réactionnel à une distillation sous vide sous soufflage d’azote à 85 °C pendant 8 min, suivi d’un soufflage d’azote à 110 °C pendant 4 min pour éliminer l’eau résiduelle.
- Ajouter le précurseur du récipient n° 3 dans le récipient n° 12 et chauffer à 130 °C pendant 10 min. La radiosynthèse de 18F-AV-1451 est illustrée à la figure 2.
- Refroidissez le mélange réactionnel à 50 °C, puis ouvrez les vannes désignées pour rétablir la pression atmosphérique.
- Rincer le mélange réactionnel dans le récipient n° 14 à l’aide d’un volume de 3 mL de phase mobile HPLC (solution aqueuse d’éthanol à 25 %, pH ajusté à 2,0) provenant des récipients n° 5 et n° 6. Ouvrez les vannes désignées pour permettre l’entrée du mélange dans la boucle HPLC sous pression d’hélium.
- Introduire le produit dans la colonne semi-préparative HPLC et éluer avec la phase mobile à un débit de 5 mL/min. Observez l’éluant à l’aide de compteurs UV (λ = 254 nm) et de radioactivité.
- Recueillir le produit dans la fiole à fond rond à l’aide de la vanne prévue à cet effet.
- Piéger et retenir le produit à l’intérieur de la colonne C18 (activée par 5 mL d’éthanol et 10 mL d’eau).
- Ouvrez la vanne désignée, lavez la colonne avec de l’eau du récipient n° 9 dans le récipient à déchets, puis rincez dans la bouteille de produit avec la solution des récipients n° 8 et n° 7.
- Passage du 18F-AV-1451 à travers une membrane filtrante de 0,22 μm dans le flacon de collecte dans la cellule chaude de distribution sous pression d’hélium.
- Contrôle qualité
REMARQUE : Effectuez un contrôle de qualité sur trois lots consécutifs du produit. S’assurer que le contrôle de la qualité du produit répond aux critères de l’édition 2020 de la Pharmacopée de la République populaire de Chine (voir le tableau des matériaux).- Effectuez une inspection visuelle en plaçant le produit derrière du verre au plomb et en inspectant la couleur et la clarté.
- Déterminez la valeur du pH du produit à l’aide d’un papier réactif de pH de précision.
- Utilisez HPLC pour analyser la pureté radiochimique du produit 8,16.
- Analyser la pureté nucléaire radioactive du produit à l’aide de la méthode du spectromètre gamma17.
- Mesurez la demi-vie du produit avec précision selon la pharmacopée de la République populaire de Chine13.
- Appliquez une pression de 0,34 MPa sur la membrane filtrante stérile (étape 1.1.12) pour tester son étanchéité et son intégrité.
- Effectuer des tests de stérilité et d’endotoxines à l’aide de la culture bactérienne et de la méthode du réactif pour limule23.
- Testez le résidu de catalyseur de transfert de phase à base de cryptand en utilisant la méthode de l’iodoplatinate de potassium. Analyser la teneur en acétone, en acétonitrile et en DMSO du produit à l’aide d’un chromatographe en phase gazeuse 8,16.
REMARQUE : Assurez-vous qu’aucun autre pic n’apparaît à l’exception de 0,511 MeV et 1,022 MeV.
2. Lignes directrices préalables à l’examen
REMARQUE : Les participants ont été inclus s’ils avaient une préoccupation actuelle concernant un changement cognitif et s’ils présentaient une déficience dans un ou plusieurs domaines cognitifs tout en maintenant l’indépendance des capacités fonctionnelles25. L’éligibilité exigeait un score de 0 à 20 au mini-examen de l’état mental (MMSE) et une positivité de la protéine amyloïde, confirmée par un rapport Aβ42 ou Aβ42/Aβ40 anormal du liquide céphalo-rachidien (LCR) ou une tomographie par émission de positrons amyloïde (TEP) positive 6,20. Les critères d’exclusion englobaient un diagnostic de maladie vasculaire, de dépression, de lésion cérébrale traumatique, de troubles psychotiques ou d’autres conditions associées au déclin cognitif5. Les participants présentant des contre-indications aux stimulateurs cardiaques, aux substances ferromagnétiques ou aux objets étrangers présentant un risque de mobilité, ainsi que ceux incapables de subir une imagerie IRM, ont été exclus. D’autres critères d’exclusion comprenaient l’intolérance aux agents de contraste au gadolinium et la présence d’une insuffisance rénale sévère21.
- Demandez aux sujets de s’abstenir de consommer de l’alcool, de la caféine, des médicaments ou tout exercice ou activité intense pendant les 24 heures précédant l’étude. Maintenir un état physiologique stable (p. ex., biorythmes, fonctions cérébrales) pour assurer l’exactitude des données.
- Laissez les sujets consommer de l’eau et de la nourriture avant l’examen, car ceux-ci n’interfèrent pas avec l’imagerie TEP/IRM tau.
- Arrêtez les médicaments neurologiques pendant au moins 12 heures avant l’imagerie.
- Conseillez aux sujets d’éviter de porter des bijoux en métal ou des vêtements avec des boutons ou des fermetures éclair en métal le jour de l’examen.
REMARQUE : Assurez-vous que le patient est accompagné d’un membre de sa famille, qu’il apporte les dossiers d’examens précédents et qu’il informe le personnel médical de l’utilisation des médicaments.
3. Préparation à la numérisation
- Vérifiez le formulaire de demande pour confirmer les renseignements généraux, l’objectif de l’examen et le programme. Assurez-vous que tous les préparatifs nécessaires ont été effectués. Enregistrez-vous et archivez les détails.
- Obtenir le consentement éclairé du sujet ou d’un membre de la famille pour l’imagerie TEP/IRM. Informez le sujet de l’objectif, de la procédure, des risques et des avantages.
- Effectuez un examen détaillé des antécédents médicaux, notez la taille, le poids et la concentration sanguine du sujet, et confirmez l’absence de contre-indications à l’examen IRM.
- Établissez un cathéter intraveineux dans une veine superficielle périphérique ou accédez à un cathéter portuaire.
- Avant d’administrer le 18F-AV-1451, vérifiez à nouveau toutes les informations pour éviter les erreurs.
- Injecter lentement 18F-AV-1451 à raison de 3,7 à 5,5 MBq/kg par voie intraveineuse. Rincez le tube avec une quantité appropriée de solution saline pour minimiser les résidus de traceurs radioactifs. Appliquez une compression sur le site d’injection pour éviter les fuites de liquide.
- Notez le moment de l’injection, le site et l’activité.
- Une fois l’injection terminée, amorcez la fermeture audio-visuelle. Tamisez les lumières dans l’attente
et réglez la température à environ 22 °C. Demandez au sujet de se reposer au lit les yeux fermés pendant 80 minutes, en évitant de parler, de manger ou de mâcher pendant cette période.
4. Imagerie TEP/IRM
- Demandez au sujet et à son compagnon d’enlever tous les objets métalliques, y compris les téléphones portables, les couvre-chefs, les prothèses dentaires, les lunettes, les montres, les portefeuilles et les pièces de monnaie, avant l’examen. N’autorisez pas les fauteuils roulants, les civières, les lits d’examen, les bouteilles d’oxygène ou l’équipement de surveillance dans la salle d’examen.
- Fournissez des bouchons d’oreille au sujet et placez-le en décubitus dorsal sur la table de TEP/IRM avec une bobine tête/cou entourant la région cervicale. Utilisez un appui-tête spécialisé ou un coussinet éponge pour stabiliser la tête, minimiser les mouvements et assurer le confort.
REMARQUE : Administrer une dose appropriée de médicament sédatif, si nécessaire, en fonction de l’évaluation neurologique. - Positionnez le sujet avec les bras baissés et demandez-lui d’utiliser le dispositif d’alarme en cas d’inconfort.
- Examinez les images pour confirmer que la tête est centrée dans le scanner, alignée avec le centre de la bobine et positionnée de manière cohérente par rapport au cou.
- Utilisez une bobine d’union tête et cou à 8 canaux pour l’imagerie.
- Acquérez des séquences volumétriques pondérées en T1 cérébrales 3D avec une haute résolution et un rapport signal/bruit (SNR) élevé à l’aide d’une séquence dégradée rappelée. Définissez les paramètres suivants :
- Temps de répétition (TR) = 8,5 ms ; Temps d’écho (TE) = 3,2 ms ; Temps d’inversion (TI) = 450 ms ; Angle de retournement = 12° ; Taille du voxel = 1 × 1 × 1 mm³ ; Champ de vision (FOV) = 256 mm ; Taille de la matrice = 256 × 256 ; Épaisseur de la tranche = 1 mm.
- Acquisition de séquences axiales pondérées en T2 avec les paramètres suivants : TR = 6837 ms ; TE = 132 ms ; Angle de retournement = 142° ; Champ de vision = 240 mm ; Taille de la matrice = 416 × 416 ; Épaisseur de la tranche = 5 mm.
REMARQUE : La TEP utilise une seule position de lit, couvrant tout le cerveau, du foramen magnum au sommet du crâne.
- Acquérez des images TEP de 20 minutes simultanément.
- Effectuez un balayage TEP en mode d’acquisition 3D.
- Utilisez le balayage volumétrique pour l’imagerie TEP.
- Effectuez une correction de l’atténuation de l’imagerie IRM à l’aide d’une séquence d’impulsions à temps d’écho zéro (ZTE) pour segmenter l’os, l’air et les tissus mous.
- Acquérir des données TEP à l’aide de la maximisation des attentes de sous-ensembles ordonnés en temps de vol (OSEM) pour la reconstruction d’images20,23. Utilisez les paramètres suivants :
- Taille de la matrice = 192 × 192 ; 28 sous-ensembles avec 6 itérations ; Champ de vision = 350 × 350 mm ; Pleine largeur à mi-hauteur (FWHM) = 3,0 mm.
- Calculer la valeur d’absorption normalisée (VUS) à l’aide de la formule20,23 :
SUV = (Activité de la sphère (Bq/ml) × Poids corporel (kg)) / Dose injectée.
5. Interprétation de l’image
- Évaluer visuellement toutes les images TEP/IRM de manière indépendante par au moins deux médecins nucléaires expérimentés sans connaissance du diagnostic clinique.
- Identifier les lobes cérébraux présentant des changements structurels anormaux et un dépôt de protéines.
- Répétez l’évaluation visuelle jusqu’à ce qu’un consensus final soit atteint.
- Définir un « balayage positif » comme une augmentation de l’absorption de 18F-AV-1451 dans l’une ou l’ensemble des régions corticales. Définir un « balayage négatif » comme l’absence d’absorption de 18F-AV-1451 dans toutes les régions corticales.
- Définir l’atrophie du lobe temporal médial, en particulier de l’hippocampe à l’IRM, comme une neurodégénérescence20,25.
Résultats
18Résultats de la synthèse du F-AV-1451
La synthèse en une étape de 18F-AV-1451 dans des conditions de réaction optimisées a augmenté le rendement de synthèse à 25,7 % ± 5,8 %. Le temps de réaction total était de 70 min. Un spectre HPLC et UV semi-préparatif typique est illustré à la figure 3, où le pic 2 représente le pic du produit.
Résultats des tests de qualité
Pour trois lots consécutifs, les résultats du contrôle de la qualité étaient les suivants : la solution était incolore, visuellement transparente et exempte d’impuretés évidentes. Le pH variait de 4,5 à 7,5. Les analyses HPLC et CCM ont montré que la pureté chimique était de >95 % et la pureté radiochimique de >95 %. L’énergie primaire des photons était de 0,511 MeV. La demi-vie a satisfait aux spécifications requises, à l’exclusion des isotopes de demi-vie longue (t1/2 > 5 jours). La membrane filtrante stérile a été pressurisée à 0,34 MPa sans fuite d’air. Les niveaux d’endotoxines étaient de <15 UE par 1 mL du produit. La culture bactérienne a confirmé la stérilité. K2. 2. Aéroport 2 était de ≤50 μg/mL. De plus, les solvants résiduels tels que l’acétone, l’acétonitrile et le DMSO répondaient aux normes de la pharmacopée de la République populaire de Chine (voir le tableau des matériaux).
18F-AV-1451 Résultats TEP/IRM
La figure 4 présente un exemple d’imagerie TEP/IRM chez un homme de 69 ans présentant un déclin cognitif persistant (score MMSE : 19/30) avec un dépôt tau positif. Les images montrent une atrophie cérébrale importante, principalement caractérisée par un gyri de matière grise élargi et approfondi et des ventricules élargis. Les sous-groupes AD ont montré une liaison significative de 18F-AV-1451 avec une distribution régionale variée. L’accumulation de tau a commencé dans le cortex entorhinal et l’hippocampe, puis s’est propagée aux cortex temporal et pariétal, et s’est finalement étendue à travers le cortex cérébral.
La figure 5 présente un exemple d’imagerie TEP/IRM chez un homme de 68 ans présentant un déclin cognitif (score MMSE : 24/30) avec un dépôt tau négatif. Les images montrent une morphologie normale du parenchyme cérébral bilatéralement, avec une absorption uniforme et symétrique de la radioactivité 18F-AV-1451. L’IRM de la même séance d’imagerie a montré une taille et une morphologie ventriculaires normales, sans déplacement de la ligne médiane et sans signaux anormaux détectés dans le parenchyme cérébral. Il y avait une absorption non spécifique dans les ganglions de la base et le tronc cérébral.
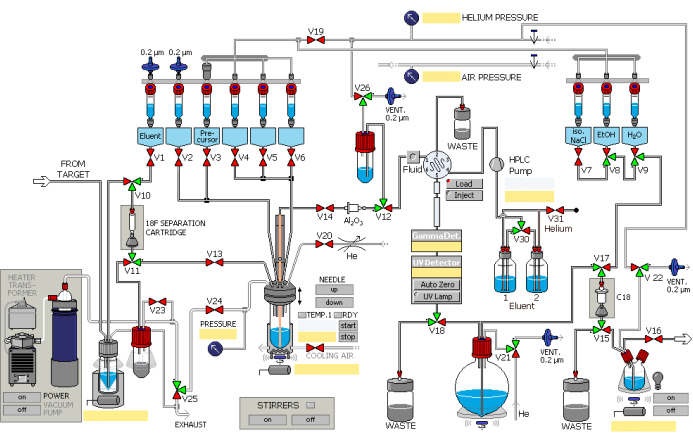
Figure 1 : Schéma de principe du module de radiosynthèse. Le module de synthèse fonctionne de manière séquentielle selon les étapes désignées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
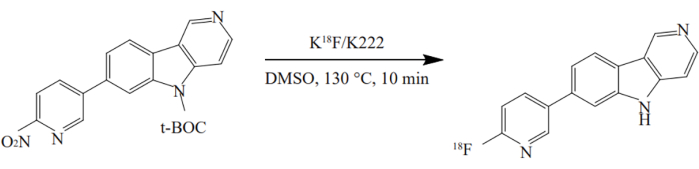
Figure 2 : Radiosynthèse de 18F-AV-1451. Le composé a été synthétisé à l’aide d’une méthode à un seul pot dans des conditions optimisées. Le précurseur nitro a réagi avec K[18F]/K2.2.2 dans du DMSO à 130 °C pendant 10 min. Veuillez cliquer ici pour voir une version agrandie de cette figure.
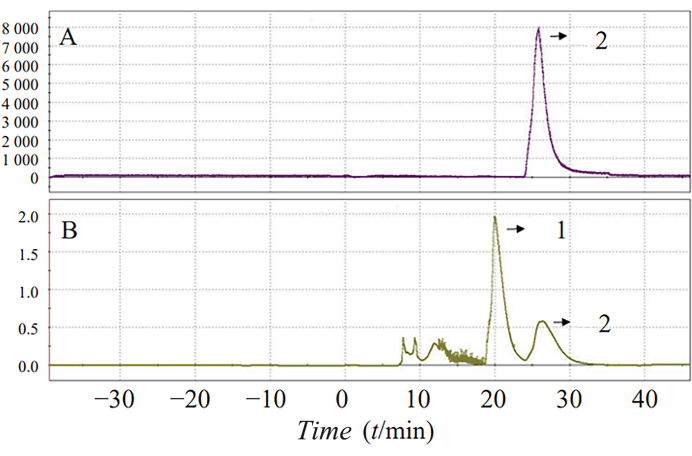
Figure 3 : Séparation HPLC (A) et UV (B) de 18F-AV-1451 radioactivité. Les spectres HPLC et UV semi-préparatifs sont présentés. Le pic 2 représente le pic du produit. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Données d’imagerie représentatives d’un patient avec dépôt de tau positif. (A) 18images TEP F-AV-1451. (B) Images axiales pondérées en T1 (T1WI). (C) Images axiales pondérées en T2 (T2WI). (D) Images de fusion PET/MR Axial 18F-AV-1451. Les images T1WI et T2WI montrent une réduction bilatérale du volume de l’hippocampe, une dilatation ventriculaire, un élargissement et un approfondissement des fissures sulcales, et aucun déplacement de la structure médiane. 18Les images de fusion TEP/IRM F-AV-1451 révèlent une TEP tau positive, avec absorption dans le gyrus frontal médial, le cunéus antérieur, le gyrus temporal inférieur et le cortex occipital latéral. Veuillez cliquer ici pour voir une version agrandie de cette figure.
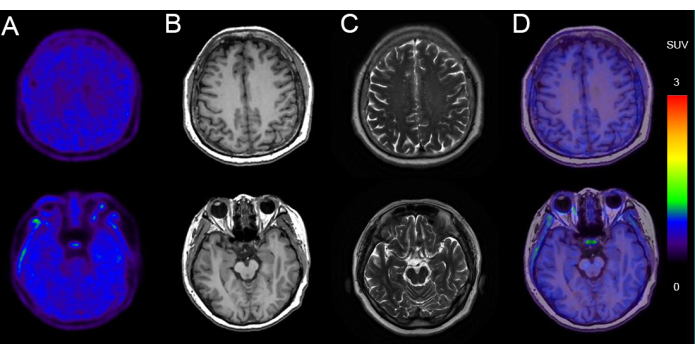
Figure 5 : Données d’imagerie représentatives d’un patient présentant un dépôt tau négatif. (A) 18images TEP F-AV-1451. (B) Images axiales pondérées en T1 (T1WI). (C) Images axiales pondérées en T2 (T2WI). (D) Images de fusion PET/MR Axial 18F-AV-1451. Les images T1WI et T2WI montrent une IRM cérébrale normale, sans atrophie significative du lobe temporal indiquant une neurodégénérescence. 18Les images de fusion TEP/IRM F-AV-1451 démontrent une TEP tau normale, sans absorption corticale spécifique suggérant une tauopathie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Flacon de solvant | solvant |
| N°1 | 1,5 mg de K2CO3 dans 0,5 ml d’eau |
| N°2 | 1,5 mg de K2.2.2 dans 1 ml d’acétonitrile |
| N°3 | 1 mg de précurseur dans 1,2 ml de solvant DMSO |
| N° 5 | 1,5 ml HPLC phase mobile |
| N° 6 | 1,5 ml HPLC phase mobile |
| Fiole à fond rond | 2 ml de solution aqueuse de NaHCO3 à 84 % et 30 ml d’eau |
| N° 7 | 9 ml de solution saline à 0,9 % |
| N°8 | 1 ml d’EtOH |
| N°9 | 10 ml d’eau |
Tableau 1 : Solutions présentes dans les différents récipients du module de radiosynthèse.
Discussion
Dans ce manuscrit méthodologique, nous avons présenté une radiosynthèse actualisée de 18F-AV-1451 pour l’imagerie TEP tau et les techniques d’acquisition d’images TEP/IRM 18F-AV-1451, et fourni l’utilité potentielle de 18F-AV-1451 TEP/IRM pour l’évaluation de la MA. La TDM ou l’IRM cérébrale conventionnelle fournit généralement une évaluation structurelle anatomique macroscopique, ce qui limite l’évaluation de la progression de la maladie et la prédiction du pronostic. La TEP est un outil de neuroimagerie qui permet de mesurer des processus moléculaires in vivo . Les radioligands TEP peuvent se lier à des cibles, notamment des récepteurs, des protéines de transport ou des enzymes26. La technologie a été utilisée dans le diagnostic des troubles neurologiques, l’élaboration de programmes et l’évaluation de la progression de la maladie. La TEP/IRM est un nouveau système hybride d’imagerie cérébrale fonctionnelle qui combine la tomographie par émission de positons (TEP) et l’IRM. En raison de la grande variété de traceurs TEP, la TEP/IRM peut fournir des informations physiologiques supplémentaires au-delà des images IRM anatomiques. L’acquisition simultanée des données de TEP et d’IRM permettra de tirer parti des avantages inhérents aux deux technologies et d’éliminer le retard potentiel de deux inspections distinctes, tout en augmentant l’efficacité et la commodité pour le patient. La TEP/IRM supprime le rayonnement supplémentaire nécessaire à la correction de l’atténuation et à la corrélation anatomique dans la partie TDM d’une TEP/TDM, ce qui peut être un grand avantage pour les patients spéciaux tels que les femmes enceintes, les jeunes enfants et les patients qui ont besoin de plusieurs examens d’imagerie TEP.
L’Institut national sur le vieillissement et l’Association Alzheimer (NIA-AA) a proposé en 2011 un cadre diagnostique (cadre A/T/N) basé sur des marqueurs biologiques27, y compris le dépôt β-amyloïde (Aβ), la tau pathologique (T) et la neurodégénérescence (N)28,29. Aβ est le composant des plaques séniles, dont les marqueurs comprennent des mesures de niveaux réduits d’Aβ42 dans le liquide céphalo-rachidien (LCR) et des dépôts d’Aβ mis en évidence par TEP. La tau pathologique est le principal composant de la fibrose neurofibrillaire, dont les marqueurs comprennent une augmentation de la tau totale ou de la tau phosphorylée (p-tau) dans le LCR 30,31,32,33. Les mesures de la neurodégénérescence comprennent les taux d’atrophie cérébrale34,35 et l’atrophie du volume hippocampique ou du lobe temporal médial36,37 détectée par IRM, et l’hypométabolisme ou l’hypoperfusion obtenue par TEP et tomographie par émission de photons uniques (SPECT)38,39. La TEP/IRM peut offrir des avantages par rapport à d’autres méthodes d’imagerie dans le diagnostic de la MA en fournissant simultanément le dépôt et l’atrophie pathologiques de protéines dans la région de l’hippocampe en un seul balayage.
Récemment, de nouveaux traceurs TEP ont été mis à disposition pour la détection non invasive in vivo de la protéine tau, dont l’accumulation est une caractéristique déterminante de la pathologie de la MA40. 18F-AV1451 présente une liaison et une sélectivité puissantes pour la protéine tau dans le tissu cérébral des patients atteints de la maladie d’Alzheimer41, avec une cinétique relativement plus lente. Nous avons utilisé 18F-AV1451 pour examiner la distribution des protéines tau dans le cerveau des patients atteints de la maladie d’Alzheimer. 18Le F-AV-1451 a été synthétisé de plusieurs manières. Cette étude a automatisé la synthèse de 18F-AV-1451 sur le synthétiseur TRACERlab FXFN en utilisant une méthode one-pot avec des conditions optimisées. La posologie du précurseur est passée à 1 mg42. Simultanément, les conditions de séparation HPLC ont été ajustées à une solution aqueuse d’EtOH à 25 % avec un pH ajusté à 2,0 pour la déprotection en ligne du BOC. La conversion du solvant et la repurification sur une colonne C18 ont été effectuées. Le rendement de la synthèse a été augmenté de 20,5 % ± 6,1 % à 25,7 % ±5,8 % en appliquant la méthode de synthèse améliorée. La méthode a amélioré le rendement du produit. Divers tests de contrôle de la qualité effectués après la synthèse ont montré que le produit répondait aux normes de contrôle de la qualité.
Les résultats ont montré que les patients atteints de la MA présentaient une atrophie cérébrale évidente, avec une liaison significative de 18F-AV-1451. L’accumulation de tau commence dans le cortex entorhinal et l’hippocampe, puis se propage aux cortex temporal et pariétal, et enfin reste largement dans tout le cortex cérébral. La TEP tau est un outil prometteur, et plusieurs études ont déjà évalué la valeur diagnostique de la TEP-tau. Des études ont montré que la tau-TEP, les modèles de liaison, correspond bien aux descriptions histopathologiques de Braak43,44, qui est un cadre de stadification qui correspond bien à l’état clinique sur l’ensemble du spectre de la MA45,46. La charge tau et la topographie sont mieux corrélées avec les symptômes cliniques que la charge amyloïde47.
La NIA-AA a classé la positivité « A » dans le « continuum de la maladie d’Alzheimer » en 201129. En 2018, le cadre de recherche sur la MA basé sur les biomarqueurs a été établi et affiné, indiquant que les patients à ce stade présentent les changements pathologiques de la MA27. Dans les critères révisés pour la stadification de la DA, publiés en 2024, il est noté que A+T- sont le stade initial48. Dans certains cas, il peut s’écouler de nombreuses années avant qu’ils n’apparaissent des symptômes cliniques. Les personnes qui sont positives pour les biomarqueurs dans les catégories « A » et « T » sont classées comme ayant la MA. Des études antérieures ont montré que les personnes tau négatives étaient moins susceptibles de présenter des caractéristiques de la MA et que la plupart des patients n’évoluent pas vers la démence pendant au moins 5 ans de suivi49. Les patients atteints d’un TCL tau positif peuvent évoluer vers la MA. Si le patient a une large absorption de T et est positif pour N, cela signifie qu’il est à un stade avancé de la maladie. Par conséquent, la détection de la pathologie tau et de la neurodégénérescence est essentielle pour une prise en charge précise des patients. Des études antérieures ont indiqué que les personnes atteintes de négativité tau étaient moins susceptibles de présenter des caractéristiques cliniques associées à la maladie d’Alzheimer, et la plupart n’ont pas développé de démence au cours d’une période de suivi d’au moins cinq ans49. Le diagnostic précoce in vivo d’une déficience cognitive légère avec positivité tau, qui peut évoluer vers la maladie d’Alzheimer, est essentiel pour une prise en charge précise des patients.
Auparavant, les informations obtenues par TEP et IRM nécessitaient une analyse parallèle des données acquises séquentiellement suivie d’une fusion post-hoc pour fournir un bon recalage spatial. Cependant, l’état mental et les conditions physiologiques ou cognitives d’un sujet peuvent changer entre les examens. La TEP/IRM hybride affiche différentes informations physiologiques et métaboliques sur le processus de la maladie en faisant correspondre temporellement et spatialement des ensembles de données.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Ce travail a été soutenu par des subventions du Plan clé de recherche et de développement de la province du Liaoning (2019JH/10300010) et du Programme de recherche fondamentale appliquée de la province du Liaoning (2022JH2/101500011).
matériels
| Name | Company | Catalog Number | Comments |
| 18O-rich water | Taiyo Nippon Sanso,Japan | 24-0091 | |
| 2020 edition of Pharmacopoeia of the People's Republic of China | NA | https://english.nmpa.gov.cn/2020-07/03/c_538689.htm | |
| Acetonitrile | ABX,Germany | TF-A1-231207002 | |
| air filter membrane (Millex-25) | Merck,Germany | SLFGN25VS | |
| Boc-protected-precursor | Huayi,Jiangsu,China | NPPI-95-0001A | |
| C18 column | Waters,USA | 186004770 | |
| Cyclotron | GE,USA | MINITRACE | |
| Dimethyl sulfoxide (DMSO) | Bailing Wei Technology,Beijing,China | 984549 | |
| EtOH | ABX,Germany | 10009216 | |
| EtOH for isolation | Sinopharm Chemical Reagent,Shanghai,China | 400212682 | |
| Gas chromatography | Tianmei,Shanghai,China | GC-7900 | |
| HPLC | SYKNM,Germany | S-1122 | |
| Hydrochloric acid | Sinopharm Chemical Reagent,Shanghai,China | 10011018 | |
| K2CO3 Solution | ABX,Germany | TF-K1-230724001 | |
| Kryptofix[2.2.2](K222) | ABX,Germany | 800 | |
| liquid filter membrane (Millex-GV) | Merck,Germany | SLGVR33RB | |
| Oasis HLB solid-phase extraction (SPE) column | Waters,USA | 186003908 | |
| PET/MR | GE,USA | Signa | |
| QMA column | Waters,USA | 186002350 | |
| Radionuclide activity | Capintec,USA | CRC-25R |
Références
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Rajan, K. B., et al. Population estimate of people with clinical AD and mild cognitive impairment in the United States (2020-2060). Alzheimers Dement. 17 (12), 1966-1975 (2021).
- U.S. Burden of Disease Collaborators. The state of U.S. health, 1990-2016: Burden of diseases, injuries, and risk factors among U.S. states. JAMA. 319 (14), 1444-1472 (2018).
- Bhatt, J., et al. . The World Alzheimer Report 2019: Attitudes to dementia. , (2019).
- Rostagno, A. A. Pathogenesis of Alzheimer's disease. Int J Mol Sci. 24 (1), 107 (2022).
- Ossenkoppele, R., van der Kant, R., Hansson, O. Tau biomarkers in Alzheimer's disease: Towards implementation in clinical practice and trials. Lancet Neurol. 21 (8), 726-734 (2022).
- Abbott, A. Conquering Alzheimer's: A look at the therapies of the future. Nature. 616 (7955), 26-28 (2023).
- Politis, M., Piccini, P. Positron emission tomography imaging in neurological disorders. J Neurol. 259 (9), 1769-1780 (2012).
- Okamura, N., et al. Tau PET imaging in Alzheimer's disease. Curr Neurol Neurosci Rep. 14 (11), 500 (2014).
- Holland, N., et al. Differential synaptic loss in β-amyloid positive versus β-amyloid negative corticobasal syndrome. Mov Disord. 39 (7), 1166-1178 (2024).
- Nicastro, N., et al. 18F-AV1451 PET imaging and multimodal MRI changes in progressive supranuclear palsy. J Neurol. 267 (2), 341-349 (2020).
- Cousins, O., et al. Microglial activation, tau and amyloid deposition in TREM2 p.R47H carriers and mild cognitive impairment patients: A multi-modal/multi-tracer PET/MRI imaging study with influenza vaccine immune challenge. J Neuroinflammation. 20 (1), 272 (2023).
- Chien, D., et al. Early clinical PET imaging results with the novel PHF-tau radioligand [F18]-T808. J Alzheimers Dis. 38 (1), 171-184 (2014).
- Maruyama, M., et al. Imaging of tau pathology in a tauopathy mouse model and in Alzheimer patients compared to normal controls. Neuron. 79 (6), 1094-1108 (2013).
- Li, Y., et al. Cortical laminar binding of PET amyloid and tau tracers in Alzheimer disease. J Nucl Med. 56 (2), 270-273 (2015).
- Fodero-Tavoletti, M. T., et al. 18F-THK523: A novel in vivo tau imaging ligand for Alzheimer's disease. Brain. 134 (4), 1089-1100 (2011).
- Okamura, N., et al. Non-invasive assessment of Alzheimer's disease neurofibrillary pathology using 18F-THK5105 PET. Brain. 137 (Pt 6), 1762-1771 (2014).
- Tago, T., et al. Preclinical evaluation of [(18)F]THK-5105 enantiomers: Effects of chirality on its effectiveness as a tau imaging radiotracer. Mol Imaging Biol. 18 (2), 258-266 (2016).
- Xia, C. F., et al. [18F]T807, a novel tau positron emission tomography imaging agent for Alzheimer's disease. Alzheimers Dement. 9, 666-676 (2013).
- Fleisher, A. S., et al. Positron emission tomography imaging with [18F]flortaucipir and postmortem assessment of Alzheimer disease neuropathologic changes. JAMA Neurol. 77 (7), 829-839 (2020).
- Whitwell, J., et al. [18F]AV-1451 tau positron emission tomography in progressive supranuclear palsy. Mov Disord. 32 (1), 124-133 (2017).
- Kantarci, K., et al. AV-1451 Tau and β-amyloid positron emission tomography imaging in dementia with Lewy bodies. Ann Neurol. 81 (1), 58-67 (2017).
- Mossine, A. V., et al. An updated radiosynthesis of [18F]AV1451 for tau PET imaging. EJNMMI Radiopharm Chem. 2 (1), 7 (2017).
- McKhann, G., et al. Clinical diagnosis of Alzheimer's disease: Report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology. 34 (7), 939-944 (1984).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 7 (3), 263-269 (2011).
- Chandra, A., et al. Alzheimer's Disease Neuroimaging Initiative. Applications of amyloid, Tau, and neuroinflammation PET imaging to Alzheimer's disease and mild cognitive impairment. Hum Brain Mapp. 40 (18), 5424-5442 (2019).
- Jack, C. R., et al. NIA-AA research framework: Toward a biological definition of Alzheimer's disease. Alzheimers Dement. 14 (4), 535-562 (2018).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging and the Alzheimer's Association Workgroup. Alzheimers Dement. 7, 263-269 (2011).
- Albert, M. S., et al. The diagnosis of mild cognitive impairment due to Alzheimer's disease: Recommendations from the National Institute on Aging and Alzheimer's Association Workgroup. Alzheimers Dement. 7, 270-279 (2011).
- Simrén, J., Elmgren, A., Blennow, K., Zetterberg, H. Fluid biomarkers in Alzheimer's disease. Adv Clin Chem. 112, 249-281 (2023).
- Molinuevo, J. L., et al. Current state of Alzheimer's fluid biomarkers. Acta Neuropathol. 136, 821-853 (2018).
- Alcolea, D., et al. Amyloid precursor protein metabolism and inflammation markers in preclinical Alzheimer disease. Neurology. 85, 626-633 (2015).
- Ia, J., et al. Biomarker changes during 20 years preceding Alzheimer's disease. N Engl J Med. 390 (8), 712-722 (2024).
- Leung, K. K., et al. Cerebral atrophy in mild cognitive impairment and Alzheimer disease: Rates and acceleration. Neurology. 80 (7), 648-654 (2013).
- Contador, J., et al. Longitudinal brain atrophy and CSF biomarkers in early-onset Alzheimer's disease. Neuroimage Clin. 32, 102804 (2021).
- Menéndez-González, M., de Celis Alonso, B., Salas-Pacheco, J., Arias-Carrión, O. Structural neuroimaging of the medial temporal lobe in Alzheimer's disease clinical trials. J Alzheimers Dis. 48 (3), 581-589 (2015).
- van Oostveen, W. M., de Lange, E. C. M. Imaging techniques in Alzheimer's disease: A review of applications in early diagnosis and longitudinal monitoring. Int J Mol Sci. 22 (4), 2110 (2021).
- Reiman, E. M., Jagust, W. J. Brain imaging in the study of Alzheimer's disease. Neuroimage. 61 (2), 505-516 (2012).
- Herholz, K. Perfusion SPECT and FDG-PET. Int Psychogeriatr. 23 (Suppl 2), S25-S31 (2011).
- Lamontagne-Kam, D., et al. Implication of tau propagation on neurodegeneration in Alzheimer's disease. Front Neurosci. 17, 1219299 (2023).
- Gomar, J. J., et al. Increased retention of tau PET ligand [18F]-AV1451 in Alzheimer's disease psychosis. Transl Psychiatry. 12 (1), 82 (2022).
- Shoup, T. M., et al. A concise radiosynthesis of the tau radiopharmaceutical [(18)F]T807. J Labelled Compd Radiopharm. 56 (14), 736-740 (2013).
- Schwarz, A. J., et al. Regional profiles of the candidate tau PET ligand 18F-AV-1451 recapitulate key features of Braak histopathological stages. Brain. 139, 1539-1550 (2016).
- Pascoal, T. A., et al. Longitudinal 18F-MK-6240 tau tangles accumulation follows Braak stages. Brain. 144, 3517-3528 (2021).
- Braak, H., Braak, E. Neuropathological staging of Alzheimer-related changes. Acta Neuropathol. 82, 239-259 (1991).
- Braak, H., et al. Staging of Alzheimer disease-associated neurofibrillary pathology using paraffin sections and immunocytochemistry. Acta Neuropathol. 112, 389-404 (2006).
- Ossenkoppele, R., et al. Associations between Tau, Aβ, and cortical thickness with cognition in Alzheimer disease. Neurology. 92, e601-e612 (2019).
- Jack, C. R., et al. Revised criteria for diagnosis and staging of Alzheimer's disease: Alzheimer's Association Workgroup. Alzheimers Dement. 20 (8), 5143-5169 (2024).
- Josephs, K. A., Weigand, S. D., Whitwell, J. L. Characterizing amyloid-positive individuals with normal tau PET levels after 5 years. Neurology. 98, e2282-e2292 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon