Method Article
Hybride PET/MRT-Bildgebung der Alzheimer-Krankheit auf Basis von 18F-AV-1451
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Verwendung von 18F-AV-1451 PET/MRT zur Aufdeckung der Tau-Pathologie und Neurodegeneration, unterstützt Neurologen bei der Diagnose der Alzheimer-Krankheit, der Beurteilung ihres Schweregrads und der Gewinnung von Einblicken in ihr Fortschreiten und die zugrunde liegenden pathologischen Mechanismen.
Zusammenfassung
Die Alzheimer-Krankheit (AD) ist eine fortschreitende und irreversible neurodegenerative Erkrankung, die durch kognitive Dysfunktion, Verschlechterung der täglichen Lebensfähigkeit und Verhaltensänderungen gekennzeichnet ist und weltweit eine erhebliche wirtschaftliche und soziale Belastung darstellt. Eines der primären pathologischen Kennzeichen der Alzheimer-Krankheit ist die Anhäufung von neurofibrillären Bündeln, die durch hyperphosphoryliertes Tau-Protein gebildet werden. Die Positronen-Emissions-Tomographie/Magnetresonanztomographie (PET/MRT) liefert detaillierte strukturelle und funktionelle Informationen sowie spezifische Proteinverteilungen, was sie zu einem zunehmend wertvollen Werkzeug für die Diagnose und Erforschung von Alzheimer macht. 18F-AV-1451 ist ein Radiotracer, der speziell für den Nachweis von Tau-Proteinen in der PET-Bildgebung von Hirngewebe entwickelt wurde. Diese Studie stellt ein detailliertes Protokoll für die Radiosynthese von 18F-AV-1451, die Patientenvorbereitung, PET/MRT-Bildaufnahmetechniken und ihre potenziellen Anwendungen in der AD-Bewertung vor. 18Die PET/MRT F-AV-1451 könnte Neurologen bei der Diagnose von Alzheimer, der Beurteilung des Schweregrads der Erkrankung und der Gewinnung von Erkenntnissen über ihre pathologischen Mechanismen unterstützen. Zusammenfassend lässt sich sagen, dass dieses Protokoll einen sensitiven, umfassenden und nicht-invasiven Ansatz für die Bewertung der AD bietet und wertvolle Einblicke in das Fortschreiten der Erkrankung und die Pathologie bietet.
Einleitung
Die Alzheimer-Krankheit (AD) ist eine fortschreitende und irreversible neurodegenerative Erkrankung. Die Patienten leiden in der Regel unter kognitiven Dysfunktionen, einem Rückgang der Fähigkeiten des täglichen Lebens und Verhaltensänderungen. Mit der immer schneller alternden Weltbevölkerung ist die Alzheimer-Krankheit zu einem großen Problem für die öffentliche Gesundheit geworden. Derzeit leben weltweit mehr als 50 Millionen Menschen mit AD. Bis zum Jahr 2050 wird sich die Prävalenz von Demenz voraussichtlich weltweit verdreifachen1. Etwa 10,8 % der Menschen ab 65 Jahren leiden an Alzheimer-Demenz. Die Prävalenz von AD liegt bei Personen im Alter von 65 bis 74 Jahren bei etwa 5 % und steigt bei Personen ab 85 Jahren auf 33,3 %, was sie zu einer der häufigsten Todesursachen bei älteren Menschen macht2. Sobald ein Patient an Alzheimer erkrankt, stellt dies eine erhebliche Belastung für die Familiedar 3. Aufgrund des heimtückischen Beginns verpassen Patienten oft das optimale Zeitfenster für die Behandlung nach der Diagnose. Ihre Früherkennung bleibt eine globale Herausforderung4, da die genaue Ätiologie noch nicht vollständig verstanden ist 5,6. Angesichts der komplexen Ätiologie und der Signalwege, die die Alzheimer-Krankheit beeinflussen, besteht ein dringender Bedarf an genaueren und frühzeitigeren Diagnosestrategien.
Herkömmliche bildgebende Verfahren wie Computertomographie (CT) und Magnetresonanztomographie (MRT) werden eingesetzt, um Atrophie oder andere strukturelle Veränderungen im Gehirn zu beobachten, die zu kognitiven Beeinträchtigungen beitragen können. Insbesondere die MRT bietet einen besseren Weichteilkontrast als die CT und liefert Informationen zur Tumorbiologie, ohne dass die Patienten ionisierender Strahlung ausgesetzt werden, was sie zur bevorzugten Bildgebungsmethode für die meisten neurologischen Erkrankungen macht6. Die MRT ist ein leistungsfähiges bildgebendes Verfahren, das nicht nur detaillierte makroskopische anatomische Informationen liefert, sondern auch verschiedene funktionelle Bildgebungsverfahren umfasst, wie z. B. die blutsauerstoffabhängige funktionelle Magnetresonanztomographie (BOLD fMRT), mit der die funktionelle Hirnaktivität beobachtet werden kann6. Die Positronen-Emissions-Tomographie (PET) ist ein nicht-invasives molekulares Bildgebungsverfahren, das eine umfangreiche semiquantitative Analyse biologischer Prozesse im menschlichen Gehirn ermöglicht. Die Hybrid-PET/MRT kann gegenüber anderen bildgebenden Verfahren für die AD-Diagnose Vorteile bieten7, da die Verwendung einer Vielzahl von PET-Tracern zusätzliche physiologische Informationen zur Ergänzung der anatomischen MRT-Bilder liefern kann 8,9.
Neurofibrilläre Verwicklungen, die durch die Hyperphosphorylierung des Tau-Proteins gebildet werden, sind eines der pathologischen Merkmale der AD, das eng mit dem Auftreten der Neurodegeneration und der Manifestation klinischer Symptome sowohl räumlich als auch zeitlich verbunden ist6. Das Tau-Protein ist das am häufigsten vorkommende Mikrotubuli-assoziierte Protein in vivo und ist sowohl im peripheren als auch im zentralen Nervensystem vorherrschend. Die pathologische Progression von Tau korreliert stark mit dem Grad der kognitiven Beeinträchtigung und hat das Potenzial, als therapeutisches Ziel für Alzheimer-Patienten zu dienen7. Der nicht-invasive Nachweis der Ablagerung von Tau-Proteinen in bestimmten Hirnregionen ist wertvoll für die frühzeitige Vorhersage und Diagnose der Krankheit. Der Einsatz von Tau-Radiotracern ermöglicht die Visualisierung und Lokalisierung von Tau-Proteinablagerungen im Gehirn und ermöglicht so eine zeitnahe und genaue Differentialdiagnose sowie eine wertvolle Unterstützung bei der Verfolgung des Krankheitsverlaufs und der Beurteilung experimenteller klinischer Behandlungen 8,9.
Mehrere Studien haben einen Zusammenhang zwischen Veränderungen bestimmter Proteine und funktionellen oder morphologischen MRT-Befunden gezeigt10,11. Es gibt jedoch nur wenige Berichte über kombinierte Analysen mittels Amyloid/Tau-Bildgebung und funktioneller MRT12. Das neuartige molekulare Diagnostikum 18F-AV-1451 (7-(6-[18F]fluoropyridin-3yl)-5H-pyrido[4,3-b]indol) wurde als Radiodiagnostikum für den Nachweis von Tau-Proteinen in PET-abgebildetem Hirngewebe eingesetzt. Die Forschung zur Tau-PET-Bildgebung befindet sich noch in der Entwicklungsphase, wobei derzeit nur wenige Tracer ausgewertet werden, darunter 18F-T807 (18F-AV-1451), 18F-T808 (18F-AV-680)13, 11C-PBB314, 18F-THK-511715, 18F-THK-52316 und 18F-THK-510517,18. 18F-AV-1451 wurde kommerziell entwickelt19und für die Anwendung bei Patienten mit AD20, progressiver supranukleärer Parese21 und Demenz mit Lewy-Körpernberichtet 22. Der Radiosyntheseprozess von 18F-AV-1451 erfordert einen komplexen Reinigungsschritt, um sicherzustellen, dass das Endprodukt die Dosisanforderungen für klinische Bildgebungsstudien erfüllt23. Mit der zunehmenden Anwendung von 18F-markierten Radiotracern in der PET-Bildgebungstechnologie steigt die Nachfrage nach der Synthese und Entwicklung neuer 18F-markierter Radiotracer. In dieser Studie wird ein tau-PET/MRT-Bildgebungsverfahren vorgestellt, das darauf abzielt, detailliertere Informationen für die Diagnose von Patienten mit Alzheimer-Krankheit zu liefern.
Protokoll
Die Studie wurde von der lokalen medizinischen Ethikkommission genehmigt, und alle Probanden gaben vor der Teilnahme eine schriftliche Einverständniserklärung ab. Alle Studien wurden in Übereinstimmung mit den Grundsätzen der Deklaration von Helsinki durchgeführt. Alle Probanden wurden innerhalb von drei Monaten vor und nach der Bildgebung neurologischen und neuropsychologischen Untersuchungen durch eine medizinische Fachkraft unterzogen. Die Patienten wurden auf der Grundlage des Kriteriums24 der National Institute on Aging-Alzheimer's Disease Association (NINCDS-ADRDA) und des Kriteriums25 des National Institute on Aging-Alzheimer's Association (NAA) eingeschlossen. Die Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. 18F-AV-1451 Synthese
HINWEIS: Befolgen Sie während des Betriebs die Grundsätze des biologischen und radiologischen Arbeitsschutzes sowie die Grundsätze der Entsorgung medizinischer und radioaktiver Abfälle.
- Details aus Synthetik
- Synthetisieren Sie 2,5 mL [18F]-Fluorid unter Verwendung der Kernreaktion 18O(p, n)18F unter Verwendung eines Teilchenbeschleunigers, wobei Protonen mit integrierten Strömen bis zu 45 μA 40 Minuten lang bombardiert werden. Geben Sie [18F] Fluorid über die Transferleitung in das automatisierte Synthesemodul, was durch den Heliumgas-Überdruck erleichtert wird. Betreiben Sie das Synthesemodul in der in Abbildung 1 gezeigten Reihenfolge.
- Fluorid [18F] auf einer Ionenaustauschsäule auffangen (mit 1 mL Ethanol und 2 mL Wasser voraktivieren), während das 18O Wasser im Auffanggefäß zurückgehalten wird.
- Lassen Sie die Kaliumcarbonatlösung aus dem Gefäß Nr. 1 (Abbildung 1) durch die dafür vorgesehenen Ventile und die Ionenaustauschersäule fließen, um sie mit [18F] Fluorid auszutauschen, und eluieren Sie dann in das Reaktionsgefäß. Siehe Tabelle 1 für Lösungen in den verschiedenen Behältern.
- Fluorid [18F] und ein Phasentransferkatalysator auf Kryptoandenbasis, der in das Gefäß Nr. 2 im Reaktionsgefäß vorgeladen ist, werden gelöst.
- Öffnen Sie das dafür vorgesehene Ventil. Das Reaktionsgemisch wird 8 min lang einer Vakuumdestillation unter Stickstoffblasen bei 85 °C und anschließend 4 min lang unter Stickstoffblasen bei 110 °C unterzogen, um Restwasser zu entfernen.
- Den Vorläufer aus dem Gefäß Nr. 3 in das Gefäß Nr. 12 geben und 10 min auf 130 °C erhitzen. Die Radiosynthese von 18F-AV-1451 ist in Abbildung 2 dargestellt.
- Das Reaktionsgemisch auf 50 °C abkühlen und dann die dafür vorgesehenen Ventile öffnen, um den atmosphärischen Druck wiederherzustellen.
- Spülen Sie das Reaktionsgemisch in das Gefäß Nr. 14 mit einem Volumen von 3 ml HPLC-Mobilphase (25 % wässrige Ethanollösung, pH-Wert auf 2,0 eingestellt), das aus den Gefäßen Nr. 5 und Nr. 6 stammt. Öffnen Sie die dafür vorgesehenen Ventile, um das Eindringen des Gemisches in den HPLC-Kreislauf unter Heliumdruck zu ermöglichen.
- Geben Sie das Produkt in die semi-präparative HPLC-Säule und eluieren Sie mit der mobilen Phase bei einer Flussrate von 5 mL/min. Beobachten Sie das Eluent mit UV- (λ = 254 nm) und Radioaktivitätszählern.
- Das Produkt wird über das dafür vorgesehene Ventil in den Rundkolben aufgefangen.
- Das Produkt wird in der C18-Säule eingeschlossen und zurückgehalten (aktiviert durch 5 mL Ethanol und 10 mL Wasser).
- Öffnen Sie das dafür vorgesehene Ventil, spülen Sie die Säule mit Wasser aus dem Gefäß Nr. 9 in den Abfallbehälter und spülen Sie sie dann mit der Lösung aus den Gefäßen Nr. 8 und Nr. 7 in die Produktflasche.
- 18F-AV-1451 wird unter Heliumdruck durch eine 0,22 μm große Flüssigkeitsfiltermembran in die Auffangflasche in der Dosier-Heißzelle geleitet.
- Qualitätskontrolle
HINWEIS: Führen Sie eine Qualitätskontrolle für drei aufeinanderfolgende Chargen des Produkts durch. Stellen Sie sicher, dass die Qualitätskontrolle des Produkts die Kriterien des Arzneibuchs der Volksrepublik China in der Ausgabe 2020 erfüllt (siehe Materialtabelle).- Führen Sie eine Sichtprüfung durch, indem Sie das Produkt hinter Bleiglas legen und die Farbe und Klarheit überprüfen.
- Bestimmen Sie den pH-Wert des Produkts mit Präzisions-pH-Testpapier.
- Verwenden Sie HPLC, um die radiochemische Reinheit des Produkts zu analysieren 8,16.
- Die radioaktive Kernreinheit des Produkts ist mit der Gammaspektrometermethode17 zu analysieren.
- Messen Sie die Halbwertszeit des Produkts genau gemäß dem Arzneibuch der Volksrepublik China13.
- Üben Sie einen Druck von 0,34 MPa auf die Sterilfiltermembran aus (Schritt 1.1.12), um ihre Dichtheit und Unversehrtheit zu testen.
- Sterilitäts- und Endotoxintests unter Verwendung von Bakterienkulturen und der Pfeilschwanzkrebs-Reagenzmethodedurchführen 23.
- Prüfen Sie den Rückstand des Phasentransferkatalysators auf Kryptandenbasis mit der Kaliumiodoplatinat-Methode. Der Gehalt an Aceton, Acetonitril und DMSO im Produkt ist mit einem Gaschromatographenzu analysieren 8,16.
HINWEIS: Stellen Sie sicher, dass außer 0,511 MeV und 1,022 MeV keine anderen Spitzen angezeigt werden.
2. Richtlinien für die Vorprüfung
HINWEIS: Teilnehmer wurden eingeschlossen, wenn sie ein aktuelles Problem hinsichtlich einer Veränderung der Kognition hatten und eine Beeinträchtigung in einem oder mehreren kognitiven Bereichen zeigten, während sie ihre Unabhängigkeit in ihren funktionellen Fähigkeiten beibehielten25. Voraussetzung für die Eignung war ein MMSE-Ergebnis (Mini-Mental State Examination) zwischen 0 und 20 und eine positive Amyloidprotein-Positivität, die durch ein abnormales Aβ42- oder Aβ42/Aβ40-Verhältnis der Zerebrospinalflüssigkeit (CSF) oder eine positive Amyloid-Positronen-Emissions-Tomographie (PET) bestätigt wurde 6,20. Zu den Ausschlusskriterien gehörte die Diagnose von Gefäßerkrankungen, Depressionen, traumatischen Hirnverletzungen, psychotischen Störungen oder anderen Erkrankungen, die mit kognitivem Verfall verbunden sind5. Ausgeschlossen wurden Teilnehmer mit Kontraindikationen für Herzschrittmacher, ferromagnetische Substanzen oder Fremdkörper, die eine Mobilitätsgefährdung darstellen, sowie solche, die sich keiner MRT-Bildgebung unterziehen konnten. Weitere Ausschlusskriterien waren eine Unverträglichkeit gegenüber Gadolinium-Kontrastmitteln und das Vorliegen einer schweren Niereninsuffizienz21.
- Weisen Sie die Probanden an, 24 Stunden vor der Studie auf Alkohol, Koffein, Medikamente oder anstrengende Übungen oder Aktivitäten zu verzichten. Aufrechterhaltung eines stabilen physiologischen Zustands (z. B. Biorhythmen, Aufgaben der Gehirnfunktion), um die Datengenauigkeit zu gewährleisten.
- Lassen Sie die Probanden vor der Untersuchung Wasser und Nahrung zu sich nehmen, da diese die Tau-PET/MR-Bildgebung nicht beeinträchtigen.
- Brechen Sie neurologische Arzneimittel mindestens 12 Stunden vor der Bildgebung ab.
- Raten Sie den Probanden, am Tag der Untersuchung keinen Metallschmuck oder Kleidung mit Metallknöpfen oder Reißverschlüssen zu tragen.
HINWEIS: Stellen Sie sicher, dass der Patient von einem Familienmitglied begleitet wird, frühere Untersuchungsunterlagen mitbringt und das medizinische Personal über die Einnahme von Medikamenten informiert.
3. Vorbereitung für den Scanvorgang
- Überprüfen Sie das Antragsformular, um allgemeine Informationen, den Prüfungszweck und das Programm zu bestätigen. Stellen Sie sicher, dass alle notwendigen Vorbereitungen abgeschlossen sind. Registrieren Sie sich und legen Sie die Details ab.
- Holen Sie die Einverständniserklärung für PET/MRT-Bildgebung vom Probanden oder einem Familienmitglied ein. Informieren Sie das Subjekt über den Zweck, das Verfahren, die Risiken und den Nutzen.
- Führen Sie eine detaillierte Anamneseüberprüfung durch, erfassen Sie die Größe, das Gewicht und die Blutkonzentration des Probanden und bestätigen Sie, dass keine Kontraindikationen für die MRT-Untersuchung vorliegen.
- Legen Sie einen intravenösen Zugang in einer peripheren oberflächlichen Vene an oder greifen Sie auf einen Portkatheter zu.
- Überprüfen Sie vor der Verabreichung von 18F-AV-1451 alle Angaben erneut, um Fehler zu vermeiden.
- Injizieren Sie 18F-AV-1451 in einer Dosis von 3,7-5,5 MBq/kg langsam durch den intravenösen Zugang. Spülen Sie das Röhrchen mit einer angemessenen Menge Kochsalzlösung, um radioaktive Tracerrückstände zu minimieren. Wenden Sie eine Kompression auf die Injektionsstelle an, um ein Austreten von Flüssigkeit zu verhindern.
- Notieren Sie den Injektionszeitpunkt, die Injektionsstelle und die Aktivität.
- Nach Abschluss der Injektion den audiovisuellen Verschluss einleiten. Dimmen Sie das Licht in der Wartezeit
und stellen Sie die Temperatur auf ca. 22 °C ein. Weisen Sie den Probanden an, sich 80 Minuten lang mit geschlossenen Augen im Bett auszuruhen und während dieser Zeit nicht zu sprechen, zu essen oder zu kauen.
4. PET/MRT-Untersuchung
- Weisen Sie den Probanden und den Begleiter an, vor der Untersuchung alle metallischen Gegenstände, einschließlich Mobiltelefone, Kopfbedeckungen, Zahnprothesen, Brillen, Uhren, Geldbörsen und Münzen, zu entfernen. Lassen Sie keine Rollstühle, Tragen, Untersuchungsbetten, Sauerstoffflaschen oder Überwachungsgeräte im Untersuchungsraum zu.
- Geben Sie dem Probanden Ohrstöpsel und positionieren Sie ihn in Rückenlage auf dem PET/MRT-Tisch mit einer Kopf-/Halsspirale, die den Halsbereich umschließt. Verwenden Sie eine spezielle Kopfstütze oder ein Schwammpolster, um den Kopf zu stabilisieren, Bewegungen zu minimieren und Komfort zu gewährleisten.
HINWEIS: Verabreichen Sie bei Bedarf eine angemessene Dosis Beruhigungsmittel auf der Grundlage einer neurologischen Untersuchung. - Positionieren Sie die Person mit den Armen nach unten und weisen Sie sie an, das Alarmgerät zu benutzen, falls sie sich unwohl fühlen.
- Überprüfen Sie die Bilder, um sicherzustellen, dass der Kopf im Scanner zentriert, mit der Mitte der Spule ausgerichtet und konsistent relativ zum Hals positioniert ist.
- Verwenden Sie für die Bildgebung eine 8-Kanal-Kopf- und Halsverbindungsspule.
- Erfassen Sie volumetrische T1-gewichtete 3D-Sequenzen des Gehirns mit hoher Auflösung und hohem Signal-Rausch-Verhältnis (SNR) unter Verwendung einer verdorbenen Gradienten-Recall-Sequenz. Legen Sie die folgenden Parameter fest:
- Wiederholzeit (TR) = 8,5 ms; Echozeit (TE) = 3,2 ms; Inversionszeit (TI) = 450 ms; Flip-Winkel = 12°; Voxelgröße = 1 × 1 × 1 mm³; Sichtfeld (FOV) = 256 mm; Matrixgröße = 256 × 256; Dicke der Scheibe = 1 mm.
- Erfassen Sie axiale PROPELLER T2-gewichtete Sequenzen mit den folgenden Parametern: TR = 6837 ms; TE = 132 ms; Flip-Winkel = 142°; Sichtfeld = 240 mm; Matrixgröße = 416 × 416; Scheibenstärke = 5 mm.
HINWEIS: Beim PET-Scannen wird eine Einzelbettposition verwendet, die das gesamte Gehirn vom Foramen magnum bis zur Schädeldecke abdeckt.
- Gleichzeitige Aufnahme von 20-minütigen PET-Bildern.
- Führen Sie PET-Scans im 3D-Erfassungsmodus durch.
- Verwenden Sie volumetrisches Scannen für die PET-Bildgebung.
- Führen Sie eine MRT-Bildgebungs-Dämpfungskorrektur mit einer ZTE-Impulssequenz (Null-Echo-Zeit) durch, um Knochen, Luft und Weichgewebe zu segmentieren.
- Erfassen Sie PET-Daten unter Verwendung der Time-of-Flight Ordered Subset Expectation Maximization (OSEM) für die Bildrekonstruktion20,23. Verwenden Sie die folgenden Parameter:
- Matrixgröße = 192 × 192; 28 Teilmengen mit 6 Iterationen; Sichtfeld = 350 × 350 mm; Volle Breite bei halbem Maximum (FWHM) = 3,0 mm.
- Berechnen Sie den standardisierten Aufnahmewert (SUV) nach der Formel20,23:
SUV = (Sphärenaktivität (Bq/ml) × Körpergewicht (kg)) / Injizierte Dosis.
5. Interpretation des Bildes
- Visuelle Beurteilung aller PET/MRT-Bilder unabhängig voneinander von mindestens zwei erfahrenen Nuklearmedizinern, die für die klinische Diagnose verblindet sind.
- Identifizieren Sie Hirnlappen, die abnormale strukturelle Veränderungen und Proteinablagerungen aufweisen.
- Wiederholen Sie die visuelle Beurteilung, bis ein endgültiger Konsens erreicht ist.
- Definieren Sie einen "positiven Scan" als eine erhöhte Aufnahme von 18F-AV-1451 in einer oder allen kortikalen Regionen. Definieren Sie einen "negativen Scan" als das Fehlen einer 18F-AV-1451-Aufnahme in allen kortikalen Regionen.
- Definieren Sie die Atrophie im medialen Temporallappen, insbesondere im Hippocampus im MRT, als Neurodegeneration20,25.
Ergebnisse
18Ergebnisse der F-AV-1451-Synthese
Die einstufige Synthese von 18F-AV-1451 unter optimierten Reaktionsbedingungen erhöhte die Syntheseausbeute auf 25,7 % ± 5,8 %. Die Gesamteinwirkzeit betrug 70 min. Ein typisches semi-präparatives HPLC- und UV-Spektrum ist in Abbildung 3 dargestellt, wobei Peak 2 den Produktpeak darstellt.
Ergebnisse von Qualitätstests
Für drei aufeinanderfolgende Chargen ergaben sich folgende Ergebnisse der Qualitätskontrolle: Die Lösung war farblos, visuell transparent und frei von offensichtlichen Verunreinigungen. Der pH-Wert lag zwischen 4,5 und 7,5. HPLC- und DC-Analysen zeigten, dass die chemische Reinheit >95 % und die radiochemische Reinheit >95 % betrug. Die primäre Photonenenergie betrug 0,511 MeV. Die Halbwertszeit entsprach den geforderten Spezifikationen, ohne Isotope mit langer Halbwertszeit (t1/2 > 5 Tage). Die sterile Filtermembran wurde ohne Luftleckage auf 0,34 MPa unter Druck gesetzt. Die Endotoxingehalte betrugen <15 EU pro 1 ml des Produkts. Eine Bakterienkultur bestätigte die Sterilität. K2. 2. Urheberrecht 2 betrug ≤50 μg/ml. Darüber hinaus entsprachen Restlösungsmittel wie Aceton, Acetonitril und DMSO den Standards des Arzneibuchs der Volksrepublik China (siehe Materialtabelle).
18F-AV-1451 PET/MR Ergebnisse
Abbildung 4 zeigt ein Beispiel für die PET/MR-Bildgebung bei einem 69-jährigen Mann mit anhaltendem kognitiven Verfall (MMSE-Score: 19/30) mit positiver Tau-Ablagerung. Die Bilder zeigen eine signifikante Hirnatrophie, die vor allem durch erweiterte und vertiefte Windungen der grauen Substanz und vergrößerte Ventrikel gekennzeichnet ist. Die AD-Untergruppen zeigten eine signifikante Bindung von 18F-AV-1451 mit der unterschiedlichen regionalen Verteilung. Die Tau-Akkumulation begann im entorhinalen Kortex und im Hippocampus, breitete sich dann auf den temporalen und parietalen Kortex aus und erstreckte sich schließlich großflächig über die gesamte Großhirnrinde.
Abbildung 5 zeigt ein Beispiel für die PET/MR-Bildgebung bei einem 68-jährigen Mann mit kognitivem Verfall (MMSE-Score: 24/30) mit negativer Tau-Ablagerung. Die Bilder zeigen eine normale Hirnparenchymmorphologie beidseitig, mit einer gleichmäßigen und symmetrischen Aufnahme von 18F-AV-1451 Radioaktivität. MRT aus derselben Bildgebungssitzung zeigte eine normale ventrikuläre Größe und Morphologie, ohne Verschiebung der Mittellinie und ohne abnormale Signale im Hirnparenchym. Es gab eine unspezifische Aufnahme in den Basalganglien und im Hirnstamm.
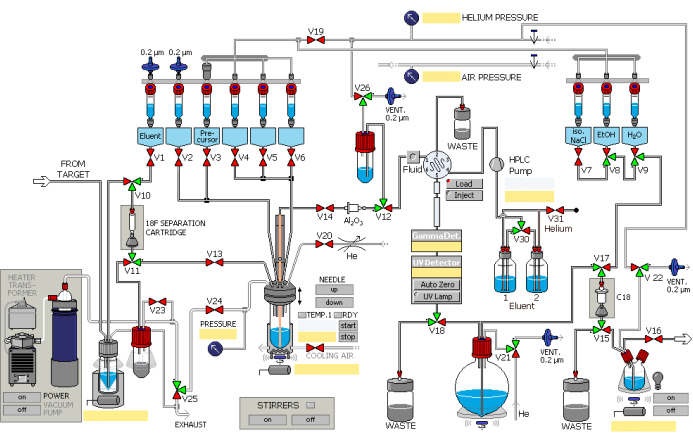
Abbildung 1: Schematische Darstellung des Radiosynthesemoduls. Das Synthesemodul arbeitet sequenziell gemäß den angegebenen Schritten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
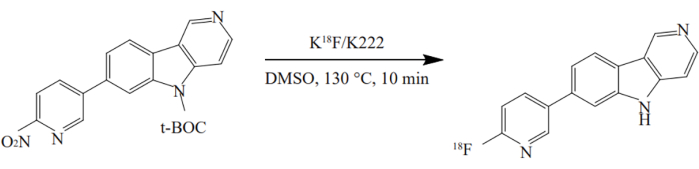
Abbildung 2: Radiosynthese von 18F-AV-1451. Die Verbindung wurde in einem Eintopfverfahren unter optimierten Bedingungen synthetisiert. Der Nitro-Vorläufer wurde mit K[18F]/K2.2.2 in DMSO bei 130 °C für 10 min umgesetzt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
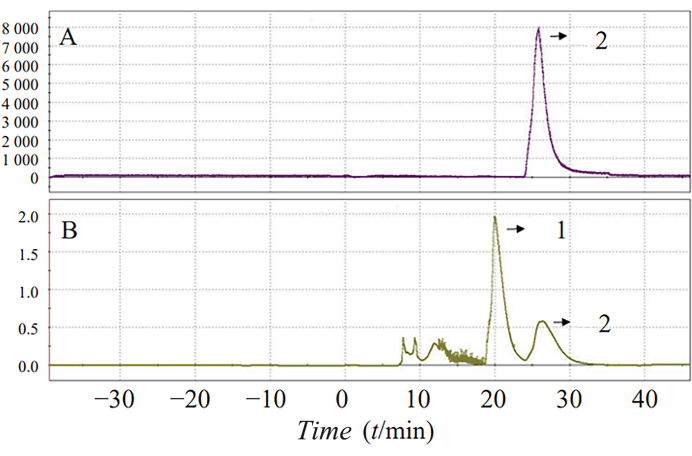
Abbildung 3: HPLC (A) und UV (B) Trennung von 18F-AV-1451 Radioaktivität. Gezeigt werden die semi-präparativen HPLC- und UV-Spektren. Peak 2 stellt den Produkt-Peak dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Repräsentative bildgebende Daten eines Patienten mit positiver Tau-Ablagerung. (A) 18F-AV-1451 PET-Bilder. (B) Axiale T1-gewichtete Bilder (T1WI). (C) Axiale T2-gewichtete Bilder (T2WI). (D) Axiale 18F-AV-1451 PET/MR-Fusionsbilder. T1WI- und T2WI-Bilder zeigen eine bilaterale Volumenreduktion des Hippocampus, eine ventrikuläre Dilatation, eine Erweiterung und Vertiefung der Sulkalfissuren und keine Verschiebung der Mittellinienstruktur. 18F-AV-1451 PET/MR-Fusionsbilder zeigen einen positiven Tau-PET-Scan mit Aufnahme im medialen frontalen Gyrus, im vorderen Cuneus, im Gyrus temporalis inferior und im lateralen okzipitalen Kortex. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
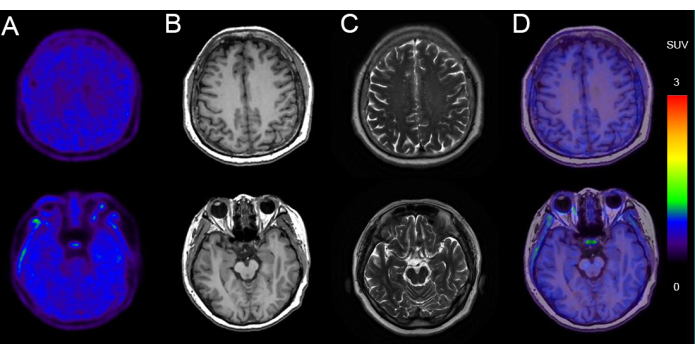
Abbildung 5: Repräsentative Bildgebungsdaten eines Patienten mit negativer Tau-Ablagerung. (A) 18F-AV-1451 PET-Bilder. (B) Axiale T1-gewichtete Bilder (T1WI). (C) Axiale T2-gewichtete Bilder (T2WI). (D) Axiale 18F-AV-1451 PET/MR-Fusionsbilder. T1WI- und T2WI-Bilder zeigen eine normale MRT des Gehirns, ohne signifikante Temporallappenatrophie, die auf eine Neurodegeneration hinweist. 18F-AV-1451 PET/MR-Fusionsbilder zeigen einen normalen Tau-PET-Scan ohne spezifische kortikale Aufnahme, die auf eine Tauopathie hindeutet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Flasche mit Lösungsmittel | Lösungsmittel |
| Nr.1 | 1,5 mg K2CO3 in 0,5 ml Wasser |
| Nr.2 | 1,5 mg K2.2.2. in 1 ml Acetonitril |
| Nr.3 | 1 mg Vorläufer in 1,2 ml DMSO-Lösungsmittel |
| Nr.5 | 1,5 ml HPLC mobile Phase |
| Nr.6 | 1,5 ml HPLC mobile Phase |
| Kolben mit rundem Boden | 2 ml 84%iges NaHCO3 wässrige Lösung und 30 ml Wasser |
| Nr.7 | 9 ml 0,9% Kochsalzlösung |
| Nr.8 | 1 ml EtOH |
| Nr.9 | 10 ml Wasser |
Tabelle 1: Lösungen, die in verschiedenen Gefäßen des Radiosynthesemoduls vorhanden sind.
Diskussion
In diesem methodischen Manuskript haben wir eine aktualisierte Radiosynthese von 18F-AV-1451 für die Tau-PET-Bildgebung und die Techniken für die 18F-AV-1451 PET/MRT-Bildaufnahme vorgestellt und den potenziellen Nutzen von 18F-AV-1451 PET/MR für die Beurteilung von AD dargelegt. Konventionelle Gehirn-CT oder MRT bietet in der Regel eine makroskopische anatomische Strukturbeurteilung, die die Beurteilung des Krankheitsverlaufs und die Vorhersage der Prognose einschränkt. PET ist ein Neuroimaging-Tool, das es ermöglicht, molekulare Prozesse in vivo zu messen. PET-Radioliganden können an Ziele binden, darunter Rezeptoren, Transporterproteine oder Enzyme26. Die Technologie wurde bei der Diagnose neurologischer Störungen, der Entwicklung von Programmen und der Beurteilung des Krankheitsverlaufs eingesetzt. PET/MRT ist ein neuartiges hybrides funktionelles Bildgebungssystem für das Gehirn, das Positronen-Emissions-Tomographie (PET) und MRT kombiniert. Aufgrund der großen Vielfalt an PET-Tracern kann PET/MR über anatomische MRT-Bilder hinaus zusätzliche physiologische Informationen liefern. Die gleichzeitige Erfassung von PET- und MRT-Daten wird dazu beitragen, die inhärenten Vorteile beider Technologien zu nutzen und die potenzielle Verzögerung von zwei separaten Inspektionen zu vermeiden, während gleichzeitig die Effizienz und der Komfort für den Patienten erhöht werden. PET/MRT entfernt die zusätzliche Strahlung, die für die Dämpfungskorrektur und die anatomische Korrelation im CT-Teil eines PET/CT erforderlich ist, was für spezielle Patienten wie Schwangere, Kleinkinder und Patienten, die mehrere PET-Bildgebungsuntersuchungen benötigen, ein großer Vorteil sein kann.
Das National Institute on Aging and Alzheimer's Association (NIA-AA) schlug 2011 einen diagnostischen Rahmen (A/T/N-Rahmen) vor, der auf biologischen Markern27 basiert, darunter β-Amyloid (Aβ)-Ablagerung (A), pathologisches Tau (T) und Neurodegeneration (N)28,29. Aβ ist die Komponente von senilen Plaques, zu deren Markern Messungen von reduzierten Aβ42-Spiegeln in der Zerebrospinalflüssigkeit (CSF) und Aβ-Ablagerung durch PET gehören. Pathologisches Tau ist die Hauptkomponente der neurofibrillären Fibrose, zu deren Markern ein erhöhtes Gesamt-Tau oder phosphoryliertes Tau (p-Tau) im Liquor gehört 30,31,32,33. Zu den Messungen der Neurodegeneration gehören die Hirnatrophieraten34,35 und die durch MRT nachgewiesene Atrophie des Hippocampusvolumens oder des medialen Temporallappens36,37 sowie der Hypometabolismus oder die Hypoperfusion, die mit PET und Einzelphotonenemissions-Computertomographie (SPECT) ermittelt wurde38,39. Die PET/MRT kann bei der Diagnose der AD Vorteile gegenüber anderen bildgebenden Verfahren bieten, da sie in einem einzigen Scan eine gleichzeitige pathologische Proteinablagerung und -atrophie im Hippocampusbereich ermöglicht.
Vor kurzem wurden neue PET-Tracer für den nicht-invasiven In-vivo-Nachweis von Tau zur Verfügung gestellt, dessen Akkumulation ein definierendes Merkmal der AD-Pathologieist 40. 18F-AV1451 zeigt eine starke Bindung und Selektivität für Tau im Hirngewebe von Alzheimer-Patienten41, mit relativ langsamerer Kinetik. Wir verwendeten 18F-AV1451, um die Verteilung von Tau-Proteinen im Gehirn von Alzheimer-Patienten zu untersuchen. 18F-AV-1451 wurde auf verschiedene Weise synthetisiert. In dieser Studie wurde die Synthese von 18F-AV-1451 auf dem TRACERlab FXFN-Synthesizer unter Verwendung einer Ein-Poti-Methode mit optimierten Bedingungen automatisiert. Die Vorläuferdosis wurde auf 1 mg42 geändert. Gleichzeitig wurden die HPLC-Trennbedingungen auf eine 25%ige wässrige EtOH-Lösung mit einem pH-Wert von 2,0 eingestellt, um die Online-Entschützung von BOC zu ermöglichen. Die Lösungsmittelumwandlung und die Rereinigung wurden auf einer C18-Säule durchgeführt. Die Ausbeute der Synthese konnte durch die Anwendung der verbesserten Synthesemethode von 20,5 % ± 6,1 % auf 25,7 % ±5,8 % gesteigert werden. Das Verfahren verbesserte die Produktausbeute. Verschiedene Qualitätskontrolltests, die nach der Synthese durchgeführt wurden, zeigten, dass das Produkt den Qualitätskontrollstandards entsprach.
Die Ergebnisse zeigten, dass AD-Patienten eine offensichtliche Hirnatrophie mit einer signifikanten Bindung von 18F-AV-1451 aufwiesen. Die Akkumulation von Tau beginnt in der entorhinalen Rinde und im Hippocampus, breitet sich dann auf die temporale und parietale Rinde aus und verbleibt schließlich großflächig in der Großhirnrinde. Tau-PET ist ein vielversprechendes Instrument, und mehrere Studien haben bereits den diagnostischen Wert von Tau-PET bewertet. Die Studien zeigten, dass tau-PET, die Bindungsmuster, gut mit den histopathologischen Beschreibungen von Braak korrespondieren43,44, was ein Staging-Framework ist, das gut mit dem klinischen Status im gesamten AD-Spektrum übereinstimmt45,46. Die Tau-Belastung und die Topographie korrelieren besser mit den klinischen Symptomen als die Amyloid-Belastung47.
Die NIA-AA stufte 2011 eine "A"-Positivität als "Alzheimer-Kontinuum" ein29. Im Jahr 2018 wurde der Rahmen für die Biomarker-basierte Alzheimer-Forschung etabliert und verfeinert, wobei festgestellt wurde, dass Patienten in diesem Stadium die pathologischen Veränderungen vonAD 27 aufweisen. In den überarbeiteten Kriterien für die Inszenierung von AD, die 2024 veröffentlicht wurden, wird darauf hingewiesen, dass A+T- die Anfangsphase48 sind. In einigen Fällen kann es viele Jahre dauern, bis klinische Symptome auftreten. Personen, die positiv auf Biomarker sowohl in der Kategorie "A" als auch in der Kategorie "T" sind, werden als AD eingestuft. Frühere Studien zeigten, dass Tau-negative Personen mit geringerer Wahrscheinlichkeit AD-Merkmale aufwiesen und dass die meisten Patienten während der Nachbeobachtung von mindestens 5 Jahren nicht zu einer Demenz avancierten49. Patienten mit Tau-positiver MCI können sich zu AD entwickeln. Wenn der Patient eine breite Aufnahme von T hat und positiv für N ist, bedeutet dies, dass er sich in einem fortgeschrittenen Stadium der Erkrankung befindet. Daher ist der Nachweis von Tau-Pathologie und Neurodegeneration für ein genaues Patientenmanagement unerlässlich. Frühere Studien haben gezeigt, dass Personen mit Tau-Negativität mit geringerer Wahrscheinlichkeit klinische Merkmale im Zusammenhang mit der Alzheimer-Krankheit aufwiesen, und die meisten entwickelten über einen Nachbeobachtungszeitraum von mindestens fünf Jahren keine Demenz49. Die frühzeitige In-vivo-Diagnose einer leichten kognitiven Beeinträchtigung mit Tau-Positivität, die zur Alzheimer-Krankheit führen kann, ist für ein präzises Patientenmanagement unerlässlich.
Bisher erforderten die mit PET und MRT gewonnenen Informationen eine parallele Analyse der sequentiell erfassten Daten, gefolgt von einer Post-hoc-Fusion, um eine gute räumliche Registrierung zu gewährleisten. Der psychische Zustand und die physiologischen oder kognitiven Bedingungen eines Probanden können sich jedoch zwischen den Untersuchungen ändern. Die Hybrid-PET/MR zeigt unterschiedliche physiologische und metabolische Informationen über den Krankheitsverlauf ab, indem Datensätze zeitlich und räumlich abgeglichen werden.
Offenlegungen
Die Autoren haben keinen Interessenkonflikt zu erklären.
Danksagungen
Diese Arbeit wurde durch Zuschüsse aus dem Key Research and Development Plan der Provinz Liaoning (2019JH/10300010) und dem Applied Basic Research Program der Provinz Liaoning (2022JH2/101500011) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 18O-rich water | Taiyo Nippon Sanso,Japan | 24-0091 | |
| 2020 edition of Pharmacopoeia of the People's Republic of China | NA | https://english.nmpa.gov.cn/2020-07/03/c_538689.htm | |
| Acetonitrile | ABX,Germany | TF-A1-231207002 | |
| air filter membrane (Millex-25) | Merck,Germany | SLFGN25VS | |
| Boc-protected-precursor | Huayi,Jiangsu,China | NPPI-95-0001A | |
| C18 column | Waters,USA | 186004770 | |
| Cyclotron | GE,USA | MINITRACE | |
| Dimethyl sulfoxide (DMSO) | Bailing Wei Technology,Beijing,China | 984549 | |
| EtOH | ABX,Germany | 10009216 | |
| EtOH for isolation | Sinopharm Chemical Reagent,Shanghai,China | 400212682 | |
| Gas chromatography | Tianmei,Shanghai,China | GC-7900 | |
| HPLC | SYKNM,Germany | S-1122 | |
| Hydrochloric acid | Sinopharm Chemical Reagent,Shanghai,China | 10011018 | |
| K2CO3 Solution | ABX,Germany | TF-K1-230724001 | |
| Kryptofix[2.2.2](K222) | ABX,Germany | 800 | |
| liquid filter membrane (Millex-GV) | Merck,Germany | SLGVR33RB | |
| Oasis HLB solid-phase extraction (SPE) column | Waters,USA | 186003908 | |
| PET/MR | GE,USA | Signa | |
| QMA column | Waters,USA | 186002350 | |
| Radionuclide activity | Capintec,USA | CRC-25R |
Referenzen
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Rajan, K. B., et al. Population estimate of people with clinical AD and mild cognitive impairment in the United States (2020-2060). Alzheimers Dement. 17 (12), 1966-1975 (2021).
- U.S. Burden of Disease Collaborators. The state of U.S. health, 1990-2016: Burden of diseases, injuries, and risk factors among U.S. states. JAMA. 319 (14), 1444-1472 (2018).
- Bhatt, J., et al. The World Alzheimer Report 2019: Attitudes to dementia. , (2019).
- Rostagno, A. A. Pathogenesis of Alzheimer's disease. Int J Mol Sci. 24 (1), 107(2022).
- Ossenkoppele, R., van der Kant, R., Hansson, O. Tau biomarkers in Alzheimer's disease: Towards implementation in clinical practice and trials. Lancet Neurol. 21 (8), 726-734 (2022).
- Abbott, A. Conquering Alzheimer's: A look at the therapies of the future. Nature. 616 (7955), 26-28 (2023).
- Politis, M., Piccini, P. Positron emission tomography imaging in neurological disorders. J Neurol. 259 (9), 1769-1780 (2012).
- Okamura, N., et al. Tau PET imaging in Alzheimer's disease. Curr Neurol Neurosci Rep. 14 (11), 500(2014).
- Holland, N., et al. Differential synaptic loss in β-amyloid positive versus β-amyloid negative corticobasal syndrome. Mov Disord. 39 (7), 1166-1178 (2024).
- Nicastro, N., et al. 18F-AV1451 PET imaging and multimodal MRI changes in progressive supranuclear palsy. J Neurol. 267 (2), 341-349 (2020).
- Cousins, O., et al. Microglial activation, tau and amyloid deposition in TREM2 p.R47H carriers and mild cognitive impairment patients: A multi-modal/multi-tracer PET/MRI imaging study with influenza vaccine immune challenge. J Neuroinflammation. 20 (1), 272(2023).
- Chien, D., et al. Early clinical PET imaging results with the novel PHF-tau radioligand [F18]-T808. J Alzheimers Dis. 38 (1), 171-184 (2014).
- Maruyama, M., et al. Imaging of tau pathology in a tauopathy mouse model and in Alzheimer patients compared to normal controls. Neuron. 79 (6), 1094-1108 (2013).
- Li, Y., et al. Cortical laminar binding of PET amyloid and tau tracers in Alzheimer disease. J Nucl Med. 56 (2), 270-273 (2015).
- Fodero-Tavoletti, M. T., et al. 18F-THK523: A novel in vivo tau imaging ligand for Alzheimer's disease. Brain. 134 (4), 1089-1100 (2011).
- Okamura, N., et al. Non-invasive assessment of Alzheimer's disease neurofibrillary pathology using 18F-THK5105 PET. Brain. 137 (Pt 6), 1762-1771 (2014).
- Tago, T., et al. Preclinical evaluation of [(18)F]THK-5105 enantiomers: Effects of chirality on its effectiveness as a tau imaging radiotracer. Mol Imaging Biol. 18 (2), 258-266 (2016).
- Xia, C. F., et al. [18F]T807, a novel tau positron emission tomography imaging agent for Alzheimer's disease. Alzheimers Dement. 9, 666-676 (2013).
- Fleisher, A. S., et al. Positron emission tomography imaging with [18F]flortaucipir and postmortem assessment of Alzheimer disease neuropathologic changes. JAMA Neurol. 77 (7), 829-839 (2020).
- Whitwell, J., et al. [18F]AV-1451 tau positron emission tomography in progressive supranuclear palsy. Mov Disord. 32 (1), 124-133 (2017).
- Kantarci, K., et al. AV-1451 Tau and β-amyloid positron emission tomography imaging in dementia with Lewy bodies. Ann Neurol. 81 (1), 58-67 (2017).
- Mossine, A. V., et al. An updated radiosynthesis of [18F]AV1451 for tau PET imaging. EJNMMI Radiopharm Chem. 2 (1), 7(2017).
- McKhann, G., et al. Clinical diagnosis of Alzheimer's disease: Report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology. 34 (7), 939-944 (1984).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 7 (3), 263-269 (2011).
- Chandra, A., et al. Alzheimer's Disease Neuroimaging Initiative. Applications of amyloid, Tau, and neuroinflammation PET imaging to Alzheimer's disease and mild cognitive impairment. Hum Brain Mapp. 40 (18), 5424-5442 (2019).
- Jack, C. R., et al. NIA-AA research framework: Toward a biological definition of Alzheimer's disease. Alzheimers Dement. 14 (4), 535-562 (2018).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging and the Alzheimer's Association Workgroup. Alzheimers Dement. 7, 263-269 (2011).
- Albert, M. S., et al. The diagnosis of mild cognitive impairment due to Alzheimer's disease: Recommendations from the National Institute on Aging and Alzheimer's Association Workgroup. Alzheimers Dement. 7, 270-279 (2011).
- Simrén, J., Elmgren, A., Blennow, K., Zetterberg, H. Fluid biomarkers in Alzheimer's disease. Adv Clin Chem. 112, 249-281 (2023).
- Molinuevo, J. L., et al. Current state of Alzheimer's fluid biomarkers. Acta Neuropathol. 136, 821-853 (2018).
- Alcolea, D., et al. Amyloid precursor protein metabolism and inflammation markers in preclinical Alzheimer disease. Neurology. 85, 626-633 (2015).
- Ia, J., et al. Biomarker changes during 20 years preceding Alzheimer's disease. N Engl J Med. 390 (8), 712-722 (2024).
- Leung, K. K., et al. Cerebral atrophy in mild cognitive impairment and Alzheimer disease: Rates and acceleration. Neurology. 80 (7), 648-654 (2013).
- Contador, J., et al. Longitudinal brain atrophy and CSF biomarkers in early-onset Alzheimer's disease. Neuroimage Clin. 32, 102804(2021).
- Menéndez-González, M., de Celis Alonso, B., Salas-Pacheco, J., Arias-Carrión, O. Structural neuroimaging of the medial temporal lobe in Alzheimer's disease clinical trials. J Alzheimers Dis. 48 (3), 581-589 (2015).
- van Oostveen, W. M., de Lange, E. C. M. Imaging techniques in Alzheimer's disease: A review of applications in early diagnosis and longitudinal monitoring. Int J Mol Sci. 22 (4), 2110(2021).
- Reiman, E. M., Jagust, W. J. Brain imaging in the study of Alzheimer's disease. Neuroimage. 61 (2), 505-516 (2012).
- Herholz, K. Perfusion SPECT and FDG-PET. Int Psychogeriatr. 23 (Suppl 2), S25-S31 (2011).
- Lamontagne-Kam, D., et al. Implication of tau propagation on neurodegeneration in Alzheimer's disease. Front Neurosci. 17, 1219299(2023).
- Gomar, J. J., et al. Increased retention of tau PET ligand [18F]-AV1451 in Alzheimer's disease psychosis. Transl Psychiatry. 12 (1), 82(2022).
- Shoup, T. M., et al. A concise radiosynthesis of the tau radiopharmaceutical [(18)F]T807. J Labelled Compd Radiopharm. 56 (14), 736-740 (2013).
- Schwarz, A. J., et al. Regional profiles of the candidate tau PET ligand 18F-AV-1451 recapitulate key features of Braak histopathological stages. Brain. 139, 1539-1550 (2016).
- Pascoal, T. A., et al. Longitudinal 18F-MK-6240 tau tangles accumulation follows Braak stages. Brain. 144, 3517-3528 (2021).
- Braak, H., Braak, E. Neuropathological staging of Alzheimer-related changes. Acta Neuropathol. 82, 239-259 (1991).
- Braak, H., et al. Staging of Alzheimer disease-associated neurofibrillary pathology using paraffin sections and immunocytochemistry. Acta Neuropathol. 112, 389-404 (2006).
- Ossenkoppele, R., et al. Associations between Tau, Aβ, and cortical thickness with cognition in Alzheimer disease. Neurology. 92, e601-e612 (2019).
- Jack, C. R., et al. Revised criteria for diagnosis and staging of Alzheimer's disease: Alzheimer's Association Workgroup. Alzheimers Dement. 20 (8), 5143-5169 (2024).
- Josephs, K. A., Weigand, S. D., Whitwell, J. L. Characterizing amyloid-positive individuals with normal tau PET levels after 5 years. Neurology. 98, e2282-e2292 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten