Method Article
18F-AV-1451に基づくアルツハイマー病のハイブリッドPET/MRIイメージング
要約
このプロトコルでは、 18F-AV-1451 PET/MRI を使用してタウの病理と神経変性を明らかにし、神経科医がアルツハイマー病を診断し、その重症度を評価し、その進行と根本的な病理学的メカニズムについての洞察を得るのを支援します。
要約
アルツハイマー病(AD)は、認知機能障害、日常生活能力の低下、行動変容を特徴とする進行性かつ不可逆的な神経変性疾患であり、世界的に大きな経済的・社会的負担を強いています。ADの主な病理学的特徴の1つは、過剰リン酸化タウタンパク質によって形成される神経原線維変化の蓄積です。陽電子放出断層撮影法/磁気共鳴画像法(PET/MRI)は、特定のタンパク質分布とともに詳細な構造および機能情報を提供するため、ADの診断と研究のためのますます価値のあるツールとなっています。 18名F-AV-1451は、脳組織のPETイメージングにおけるタウタンパク質検出用に特別に設計された放射性トレーサーです。この研究では、 18個の F-AV-1451 の放射性合成、患者の準備、PET/MRI 画像取得技術、および AD 評価におけるその潜在的なアプリケーションに関する詳細なプロトコルを示します。 18名F-AV-1451 PET/MRIは、神経科医がADを診断し、疾患の重症度を評価し、その病理学的メカニズムに関する洞察を得るのに役立つ可能性があります。結論として、このプロトコルは、ADの評価に高感度、包括的、非侵襲的なアプローチを提供し、疾患の進行と病理に関する貴重な洞察を提供します。
概要
アルツハイマー病(AD)は、進行性で不可逆的な神経変性疾患です。患者さんは一般的に、認知機能障害、日常生活能力の低下、行動の変化を経験します。世界的な高齢化が加速する中、アルツハイマー病は公衆衛生上の大きな懸念事項となっています。現在、世界中で5,000万人以上がADとともに生活しています。2050年までに、認知症の有病率は世界で3倍になると予想されています1。65歳以上の人の約10.8%がアルツハイマー型認知症を患っています。アルツハイマー病の有病率は65歳から74歳で約5%、85歳以上では33.3%に増加し、高齢者の死因の1つとなっています2。患者がADを発症すると、家族に大きな負担がかかります3。その潜行性の発症により、患者は診断後の治療に最適なウィンドウを見逃すことがよくあります。その早期発見は、正確な病因がまだ完全には理解されていないため、世界的な課題4のままです5,6。ADに影響を与える複雑な病因と経路を考えると、より正確で早期の診断戦略が急務です。
コンピュータ断層撮影法(CT)や磁気共鳴画像法(MRI)などの従来の画像法は、認知障害の一因となる可能性のある脳の萎縮やその他の構造変化を観察するために使用されます。特にMRIは、CTよりも軟部組織のコントラストが優れており、患者を電離放射線にさらすことなく腫瘍の生物学的情報を提供するため、ほとんどの神経疾患6に推奨される画像診断法となっています。MRIは、詳細な肉眼的な解剖学的情報を提供するだけでなく、機能的な脳活動を観察するために使用できる血中酸素レベル依存機能的磁気共鳴画像法(BOLD fMRI)など、さまざまな機能的イメージング法を含む強力なイメージング技術です6。陽電子放出断層撮影法(PET)は、ヒトの脳内の生物学的プロセスの広範な半定量的分析を可能にする非侵襲的な分子イメージング法です。ハイブリッドPET/MRIは、AD診断のための他の画像技術よりも利点を提供する可能性がある7、なぜなら、多種多様なPETトレーサーの使用は、解剖学的MRI画像8,9を補完するための追加の生理学的情報を提供できるからである。
タウタンパク質の過剰リン酸化によって形成される神経原線維変化は、ADの病理学的特徴の1つであり、神経変性の発症および空間的および時間的臨床症状の発現と密接に関連しています6。タウタンパク質は、in vivoで最も存在量の多い微小管関連タンパク質であり、末梢神経系と中枢神経系の両方に多く存在しています。タウの病理学的進行は認知障害の程度と強く相関しており、AD患者の治療標的として機能する可能性があります7。特定の脳領域におけるタウタンパク質沈着の非侵襲的検出は、疾患の早期予測と診断に有用です。タウ放射性トレーサーの使用により、脳内のタウタンパク質沈着物の可視化と局在化が可能になり、タイムリーで正確な鑑別診断が得られるだけでなく、疾患の進行を追跡し、実験的臨床治療を評価するための貴重なサポートが得られます8,9。
いくつかの研究は、特定のタンパク質の変化と機能的または形態学的MRI所見との間に関係があることを実証しています10,11。しかし、アミロイド/タウイメージングと機能的MRIを用いた複合解析に関する報告は限られています12。新規分子診断薬18F-AV-1451(7-(6-[18F]フルオロピリジン-3yl)-5H-ピリド[4,3-b]インドール)は、PET画像脳組織におけるタウタンパク質検出のための放射線診断薬として使用されています。タウPETイメージングの研究はまだ発展段階にあり、現在評価されているトレーサーは、18F-T807(18F-AV-1451)、18F-T808(18F-AV-680)13、11C-PBB314、18F-THK-511715、18F-THK-52316、18F-THK-510517,18。18名F-AV-1451は商業的に開発され19、AD患者20、進行性核上性麻痺患者21、およびレビー小体型認知症22の患者での使用が報告されています。18F−AV-1451の放射合成プロセスでは、最終製品が臨床画像研究23の投与量要件を満たすことを確実にするために、複雑な精製ステップが必要である。PETイメージング技術における18F標識放射性トレーサーの応用が進むにつれ、新しい18F標識放射性トレーサーの合成と開発に対する需要が高まっています。この研究は、アルツハイマー病患者の診断のためのより詳細な情報を提供することを目的としたタウPET / MRIイメージング法を示しています。
プロトコル
この研究は地元の医療倫理委員会によって承認され、すべての被験者は参加前に書面によるインフォームドコンセントを提供しました。すべての研究は、ヘルシンキ宣言の信条に従って実施されました。すべての被験者は、イメージングの前後3か月以内に医療専門家による神経学的および神経心理学的評価を受けました。患者は、National Institute on Aging-Alzheimer's Disease Association(NINCDS-ADRDA)の基準24 およびNational Institute on Aging-Alzheimer's Association(NAA)の基準25に基づいて組み入れられました。使用した試薬や機器の詳細は 、資料表に記載されています。
1 . 18F-AV-1451合成
注:手術中は、生物学的および放射線学的職業保護の原則、および医療廃棄物および放射性廃棄物処理の原則に従ってください。
- 合成の詳細
- 18O(p, n)18F核反応を用いて2.5 mLの[18F]フッ化物を粒子加速器を用いて合成し、最大45 μAの積分電流の陽子を40分間照射します。トランスファーパイプラインを介して自動合成モジュールに[18F]フッ化物を添加します。これは、ヘリウムガスの過圧によって促進されます。合成モジュールは、図1に示す順序で操作します。
- イオン交換カラムにフッ化物[18F]をトラップします(1 mLのエタノールと2 mLの水で事前に活性化します)一方で、 18Oの水を回収容器に保持します。
- No.1容器(図1)の炭酸カリウム溶液を所定のバルブとイオン交換カラムに流し、[18F]フッ化物と交換した後、反応容器に溶出させます。さまざまな容器の溶液については、表1を参照してください。
- [18F]フッ化物と、反応容器のNo.2容器に予めロードしたクリプタンドベースの相間移動触媒を溶解します。
- 指定のバルブを開きます。反応混合物を85°Cで8分間窒素ブロー下で真空蒸留し、続いて110°Cで4分間窒素ブローして残留水を除去します。
- No.3容器からNo.12容器に前駆体を加え、130°Cで10分間加熱します。 18機のF-AV-1451の放射合成を 図2に示します。
- 反応混合物を50°Cに冷却し、指定されたバルブを開いて大気圧を回復します。
- No.5およびNo.6容器から供給された3 mLのHPLC移動相(25%エタノール水溶液、pHを2.0に調整)の容量を使用して、反応混合物をNo.14容器にフラッシングします。指定されたバルブを開いて、ヘリウム圧力下で混合物をHPLCループに侵入できるようにします。
- 製品をHPLCセミ分取カラムに導入し、移動相とともに5 mL/minの流速で溶出します。UV(λ = 254 nm)および放射能カウンターを使用して溶離液を観察します。
- 指定されたバルブ を介して 製品を丸底フラスコに集めます。
- 製品をC18カラム内に閉じ込めて保持します(5 mLのエタノールと10 mLの水で活性化します)。
- 指定のバルブを開き、9番容器の水でカラムを廃棄物容器に洗浄し、8番容器と7番容器の溶液で製品ボトルにすすいでください。
- 18F-AV-1451を0.22μmの液体フィルターメンブレンに通し、ヘリウム圧力下でディスペンシングホットセルのコレクションボトルに入れます。
- 品質管理
注意: 製品の3つの連続したバッチで品質管理を実行します。製品の品質管理が、2020年版の中華人民共和国薬局方の基準を満たしていることを確認してください( 資料の表を参照)。- 製品を鉛ガラスの後ろに置き、色と透明度を検査することにより、目視検査を実施します。
- 精密pH試験紙を使用して製品のpH値を決定します。
- HPLCを使用して、製品の放射性化学的純度を分析します8,16。
- ガンマ分光計法17を使用して、製品の放射性核純度を分析します。
- 中華人民共和国の薬局方13に従って、製品の半減期を正確に測定します。
- 滅菌フィルターメンブレンに0.34MPaの圧力を印加し(ステップ1.1.12)、そのシーリングと完全性をテストします。
- 細菌培養物およびカブトガニ試薬法23を用いて、無菌試験およびエンドトキシン試験を実施する。
- クリプタンドベースの相間移動触媒残基を、ヨード白金酸カリウム法を用いて試験します。ガスクロマトグラフ8,16を使用して、製品中のアセトン、アセトニトリル、およびDMSOの含有量を分析します。
注:0.511 MeVと1.022 MeV以外のピークが現れないようにしてください。
2. 事前審査ガイドライン
注:参加者は、認知の変化に関して現在の懸念があり、機能的能力の独立性を維持しながら1つ以上の認知領域で障害を示した場合に含まれました25。適格性には、0 から 20 のミニメンタルステート検査 (MMSE) スコアと、異常な脳脊髄液 (CSF) Aβ42 または Aβ42/Aβ40 比、または陽性のアミロイド陽電子放出断層撮影法 (PET) スキャン 6,20 によって確認されたアミロイドタンパク質陽性が必要でした。除外基準には、血管疾患、うつ病、外傷性脳損傷、精神病性障害、または認知機能低下に関連するその他の状態の診断が含まれていました5。ペースメーカー、強磁性体、または移動の危険をもたらす異物に禁忌がある参加者、およびMRI画像検査を受けることができない参加者は除外されました。追加の除外基準には、ガドリニウム造影剤に対する不耐性と重度の腎不全の存在が含まれていました21。
- 研究の 24 時間前に、アルコール、カフェイン、薬物療法、または激しい運動や活動を控えるように被験者に指示します。安定した生理学的状態(バイオリズム、脳機能タスクなど)を維持して、データの正確性を確保します。
- 被験者が検査前に水と食物を摂取することを許可します、これらはタウPET / MRイメージングを妨げません。
- イメージングする前に、神経関連薬を少なくとも12時間中止してください。.
- 試験当日は、金属製の宝飾品や金属製のボタンやジッパー付きの衣服を着用しないように被験者にアドバイスしてください。
注:患者が家族と一緒にいることを確認し、以前の検査記録を持参し、薬の使用について医療スタッフに知らせてください。
3. スキャンの準備
- 申請書を確認して、一般的な情報、試験の目的、およびプログラムを確認してください。必要な準備がすべて完了していることを確認します。詳細を登録して提出します。
- 被験者または家族から PET/MR イメージングのインフォームド コンセントを取得します。目的、手順、リスク、および利点を被験者に伝えます。
- 詳細な病歴レビューを実施し、被験者の身長、体重、血中濃度を記録し、MR検査に禁忌がないことを確認します。
- 末梢表在静脈に静脈ラインを確立するか、ポートカテーテルにアクセスします。
- 18F-AV-1451を投与する前に、エラーを防ぐためにすべての情報を再度確認してください。
- 18F-AV-1451を3.7〜5.5 MBq / kgで静脈内アクセスを通じてゆっくりと注入します。放射性トレーサーの残留物を最小限に抑えるために、適切な量の生理食塩水でチューブを洗い流します。注入部位に圧縮を加えて、液体の漏れを防ぎます。
- 注入時間、部位、および活動を記録します。
- 注射が完了したら、視聴覚閉鎖を開始します。待っているライトを暗くする
部屋に出て、温度を約22°Cに設定します。 被験者に、80分間目を閉じてベッドで休むように指示し、この期間中は話したり、食べたり、噛んだりしないようにします。
4. PET/MRIスキャン
- 被験者と同伴者に、検査前に携帯電話、ヘッドギア、入れ歯、眼鏡、時計、財布、硬貨を含むすべての金属物体を取り除くように指示します。車椅子、ストレッチャー、診察ベッド、酸素ボンベ、モニタリング機器を診察室に持ち込まないでください。
- 被験者に耳栓を提供し、頸部を囲む頭/首のコイルを使用して、PET / MRIテーブルの上に仰向けに配置します。専用のヘッドレストまたはスポンジパッドを使用して頭を安定させ、動きを最小限に抑え、快適さを確保します。
注:神経学的評価に基づいて、必要に応じて適切な用量の鎮静薬を投与します。. - 被験者を腕を下にして配置し、不快感がある場合は警報装置を使用するように指示します。
- 画像を確認して、ヘッドがスキャナーの中央にあり、コイルの中心に揃い、首に対して一貫して配置されていることを確認します。
- イメージングには8チャンネルのヘッドアンドネックユニオンコイルを使用します。
- スポイルドグラディエントリコールシーケンスを使用して、高分解能および高信号対雑音比(SNR)で3D脳ボリュームT1強調シーケンスを取得します。次のパラメータを設定します。
- 繰り返し時間(TR)= 8.5ミリ秒。エコー時間 (TE) = 3.2 ms;反転時間 (TI) = 450 ms。フリップ角度= 12°;ボクセルサイズ= 1 × 1 × 1mm³;視野(FOV)= 256 mm;行列サイズ = 256 × 256;スライスの厚さ = 1 mm。
- 次のパラメータで軸方向PROPELLER T2強調シーケンスを取得します:TR = 6837 ms;TE = 132 ミリ秒;フリップ角度 = 142°;視野角 = 240 mm;行列サイズ = 416 × 416;スライスの厚さ = 5 mm。
注:PETスキャンは、大孔から頭蓋骨の上部までの脳全体を覆うシングルベッドの位置を使用します。
- 20分間のPET画像を同時に取得します。
- 3D取得モードでPETスキャンを実行します。
- PETイメージングにはボリュームスキャンを使用します。
- ゼロエコータイム(ZTE)パルスシーケンスを使用してMRイメージング減衰補正を行い、骨、空気、軟部組織をセグメント化します。
- 画像再構成のためのTime-of-Flight Ordered Subset Expectation Maximization(OSEM)を使用してPETデータを取得する20,23。次のパラメータを使用します。
- 行列サイズ = 192 × 192;28 のサブセットと 6 回の反復。FOV = 350 × 350 mm;半値全幅(FWHM)=3.0mm。
- 標準化された摂取量(SUV)を式20,23を使用して計算します。
SUV = (球活動 (Bq/ml) × 体重 (kg)) / 注射量。
5. 画像解釈
- 臨床診断を知らされていない少なくとも2人の経験豊富な核医学医師が、すべてのPET/MR画像を独立して視覚的に評価します。
- 異常な構造変化とタンパク質沈着を示す脳葉を特定します。
- 最終的なコンセンサスに達するまで、視覚的な評価を繰り返します。
- 「ポジティブスキャン」とは、皮質領域の一部またはすべてにおける 18のF-AV-1451の取り込みの増加と定義します。「ネガティブスキャン」とは、すべての皮質領域に 18個のF-AV-1451の取り込みがないことと定義します。
- 内側側頭葉、特に海馬の萎縮をMRIで神経変性20,25と定義します。
結果
18名F-AV-1451の合成結果
最適化された反応条件下で 18個のF-AV-1451をワンステップ合成したところ、合成収率は5.8%±25.7%に増加しました。総反応時間は70分でした。典型的なセミ分取HPLCおよびUVスペクトルを 図3に示します(ピーク2は製品のピークを表します)。
品質試験結果
3つの連続したバッチの品質管理結果は次のとおりです:溶液は無色で、視覚的に透明で、明らかな不純物がありませんでした。pHは4.5〜7.5の範囲でした。HPLCおよびTLC分析では、化学純度は>95%、放射性化学純度は>95%であることが示されました。一次光子エネルギーは0.511MeVであった。半減期は、長い半減期同位体(t1/2 > 5日)を除いて、必要な仕様を満たしていました。滅菌フィルター膜は、空気漏れなく0.34MPaに加圧されました。エンドトキシンレベルは、製品1mLあたり<15 EUでした。細菌培養により無菌性が確認されました。K2.2.2 濃度は≤50μg/mLでした。さらに、アセトン、アセトニトリル、DMSOなどの残留溶媒は、中華人民共和国薬局方の基準を満たしていました( 材料表を参照)。
18名F-AV-1451 PET/MRの結果
図4は、タウ沈着が陽性の認知機能低下が持続する69歳男性(MMSEスコア:19/30)のPET/MRイメージングの例を示しています。画像は、主に灰白質回の拡大と深化、および脳室の拡大を特徴とする重大な脳萎縮を示しています。ADサブグループは、さまざまな地域分布で有意な 18のF-AV-1451結合を示しました。タウの蓄積は嗅内皮質と海馬で始まり、その後側頭皮質と頭頂葉に広がり、最終的には大脳皮質全体に広がった。
図5は、タウ沈着が陰性の認知機能低下(MMSEスコア:24/30)の68歳男性におけるPET/MRイメージングの例を示しています。画像は、正常な脳実質の形態を両側から示しており、 18F-AV-1451放射能の取り込みは均一で対称的です。同じ画像セッションからのMRIは、正常な心室のサイズと形態を示し、正中線の変位はなく、脳実質で異常な信号は検出されませんでした。大脳基底核と脳幹に非特異的な取り込みが認められた。
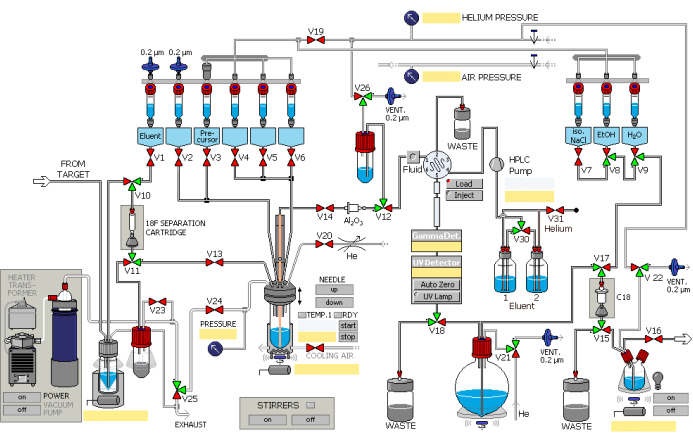
図1:放射性合成モジュールの概略図。 合成モジュールは、指定されたステップに従って順次動作します。 この図の拡大版を表示するには、ここをクリックしてください。
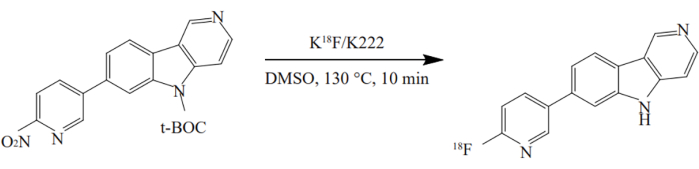
図2: 18機のF-AV-1451の放射性合成。 この化合物は、最適化された条件下でワンポット法を使用して合成されました。ニトロ前駆体をDMSO中のK[18F]/K2.2.2 と130°Cで10分間反応させた。 この図の拡大版を見るには、ここをクリックしてください。
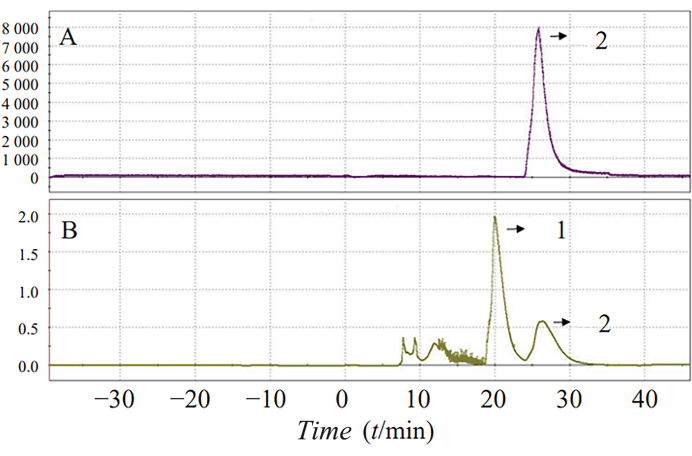
図3:18F-AV-1451放射能のHPLC(A)およびUV(B)分離。 セミ分取HPLCおよびUVスペクトルが示されています。ピーク 2 は、製品のピークを表します。 この図の拡大版を表示するには、ここをクリックしてください。

図4:タウ沈着が陽性の患者の代表的な画像データ。 (A) 18枚のF-AV-1451PET画像。(B)軸方向T1ウェイト画像(T1WI)。(C)軸方向T2ウェイト画像(T2WI)。(D)Axial 18F-AV-1451 PET/MR融合画像。T1WIおよびT2WI画像は、両側の海馬の体積減少、心室拡張、溝裂孔の拡大と深化を示しており、正中線構造の変位はありません。 18名F-AV-1451 PET/MR 融合画像は、内側前頭回、前楔、下側頭回、および外側後頭皮質に取り込みを伴う陽性のタウ PET スキャンを示しています。 この図の拡大版を表示するには、ここをクリックしてください。
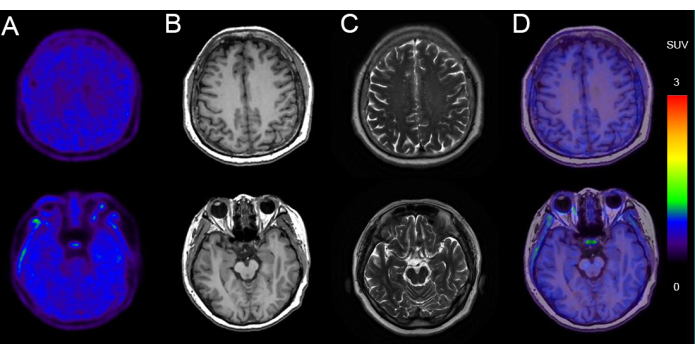
図5:タウ沈着が陰性の患者の代表的な画像データ(A)18枚のF-AV-1451 PET画像。(B)軸方向T1ウェイト画像(T1WI)。(C)軸方向T2ウェイト画像(T2WI)。(D)Axial 18F-AV-1451 PET/MR融合画像。T1WIおよびT2WI画像は正常な脳MRIを示しており、神経変性を示す重大な側頭葉萎縮はありません。18名F-AV-1451 PET/MR 融合画像は、正常なタウ PET スキャンを示しており、タウオパチーを示唆する特定の皮質取り込みはありません。この図の拡大版を表示するには、ここをクリックしてください。
| 溶剤ボトル | 溶媒 |
| No.1 | 1.5 mg K2CO3 0.5 mL 水溶液中 |
| No.2 | 1.5 mg K2.2.2. アセトニトリル1 mL中 |
| No.3 | 1 mg 前駆体 1.2 ml DMSO 溶媒 |
| No.5 | 1.5 ml HPLC 移動相 |
| No.6 | 1.5 ml HPLC 移動相 |
| 丸底フラスコ | 2 ml 84% NaHCO3 水溶液と30 mlの水 |
| No.7 | 9 ml 0.9%生理食塩水 |
| No.8 | 1 mL EtOH |
| No.9 | 水10ml |
表1:放射性合成モジュールのさまざまな容器に存在する溶液。
ディスカッション
この方法論の原稿では、タウPETイメージングのための 18F-AV-1451の更新された放射合成と 18F-AV-1451 PET/MRI画像取得の技術を紹介し、ADを評価するための 18F-AV-1451 PET/MRの潜在的な有用性を提供しました。 従来の脳CTまたはMRIは通常、肉眼的な解剖学的構造評価を提供し、疾患の進行の評価と予後の予測を制限します。PETは、 生体内の 分子プロセスを測定できるニューロイメージングツールです。PET放射性リガンドは、受容体、トランスポータータンパク質、または酵素26などの標的に結合することができる。この技術は、神経疾患の診断、プログラムの開発、疾患の進行の評価に使用されています。PET/MRIは、陽電子放出断層撮影法(PET)とMRIを組み合わせた新しいハイブリッド機能脳イメージングシステムです。PETトレーサーは種類が豊富なため、PET/MRは解剖学的MRI画像を超えた追加の生理学的情報を提供することができます。PETとMRIのデータを同時に取得することで、両技術の固有の利点を活用し、2つの別々の検査による遅延の可能性を排除すると同時に、患者の効率と利便性を向上させることができます。PET/MRIは、PET/CTのCT部分における減衰補正や解剖学的相関に必要な追加の放射線を除去するため、妊婦や幼児、複数のPET画像検査が必要な患者など、特殊な患者にとって大きなメリットとなります。
National Institute on Aging and Alzheimer's Association(NIA-AA)は、2011年に、β-アミロイド(Aβ)沈着(A)、病理学的タウ(T)、神経変性(N)28,29などの生物学的マーカー27に基づく診断フレームワーク(A/T/Nフレームワーク)を提案しました。Aβは老人性プラークの成分であり、そのマーカーには、脳脊髄液(CSF)中のAβ42の減少レベルの測定、およびPETによって示されるAβ沈着が含まれます。病理学的タウは神経原線維変化線維症の主成分であり、そのマーカーには、CSF 30,31,32,33 の総タウまたはリン酸化タウ (p-タウ) の増加が含まれます。神経変性の尺度には、MRIによって検出された脳萎縮率34,35および海馬容積または内側側頭葉萎縮36,37、およびPETおよび単一光子放出型コンピュータ断層撮影法(SPECT)イメージング38,39で得られる低代謝または低灌流が含まれる.PET / MRIは、ADの診断において、1回のスキャンで海馬領域の病理学的タンパク質沈着と萎縮を同時に提供できるという点で、他のイメージング方法よりも利点を提供する可能性があります。
最近、新しいPETトレーサーがタウの in vivo 非侵襲的検出のために利用可能になりました。タウの蓄積はAD病理学40の決定的な特徴です。 18名F-AV1451は、AD患者の脳組織におけるタウに対して強力な結合および選択性を示す41が、その動態は比較的遅い。 18個のF-AV1451を用いて、AD患者の脳内のタウタンパク質の分布を調べた。 18名F-AV-1451は複数の方法で合成されています。この研究では、最適化された条件のワンポット法を使用して、TRACERlab FXFNシンセサイザー上で 18個のF-AV-1451の合成を自動化しました。前駆体投与量を1 mg42に変更しました。.同時に、HPLCの分離条件を25%EtOH水溶液に調整し、pHを2.0に調整してBOCのオンライン脱保護を行いました。C18 カラム上で溶媒変換と再精製を行いました。改良された合成法を適用することにより、合成収率は20.5%から6.1%±25.7%±5.8%に増加しました。この方法により、製品の歩留まりが向上しました。合成後に実施されたさまざまな品質管理試験では、製品が品質管理基準を満たしていることが示されました。
その結果、AD患者は明らかな脳萎縮を示し、18個のF-AV-1451が有意に結合していることが示されました。タウの蓄積は、嗅内皮質と海馬から始まり、側頭皮質と頭頂葉に広がり、最終的には大脳皮質全体に広範囲に残ります。タウPETは有望なツールであり、すでにいくつかの研究でタウPETの診断的価値が評価されています。研究によると、結合パターンであるtau-PETは、ADスペクトル45,46全体の臨床状態とよく一致する病期分類フレームワークであるBraak組織病理学的記述43,44とよく一致していることが示されました。タウ負荷とトポグラフィーは、アミロイド負荷47よりも臨床症状とよく相関しています。
NIA-AAは、2011年に「A」陽性率を「アルツハイマー病連続体」に分類した29。2018年には、バイオマーカーに基づくAD研究の枠組みが確立され、改良され、この段階の患者にはAD27の病理学的変化が見られることが示されました。2024年に発表されたADの病期分類の改訂基準では、A + T-が初期ステージ48であることが注目されています。場合によっては、臨床症状が現れるまでに何年もかかることがあります。「A」と「T」の両方のカテゴリーでバイオマーカーが陽性の個人は、ADに分類されます。以前の研究では、タウ陰性の個人はADの特徴を呈する可能性が低く、ほとんどの患者は少なくとも5年間の追跡期間中に認知症に進行しないことが示されました49。タウ陽性MCIの患者さんは、ADに進化することがあります。患者がTの取り込みが広く、Nが陽性である場合、それは彼らが病気の進行段階にあることを意味します。したがって、タウの病理と神経変性の検出は、正確な患者管理に不可欠です。以前の研究では、タウ陰性を持つ個人はアルツハイマー病に関連する臨床的特徴を示す可能性が低く、ほとんどの人は少なくとも5年間の追跡期間にわたって認知症を発症しなかったことが示されています49。アルツハイマー病に進行する可能性のあるタウ陽性の軽度認知障害の 早期in vivo 診断は、正確な患者管理に不可欠です。
これまで、PETとMRIで得られた情報では、逐次取得したデータを並行して解析し、その後にポストホック融合を行うことで、良好な空間レジストレーションを実現する必要がありました。ただし、被験者の精神状態や生理学的または認知的状態は、検査間で異なる場合があります。ハイブリッドPET/MRは、データセットを時間的および空間的に一致させることにより、疾患プロセスに関するさまざまな生理学的および代謝的情報を表示します。
開示事項
著者は、宣言すべき利益相反を持っていません。
謝辞
この研究は、遼寧省の主要研究開発計画(2019JH/10300010)および遼寧省応用基礎研究プログラム(2022JH2/101500011)からの助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 18O-rich water | Taiyo Nippon Sanso,Japan | 24-0091 | |
| 2020 edition of Pharmacopoeia of the People's Republic of China | NA | https://english.nmpa.gov.cn/2020-07/03/c_538689.htm | |
| Acetonitrile | ABX,Germany | TF-A1-231207002 | |
| air filter membrane (Millex-25) | Merck,Germany | SLFGN25VS | |
| Boc-protected-precursor | Huayi,Jiangsu,China | NPPI-95-0001A | |
| C18 column | Waters,USA | 186004770 | |
| Cyclotron | GE,USA | MINITRACE | |
| Dimethyl sulfoxide (DMSO) | Bailing Wei Technology,Beijing,China | 984549 | |
| EtOH | ABX,Germany | 10009216 | |
| EtOH for isolation | Sinopharm Chemical Reagent,Shanghai,China | 400212682 | |
| Gas chromatography | Tianmei,Shanghai,China | GC-7900 | |
| HPLC | SYKNM,Germany | S-1122 | |
| Hydrochloric acid | Sinopharm Chemical Reagent,Shanghai,China | 10011018 | |
| K2CO3 Solution | ABX,Germany | TF-K1-230724001 | |
| Kryptofix[2.2.2](K222) | ABX,Germany | 800 | |
| liquid filter membrane (Millex-GV) | Merck,Germany | SLGVR33RB | |
| Oasis HLB solid-phase extraction (SPE) column | Waters,USA | 186003908 | |
| PET/MR | GE,USA | Signa | |
| QMA column | Waters,USA | 186002350 | |
| Radionuclide activity | Capintec,USA | CRC-25R |
参考文献
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Rajan, K. B., et al. Population estimate of people with clinical AD and mild cognitive impairment in the United States (2020-2060). Alzheimers Dement. 17 (12), 1966-1975 (2021).
- U.S. Burden of Disease Collaborators. The state of U.S. health, 1990-2016: Burden of diseases, injuries, and risk factors among U.S. states. JAMA. 319 (14), 1444-1472 (2018).
- Bhatt, J., et al. The World Alzheimer Report 2019: Attitudes to dementia. , (2019).
- Rostagno, A. A. Pathogenesis of Alzheimer's disease. Int J Mol Sci. 24 (1), 107(2022).
- Ossenkoppele, R., van der Kant, R., Hansson, O. Tau biomarkers in Alzheimer's disease: Towards implementation in clinical practice and trials. Lancet Neurol. 21 (8), 726-734 (2022).
- Abbott, A. Conquering Alzheimer's: A look at the therapies of the future. Nature. 616 (7955), 26-28 (2023).
- Politis, M., Piccini, P. Positron emission tomography imaging in neurological disorders. J Neurol. 259 (9), 1769-1780 (2012).
- Okamura, N., et al. Tau PET imaging in Alzheimer's disease. Curr Neurol Neurosci Rep. 14 (11), 500(2014).
- Holland, N., et al. Differential synaptic loss in β-amyloid positive versus β-amyloid negative corticobasal syndrome. Mov Disord. 39 (7), 1166-1178 (2024).
- Nicastro, N., et al. 18F-AV1451 PET imaging and multimodal MRI changes in progressive supranuclear palsy. J Neurol. 267 (2), 341-349 (2020).
- Cousins, O., et al. Microglial activation, tau and amyloid deposition in TREM2 p.R47H carriers and mild cognitive impairment patients: A multi-modal/multi-tracer PET/MRI imaging study with influenza vaccine immune challenge. J Neuroinflammation. 20 (1), 272(2023).
- Chien, D., et al. Early clinical PET imaging results with the novel PHF-tau radioligand [F18]-T808. J Alzheimers Dis. 38 (1), 171-184 (2014).
- Maruyama, M., et al. Imaging of tau pathology in a tauopathy mouse model and in Alzheimer patients compared to normal controls. Neuron. 79 (6), 1094-1108 (2013).
- Li, Y., et al. Cortical laminar binding of PET amyloid and tau tracers in Alzheimer disease. J Nucl Med. 56 (2), 270-273 (2015).
- Fodero-Tavoletti, M. T., et al. 18F-THK523: A novel in vivo tau imaging ligand for Alzheimer's disease. Brain. 134 (4), 1089-1100 (2011).
- Okamura, N., et al. Non-invasive assessment of Alzheimer's disease neurofibrillary pathology using 18F-THK5105 PET. Brain. 137 (Pt 6), 1762-1771 (2014).
- Tago, T., et al. Preclinical evaluation of [(18)F]THK-5105 enantiomers: Effects of chirality on its effectiveness as a tau imaging radiotracer. Mol Imaging Biol. 18 (2), 258-266 (2016).
- Xia, C. F., et al. [18F]T807, a novel tau positron emission tomography imaging agent for Alzheimer's disease. Alzheimers Dement. 9, 666-676 (2013).
- Fleisher, A. S., et al. Positron emission tomography imaging with [18F]flortaucipir and postmortem assessment of Alzheimer disease neuropathologic changes. JAMA Neurol. 77 (7), 829-839 (2020).
- Whitwell, J., et al. [18F]AV-1451 tau positron emission tomography in progressive supranuclear palsy. Mov Disord. 32 (1), 124-133 (2017).
- Kantarci, K., et al. AV-1451 Tau and β-amyloid positron emission tomography imaging in dementia with Lewy bodies. Ann Neurol. 81 (1), 58-67 (2017).
- Mossine, A. V., et al. An updated radiosynthesis of [18F]AV1451 for tau PET imaging. EJNMMI Radiopharm Chem. 2 (1), 7(2017).
- McKhann, G., et al. Clinical diagnosis of Alzheimer's disease: Report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology. 34 (7), 939-944 (1984).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 7 (3), 263-269 (2011).
- Chandra, A., et al. Alzheimer's Disease Neuroimaging Initiative. Applications of amyloid, Tau, and neuroinflammation PET imaging to Alzheimer's disease and mild cognitive impairment. Hum Brain Mapp. 40 (18), 5424-5442 (2019).
- Jack, C. R., et al. NIA-AA research framework: Toward a biological definition of Alzheimer's disease. Alzheimers Dement. 14 (4), 535-562 (2018).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging and the Alzheimer's Association Workgroup. Alzheimers Dement. 7, 263-269 (2011).
- Albert, M. S., et al. The diagnosis of mild cognitive impairment due to Alzheimer's disease: Recommendations from the National Institute on Aging and Alzheimer's Association Workgroup. Alzheimers Dement. 7, 270-279 (2011).
- Simrén, J., Elmgren, A., Blennow, K., Zetterberg, H. Fluid biomarkers in Alzheimer's disease. Adv Clin Chem. 112, 249-281 (2023).
- Molinuevo, J. L., et al. Current state of Alzheimer's fluid biomarkers. Acta Neuropathol. 136, 821-853 (2018).
- Alcolea, D., et al. Amyloid precursor protein metabolism and inflammation markers in preclinical Alzheimer disease. Neurology. 85, 626-633 (2015).
- Ia, J., et al. Biomarker changes during 20 years preceding Alzheimer's disease. N Engl J Med. 390 (8), 712-722 (2024).
- Leung, K. K., et al. Cerebral atrophy in mild cognitive impairment and Alzheimer disease: Rates and acceleration. Neurology. 80 (7), 648-654 (2013).
- Contador, J., et al. Longitudinal brain atrophy and CSF biomarkers in early-onset Alzheimer's disease. Neuroimage Clin. 32, 102804(2021).
- Menéndez-González, M., de Celis Alonso, B., Salas-Pacheco, J., Arias-Carrión, O. Structural neuroimaging of the medial temporal lobe in Alzheimer's disease clinical trials. J Alzheimers Dis. 48 (3), 581-589 (2015).
- van Oostveen, W. M., de Lange, E. C. M. Imaging techniques in Alzheimer's disease: A review of applications in early diagnosis and longitudinal monitoring. Int J Mol Sci. 22 (4), 2110(2021).
- Reiman, E. M., Jagust, W. J. Brain imaging in the study of Alzheimer's disease. Neuroimage. 61 (2), 505-516 (2012).
- Herholz, K. Perfusion SPECT and FDG-PET. Int Psychogeriatr. 23 (Suppl 2), S25-S31 (2011).
- Lamontagne-Kam, D., et al. Implication of tau propagation on neurodegeneration in Alzheimer's disease. Front Neurosci. 17, 1219299(2023).
- Gomar, J. J., et al. Increased retention of tau PET ligand [18F]-AV1451 in Alzheimer's disease psychosis. Transl Psychiatry. 12 (1), 82(2022).
- Shoup, T. M., et al. A concise radiosynthesis of the tau radiopharmaceutical [(18)F]T807. J Labelled Compd Radiopharm. 56 (14), 736-740 (2013).
- Schwarz, A. J., et al. Regional profiles of the candidate tau PET ligand 18F-AV-1451 recapitulate key features of Braak histopathological stages. Brain. 139, 1539-1550 (2016).
- Pascoal, T. A., et al. Longitudinal 18F-MK-6240 tau tangles accumulation follows Braak stages. Brain. 144, 3517-3528 (2021).
- Braak, H., Braak, E. Neuropathological staging of Alzheimer-related changes. Acta Neuropathol. 82, 239-259 (1991).
- Braak, H., et al. Staging of Alzheimer disease-associated neurofibrillary pathology using paraffin sections and immunocytochemistry. Acta Neuropathol. 112, 389-404 (2006).
- Ossenkoppele, R., et al. Associations between Tau, Aβ, and cortical thickness with cognition in Alzheimer disease. Neurology. 92, e601-e612 (2019).
- Jack, C. R., et al. Revised criteria for diagnosis and staging of Alzheimer's disease: Alzheimer's Association Workgroup. Alzheimers Dement. 20 (8), 5143-5169 (2024).
- Josephs, K. A., Weigand, S. D., Whitwell, J. L. Characterizing amyloid-positive individuals with normal tau PET levels after 5 years. Neurology. 98, e2282-e2292 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved