Method Article
הדמיית PET/MRI היברידית של מחלת אלצהיימר המבוססת על 18F-AV-1451
In This Article
Summary
פרוטוקול זה מתאר את השימוש ב-18F-AV-1451 PET/MRI כדי לחשוף פתולוגיה של טאו וניוון עצבי, לסייע לנוירולוגים באבחון מחלת אלצהיימר, להעריך את חומרתה ולקבל תובנות לגבי התקדמותה והמנגנונים הפתולוגיים הבסיסיים שלה.
Abstract
מחלת אלצהיימר (AD) היא הפרעה ניוונית מתקדמת ובלתי הפיכה המאופיינת בתפקוד קוגניטיבי לקוי, ירידה ביכולות החיים היומיומיות ושינויים התנהגותיים, המטילים נטל כלכלי וחברתי משמעותי ברחבי העולם. אחד מסימני ההיכר הפתולוגיים העיקריים של אלצהיימר הוא הצטברות של סבכים נוירו-פיברילריים הנוצרים על ידי חלבון טאו היפר-זרחני. טומוגרפיה של פליטת פוזיטרונים/הדמיית תהודה מגנטית (PET/MRI) מספקת מידע מבני ותפקודי מפורט יחד עם התפלגויות חלבון ספציפיות, מה שהופך אותה לכלי בעל ערך הולך וגדל לאבחון ומחקר של אלצהיימר. 18F-AV-1451 הוא רדיו-טריסר שתוכנן במיוחד לזיהוי חלבון טאו בהדמיית PET של רקמת המוח. מחקר זה מציג פרוטוקול מפורט לרדיוסינתזה של 18F-AV-1451, הכנת חולים, טכניקות רכישת תמונות PET/MRI ויישומיו הפוטנציאליים בהערכת אלצהיימר. 18F-AV-1451 PET/MRI יכול לסייע לנוירולוגים באבחון אלצהיימר, הערכת חומרת המחלה וקבלת תובנות לגבי המנגנונים הפתולוגיים שלה. לסיכום, פרוטוקול זה מספק גישה רגישה, מקיפה ולא פולשנית להערכת אלצהיימר, ומציע תובנות חשובות לגבי התקדמות המחלה והפתולוגיה.
Introduction
מחלת אלצהיימר (AD) היא הפרעה ניוונית מתקדמת ובלתי הפיכה. חולים חווים בדרך כלל תפקוד קוגניטיבי לקוי, ירידה ביכולות החיים היומיומיות ושינויים התנהגותיים. עם ההזדקנות המואצת של האוכלוסייה העולמית, מחלת האלצהיימר הפכה לדאגה מרכזית לבריאות הציבור. נכון לעכשיו, יותר מ-50 מיליון אנשים ברחבי העולם חיים עם אלצהיימר. עד שנת 2050, שכיחות הדמנציה צפויה לשלש את עצמה בעולם1. כ-10.8% מהאנשים בגילאי 65 ומעלה סובלים מדמנציה של אלצהיימר. השכיחות של אלצהיימר היא כ-5% בקרב אנשים בגילאי 65 עד 74, ועולה ל-33.3% בקרב בני 85 ומעלה, מה שהופך אותה לאחת מסיבות המוות המובילותבקרב קשישים. ברגע שחולה מפתח אלצהיימר, זה מטיל נטל משמעותי על המשפחה3. בשל הופעתו הערמומית, חולים מפספסים לעתים קרובות את החלון האופטימלי לטיפול לאחר האבחון. גילויו המוקדם נותר אתגר עולמי4, מכיוון שהאטיולוגיה המדויקת עדיין לא מובנת לחלוטין 5,6. בהתחשב באטיולוגיה המורכבת והמסלולים המשפיעים על אלצהיימר, יש צורך דחוף באסטרטגיות אבחון מדויקות ומוקדמות יותר.
שיטות הדמיה קונבנציונליות כגון טומוגרפיה ממוחשבת (CT) והדמיית תהודה מגנטית (MRI) משמשות לצפייה בניוון או בשינויים מבניים אחרים במוח, שעלולים לתרום לפגיעה קוגניטיבית. MRI, בפרט, מספק ניגודיות טובה יותר של רקמות רכות מאשר CT ומציע מידע על ביולוגיה של הגידול מבלי לחשוף את החולים לקרינה מייננת, מה שהופך אותו לשיטת ההדמיה המועדפת עבור רוב ההפרעות הנוירולוגיות6. MRI היא טכניקת הדמיה רבת עוצמה שלא רק מספקת מידע אנטומי מקרוסקופי מפורט אלא כוללת גם שיטות הדמיה תפקודיות שונות, כגון הדמיית תהודה מגנטית תפקודית תלויה ברמת החמצן בדם (BOLD fMRI), שניתן להשתמש בה כדי לצפות בפעילות מוחית תפקודית6. טומוגרפיה של פליטת פוזיטרונים (PET) היא שיטת הדמיה מולקולרית לא פולשנית המאפשרת ניתוח חצי כמותי נרחב של תהליכים ביולוגיים במוח האנושי. PET/MRI היברידי עשוי להציע יתרונות על פני טכניקות הדמיה אחרות לאבחון אלצהיימר7, שכן השימוש במגוון רחב של עוקבי PET יכול לספק מידע פיזיולוגי נוסף להשלמת תמונות MRI אנטומיות 8,9.
סבכים נוירו-פיברילריים הנוצרים על ידי היפר-זרחון של חלבון טאו הם אחד המאפיינים הפתולוגיים של אלצהיימר, הקשורים קשר הדוק להופעת ניוון עצבי ולביטוי של תסמינים קליניים הן מרחבית והן זמנית6. חלבון טאו הוא החלבון הנפוץ ביותר הקשור למיקרו-צינוריות in vivo והוא נפוץ הן במערכת העצבים ההיקפית והן במערכת העצבים המרכזית. ההתקדמות הפתולוגית של טאו קשורה קשר הדוק למידת הליקוי הקוגניטיבי ויש לה פוטנציאל לשמש מטרה טיפולית לחולי אלצהיימר7. זיהוי לא פולשני של שקיעת חלבון טאו באזורים ספציפיים במוח הוא בעל ערך לחיזוי ואבחון מוקדם של המחלה. השימוש ב-tau radiotracers מאפשר הדמיה ולוקליזציה של משקעי חלבון טאו במוח, ומספק אבחנה מבדלת מדויקת ובזמן הנכון, כמו גם תמיכה רבת ערך במעקב אחר התקדמות המחלה והערכת טיפולים קליניים ניסיוניים 8,9.
מספר מחקרים הראו קשר בין שינויים בחלבונים ספציפיים לבין ממצאי MRI תפקודיים או מורפולוגיים10,11. עם זאת, ישנם דיווחים מוגבלים על ניתוחים משולבים באמצעות הדמיית עמילואיד/טאו ו-MRIתפקודי 12. תרופת האבחון המולקולרית החדשה 18F-AV-1451 (7-(6-[18F]fluoropyridin-3yl)-5H-pyrido[4,3-b]indole) שימשה כחומר רדיו-דיאגנוסטי לזיהוי חלבון טאו ברקמת מוח שצולמה על ידי PET. המחקר על הדמיית טאו PET עדיין נמצא בשלב הפיתוח שלו, עם רק עוקבים בודדים שהוערכו כיום, כולל 18F-T807 (18F-AV-1451), 18F-T808 (18F-AV-680)13, 11C-PBB314, 18F-THK-511715, 18F-THK-52316 ו-18F-THK-510517,18. 18F-AV-1451 פותח באופן מסחרי19ודווח לשימוש בחולים עם AD20, שיתוק על-גרעיני מתקדם21 ודמנציה עם גופי לוי22. תהליך הרדיוסינתזה של 18F-AV-1451 דורש שלב טיהור מורכב כדי להבטיח שהמוצר הסופי עומד בדרישות המינון למחקרי הדמיה קליניים23. עם היישום ההולך וגובר של 18רדיו-עוקבים עם תווית F בטכנולוגיית הדמיית PET, יש ביקוש הולך וגובר לסינתזה ופיתוח של 18רדיו-טריסרים חדשים עם תווית F. מחקר זה מציג שיטת הדמיה TAU PET/MRI שמטרתה לספק מידע מפורט יותר לאבחון חולי אלצהיימר.
Protocol
המחקר אושר על ידי ועדת האתיקה הרפואית המקומית, וכל הנבדקים סיפקו הסכמה מדעת בכתב לפני ההשתתפות. כל המחקרים נערכו בהתאם לעקרונות הצהרת הלסינקי. כל הנבדקים עברו הערכות נוירולוגיות ונוירופסיכולוגיות על ידי איש מקצוע בתחום הבריאות תוך שלושה חודשים לפני ואחרי ההדמיה. החולים נכללו על סמך קריטריונים24 של המכון הלאומי להזדקנות-מחלת אלצהיימר (NINCDS-ADRDA) וקריטריונים25 של המכון הלאומי להזדקנות-אלצהיימר (NAA). פרטי הריאגנטים והציוד המשמשים מפורטים בטבלת החומרים.
1. 18סינתזה של F-AV-1451
הערה: פעל לפי עקרונות ההגנה התעסוקתית הביולוגית והרדיולוגית, כמו גם עקרונות סילוק פסולת רפואית ורדיואקטיבית, במהלך הפעולות.
- פרטים סינתטיים
- לסנתז 2.5 מ"ל של פלואוריד [18F] באמצעות התגובה הגרעינית של 18O(p, n)18F על ידי שימוש במאיץ חלקיקים, עם פרוטונים בזרמים משולבים של עד 45 μA מפציצים למשך 40 דקות. הוסף [18F] פלואוריד למודול הסינתזה האוטומטי דרך צינור ההעברה, בסיוע לחץ יתר של גז הליום. הפעל את מודול הסינתזה בסדר המוצג באיור 1.
- לכוד [18F] פלואוריד על עמוד חילופי יונים (הפעל מראש עם 1 מ"ל אתנול ו-2 מ"ל מים) תוך שמירה על המים של 18O בכלי ההתאוששות.
- אפשר לתמיסת אשלגן פחמתי מכלי מס' 1 (איור 1) לזרום דרך שסתומים ייעודיים ועמוד חילופי יונים כדי להחליף עם פלואוריד [18F], ואז לזרום לתוך כלי התגובה. ראה טבלה 1 לפתרונות בכלים השונים.
- ממיסים [18F] פלואוריד וזרז העברת פאזה מבוסס קריפטנד שנטען מראש לתוך הכלי מס' 2 בכלי התגובה.
- פתח את השסתום המיועד. הכניסו את תערובת התגובה לזיקוק ואקום תחת ניפוח חנקן ב-85 מעלות צלזיוס למשך 8 דקות, ולאחר מכן ניפוח חנקן ב-110 מעלות צלזיוס למשך 4 דקות כדי לחסל שאריות מים.
- מוסיפים את המבשר מהכלי מס' 3 לכלי מס' 12 ומחממים ל-130 מעלות צלזיוס למשך 10 דקות. הרדיוסינתזה של 18F-AV-1451 מוצגת באיור 2.
- מצננים את תערובת התגובה ל-50 מעלות צלזיוס, ואז פותחים את השסתומים המיועדים כדי להחזיר את הלחץ האטמוספרי.
- שטפו את תערובת התגובה לתוך הכלי מס' 14 באמצעות נפח של 3 מ"ל שלב נייד HPLC (תמיסה מימית של 25% אתנול, pH מותאם ל-2.0) שמקורו בכלי מס' 5 ומס' 6. פתח את השסתומים המיועדים כדי לאפשר חדירת התערובת ללולאת HPLC בלחץ הליום.
- הכנס את המוצר לעמודת ההכנה למחצה של HPLC והוציא עם השלב הנייד בקצב זרימה של 5 מ"ל לדקה. התבונן בחומר הניקוי באמצעות UV (λ = 254 ננומטר) ומוני רדיואקטיביות.
- אוספים את המוצר לבקבוק התחתון העגול דרך השסתום המיועד.
- לכוד ושמור את המוצר בתוך עמודת C18 (מופעל על ידי 5 מ"ל אתנול ו-10 מ"ל מים).
- פתח את השסתום המיועד, שטוף את העמוד במים מכלי מס' 9 לתוך מיכל הפסולת, ולאחר מכן שטוף לתוך בקבוק המוצר עם תמיסה מכלי מס' 8 ומס' 7.
- העבירו 18F-AV-1451 דרך קרום מסנן נוזלי של 0.22 מיקרומטר לתוך בקבוק האיסוף בתא החם המחלק בלחץ הליום.
- בקרת איכות
הערה: בצע בקרת איכות בשלוש קבוצות רצופות של המוצר. ודא שבקרת האיכות של המוצר עומדת בקריטריונים של מהדורת 2020 של Pharmacopoeia of the People's Republic of China (ראה טבלת חומרים).- בצע בדיקה ויזואלית על ידי הנחת המוצר מאחורי זכוכית עופרת ובדיקת הצבע והבהירות.
- קבע את ערך ה-pH של המוצר באמצעות נייר בדיקת pH מדויק.
- השתמש ב-HPLC כדי לנתח את הטוהר הרדיוכימי של המוצר 8,16.
- נתח את הטוהר הגרעיני הרדיואקטיבי של המוצר בשיטת ספקטרומטר גמא17.
- מדוד את זמן מחצית החיים של המוצר במדויק על פי הפרמקופיאה של הרפובליקה העממית של סין13.
- הפעל לחץ של 0.34 מגה פיקסל על קרום המסנן הסטרילי (שלב 1.1.12) כדי לבדוק את איטומו ושלמותו.
- בצע בדיקות סטריליות ואנדוטוקסין באמצעות תרבית חיידקים ושיטת ריאגנט סרטן פרסה23.
- בדוק את שאריות זרז העברת הפאזה המבוססות על קריפטנד בשיטת אשלגן יודופלטינאט. נתח את תכולת האצטון, האצטוניטריל וה-DMSO במוצר באמצעות כרומטוגרף גז 8,16.
הערה: ודא שלא מופיעות פסגות אחרות מלבד 0.511 MeV ו-1.022 MeV.
2. הנחיות לבחינה מוקדמת
הערה: המשתתפים נכללו אם היה להם חשש נוכחי לגבי שינוי בקוגניציה והפגינו ליקוי בתחום קוגניטיבי אחד או יותר תוך שמירה על עצמאות ביכולות תפקודיות25. הזכאות דרשה ציון בדיקת מצב נפשי מיני (MMSE) בין 0 ל-20 וחיובי לחלבון עמילואיד, שאושר באמצעות יחס חריג של נוזל מוחי שדרתי (CSF) Aβ42 או Aβ42/Aβ40 או סריקת טומוגרפיה חיובית של פליטת פוזיטרונים עמילואיד (PET) 6,20. קריטריוני ההדרה כללו אבחנה של מחלות כלי דם, דיכאון, פגיעה מוחית טראומטית, הפרעות פסיכוטיות או מצבים אחרים הקשורים לירידה קוגניטיבית5. משתתפים עם התוויות נגד לקוצבי לב, חומרים פרומגנטיים או עצמים זרים המהווים סכנת ניידות, כמו גם כאלה שלא יכלו לעבור הדמיית MRI, לא נכללו. קריטריונים נוספים להחרגה כללו אי סבילות לחומרי ניגוד גדוליניום ונוכחות של אי ספיקת כליות חמורה21.
- הנחו את הנבדקים להימנע מאלכוהול, קפאין, תרופות או כל פעילות גופנית מאומצת במשך 24 שעות לפני המחקר. שמור על מצב פיזיולוגי יציב (למשל, מקצבים ביולוגיים, משימות תפקוד מוח) כדי להבטיח דיוק נתונים.
- אפשר לנבדקים לצרוך מים ומזון לפני הבדיקה, מכיוון שהם אינם מפריעים להדמיית טאו PET/MR.
- יש להפסיק את השימוש בתרופות הקשורות לנוירולוגיקה למשך 12 שעות לפחות לפני ההדמיה.
- ייעץ לנבדקים להימנע מללבוש תכשיטי מתכת או בגדים עם כפתורי מתכת או רוכסנים ביום הבדיקה.
הערה: ודא שהמטופל מלווה בבן משפחה, מביא רישומי בדיקות קודמות ומיידע את הצוות הרפואי על שימוש בתרופות.
3. הכנה לסריקה
- אמת את טופס הבקשה כדי לאשר מידע כללי, מטרת הבחינה והתוכנית. ודא שכל ההכנות הנדרשות הושלמו. הירשמו והגישו את הפרטים.
- קבל הסכמה מדעת להדמיית PET/MR מהנבדק או מבן משפחה. יידע את הנבדק על המטרה, הנוהל, הסיכונים והיתרונות.
- ערכו סקירה מפורטת של ההיסטוריה הרפואית, רשמו את גובהו, משקלו וריכוז הדם של הנבדק, ואשרו היעדר התוויות נגד לבדיקת MR.
- צור קו תוך-ורידי בווריד שטחי היקפי או גש לצנתר פורט.
- לפני מתן 18F-AV-1451, אמת שוב את כל המידע כדי למנוע שגיאות.
- הזרקו 18F-AV-1451 ב-3.7-5.5 מגה-מעוקב/ק"ג באיטיות דרך הגישה התוך-ורידית. שטפו את הצינור בכמות מתאימה של מי מלח כדי למזער שאריות עוקב רדיואקטיביות. החל דחיסה על מקום ההזרקה כדי למנוע דליפת נוזלים.
- רשום את זמן ההזרקה, האתר והפעילות.
- לאחר השלמת ההזרקה, התחל סגירה אורקולית. עמעמו את האורות בהמתנה
חדר והגדר את הטמפרטורה לכ-22 מעלות צלזיוס. הנחו את הנבדק לנוח במיטה בעיניים עצומות למשך 80 דקות, והימנעו מדיבור, אכילה או לעיסה במהלך תקופה זו.
4. סריקת PET/MRI
- הנחו את הנבדק ואת המלווה להסיר את כל החפצים המתכתיים, כולל טלפונים ניידים, כיסויי ראש, שיניים תותבות, משקפיים, שעונים, ארנקים ומטבעות, לפני הבדיקה. אין להכניס לחדר הבדיקה כיסאות גלגלים, אלונקות, מיטות בדיקה, בלוני חמצן או ציוד ניטור.
- ספקו אטמי אוזניים לנבדק והניחו אותו בשכיבה על שולחן ה-PET/MRI עם סליל ראש/צוואר התוחם את אזור צוואר הרחם. השתמש במשענת ראש מיוחדת או כרית ספוג כדי לייצב את הראש, למזער את התנועה ולהבטיח נוחות.
הערה: יש לתת מינון מתאים של תרופות הרגעה, במידת הצורך, על סמך הערכה נוירולוגית. - מקם את הנושא עם ידיים כלפי מטה והורה לו להשתמש במכשיר האזעקה במקרה של אי נוחות.
- סקור את התמונות כדי לוודא שהראש ממורכז בסורק, מיושר עם מרכז הסליל וממוקם באופן עקבי ביחס לצוואר.
- השתמש בסליל איחוד ראש וצוואר בעל 8 ערוצים להדמיה.
- רכוש רצפים משוקללים T1 נפחיים תלת מימדיים במוח עם רזולוציה גבוהה ויחס אות לרעש (SNR) גבוה באמצעות רצף מקולקל שנזכר בשיפוע. הגדר את הפרמטרים הבאים:
- זמן חזרה (TR) = 8.5 אלפיות השנייה; זמן הד (TE) = 3.2 אלפיות השנייה; זמן היפוך (TI) = 450 אלפיות השנייה; זווית היפוך = 12°; גודל ווקסל = 1 × 1 × 1 מ"מ³; שדה ראייה (FOV) = 256 מ"מ; גודל מטריצה = 256 × 256; עובי הפרוסה = 1 מ"מ.
- רכוש רצפים משוקללים PROPELLER T2 ציריים עם הפרמטרים הבאים: TR = 6837 ms; TE = 132 אלפיות השנייה; זווית היפוך = 142°; FOV = 240 מ"מ; גודל מטריצה = 416 × 416; עובי הפרוסה = 5 מ"מ.
הערה: סריקת PET משתמשת בתנוחת מיטה אחת, המכסה את כל המוח מהנקב מגנום ועד לחלק העליון של הגולגולת.
- קבל תמונות PET של 20 דקות בו-זמנית.
- בצע סריקת PET במצב רכישה תלת-ממדית.
- השתמש בסריקה נפחית להדמיית PET.
- בצע תיקון הנחתה של הדמיית MR באמצעות רצף דופק אפס זמן הד (ZTE) כדי לפלח עצם, אוויר ורקמות רכות.
- רכוש נתוני PET באמצעות מקסום תוחלת תת-קבוצה מסודרת של זמן טיסה (OSEM) לשחזור תמונה20,23. השתמש בפרמטרים הבאים:
- גודל מטריצה = 192 × 192; 28 תת-קבוצות עם 6 איטרציות; FOV = 350 × 350 מ"מ; רוחב מלא בחצי מקסימום (FWHM) = 3.0 מ"מ.
- חשב ערך קליטה סטנדרטי (SUV) באמצעות הנוסחה20,23:
SUV = (פעילות כדורית (Bq/ml) × משקל גוף (ק"ג)) / מינון מוזרק.
5. פרשנות תמונה
- להעריך חזותית את כל תמונות ה-PET/MR באופן עצמאי על ידי לפחות שני רופאים מנוסים ברפואה גרעינית עיוורים לאבחנה הקלינית.
- לזהות אונות מוח המציגות שינויים מבניים חריגים ושקיעת חלבונים.
- חזור על ההערכה החזותית עד להגעה להסכמה סופית.
- הגדר "סריקה חיובית" כקליטה מוגברת של 18F-AV-1451 בכל אזור קליפת המוח או בכולם. הגדר "סריקה שלילית" כהיעדר קליטה של 18F-AV-1451 בכל אזורי קליפת המוח.
- הגדר ניוון באונה הרקתית האמצעית, במיוחד בהיפוקמפוס ב-MRI, כניוון עצבי20,25.
תוצאות
18תוצאות סינתזה של F-AV-1451
הסינתזה החד-שלבית של 18F-AV-1451 בתנאי תגובה אופטימליים הגדילה את תפוקת הסינתזה ל-25.7% ±-5.8%. זמן התגובה הכולל היה 70 דקות. ספקטרום HPLC ו-UV טיפוסי למחצה מוצג באיור 3, כאשר שיא 2 מייצג את שיא המוצר.
תוצאות בדיקות איכות
עבור שלוש קבוצות רצופות, תוצאות בקרת האיכות היו כדלקמן: התמיסה הייתה חסרת צבע, שקופה מבחינה ויזואלית וללא זיהומים ברורים. ה-pH נע בין 4.5 ל-7.5. ניתוחי HPLC ו-TLC הראו כי הטוהר הכימי היה >95% והטוהר הרדיוכימי היה >95%. אנרגיית הפוטון העיקרית הייתה 0.511 MeV. זמן מחצית החיים עמד במפרט הנדרש, למעט איזוטופים ארוכים של זמן מחצית חיים (t1/2 > 5 ימים). קרום המסנן הסטרילי נלחץ ל -0.34 מגה פיקסל ללא דליפת אוויר. רמות האנדוטוקסין היו <15 אירו לכל 1 מ"ל של המוצר. תרבית חיידקים אישרה סטריליות. ק2. 2. ריכוז 2 היה ≤50 מיקרוגרם/מ"ל. בנוסף, שאריות ממיסים כגון אצטון, אצטוניטריל ו-DMSO עמדו בסטנדרטים של הפרמקופיאה של הרפובליקה העממית של סין (ראה טבלת חומרים).
18תוצאות F-AV-1451 PET/MR
איור 4 מציג דוגמה להדמיית PET/MR בגבר בן 69 עם ירידה קוגניטיבית מתמשכת (ציון MMSE: 19/30) עם שקיעת טאו חיובית. התמונות מראות ניוון מוחי משמעותי, המאופיין בעיקר בגירי חומר אפור מורחב ומעמיק וחדרים מוגדלים. תת-קבוצות AD הראו קשירה משמעותית של 18F-AV-1451 עם התפוצה האזורית המגוונת. הצטברות טאו החלה בקליפת המוח האנטורינית ובהיפוקמפוס, לאחר מכן התפשטה לקליפת המוח הטמפורלית והקודקודית, ובסופו של דבר התפשטה באופן נרחב בכל קליפת המוח.
איור 5 מציג דוגמה להדמיית PET/MR בגבר בן 68 עם ירידה קוגניטיבית (ציון MMSE: 24/30) עם שקיעת טאו שלילית. התמונות מציגות מורפולוגיה תקינה של פרנכימה במוח באופן דו-צדדי, עם קליטה אחידה וסימטרית של 18F-AV-1451 רדיואקטיביות. MRI מאותו מפגש הדמיה הראה גודל חדר ומורפולוגיה תקינים, ללא תזוזה של קו האמצע ולא זוהו אותות חריגים בפרנכימה של המוח. הייתה קליטה לא ספציפית בגרעיני הבסיס ובגזע המוח.
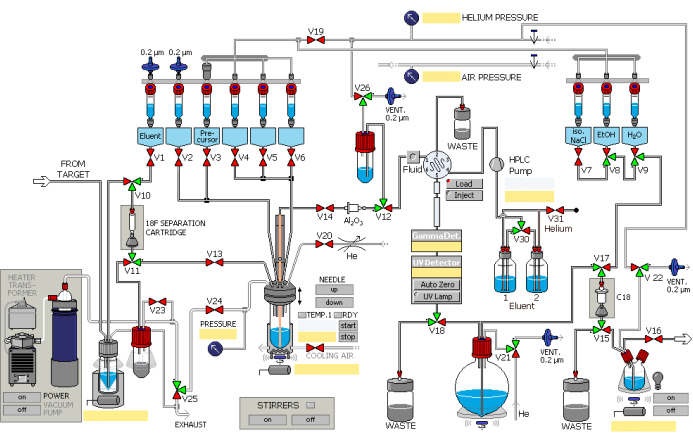
איור 1: תרשים סכמטי של מודול הרדיוסינתזה. מודול הסינתזה פועל ברצף לפי השלבים המיועדים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
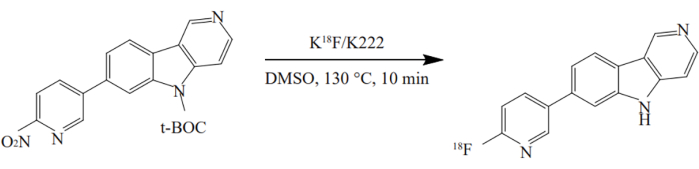
איור 2: רדיוסינתזה של 18F-AV-1451. התרכובת סונתזה בשיטת סיר אחד בתנאים אופטימליים. מבשר הניטרו הגיב עם K[18F]/K2.2.2 ב-DMSO ב-130 מעלות צלזיוס למשך 10 דקות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של נתון זה.
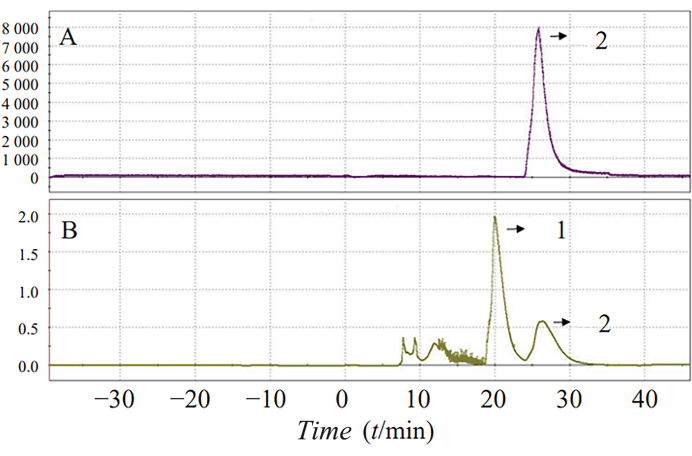
איור 3: הפרדת HPLC (A) ו-UV (B) של 18F-AV-1451 רדיואקטיביות. ה-HPLC וספקטרום ה-UV המוכנים למחצה מוצגים. שיא 2 מייצג את שיא המוצר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: נתוני הדמיה מייצגים של מטופל עם שקיעת טאו חיובית. (A) 18תמונות של F-AV-1451 PET. (B) תמונות משוקללות T1 ציריות (T1WI). (C) תמונות משוקללות T2 ציריות (T2WI). (D) תמונות היתוך ציריות 18F-AV-1451 PET/MR. תמונות T1WI ו-T2WI מראות הפחתת נפח היפוקמפוס דו-צדדית, התרחבות חדרית, הרחבה והעמקה של הסדקים הסולקליים וללא תזוזה של מבנה קו האמצע. 18תמונות היתוך F-AV-1451 PET/MR חושפות סריקת PET חיובית, עם קליטה בפיתול המצחי המדיאלי, הקונאוס הקדמי, הפיתול הטמפורלי התחתון וקליפת המוח העורפית הצדדית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
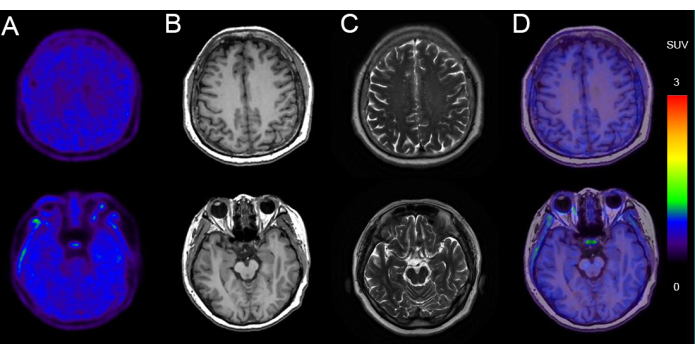
איור 5: נתוני הדמיה מייצגים של מטופל עם שקיעת טאו שלילית. (A) 18תמונות PET F-AV-1451. (B) תמונות משוקללות T1 ציריות (T1WI). (C) תמונות משוקללות T2 ציריות (T2WI). (D) תמונות היתוך ציריות 18F-AV-1451 PET/MR. תמונות T1WI ו-T2WI מראות MRI מוחי תקין, ללא ניוון משמעותי של האונה הטמפורלית המעיד על ניוון עצבי. 18תמונות היתוך F-AV-1451 PET/MR מדגימות סריקת טאו PET רגילה, ללא קליטה ספציפית של קליפת המוח המרמזת על טאאופתיה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| בקבוק ממס | הממס |
| מס' 1 | 1.5 מ"ג K2CO3 ב-0.5 מ"ל מים |
| מס' 2 | 1.5 מ"ג K2.2.2. ב-1 מ"ל אצטוניטריל |
| מס' 3 | 1 מ"ג פרקורסור ב-1.2 מ"ל ממס DMSO |
| מס' 5 | שלב נייד HPLC 1.5 מ"ל |
| מס' 6 | שלב נייד HPLC 1.5 מ"ל |
| בקבוק תחתון עגול | 2 מ"ל 84% NaHCO3 תמיסה מימית ו-30 מ"ל מים |
| מס' 7 | 9 מ"ל 0.9% מי מלח |
| מס' 8 | 1 מ"ל EtOH |
| מס' 9 | 10 מ"ל מים |
טבלה 1: פתרונות הקיימים בכלים שונים של מודול הרדיוסינתזה.
Discussion
בכתב יד מתודולוגי זה, הצגנו רדיוסינתזה מעודכנת של 18F-AV-1451 להדמיית טאו PET ואת הטכניקות לרכישת תמונות 18F-AV-1451 PET/MRI, וסיפקנו את התועלת הפוטנציאלית של 18F-AV-1451 PET/MR להערכת אלצהיימר. CT מוח או MRI קונבנציונלי מספקים בדרך כלל הערכה מבנית אנטומית מקרוסקופית, המגבילה את הערכת התקדמות המחלה וחיזוי הפרוגנוזה. PET הוא כלי הדמיה מוחית המאפשר למדוד תהליכים מולקולריים in vivo . רדיוליגנדים של PET יכולים לקשור מטרות, כולל קולטנים, חלבוני טרנספורטר או אנזימים26. הטכנולוגיה שימשה לאבחון הפרעות נוירולוגיות, פיתוח תוכניות והערכת התקדמות המחלה. PET/MRI היא מערכת הדמיה מוחית תפקודית היברידית חדשה המשלבת טומוגרפיה של פליטת פוזיטרונים (PET) ו-MRI. בגלל המגוון הרחב של עוקבי PET, PET/MR יכול לספק מידע פיזיולוגי נוסף מעבר לתמונות MRI אנטומיות. רכישה בו-זמנית של נתוני PET ו-MRI תעזור לנצל את היתרונות הגלומים בשתי הטכנולוגיות ולבטל את העיכוב הפוטנציאלי של שתי בדיקות נפרדות, תוך הגברת היעילות והנוחות עבור המטופל. PET/MRI מסיר את הקרינה הנוספת הנדרשת לתיקון הנחתה ומתאם אנטומי בחלק ה-CT של PET/CT, מה שיכול להוות יתרון גדול עבור מטופלים מיוחדים כגון נשים בהריון, ילדים צעירים וחולים הזקוקים לבדיקות הדמיה מרובות של PET.
המכון הלאומי להזדקנות ואלצהיימר (NIA-AA) הציע מסגרת אבחנתית (מסגרת A/T/N) בשנת 2011 המבוססת על סמנים ביולוגיים27, כולל שקיעת β-עמילואיד (Aβ) (A), טאו פתולוגי (T) וניוון עצבי (N)28,29. Aβ הוא המרכיב של פלאק סנילי, שהסמנים שלו כוללים מדידות של רמות מופחתות של Aβ42 בנוזל המוח השדרתי (CSF), ותצהיר Aβ שהודגם על ידי PET. טאו פתולוגי הוא המרכיב העיקרי של פיברוזיס סבך נוירו-פיברילרי, שהסמנים שלו כוללים עלייה בטאו הכולל או טאו זרחני (p-tau) ב-CSF 30,31,32,33. מדדים של ניוון עצבי כוללים שיעורי ניוון מוחי34,35 ונפח ההיפוקמפוס או ניוון האונה הטמפורליתהאמצעית 36,37 שזוהה על ידי MRI, והיפומטבוליזם או היפופרפוזיה המתקבלים באמצעות PET והדמיית טומוגרפיה ממוחשבת של פליטת פוטון בודד (SPECT)38,39. PET/MRI עשוי להציע יתרונות על פני שיטות הדמיה אחרות באבחון אלצהיימר במתן שקיעת חלבון פתולוגית בו זמנית וניוון באזור ההיפוקמפוס בסריקה אחת.
לאחרונה, עוקבי PET חדשים הפכו לזמינים לזיהוי לא פולשני in vivo של טאו, שהצטברותו היא מאפיין מגדיר של פתולוגיה של אלצהיימר40. 18F-AV1451 מפגין קשירה וסלקטיביות חזקה לטאו ברקמת המוח של חולי אלצהיימר41, עם קינטיקה איטית יחסית. השתמשנו ב-18F-AV1451 כדי לבחון את התפלגות חלבוני הטאו במוחות של חולי אלצהיימר. 18F-AV-1451 סונתז במספר שיטות. מחקר זה הפך את הסינתזה של 18F-AV-1451 לאוטומטית בסינתיסייזר TRACERlab FXFN בשיטת סיר אחד עם תנאים אופטימליים. מינון הפרקורסור השתנה ל-1 מ"ג42. במקביל, תנאי ההפרדה של HPLC הותאמו לתמיסה מימית של 25% EtOH עם pH מותאם ל-2.0 להגנה מקוונת על BOC. בוצעו המרת ממס וטיהור מחדש על עמוד C18. תפוקת הסינתזה הוגדלה מ-20.5% ±-6.1% ל-25.7% ±5.8% על ידי יישום שיטת הסינתזה המשופרת. השיטה שיפרה את תפוקת המוצר. בדיקות בקרת איכות שונות שבוצעו לאחר הסינתזה הראו כי המוצר עומד בתקני בקרת האיכות.
התוצאות הראו כי לחולי אלצהיימר יש ניוון מוחי ברור, עם קשירה משמעותית של 18F-AV-1451. הצטברות הטאו מתחילה בקליפת המוח האנטורינלית ובהיפוקמפוס, לאחר מכן מתפשטת לקליפת המוח הטמפורלית והקודקודית, ולבסוף נשארת באופן נרחב בכל קליפת המוח. Tau PET הוא כלי מבטיח, ומספר מחקרים כבר העריכו את הערך האבחנתי של tau-PET. מחקרים הראו כי tau-PET, דפוסי הקישור, תואם היטב את התיאורים ההיסטופתולוגיים של בראק43,44, שהיא מסגרת בימוי התואמת היטב את המצב הקליני על פני ספקטרום AD45,46. עומס טאו וטופוגרפיה נמצאים בקורלציה טובה יותר עם תסמינים קליניים מאשר עומס עמילואיד47.
ה-NIA-AA סיווג את החיובי "A" כ"רצף אלצהיימר" בשנת 201129. בשנת 2018 הוקמה ושוכללה המסגרת למחקר אלצהיימר מבוסס סמנים ביולוגיים, וקבעה כי לחולים בשלב זה יש את השינויים הפתולוגיים של AD27. בקריטריונים המתוקנים לשלב AD, שפורסמו בשנת 2024, מצוין כי A+T- הם שלב ראשוני48. במקרים מסוימים, עשויות לחלוף שנים רבות עד שהם יופיעו תסמינים קליניים. אנשים שנמצאו חיוביים לסמנים ביולוגיים בשתי הקטגוריות "A" ו-"T" מסווגים כבעלי אלצהיימר. מחקרים קודמים הראו כי אנשים שליליים לטאו היו בעלי סיכוי נמוך יותר להציג מאפיינים של אלצהיימר וכי רוב החולים אינם מתקדמים לדמנציה במהלך לפחות 5 שנות מעקב49. חולים עם MCI חיובי לטאו עשויים להתפתח למחלת אלצהיימר. אם לחולה יש ספיגה רחבה של T והוא חיובי ל-N, זה אומר שהוא נמצא בשלב מתקדם של המחלה. לכן, זיהוי פתולוגיה של טאו וניוון עצבי חיוני לניהול מדויק של המטופלים. מחקרים קודמים הצביעו על כך שאנשים עם שליליות טאו נטו פחות להפגין מאפיינים קליניים הקשורים למחלת אלצהיימר, ורובם לא פיתחו דמנציה במהלך תקופת מעקב של לפחותחמש שנים. האבחנה המוקדמת של ליקוי קוגניטיבי קל עם טאו חיובי, שעלולה להתקדם למחלת אלצהיימר, חיונית לניהול מדויק של המטופל.
בעבר, מידע שהושג באמצעות PET ו-MRI דרש ניתוח מקביל של נתונים שנרכשו ברצף ואחריו היתוך פוסט-הוק כדי לספק רישום מרחבי טוב. עם זאת, מצבו הנפשי של הנבדק ומצבו הפיזיולוגי או הקוגניטיבי עשויים להשתנות בין הבדיקות. PET/MR היברידי מציג מידע פיזיולוגי ומטבולי שונה על תהליך המחלה על ידי התאמה זמנית ומרחבית של מערכי נתונים.
Disclosures
למחברים אין ניגוד אינטרסים להצהיר עליהם.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מתוכנית המחקר והפיתוח המרכזית של מחוז ליאונינג (2019JH/10300010) ותוכנית המחקר הבסיסי היישומי של מחוז ליאונינג (2022JH2/101500011).
Materials
| Name | Company | Catalog Number | Comments |
| 18O-rich water | Taiyo Nippon Sanso,Japan | 24-0091 | |
| 2020 edition of Pharmacopoeia of the People's Republic of China | NA | https://english.nmpa.gov.cn/2020-07/03/c_538689.htm | |
| Acetonitrile | ABX,Germany | TF-A1-231207002 | |
| air filter membrane (Millex-25) | Merck,Germany | SLFGN25VS | |
| Boc-protected-precursor | Huayi,Jiangsu,China | NPPI-95-0001A | |
| C18 column | Waters,USA | 186004770 | |
| Cyclotron | GE,USA | MINITRACE | |
| Dimethyl sulfoxide (DMSO) | Bailing Wei Technology,Beijing,China | 984549 | |
| EtOH | ABX,Germany | 10009216 | |
| EtOH for isolation | Sinopharm Chemical Reagent,Shanghai,China | 400212682 | |
| Gas chromatography | Tianmei,Shanghai,China | GC-7900 | |
| HPLC | SYKNM,Germany | S-1122 | |
| Hydrochloric acid | Sinopharm Chemical Reagent,Shanghai,China | 10011018 | |
| K2CO3 Solution | ABX,Germany | TF-K1-230724001 | |
| Kryptofix[2.2.2](K222) | ABX,Germany | 800 | |
| liquid filter membrane (Millex-GV) | Merck,Germany | SLGVR33RB | |
| Oasis HLB solid-phase extraction (SPE) column | Waters,USA | 186003908 | |
| PET/MR | GE,USA | Signa | |
| QMA column | Waters,USA | 186002350 | |
| Radionuclide activity | Capintec,USA | CRC-25R |
References
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Rajan, K. B., et al. Population estimate of people with clinical AD and mild cognitive impairment in the United States (2020-2060). Alzheimers Dement. 17 (12), 1966-1975 (2021).
- U.S. Burden of Disease Collaborators. The state of U.S. health, 1990-2016: Burden of diseases, injuries, and risk factors among U.S. states. JAMA. 319 (14), 1444-1472 (2018).
- Bhatt, J., et al. The World Alzheimer Report 2019: Attitudes to dementia. , (2019).
- Rostagno, A. A. Pathogenesis of Alzheimer's disease. Int J Mol Sci. 24 (1), 107(2022).
- Ossenkoppele, R., van der Kant, R., Hansson, O. Tau biomarkers in Alzheimer's disease: Towards implementation in clinical practice and trials. Lancet Neurol. 21 (8), 726-734 (2022).
- Abbott, A. Conquering Alzheimer's: A look at the therapies of the future. Nature. 616 (7955), 26-28 (2023).
- Politis, M., Piccini, P. Positron emission tomography imaging in neurological disorders. J Neurol. 259 (9), 1769-1780 (2012).
- Okamura, N., et al. Tau PET imaging in Alzheimer's disease. Curr Neurol Neurosci Rep. 14 (11), 500(2014).
- Holland, N., et al. Differential synaptic loss in β-amyloid positive versus β-amyloid negative corticobasal syndrome. Mov Disord. 39 (7), 1166-1178 (2024).
- Nicastro, N., et al. 18F-AV1451 PET imaging and multimodal MRI changes in progressive supranuclear palsy. J Neurol. 267 (2), 341-349 (2020).
- Cousins, O., et al. Microglial activation, tau and amyloid deposition in TREM2 p.R47H carriers and mild cognitive impairment patients: A multi-modal/multi-tracer PET/MRI imaging study with influenza vaccine immune challenge. J Neuroinflammation. 20 (1), 272(2023).
- Chien, D., et al. Early clinical PET imaging results with the novel PHF-tau radioligand [F18]-T808. J Alzheimers Dis. 38 (1), 171-184 (2014).
- Maruyama, M., et al. Imaging of tau pathology in a tauopathy mouse model and in Alzheimer patients compared to normal controls. Neuron. 79 (6), 1094-1108 (2013).
- Li, Y., et al. Cortical laminar binding of PET amyloid and tau tracers in Alzheimer disease. J Nucl Med. 56 (2), 270-273 (2015).
- Fodero-Tavoletti, M. T., et al. 18F-THK523: A novel in vivo tau imaging ligand for Alzheimer's disease. Brain. 134 (4), 1089-1100 (2011).
- Okamura, N., et al. Non-invasive assessment of Alzheimer's disease neurofibrillary pathology using 18F-THK5105 PET. Brain. 137 (Pt 6), 1762-1771 (2014).
- Tago, T., et al. Preclinical evaluation of [(18)F]THK-5105 enantiomers: Effects of chirality on its effectiveness as a tau imaging radiotracer. Mol Imaging Biol. 18 (2), 258-266 (2016).
- Xia, C. F., et al. [18F]T807, a novel tau positron emission tomography imaging agent for Alzheimer's disease. Alzheimers Dement. 9, 666-676 (2013).
- Fleisher, A. S., et al. Positron emission tomography imaging with [18F]flortaucipir and postmortem assessment of Alzheimer disease neuropathologic changes. JAMA Neurol. 77 (7), 829-839 (2020).
- Whitwell, J., et al. [18F]AV-1451 tau positron emission tomography in progressive supranuclear palsy. Mov Disord. 32 (1), 124-133 (2017).
- Kantarci, K., et al. AV-1451 Tau and β-amyloid positron emission tomography imaging in dementia with Lewy bodies. Ann Neurol. 81 (1), 58-67 (2017).
- Mossine, A. V., et al. An updated radiosynthesis of [18F]AV1451 for tau PET imaging. EJNMMI Radiopharm Chem. 2 (1), 7(2017).
- McKhann, G., et al. Clinical diagnosis of Alzheimer's disease: Report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology. 34 (7), 939-944 (1984).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 7 (3), 263-269 (2011).
- Chandra, A., et al. Alzheimer's Disease Neuroimaging Initiative. Applications of amyloid, Tau, and neuroinflammation PET imaging to Alzheimer's disease and mild cognitive impairment. Hum Brain Mapp. 40 (18), 5424-5442 (2019).
- Jack, C. R., et al. NIA-AA research framework: Toward a biological definition of Alzheimer's disease. Alzheimers Dement. 14 (4), 535-562 (2018).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging and the Alzheimer's Association Workgroup. Alzheimers Dement. 7, 263-269 (2011).
- Albert, M. S., et al. The diagnosis of mild cognitive impairment due to Alzheimer's disease: Recommendations from the National Institute on Aging and Alzheimer's Association Workgroup. Alzheimers Dement. 7, 270-279 (2011).
- Simrén, J., Elmgren, A., Blennow, K., Zetterberg, H. Fluid biomarkers in Alzheimer's disease. Adv Clin Chem. 112, 249-281 (2023).
- Molinuevo, J. L., et al. Current state of Alzheimer's fluid biomarkers. Acta Neuropathol. 136, 821-853 (2018).
- Alcolea, D., et al. Amyloid precursor protein metabolism and inflammation markers in preclinical Alzheimer disease. Neurology. 85, 626-633 (2015).
- Ia, J., et al. Biomarker changes during 20 years preceding Alzheimer's disease. N Engl J Med. 390 (8), 712-722 (2024).
- Leung, K. K., et al. Cerebral atrophy in mild cognitive impairment and Alzheimer disease: Rates and acceleration. Neurology. 80 (7), 648-654 (2013).
- Contador, J., et al. Longitudinal brain atrophy and CSF biomarkers in early-onset Alzheimer's disease. Neuroimage Clin. 32, 102804(2021).
- Menéndez-González, M., de Celis Alonso, B., Salas-Pacheco, J., Arias-Carrión, O. Structural neuroimaging of the medial temporal lobe in Alzheimer's disease clinical trials. J Alzheimers Dis. 48 (3), 581-589 (2015).
- van Oostveen, W. M., de Lange, E. C. M. Imaging techniques in Alzheimer's disease: A review of applications in early diagnosis and longitudinal monitoring. Int J Mol Sci. 22 (4), 2110(2021).
- Reiman, E. M., Jagust, W. J. Brain imaging in the study of Alzheimer's disease. Neuroimage. 61 (2), 505-516 (2012).
- Herholz, K. Perfusion SPECT and FDG-PET. Int Psychogeriatr. 23 (Suppl 2), S25-S31 (2011).
- Lamontagne-Kam, D., et al. Implication of tau propagation on neurodegeneration in Alzheimer's disease. Front Neurosci. 17, 1219299(2023).
- Gomar, J. J., et al. Increased retention of tau PET ligand [18F]-AV1451 in Alzheimer's disease psychosis. Transl Psychiatry. 12 (1), 82(2022).
- Shoup, T. M., et al. A concise radiosynthesis of the tau radiopharmaceutical [(18)F]T807. J Labelled Compd Radiopharm. 56 (14), 736-740 (2013).
- Schwarz, A. J., et al. Regional profiles of the candidate tau PET ligand 18F-AV-1451 recapitulate key features of Braak histopathological stages. Brain. 139, 1539-1550 (2016).
- Pascoal, T. A., et al. Longitudinal 18F-MK-6240 tau tangles accumulation follows Braak stages. Brain. 144, 3517-3528 (2021).
- Braak, H., Braak, E. Neuropathological staging of Alzheimer-related changes. Acta Neuropathol. 82, 239-259 (1991).
- Braak, H., et al. Staging of Alzheimer disease-associated neurofibrillary pathology using paraffin sections and immunocytochemistry. Acta Neuropathol. 112, 389-404 (2006).
- Ossenkoppele, R., et al. Associations between Tau, Aβ, and cortical thickness with cognition in Alzheimer disease. Neurology. 92, e601-e612 (2019).
- Jack, C. R., et al. Revised criteria for diagnosis and staging of Alzheimer's disease: Alzheimer's Association Workgroup. Alzheimers Dement. 20 (8), 5143-5169 (2024).
- Josephs, K. A., Weigand, S. D., Whitwell, J. L. Characterizing amyloid-positive individuals with normal tau PET levels after 5 years. Neurology. 98, e2282-e2292 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved