Method Article
Imágenes híbridas de PET/RM de la enfermedad de Alzheimer basadas en 18F-AV-1451
En este artículo
Resumen
Este protocolo describe el uso de 18F-AV-1451 PET/MRI para revelar la patología de tau y la neurodegeneración, ayudando a los neurólogos a diagnosticar la enfermedad de Alzheimer, evaluar su gravedad y obtener información sobre su progresión y los mecanismos patológicos subyacentes.
Resumen
La enfermedad de Alzheimer (EA) es un trastorno neurodegenerativo progresivo e irreversible caracterizado por disfunción cognitiva, disminución de las capacidades de la vida diaria y cambios de comportamiento, lo que impone una importante carga económica y social en todo el mundo. Una de las principales características patológicas de la EA es la acumulación de ovillos neurofibrilares formados por la proteína tau hiperfosforilada . La tomografía por emisión de positrones/resonancia magnética (PET/RM) proporciona información estructural y funcional detallada junto con distribuciones específicas de proteínas, lo que la convierte en una herramienta cada vez más valiosa para el diagnóstico y la investigación de la EA. 18F-AV-1451 es un radiotrazador diseñado específicamente para la detección de la proteína tau en la obtención de imágenes PET de tejido cerebral. Este estudio presenta un protocolo detallado para la radiosíntesis de 18F-AV-1451, preparación del paciente, técnicas de adquisición de imágenes PET/MRI y sus posibles aplicaciones en la evaluación de la EA. 18La PET/RM F-AV-1451 podría ayudar a los neurólogos a diagnosticar la enfermedad de Alzheimer, evaluar la gravedad de la enfermedad y obtener información sobre sus mecanismos patológicos. En conclusión, este protocolo proporciona un enfoque sensible, integral y no invasivo para la evaluación de la EA, ofreciendo información valiosa sobre la progresión y la patología de la enfermedad.
Introducción
La enfermedad de Alzheimer (EA) es un trastorno neurodegenerativo progresivo e irreversible. Los pacientes suelen experimentar disfunción cognitiva, disminución de las capacidades de la vida diaria y cambios de comportamiento. Con el envejecimiento acelerado de la población mundial, la enfermedad de Alzheimer se ha convertido en un importante problema de salud pública. Actualmente, más de 50 millones de personas en todo el mundo viven con la enfermedad de Alzheimer. Para 2050, se espera que la prevalencia de la demencia se triplique a nivel mundial1. Aproximadamente el 10.8% de las personas de 65 años o más tienen demencia de Alzheimer. La prevalencia de la EA es de alrededor del 5% en las personas de 65 a 74 años, aumentando al 33,3% en las personas de 85 años o más, lo que la convierte en una de las principales causas de muerte entre los ancianos2. Una vez que un paciente desarrolla EA, esto supone una carga significativa para la familia3. Debido a su inicio insidioso, los pacientes a menudo pierden la ventana óptima para el tratamiento después del diagnóstico. Su detección precoz sigue siendo un reto global4, ya que la etiología exacta aún no se conoce completamente 5,6. Dada la compleja etiología y las vías que influyen en la EA, existe una necesidad urgente de estrategias de diagnóstico más precisas y precoces.
Los métodos de imagen convencionales, como la tomografía computarizada (TC) y la resonancia magnética (RMN), se utilizan para observar la atrofia u otros cambios estructurales en el cerebro, que pueden contribuir al deterioro cognitivo. La resonancia magnética, en particular, proporciona un mejor contraste de tejidos blandos que la TC y ofrece información sobre la biología del tumor sin exponer a los pacientes a la radiación ionizante, lo que la convierte en la modalidad de imagen preferida para la mayoría de los trastornos neurológicos6. La resonancia magnética es una poderosa técnica de imagen que no solo proporciona información anatómica macroscópica detallada, sino que también incluye varios métodos de imagen funcional, como la resonancia magnética funcional dependiente del nivel de oxígeno en sangre (BOLD fMRI), que se puede utilizar para observar la actividad cerebral funcional6. La tomografía por emisión de positrones (PET) es un método de imagen molecular no invasivo que permite un análisis semicuantitativo exhaustivo de los procesos biológicos en el cerebro humano. El híbrido PET/RM puede ofrecer ventajas sobre otras técnicas de imagen para el diagnóstico de la EA7, ya que el uso de una amplia variedad de trazadores PET puede proporcionar información fisiológica adicional para complementar las imágenes anatómicas de RM 8,9.
Los ovillos neurofibrilares formados por la hiperfosforilación de la proteína tau son una de las características patológicas de la EA, estrechamente asociada al inicio de la neurodegeneración y a la manifestación de síntomas clínicos tanto espacial como temporales6. La proteína Tau es la proteína asociada a microtúbulos más abundante in vivo y es prevalente tanto en el sistema nervioso periférico como en el central. La progresión patológica de tau está fuertemente correlacionada con el grado de deterioro cognitivo y tiene el potencial de servir como diana terapéutica para los pacientes con EA7. La detección no invasiva de la deposición de proteína tau en regiones específicas del cerebro es valiosa para la predicción y el diagnóstico tempranos de la enfermedad. El uso de radiotrazadores de tau permite la visualización y localización de los depósitos de proteína tau en el cerebro, proporcionando un diagnóstico diferencial oportuno y preciso, así como un valioso apoyo en el seguimiento de la progresión de la enfermedad y la evaluación de tratamientos clínicos experimentales 8,9.
Varios estudios han demostrado una relación entre los cambios en proteínas específicas y los hallazgos funcionales o morfológicos de la RM10,11. Sin embargo, hay informes limitados sobre los análisis combinados que utilizaron imágenes de amiloide/tau y RM funcional12. El nuevo fármaco de diagnóstico molecular 18F-AV-1451 (7-(6-[18F]fluoropiridina-3yl)-5H-pirido[4,3-b]indol) se ha utilizado como agente radiodiagnóstico para la detección de la proteína tau en el tejido cerebral con imágenes PET. La investigación sobre la PET con tau aún se encuentra en su etapa de desarrollo, con solo unos pocos trazadores evaluados actualmente, incluidos 18F-T807 (18F-AV-1451), 18F-T808 (18F-AV-680)13, 11C-PBB314, 18F-THK-511715, 18F-THK-52316 y 18F-THK-510517,18. 18F-AV-1451 se desarrolló comercialmente19y se ha informado para su uso en pacientes con EA20, parálisis supranuclear progresiva21 y demencia con cuerpos de Lewy22. El proceso de radiosíntesis de 18F-AV-1451 requiere una compleja etapa de purificación para garantizar que el producto final cumpla con los requisitos de dosificación para los estudios de imágenes clínicas23. Con la creciente aplicación de radiotrazadores marcados con 18F en la tecnología de imágenes PET, existe una creciente demanda para la síntesis y el desarrollo de nuevos radiotrazadores con marca 18F. En este estudio se presenta un método de imagen PET/RM tau destinado a proporcionar información más detallada para el diagnóstico de pacientes con enfermedad de Alzheimer.
Protocolo
El estudio fue aprobado por el Comité de Ética Médica local, y todos los sujetos dieron su consentimiento informado por escrito antes de participar. Todos los estudios se llevaron a cabo de acuerdo con los principios de la Declaración de Helsinki. Todos los sujetos se sometieron a evaluaciones neurológicas y neuropsicológicas por parte de un profesional de la salud dentro de los tres meses anteriores y posteriores a la toma de imágenes. Los pacientes se incluyeron según los criterios24 de la Asociación Nacional del Instituto sobre el Envejecimiento-Alzheimer's Disease Association (NINCDS-ADRDA) y25 del Instituto Nacional sobre el Envejecimiento-Asociación de Alzheimer (NAA). Los detalles de los reactivos y equipos utilizados se enumeran en la Tabla de Materiales.
1. 18Síntesis F-AV-1451
NOTA: Siga los principios de protección ocupacional biológica y radiológica, así como los principios de eliminación de desechos médicos y radiactivos, durante las operaciones.
- Detalles sintéticos
- Sintetice 2,5 mL de fluoruro [18F] utilizando la reacción nuclear 18O(p, n)18F empleando un acelerador de partículas, con protones a corrientes integradas de hasta 45 μA bombardeando durante 40 min. Agregue fluoruro [18F] al módulo de síntesis automatizado a través de la tubería de transferencia, facilitado por la sobrepresión del gas helio. Opere el módulo de síntesis en el orden que se muestra en la Figura 1.
- Atrape el fluoruro [18F] en una columna de intercambio iónico (preactivado con 1 mL de etanol y 2 mL de agua) mientras retiene el agua de 18O en el recipiente de recuperación.
- Permita que la solución de carbonato de potasio del recipiente No.1 (Figura 1) fluya a través de las válvulas designadas y la columna de intercambio iónico para intercambiar con fluoruro [18F], luego eluya en el recipiente de reacción. Consulte la Tabla 1 para ver las soluciones en los diferentes recipientes.
- Disuelva el fluoruro [18F] y un catalizador de transferencia de fase basado en criptandos precargado en el recipiente No.2 en el recipiente de reacción.
- Abra la válvula designada. Someter la mezcla de reacción a una destilación al vacío bajo un soplado de nitrógeno a 85 °C durante 8 min, seguido de un soplado de nitrógeno a 110 °C durante 4 min para eliminar el agua residual.
- Agregue el precursor del recipiente n.º 3 al recipiente n.º 12 y caliente a 130 °C durante 10 minutos. La radiosíntesis de 18F-AV-1451 se muestra en la Figura 2.
- Enfríe la mezcla de reacción a 50 °C, luego abra las válvulas designadas para restaurar la presión atmosférica.
- Enjuague la mezcla de reacción en el recipiente n.º 14 utilizando un volumen de fase móvil de HPLC de 3 mL (solución acuosa de etanol al 25%, pH ajustado a 2,0) procedente de los recipientes n.º 5 y n.º 6. Abra las válvulas designadas para permitir la entrada de la mezcla en el circuito de HPLC bajo presión de helio.
- Introducir el producto en la columna semipreparativa de HPLC y eluir con la fase móvil a un caudal de 5 mL/min. Observe el eluyente utilizando UV (λ = 254 nm) y contadores de radiactividad.
- Recoja el producto en el matraz de fondo redondo a través de la válvula designada.
- Atrapar y retener el producto dentro de la columna C18 (activada por 5 mL de etanol y 10 mL de agua).
- Abra la válvula designada, lave la columna con agua del recipiente No.9 en el contenedor de desechos y luego enjuague en la botella del producto con solución de los recipientes No.8 y No.7.
- Pase 18F-AV-1451 a través de una membrana de filtro de líquido de 0,22 μm a la botella de recolección en la celda caliente dispensadora bajo presión de helio.
- Control de calidad
NOTA: Realizar el control de calidad en tres lotes consecutivos del producto. Asegurar que el control de calidad del producto cumpla con los criterios de la edición 2020 de la Farmacopea de la República Popular China (ver Tabla de Materiales).- Realice una inspección visual colocando el producto detrás del vidrio de plomo e inspeccionando el color y la claridad.
- Determine el valor de pH del producto utilizando papel de prueba de pH de precisión.
- Utilice HPLC para analizar la pureza radioquímica del producto 8,16.
- Analice la pureza nuclear radiactiva del producto utilizando el método del espectrómetro gamma17.
- Mida la vida media del producto con precisión de acuerdo con la Farmacopea de la República Popular China13.
- Aplique una presión de 0,34 MPa a la membrana del filtro estéril (paso 1.1.12) para probar su sellado e integridad.
- Realizar pruebas de esterilidad y endotoxinas utilizando cultivo bacteriano y el método del reactivo de cangrejo herradura23.
- Pruebe el residuo del catalizador de transferencia de fase a base de criptandos utilizando el método del yodoplatinato de potasio. Analice el contenido de acetona, acetonitrilo y DMSO en el producto utilizando un cromatógrafo de gases 8,16.
NOTA: Asegúrese de que no aparezcan otros picos excepto 0,511 MeV y 1,022 MeV.
2. Directrices previas al examen
NOTA: Se incluyó a los participantes que tenían una preocupación actual con respecto a un cambio en la cognición y exhibían deterioro en uno o más dominios cognitivos mientras mantenían la independencia en las habilidades funcionales25. La elegibilidad requirió una puntuación entre 0 y 20 en el Mini-Examen del Estado Mental (MMSE) y positividad de la proteína amiloide, confirmada a través de una relación anormal de líquido cefalorraquídeo (LCR) Aβ42 o Aβ42/Aβ40 o una tomografía por emisión de positrones (PET) amiloide positiva 6,20. Los criterios de exclusión abarcaron un diagnóstico de enfermedad vascular, depresión, lesión cerebral traumática, trastornos psicóticos u otras condiciones asociadas con el deterioro cognitivo5. Se excluyeron los participantes con contraindicaciones para marcapasos, sustancias ferromagnéticas u objetos extraños que representaran un peligro para la movilidad, así como aquellos que no pudieron someterse a imágenes de resonancia magnética. Otros criterios de exclusión fueron la intolerancia a los contrastes de gadolinio y la presencia de insuficiencia renal grave21.
- Indique a los sujetos que se abstengan de alcohol, cafeína, medicamentos o cualquier ejercicio o actividad extenuante durante 24 horas antes del estudio. Mantener un estado fisiológico estable (p. ej., biorritmos, tareas de función cerebral) para garantizar la precisión de los datos.
- Permita que los sujetos consuman agua y alimentos antes del examen, ya que estos no interfieren con las imágenes PET/MR tau.
- Suspenda los medicamentos relacionados con el neurológico durante al menos 12 horas antes de la toma de imágenes.
- Aconseje a los sujetos que eviten usar joyas de metal o ropa con botones o cremalleras de metal el día del examen.
NOTA: Asegúrese de que el paciente esté acompañado por un miembro de la familia, traiga registros de exámenes anteriores e informe al personal médico sobre el uso de medicamentos.
3. Preparación para el escaneo
- Verifique el formulario de solicitud para confirmar la información general, el propósito del examen y el programa. Asegúrese de que se hayan completado todos los preparativos necesarios. Regístrese y presente los datos.
- Obtener el consentimiento informado para la toma de imágenes PET/MR del sujeto o de un miembro de la familia. Informar al sujeto sobre el propósito, el procedimiento, los riesgos y los beneficios.
- Realizar una revisión detallada de la historia clínica, registrar la altura, el peso y la concentración sanguínea del sujeto, y confirmar la ausencia de contraindicaciones para el examen de resonancia magnética.
- Establecer una vía intravenosa en una vena superficial periférica o acceder a un catéter de puerto.
- Antes de administrar 18F-AV-1451, vuelva a verificar toda la información para evitar errores.
- Inyecte 18F-AV-1451 a 3,7-5,5 MBq/kg lentamente a través del acceso intravenoso. Enjuague el tubo con una cantidad adecuada de solución salina para minimizar los residuos radiactivos del trazador. Aplique compresión en el sitio de inyección para evitar fugas de líquido.
- Registre la hora, el sitio y la actividad de la inyección.
- Después de completar la inyección, inicie el cierre audiovisual. Atenúa las luces en la espera
y ajuste la temperatura a aproximadamente 22 °C. Indique al sujeto que descanse en la cama con los ojos cerrados durante 80 minutos, evitando hablar, comer o masticar durante este período.
4. Tomografía por emisión de positrones/resonancia magnética
- Indique al sujeto y a su acompañante que se quiten todos los objetos metálicos, incluidos los teléfonos móviles, los sombreros, las dentaduras postizas, las gafas, los relojes, las carteras y las monedas, antes del examen. No permita sillas de ruedas, camillas, camas de examen, cilindros de oxígeno ni equipos de monitoreo en la sala de examen.
- Proporcione tapones para los oídos al sujeto y colóquelos en posición supina sobre la mesa de PET/MRI con una bobina para la cabeza y el cuello que encierre la región cervical. Use un reposacabezas especializado o una almohadilla de esponja para estabilizar la cabeza, minimizando el movimiento y garantizando la comodidad.
NOTA: Administre una dosis adecuada de medicamento sedante, si es necesario, según la evaluación neurológica. - Coloque al sujeto con los brazos hacia abajo e indíquele que use el dispositivo de alarma en caso de molestia.
- Revise las imágenes para confirmar que la cabeza está centrada en el escáner, alineada con el centro de la bobina y colocada de manera consistente en relación con el cuello.
- Utilice una bobina de unión de cabeza y cuello de 8 canales para la obtención de imágenes.
- Adquiera secuencias volumétricas T1 cerebrales en 3D con alta resolución y alta relación señal-ruido (SNR) utilizando una secuencia recuperada en gradiente estropeada. Establezca los siguientes parámetros:
- Tiempo de repetición (TR) = 8,5 ms; Tiempo de eco (TE) = 3,2 ms; Tiempo de inversión (TI) = 450 ms; Ángulo de giro = 12°; Tamaño del vóxel = 1 × 1 × 1 mm³; Campo de visión (FOV) = 256 mm; Tamaño de la matriz = 256 × 256; Espesor de la loncha = 1 mm.
- Adquiera secuencias ponderadas axiales PROPULSER T2 con los siguientes parámetros: TR = 6837 ms; TE = 132 ms; Ángulo de giro = 142°; FOV = 240 mm; Tamaño de la matriz = 416 × 416; Grosor de la loncha = 5 mm.
NOTA: La tomografía por emisión de positrones (PET, por sus siglas en inglés) utiliza una posición de cama única, cubriendo todo el cerebro desde el foramen magnum hasta la parte superior del cráneo.
- Adquiera imágenes PET de 20 minutos simultáneamente.
- Realice el escaneo PET en el modo de adquisición 3D.
- Utilice el escaneo volumétrico para la obtención de imágenes por TEP.
- Realice la corrección de la atenuación de las imágenes de resonancia magnética utilizando una secuencia de pulsos de tiempo de eco cero (ZTE) para segmentar el hueso, el aire y el tejido blando.
- Adquiera datos PET utilizando la maximización de expectativas de subconjunto ordenado por tiempo de vuelo (OSEM) para la reconstrucción de imágenes20,23. Utilice los siguientes parámetros:
- Tamaño de la matriz = 192 × 192; 28 subconjuntos con 6 iteraciones; FOV = 350 × 350 mm; Ancho completo a la mitad del máximo (FWHM) = 3,0 mm.
- Calcule el valor de absorción estandarizado (SUV) utilizando la fórmula20,23:
SUV = (Actividad de la esfera (Bq/ml) × Peso corporal (kg)) / Dosis inyectada.
5. Interpretación de la imagen
- Evaluar visualmente todas las imágenes de PET/RM de forma independiente por al menos dos médicos con experiencia en medicina nuclear ciegos al diagnóstico clínico.
- Identificar los lóbulos cerebrales que exhiben cambios estructurales anormales y deposición de proteínas.
- Repita la evaluación visual hasta que se llegue a un consenso final.
- Defina una "exploración positiva" como un aumento de la captación de 18F-AV-1451 en cualquiera o todas las regiones corticales. Defina una "exploración negativa" como la ausencia de captación de 18F-AV-1451 en todas las regiones corticales.
- Definir la atrofia en el lóbulo temporal medial, particularmente en el hipocampo en la resonancia magnética, como neurodegeneración20,25.
Resultados
18Resultados de la síntesis F-AV-1451
La síntesis en un solo paso de 18F-AV-1451 en condiciones de reacción optimizadas aumentó el rendimiento de la síntesis del 5,±8% al 25,7%. El tiempo total de reacción fue de 70 min. En la Figura 3 se muestra un espectro semipreparativo típico de HPLC y UV, donde el pico 2 representa el pico del producto.
Resultados de las pruebas de calidad
Durante tres lotes consecutivos, los resultados del control de calidad fueron los siguientes: La solución era incolora, visualmente transparente y libre de impurezas evidentes. El pH osciló entre 4,5 y 7,5. Los análisis de HPLC y TLC mostraron que la pureza química era del >95% y la pureza radioquímica del >95%. La energía del fotón primario fue de 0,511 MeV. La vida media cumplió con las especificaciones requeridas, excluyendo los isótopos de vida media larga (t1/2 > 5 días). La membrana del filtro estéril se presurizó a 0,34 MPa sin fugas de aire. Los niveles de endotoxinas fueron de <15 UE por 1 mL del producto. El cultivo bacteriano confirmó la esterilidad. K2. 2. 2 concentración fue de ≤50 μg/mL. Además, los disolventes residuales como la acetona, el acetonitrilo y el DMSO cumplieron con los estándares de la Farmacopea de la República Popular China (véase la Tabla de materiales).
18F-AV-1451 Resultados de PET/MR
En la figura 4 se presenta un ejemplo de PET/RM en un hombre de 69 años con deterioro cognitivo persistente (puntuación MMSE: 19/30) con depósito de tau positivo. Las imágenes muestran una atrofia cerebral significativa, caracterizada principalmente por giros de materia gris ensanchados y profundos y ventrículos agrandados. Los subgrupos AD exhibieron una unión significativa de 18F-AV-1451 con la variada distribución regional. La acumulación de tau comenzó en la corteza entorrinal y el hipocampo, luego se extendió a las cortezas temporal y parietal, y finalmente se extendió ampliamente por toda la corteza cerebral.
En la figura 5 se presenta un ejemplo de PET/RM en un hombre de 68 años con deterioro cognitivo (puntuación MMSE: 24/30) con depósito de tau negativo. Las imágenes muestran una morfología normal del parénquima cerebral bilateral, con una captación uniforme y simétrica de radiactividad de 18F-AV-1451. La resonancia magnética de la misma sesión de imagen mostró un tamaño y morfología ventricular normales, sin desplazamiento de la línea media y sin señales anormales detectadas en el parénquima cerebral. Hubo captación inespecífica en los ganglios basales y el tronco encefálico.
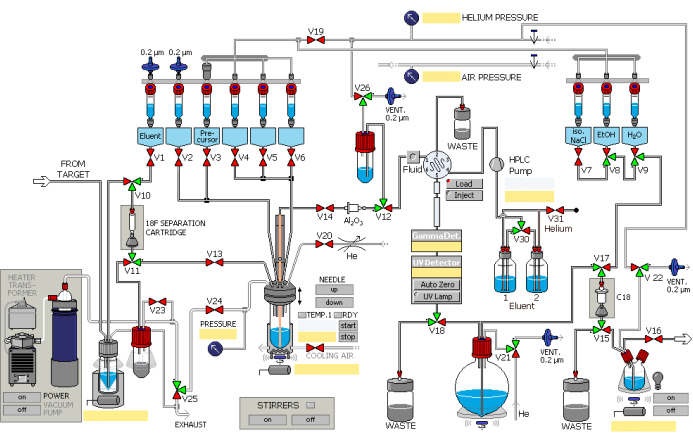
Figura 1: Diagrama esquemático del módulo de radiosíntesis. El módulo de síntesis funciona secuencialmente según los pasos designados. Haga clic aquí para ver una versión más grande de esta figura.
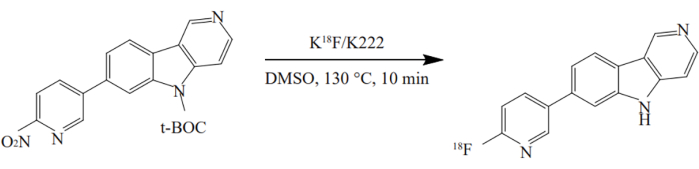
Figura 2: Radiosíntesis de 18F-AV-1451. El compuesto se sintetizó utilizando un método de un solo recipiente en condiciones optimizadas. El nitroprecursor se hizo reaccionar con K[18F]/K2.2.2 en DMSO a 130 °C durante 10 min. Haga clic aquí para ver una versión más grande de esta figura.
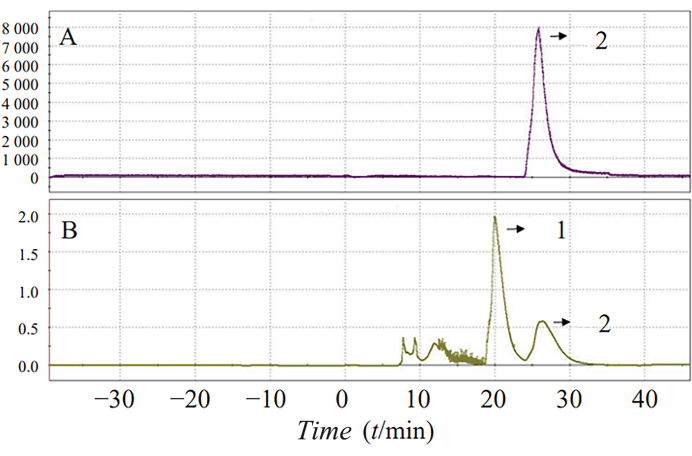
Figura 3: Separación por HPLC (A) y UV (B) de la radiactividad de 18F-AV-1451. Se muestran los espectros semi-preparativos de HPLC y UV. El pico 2 representa el pico del producto. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Datos imagenales representativos de un paciente con depósito de tau positivo. (A) 18imágenes PET F-AV-1451. (B) Imágenes axiales ponderadas en T1 (T1WI). (C) Imágenes axiales ponderadas en T2 (T2WI). (D) Axial 18F-AV-1451 Imágenes de fusión PET/MR. Las imágenes T1WI y T2WI muestran reducción del volumen del hipocampo bilateral, dilatación ventricular, ensanchamiento y profundización de las fisuras sulares y ausencia de desplazamiento de la estructura de la línea media. 18Las imágenes de fusión de la TEP/RM F-AV-1451 revelan una TEP de tau positiva, con captación en la circunvolución frontal medial, el cuneus anterior, la circunvolución temporal inferior y la corteza occipital lateral. Haga clic aquí para ver una versión más grande de esta figura.
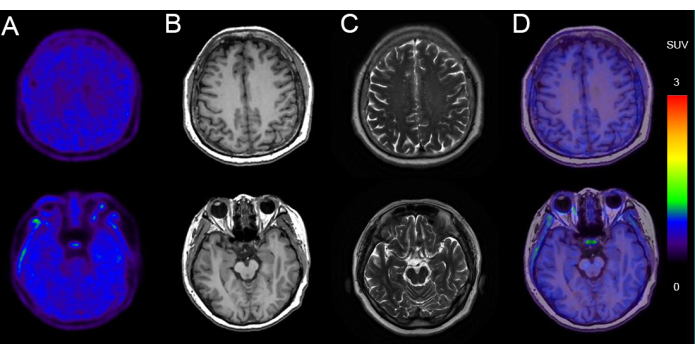
Figura 5: Datos representativos de imágenes de un paciente con depósito de tau negativo. (A) 18imágenes PET F-AV-1451. (B) Imágenes axiales ponderadas en T1 (T1WI). (C) Imágenes axiales ponderadas en T2 (T2WI). (D) Axial 18F-AV-1451 Imágenes de fusión PET/MR. Las imágenes T1WI y T2WI muestran una resonancia magnética cerebral normal, sin atrofia significativa del lóbulo temporal indicativa de neurodegeneración. 18Las imágenes de fusión PET/RM F-AV-1451 muestran una PET con tau normal, sin captación cortical específica que sugiera tauopatía. Haga clic aquí para ver una versión más grande de esta figura.
| Botella de disolvente | solvente |
| No.1 | 1,5 mg de K2CO3 en 0,5 ml de agua |
| No.2 | 1,5 mg K2.2.2. en 1 ml de acetonitrilo |
| No.3 | Precursor de 1 mg en 1,2 ml de disolvente DMSO |
| No.5 | 1,5 ml de fase móvil de HPLC |
| No.6 | 1,5 ml de fase móvil de HPLC |
| Matraz de fondo redondo | 2 ml de solución acuosa de NaHCO3 al 84% y 30 ml de agua |
| No.7 | 9 ml de solución salina al 0,9% |
| No.8 | 1 ml de EtOH |
| No.9 | 10 ml de agua |
Tabla 1: Soluciones presentes en diferentes recipientes del módulo de radiosíntesis.
Discusión
En este manuscrito metodológico, hemos introducido una radiosíntesis actualizada de 18F-AV-1451 para la obtención de imágenes PET de tau y las técnicas para la adquisición de imágenes de PET/RM de 18F-AV-1451, y hemos proporcionado la utilidad potencial de 18F-AV-1451 PET/MR para evaluar la EA. La TC o RM cerebral convencional generalmente proporciona una evaluación estructural anatómica macroscópica, lo que limita la evaluación de la progresión de la enfermedad y la predicción del pronóstico. El PET es una herramienta de neuroimagen que permite medir procesos moleculares in vivo . Los radioligandos PET pueden unirse a dianas, incluidos receptores, proteínas transportadoras o enzimas26. La tecnología se ha utilizado en el diagnóstico de trastornos neurológicos, el desarrollo de programas y la evaluación de la progresión de la enfermedad. La PET/MRI es un novedoso sistema híbrido de imágenes cerebrales funcionales que combina la tomografía por emisión de positrones (PET) y la resonancia magnética. Debido a la amplia variedad de trazadores PET, la PET/MR puede proporcionar información fisiológica adicional más allá de las imágenes anatómicas de RMN. La adquisición simultánea de datos de PET y MRI ayudará a aprovechar las ventajas inherentes de ambas tecnologías y eliminará el posible retraso de dos inspecciones separadas, al tiempo que aumenta la eficiencia y la comodidad para el paciente. La PET/MRI elimina la radiación adicional necesaria para la corrección de la atenuación y la correlación anatómica en la parte de la TC de una PET/CT, lo que puede ser una gran ventaja para pacientes especiales como mujeres embarazadas, niños pequeños y pacientes que necesitan múltiples exámenes de imágenes por PET.
El National Institute on Aging and Alzheimer's Association (NIA-AA) propuso en 2011 un marco diagnóstico (marco A/T/N) basado en marcadores biológicos27, incluyendo la deposición de β-amiloide (Aβ), tau patológica (T) y neurodegeneración (N)28,29. Aβ es el componente de las placas seniles, cuyos marcadores incluyen mediciones de niveles reducidos de Aβ42 en líquido cefalorraquídeo (LCR) y depósito de Aβ demostrado por PET. La tau patológica es el principal componente de la fibrosis de los ovillos neurofibrilares, cuyos marcadores incluyen el aumento de la tau total o la tau fosforilada (p-tau) en el LCR 30,31,32,33. Las medidas de neurodegeneración incluyen las tasas de atrofia cerebral34,35 y el volumen del hipocampo o la atrofia del lóbulo temporal medial36,37 detectados por resonancia magnética, y el hipometabolismo o hipoperfusión obtenidos con PET y tomografía computarizada por emisión de fotón único (SPECT)38,39. La PET/RM puede ofrecer ventajas sobre otros métodos de imagen en el diagnóstico de la EA al proporcionar simultáneamente la deposición de proteínas patológicas y la atrofia en la región del hipocampo en una sola exploración.
Recientemente, se han puesto a disposición nuevos trazadores PET para la detección no invasiva in vivo de tau, cuya acumulación es una característica definitoria de la patología de la EA40. 18F-AV1451 exhibe una potente unión y selectividad para tau en el tejido cerebral de pacientes con EA41, con una cinética relativamente más lenta. Utilizamos 18F-AV1451 para examinar la distribución de las proteínas tau en el cerebro de pacientes con EA. 18F-AV-1451 ha sido sintetizado en múltiples métodos. Este estudio automatizó la síntesis de 18F-AV-1451 en el sintetizador TRACERlab FXFN utilizando un método de un solo potenciómetro con condiciones optimizadas. La dosis del precursor cambió a 1 mg42. Simultáneamente, las condiciones de separación de HPLC se ajustaron a una solución acuosa de EtOH al 25% con pH ajustado a 2.0 para la desprotección en línea de BOC. Se realizó la conversión y repurificación de solventes en una columna de C18. El rendimiento de la síntesis se incrementó de 20.5% ± 6.1% a 25.7% ±5.8% mediante la aplicación del método de síntesis mejorado. El método mejoró el rendimiento del producto. Varias pruebas de control de calidad realizadas después de la síntesis mostraron que el producto cumplía con los estándares de control de calidad.
Los resultados mostraron que los pacientes con EA tenían una atrofia cerebral evidente, con una unión significativa de 18F-AV-1451. La acumulación de tau comienza en la corteza entorrinal y el hipocampo, luego se extiende a las cortezas temporal y parietal, y finalmente permanece extensamente en toda la corteza cerebral. La PET con tau es una herramienta prometedora, y varios estudios ya han evaluado el valor diagnóstico de la PET con tau. Los estudios mostraron que la tau-PET, los patrones de unión, se corresponde bien con las descripciones histopatológicas de Braak43,44, que es un marco de estadificación que se corresponde bien con el estado clínico en todo el espectro de la EA45,46. La carga de tau y la topografía se correlacionan mejor con los síntomas clínicos que la carga amiloide47.
El NIA-AA clasificó la positividad "A" como "Alzheimer's Continuum" en 201129. En 2018, se estableció y refinó el marco para la investigación de la EA basada en biomarcadores, afirmando que los pacientes en esta etapa tienen los cambios patológicos de la EA27. En los criterios revisados para la estadificación de la EA, publicados en 2024, se señala que A+T- son la etapa inicial48. En algunos casos, pueden pasar muchos años antes de que aparezcan los síntomas clínicos. Las personas que son positivas para los biomarcadores en las categorías "A" y "T" se clasifican como con EA. Estudios previos mostraron que los individuos tau negativos tenían menos probabilidades de presentar características de EA y que la mayoría de los pacientes no progresan a demencia durante al menos 5 años de seguimiento49. Los pacientes con deterioro cognitivo leve positivo para tau pueden evolucionar a EA. Si el paciente tiene una captación amplia de T y es positivo para N, eso significa que se encuentra en una etapa avanzada de la enfermedad. Por lo tanto, la detección de la patología y la neurodegeneración de tau es esencial para un manejo preciso del paciente. Estudios previos han indicado que los individuos con negatividad tau eran menos propensos a exhibir características clínicas asociadas con la enfermedad de Alzheimer, y la mayoría no desarrolló demencia durante un período de seguimiento de al menoscinco años. El diagnóstico precoz in vivo del deterioro cognitivo leve con tau positivo, que puede progresar a la enfermedad de Alzheimer, es esencial para un manejo preciso del paciente.
Anteriormente, la información obtenida con PET y RM requería un análisis paralelo de los datos adquiridos secuencialmente seguido de una fusión post hoc para proporcionar un buen registro espacial. Sin embargo, el estado mental y las condiciones fisiológicas o cognitivas de un sujeto pueden cambiar entre exámenes. El PET/MR híbrido muestra diferente información fisiológica y metabólica sobre el proceso de la enfermedad mediante la coincidencia temporal y espacial de conjuntos de datos.
Divulgaciones
Los autores no tienen ningún conflicto de intereses que declarar.
Agradecimientos
Este trabajo contó con el apoyo de subvenciones del Plan Clave de Investigación y Desarrollo de la provincia de Liaoning (2019JH/10300010) y el Programa de Investigación Básica Aplicada de la provincia de Liaoning (2022JH2/101500011).
Materiales
| Name | Company | Catalog Number | Comments |
| 18O-rich water | Taiyo Nippon Sanso,Japan | 24-0091 | |
| 2020 edition of Pharmacopoeia of the People's Republic of China | NA | https://english.nmpa.gov.cn/2020-07/03/c_538689.htm | |
| Acetonitrile | ABX,Germany | TF-A1-231207002 | |
| air filter membrane (Millex-25) | Merck,Germany | SLFGN25VS | |
| Boc-protected-precursor | Huayi,Jiangsu,China | NPPI-95-0001A | |
| C18 column | Waters,USA | 186004770 | |
| Cyclotron | GE,USA | MINITRACE | |
| Dimethyl sulfoxide (DMSO) | Bailing Wei Technology,Beijing,China | 984549 | |
| EtOH | ABX,Germany | 10009216 | |
| EtOH for isolation | Sinopharm Chemical Reagent,Shanghai,China | 400212682 | |
| Gas chromatography | Tianmei,Shanghai,China | GC-7900 | |
| HPLC | SYKNM,Germany | S-1122 | |
| Hydrochloric acid | Sinopharm Chemical Reagent,Shanghai,China | 10011018 | |
| K2CO3 Solution | ABX,Germany | TF-K1-230724001 | |
| Kryptofix[2.2.2](K222) | ABX,Germany | 800 | |
| liquid filter membrane (Millex-GV) | Merck,Germany | SLGVR33RB | |
| Oasis HLB solid-phase extraction (SPE) column | Waters,USA | 186003908 | |
| PET/MR | GE,USA | Signa | |
| QMA column | Waters,USA | 186002350 | |
| Radionuclide activity | Capintec,USA | CRC-25R |
Referencias
- Scheltens, P., et al. Alzheimer's disease. Lancet. 397 (10284), 1577-1590 (2021).
- Rajan, K. B., et al. Population estimate of people with clinical AD and mild cognitive impairment in the United States (2020-2060). Alzheimers Dement. 17 (12), 1966-1975 (2021).
- U.S. Burden of Disease Collaborators. The state of U.S. health, 1990-2016: Burden of diseases, injuries, and risk factors among U.S. states. JAMA. 319 (14), 1444-1472 (2018).
- Bhatt, J., et al. The World Alzheimer Report 2019: Attitudes to dementia. , (2019).
- Rostagno, A. A. Pathogenesis of Alzheimer's disease. Int J Mol Sci. 24 (1), 107(2022).
- Ossenkoppele, R., van der Kant, R., Hansson, O. Tau biomarkers in Alzheimer's disease: Towards implementation in clinical practice and trials. Lancet Neurol. 21 (8), 726-734 (2022).
- Abbott, A. Conquering Alzheimer's: A look at the therapies of the future. Nature. 616 (7955), 26-28 (2023).
- Politis, M., Piccini, P. Positron emission tomography imaging in neurological disorders. J Neurol. 259 (9), 1769-1780 (2012).
- Okamura, N., et al. Tau PET imaging in Alzheimer's disease. Curr Neurol Neurosci Rep. 14 (11), 500(2014).
- Holland, N., et al. Differential synaptic loss in β-amyloid positive versus β-amyloid negative corticobasal syndrome. Mov Disord. 39 (7), 1166-1178 (2024).
- Nicastro, N., et al. 18F-AV1451 PET imaging and multimodal MRI changes in progressive supranuclear palsy. J Neurol. 267 (2), 341-349 (2020).
- Cousins, O., et al. Microglial activation, tau and amyloid deposition in TREM2 p.R47H carriers and mild cognitive impairment patients: A multi-modal/multi-tracer PET/MRI imaging study with influenza vaccine immune challenge. J Neuroinflammation. 20 (1), 272(2023).
- Chien, D., et al. Early clinical PET imaging results with the novel PHF-tau radioligand [F18]-T808. J Alzheimers Dis. 38 (1), 171-184 (2014).
- Maruyama, M., et al. Imaging of tau pathology in a tauopathy mouse model and in Alzheimer patients compared to normal controls. Neuron. 79 (6), 1094-1108 (2013).
- Li, Y., et al. Cortical laminar binding of PET amyloid and tau tracers in Alzheimer disease. J Nucl Med. 56 (2), 270-273 (2015).
- Fodero-Tavoletti, M. T., et al. 18F-THK523: A novel in vivo tau imaging ligand for Alzheimer's disease. Brain. 134 (4), 1089-1100 (2011).
- Okamura, N., et al. Non-invasive assessment of Alzheimer's disease neurofibrillary pathology using 18F-THK5105 PET. Brain. 137 (Pt 6), 1762-1771 (2014).
- Tago, T., et al. Preclinical evaluation of [(18)F]THK-5105 enantiomers: Effects of chirality on its effectiveness as a tau imaging radiotracer. Mol Imaging Biol. 18 (2), 258-266 (2016).
- Xia, C. F., et al. [18F]T807, a novel tau positron emission tomography imaging agent for Alzheimer's disease. Alzheimers Dement. 9, 666-676 (2013).
- Fleisher, A. S., et al. Positron emission tomography imaging with [18F]flortaucipir and postmortem assessment of Alzheimer disease neuropathologic changes. JAMA Neurol. 77 (7), 829-839 (2020).
- Whitwell, J., et al. [18F]AV-1451 tau positron emission tomography in progressive supranuclear palsy. Mov Disord. 32 (1), 124-133 (2017).
- Kantarci, K., et al. AV-1451 Tau and β-amyloid positron emission tomography imaging in dementia with Lewy bodies. Ann Neurol. 81 (1), 58-67 (2017).
- Mossine, A. V., et al. An updated radiosynthesis of [18F]AV1451 for tau PET imaging. EJNMMI Radiopharm Chem. 2 (1), 7(2017).
- McKhann, G., et al. Clinical diagnosis of Alzheimer's disease: Report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's Disease. Neurology. 34 (7), 939-944 (1984).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 7 (3), 263-269 (2011).
- Chandra, A., et al. Alzheimer's Disease Neuroimaging Initiative. Applications of amyloid, Tau, and neuroinflammation PET imaging to Alzheimer's disease and mild cognitive impairment. Hum Brain Mapp. 40 (18), 5424-5442 (2019).
- Jack, C. R., et al. NIA-AA research framework: Toward a biological definition of Alzheimer's disease. Alzheimers Dement. 14 (4), 535-562 (2018).
- McKhann, G. M., et al. The diagnosis of dementia due to Alzheimer's disease: Recommendations from the National Institute on Aging and the Alzheimer's Association Workgroup. Alzheimers Dement. 7, 263-269 (2011).
- Albert, M. S., et al. The diagnosis of mild cognitive impairment due to Alzheimer's disease: Recommendations from the National Institute on Aging and Alzheimer's Association Workgroup. Alzheimers Dement. 7, 270-279 (2011).
- Simrén, J., Elmgren, A., Blennow, K., Zetterberg, H. Fluid biomarkers in Alzheimer's disease. Adv Clin Chem. 112, 249-281 (2023).
- Molinuevo, J. L., et al. Current state of Alzheimer's fluid biomarkers. Acta Neuropathol. 136, 821-853 (2018).
- Alcolea, D., et al. Amyloid precursor protein metabolism and inflammation markers in preclinical Alzheimer disease. Neurology. 85, 626-633 (2015).
- Ia, J., et al. Biomarker changes during 20 years preceding Alzheimer's disease. N Engl J Med. 390 (8), 712-722 (2024).
- Leung, K. K., et al. Cerebral atrophy in mild cognitive impairment and Alzheimer disease: Rates and acceleration. Neurology. 80 (7), 648-654 (2013).
- Contador, J., et al. Longitudinal brain atrophy and CSF biomarkers in early-onset Alzheimer's disease. Neuroimage Clin. 32, 102804(2021).
- Menéndez-González, M., de Celis Alonso, B., Salas-Pacheco, J., Arias-Carrión, O. Structural neuroimaging of the medial temporal lobe in Alzheimer's disease clinical trials. J Alzheimers Dis. 48 (3), 581-589 (2015).
- van Oostveen, W. M., de Lange, E. C. M. Imaging techniques in Alzheimer's disease: A review of applications in early diagnosis and longitudinal monitoring. Int J Mol Sci. 22 (4), 2110(2021).
- Reiman, E. M., Jagust, W. J. Brain imaging in the study of Alzheimer's disease. Neuroimage. 61 (2), 505-516 (2012).
- Herholz, K. Perfusion SPECT and FDG-PET. Int Psychogeriatr. 23 (Suppl 2), S25-S31 (2011).
- Lamontagne-Kam, D., et al. Implication of tau propagation on neurodegeneration in Alzheimer's disease. Front Neurosci. 17, 1219299(2023).
- Gomar, J. J., et al. Increased retention of tau PET ligand [18F]-AV1451 in Alzheimer's disease psychosis. Transl Psychiatry. 12 (1), 82(2022).
- Shoup, T. M., et al. A concise radiosynthesis of the tau radiopharmaceutical [(18)F]T807. J Labelled Compd Radiopharm. 56 (14), 736-740 (2013).
- Schwarz, A. J., et al. Regional profiles of the candidate tau PET ligand 18F-AV-1451 recapitulate key features of Braak histopathological stages. Brain. 139, 1539-1550 (2016).
- Pascoal, T. A., et al. Longitudinal 18F-MK-6240 tau tangles accumulation follows Braak stages. Brain. 144, 3517-3528 (2021).
- Braak, H., Braak, E. Neuropathological staging of Alzheimer-related changes. Acta Neuropathol. 82, 239-259 (1991).
- Braak, H., et al. Staging of Alzheimer disease-associated neurofibrillary pathology using paraffin sections and immunocytochemistry. Acta Neuropathol. 112, 389-404 (2006).
- Ossenkoppele, R., et al. Associations between Tau, Aβ, and cortical thickness with cognition in Alzheimer disease. Neurology. 92, e601-e612 (2019).
- Jack, C. R., et al. Revised criteria for diagnosis and staging of Alzheimer's disease: Alzheimer's Association Workgroup. Alzheimers Dement. 20 (8), 5143-5169 (2024).
- Josephs, K. A., Weigand, S. D., Whitwell, J. L. Characterizing amyloid-positive individuals with normal tau PET levels after 5 years. Neurology. 98, e2282-e2292 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados