Method Article
В пробирке Дифференцировка дендритных клеток человека и их маркеров при инфекции лейшмании
В этой статье
Резюме
Дендритные клетки (ДК) являются важными компонентами врожденного иммунитета против инфекции Leishmania. Механизмы, лежащие в основе сложного взаимодействия между ДК и лейшманией , остаются малоизученными. В данной статье мы описываем методы оценки того, как инфекция Leishmania влияет на иммунобиологическую функцию ДК человека, такую как экспрессия молекул, связанная с миграцией и костимулирующая экспрессия.
Аннотация
Лейшманиоз представляет собой совокупность клинических проявлений, связанных с инфекцией облигатных внутриклеточных простейших, Leishmania. Жизненный цикл паразитов Leishmania состоит из двух чередующихся жизненных стадий (амастиготы и промастиготы), в течение которых паразиты обитают либо в членистоногих переносчиках, либо в позвоночных хозяевах, соответственно. Примечательно, что сложные взаимодействия между паразитами Leishmania и несколькими клетками иммунной системы в значительной степени влияют на исход инфекции. Важно отметить, что, хотя известно, что макрофаги являются основной нишей хозяина для репликации Leishmania , паразиты также фагоцитируются другими клетками врожденного иммунитета, такими как нейтрофилы и дендритные клетки (ДК).
ДК играют важную роль в соединении врожденных и адаптивных ветвей иммунитета и, таким образом, организуют иммунные реакции против широкого спектра патогенов. Механизмы, с помощью которых Leishmania и DC взаимодействуют, остаются неясными и включают в себя аспекты захвата патогена, динамики созревания и активации DC, миграции DC в дренирующие лимфатические узлы (dLNs) и презентации антигена в Т-клетках. Несмотря на то, что большое количество исследований поддерживает идею о том, что ДК играют двойную роль в модуляции иммунных реакций против лейшмании, участие этих клеток в восприимчивости или устойчивости к лейшмании остается плохо изученным. После инфицирования ДК подвергаются процессу созревания, связанному с активацией поверхностного большого комплекса гистосовместимости (MHC) II, в дополнение к костимулирующим молекулам (а именно, CD40, CD80 и CD86).
Понимание роли ДК в исходе инфекции имеет решающее значение для разработки терапевтических и профилактических стратегий для модуляции иммунного ответа против лейшмании. В данной статье описан метод характеристики взаимодействия Leishmania-DC. Этот подробный протокол содержит рекомендации на всех этапах дифференцировки ДК, характеристики молекул клеточной поверхности и протоколов инфекции, что позволяет ученым исследовать реакцию ДК на инфекцию Leishmania и получить представление о роли, которую эти клетки играют в ходе инфекции.
Введение
Лейшманиоз представляет собой комплекс запущенных заболеваний, вызываемых различными видами рода Leishmania рода1. Leishmania — внутриклеточный простейший из семейства Trypanosomatidae, который инфицирует людей и других млекопитающих, вызывая спектр заболеваний, начиная от поражений кожи и заканчивая висцеральнымиформами. Основными клиническими проявлениями этого заболевания являются тегументарный лейшманиоз (ТЛ) и висцеральный лейшманиоз (ВЛ). По оценкам Всемирной организации здравоохранения (ВОЗ), ежегодно происходит от 700 000 до 1 миллиона новых случаев заболевания, что приводит к 70 000 смертей каждыйгод2. Лейшманиозом во всем мире страдают от 12 до 15 миллионов человек, и 350 миллионов человек подвержены риску заражения этой болезнью3.
Род Leishmania представляет две эволюционные формы: промастиготу и амастиготу4. Leishmania promastigotes характеризуются наличием жгутиков и высокой подвижностью. Эти формы обнаруживаются в пищеварительном тракте песчаной мухи, где они подвергаются дифференцировке в инфекционную форму (метациклические промастиготы)5. Напротив, амастиготы обнаруживаются во внутриклеточной среде инфицированных клеток млекопитающих. Эта эволюционная форма, в свою очередь, реплицируется в фаголизосомах фагоцитарных клеток6.
Цикл передачи Leishmania spp. начинается во время кормления кровью, когда москитные мухи инокулируют метациклические промастиготы в кожу хозяина1. Вскоре после инокуляции лейшмании клетки врожденного иммунитета, включая нейтрофилы и тканевые макрофаги, фагоцитируют паразитов. Внутри паразитофорных вакуолей лейшмании дифференцируются в амастиготы и реплицируются, что приводит к разрыву клеточной мембраны хозяина, что способствует инфицированию соседних клетоки распространению паразита4. Цикл завершается, когда флеботомины поглощают фагоциты, содержащие амастигот, которые дифференцируются в проциклические промастиготы, а затем в метациклические промастиготы в кишечном тракте насекомого7.
Дендритные клетки, профессиональные антигенпрезентирующие клетки, обнаруженные в тканях и лимфатических узлах, действуют как страж иммунной системы8. Эти клетки обнаруживаются в периферических тканях на незрелых стадиях, в основном участвуют в захвате и обработке антигена. После контакта с патогенами ДК подвергаются процессу созревания, который завершается их миграцией в лимфатические узлы, впоследствии представляя антигены наивным CD4+ Т-клеткам. Эти клетки также играют важную роль в организации врожденных и адаптивных иммунных реакций, которые вызывают толерантность или воспаление9. Процесс созревания ДК включает в себя несколько аспектов, включая повышенную экспрессию MHC и костимулирующих молекул, таких как CD40 и CD86, а также усиленную секрецию цитокинов. ДК экспрессируют различные маркеры, включая CD11b и CD11c, а у человека ДК, происходящие из моноцитов CD14+ (moDCs), экспрессируют CD1a10. CCR7 высоко экспрессируется на ДК и указывает на сложный миграционный процесс этих клеток12. CD209 и CD80 также играют важную роль в первичном контакте с ДК и лимфоцитами13.
Исследования показывают, что при лейшманиозе moDC фагоцитозируют паразитов и доставляют их в дренажные лимфатические узлы (dLNs), где они представляют антигены Т-клеткам13. Механизм захвата паразита связан с реорганизацией цитоскелета актиновыми филаментами во время фагоцитоза, что способствует интернализации паразита14. Большинство исследований, посвященных роли ДК в лейшманиозе, были сосредоточены на L. major, L. amazonensis и L. braziliensis15. Интересно, что исследования инфекции лейшмании in vivo показали, что нарушение функции ДК происходит специфическим для паразита штаммоспецифическим образом.
Было продемонстрировано, что на ранних стадиях инфекции L. amazonensis ДК демонстрируют сниженную способность сдерживать паразитарную инфекцию. И наоборот, в экспериментальной модели инфекции L. braziliensis было показано, что ДК вызывают соответствующие иммунные реакции, которые ограничивают выживаемость Leishmania16. Основными известными аспектами, связанными с дифференциальными ответами на инфекцию Leishmania spp., являются степень созревания и активации ДК. В этой статье описывается метод исследования роли ДК человека в инфекции лейшмании для дальнейшего понимания того, как эти клетки влияют на исходы заболевания.
протокол
Примечание: Клетки были получены от здоровых добровольцев-доноров. Описанная в настоящем документе процедура была одобрена Национальным комитетом по этике (номер 2.751.345) - Фиокрус, Баия, Бразилия).
1. Дифференцировка дендритных клеток человека
- Пипетка 10 мл смеси полисахарозы и триазотата натрия в конических пробирках по 50 мл.
- Промаркируйте конические пробирки объемом 50 мл соответственно для каждого донора.
- Соберите 30 мл крови от здоровых доноров и выполняйте все последующие шаги в колпаке ламинарного потока.
- Осторожно перелейте кровь в конические трубки и разведите кровь в физрастворе (0,9% натрия хлорида) в соотношении 1:1 при комнатной температуре.
- Медленно разбавленную кровь наложите на смесь полисахарозы и триазотата натрия в пробирках (шаг 1.1). Центрифугируйте пробирки один раз при 400 × г в течение 30 мин при 25 °C.
ПРИМЕЧАНИЕ: Перед центрифугированием выключите тормоз, чтобы предотвратить смешивание слоев градиента. После первого центрифугирования снизьте температуру в центрифуге до 4 °C. - Осторожно выньте пробирки из центрифуги.
- Ищите в образце кольцо, образованное мононуклеарными клетками периферической крови (PBMCs) (охристая шерсть); Осторожно отсасывайте остаточную плазму с помощью пипетки.
ПРИМЕЧАНИЕ: Центрифугирование приводит к образованию следующих градиентных слоев: эритроцитов, градиентной среды плотности, кольца PBMC и плазмы. Кольцо PBMC находится между градиентной средой плотности и слоями плазмы. - Переложите помутневший слой PBMC в другую пробирку и добавьте физиологический раствор до конечного объема 30 мл.
- Центрифугируйте пробирки, содержащие клеточные суспензии, при 250 × г в течение 10 мин при 4 °C. Выбросьте надосадочную жидкость и добавьте 1 мл физиологического раствора для ресуспендирования гранулы.
- Соберите аликвоту для подсчета клеток и разбавьте ее в соотношении 1:1 000. Используйте 10 мкл разбавленных клеток для подсчета клеток методом исключения трипанового синего с использованием камеры Нейбауэра для определения жизнеспособности клеток.
- Снова открутите суспензию при 200 × g в течение 10 минут при 4 °C.
- Ресуспендируйте гранулу в буфере для сортировки магнитных элементов (MACS). Используйте 80 мкл буфера на 1 × 107 клеток.
ПРИМЕЧАНИЕ: Состав буфера MACS см. в таблице 1. Держите буфер в холоде и храните его при температуре 2-8 °C. - Добавьте микрогранулы CD14 в клеточную суспензию, приготовленную на шаге 1.9. Используйте 20 мкл микрогранул CD14 на 1 × 107 клеток.
Микрогранулы CD14 используются для положительного отбора моноцитов человека из PBMC, поскольку гранулы, содержащие анти-CD14 человека, связываются с клетками CD14+ , экспрессируемыми на поверхности большинства моноцитов. - Проводите пипеткой вверх и вниз, чтобы равномерно суспендировать гранулы и микрогранулы. Держать на льду 15 минут.
- Центрифугируйте суспензию при 300 × г в течение 10 мин при 4 °C.
- Восстановите суспензию ячеек в буфере MACS. Используйте 1-2 мл на 1 ×10-7 клеток в клеточно-микрогранулярной смеси.
- Центрифугируйте суспензию при 300 × г в течение 10 мин при 4 °C.
- Удалите надосадочную жидкость и повторно суспендируйте гранулу в 500 мкл буфера MACS.
ПРИМЕЧАНИЕ: Это максимальный объем клеточной суспензии, который должен быть обработан в одной колонке. - Соберите магнитную колонку.
- Промойте колонку один раз 500 μл буфера MACS и дайте буферу протекать через колонку под действием силы тяжести.
ПРИМЕЧАНИЕ: Следите за тем, чтобы колонна не стала сухой, так как воздух может засорять колонну. - Добавьте 500 мкл суспензии клеточных гранул (шаг 1,19) на колонку. Дайте клеточной суспензии протекать под действием силы тяжести через колонну.
- Промойте колонку 500 μл буфера MACS (2x). Добавляйте свежий буфер только тогда, когда резервуар колонки пуст. Не допускайте пересыхания колонны.
- Поместите новую трубку под колонку, нанесите пипетку объемом 1 мл буфера MACS на колонку и немедленно промойте магнитно помеченные ячейки из колонки, сильно нажав на поршень.
- Центрифугируйте обогащенные CD14 клетки при 300 × г в течение 10 мин при 4 °C.
- Подсчитайте ячейки с помощью камеры Нейбауэра.
- Ресуспендируйте клетки в 1 мл полной RPMI со 100 мкл/мл интерлейкина-4 (IL-4) ( (50 нг/мл) + гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) (50 нг/мл).
- Затравливают клетки на 24-луночном планшете в концентрации 2 × 105 клеток на лунку в 500 мкл полной среды RPMI, содержащей вышеуказанные цитокины, и инкубируют в течение 7 суток при 37 °С.
2. Культура лейшмании
ПРИМЕЧАНИЕ: В этом анализе использовались паразиты L. amazonensis (MHOM/BR88/Ba-125).
- Поддерживайте промастиготы на кровяной агаровой среде Нови-Николь-Макнил (NNN) с помощью 5 мл полной среды Schneider или минимально незаменимой среды (MEM) в 25см 2-х культурального флакона в инкубаторе с биопотребностью в кислороде (БПК) при температуре 24 °C.
ПРИМЕЧАНИЕ: Для культивирования промастиготной формы вида L. amazonensis использовали 5 мл полной среды Schneider (Schneider ́s Insect Medium, содержащей 10% инактивированной фетальной бычьей сыворотки (FBS) и гентамицин в концентрации 50 мкг/мл). - Инкубировать в течение 7 дней при температуре 24 °C в инкубаторе БПК.
- Пипеткой внесите 100 мкл культуры промастиготы в новую колбу для клеточных культур размером 25см2 .
- Добавьте 5 мл дополненного МЭМ.
- Инкубировать при температуре 24 °C в инкубаторе БПК и периодически подсчитывать промастиготы, перенося аликвоту разбавленной физиологическим раствором суспензии клеток паразита в камеру Нейбауэра (т.е. гемоцитометр) до тех пор, пока не будет достигнута стационарная фаза.
ПРИМЕЧАНИЕ: Не используйте для экспериментов первый проход после NNN Medium. - Переложите 1 × 105 промастиготов неподвижной фазы роста Leishmania в новую колбу для клеточной культуры размером 25см2 и добавьте 5 мл дополненного MEM.
- Периодически контролируйте рост культур с помощью камеры Нейбауэра до тех пор, пока не будет достигнута неподвижная фаза.
ПРИМЕЧАНИЕ: Используйте промастиготные культуры до 7 пассажей in vitro , чтобы избежать потери вирулентности.
3. Инфекция лейшмании
- После проверки роста в стационарной фазе культивируемых паразитов извлеките все содержимое из бутылок с культурами и поместите их в конические пробирки объемом 50 мл. Добавьте холодный солевой раствор для достижения конечного объема 30 мл.
- Центрифугировать в течение 10 мин при 4 °C при 1 600 × г три раза. Выбросьте надосадочную жидкость после центрифугирования и повторно суспендируйте гранулу в холодном физиологическом растворе.
- Промойте клетки, чтобы удалить любых нежизнеспособных паразитов, и повторно суспендируйте гранулу в 1 мл холодного физиологического раствора. Медленно пропустите суспензию 5 раз через шприц объемом 1 мл с иглой 16 G, чтобы разделить скопления паразитов.
- Удалите аликвоту из образца для подсчета концентрации паразита в гемоцитометре с помощью уравнения (1).
Концентрация паразитов = среднее значение паразитов в 4 квадрантах × коэффициента разбавления × 104 (1) - Рассчитать количество Leishmania sp. требуется для того, чтобы количество клеток-хозяев было покрыто для поддержания соотношения паразитов и клеток хозяина 10:1 (шаг 1,27).
- Промойте ДК, добавив 1 мл физиологического раствора и трижды центрифугируя клетки при 300 × г в течение 10 минут при комнатной температуре.
- Поместите необходимый объем Leishmania в каждую лунку 24-луночного планшета для культивирования клеток (см. шаг 3.5).
- Инкубировать ДК с паразитами в течение 4 ч в инкубаторе при температуре 37 °C в атмосфере 5%CO2 .
4. Иммуноокрашивание для анализа проточной цитометрии
- После заражения дважды промойте клетки 1 мл физиологического раствора, чтобы удалить любых неинтернализованных паразитов.
ПРИМЕЧАНИЕ: Панель с клонами антител и флуорохромами указана в Таблице материалов. - Разведите антитела (1:50) в буфере для сортировки клеток, активируемых флуоресценцией (FACS) (1x PBS с 1% BSA) в конечном объеме 50 мкл на экспериментальное условие.
ПРИМЕЧАНИЕ: Важно титровать антитела перед экспериментом, чтобы обеспечить оптимальные концентрации окрашивания. В этом протоколе 1:50 использовалось после экспериментов по титрованию. - Приготовьте мастер-смесь (1x PBS с 1% BSA + смесь антител). Вортекс и пипетка вводят 50 мкл смеси в лунки, содержащие клетки.
- Кратковременно инкубируйте ДК со смесью антител (античеловеческий CD1a, античеловеческий CCR7, античеловеческий CD83, анти-CD11c, античеловеческий CD209, античеловеческий HLA-DR) на льду в течение 30 мин, защищенном от света.
- Дважды промойте ячейки 1 мл буфера для холодного окрашивания (1% FBS в 1x PBS) и центрифугируйте при 300 × г в течение 5 минут при 4 °C.
- Отсадите надосадочную жидкость и ресуспендируйте гранулу в 200 мкл буфера для холодного окрашивания.
- Приступайте к сбору данных на проточном цитометре.
ПРИМЕЧАНИЕ: Для обеспечения оптимальных условий для анализа FACS сбор данных должен быть выполнен в течение 48 часов после окрашивания образца. Данные были проанализированы с помощью программного обеспечения FlowJo.- Откройте программу FlowJo и создайте новое рабочее пространство. Добавьте файлы проточной цитометрии для анализа, перетащив их в окно рабочей области.
- Нажмите на название трубки , чтобы выбрать параметры бокового рассеяния (SSC) и прямого рассеяния (FSC).
Проточный цитометрический анализ созревания ДК был основан на экспрессии CD1a, CD11c, CD80, CCR7, CD209 и HLA-DR. - С помощью инструмента « Стробирование полигонов » нарисуйте ворота вокруг распределительных центров. Дважды щелкните по выбранным ячейкам ворот, чтобы отобразить новое окно. Выполните очистку дублетов, выбрав параметры FSC-A и FSC-H. С помощью инструмента « Многоугольник » нарисуйте новый график вокруг отдельных ячеек.
- Дважды щелкните по стробируемым ячейкам и выберите параметры SSC и CD11c, чтобы создать вентиль, содержащий клетки CD11c+ .
- Экспортируйте очищенный шлюз ячейки CD11c+ , выбрав его. Щелкните правой кнопкой мыши по воротам и выберите опцию «Выбрать эквивалентные узлы ». Щелкните правой кнопкой мыши и экспортируйте ворота вместе со всеми компенсированными параметрами, сохранив их в недавно созданную папку.
- Создайте новую рабочую область, открыв недавно сохраненные файлы. Нажмите на «Рабочее пространство» и выберите плагины | Даунсэмплинг | от 30 000 до 50 000 мероприятий; нажмите OK.
ПРИМЕЧАНИЕ: Поскольку TSNE является трудоемким и вычислительно сложным процессом, этот шаг рекомендуется для уменьшения общего количества анализируемых событий. - Щелкните правой кнопкой мыши файл с уменьшенной дискретизацией и выберите эквивалентные узлы.
- Щелкните правой кнопкой мыши файл с уменьшенной дискретизацией и выберите «Экспорт/конкатенация».
- Нажмите на окно конкатената и выберите все компенсированные параметры. Выберите объединенные файлы и нажмите на workspace | plugin | tSNE.
- Выберите нужные параметры (CD1a, HLA-DR, CCR7, CD80, CD209 и CD11c) для создания кластеров. Нажмите OK.
- Щелкните по объединенному файлу, чтобы визуализировать параметры tSNE1 и tSNE2.
5. Иммуноокрашивание актином
- Планшеты заражены ДК на покровных листах, помещенных в 24-луночные планшеты. Центрифугируйте планшеты при 300 × г при 4 °C в течение 10 минут. Промойте клетки 3 раза стерильным физиологическим раствором после заражения при комнатной температуре, чтобы удалить любых внеклеточных паразитов.
- Инкубируйте ДК с 500 мкл 4% параформальдегида в течение 15 минут при комнатной температуре. Удалите параформальдегид и добавьте 1 мл физиологического раствора (см. Таблицу 1).
6. Иммуномаркировка
ПРИМЕЧАНИЕ: Выполните следующие действия во время перемешивания.
- Промойте покровные стекла 1x PBS в течение 5 минут; Повторите 3 раза. Добавить 500 мкл раствора хлорида аммония на лунку; Выдерживать 10 мин при комнатной температуре.
- Промойте покровные стекла 1x PBS в течение 5 минут; Повторите 3 раза.
- Пропитайте мембрану 0,15% сапонином в течение 15 минут.
- Блокировать на 1 ч 1x PBS 1x/3% BSA/0,15% сапонина. Промойте покровные стекла 1x PBS/0,15% сапонином в течение 5 минут; Повторите 3 раза.
- Инкубируйте клетки в течение 1 ч с фаллоидином (1:1,200], разведенным в 1x PBS/1% BSA/0,15% сапонина. Промойте покровные стекла 1x PBS/0,15% сапонином в течение 5 минут; Повторите 3 раза.
- Поместите покровные стекла ячейками вниз на монтажный носитель с 4',6-диамидино-2-фенилиндолом (DAPI). Накройте горки алюминиевой фольгой, чтобы защитить их от света.
- Получение изображений с помощью конфокального флуоресцентного микроскопа с объективом 63x/1,4.
7. Получение данных с помощью конфокальной микроскопии и количественная оценка на Фиджи
- Получение иммунофлуоресцентных изображений с помощью конфокального лазерного сканирующего микроскопа (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Для достижения наилучшего разрешения используйте объектив с 63-кратным увеличением и масляной иммерсией. - Защитите покровные стекла от света и оставьте их при комнатной температуре не менее чем на 30 минут перед приобретением.
- Используйте впитывающую ткань для очистки покровных стекол. Добавьте каплю иммерсионного масла на объектив и поместите предметное стекло на предметный столик микроскопа. Выберите объектив 63x с маслом, поднимите платформу, пока масло не коснется предметного стекла, и отрегулируйте фокусировку на микроскопе.
- Откройте программу и активируйте длины волн лазера 488, 552 и 405 нм.
- Установите разрешение изображения на 1024 x 1024 пикселей.
- Нажмите на кнопку внизу, установите стек Z и нажмите Begin. Повторите этот процесс, а затем нажмите кнопку «Завершить ».
- Дождитесь завершения получения изображения, а затем выберите в инструментах параметр «Максимальная проекция».
- Сохраните эксперимент и экспортируйте изображения в формате .lif на компьютер.
- Откройте программу FIJI, запустите эксперимент в FIJI и установите стек представлений в значение Hyperstack.
- Выбор открытых файлов изображений по отдельности | сшивание плиток.
- Выберите инструмент «Свободная рука » на панели инструментов «Фиджи » и тщательно обведите каждую ячейку вручную. Нажмите «Анализ» | «Измерить » для визуализации интенсивности флуоресценции. Повторите этот процесс для каждого типа ячеек в группе.
- Сохраните измерения и экспортируйте их в таблицу. Откройте файл с данными с помощью программы статистического анализа (см. Таблицу материалов) для выполнения статистического анализа.
8. Статистический анализ
- Откройте новый проект в программе.
- Для данных с нормальным распределением используйте t-критерий Стьюдента; для непараметрических данных используйте U-критерий Манна-Уитни .
- Вставьте значения, полученные из экспериментальных результатов, в таблицу.
- Выберите описательную статистику и выберите опцию столбец статистики [все тесты] для анализа распределения данных.
ПРИМЕЧАНИЕ: Если данные следуют распределению Гаусса, выберите t-критерий для изучения образцов путем сравнения двух пар. Если распределение не является гауссовым, проанализируйте данные с помощью U-критерия Манна-Уитни с центральными мерами тенденций (средними или медианами) и мерами вариации. - Выберите оптимальный вариант графика для оптимального представления данных.
Результаты
В этом отчете исследуется роль ДК в инфекции Leishmania с использованием проточной цитометрии и конфокальной микроскопии. Первоначально был установлен фенотипический профиль ДК, полученного из моноцитов человека. Примечательно, что полученные популяции дендритных клеток CD11c+ были положительными на CCR7, CD209, CD80, CD1a и HLA-DR. Результаты показывают, что экспрессия этих маркеров в популяциях ДК глубоко зависит от инфекции Leishmania. Инфицированные ДК демонстрировали усиленную экспрессию CD80, CD209, CCR7 и HLA-DR. Тем не менее, подавление CD1a также наблюдалось у инфицированных L.amazonensis ДК. Кроме того, анализ главных компонент выявил существенные различия в экспрессии этих молекул (рис. 1B-D). Алгоритм T-распределенного стохастического встраивания соседей (t (tSNE), метод уменьшения размерности, был использован для лучшей визуализации того, как инфекция Leishmania влияет на экспрессию молекул, связанных с созреванием.
Следует отметить, что графики плотности tSNE показывают, что инфицированные ДК демонстрируют дифференциальную экспрессию HLA-DR и CD80, что еще больше свидетельствует об усилении регуляции молекул, участвующих в презентации антигена (рис. 2). Для визуализации ДК иммуноокрашивание F-актином проводили путем мечения клеток флуоресцентным фаллоидином. Для наблюдения за инфекцией L. amazonensis внутри ДК использовали ядерное окрашивание (DAPI) для сравнения инфицированных лейшманией клеток с неинфицированными клетками (рис. 3). Кинетический анализ hDC-инфекции с участием L. amazonensis promastigotes (10:1) показывает процент инфицированных клеток и количество паразитов на инфицированную клетку через 4 ч после заражения. Затем клетки промывали и повторно инкубировали в течение 6, 12 или 24 часов. В среднем в ~55% инфицированных клеток наблюдалось 4-5 паразитов на один ДК.

Рисунок 1: Маркерная характеристика ДК человека после инфекции Leishmania amazonensis; стратегия гейтирования для выбора CD11c+. (А) Оценка костимулирующей молекулы MFI. (B) Тепловая карта и (C) Анализ главных компонент значений MFI костимулирующих молекул. (D) Репрезентативные гистограммы и диаграммы рассеяния, отображающие MFI для каждой молекулы. Сокращения: DC = дендритная ячейка; MFI = медианная интенсивность флуоресценции; SSC-A = область бокового рассеяния; FSC-A = область прямого рассеяния; FSC-H = высота разброса вперед. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
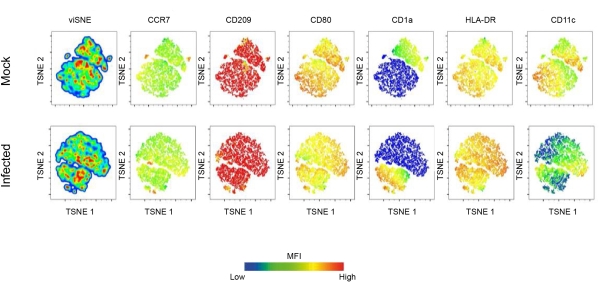
Рисунок 2: Поверхностная молекулярная экспрессия ДК, индуцированная лейшманией.Углубленная характеристика ландшафта созревания ДК, вызванного инфекцией Leishmania. Вкратце, моноцитарные ДК были получены после 7 дней дифференцировки с GM-CSF и IL-4. Полностью дифференцированные ДК были инфицированы L. amazonensis, а затем окрашены панелью созревающих антител FACS. TSNE, метод уменьшения размерности, был использован для выполнения многомерного анализа данных проточной цитометрии. Сокращения: DC = дендритная клетка; GM-CSF = гранулоцитарно-макрофагальный колониестимулирующий фактор; FACS = сортировка клеток, активируемых флуоресценцией; ИЛ-4 = интерлейкин-4; TSNE = Т-распределенное стохастическое вложение соседей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Инфекция hDC Leishmania amazonensis. Дендритные клетки человека инфицировали L. amazonensis (10:1) в течение 4 ч, промывали и мечили фаллоидином. (А) Флуоресценция мечения F-актина у инфицированных или неинфицированных hDC. Грин, F-актин; синий, DAPI для ядерного окрашивания hDCs и ядер паразитов Leishmania ; желтые стрелки представляют амастигот внутри клетки; белые стрелки представляют hDCs, F-актин; оттенки серого, DIC. (B) Процент инфекции и паразитарной нагрузки в 400 клетках, случайно оцененный с помощью флуоресцентной микроскопии (проанализирован с помощью Anova). Масштабные линейки = 25 μм. Сокращения: hDC = дендритная клетка человека; DAPI = 4',6-диамидино-2-фенилиндол; DIC = дифференциальный интерференционный контраст. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Буфер MACS |
| ЭДТА 2 мМ |
| PBS 1x |
| БСА 0,5% |
| Фосфатно-солевой буфер (PBS) 1x |
| Раствор хлорида аммония: 0,134 г NH4Cl |
| Сапонин 15% |
| 150 мг сапонина в 1 мл 1x PBS |
| 1 мл 15% сапонина в 100 мл 1x PBS |
| 10% Бычий сывороточный альбумин |
| 100 мг – 1 мл → 10% |
| 1 г – 100 мл → 1% |
| Для 10% BSA - 1 г BSA в 10 мл 1x PBS |
| 1x PBS / 1% BSA / 0,15% сапонин: 20 мл 1x PBS 2 мл 10% BSA 200 мкл 15% сапонина |
| 1x PBS / 3% BSA / 0,15% сапонин: 20 мл 1x PBS; 6 мл 10% BSA; 200 мкл 15% сапонин |
| 1x PBS / 0,3% BSA / 0,15% сапонин: 20 мл PBS; 0,6 мл 10% БСА; 200 мкл 15% сапонина |
Таблица 1: Составы растворов, используемых в данном протоколе.
Обсуждение
Лейшманиоз является серьезной проблемой общественного здравоохранения во всем мире. Патогенез этого заболевания довольно сложен, и механизмы, способствующие выживанию паразитов в позвоночных организмах-хозяевах, остаютсянеясными17. ДК — это профессиональные антигенпрезентирующие клетки, обнаруженные по всему организму, включая фильтрующие и лимфоидные органы. После захвата и обработки антигенов незрелые ДК подвергаются сложному процессу созревания, кульминацией которого является их миграция в лимфатические узлы, где эти клетки отвечают за представление антигенов Т-лимфоцитам18. Этот процесс созревания характеризуется повышенной экспрессией молекул MHC класса II, в частности CD11c, CD86, CD80 и CD1a19. При лейшманиозе моноцитарные ДК фагоцитозно паразитируют и доставляют груз к дЛН, индуцируя презентацию антигена к Т-клеткам13.
В данной статье описан краткий протокол, который позволяет исследовать влияние лейшмании на иммунобиологическое функционирование ДК в модели инфекции in vitro . Этот протокол включает в себя использование самых современных иммунологических методов, включая получение и дифференцировку моноцитов человека в ДК, а также характеристику ДК с помощью проточной цитометрии и конфокальноймикроскопии. Первоначально моноциты были очищены из ПБМК здоровых доноров. Использование метода положительной селекции, такого как античеловеческие микрогранулы CD14, обеспечивает высокую степень чистоты (>95%) дифференцированных моДХ. Эти клетки инкубируют с античеловеческими микрогранулами CD14, которые связывают антитело с CD14-положительными клетками в образце, которые затем разделяются высокоградиентным магнитным полем внутри колонки магнитного сепаратора20.
Примечательно, что дифференцировка моноцитов человека в ДК in vitro требует добавления GM-CSF и IL-4. GM-CSF является плейотропным фактором роста, который не только подавляет экспрессию макрофагального колониестимулирующего фактора (M-CSF), но и ингибирует M-CSF-индуцированную дифференцировку в макрофаги. Кроме того, IL-4 действует путем ингибирования образования колоний макрофагов, что считается подходящим методом для культивирования moDCs in vitro 21. Настоящий протокол предлагает использовать проточную цитометрию для оценки дифференцировки DC путем анализа экспрессии маркеров, связанных с созреванием, таких как CCR7, CD209, CD80, CD1a, HLA-DR и CD11c. Кроме того, методы многомерной проточной цитометрии (например, t-SNE) используются для точной идентификации паттернов экспрессии, на которые повлияла инфекция Leishmania 22. Крайне важно оптимизировать разведение антител во время иммуноокрашивания.
Конфокальная микроскопия является отличным инструментом для анализа и количественной оценки интенсивности флуоресценции в клетках человека23. Важно отметить, что этот анализ требует тщательных манипуляций перед получением изображения, таких как аккуратная стирка покровных стекол и избегание воздействия света. Основным ограничением данного метода является получение подходящего разрешения изображения при конфокальной микроскопии, что требует опыта работы с микроскопическими манипуляциями. Тем не менее, этот метод может быть использован для изучения реакции ДК на инфекцию различными патогенами. В качестве альтернативы, шаги, описанные в этом протоколе, также могут быть экстраполированы на другие модели патогенной инфекции.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Благодарим за помощь Институт Гонсалу Мониша (IGM-Fiocruz) (Баия, Бразилия) и отдел микроскопии. Авторы выражают благодарность Андрису К. Вальтеру за критический анализ, редактирование английского языка и помощь в редактировании рукописей.
Материалы
| Name | Company | Catalog Number | Comments |
| anti CCR7 | Thermo | ||
| anti CD209 | Isofarma | ||
| anti CD83 | Leica SP8 | ||
| anti HLA-DR | Gibco | ||
| Bovine serum albumin | Thermo | A2153-100G | Sigma |
| Ciprofloxacin | Gibco | ||
| confocal microscope | Thermo Fisher Scientific | ||
| Fetal bovine serum | Gibco | ||
| Flow Jo | Thermo Fisher Scientific | ||
| Gentamicin | Thermo Fisher Scientific | ||
| Glutamin | Gibco | ||
| HEPES | Thermo Fisher Scientific | ||
| phalloidin | Thermo Fisher Scientific | ||
| Phosphate buffer solution | Peprotech | ||
| prolong gold antifade kit | BD pharmigen | ||
| RPMI | BD pharmigen | ||
| Saponin | BD pharmigen | 47036 – 50G – F | Sigma |
| Schneider's insect medium | software BD biosciences |
Ссылки
- Torres-Guerrero, E., Qunitanilla-Cedillo, M. R., Ruiz-Esmenhjaud, J., Arenas, R. Leishmaniasis: a review. F1000 Research. 6, 750 (2017).
- Pace, D. Leishmaniasis. Journal of Infection. 69, 10-18 (2014).
- Reithinger, R., et al. Cutaneous leishmaniasis. Lancet. Infectious Diseases. 7 (9), 581-596 (2007).
- Kaye, P., Scott, P. Leishmaniasis: complexity at the host-pathogen interface. Nature Reviews. Microbiology. 9 (8), 604-615 (2011).
- Handman, E., Bullen, D. V. Interaction of Leishmania with the host macrophage. Trends in Parasitology. 18 (8), 332-334 (2002).
- Burza, S., Croft, S. L., Boelaert, M. Leishmaniasis. Lancet. 392 (10151), 951-970 (2018).
- Kamhawi, S. Phlebotomine sand flies and Leishmania parasites: friends or foes. Trends in Parasitology. 22 (9), 439-445 (2006).
- Guilliams, M., et al. Unsupervised high-dimensional analysis aligns dendritic cells across tissues and species. Immunity. 45 (3), 669-684 (2016).
- Moll, H. Dendritic cells and host resistance to infection. Cellular Microbiology. 5 (8), 493-500 (2003).
- Sundquist, M., Rydstrom, A., Wick, M. J. Immunity to Salmonella from a dendritic point of view. Cellular Microbiology. 6 (1), 1-11 (2004).
- Saban, D. The chemokine receptor CCR7 expressed by dendritic cells: A key player in corneal and ocular surface inflammation. Ocular Surface Journal. 12, 87-99 (2014).
- Relloso, M., et al. DC-SIGN (CD209) Expression is IL-4 dependent and it is negatively regulated by IFN, TGF and inflammatory agents. Journal of Immunology. 168 (6), 2634-2643 (2002).
- Leon, B., Lopez-Bravo, M., Ardavin, C. Monocyte-derived dendritic cells formed at the infection site control the induction of protective T helper 1 responses against Leishmania. Immunity. 26 (4), 519-531 (2007).
- Gordon, S. Phagocytosis: An immunobiologic process. Immunity. 44 (3), 463-475 (2016).
- Ashok, D., Acha-Orbea, H. Timing is everything: dendritic cell subsets in murine Leishmania infection. Trends in Parasitology. 30 (10), 499-507 (2014).
- Carvalho, A. K., et al. Leishmania (V.) braziliensis and L. (L.) amazonensis promote differential expression of dendritic cells and cellular immune response in murine model. Parasite Immunology. 34 (8-9), 395-403 (2012).
- Bates, P. A. Transmission of Leishmania metacyclic promastigotes by phlebotomine sand flies. International Journal of Parasitology. 37 (10), 1097-1106 (2007).
- Cervantes-Barragan, L., et al. Plasmacytoid dendritic cells control T-cell response to chronic viral infection. Proceedings of the National Academy of Sciences of the United States of America. 109 (8), 3012-3017 (2012).
- Caux, C., et al. Activation of human dendritic cells through CD40 cross-linking. Journal of Experimental Medicine. 180 (4), 1263-1272 (1994).
- Suzuki, H., et al. Activities of granulocyte-macrophage colony-stimulating factor and interleukin-3 on monocytes. American Journal of Hematology. 75 (4), 179-189 (2004).
- Akira, S., Takeda, K. Toll-like receptor signalling. Nature Reviews. Immunology. 4 (7), 499-511 (2004).
- McKinnon, K. M. Flow cytometry: An overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Sanderson, M. J., et al. Fluorescence microscopy. Cold Spring Harbor Protocols. 10, 1795 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены