Method Article
In vitro Diferenciación de células dendríticas humanas y sus marcadores en la infección por Leishmania
En este artículo
Resumen
Las células dendríticas (CD) son componentes esenciales de la inmunidad innata contra la infección por Leishmania. Los mecanismos que subyacen a la compleja interacción entre las CD y la Leishmania siguen siendo poco conocidos. Aquí, describimos métodos para evaluar cómo la infección por Leishmania afecta la función inmunobiológica de las CD humanas, como la expresión de moléculas coestimuladoras y relacionadas con la migración.
Resumen
La leishmaniasis comprende un conjunto de manifestaciones clínicas asociadas a la infección de protozoos intracelulares obligados, Leishmania. El ciclo de vida de los parásitos de Leishmania consta de dos etapas de vida alternas (amastigotes y promastigotes), durante las cuales los parásitos residen dentro de los artrópodos vectores o vertebrados huéspedes, respectivamente. En particular, las complejas interacciones entre los parásitos de Leishmania y varias células del sistema inmunitario influyen en gran medida en el resultado de la infección. Es importante destacar que, aunque se sabe que los macrófagos son el principal nicho de huéspedes para la replicación de Leishmania , los parásitos también son fagocitados por otras células inmunitarias innatas, como los neutrófilos y las células dendríticas (CD).
Las CD desempeñan un papel importante en la conexión de las ramas innata y adaptativa de la inmunidad y, por lo tanto, orquestan respuestas inmunitarias contra una amplia gama de patógenos. Los mecanismos por los cuales la Leishmania y las DC interactúan siguen sin estar claros e involucran aspectos de la captura de patógenos, la dinámica de la maduración y activación de las DC, la migración de las DC a los ganglios linfáticos drenantes (dLN) y la presentación de antígenos a las células T. Aunque una gran cantidad de estudios apoyan la idea de que las CD desempeñan un doble papel en la modulación de las respuestas inmunitarias contra la Leishmania, la participación de estas células en la susceptibilidad o resistencia a la Leishmania sigue siendo poco conocida. Después de la infección, las CD experimentan un proceso de maduración asociado con la regulación positiva del complejo mayor de histocompatibilidad (MHC) II de superficie, además de las moléculas coestimuladoras (a saber, CD40, CD80 y CD86).
Comprender el papel de las CD en el resultado de la infección es crucial para desarrollar estrategias terapéuticas y profilácticas que modulen la respuesta inmunitaria contra la Leishmania. En este trabajo se describe un método para la caracterización de la interacción Leishmania-DC. Este protocolo detallado proporciona orientación a lo largo de los pasos de la diferenciación de las CD, la caracterización de las moléculas de la superficie celular y los protocolos de infección, lo que permite a los científicos investigar la respuesta de las CD a la infección por Leishmania y obtener información sobre las funciones que desempeñan estas células en el curso de la infección.
Introducción
La leishmaniasis constituye un complejo de enfermedades desatendidas causadas por diferentes especies del género Leishmania 1. Leishmania es un protozoo intracelular de la familia Trypanosomatidae que infecta a humanos y otros mamíferos, causando un espectro de enfermedades que van desde lesiones cutáneas hasta formas viscerales2. Las principales manifestaciones clínicas de esta enfermedad son la leishmaniasis tegumentaria (LT) y la leishmaniasis visceral (VL). La Organización Mundial de la Salud (OMS) estima que anualmente se producen entre 700.000 y 1 millón de nuevos casos, que causan 70.000 muertes cada año2. En todo el mundo, la leishmaniasis afecta aproximadamente a 12 a 15 millones de personas, y 350 millones están en riesgo de contraer la enfermedad3.
El género Leishmania presenta dos formas evolutivas: el promastigote y el amastigote4. Los promastigotes de Leishmania se caracterizan por la presencia de flagelos y alta motilidad. Estas formas se encuentran en el tracto digestivo del flebótomo, donde experimentan diferenciación en la forma infecciosa (promastigotes metacíclicos)5. Por el contrario, los amastigotes se encuentran en el entorno intracelular de las células de mamíferos infectadas. Esta forma evolutiva, a su vez, se replica en los fagolisosomas de las células fagocíticas6.
El ciclo de transmisión de Leishmania spp. comienza durante la alimentación sanguínea, cuando los flebótomos inoculan promastigotes metacíclicos en la piel del huésped1. Poco después de la inoculación de Leishmania , las células inmunitarias innatas, incluidos los neutrófilos y los macrófagos residentes en los tejidos, fagocitan los parásitos. Dentro de las vacuolas parasitóforas, los Leishmania se diferencian en amastigotes y se replican, culminando con la ruptura de la membrana de la célula huésped, lo que permite la infección de las células vecinas y la propagación del parásito4. El ciclo se completa cuando los flebotomines ingieren fagocitos que contienen amastigotes, que se diferencian en promastigotes procíclicos y posteriormente en promastigotes metacíclicos en el tracto intestinal del insecto7.
Las células dendríticas, células presentadoras de antígenos profesionales que se encuentran en los tejidos y los ganglios linfáticos, actúan como centinelas del sistema inmunitario8. Estas células se encuentran en tejidos periféricos en etapas inmaduras, involucradas principalmente en la captura y procesamiento de antígenos. Tras el contacto con patógenos, las CD experimentan un proceso de maduración que culmina con su migración a los ganglios linfáticos, presentando posteriormente antígenos a los linfocitos T CD4+ naïve. Estas células también son esenciales en la orquestación de las respuestas inmunitarias innatas y adaptativas que generan tolerancia o inflamación. El proceso de maduración de la DC implica varios aspectos, incluido el aumento de la expresión de MHC y moléculas coestimuladoras, como CD40 y CD86, así como una mayor secreción de citocinas. Las CD expresan diferentes marcadores, incluidos CD11b y CD11c, y, en los humanos, las DC que se originan a partir de monocitos CD14+ (moDC) expresan CD1a10. CCR7 se expresa en gran medida en las CD e indica el complejo proceso migratorio de estas células12. CD209 y CD80 también juegan un papel importante en el contacto inicial con las CD y los linfocitos13.
En la leishmaniasis, los estudios sugieren que las moDCs fagocitan los parásitos y los transportan a los ganglios linfáticos drenantes (dLN), donde presentan antígenos a las células T13. El mecanismo de captura del parásito está asociado a la reorganización del citoesqueleto por los filamentos de actina durante la fagocitosis, lo que promueve la internalización del parásito14. La mayoría de los estudios sobre las funciones ejercidas por las CD en la leishmaniasis se han centrado en L. major, L. amazonensis y L. braziliensis15. Curiosamente, los estudios in vivo de la infección por Leishmania han demostrado que el deterioro de la función de la CD se produce de una manera específica de la cepa del parásito.
Se ha demostrado que durante las primeras etapas de la infección por L. amazonensis , las CD exhiben una capacidad disminuida para restringir la infección por parásitos. Por el contrario, en un modelo experimental de infección por L. braziliensis , se demostró que las CD montaban respuestas inmunitarias apropiadas que restringían la supervivencia de Leishmania16. Los principales aspectos que se sabe que se asocian con respuestas diferenciales a la infección por Leishmania spp. son el grado de maduración y activación de las CD. Este artículo describe un método para investigar el papel que desempeñan las CD humanas en la infección por Leishmania para comprender mejor cómo estas células influyen en los resultados de la enfermedad.
Protocolo
NOTA: Las células se obtuvieron de donantes voluntarios sanos. El procedimiento descrito fue aprobado por el Comité Nacional de Ética (nº 2.751.345)-Fiocruz, Bahía, Brasil).
1. Diferenciación de células dendríticas humanas
- Pipetear 10 mL de mezcla de polisacarosa-triazoato de sodio en tubos cónicos de 50 mL.
- Etiquete los tubos cónicos de 50 mL respectivamente para cada donante.
- Recoja 30 ml de sangre de donantes sanos y realice todos los pasos posteriores en la campana de flujo laminar.
- Transfiera cuidadosamente la sangre a los tubos cónicos y diluya la sangre en solución salina (cloruro de sodio al 0,9%) en una proporción de 1:1 a temperatura ambiente.
- Superponga la sangre diluida lentamente sobre la mezcla de polisacarosa y triazoato de sodio en los tubos (paso 1.1). Centrifugar los tubos una vez a 400 × g durante 30 min a 25 °C.
NOTA: Apague el freno antes de la centrifugación para evitar la mezcla de capas degradadas. Después de la primera centrifugación, disminuya la temperatura a 4 °C en la centrífuga. - Saque con cuidado los tubos de la centrífuga.
- Busque el anillo formado por las células mononucleares de sangre periférica (PBMC) en la muestra (capa leucocitaria); Aspire el plasma residual con cuidado con una pipeta.
NOTA: La centrifugación conduce a la formación de las siguientes capas de gradiente: eritrocitos, medio de gradiente de densidad, anillo PBMC y plasma. El anillo PBMC se encuentra entre el medio de gradiente de densidad y las capas de plasma. - Transfiera la capa turbia de PBMC a otro tubo y agregue solución salina hasta un volumen final de 30 mL.
- Centrifugar los tubos que contienen las suspensiones celulares a 250 × g durante 10 min a 4 °C. Deseche el sobrenadante y agregue 1 mL de solución salina para resuspender el pellet.
- Recoge una alícuota para el recuento de células y dilúyela 1:1.000. Utilice 10 μL de las células diluidas para contar las células mediante el método de exclusión de azul de tripano utilizando una cámara de Neubauer para determinar la viabilidad celular.
- Vuelva a girar la suspensión a 200 × g durante 10 minutos a menos de 4 °C.
- Vuelva a suspender el pellet en el tampón de clasificación de células activadas magnéticamente (MACS). Utilice 80 μL del tampón por 1 × 107 células.
NOTA: Consulte la Tabla 1 para ver la composición del búfer MACS. Mantenga el tampón frío y guárdelo a 2-8 °C. - Agregue microperlas CD14 a la suspensión celular preparada en el paso 1.9. Utilice 20 μL de microesferas CD14 por 1 × 107 células.
NOTA: Las microesferas CD14 se utilizan para seleccionar positivamente monocitos humanos de PBMC, ya que las perlas que contienen anti-CD14 humano se unen a las células CD14+ expresadas en las superficies de la mayoría de los monocitos. - Pipetear hacia arriba y hacia abajo para resuspender los gránulos y las microperlas de manera uniforme. Mantener en hielo durante 15 min.
- Centrifugar la suspensión a 300 × g durante 10 min a 4 °C.
- Vuelva a suspender las celdas en el búfer MACS. Use 1-2 mL por 1 × 107 celdas en la mezcla de células y microperlas.
- Centrifugar la suspensión a 300 × g durante 10 min a 4 °C.
- Retire el sobrenadante y vuelva a suspender el pellet en 500 μL de tampón MACS.
NOTA: Este es el volumen máximo de la suspensión de celdas que se procesará en una columna. - Ensamble la columna magnética.
- Lave la columna una vez con 500 μL de tampón MACS y deje que el tampón fluya por gravedad a través de la columna.
NOTA: Tenga cuidado de no permitir que la columna se seque, ya que el aire puede obstruir la columna. - Añadir 500 μL de la suspensión de perlas (paso 1.19) por columna. Permita que la suspensión de la celda fluya por gravedad a través de la columna.
- Lave la columna con 500 μL de tampón MACS (2x). Agregue un búfer nuevo solo cuando el depósito de columna esté vacío. No deje que la columna se seque.
- Coloque un nuevo tubo debajo de la columna, pipetee 1 mL del tampón MACS en la columna e inmediatamente enjuague las celdas marcadas magnéticamente fuera de la columna empujando firmemente el émbolo.
- Centrifugar las células enriquecidas con CD14 a 300 × g durante 10 min a 4 °C.
- Cuente las celdas usando una cámara de Neubauer.
- Resuspender las células en 1 mL de RPMI completo con 100 μL/mL de interleucina-4 (IL-4) (50 ng/mL) + factor estimulante de colonias de granulocitos-macrófagos (GM-CSF) (50 ng/mL).
- Las células de siembra se colocan en una placa de 24 pocillos a una concentración de 2 × 105 células por pocillo en 500 μL de medio RPMI completo que contiene las citocinas anteriores e incuban durante 7 días a 37 °C.
2. Cultura Leishmania
NOTA: En este ensayo se utilizaron parásitos L. amazonensis (MHOM/BR88/Ba-125).
- Mantener los promastigotes en medio de agar sanguíneo Novy-Nicolle-MacNeal (NNN) con 5 mL de medio completo de Schneider o Medio Esencial Mínimo (MEM) en un frasco de cultivo de25 cm2 en una incubadora de demanda de biooxígeno (DBO) a 24 °C.
NOTA: Para cultivar la forma promastigota de la especie L. amazonensis , se utilizaron 5 mL del medio completo de Schneider (Schneider ́s Insect Medium que contiene 10% de suero fetal bovino inactivado (FBS) y gentamicina a una concentración de 50 μg/mL). - Incubar durante 7 días a 24 °C en la incubadora de DBO.
- Pipetear 100 μL de cultivo de promastigote en un nuevo matraz de cultivo celular de25 cm2 .
- Añadir 5 mL del MEM suplementado.
- Incubar a 24 °C en la incubadora de DBO y contar periódicamente los promastigotes transfiriendo una alícuota de suspensión de células de parásito diluida en solución salina a una cámara de Neubauer (es decir, hemocitómetro) hasta que se alcance la fase estacionaria.
NOTA: No utilice el primer pasaje después de NNN Medium para experimentos. - Transfiera 1 × 105 de promastigotes de la fase de crecimiento estacionaria de Leishmania a un nuevo matraz de cultivo celular de 25cm2 y agregue 5 mL del MEM suplementado.
- Monitorizar periódicamente el crecimiento de los cultivos utilizando una cámara de Neubauer hasta alcanzar la fase estacionaria.
NOTA: Utilice cultivos promastigotes hasta por 7 pasadas in vitro para evitar la pérdida de virulencia.
3. Infección por Leishmania
- Después de verificar el crecimiento en fase estacionaria de los parásitos cultivados, retire todo el contenido de los frascos de cultivo y colóquelos en tubos cónicos de 50 mL. Agregue solución salina fría para lograr un volumen final de 30 mL.
- Centrifugar durante 10 min a 4 °C a 1.600 × g tres veces. Deseche el sobrenadante después de la centrifugación y vuelva a suspender el pellet en una solución salina fría.
- Lave las células para eliminar cualquier parásito no viable y vuelva a suspender el pellet en 1 ml de solución salina fría. Pase la suspensión 5 veces lentamente a través de una jeringa de 1 mL provista de una aguja de 16 G para separar los grupos de parásitos.
- Extraiga una alícuota de la muestra para contar la concentración de parásitos en un hemocitómetro utilizando la Ec (1).
Concentración de parásitos = media de parásitos en 4 cuadrantes × factor de dilución × 104 (1) - Calcula la cantidad de Leishmania sp. Necesario para que el número de células huésped que se van a sembrar mantenga una proporción de parásitos: células huésped de 10:1 (paso 1.27).
- Lave las CD añadiendo 1 ml de solución salina y centrifugando las células tres veces a 300 × g durante 10 min a temperatura ambiente.
- Coloque el volumen requerido de Leishmania en cada pocillo de la placa de cultivo celular de 24 pocillos (ver paso 3.5).
- Incubar las CD con parásitos durante 4 h en una incubadora a 37 °C en una atmósfera con 5% deCO2 .
4. Inmunotinción para el análisis de citometría de flujo
- Después de la infección, lave las células dos veces con 1 ml de solución salina para eliminar cualquier parásito no internalizado.
NOTA: El panel con clones de anticuerpos y fluorocromos se enumera en la Tabla de Materiales. - Diluir anticuerpos (1:50) en tampón de clasificación celular activada por fluorescencia (FACS) (1x PBS con 1% de BSA) a un volumen final de 50 μL por condición experimental.
NOTA: Es importante valorar los anticuerpos antes de la experimentación para garantizar concentraciones óptimas de tinción. En este protocolo, se utilizó 1:50 después de los experimentos de valoración. - Prepare una mezcla maestra (1x PBS con 1% de BSA + mezcla de anticuerpos). Vórtice y pipeteo 50 μL de la mezcla en pocillos que contienen celdas.
- Incubar brevemente las CD con la mezcla de anticuerpos (anti-CD1a humano, anti-CCR7 humano, anti-CD83 humano, anti-CD11c, anti-CD209, anti-HLA-DR humano) en hielo durante 30 min, protegido de la luz.
- Lavar las celdas dos veces con 1 ml de tampón de tinción en frío (1% de FBS en 1x PBS) y centrifugar a 300 × g durante 5 min a 4 °C.
- Aspirar el sobrenadante y volver a suspender el pellet en 200 μL de tampón de tinción en frío.
- Proceda con la adquisición de datos en un citómetro de flujo.
NOTA: Para garantizar las condiciones óptimas para el análisis FACS, la adquisición de datos debe realizarse dentro de las 48 horas posteriores a la tinción de la muestra. Los datos se analizaron con el software FlowJo.- Abra el programa de software FlowJo y cree un nuevo espacio de trabajo. Añada los archivos de citometría de flujo que se van a analizar arrastrándolos a la ventana del espacio de trabajo.
- Haga clic en el nombre del tubo para seleccionar los parámetros de dispersión lateral (SSC) y dispersión directa (FSC).
NOTA: El análisis citométrico de flujo de la maduración de DC se basó en la expresión de CD1a, CD11c, CD80, CCR7, CD209 y HLA-DR. - Con la herramienta de compuerta poligonal , dibuje una puerta alrededor de los DC. Haga doble clic en las celdas cerradas seleccionadas para mostrar una nueva ventana. Realice la limpieza de dobletes seleccionando los parámetros FSC-A y FSC-H. Con la herramienta Polígono , dibuje un nuevo trazado alrededor de celdas individuales.
- Haga doble clic en las celdas cerradas y seleccione los parámetros SSC y CD11c para generar una puerta que contenga celdas CD11c+ .
- Exporte la puerta de celda CD11c+ limpia seleccionándola. Haga clic con el botón derecho en la puerta y seleccione la opción Seleccionar nodos equivalentes . Haga clic con el botón derecho y exporte la puerta junto con todos los parámetros compensados guardándola en una carpeta creada recientemente.
- Cree un nuevo espacio de trabajo abriendo los archivos guardados recientemente. Haz clic en Espacio de trabajo y selecciona plugins | Reducción de muestra | de 30.000 a 50.000 eventos; presione OK.
NOTA: Dado que TSNE es un proceso que requiere mucho tiempo y desde el punto de vista computacional, se recomienda este paso para reducir el número total de eventos analizados. - Haga clic con el botón derecho en un archivo con resolución reducida y seleccione los nodos equivalentes.
- Haga clic con el botón derecho en un archivo con resolución reducida y seleccione Exportar/concatenar.
- Haga clic en la ventana de concatenación y seleccione todos los parámetros compensados. Seleccione los archivos concatenados y haga clic en workspace | plugin | tSNE.
- Seleccione los parámetros deseados (CD1a, HLA-DR, CCR7, CD80, CD209 y CD11c) para crear clústeres. Presione Aceptar.
- Haga clic en el archivo concatenado para visualizar los parámetros tSNE1 y tSNE2.
5. Inmunotinción de actina
- Placa de DC infectadas en cubreobjetos colocados en placas de 24 pocillos. Centrifugar las placas a 300 × g a 4 °C durante 10 min. Lave las células 3 veces con solución salina estéril después de la infección a temperatura ambiente para eliminar cualquier parásito extracelular.
- Incubar los CD con 500 μL de paraformaldehído al 4% durante 15 min a temperatura ambiente. Retire el paraformaldehído y agregue 1 mL de solución salina (ver Tabla 1).
6. Inmunomarcaje
NOTA: Realice los siguientes pasos bajo agitación.
- Lave los cubreobjetos con 1x PBS durante 5 min; Repita 3 veces. Añadir 500 μL de solución de cloruro de amonio por pocillo; Incubar durante 10 min a temperatura ambiente.
- Lave los cubreobjetos con 1x PBS durante 5 min; Repita 3 veces.
- Permeabilizar la membrana con saponina al 0,15% durante 15 min.
- Bloquear durante 1 h con 1x PBS 1x/3% BSA/0,15% saponina. Lave los cubreobjetos con 1x PBS/saponina al 0,15% durante 5 min; Repita 3 veces.
- Incubar las células durante 1 h con faloidina (1:1.200) diluida en 1x PBS/1% BSA/0,15% saponina. Lave los cubreobjetos con 1x PBS/saponina al 0,15% durante 5 min; Repita 3 veces.
- Coloque los cubreobjetos con las celdas hacia abajo en el medio de montaje con 4',6-diamidino-2-fenilindol (DAPI). Cubra los portaobjetos con papel de aluminio para protegerlos de la luz.
- Adquiera imágenes utilizando un microscopio de fluorescencia confocal con un objetivo de 63x/1,4.
7. Adquisición de microscopía confocal y cuantificación de Fiji
- Capture imágenes de inmunofluorescencia utilizando un microscopio de barrido láser confocal (consulte la Tabla de materiales).
NOTA: Para obtener la mejor resolución, use una lente de inmersión en aceite de objetivo de 63x. - Proteja los cubreobjetos de la luz y déjelos a temperatura ambiente durante al menos 30 minutos antes de la adquisición.
- Use un pañuelo absorbente para limpiar los cubreobjetos. Agregue una gota de aceite de inmersión al objetivo y coloque el portaobjetos en la platina del microscopio. Seleccione el objetivo 63x con aceite, levante la plataforma hasta que el aceite toque el portaobjetos y ajuste el enfoque en el microscopio.
- Abra el programa y active las longitudes de onda láser de 488, 552 y 405 nm.
- Establezca la resolución de la imagen en 1024 x 1024 píxeles.
- Haga clic en la parte inferior en vivo, establezca la pila Z y presione Comenzar. Repita este proceso y luego presione el botón Fin .
- Espere a que se complete la adquisición de la imagen y, a continuación, seleccione la opción Proyección máxima en las herramientas.
- Guarde el experimento y exporte las imágenes en formato .lif a un equipo.
- Abra el programa FIJI, abra el experimento en FIJI y establezca la pila de vistas en Hyperstack.
- Seleccione los archivos de imagen abiertos individualmente | coser mosaicos.
- Seleccione la herramienta de mano libre en la barra de herramientas de Fiji y trace cada celda cuidadosamente a mano. Presione analizar | medir para visualizar la intensidad de fluorescencia. Repita este proceso para cada tipo de célula por grupo.
- Guarde las medidas y expórtelas a una hoja de cálculo. Abra el archivo que contiene los datos utilizando un software de análisis estadístico (consulte la Tabla de materiales) para realizar análisis estadísticos.
8. Análisis estadístico
- Abra un nuevo proyecto en el software.
- Para datos con distribución normal, utilice la prueba t de Student; para datos no paramétricos, utilice la prueba U de Mann-Whitney.
- Pegue los valores obtenidos de los resultados experimentales en la tabla.
- Seleccione estadísticas descriptivas y elija la columna de opciones estadísticas [todas las pruebas] para analizar la distribución de datos.
NOTA: Si los datos siguen la distribución gaussiana, elija la prueba t para examinar las muestras comparando dos pares. Si la distribución no es gaussiana, analice los datos utilizando la prueba U de Mann-Whitney con medidas de tendencia central (medias o medianas) y medidas de variación. - Elija la mejor opción de gráfico para una representación óptima de los datos.
Resultados
En este artículo se investiga el papel de las CD en la infección por Leishmania mediante citometría de flujo y microscopía confocal. Inicialmente, se estableció el perfil fenotípico de la CD derivada de monocitos humanos. En particular, las poblaciones de células dendríticas CD11c+ obtenidas fueron positivas para CCR7, CD209, CD80, CD1a y HLA-DR. Los resultados indican que la expresión de estos marcadores en las poblaciones de DC se ve profundamente afectada por la infección por Leishmania. Los DC infectados mostraron un aumento en la expresión de CD80, CD209, CCR7 y HLA-DR. Sin embargo, también se observó una regulación negativa de CD1a en las CD infectadas por L. amazonensis. Además, el análisis de componentes principales reveló diferencias sustanciales en la expresión de estas moléculas (Figura 1B-D). Se empleó el algoritmo T-Distributed Stochastic Neighbor Embedding (t (tSNE), una técnica de reducción de dimensionalidad, para visualizar mejor cómo la infección por Leishmania afecta la expresión de moléculas relacionadas con la maduración.
Cabe destacar que los gráficos de densidad de tSNE muestran que las CD infectadas presentan una expresión diferencial de HLA-DR y CD80, lo que sugiere aún más la regulación positiva de las moléculas involucradas en la presentación de antígenos (Figura 2). Para visualizar las CD, la inmunotinción con F-actina se realizó marcando las células con faloidina fluorescente. Para observar la infección por L. amazonensis dentro de las CD, se utilizó la tinción nuclear (DAPI) para comparar las células infectadas por Leishmania con las células no infectadas (Figura 3). El análisis cinético de la infección por hDC con L. amazonensis promastigotes (10:1) indica el porcentaje de células infectadas y el número de parásitos por célula infectada a las 4 h después de la infección. A continuación, las células se lavaron y se volvieron a incubar durante 6, 12 o 24 horas. En promedio, se observaron 4-5 parásitos por DC en ~ 55% de las células infectadas.

Figura 1: Caracterización de DC humana basada en marcadores después de la infección por Leishmania amazonensis; estrategia de activación para la selección de CD11c+. (A) Evaluación de la molécula coestimuladora MFI. (B) Mapa de calor y (C) análisis de componentes principales de los valores de MFI de moléculas coestimuladoras. (D) Histogramas representativos y diagramas de dispersión que representen MFI para cada molécula. Abreviaturas: DC = célula dendrítica; MFI = intensidad media de fluorescencia; SSC-A = área de dispersión lateral; FSC-A = área de dispersión hacia adelante; FSC-H = altura de dispersión hacia adelante. Haga clic aquí para ver una versión más grande de esta figura.
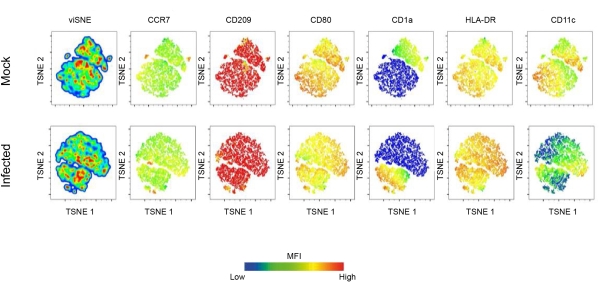
Figura 2: Expresión molecular de superficie de DC inducida por Leishmania.Caracterización en profundidad del panorama de maduración de las CD inducidas por la infección por Leishmania. Brevemente, se obtuvieron CD derivadas de monocitos después de 7 días de diferenciación con GM-CSF e IL-4. Las CD completamente diferenciadas se infectaron con L. amazonensis y luego se tiñeron con un panel de anticuerpos FACS de maduración. Se empleó TSNE, una técnica de reducción de dimensionalidad, para realizar un análisis de alta dimensionalidad de los datos de citometría de flujo. Abreviaturas: DC = célula dendrítica; GM-CSF = factor estimulante de colonias de granulocitos y macrófagos; FACS = clasificación de células activadas por fluorescencia; IL-4 = interleucina-4; TSNE = Incrustación de vecino estocástico distribuido en T. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Infección por hDC por Leishmania amazonensis. Las células dendríticas humanas se infectaron con L. amazonensis (10:1) durante 4 h, se lavaron y se marcaron con faloidina. (A) Fluorescencia del marcaje de F-actina en hDC infectadas o no infectadas. Verde, F-actina; azul, DAPI para la tinción nuclear de hDCs y núcleos de parásitos Leishmania ; las flechas amarillas representan amastigotes dentro de la celda; las flechas blancas representan la actina F de las hDC; escala de grises, DIC. (B) Porcentaje de infección y carga parasitaria en 400 células evaluadas aleatoriamente por microscopía de fluorescencia (analizadas mediante Anova). Barras de escala = 25 μm. Abreviaturas: hDC = célula dendrítica humana; DAPI = 4',6-diamidino-2-fenilindol; DIC = contraste de interferencia diferencial. Haga clic aquí para ver una versión más grande de esta figura.
| Búfer MACS |
| EDTA 2 mM |
| PBS 1x |
| BSA 0.5% |
| Solución salina tamponada con fosfato (PBS) 1x |
| Solución de cloruro de amonio: 0,134 g de NH4Cl |
| Saponina 15% |
| 150 mg de saponina en 1 mL de 1x PBS |
| 1 mL de saponina al 15% en 100 mL de 1x PBS |
| 10% Albúmina sérica bovina |
| 100 mg – 1 mL → 10% |
| 1 g – 100 mL → 1% |
| Para 10% de BSA - 1 g de BSA en 10 mL de 1x PBS |
| 1x PBS/ 1% BSA / 0,15% Saponina: 20 mL de 1x PBS 2 mL de BSA al 10% 200 μL de saponina al 15% |
| 1x PBS/ 3% BSA / 0,15% Saponina: 20 mL de 1x PBS ; 6 mL de BSA al 10%; 200 μL 15% Saponina |
| 1x PBS / 0,3% BSA / 0,15% Saponina: 20 mL PBS; 0,6 mL de BSA al 10%; 200 μL de saponina al 15% |
Tabla 1: Composiciones de las soluciones utilizadas en este protocolo.
Discusión
La leishmaniasis es un grave problema de salud pública en todo el mundo. La patogenia de esta enfermedad es bastante compleja y los mecanismos que favorecen la supervivencia del parásito en los huéspedes vertebrados siguen siendo difíciles de alcanzar17. Las CD son células presentadoras de antígenos profesionales que se encuentran en todo el cuerpo, incluidos los órganos filtrantes y linfoides. Tras la captura y procesamiento de antígenos, las CD inmaduras experimentan un complejo proceso de maduración que culmina con su migración a los ganglios linfáticos, donde estas células son las encargadas de presentar los antígenos a los linfocitos T18. Este proceso de maduración se caracteriza por un aumento de la expresión molecular del MHC de clase II, en particular CD11c, CD86, CD80 y CD1a19. En la leishmaniasis, las CD derivadas de monocitos fagocitan a los parásitos y entregan la carga a las dLN, induciendo la presentación de antígenos a las células T13.
En este trabajo se describe un protocolo conciso que permite investigar el impacto de Leishmania en el funcionamiento inmunobiológico de las CD en un modelo in vitro de infección. Este protocolo engloba el uso de técnicas inmunológicas de última generación, incluyendo la obtención y diferenciación de monocitos humanos en CDs, así como la caracterización de DC mediante citometría de flujo y microscopía confocal14. Inicialmente, los monocitos se purificaron a partir de las PBMC de donantes sanos. El uso de un método de selección positiva, como las microperlas CD14 antihumanas, garantiza un alto grado de pureza (>95%) de los moDC diferenciados. Estas células se incuban con microesferas anti-CD14 humanas que unen el anticuerpo a las células CD14 positivas en la muestra, que luego se separan mediante un campo magnético de alto gradiente dentro de la columna de un separador de células magnéticas20.
En particular, la diferenciación in vitro de monocitos humanos en CD requiere la adición de GM-CSF e IL-4. GM-CSF es un factor de crecimiento pleiotrópico que no solo regula a la baja la expresión del factor estimulante de colonias de macrófagos (M-CSF), sino que también inhibe la diferenciación inducida por M-CSF en macrófagos. Además, la IL-4 actúa inhibiendo la formación de colonias de macrófagos, considerado un método adecuado para el cultivo de moDCs in vitro21. El presente protocolo propone el uso de la citometría de flujo para evaluar la diferenciación de las CD mediante el análisis de la expresión de marcadores relacionados con la maduración, como CCR7, CD209, CD80, CD1a, HLA-DR y CD11c. Además, se utilizan técnicas de citometría de flujo de alta dimensión (p. ej., t-SNE) para identificar con precisión los patrones de expresión influenciados por la infección por Leishmania 22. Es crucial optimizar la dilución de los anticuerpos durante la inmunotinción.
La microscopía confocal constituye una excelente herramienta para analizar y cuantificar la intensidad de fluorescencia en células humanas23. Es importante tener en cuenta que este ensayo requiere una manipulación cuidadosa antes de la adquisición de la imagen, como lavar los cubreobjetos suavemente y evitar la exposición a la luz. La principal limitación de este método es la adquisición de una resolución de imagen adecuada en microscopía confocal, lo que requiere experiencia en la manipulación de microscopía. Sin embargo, este método se puede utilizar para estudiar la respuesta de las CD a la infección por diferentes patógenos. Alternativamente, los pasos descritos en este protocolo también se pueden extrapolar a otros modelos de infección por patógenos.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Agradecemos al Instituto Gonçalo Moniz (IGM-Fiocruz) (Bahía, Brasil) y al departamento de microscopía por su asistencia. Los autores agradecen a Andris K. Walter por su análisis crítico, revisión del idioma inglés y asistencia en la edición de manuscritos.
Materiales
| Name | Company | Catalog Number | Comments |
| anti CCR7 | Thermo | ||
| anti CD209 | Isofarma | ||
| anti CD83 | Leica SP8 | ||
| anti HLA-DR | Gibco | ||
| Bovine serum albumin | Thermo | A2153-100G | Sigma |
| Ciprofloxacin | Gibco | ||
| confocal microscope | Thermo Fisher Scientific | ||
| Fetal bovine serum | Gibco | ||
| Flow Jo | Thermo Fisher Scientific | ||
| Gentamicin | Thermo Fisher Scientific | ||
| Glutamin | Gibco | ||
| HEPES | Thermo Fisher Scientific | ||
| phalloidin | Thermo Fisher Scientific | ||
| Phosphate buffer solution | Peprotech | ||
| prolong gold antifade kit | BD pharmigen | ||
| RPMI | BD pharmigen | ||
| Saponin | BD pharmigen | 47036 – 50G – F | Sigma |
| Schneider's insect medium | software BD biosciences |
Referencias
- Torres-Guerrero, E., Qunitanilla-Cedillo, M. R., Ruiz-Esmenhjaud, J., Arenas, R. Leishmaniasis: a review. F1000 Research. 6, 750(2017).
- Pace, D. Leishmaniasis. Journal of Infection. 69, Suppl 1 10-18 (2014).
- Reithinger, R., et al. Cutaneous leishmaniasis. Lancet. Infectious Diseases. 7 (9), 581-596 (2007).
- Kaye, P., Scott, P. Leishmaniasis: complexity at the host-pathogen interface. Nature Reviews. Microbiology. 9 (8), 604-615 (2011).
- Handman, E., Bullen, D. V. Interaction of Leishmania with the host macrophage. Trends in Parasitology. 18 (8), 332-334 (2002).
- Burza, S., Croft, S. L., Boelaert, M. Leishmaniasis. Lancet. 392 (10151), 951-970 (2018).
- Kamhawi, S. Phlebotomine sand flies and Leishmania parasites: friends or foes. Trends in Parasitology. 22 (9), 439-445 (2006).
- Guilliams, M., et al. Unsupervised high-dimensional analysis aligns dendritic cells across tissues and species. Immunity. 45 (3), 669-684 (2016).
- Moll, H. Dendritic cells and host resistance to infection. Cellular Microbiology. 5 (8), 493-500 (2003).
- Sundquist, M., Rydstrom, A., Wick, M. J. Immunity to Salmonella from a dendritic point of view. Cellular Microbiology. 6 (1), 1-11 (2004).
- Saban, D. The chemokine receptor CCR7 expressed by dendritic cells: A key player in corneal and ocular surface inflammation. Ocular Surface Journal. 12, 87-99 (2014).
- Relloso, M., et al. DC-SIGN (CD209) Expression is IL-4 dependent and it is negatively regulated by IFN, TGF and inflammatory agents. Journal of Immunology. 168 (6), 2634-2643 (2002).
- Leon, B., Lopez-Bravo, M., Ardavin, C. Monocyte-derived dendritic cells formed at the infection site control the induction of protective T helper 1 responses against Leishmania. Immunity. 26 (4), 519-531 (2007).
- Gordon, S. Phagocytosis: An immunobiologic process. Immunity. 44 (3), 463-475 (2016).
- Ashok, D., Acha-Orbea, H. Timing is everything: dendritic cell subsets in murine Leishmania infection. Trends in Parasitology. 30 (10), 499-507 (2014).
- Carvalho, A. K., et al. Leishmania (V.) braziliensis and L. (L.) amazonensis promote differential expression of dendritic cells and cellular immune response in murine model. Parasite Immunology. 34 (8-9), 395-403 (2012).
- Bates, P. A. Transmission of Leishmania metacyclic promastigotes by phlebotomine sand flies. International Journal of Parasitology. 37 (10), 1097-1106 (2007).
- Cervantes-Barragan, L., et al. Plasmacytoid dendritic cells control T-cell response to chronic viral infection. Proceedings of the National Academy of Sciences of the United States of America. 109 (8), 3012-3017 (2012).
- Caux, C., et al. Activation of human dendritic cells through CD40 cross-linking. Journal of Experimental Medicine. 180 (4), 1263-1272 (1994).
- Suzuki, H., et al. Activities of granulocyte-macrophage colony-stimulating factor and interleukin-3 on monocytes. American Journal of Hematology. 75 (4), 179-189 (2004).
- Akira, S., Takeda, K. Toll-like receptor signalling. Nature Reviews. Immunology. 4 (7), 499-511 (2004).
- McKinnon, K. M. Flow cytometry: An overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Sanderson, M. J., et al. Fluorescence microscopy. Cold Spring Harbor Protocols. 10, 1795(2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados