Method Article
In vitro Différenciation des cellules dendritiques humaines et de leurs marqueurs dans l’infection à Leishmania
Dans cet article
Résumé
Les cellules dendritiques (CD) sont des composants essentiels de l’immunité innée contre l’infection à Leishmania. Les mécanismes sous-jacents à l’interaction complexe entre les DC et Leishmania restent mal compris. Ici, nous décrivons des méthodes pour évaluer comment l’infection à Leishmania affecte la fonction immunobiologique des CD humains, telles que l’expression des molécules liées à la migration et costimulatrices.
Résumé
La leishmaniose comprend un ensemble de manifestations cliniques associées à l’infection de protozoaires intracellulaires obligatoires, la leishmaniose. Le cycle de vie des parasites Leishmania se compose de deux stades de vie alternés (amastigotes et promastigotes), au cours desquels les parasites résident soit chez des arthropodes vecteurs, soit chez des hôtes vertébrés, respectivement. Notamment, les interactions complexes entre les parasites Leishmania et plusieurs cellules du système immunitaire influencent largement l’issue de l’infection. Il est important de noter que, bien que les macrophages soient connus pour être la principale niche d’hôte pour la réplication de Leishmania , les parasites sont également phagocytés par d’autres cellules immunitaires innées, telles que les neutrophiles et les cellules dendritiques (DC).
Les DC jouent un rôle majeur dans le rapprochement entre les branches innées et adaptatives de l’immunité et orchestrent ainsi les réponses immunitaires contre un large éventail d’agents pathogènes. Les mécanismes par lesquels Leishmania et les DC interagissent restent flous et impliquent des aspects de la capture des agents pathogènes, de la dynamique de la maturation et de l’activation des CD, de la migration des DC vers les ganglions lymphatiques drainants (dLN) et de la présentation de l’antigène aux lymphocytes T. Bien qu’un grand nombre d’études soutiennent l’idée que les CD jouent un double rôle dans la modulation des réponses immunitaires contre Leishmania, la participation de ces cellules à la susceptibilité ou à la résistance à Leishmania reste mal comprise. Après l’infection, les CD subissent un processus de maturation associé à la régulation positive du complexe majeur d’histocompatibilité (CMH) II de surface, en plus des molécules de costimulation (à savoir, CD40, CD80 et CD86).
Comprendre le rôle des CD dans l’issue de l’infection est crucial pour développer des stratégies thérapeutiques et prophylactiques visant à moduler la réponse immunitaire contre Leishmania. Cet article décrit une méthode de caractérisation de l’interaction Leishmania-DC. Ce protocole détaillé fournit des conseils tout au long des étapes de la différenciation des CD, de la caractérisation des molécules de surface cellulaire et des protocoles d’infection, permettant aux scientifiques d’étudier la réponse des DC à l’infection à Leishmania et de mieux comprendre les rôles joués par ces cellules au cours de l’infection.
Introduction
La leishmaniose constitue un complexe de maladies négligées causées par différentes espèces du genre Leishmania 1. Leishmania est un protozoaire intracellulaire de la famille des Trypanosomatidae qui infecte les humains et d’autres mammifères, provoquant un éventail de maladies allant des lésions cutanées aux formes viscérales2. Les principales manifestations cliniques de cette maladie sont la leishmaniose tégumentaire (TL) et la leishmaniose viscérale (VL). L’Organisation mondiale de la santé (OMS) estime que 700 000 à 1 million de nouveaux cas surviennent chaque année, causant 70 000 décès chaque année2. Dans le monde, la leishmaniose touche environ 12 à 15 millions de personnes, et 350 millions sont à risque de contracter la maladie3.
Le genre Leishmania présente deux formes évolutives : le promastigote et l’amastigote4. Les promastigotes de Leishmania se caractérisent par la présence de flagelles et une motilité élevée. Ces formes se trouvent dans le tube digestif du phlébotome, où elles subissent une différenciation en forme infectieuse (promastigotes métacycliques)5. En revanche, les amastigotes se trouvent dans l’environnement intracellulaire des cellules de mammifères infectées. Cette forme évolutive, à son tour, se réplique dans les phagolysosomes des cellules phagocytaires6.
Le cycle de transmission de Leishmania spp. commence pendant l’alimentation sanguine, lorsque les phlébotomes inoculent des promastigotes métacycliques dans la peau de l’hôte1. Peu de temps après l’inoculation de Leishmania , les cellules immunitaires innées, y compris les neutrophiles et les macrophages résidant dans les tissus, phagocytent les parasites. À l’intérieur des vacuoles parasitophores, Leishmania se différencie en amastigotes et se réplique, aboutissant à la rupture de la membrane de la cellule hôte, ce qui permet l’infection des cellules voisines et la propagation du parasite4. Le cycle est terminé lorsque les phlébotomines ingèrent des phagocytes contenant de l’amastigote, qui se différencient en promastigotes procycliques et plus tard en promastigotes métacycliques dans le tractus intestinal de l’insecte7.
Les cellules dendritiques, cellules présentatrices d’antigènes professionnelles présentes dans les tissus et les ganglions lymphatiques, agissent comme une sentinelle pour le système immunitaire8. Ces cellules se trouvent dans les tissus périphériques aux stades immatures, principalement impliquées dans la capture et le traitement de l’antigène. Après avoir été en contact avec des agents pathogènes, les DC subissent un processus de maturation qui aboutit à leur migration vers les ganglions lymphatiques, présentant ensuite des antigènes aux lymphocytes T CD4+ naïfs. Ces cellules sont également essentielles dans l’orchestration des réponses immunitaires innées et adaptatives qui génèrent la tolérance ou l’inflammation9. Le processus de maturation des DC implique plusieurs aspects, notamment l’expression accrue du CMH et des molécules costimulatrices, telles que CD40 et CD86, ainsi que l’amélioration de la sécrétion de cytokines. Les DC expriment différents marqueurs, notamment CD11b et CD11c, et, chez l’homme, les DC qui proviennent des monocytes CD14+ (moDC) expriment CD1a10. CCR7 est fortement exprimé sur les DC et indique le processus migratoire complexe de ces cellules12. CD209 et CD80 jouent également un rôle important dans le contact initial avec les DC et les lymphocytes13.
Dans la leishmaniose, des études suggèrent que les moDC phagocytent les parasites et les délivrent aux ganglions lymphatiques drainants (dLN), où ils présentent des antigènes aux lymphocytes T13. Le mécanisme de capture du parasite est associé à la réorganisation du cytosquelette par les filaments d’actine lors de la phagocytose, ce qui favorise l’internalisation du parasite14. La plupart des études concernant les rôles exercés par les DC dans la leishmaniose se sont concentrées sur L. major, L. amazonensis et L. braziliensis15. Il est intéressant de noter que des études in vivo de l’infection à Leishmania ont démontré que l’altération de la fonction des DC se produit d’une manière spécifique à la souche parasitaire.
Il a été démontré qu’au cours des premiers stades de l’infection à L. amazonensis , les CD présentent une capacité réduite à limiter l’infection parasitaire. À l’inverse, dans un modèle expérimental d’infection à L. braziliensis , il a été démontré que les CD développaient des réponses immunitaires appropriées qui limitaient la survie à Leishmania16. Les principaux aspects connus pour être associés aux réponses différentielles à l’infection à Leishmania spp. sont le degré de maturation et d’activation des DC. Cet article décrit une méthode pour étudier le rôle que jouent les CD humains dans l’infection à Leishmania afin de mieux comprendre comment ces cellules influencent l’issue de la maladie.
Protocole
REMARQUE : Les cellules ont été obtenues à partir de donneurs volontaires sains. La procédure décrite dans le présent document a été approuvée par le Comité national d’éthique (numéro 2.751.345) - Fiocruz, Bahia, Brésil).
1. Différenciation des cellules dendritiques humaines
- Pipeter 10 mL de mélange de polysaccharose-triazoate de sodium dans des tubes coniques de 50 mL.
- Étiquetez les tubes coniques de 50 mL respectivement pour chaque donneur.
- Prélever 30 ml de sang de donneurs sains et effectuer toutes les étapes subséquentes dans la hotte à flux laminaire.
- Transférez soigneusement le sang dans les tubes coniques et diluez le sang dans une solution saline (chlorure de sodium à 0,9 %) dans un rapport de 1:1 à température ambiante.
- Superposez le sang lentement dilué sur le mélange de polysaccharose et de triazoate de sodium dans les tubes (étape 1.1). Centrifuger les tubes une fois à 400 × g pendant 30 min à 25 °C.
REMARQUE : Désactiver le frein avant la centrifugation pour éviter le mélange des couches de gradient. Après la première centrifugation, abaissez la température à 4 °C dans la centrifugeuse. - Retirez délicatement les tubes de la centrifugeuse.
- Recherchez l’anneau formé par les cellules mononucléées du sang périphérique (PBMC) dans l’échantillon (couche leucocytaire) ; Aspirez soigneusement le plasma résiduel à l’aide d’une pipette.
REMARQUE : La centrifugation conduit à la formation des couches de gradient suivantes : érythrocytes, milieu de gradient de densité, anneau PBMC et plasma. L’anneau PBMC se trouve entre le milieu à gradient de densité et les couches de plasma. - Transférez la couche trouble de PBMC dans un autre tube et ajoutez du sérum physiologique jusqu’à un volume final de 30 ml.
- Centrifuger les tubes contenant les suspensions cellulaires à 250 × g pendant 10 min à 4 °C. Jeter le surnageant et ajouter 1 mL de solution saline pour remettre la pastille en suspension.
- Prélever une aliquote pour le comptage cellulaire et la diluer à l’échelle 1:1 000. Utiliser 10 μL de cellules diluées pour compter les cellules par la méthode d’exclusion au bleu de trypan à l’aide d’une chambre de Neubauer afin de déterminer la viabilité des cellules.
- Faites tourner à nouveau la suspension à 200 × g pendant 10 min à 4 °C.
- Remettez la pastille en suspension dans un tampon de tri cellulaire activé magnétiquement (MACS). Utilisez 80 μL de tampon par 1 × 107 cellules.
REMARQUE : reportez-vous au Tableau 1 pour la composition de la mémoire tampon MACS. Conservez le tampon au froid et conservez-le à une température de 2 à 8 °C. - Ajoutez des microbilles CD14 à la suspension cellulaire préparée à l’étape 1.9. Utiliser 20 μL de microbilles CD14 par 1 × 107 cellules.
REMARQUE : Les microbilles CD14 sont utilisées pour sélectionner positivement les monocytes humains des PBMC, car les billes contenant des anti-CD14 humains se lient aux cellules CD14+ exprimées à la surface de la plupart des monocytes. - Pipette de haut en bas pour remettre uniformément les granulés et les microbilles en suspension. Garder sur glace pendant 15 min.
- Centrifuger la suspension à 300 × g pendant 10 min à 4 °C.
- Suspendez à nouveau les cellules dans la mémoire tampon MACS. Utiliser 1 à 2 mL par 1 × 107 cellules dans le mélange cellule-microbilles.
- Centrifuger la suspension à 300 × g pendant 10 min à 4 °C.
- Retirer le surnageant et remettre la pastille en suspension dans 500 μL de tampon MACS.
REMARQUE : Il s’agit du volume maximum de la suspension cellulaire à traiter dans une colonne. - Assemblez la colonne magnétique.
- Lavez une fois la colonne avec 500 μL de tampon MACS et laissez le tampon s’écouler par gravité à travers la colonne.
REMARQUE : Veillez à ne pas laisser la colonne devenir sèche, car l’air peut obstruer la colonne. - Ajouter 500 μL de suspension de billes de cellules (étape 1.19) par colonne. Laissez la suspension de la cellule s’écouler par gravité à travers la colonne.
- Laver la colonne avec 500 μL de tampon MACS (2x). N’ajoutez de nouveau tampon que lorsque le réservoir de la colonne est vide. Ne laissez pas la colonne sécher.
- Placez un nouveau tube sous la colonne, pipetez 1 mL de tampon MACS sur la colonne et rincez immédiatement les cellules marquées magnétiquement hors de la colonne en poussant fermement le piston.
- Centrifuger les cellules enrichies en CD14 à 300 × g pendant 10 min à 4 °C.
- Comptez les cellules à l’aide d’une chambre de Neubauer.
- Remettre les cellules en suspension dans 1 mL de RPMI complet avec 100 μL/mL d’interleukine-4 (IL-4) (50 ng/mL) + facteur de stimulation des colonies de granulocytes-macrophages (GM-CSF) (50 ng/mL).
- Cellules d’ensemencement sur une plaque de 24 puits à une concentration de 2 × 10 à5 cellules par puits dans 500 μL de milieu RPMI complet contenant les cytokines ci-dessus et incuber pendant 7 jours à 37 °C.
2. La culture de Leishmania
REMARQUE : Les parasites L . amazonensis (MHOM/BR88/Ba-125) ont été utilisés dans cet essai.
- Maintenir les promastigotes sur un milieu gélose au sang Novy-Nicolle-MacNeal (NNN) avec 5 mL de milieu complet de Schneider ou de milieu essentiel minimal (MEM) dans un flacon deculture de 25 cm dans un incubateur à la demande en biooxygène (DBO) à 24 °C.
REMARQUE : Pour cultiver la forme promastigote de l’espèce L. amazonensis , 5 mL du milieu complet de Schneider (milieu d’insecte Schneider ́s contenant 10 % de sérum fœtal de bovin inactivé (FBS) et de la gentamicine à une concentration de 50 μg/mL) ont été utilisés. - Incuber pendant 7 jours à 24 °C dans l’incubateur BOD.
- Pipeter 100 μL de culture de promastigote dans une nouvelle fiole deculture de 25 cm de 2 cellules.
- Ajouter 5 ml de MEM supplémenté.
- Incuber à 24 °C dans l’incubateur de DBO et compter périodiquement les promastigotes en transférant une aliquote de suspension de cellules parasitaires diluées dans une solution saline dans une chambre de Neubauer (c’est-à-dire un hémocytomètre) jusqu’à ce que la phase stationnaire soit atteinte.
REMARQUE : N’utilisez pas le premier passage post-NNN Medium pour des expériences. - Transvaser 1 × 105 de promastigotes stationnaires en phase de croissance de Leishmania dans une nouvelle fiole de culture cellulairede 25 cm et ajouter 5 ml de MEM supplémenté.
- Surveiller périodiquement la croissance des cultures à l’aide d’une chambre Neubauer jusqu’à ce que la phase stationnaire soit atteinte.
REMARQUE : Utiliser des cultures de promastigote pour un maximum de 7 passages in vitro afin d’éviter la perte de virulence.
3. Infection à Leishmania
- Après avoir vérifié la croissance en phase stationnaire des parasites en culture, retirer tout le contenu des flacons de culture et les placer dans des tubes coniques de 50 ml. Ajouter une solution saline froide pour obtenir un volume final de 30 ml.
- Centrifuger pendant 10 min à 4 °C à 1 600 × g trois fois. Jetez le surnageant après la centrifugation et remettez la pastille en suspension dans une solution saline froide.
- Lavez les cellules pour éliminer tous les parasites non viables et remettez la pastille en suspension dans 1 mL de solution saline froide. Passer la suspension 5 fois lentement dans une seringue de 1 mL munie d’une aiguille de 16 G pour séparer les grappes de parasites.
- Prélever une aliquote de l’échantillon pour compter la concentration de parasites dans un hémocytomètre à l’aide de l’équation (1).
Concentration parasitaire = moyenne des parasites dans 4 quadrants × facteur de dilution × 104 (1) - Calculez la quantité de Leishmania sp. Requis pour que le nombre de cellules hôtes à plaquer maintienne un rapport parasite/cellule hôte de 10:1 (étape 1.27).
- Lavez les DC en ajoutant 1 mL de solution saline et en centrifugeant les cellules trois fois à 300 × g pendant 10 min à température ambiante.
- Placez le volume requis de Leishmania dans chaque puits de la plaque de culture cellulaire à 24 puits (voir étape 3.5).
- Incuber les DC parasites pendant 4 h dans un incubateur à 37 °C dans une atmosphère à 5 % de CO2 .
4. Immunocoloration pour l’analyse par cytométrie en flux
- Après l’infection, laver les cellules deux fois avec 1 ml de solution saline pour éliminer tous les parasites non internalisés.
REMARQUE : Le panneau avec des clones d’anticorps et des fluorochromes est répertorié dans la table des matériaux. - Anticorps dilués (1:50) dans un tampon de tri cellulaire activé par fluorescence (FACS) (1x PBS avec 1 % BSA) à un volume final de 50 μL par condition expérimentale.
REMARQUE : Il est important de titrer les anticorps avant l’expérimentation afin d’assurer des concentrations de coloration optimales. Dans ce protocole, 1:50 a été utilisé après les expériences de titrage. - Préparez un mélange maître (1x PBS avec 1 % de BSA + mélange d’anticorps). Vortex et pipette 50 μL du mélange dans des puits contenant des cellules.
- Incuber brièvement les CD avec le mélange d’anticorps (CD1a humain, CCR7 humain, CD83 humain, CD11c antihumain, CD209 humain, HLA-DR humain) sur de la glace pendant 30 min, à l’abri de la lumière.
- Laver les cellules deux fois avec 1 mL de tampon de coloration à froid (1 % FBS dans 1x PBS) et centrifuger à 300 × g pendant 5 min à 4 °C.
- Aspirez le surnageant et remettez la pastille en suspension dans 200 μL de tampon de coloration à froid.
- Procéder à l’acquisition des données sur un cytomètre en flux.
REMARQUE : Pour assurer des conditions optimales pour l’analyse FACS, l’acquisition des données doit être effectuée dans les 48 heures suivant la coloration de l’échantillon. Les données ont été analysées à l’aide du logiciel FlowJo.- Ouvrez le logiciel FlowJo et créez un nouvel espace de travail. Ajoutez les fichiers de cytométrie en flux à analyser en les faisant glisser dans la fenêtre de l’espace de travail.
- Cliquez sur le nom du tube pour sélectionner les paramètres de diffusion latérale (SSC) et de diffusion directe (FSC).
REMARQUE : L’analyse cytométrique en flux de la maturation des DC a été basée sur l’expression de CD1a, CD11c, CD80, CCR7, CD209 et HLA-DR. - À l’aide de l’outil de contrôle polygonal , dessinez une porte autour des centres de distribution. Double-cliquez sur les cellules fermées sélectionnées pour afficher une nouvelle fenêtre. Effectuez le nettoyage en double en sélectionnant les paramètres FSC-A et FSC-H. À l’aide de l’outil Polygone , dessinez un nouveau tracé autour de cellules individuelles.
- Double-cliquez sur les cellules fermées et sélectionnez les paramètres SSC et CD11c pour générer une porte contenant des cellules CD11c+ .
- Exportez la porte de cellule CD11c+ nettoyée en la sélectionnant. Faites un clic droit sur la porte et sélectionnez l’option Sélectionner les nœuds équivalents . Cliquez avec le bouton droit de la souris et exportez le gate avec tous les paramètres compensés en l’enregistrant dans un dossier récemment créé.
- Créez un nouvel espace de travail en ouvrant les fichiers récemment enregistrés. Cliquez sur Espace de travail et sélectionnez Plugins | Sous-échantillon | 30 000 à 50 000 événements ; appuyez sur OK.
REMARQUE : Étant donné que TSNE est un processus à la fois long et exigeant en termes de calcul, cette étape est recommandée pour réduire le nombre total d’événements analysés. - Cliquez avec le bouton droit de la souris sur un fichier sous-échantillonné et sélectionnez des nœuds équivalents.
- Cliquez avec le bouton droit de la souris sur un fichier sous-échantillonné et sélectionnez Exporter/Concaténer.
- Cliquez sur la fenêtre de concaténation et sélectionnez tous les paramètres compensés. Sélectionnez les fichiers concaténés et cliquez sur workspace | plugin | tSNE.
- Sélectionnez les paramètres souhaités (CD1a, HLA-DR, CCR7, CD80, CD209 et CD11c) pour créer des clusters. Appuyez sur OK.
- Cliquez sur le fichier concaténé pour visualiser les paramètres tSNE1 et tSNE2.
5. Immunomarquage à l’actine
- Plaques infectées DC sur des lamelles placées dans des plaques à 24 puits. Centrifuger les plaques à 300 × g à 4 °C pendant 10 min. Lavez les cellules 3 fois avec une solution saline stérile après l’infection à température ambiante pour éliminer tous les parasites extracellulaires.
- Incuber les CD avec 500 μL de paraformaldéhyde à 4 % pendant 15 min à température ambiante. Retirer le paraformaldéhyde et ajouter 1 mL de solution saline (voir le tableau 1).
6. Immunomarquage
REMARQUE : Effectuez les étapes suivantes sous agitation.
- Lavez les lamelles avec 1x PBS pendant 5 min ; Répétez 3 fois. Ajouter 500 μL de solution de chlorure d’ammonium par puits ; Incuber 10 min à température ambiante.
- Lavez les lamelles avec 1x PBS pendant 5 min ; Répétez 3 fois.
- Perméabiliser la membrane avec 0,15 % de saponine pendant 15 min.
- Bloc pendant 1 h avec 1x PBS 1x/3 % BSA/0,15 % de saponine. Lavez les lamelles avec 1x PBS/0,15 % de saponine pendant 5 min ; Répétez 3 fois.
- Incuber les cellules pendant 1 h avec de la phalloïdine (1:1 200) diluée dans 1x PBS/1 % BSA/0,15 % de saponine. Lavez les lamelles avec 1x PBS/0,15 % de saponine pendant 5 min ; Répétez 3 fois.
- Placez les lamelles avec les cellules vers le bas sur un support de montage avec du 4',6-diamidino-2-phénylindole (DAPI). Couvrez les diapositives d’une feuille d’aluminium pour les protéger de la lumière.
- Acquérez des images à l’aide d’un microscope confocal à fluorescence avec un objectif 63x/1,4.
7. Acquisition de la microscopie confocale et quantification des Fidji
- Capturez des images d’immunofluorescence à l’aide d’un microscope confocal à balayage laser (voir le tableau des matériaux).
REMARQUE : Pour une meilleure résolution, utilisez un objectif 63x à immersion dans l’huile. - Protégez les lamelles de la lumière et laissez-les à température ambiante pendant au moins 30 minutes avant l’acquisition.
- Utilisez un chiffon absorbant pour nettoyer les lamelles. Ajoutez une goutte d’huile d’immersion dans l’objectif et placez la lame sur la platine du microscope. Sélectionnez l’objectif 63x avec de l’huile, soulevez la plate-forme jusqu’à ce que l’huile touche la lame et ajustez la mise au point sur le microscope.
- Ouvrez le programme et activez les longueurs d’onde laser de 488, 552 et 405 nm.
- Réglez la résolution de l’image sur 1024 x 1024 pixels.
- Cliquez sur le bas de l’écran, définissez la pile Z et appuyez sur Commencer. Répétez ce processus, puis appuyez sur le bouton Fin .
- Attendez la fin de l’acquisition de l’image, puis sélectionnez l’option Projection maximale dans les outils.
- Enregistrez l’expérience et exportez les images au format .lif sur un ordinateur.
- Ouvrez le programme FIJI, ouvrez l’expérience dans FIJI et définissez la pile de vues sur Hyperstack.
- Sélectionnez les fichiers image ouverts individuellement | assemblez les tuiles.
- Sélectionnez l’outil à main libre dans la barre d’outils Fidji et tracez soigneusement chaque cellule à la main. Appuyez sur analyser | mesurer pour visualiser l’intensité de fluorescence. Répétez ce processus pour chaque type de cellule par groupe.
- Enregistrez les mesures et exportez-les vers une feuille de calcul. Ouvrez le fichier contenant les données à l’aide d’un logiciel d’analyse statistique (voir la Table des matériaux) pour effectuer une analyse statistique.
8. Analyse statistique
- Ouvrez un nouveau projet dans le logiciel.
- Pour les données à distribution normale, utilisez le test t de Student ; pour les données non paramétriques, utilisez le test U de Mann-Whitney.
- Collez les valeurs obtenues à partir des résultats expérimentaux dans le tableau.
- Sélectionnez Statistiques descriptives et choisissez l’option Statistiques de la colonne [tous les tests] pour analyser la distribution des données.
REMARQUE : Si les données suivent la distribution gaussienne, choisissez le test t pour examiner les échantillons en comparant deux paires. Si la distribution n’est pas gaussienne, analysez les données à l’aide du test U de Mann-Whitney avec des mesures de tendance centrale (moyennes ou médianes) et des mesures de variation. - Choisissez l’option de graphique la mieux adaptée pour une représentation optimale des données.
Résultats
Ce rapport étudie le rôle des CD dans l’infection à Leishmania à l’aide de la cytométrie en flux et de la microscopie confocale. Initialement, le profil phénotypique de la DC dérivée des monocytes humains a été établi. Notamment, les populations de cellules dendritiques CD11c+ obtenues étaient positives pour CCR7, CD209, CD80, CD1a et HLA-DR. Les résultats indiquent que l’expression de ces marqueurs dans les populations de DC est profondément affectée par l’infection à Leishmania. Les DC infectés présentaient une expression accrue de CD80, CD209, CCR7 et HLA-DR. Cependant, une régulation négative de CD1a a également été observée dans les CD infectées par L. amazonensis. De plus, l’analyse en composantes principales a révélé des différences substantielles dans l’expression de ces molécules (Figure 1B-D). L’algorithme t (tSNE), une technique de réduction de la dimensionnalité, a été utilisé pour mieux visualiser comment l’infection à Leishmania affecte l’expression des molécules liées à la maturation.
Il convient de noter que les graphiques de densité tSNE montrent que les DC infectés présentent une expression différentielle de HLA-DR et de CD80, ce qui suggère en outre la régulation à la hausse des molécules impliquées dans la présentation de l’antigène (Figure 2). Pour visualiser les DC, l’immunocoloration de l’actine F a été réalisée en marquant les cellules avec de la phalloïdine fluorescente. Pour observer l’infection à L. amazonensis à l’intérieur des CD, la coloration nucléaire (DAPI) a été utilisée pour comparer les cellules infectées par Leishmania avec les cellules non infectées (Figure 3). L’analyse cinétique de l’infection par les promastigotes de L. amazonensis (10:1) indique le pourcentage de cellules infectées et le nombre de parasites par cellule infectée 4 h après l’infection. Les cellules ont ensuite été lavées et réincubées pendant 6, 12 ou 24 heures. En moyenne, 4 à 5 parasites ont été observés par DC dans ~55 % des cellules infectées.

Figure 1 : Caractérisation des DC humaines à l’aide de marqueurs après une infection à Leishmania amazonensis ; stratégie de déclenchement pour la sélection de CD11c+. (A) Évaluation de la molécule de costimulation MFI. (B) Heatmap et (C) analyse en composantes principales des valeurs MFI des molécules de costimulation. (D) Histogrammes représentatifs et diagrammes de dispersion illustrant l’IFM pour chaque molécule. Abréviations : DC = cellule dendritique ; MFI = intensité médiane de fluorescence ; SSC-A = aire de diffusion latérale ; FSC-A = aire de diffusion vers l’avant ; FSC-H = hauteur de diffusion vers l’avant. Veuillez cliquer ici pour voir une version agrandie de cette figure.
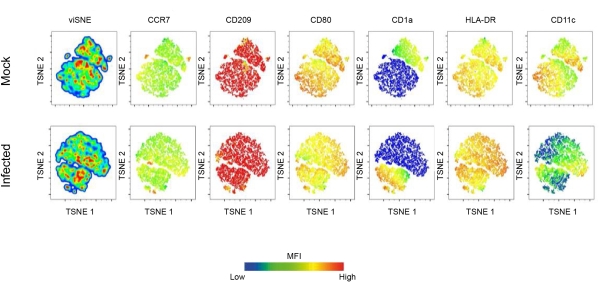
Figure 2 : Expression moléculaire de surface des DC induite par Leishmania.Caractérisation approfondie du paysage de maturation des DC induite par l’infection à Leishmania. En bref, des CD dérivées de monocytes ont été obtenues après 7 jours de différenciation avec GM-CSF et IL-4. Des CD entièrement différenciés ont été infectés par L. amazonensis, puis colorés avec un panel d’anticorps FACS de maturation. TSNE, une technique de réduction de la dimensionnalité, a été utilisée pour effectuer une analyse dimensionnelle élevée des données de cytométrie en flux. Abréviations : DC = cellule dendritique ; GM-CSF = facteur de stimulation des colonies de granulocytes-macrophages ; FACS = tri cellulaire activé par fluorescence ; IL-4 = interleukine-4 ; TSNE = Intégration de voisin stochastique distribuée T. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : infection par le hDC à Leishmania amazonensis. Des cellules dendritiques humaines ont été infectées par L. amazonensis (10:1) pendant 4 heures, lavées et marquées à la phalloïdine. (A) Fluorescence du marquage de l’actine F dans les hDC infectés ou non infectés. Vert, F-actine ; bleu, DAPI pour la coloration nucléaire des hDC et des noyaux des parasites Leishmania ; les flèches jaunes représentent les amastigotes à l’intérieur de la cellule ; les flèches blanches représentent l’actine F des hDC ; niveaux de gris, DIC. (B) Pourcentage d’infection et de charge parasitaire dans 400 cellules évaluées au hasard par microscopie à fluorescence (analysées à l’aide d’Anova). Barres d’échelle = 25 μm. Abréviations : hDC = cellule dendritique humaine ; DAPI = 4',6-diamidino-2-phénylindole ; DIC = contraste d’interférence différentiel. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Tampon MACS |
| EDTA 2 mM |
| PBS 1x |
| BSA 0,5 % |
| Solution saline tamponnée au phosphate (PBS) 1x |
| Solution de chlorure d’ammonium : 0,134 g de NH4Cl |
| Saponine 15 % |
| 150 mg de saponine dans 1 mL de 1x PBS |
| 1 mL de saponine à 15 % dans 100 mL de 1x PBS |
| 10 % d’albumine sérique bovine |
| 100 mg – 1 mL → 10 % |
| 1 g – 100 mL → 1 % |
| Pour 10 % de BSA - 1 g de BSA dans 10 mL de 1x PBS |
| 1x PBS / 1 % BSA / 0,15 % Saponine : 20 mL de 1x PBS 2 mL de BSA à 10 % 200 μL de saponine à 15 % |
| 1x PBS / 3 % BSA / 0,15 % Saponine : 20 mL de 1x PBS ; 6 mL de BSA à 10 % ; 200 μL 15 % Saponine |
| 1x PBS / 0,3 % BSA / 0,15 % Saponine : 20 mL PBS ; 0,6 mL de BSA à 10 %; 200 μL de saponine à 15 % |
Tableau 1 : Compositions des solutions utilisées dans ce protocole.
Discussion
La leishmaniose est un grave problème de santé publique dans le monde entier. La pathogenèse de cette maladie est assez complexe, et les mécanismes favorisant la survie des parasites chez les hôtes vertébrés restent insaisissables17. Les DC sont des cellules professionnelles présentatrices d’antigènes présentes dans tout le corps, y compris les organes filtrants et lymphoïdes. Après la capture et le traitement de l’antigène, les CD immatures subissent un processus de maturation complexe qui aboutit à leur migration vers les ganglions lymphatiques, où ces cellules sont responsables de la présentation des antigènes aux lymphocytes T18. Ce processus de maturation est caractérisé par une augmentation de l’expression moléculaire du CMH de classe II, notamment CD11c, CD86, CD80 et CD1a19. Dans le cas de la leishmaniose, les CD dérivées de monocytes phagocytent les parasites et livrent la cargaison aux dLNs, induisant la présentation de l’antigène aux lymphocytes T13.
Cet article décrit un protocole concis qui permet d’étudier l’impact de Leishmania sur le fonctionnement immunobiologique des CD dans un modèle in vitro d’infection. Ce protocole comprend l’utilisation de techniques immunologiques de pointe, y compris l’obtention et la différenciation de monocytes humains en CD, ainsi que la caractérisation des DC par cytométrie en flux et microscopie confocale14. Initialement, les monocytes ont été purifiés à partir des PBMC de donneurs sains. L’utilisation d’une méthode de sélection positive, telle que les microbilles CD14 anti-humaines, garantit un haut degré de pureté (>95 %) des moDC différenciés. Ces cellules sont incubées avec des microbilles CD14 anti-humaines qui lient l’anticorps aux cellules CD14 positives de l’échantillon, qui sont ensuite séparées par un champ magnétique à gradient élevé à l’intérieur de la colonne d’un séparateur de cellules magnétiques20.
Notamment, la différenciation in vitro des monocytes humains en CD nécessite l’ajout de GM-CSF et d’IL-4. Le GM-CSF est un facteur de croissance pléiotrope qui non seulement régule à la baisse l’expression du facteur de stimulation des colonies de macrophages (M-CSF), mais inhibe également la différenciation induite par le M-CSF en macrophages. De plus, l’IL-4 agit en inhibant la formation de colonies de macrophages, considérée comme une méthode appropriée pour la culture in vitro de moDC 21. Le présent protocole propose l’utilisation de la cytométrie en flux pour évaluer la différenciation des DC en analysant l’expression de marqueurs liés à la maturation, tels que CCR7, CD209, CD80, CD1a, HLA-DR et CD11c. De plus, des techniques de cytométrie en flux de grande dimension (par exemple, t-SNE) sont utilisées pour identifier précisément les modèles d’expression influencés par l’infection à Leishmania 22. Il est crucial d’optimiser la dilution des anticorps lors de l’immunomarquage.
La microscopie confocale constitue un excellent outil pour analyser et quantifier l’intensité de la fluorescence dans les cellules humaines23. Il est important de noter que ce test nécessite une manipulation minutieuse avant l’acquisition de l’image, comme le lavage doux des lamelles et l’évitement de l’exposition à la lumière. La principale limitation de cette méthode est l’acquisition d’une résolution d’image appropriée en microscopie confocale, ce qui nécessite une expérience de la manipulation en microscopie. Cependant, cette méthode peut être utilisée pour étudier la réponse des CD à l’infection par différents agents pathogènes. Alternativement, les étapes décrites dans ce protocole peuvent également être extrapolées à d’autres modèles d’infection par des agents pathogènes.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous remercions l’Institut Gonçalo Moniz (IGM-Fiocruz) (Bahia, Brésil) et le département de microscopie pour leur aide. Les auteurs sont reconnaissants à Andris K. Walter pour l’analyse critique, la révision de la langue anglaise et l’aide à la révision des manuscrits.
matériels
| Name | Company | Catalog Number | Comments |
| anti CCR7 | Thermo | ||
| anti CD209 | Isofarma | ||
| anti CD83 | Leica SP8 | ||
| anti HLA-DR | Gibco | ||
| Bovine serum albumin | Thermo | A2153-100G | Sigma |
| Ciprofloxacin | Gibco | ||
| confocal microscope | Thermo Fisher Scientific | ||
| Fetal bovine serum | Gibco | ||
| Flow Jo | Thermo Fisher Scientific | ||
| Gentamicin | Thermo Fisher Scientific | ||
| Glutamin | Gibco | ||
| HEPES | Thermo Fisher Scientific | ||
| phalloidin | Thermo Fisher Scientific | ||
| Phosphate buffer solution | Peprotech | ||
| prolong gold antifade kit | BD pharmigen | ||
| RPMI | BD pharmigen | ||
| Saponin | BD pharmigen | 47036 – 50G – F | Sigma |
| Schneider's insect medium | software BD biosciences |
Références
- Torres-Guerrero, E., Qunitanilla-Cedillo, M. R., Ruiz-Esmenhjaud, J., Arenas, R. Leishmaniasis: a review. F1000 Research. 6, 750(2017).
- Pace, D. Leishmaniasis. Journal of Infection. 69, Suppl 1 10-18 (2014).
- Reithinger, R., et al. Cutaneous leishmaniasis. Lancet. Infectious Diseases. 7 (9), 581-596 (2007).
- Kaye, P., Scott, P. Leishmaniasis: complexity at the host-pathogen interface. Nature Reviews. Microbiology. 9 (8), 604-615 (2011).
- Handman, E., Bullen, D. V. Interaction of Leishmania with the host macrophage. Trends in Parasitology. 18 (8), 332-334 (2002).
- Burza, S., Croft, S. L., Boelaert, M. Leishmaniasis. Lancet. 392 (10151), 951-970 (2018).
- Kamhawi, S. Phlebotomine sand flies and Leishmania parasites: friends or foes. Trends in Parasitology. 22 (9), 439-445 (2006).
- Guilliams, M., et al. Unsupervised high-dimensional analysis aligns dendritic cells across tissues and species. Immunity. 45 (3), 669-684 (2016).
- Moll, H. Dendritic cells and host resistance to infection. Cellular Microbiology. 5 (8), 493-500 (2003).
- Sundquist, M., Rydstrom, A., Wick, M. J. Immunity to Salmonella from a dendritic point of view. Cellular Microbiology. 6 (1), 1-11 (2004).
- Saban, D. The chemokine receptor CCR7 expressed by dendritic cells: A key player in corneal and ocular surface inflammation. Ocular Surface Journal. 12, 87-99 (2014).
- Relloso, M., et al. DC-SIGN (CD209) Expression is IL-4 dependent and it is negatively regulated by IFN, TGF and inflammatory agents. Journal of Immunology. 168 (6), 2634-2643 (2002).
- Leon, B., Lopez-Bravo, M., Ardavin, C. Monocyte-derived dendritic cells formed at the infection site control the induction of protective T helper 1 responses against Leishmania. Immunity. 26 (4), 519-531 (2007).
- Gordon, S. Phagocytosis: An immunobiologic process. Immunity. 44 (3), 463-475 (2016).
- Ashok, D., Acha-Orbea, H. Timing is everything: dendritic cell subsets in murine Leishmania infection. Trends in Parasitology. 30 (10), 499-507 (2014).
- Carvalho, A. K., et al. Leishmania (V.) braziliensis and L. (L.) amazonensis promote differential expression of dendritic cells and cellular immune response in murine model. Parasite Immunology. 34 (8-9), 395-403 (2012).
- Bates, P. A. Transmission of Leishmania metacyclic promastigotes by phlebotomine sand flies. International Journal of Parasitology. 37 (10), 1097-1106 (2007).
- Cervantes-Barragan, L., et al. Plasmacytoid dendritic cells control T-cell response to chronic viral infection. Proceedings of the National Academy of Sciences of the United States of America. 109 (8), 3012-3017 (2012).
- Caux, C., et al. Activation of human dendritic cells through CD40 cross-linking. Journal of Experimental Medicine. 180 (4), 1263-1272 (1994).
- Suzuki, H., et al. Activities of granulocyte-macrophage colony-stimulating factor and interleukin-3 on monocytes. American Journal of Hematology. 75 (4), 179-189 (2004).
- Akira, S., Takeda, K. Toll-like receptor signalling. Nature Reviews. Immunology. 4 (7), 499-511 (2004).
- McKinnon, K. M. Flow cytometry: An overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Sanderson, M. J., et al. Fluorescence microscopy. Cold Spring Harbor Protocols. 10, 1795(2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon