Method Article
体外研究利什曼原虫感染中人树突状细胞及其标志物的分化
摘要
树突状细胞 (DC) 是针对利什曼原虫感染的先天免疫的重要组成部分。DC 和 利什曼原虫 之间复杂相互作用的潜在机制仍然知之甚少。在这里,我们描述了评估 利什曼原虫 感染如何影响人类 DC 免疫生物学功能的方法,例如迁移相关和共刺激分子表达。
摘要
利什曼病包括与专性细胞内原生动物感染相关的一系列临床表现,即利什曼原虫。 利什曼原虫寄生虫的生命周期包括两个交替的生命阶段(无鞭毛体和前鞭毛体),在此期间,寄生虫分别居住在节肢动物媒介或脊椎动物宿主中。值得注意的是,利什曼原虫寄生虫与免疫系统的几个细胞之间的复杂相互作用在很大程度上影响感染的结果。重要的是,尽管已知巨噬细胞是利什曼原虫复制的主要宿主生态位,但寄生虫也会被其他先天免疫细胞吞噬,例如中性粒细胞和树突状细胞 (DC)。
DC 在桥接免疫的先天性和适应性分支中发挥着重要作用,从而协调针对多种病原体的免疫反应。 利什曼原虫 和 DC 相互作用的机制尚不清楚,涉及病原体捕获、DC 成熟和激活的动力学、DC 迁移到引流淋巴结 (dLNs) 以及抗原呈递到 T 细胞等方面。尽管大量研究支持 DC 在调节针对 利什曼原虫的免疫反应中起双重作用的观点,但这些细胞参与对 利什曼原虫 的易感性或抵抗性仍然知之甚少。感染后,除了共刺激分子(即 CD40、CD80 和 CD86)外,树突状细胞还经历了与表面主要组织相容性复合体 (MHC) II 上调相关的成熟过程。
了解 DC 在感染结果中的作用对于制定治疗和预防策略以调节针对 利什曼原虫的免疫反应至关重要。本文描述了一种表征 利什曼原虫-DC 相互作用的方法。该详细的方案为树突细胞分化的整个步骤、细胞表面分子的表征和感染方案提供了指导,使科学家能够研究树突状细胞对 利什曼原虫 感染的反应,并深入了解这些细胞在感染过程中所起的作用。
引言
利什曼病是由 利什曼原虫 属1 的不同物种引起的一系列被忽视的疾病。 利什曼原虫 是锥虫科的一种细胞内原生动物,可感染人类和其他哺乳动物,引起从皮肤病变到内脏形式的一系列疾病2。本病的主要临床表现为皮状利什曼病 (TL) 和内脏利什曼病 (VL)。世界卫生组织 (WHO) 估计,每年有 700,000 至 100 万例新病例,每年造成 70,000 人死亡2。在全球范围内,利什曼病影响了大约 12 至 1500 万人,其中 3.5 亿人有感染该病的风险3。
利什曼原虫属呈现两种进化形式:前鞭毛体和 amastigote4。利什曼原虫前鞭毛体的特征是存在鞭毛和高运动性。这些形式存在于沙蝇的消化道中,在那里它们分化成感染性形式(超环前鞭毛体)5。相比之下,无鞭毛体存在于受感染的哺乳动物细胞的细胞内环境中。反过来,这种进化形式在吞噬细胞的吞噬溶酶体中复制6。
利什曼原虫属的传播周期始于采血期间,此时白蛉将后环前鞭毛体接种到宿主的皮肤中1。接种利什曼原虫后不久,先天免疫细胞,包括中性粒细胞和组织驻留的巨噬细胞,吞噬寄生虫。在寄生液泡内,利什曼原虫分化为无鞭毛体并复制,最终导致宿主细胞膜破裂,从而允许邻近细胞感染和寄生虫传播4。当静脉导管摄入含有无鞭毛体的吞噬细胞时,该循环就完成了,吞噬细胞在昆虫的肠道中分化为前环前鞭毛细胞,后来分化为后环前鞭毛细胞7。
树突状细胞是在组织和淋巴结中发现的专业抗原呈递细胞,充当免疫系统的前哨8。这些细胞存在于未成熟期的外周组织中,主要参与抗原捕获和加工。与病原体接触后,树突状细胞经历成熟过程,最终迁移到淋巴结,随后将抗原呈递给幼稚的 CD4+ T 细胞。这些细胞在协调产生耐受性或炎症的先天性和适应性免疫反应中也是必不可少的9。DC 成熟过程涉及几个方面,包括 MHC 和共刺激分子(如 CD40 和 CD86)的表达增加,以及细胞因子分泌的增强。树突状细胞表达不同的标志物,包括 CD11b 和 CD11c,在人类中,源自 CD14+ 单核细胞 (moDC) 的树突状细胞表达CD1a 10。CCR7 在 DC 上高度表达,表明这些细胞的复杂迁移过程12。CD209 和 CD80 在与 DC 和淋巴细胞的初始接触中也起重要作用13。
在利什曼病中,研究表明 moDC 吞噬寄生虫并将其输送到引流淋巴结 (dLN),在那里它们将抗原呈递给 T 细胞13。寄生虫捕获机制与吞噬过程中肌动蛋白丝的细胞骨架重组有关,从而促进寄生虫的内化14。大多数关于 DC 在利什曼病中的作用的研究都集中在 L. major 、 L. amazonensis 和 L. braziliensis15 上。有趣的是,利什曼原虫感染的体内研究表明,DC 功能的损害以寄生虫菌株特异性方式发生。
已经证明,在 亚马逊乳杆菌 感染的早期阶段,树突状细胞表现出限制寄生虫感染的能力下降。相反,在 巴西乳杆菌 感染的实验模型中,DC 被证明会产生适当的免疫反应,从而限制利什曼原虫的存活16。已知与对 利什曼原虫属 感染的不同反应相关的主要方面是 DC 成熟和激活的程度。本文描述了一种研究人类树突状细胞在 利什曼原虫 感染中的作用的方法,以进一步了解这些细胞如何影响疾病结果。
研究方案
注:细胞来自健康的供体志愿者。此处描述的程序已获得国家伦理委员会(编号 2.751.345)-巴西巴伊亚州菲奥克鲁斯的批准)。
1. 人树突状细胞的分化
- 在 50 mL 锥形管中吸取 10 mL 聚蔗糖-三唑酸钠混合物。
- 为每个供体分别标记 50 mL 锥形管。
- 从健康供体中采集 30 mL 血液,并在层流罩中执行所有后续步骤。
- 小心地将血液转移到锥形管中,并在室温下以 1:1 的比例用盐水溶液(0.9% 氯化钠)稀释血液。
- 将缓慢稀释的血液覆盖在试管中的多糖 - 三唑酸钠混合物上(步骤 1.1)。将试管在 25 °C 下以 400 × g 离心一次 30 分钟。
注意:离心前关闭制动器,以防止梯度层混合。第一次离心后,将离心机中的温度降至 4 °C。 - 小心地从离心机中取出试管。
- 寻找样品中外周血单核细胞 (PBMC) 形成的环(血沉棕黄层);用移液管小心吸出残留血浆。
注:离心导致形成以下梯度层:红细胞、密度梯度培养基、PBMC 环和血浆。PBMC 环位于密度梯度介质和血浆层之间。 - 将混浊的 PBMC 层转移到另一根试管中,加入生理盐水至最终体积为 30 mL。
- 将含有细胞悬液的试管在 4 °C 下以 250 × g 离心 10 分钟。 弃去上清液,加入 1 mL 生理盐水以重悬沉淀。
- 收集等分试样用于细胞计数,并以 1:1,000 的比例稀释。使用 10 μL 稀释的细胞通过台盼蓝排除法对细胞进行计数,使用 Neubauer 室确定细胞活力。
- 在 4 °C 下以 200 × g 再次旋转悬浮液 10 分钟。
- 将沉淀重悬于磁激活细胞分选 (MACS) 缓冲液中。每 1 × 107 个细胞使用 80 μL 缓冲液。
注:有关 MACS 缓冲液的组成,请参见 表 1。保持缓冲液低温并储存在 2-8 °C。 - 将 CD14 微珠添加到步骤 1.9 中制备的细胞悬液中。每 1 × 107 个细胞使用 20 μL CD14 微珠。
注:CD14 微珠用于从 PBMC 中阳性选择人单核细胞,因为含有人抗 CD14 的微珠与大多数单核细胞表面表达的 CD14+ 细胞结合。 - 上下移液以均匀地重悬沉淀和微珠。在冰上保持 15 分钟。
- 将悬浮液在 4 °C 下以 300 × g 离心 10 分钟。
- 在 MACS 缓冲液中重悬细胞。在细胞微珠混合物中,每 1 × 107 个细胞使用 1-2 mL。
- 将悬浮液在 4 °C 下以 300 × g 离心 10 分钟。
- 去除上清液,将沉淀重悬于 500 μL MACS 缓冲液中。
注:这是在一根色谱柱中处理的细胞悬液的最大体积。 - 组装磁柱。
- 用 500 μL MACS 缓冲液洗涤色谱柱一次,让缓冲液在重力作用过色谱柱。
注意:注意不要让色谱柱变干,因为空气会阻碍色谱柱。 - 每根柱子添加 500 μL 细胞珠悬浮液(步骤 1.19)。让细胞悬液在重力作用过色谱柱。
- 用 500 μL MACS 缓冲液 (2x) 洗涤色谱柱。仅当色谱柱储液器为空时,才添加新鲜缓冲液。不要让色谱柱干燥。
- 在色谱柱下方放置一根新管,将 1 mL 的 MACS 缓冲液移液到色谱柱上,然后立即用力推动柱塞,将磁性标记的细胞从色谱柱中冲洗出来。
- 将富含CD14的细胞在4°C下以300 × g 离心10分钟。
- 使用 Neubauer 室对细胞进行计数。
- 将细胞重悬于 1 mL 完全 RPMI 中,含 100 μL/mL 白细胞介素-4 (IL-4) ((50 ng/mL) + 粒细胞-巨噬细胞集落刺激因子 (GM-CSF) (50 ng/mL)。
- 将浓度为每孔 2 × 105 个细胞的 24 孔板上的细胞接种在 500 μL 含有上述细胞因子的 RPMI 完全培养基中,并在 37 °C 下孵育 7 天。
2. 利什曼原虫 文化
注意:该测定使用了 L. amazonensis (MHOM/BR88/Ba-125) 寄生虫。
- 在 24 °C 的生物需氧量 (BOD) 培养箱中,将 5 mL Schneider 完全培养基或最低必需培养基 (MEM) 保存在 Novy-Nicolle-MacNeal (NNN) 血琼脂培养基上,并在 25 cm2 培养瓶中保持前鞭毛体。
注:为了培养 亚马逊乳 杆菌物种的前鞭毛体形式,使用 5 mL Schneider 完全培养基(含有 10% 灭活胎牛血清 (FBS) 和浓度为 50 μg/mL 庆大霉素的 Schneider 昆虫培养基)。 - 在 BOD 培养箱中于 24 °C 孵育 7 天。
- 将 100 μL 前鞭毛体培养物移液到新的 25 cm2 细胞培养瓶中。
- 加入 5 mL 补充的 MEM。
- 在 BOD 培养箱中于 24 °C 孵育,并通过将等分试样的盐水稀释的寄生虫细胞悬液转移到 Neubauer 室(即血细胞计数器)中来定期计数前鞭毛体,直至达到固定期。
注:请勿使用 NNN 后的第一代培养基进行实验。 - 将 1 × 105 的 利什曼原 虫稳态生长期前鞭毛体转移到新的 25 cm2 细胞培养瓶中,并加入 5 mL 补充的 MEM。
- 使用 Neubauer 腔室定期监测培养物的生长,直到达到固定相。
注:在 体外 使用前鞭毛体培养物最多 7 代,以避免毒力损失。
3. 利什曼原虫 感染
- 在验证培养寄生虫的静止期生长后,从培养瓶中取出所有内容物并将它们放入 50 mL 锥形管中。加入冷盐水溶液,使最终体积达到 30 mL。
- 在 4 °C 下以 1,600 × g 离心 10 分钟,离心 3 次。离心后弃去上清液,将沉淀重悬于冷盐水溶液中。
- 洗涤细胞以去除任何无活力的寄生虫,并将沉淀重悬于 1 mL 冷盐水中。将悬浮液缓慢地通过装有 16 G 针头的 1 mL 注射器 5 次,以分离寄生虫簇。
- 从样品中取出等分试样,以使用 Eq (1) 在血细胞计数器中计算寄生虫浓度。
寄生虫浓度 = 稀释因子× 104 (1) 的 4 个象限中寄生虫×平均值 - 计算 利什曼原虫属 的量。需要接种的宿主细胞数量以保持 10:1 的寄生虫:宿主细胞比率(步骤 1.27)。
- 通过加入 1 mL 盐水溶液并在室温下以 300 × g 离心细胞 3 次 10 分钟来洗涤 DC。
- 将所需体积的 利什曼原虫 放入 24 孔细胞培养板的每个孔中(参见步骤 3.5)。
- 将 DC 与寄生虫在 37 °C 的培养箱中,在 5% CO2 气氛中孵育 4 小时。
4. 用于流式细胞术分析的免疫染色
- 感染后,用 1 mL 盐水溶液洗涤细胞两次,以去除任何未内化的寄生虫。
注:材料 表中列出了带有抗体克隆和荧光染料的检测组合。 - 在荧光激活细胞分选 (FACS) 缓冲液(含 1% BSA 的 1x PBS)中稀释抗体 (1:50),每个实验条件的最终体积为 50 μL。
注:在实验前滴定抗体以确保最佳染色浓度非常重要。在该方案中,滴定实验后使用 1:50。 - 准备预混液(1x PBS 含 1% BSA + 抗体混合物)。涡旋并移液 50 μL 在含有细胞的孔中加入混合物。
- 将 DC 与抗体混合物(抗人 CD1a、抗人 CCR7、抗人 CD83、抗 CD11c、抗人 CD209、抗人 HLA-DR)在冰上短暂孵育 30 分钟,避光。
- 用 1 mL 冷染色缓冲液(1% FBS 在 1x PBS 中)洗涤细胞两次,并在 4 °C 下以 300 × g 离心 5 分钟。
- 吸出上清液,并将沉淀重悬于 200 μL 冷染色缓冲液中。
- 在流式细胞仪上进行数据采集。
注意:为确保 FACS 分析的最佳条件,应在样品染色后 48 小时内进行数据采集。使用 FlowJo 软件分析数据。- 打开 FlowJo 软件程序并创建一个新的工作区。通过将流式细胞术文件拖动到工作区窗口中来添加它们。
- 单击 试管名称 以选择侧向散射 (SSC) 和前向散射 (FSC) 参数。
注:DC 成熟的流式细胞术分析基于 CD1a、CD11c、CD80、CCR7、CD209 和 HLA-DR 的表达。 - 使用 多边形门控 工具,在 DC 周围绘制一个门。双击选定的门控单元以显示新窗口。通过选择 FSC-A 和 FSC-H 参数执行双峰清除。使用 多边形 工具,在单个单元格周围绘制一个新绘图。
- 双击门控细胞并选择 SSC 和 CD11c 参数以生成包含 CD11c + 细胞的门。
- 通过选择它导出清洁的 CD11c + 细胞门。右键单击门,然后选择 Select equivalent nodes 选项。右键单击并通过将门保存到最近创建的文件夹来导出门以及所有补偿的参数。
- 通过打开最近保存的文件来创建新工作区。单击 工作区 并选择 插件 |下采样 |30,000 到 50,000 个事件;按 OK。
注意:由于 TSNE 是一个耗时且计算要求高的过程,因此建议执行此步骤以减少分析事件的总数。 - 右键单击缩减采样的文件并选择 等效节点。
- 右键单击缩减像素采样的文件,然后选择 Export/concatenate。
- 单击 concatenate 窗口并选择 所有补偿参数。选择串联的文件,然后单击 workspace | plugin | tSNE。
- 选择所需的参数(CD1a、HLA-DR、CCR7、CD80、CD209 和 CD11c)以创建集群。按 OK。
- 单击连接文件以可视化 tSNE1 和 tSNE2 参数。
5. 肌动蛋白免疫染色
- 将感染的 DC 放在置于 24 孔板中的盖玻片上。将板在 4 °C 下以 300 × g 离心 10 分钟。感染后,在室温下用无菌盐水洗涤细胞 3 次,以去除任何细胞外寄生虫。
- 将 DC 与 500 μL 4% 多聚甲醛在室温下孵育 15 分钟。去除多聚甲醛并加入 1 mL 生理盐水(见 表 1)。
6. 免疫标记
注意: 在搅拌下执行以下步骤。
- 用 1x PBS 洗涤盖玻片 5 分钟;重复 3 次。每孔加入 500 μL 氯化铵溶液;在室温下孵育 10 分钟。
- 用 1x PBS 洗涤盖玻片 5 分钟;重复 3 次。
- 用 0.15% 皂苷透化膜 15 分钟。
- 用 1x PBS 1x/3% BSA/0.15% 皂苷封闭 1 小时。用 1x PBS/0.15% 皂苷洗涤盖玻片 5 分钟;重复 3 次。
- 用在 1x PBS/1% BSA/0.15% 皂苷中稀释的鬼笔环肽 (1:1,200) 孵育细胞 1 小时。用 1x PBS/0.15% 皂苷洗涤盖玻片 5 分钟;重复 3 次。
- 将盖玻片与细胞朝下放在含有 4',6-二脒基-2-苯基吲哚 (DAPI) 的封固剂上。用铝箔覆盖载玻片以保护它们避光。
- 使用具有 63 倍/1.4 物镜的共聚焦荧光显微镜采集图像。
7. 共聚焦显微镜采集和斐济定量
- 使用共聚焦激光扫描显微镜捕获免疫荧光图像(参见 材料表)。
注意:为获得最佳分辨率,请使用 63 倍物镜油浸物镜。 - 保护盖玻片避光,并在采集前将它们在室温下放置至少 30 分钟。
- 使用吸收性纸巾清洁盖玻片。在物镜中加入一滴浸油,然后将载玻片放在显微镜载物台上。选择带油的 63 倍物镜,抬起平台直到油接触到载玻片,然后调整显微镜上的焦距。
- 打开程序并激活 488、552 和 405 nm 的激光波长。
- 将图像分辨率设置为 1024 x 1024 像素。
- 点击 live bottom,设置 Z 堆栈,然后按 Begin。重复此过程,然后按 End 按钮。
- 等待图像采集完成,然后在工具中选择 Maximum Projection 选项。
- 保存实验,并将 .lif 格式的图像导出到计算机。
- 打开 FIJI 程序,在 FIJI 中打开实验,然后将 视图堆栈 设置为 Hyperstack。
- 单独选择打开的图像文件 |缝合平铺。
- 选择 Fiji 工具栏中的徒手工具,然后仔细手动描摹每个单元格。按 analyze | measure 以可视化荧光强度。对每组的每种细胞类型重复此过程。
- 保存测量结果并将其导出到电子表格。使用统计分析软件(参见 材料表)打开包含数据的文件以执行统计分析。
8. 统计分析
- 在软件中打开一个新项目。
- 对于正态分布的数据,使用 Student 的 t 检验;对于非参数数据,请使用 Mann-Whitney U 检验。
- 将从实验结果中获得的值粘贴到表中。
- 选择 descriptive statistics(描述性统计 量),然后选择选项 statistics [all tests] 列 来分析数据分布。
注意:如果数据服从高斯分布,请选择 t 检验,通过比较两对来检查样本。如果分布是非高斯分布,则使用具有集中趋势测度(均值或中位数)和变异测度的 Mann-Whitney U 检验分析数据。 - 选择 最佳图形 选项以实现最佳数据表示。
结果
本报告使用流式细胞术和共聚焦显微镜研究了 DC 在利什曼原虫感染中的作用。最初,建立了人单核细胞衍生的 DC 的表型谱。值得注意的是,获得的 CD11c+ 树突状细胞群对 CCR7 、 CD209 、 CD80 、 CD1a 和 HLA-DR 呈阳性。结果表明,这些标志物在 DC 人群中的表达受到利什曼原虫感染的深刻影响。感染的 DC 表现出增强的 CD80 、 CD209 、 CCR7 和 HLA-DR 表达。然而,在 L .amazonensis 感染的 DC 中也观察到 CD1a 的下调。此外,主成分分析显示这些分子的表达存在显着差异(图 1B-D)。T 分布随机邻域嵌入 (t (tSNE) 算法是一种降维技术,用于更好地可视化利什曼原虫感染如何影响成熟相关分子的表达。
值得注意的是,tSNE 密度图显示,感染的 DC 呈现不同的 HLA-DR 和 CD80 表达,这进一步表明参与抗原呈递的分子上调(图 2)。为了可视化 DC,通过用荧光鬼笔环肽标记细胞进行 F-肌动蛋白免疫染色。为了观察 DC 内的 亚马逊乳杆菌 感染,使用核染色 (DAPI) 将 利什曼原虫感染的细胞与未感染的细胞进行比较(图 3)。涉及 亚马逊乳 杆菌前鞭毛体的 hDC 感染的动力学分析 (10:1) 表明感染后 4 小时感染细胞的百分比和每个感染细胞的寄生虫数量。然后洗涤细胞并重新孵育 6、12 或 24 小时。平均而言,在 ~55% 的感染细胞中,每个 DC 观察到 5-55 个寄生虫。

图 1:亚马逊利什曼原虫感染后基于标记的人类 DC 表征;选择 CD 11c+ 的门控策略。 (A) 共刺激分子 MFI 的评估。(B) 共刺激分子 MFI 值的热图和 (C) 主成分分析。(D) 描述每个分子的 MFI 的代表性直方图和散点图。缩写: DC = 树突状细胞;MFI = 中位荧光强度;SSC-A = 侧向散射区;FSC-A = 前向散射区;FSC-H = 前向散射高度。请单击此处查看此图的较大版本。
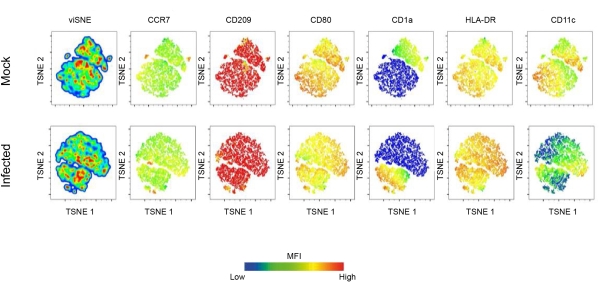
图 2: 利什曼原虫诱导的 DC 表面分子表达。 利 什曼原虫 感染诱导的 DC 成熟景观的深入表征。简而言之,在用 GM-CSF 和 IL-4 分化 7 天后获得单核细胞衍生的 DC。完全分化的 DC 感染 亚马逊乳杆菌 ,然后用一组成熟的 FACS 抗体染色。TSNE 是一种降维技术,用于对流式细胞术数据进行高维分析。缩写: DC = 树突状细胞;GM-CSF = 粒细胞-巨噬细胞集落刺激因子;FACS = 荧光激活细胞分选;IL-4 = 白细胞介素-4;TSNE = T 分布式随机邻域嵌入。 请单击此处查看此图的较大版本。

图 3:亚马逊利什曼原虫 hDC 感染。人树突状细胞用 L. amazonensis (10:1) 感染 4 h,洗涤并用鬼笔环肽标记。(A) 感染或未感染的 hDC 中 F-肌动蛋白标记的荧光。Green,F-肌动蛋白;蓝色,DAPI 用于利什曼原虫寄生虫 hDC 和细胞核的核染色;黄色箭头代表细胞内的无毛体;白色箭头代表 hDCs F-肌动蛋白;灰度,DIC。(B) 通过荧光显微镜随机评估的 400 个细胞中的感染和寄生虫负荷百分比(使用方差分析分析)。比例尺 = 25 μm。缩写: hDC = 人树突状细胞;DAPI = 4',6-二脒基-2-苯基吲哚;DIC = 微分干涉对比。请单击此处查看此图的较大版本。
| MACS 缓冲区 |
| 乙二胺四乙酸 2 毫米 |
| PBS 1x |
| BSA 0.5% |
| 磷酸盐缓冲盐水 (PBS) 1x |
| 氯化铵溶液:0.134 克 NH4Cl |
| 皂苷 15% |
| 150 mg 皂苷溶于 1 mL 1x PBS 中 |
| 1 mL 15% 皂苷在 100 mL 1x PBS 中 |
| 10% 牛血清白蛋白 |
| 100 毫克 – 1 毫升 → 10% |
| 1 克 – 100 毫升 → 1% |
| 对于 10% BSA - 10 mL 1x PBS 中的 1 g BSA |
| 1x PBS/1% BSA/0.15% 皂苷:20 mL 1x PBS 2 mL 10% BSA 200 μL 15% 皂苷 |
| 1x PBS / 3% BSA / 0.15% 皂苷:20 mL 1x PBS;6 mL 10% BSA ;200 μL 15% 皂苷 |
| 1x PBS / 0.3% BSA / 0.15% 皂苷:20 mL PBS;0.6 mL 10% BSA;200 μL 15% 皂苷 |
表 1:本协议中使用的溶液组合。
讨论
利什曼病是世界范围内的一个严重公共卫生问题。这种疾病的发病机制相当复杂,有利于寄生虫在脊椎动物宿主中生存的机制仍然难以捉摸17。DC 是遍布全身的专业抗原呈递细胞,包括过滤和淋巴器官。在抗原捕获和加工之后,未成熟的 DC 经历一个复杂的成熟过程,最终迁移到淋巴结,这些细胞负责将抗原呈递给 T 淋巴细胞18。这种成熟过程的特征是 MHC II 类分子表达增加,特别是 CD11c、CD86、CD80 和 CD1a19。在利什曼病中,单核细胞衍生的 DC 吞噬寄生虫并将货物输送到 dLN,诱导抗原呈递给 T 细胞13。
本文描述了一种简洁的方案,该方案能够研究 利什曼原虫 对 体外 感染模型中 DC 免疫生物学功能的影响。该方案包括使用最先进的免疫学技术,包括获得人单核细胞并将其分化为 DC,以及通过流式细胞术和共聚焦显微镜进行 DC 表征14。最初,从健康供体的 PBMC 中纯化单核细胞。使用阳性选择方法,例如抗人 CD14 微珠,可确保分化 moDC 的高纯度 (>95%)。这些细胞与抗人 CD14 微珠一起孵育,这些微珠将抗体与样品中的 CD14 阳性细胞结合,然后通过磁性细胞分离器20 柱内的高梯度磁场分离。
值得注意的是,人单核细胞在体外分化为 DC 需要添加 GM-CSF 和 IL-4。GM-CSF 是一种多效性生长因子,不仅下调巨噬细胞集落刺激因子 (M-CSF) 的表达,还抑制 M-CSF 诱导的向巨噬细胞分化。此外,IL-4 通过抑制巨噬细胞集落形成发挥作用,被认为是体外培养 moDC 的合适方法 21。本方案建议使用流式细胞术通过分析成熟相关标志物(如 CCR7、CD209、CD80、CD1a、HLA-DR 和 CD11c)的表达来评估 DC 分化。此外,高维流式细胞术技术(例如 t-SNE)用于精确识别受利什曼原虫感染影响的表达模式22。在免疫染色过程中优化抗体稀释度至关重要。
共聚焦显微镜是分析和量化人体细胞荧光强度的出色工具23。需要注意的是,该测定需要在图像采集前进行仔细作,例如轻轻清洗盖玻片并避免暴露在光线下。这种方法的主要局限性是在共聚焦显微镜中获得合适的图像分辨率,这需要显微镜作的经验。然而,这种方法可用于研究 DC 对不同病原体感染的反应。或者,该方案中描述的步骤也可以外推到其他病原体感染模型。
披露声明
作者没有需要披露的利益冲突。
致谢
我们感谢 Gonçalo Moniz 研究所 (IGM-Fiocruz)(巴西巴伊亚州)和显微镜部门的帮助。作者感谢 Andris K. Walter 的批判性分析、英语语言修订和手稿编辑帮助。
材料
| Name | Company | Catalog Number | Comments |
| anti CCR7 | Thermo | ||
| anti CD209 | Isofarma | ||
| anti CD83 | Leica SP8 | ||
| anti HLA-DR | Gibco | ||
| Bovine serum albumin | Thermo | A2153-100G | Sigma |
| Ciprofloxacin | Gibco | ||
| confocal microscope | Thermo Fisher Scientific | ||
| Fetal bovine serum | Gibco | ||
| Flow Jo | Thermo Fisher Scientific | ||
| Gentamicin | Thermo Fisher Scientific | ||
| Glutamin | Gibco | ||
| HEPES | Thermo Fisher Scientific | ||
| phalloidin | Thermo Fisher Scientific | ||
| Phosphate buffer solution | Peprotech | ||
| prolong gold antifade kit | BD pharmigen | ||
| RPMI | BD pharmigen | ||
| Saponin | BD pharmigen | 47036 – 50G – F | Sigma |
| Schneider's insect medium | software BD biosciences |
参考文献
- Torres-Guerrero, E., Qunitanilla-Cedillo, M. R., Ruiz-Esmenhjaud, J., Arenas, R. Leishmaniasis: a review. F1000 Research. 6, 750 (2017).
- Pace, D. Leishmaniasis. Journal of Infection. 69, 10-18 (2014).
- Reithinger, R., et al. Cutaneous leishmaniasis. Lancet. Infectious Diseases. 7 (9), 581-596 (2007).
- Kaye, P., Scott, P. Leishmaniasis: complexity at the host-pathogen interface. Nature Reviews. Microbiology. 9 (8), 604-615 (2011).
- Handman, E., Bullen, D. V. Interaction of Leishmania with the host macrophage. Trends in Parasitology. 18 (8), 332-334 (2002).
- Burza, S., Croft, S. L., Boelaert, M. Leishmaniasis. Lancet. 392 (10151), 951-970 (2018).
- Kamhawi, S. Phlebotomine sand flies and Leishmania parasites: friends or foes. Trends in Parasitology. 22 (9), 439-445 (2006).
- Guilliams, M., et al. Unsupervised high-dimensional analysis aligns dendritic cells across tissues and species. Immunity. 45 (3), 669-684 (2016).
- Moll, H. Dendritic cells and host resistance to infection. Cellular Microbiology. 5 (8), 493-500 (2003).
- Sundquist, M., Rydstrom, A., Wick, M. J. Immunity to Salmonella from a dendritic point of view. Cellular Microbiology. 6 (1), 1-11 (2004).
- Saban, D. The chemokine receptor CCR7 expressed by dendritic cells: A key player in corneal and ocular surface inflammation. Ocular Surface Journal. 12, 87-99 (2014).
- Relloso, M., et al. DC-SIGN (CD209) Expression is IL-4 dependent and it is negatively regulated by IFN, TGF and inflammatory agents. Journal of Immunology. 168 (6), 2634-2643 (2002).
- Leon, B., Lopez-Bravo, M., Ardavin, C. Monocyte-derived dendritic cells formed at the infection site control the induction of protective T helper 1 responses against Leishmania. Immunity. 26 (4), 519-531 (2007).
- Gordon, S. Phagocytosis: An immunobiologic process. Immunity. 44 (3), 463-475 (2016).
- Ashok, D., Acha-Orbea, H. Timing is everything: dendritic cell subsets in murine Leishmania infection. Trends in Parasitology. 30 (10), 499-507 (2014).
- Carvalho, A. K., et al. Leishmania (V.) braziliensis and L. (L.) amazonensis promote differential expression of dendritic cells and cellular immune response in murine model. Parasite Immunology. 34 (8-9), 395-403 (2012).
- Bates, P. A. Transmission of Leishmania metacyclic promastigotes by phlebotomine sand flies. International Journal of Parasitology. 37 (10), 1097-1106 (2007).
- Cervantes-Barragan, L., et al. Plasmacytoid dendritic cells control T-cell response to chronic viral infection. Proceedings of the National Academy of Sciences of the United States of America. 109 (8), 3012-3017 (2012).
- Caux, C., et al. Activation of human dendritic cells through CD40 cross-linking. Journal of Experimental Medicine. 180 (4), 1263-1272 (1994).
- Suzuki, H., et al. Activities of granulocyte-macrophage colony-stimulating factor and interleukin-3 on monocytes. American Journal of Hematology. 75 (4), 179-189 (2004).
- Akira, S., Takeda, K. Toll-like receptor signalling. Nature Reviews. Immunology. 4 (7), 499-511 (2004).
- McKinnon, K. M. Flow cytometry: An overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Sanderson, M. J., et al. Fluorescence microscopy. Cold Spring Harbor Protocols. 10, 1795 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。