Method Article
במבחנה התמיינות של תאים דנדריטיים אנושיים וסמניהם בזיהום לישמניה.
In This Article
Summary
תאים דנדריטיים (DCs) הם מרכיבים חיוניים של חסינות מולדת נגד זיהום לישמניה. המנגנונים העומדים בבסיס האינטראקציה המורכבת בין DCs ללישמאניה נותרו לא מובנים היטב. כאן, אנו מתארים שיטות להעריך כיצד זיהום לישמניה, משפיע על התפקוד האימונוביולוגי של DCs אנושיים, כגון ביטוי מולקולות הקשורות להגירה ועליות.
Abstract
לישמניאזיס מורכבת מאוסף של ביטויים קליניים הקשורים לזיהום של פרוטוזואנים תוך-תאיים מחייבים, לישמניה. מחזור החיים של טפילי לישמניה , מורכב משני שלבי חיים מתחלפים (אמסטיגוטים ופרומסטיגוטים), שבמהלכם טפילים שוכנים בתוך וקטורים של פרוקי רגליים או פונדקאים של בעלי חוליות, בהתאמה. יש לציין כי האינטראקציות המורכבות בין טפילי הלישמניה למספר תאים של מערכת החיסון משפיעות במידה רבה על תוצאות הזיהום. חשוב לציין, למרות שידוע כי מקרופאגים הם הנישה המארחת העיקרית לשכפול הלישמניה , טפילים עוברים פגוציטוזות גם על ידי תאים חיסוניים מולדים אחרים, כגון נויטרופילים ותאים דנדריטיים (DCs).
DCs ממלאים תפקיד מרכזי בגישור בין הענפים המולדים והנרכשים של החיסון ובכך מתזמרים תגובות חיסוניות נגד מגוון רחב של פתוגנים. המנגנונים שבאמצעותם לישמנייה ו-DCs מתקשרים נותרו לא ברורים וכוללים היבטים של לכידת פתוגנים, הדינמיקה של התבגרות והפעלה של DC, נדידת DC לבלוטות לימפה מנקזות (dLNs) והצגת אנטיגן לתאי T. למרות שגוף גדול של מחקרים תומך ברעיון ש-DCs ממלאים תפקיד כפול בוויסות התגובות החיסוניות נגד לישמניה, השתתפותם של תאים אלה ברגישות או עמידות ללישמניה , נותרה לא מובנת היטב. לאחר ההדבקה, DCs עוברים תהליך התבגרות הקשור לוויסות של קומפלקס תאימות היסטולוגית עיקרית על פני השטח (MHC) II, בנוסף למולקולות קוסטימולטוריות (כלומר, CD40, CD80 ו-CD86).
הבנת תפקידם של DCs בתוצאות הזיהום היא חיונית לפיתוח אסטרטגיות טיפוליות ומניעתיות לווסת את התגובה החיסונית נגד לישמניה. מאמר זה מתאר שיטה לאפיון אינטראקציה בין לישמניה-DC. פרוטוקול מפורט זה מספק הדרכה לאורך כל שלבי התמיינות DC, אפיון מולקולות פני התא ופרוטוקולי זיהום, ומאפשר למדענים לחקור את תגובת DC לזיהום בלישמניה ולקבל תובנה לגבי התפקידים שממלאים תאים אלה במהלך ההדבקה.
Introduction
לישמניאזיס מהווה קומפלקס של מחלות מוזנחות הנגרמות על ידי מינים שונים של הסוג לישמניה. לישמניה היא פרוטוזואה תוך-תאית ממשפחת Trypanosomatidae המדביקה בני אדם ויונקים אחרים, וגורמת לספקטרום של מחלות החל מנגעי עור ועד צורות קרביים2. הביטויים הקליניים העיקריים של מחלה זו הם לישמניאזיס טגומנטרי (TL) ולישמניאזיס קרביים (VL). ארגון הבריאות העולמי (WHO) מעריך כי 700,000 עד מיליון מקרים חדשים מתרחשים מדי שנה, הגורמים ל-70,000 מקרי מוותמדי שנה. ברחבי העולם, לישמניאזיס פוגעת בכ-12 עד 15 מיליון בני אדם, ו-350 מיליון נמצאים בסיכון להידבק במחלה3.
הסוג Leishmania מציג שתי צורות אבולוציוניות: הפרומסטיגוטה והאמסטיגוטה4. פרומסטיגוטים של לישמניה, מאופיינים בנוכחות של דגלים ותנועתיות גבוהה. צורות אלה נמצאות במערכת העיכול של זבוב החול, שם הן עוברות התמיינות לצורה הזיהומית (פרומסטיגוטים מטציקליים)5. לעומת זאת, אמסטיגוטים נמצאים בסביבה התוך-תאית של תאי יונקים נגועים. צורה אבולוציונית זו, בתורה, משתכפלת בפגוליזוזומים של תאים פגוציטים6.
מחזור ההעברה של Leishmania spp. מתחיל במהלך הזנת הדם, כאשר זבובי חול מחסנים פרומסטיגוטים מטציקליים לתוך עור המארח1. זמן קצר לאחר חיסון הלישמניה , תאי חיסון מולדים, כולל נויטרופילים ומקרופאגים השוכנים ברקמות, מביאים לפגוציטים של הטפילים. בתוך ואקואולים טפילים, הלישמניה מתמיינה לאמסטיגוטים ומשתכפלת, ומגיעה לשיאה בקרע של קרום התא המארח, המאפשר זיהום של תאים שכנים והתפשטות טפילים4. המחזור הושלם כאשר פלבוטומינים בולעים פגוציטים המכילים אמסטיגוטה, המתמיינים לפרומאסטיגוטים פרוציקליים ומאוחר יותר לפומסטיגוטים מטציקליים במערכת העיכול של החרק7.
תאים דנדריטיים, תאים מקצועיים מציגי אנטיגן הנמצאים ברקמות ובבלוטות הלימפה, פועלים כזקיף למערכת החיסון8. תאים אלה נמצאים ברקמות היקפיות בשלבים לא בשלים, ומעורבים בעיקר בלכידת אנטיגן ועיבודו. לאחר מגע עם פתוגנים, DCs עוברים תהליך התבגרות שמגיע לשיאו בנדידתם לבלוטות הלימפה, ולאחר מכן מציגים אנטיגנים לתאי CD4+ T נאיביים. תאים אלה חיוניים גם בתזמור התגובות החיסוניות המולדות והמסתגלות היוצרות סבילות או דלקת9. תהליך ההתבגרות של DC כולל מספר היבטים, כולל ביטוי מוגבר של MHC ומולקולות קוסטימולטוריות, כגון CD40 ו-CD86, כמו גם הפרשת ציטוקינים מוגברת. DCs מבטאים סמנים שונים, כולל CD11b ו-CD11c, ובבני אדם, ה-DCs שמקורם ב-CD14+ מונוציטים (moDCs) מבטאים CD1a10. CCR7 מתבטא מאוד ב-DCs ומצביע על תהליך הנדידה המורכב של תאים אלה12. CD209 ו-CD80 ממלאים גם תפקיד חשוב במגע הראשוני עם DCs ולימפוציטים13.
בלישמניאזיס, מחקרים מצביעים על כך ש-moDCs טפילי פגוציטוז ומעבירים אותם לבלוטות הלימפה המנקזות (dLNs), שם הם מציגים אנטיגנים לתאי T13. מנגנון לכידת הטפיל קשור לארגון מחדש של השלד הציטולוגי על ידי חוטי אקטין במהלך פגוציטוזיס, מה שמקדם את הפנמת הטפיל14. רוב המחקרים הנוגעים לתפקידים שממלאים DCs בלישמניאזיס התמקדו ב-L. major, L. amazonensis ו-L. braziliensis15. מעניין לציין שמחקרים in vivo על זיהום לישמניה, הראו כי הפגיעה בתפקוד DC מתרחשת באופן ספציפי לזן הטפיל.
הוכח כי בשלבים המוקדמים של זיהום L. amazonensis , DCs מפגינים יכולת מופחתת לרסן זיהום טפיל. לעומת זאת, במודל ניסיוני של זיהום L. braziliensis , הוכח כי DCs מפעילים תגובות חיסוניות מתאימות שהגבילו את הישרדות הלישמניה16. ההיבטים העיקריים הידועים כקשורים לתגובות דיפרנציאליות לזיהום ב-Leishmania spp. הם מידת ההתבגרות וההפעלה של DC. מאמר זה מתאר שיטה לחקור את התפקיד שממלאים DCs אנושיים בזיהום לישמניה , כדי להבין עוד יותר כיצד תאים אלה משפיעים על תוצאות המחלה.
Protocol
הערה: התאים הושגו ממתנדבים תורמים בריאים. הנוהל המתואר כאן אושר על ידי ועדת האתיקה הלאומית (מספר 2.751.345) - Fiocruz, Bahia, ברזיל).
1. התמיינות של תאים דנדריטיים אנושיים
- פיפטה 10 מ"ל של תערובת פוליסוכרוז-נתרן טריאזואט בצינורות חרוטיים של 50 מ"ל.
- סמן את הצינורות החרוטיים בנפח 50 מ"ל בהתאמה לכל תורם.
- אסוף 30 מ"ל דם מתורמים בריאים ובצע את כל השלבים הבאים במכסה הזרימה הלמינרית.
- מעבירים בזהירות את הדם לצינורות החרוטיים ומדללים את הדם בתמיסת מלח (0.9% נתרן כלורי) ביחס של 1:1 בטמפרטורת החדר.
- שכבו את הדם המדולל לאט על תערובת הפוליסוכרוז-נתרן טריאזואט בצינורות (שלב 1.1). צנטריפוגה את הצינורות פעם אחת ב-400 × גרם למשך 30 דקות ב-25 מעלות צלזיוס.
הערה: כבה את הבלם לפני הצנטריפוגה כדי למנוע ערבוב של שכבות שיפוע. לאחר הצנטריפוגה הראשונה, הורידו את הטמפרטורה ל-4 מעלות צלזיוס בצנטריפוגה. - הוצא בזהירות את הצינורות מהצנטריפוגה.
- חפש את הטבעת שנוצרה על ידי תאים חד-גרעיניים בדם היקפי (PBMCs) בדגימה (מעיל באפי); שאפו את שאריות הפלזמה בזהירות בעזרת פיפטה.
הערה: צנטריפוגה מובילה להיווצרות שכבות השיפוע הבאות: אריתרוציטים, מדיום שיפוע צפיפות, טבעת PBMC ופלזמה. טבעת ה-PBMC נמצאת בין מדיום שיפוע הצפיפות לשכבות הפלזמה. - העבירו את שכבת ה-PBMC העכורה לצינור אחר והוסיפו מי מלח לנפח סופי של 30 מ"ל.
- צנטריפוגה הצינורות המכילים את מתלי התאים ב-250 × גרם למשך 10 דקות ב-4 מעלות צלזיוס. השליכו את הסופרנטנט והוסיפו 1 מ"ל מי מלח כדי להשעות מחדש את הגלולה.
- אסוף אליקוט לספירת תאים ודלל אותו 1:1,000. השתמש ב-10 מיקרוליטר מהתאים המדוללים לספירת התאים בשיטת אי הכללת טריפן כחול באמצעות תא נויבאואר כדי לקבוע את כדאיות התא.
- סובב את המתלה שוב ב-200 × גרם למשך 10 דקות מתחת ל-4 מעלות צלזיוס.
- השעו מחדש את הגלולה במאגר מיון תאים מופעל מגנטי (MACS). השתמש ב-80 מיקרוליטר של המאגר לכל 1 ×-107 תאים.
הערה: ראה טבלה 1 עבור הרכב המאגר של MACS. שמור את המאגר קר ואחסן אותו בטמפרטורה של 2-8 מעלות צלזיוס. - הוסף מיקרו-חרוזי CD14 לתרחיף התאים שהוכן בשלב 1.9. השתמש ב -20 מיקרוליטר של מיקרו-חרוזי CD14 לכל 1 × 107 תאים.
הערה: מיקרו-חרוזי CD14 משמשים לבחירה חיובית של מונוציטים אנושיים מ-PBMCs, שכן חרוזים המכילים אנטי-CD14 אנושיים נקשרים לתאי CD14+ המתבטאים על פני השטח של רוב המונוציטים. - פיפטה למעלה ולמטה כדי להשעות מחדש את הכדורים והמיקרו-חרוזים באופן אחיד. שמור על קרח למשך 15 דקות.
- צנטריפוגה את המתלה ב-300 × גרם למשך 10 דקות ב-4 מעלות צלזיוס.
- השעו מחדש את התאים במאגר MACS. השתמש ב 1-2 מ"ל לכל 1 × 107 תאים בתערובת תאים-מיקרו-חרוזים.
- צנטריפוגה את המתלה ב-300 × גרם למשך 10 דקות ב-4 מעלות צלזיוס.
- הסר את ה-supernatant והשהה מחדש את הגלולה ב-500 מיקרוליטר של מאגר MACS.
הערה: זהו הנפח המרבי של מתלה התא שיש לעבד בעמודה אחת. - הרכיבו את העמוד המגנטי.
- שטפו את העמודה פעם אחת עם 500 מיקרוליטר של מאגר MACS ואפשרו למאגר לזרום תחת כוח הכבידה דרך העמודה.
הערה: הקפד לא לאפשר לעמוד להתייבש, מכיוון שאוויר עלול לחסום את העמוד. - הוסף 500 מיקרוליטר של מתלה חרוזי התא (שלב 1.19) לכל עמודה. אפשר למתלה התא לזרום תחת כוח הכבידה דרך העמוד.
- שטפו את העמודה עם 500 מיקרוליטר של מאגר MACS (פי 2). הוסף חיץ טרי רק כאשר מאגר העמודים ריק. אל תתנו לעמודה להתייבש.
- הנח צינור חדש מתחת לעמוד, פיפטה 1 מ"ל של מאגר ה-MACS על העמוד, ושטוף מיד את התאים המסומנים מגנטית מהעמודה על ידי דחיפה חזקה של הבוכנה.
- צנטריפוגה התאים המועשרים CD14 ב-300 × גרם למשך 10 דקות ב-4 מעלות צלזיוס.
- ספרו את התאים באמצעות תא נויבאואר.
- השעו מחדש את התאים ב-1 מ"ל של RPMI מלא עם 100 מיקרוליטר/מ"ל של אינטרלוקין-4 (IL-4) ((50 ננוגרם/מ"ל) + גורם מגרה מושבת גרנולוציטים-מקרופאגים (GM-CSF) (50 ננוגרם/מ"ל).
- תאי זרע על צלחת של 24 בארות בריכוז של 2 × 105 תאים לבאר ב-500 מיקרוליטר של מדיום RPMI שלם המכיל את הציטוקינים הנ"ל ודוגרים במשך 7 ימים בטמפרטורה של 37 מעלות צלזיוס.
2. תרבות הלישמניה
הערה: טפילי L. amazonensis (MHOM/BR88/Ba-125) שימשו בבדיקה זו.
- שמור על פרומסטיגוטים על מדיום אגר הדם של נובי-ניקול-מקניל (NNN) עם 5 מ"ל של המדיום השלם או המדיום החיוני המינימלי (MEM) של שניידר בבקבוק תרביתבגודל 25 ס"מ באינקובטור דרישת ביו-חמצן (BOD) בטמפרטורה של 24 מעלות צלזיוס.
הערה: כדי לטפח את צורת הפרומסטיגוט של המין L. amazonensis , נעשה שימוש ב-5 מ"ל של המדיום השלם של שניידר (מדיום החרקים של שניידר המכיל 10% סרום בקר עוברי מומת (FBS) וגנטמיצין בריכוז של 50 מיקרוגרם/מ"ל). - דגירה למשך 7 ימים בטמפרטורה של 24 מעלות צלזיוס בחממת BOD.
- פיפטה 100 מיקרוליטר של תרבית פרומסטיגוט לבקבוק תרבית תאים חדש בגודל 25 ס"מ2 .
- הוסף 5 מ"ל של ה-MEM בתוסף.
- דגירה בטמפרטורה של 24 מעלות צלזיוס בחממת ה-BOD וספירת הפרומסטיגוטים מעת לעת על ידי העברת מנה של תרחיף תאי טפיל מדולל במי מלח לתוך תא נויבאואר (כלומר, המוציטומטר) עד להגעה לשלב הנייח.
הערה: אל תשתמש בקטע הראשון שלאחר מדיום NNN לניסויים. - העבירו 1 × 105 של פרומסטיגוטים של שלב הגדילה הנייח של לישמניה , לבקבוק תרביתתאים חדש בגודל 25 ס"מ 2 והוסיפו 5 מ"ל של ה-MEM המשלים.
- עקוב מעת לעת אחר צמיחת התרבויות באמצעות תא נויבאואר עד להשגת השלב הנייח.
הערה: השתמש בתרביות פרומסטיגוט עד 7 מעברים במבחנה כדי למנוע אובדן אלימות.
3. זיהום בלישמניה
- לאחר אימות צמיחה בשלב נייח של טפילים מתורבתים, הסר את כל התוכן מבקבוקי התרבות והניח אותם בצינורות חרוטיים של 50 מ"ל. הוסף תמיסת מלח קרה כדי להשיג נפח סופי של 30 מ"ל.
- צנטריפוגה למשך 10 דקות ב-4 מעלות צלזיוס ב-1,600 × גרם שלוש פעמים. יש להשליך את הסופרנטנט לאחר הצנטריפוגה ולהשעות את הגלולה בתמיסת מלח קרה.
- שטפו את התאים כדי להסיר טפילים שאינם ברי קיימא, והשעו מחדש את הגלולה במי מלח קרים של 1 מ"ל. העבירו את המתלה 5 פעמים לאט דרך מזרק של 1 מ"ל המצויד במחט 16 גרם כדי להפריד בין אשכולות טפילים.
- הסר אליקוט מהדגימה כדי לספור את ריכוז הטפילים בהמוציטומטר באמצעות Eq (1).
ריכוז הטפילים = ממוצע הטפילים ב-4 רבעים × גורם דילול × 104 (1) - חשב את כמות הלישמניה sp. נדרש למספר תאי המארח שיש לציפוי כדי לשמור על יחס טפיל 10:1: תא מארח (שלב 1.27).
- שטפו את ה-DCs על ידי הוספת 1 מ"ל תמיסת מלח וצנטריפוגה של התאים שלוש פעמים בחום של 300 × גרם למשך 10 דקות בטמפרטורת החדר.
- הנח את הנפח הנדרש של לישמניה, בכל באר של צלחת תרבית התאים בת 24 הבארות (ראה שלב 3.5).
- דגרו את ה-DCs עם טפילים למשך 4 שעות בחממה בטמפרטורה של 37 מעלות צלזיוס באטמוספירה של 5% CO2 .
4. צביעה חיסונית לניתוח ציטומטריית זרימה
- לאחר ההדבקה, שטפו את התאים פעמיים עם 1 מ"ל של תמיסת מלח כדי להסיר טפילים שאינם מופנמים.
הערה: הפאנל עם שיבוטי נוגדנים ופלואורוכרומים מופיע בטבלת החומרים. - דילול נוגדנים (1:50) במאגר מיון תאים מופעל פלואורסצנטי (FACS) (1x PBS עם 1% BSA) בנפח סופי של 50 מיקרוליטר לכל תנאי ניסוי.
הערה: חשוב לבצע טיטרציה של נוגדנים לפני הניסוי כדי להבטיח ריכוזי צביעה אופטימליים. בפרוטוקול זה, נעשה שימוש ב-1:50 לאחר ניסויי טיטרציה. - הכינו תערובת מאסטר (1x PBS עם 1% BSA + תערובת נוגדנים). מערבולת ופיפטה 50 מיקרוליטר מהתערובת בבארות המכילות תאים.
- דגרו לזמן קצר את ה-DCs עם תערובת הנוגדנים (CD1a אנטי אנושי, CCR7 אנטי אנושי, CD83 אנטי אנושי, אנטי CD11c, CD209 אנטי אנושי, HLA-DR אנטי אנושי) על קרח למשך 30 דקות, מוגן מאור.
- שטפו תאים פעמיים עם 1 מ"ל של מאגר צביעה קר (1% FBS ב-1x PBS) וצנטריפוגה ב-300 × גרם למשך 5 דקות ב-4 מעלות צלזיוס.
- שאפו את הסופרנטנט והשעו מחדש את הגלולה ב-200 מיקרוליטר של מאגר צביעה קרה.
- המשך ברכישת נתונים על ציטומטר זרימה.
הערה: כדי להבטיח תנאים אופטימליים לניתוח FACS, יש לבצע רכישת נתונים תוך 48 שעות לאחר צביעת הדגימה. הנתונים נותחו באמצעות תוכנת FlowJo.- פתח את תוכנת FlowJo וצור סביבת עבודה חדשה. הוסף את קבצי ציטומטריית הזרימה לניתוח על ידי גרירתם לחלון סביבת העבודה.
- לחץ על שם הצינור כדי לבחור פרמטרים של פיזור צד (SSC) ופיזור קדימה (FSC).
הערה: ניתוח זרימה ציטומטרי של הבשלת DC התבסס על הביטוי של CD1a, CD11c, CD80, CCR7, CD209 ו-HLA-DR. - בעזרת כלי שער המצולע , צייר שער סביב ה-DCs. לחץ פעמיים על התאים המגודרים שנבחרו כדי להציג חלון חדש. בצע ניקוי כפול על-ידי בחירת הפרמטרים FSC-A ו- FSC-H. בעזרת הכלי מצולע , צייר תרשים חדש סביב תאים בודדים.
- לחץ פעמיים על התאים המגודרים ובחר פרמטרים SSC ו-CD11c כדי ליצור שער המכיל תאי CD11c+ .
- ייצא את שער התא CD11c+ הנקי על ידי בחירתו. לחץ לחיצה ימנית על השער ובחר באפשרות בחר צמתים שווי ערך . לחץ לחיצה ימנית וייצא את השער יחד עם כל הפרמטרים שקיבלו פיצוי על ידי שמירתו בתיקייה שנוצרה לאחרונה.
- צור סביבת עבודה חדשה על-ידי פתיחת הקבצים שנשמרו לאחרונה. לחץ על Workspace ובחר תוספים | דגימת הפחתה | 30,000 עד 50,000 אירועים; לחץ על אישור.
הערה: מכיוון ש-TSNE הוא תהליך גוזל זמן ותובעני מבחינה חישובית, שלב זה מומלץ כדי להפחית את המספר הכולל של האירועים המנותחים. - לחץ לחיצה ימנית על קובץ שנדגם לאחור ובחר צמתים שווי ערך.
- לחץ לחיצה ימנית על קובץ עם דגימה מופחתת ובחר ייצוא/שרשור.
- לחץ על חלון השרשור ובחר את כל הפרמטרים המפוצים. בחר את הקבצים המשורשרים ולחץ על סביבת עבודה | תוסף | tSNE.
- בחר את הפרמטרים הרצויים (CD1a, HLA-DR, CCR7, CD80, CD209 ו-CD11c) כדי ליצור אשכולות. לחץ על אישור.
- לחץ על הקובץ המשורשר כדי לדמיין את הפרמטרים tSNE1 ו- tSNE2.
5. צביעה חיסונית של אקטין
- DCs נגועים בצלחת על כיסויים שהונחו בצלחות של 24 בארות. צנטריפוגה את הצלחות ב -300 × גרם ב -4 מעלות צלזיוס למשך 10 דקות. שטפו תאים פי 3 עם מי מלח סטריליים לאחר הדבקה בטמפרטורת החדר כדי להסיר טפילים חוץ-תאיים.
- דגרו את ה-DCs עם 500 מיקרוליטר של 4% פרפורמלדהיד למשך 15 דקות בטמפרטורת החדר. הסר את הפרפורמלדהיד והוסף 1 מ"ל מי מלח (ראה טבלה 1).
6. תיוג חיסוני
הערה: בצע את השלבים הבאים תחת תסיסה.
- שטפו את הכיסויים עם 1x PBS למשך 5 דקות; חזור על הפעולה 3x. הוסף 500 מיקרוליטר של תמיסת אמוניום כלוריד לבאר; דגירה למשך 10 דקות בטמפרטורת החדר.
- שטפו את הכיסויים עם 1x PBS למשך 5 דקות; חזור על הפעולה 3x.
- חדירה לקרום עם 0.15% ספונין למשך 15 דקות.
- בלוק למשך שעה אחת עם 1x PBS 1x/3% BSA/0.15% ספונין. שטפו את הכיסויים עם 1x PBS/0.15% ספונין למשך 5 דקות; חזור על הפעולה 3x.
- דגרו על התאים למשך שעה אחת עם פלואידין (1:1,200) מדולל ב-1x PBS/1% BSA/0.15% ספונין. שטפו את הכיסויים עם 1x PBS/0.15% ספונין למשך 5 דקות; חזור על הפעולה 3x.
- הנח את החלקות הכיסוי עם תאים הפונים כלפי מטה על מדיום הרכבה עם 4',6-דיאמידינו-2-פנילינדול (DAPI). מכסים את השקופיות בנייר אלומיניום כדי להגן עליהן מפני אור.
- רכוש תמונות באמצעות מיקרוסקופ פלואורסצנטי קונפוקלי עם מטרה של 63x/1.4.
7. רכישת מיקרוסקופיה קונפוקלית וכימות פיג'י
- צלם תמונות אימונופלואורסצנטיות באמצעות מיקרוסקופ סריקת לייזר קונפוקלי (ראה טבלת החומרים).
הערה: לקבלת הרזולוציה הטובה ביותר, השתמש בעדשת טבילה בשמן אובייקטיבי פי 63. - הגן על החלקות הכיסוי מפני אור והשאיר אותן בטמפרטורת החדר לפחות 30 דקות לפני הרכישה.
- השתמש ברקמה סופגת כדי לנקות את הכיסויים. הוסף טיפת שמן טבילה למטרה והנח את השקופית על במת המיקרוסקופ. בחר את המטרה פי 63 עם שמן, הרם את הפלטפורמה עד שהשמן נוגע בשקופית, והתאם את המיקוד במיקרוסקופ.
- פתח את התוכנית והפעל את אורכי גל הלייזר של 488, 552 ו-405 ננומטר.
- הגדר את רזולוציית התמונה ל- 1024 x 1024 פיקסלים.
- לחץ על תחתית חיה, הגדר את ערימת Z ולחץ על התחל. חזור על תהליך זה ולאחר מכן לחץ על כפתור סיום .
- המתן להשלמת רכישת התמונה ולאחר מכן בחר באפשרות הקרנה מקסימלית בכלים.
- שמור את הניסוי וייצא תמונות בתבנית .lif למחשב.
- פתח את תוכנית FIJI, פתח את הניסוי ב-FIJI והגדר את מחסנית התצוגה ל-Hyperstack.
- בחר קבצי תמונה פתוחים בנפרד | חיבור אריחים.
- בחר בכלי היד החופשית בסרגל הכלים פיג'י ועקוב אחר כל תא בזהירות ביד. לחץ על ניתוח | מדוד כדי להמחיש את עוצמת הקרינה. חזור על תהליך זה עבור כל סוג תא בכל קבוצה.
- שמור את המידות וייצא אותן לגיליון אלקטרוני. פתח את הקובץ המכיל נתונים באמצעות תוכנת ניתוח סטטיסטי (ראה טבלת החומרים) לביצוע ניתוח סטטיסטי.
8. ניתוח סטטיסטי
- פתח פרויקט חדש בתוכנה.
- עבור נתונים עם התפלגות נורמלית, השתמש במבחן t של סטודנט; עבור נתונים לא פרמטריים, השתמש במבחן Mann-Whitney U .
- הדבק את הערכים שהתקבלו מתוצאות הניסוי בטבלה.
- בחר סטטיסטיקה תיאורית ובחר בסטטיסטיקה של עמודת האפשרויות [כל הבדיקות] כדי לנתח את התפלגות הנתונים.
הערה: אם הנתונים עוקבים אחר התפלגות גאוס, בחר t-test כדי לבחון דגימות על ידי השוואה בין שני זוגות. אם ההתפלגות אינה גאוסית, נתח נתונים באמצעות מבחן Mann-Whitney U עם מדדי נטייה מרכזיים (אמצעים או חציונים) ומדדי שונות. - בחר את אפשרות הגרף הטובה ביותר לייצוג נתונים אופטימלי.
תוצאות
דוח זה חוקר את תפקידם של DCs בזיהום לישמניה, באמצעות ציטומטריית זרימה ומיקרוסקופיה קונפוקלית. בתחילה, נקבע הפרופיל הפנוטיפי של DC שמקורו במונוציטים אנושיים. יש לציין כי אוכלוסיות התאים הדנדריטים CD11c+ שהושגו היו חיוביות ל-CCR7, CD209, CD80, CD1a ו-HLA-DR. התוצאות מצביעות על כך שהביטוי של סמנים אלה באוכלוסיות DC מושפע עמוקות מזיהום לישמניה. DCs נגועים הפגינו ביטוי מוגבר של CD80, CD209, CCR7 ו-HLA-DR. עם זאת, ויסות נמוך של CD1a נצפתה גם ב-DCs נגועים ב-L.amazonensis. בנוסף, ניתוח הרכיבים העיקריים חשף הבדלים מהותיים בביטוי של מולקולות אלה (איור 1B-D). האלגוריתם של הטמעת שכן סטוכסטי מבוזר (t (tSNE), טכניקה להפחתת מימדים, שימש כדי להמחיש טוב יותר כיצד זיהום לישמניה, משפיע על הביטוי של מולקולות הקשורות להתבגרות.
יש לציין כי תרשימי צפיפות tSNE מראים כי DCs נגועים מציגים ביטוי דיפרנציאלי של HLA-DR ו-CD80, מה שמרמז עוד יותר על ויסות מוגבר של מולקולות המעורבות בהצגת אנטיגן (איור 2). כדי להמחיש DCs, צביעה חיסונית של F-actin בוצעה על ידי תיוג התאים בפאלואידין פלואורסצנטי. כדי לצפות בזיהום של L. amazonensis בתוך DCs, נעשה שימוש בצביעה גרעינית (DAPI) כדי להשוות תאים נגועים בלישמניה עם תאים לא נגועים (איור 3). הניתוח הקינטי של זיהום hDC הכולל L. amazonensis promastigotes (10:1) מצביע על אחוז התאים הנגועים ומספר הטפילים לכל תא נגוע 4 שעות לאחר ההדבקה. לאחר מכן התאים נשטפו והודגרו מחדש למשך 6, 12 או 24 שעות. בממוצע, נצפו 4-5 טפילים לכל DC ב~55% מהתאים הנגועים.

איור 1: אפיון DC אנושי מבוסס סמן לאחר זיהום Leishmania amazonensis; אסטרטגיית שער לבחירת CD11c+. (A) הערכת MFI של מולקולה קוסטימולטורית. (B) מפת חום ו-(C) ניתוח רכיבים עיקריים של ערכי MFI של מולקולות קוסטימולטוריות. (D) היסטוגרמות מייצגות ותרשימי פיזור המתארים MFI עבור כל מולקולה. קיצורים: DC = תא דנדריטי; MFI = עוצמת הקרינה החציונית; SSC-A = אזור פיזור צד; FSC-A = אזור פיזור קדימה; FSC-H = גובה פיזור קדימה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
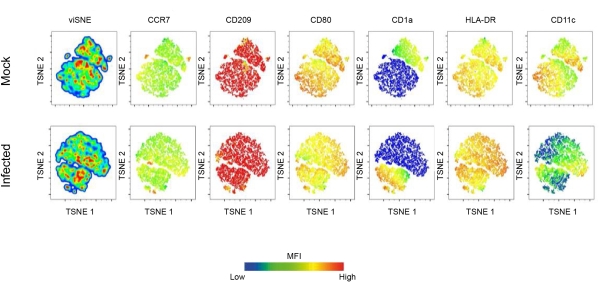
איור 2: ביטוי מולקולרי פני השטח DC המושרה על ידי לישמניה.אפיון מעמיק של נוף התבגרות DC הנגרמת על ידי זיהום לישמניה. בקצרה, DCs שמקורם במונוציטים הושגו לאחר 7 ימים של התמיינות עם GM-CSF ו-IL-4. DCs מובחנים לחלוטין נדבקו ב-L. amazonensis ולאחר מכן נצבעו בפאנל של נוגדני FACS להבשלה. TSNE, טכניקת הפחתת מימדים, שימשה לביצוע ניתוח ממדי גבוה של נתוני ציטומטריית זרימה. קיצורים: DC = תא דנדריטי; GM-CSF = גורם מגרה מושבת גרנולוציטים-מקרופאגים; FACS = מיון תאים המופעל על ידי פלואורסצנטיות; IL-4 = אינטרלוקין-4; TSNE = הטמעת שכן סטוכסטית מבוזרת T. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: זיהום hDC עם Leishmania amazonensis. תאים דנדריטיים אנושיים נדבקו ב-L. amazonensis (10:1) במשך 4 שעות, נשטפו וסומנו בפאלואידין. (A) פלואורסצנטיות של תיוג F-actin ב-hDCs נגועים או לא נגועים. גרין, פ-אקטין; כחול, DAPI לצביעה גרעינית של hDCs וגרעינים של טפילי לישמניה ; חיצים צהובים מייצגים אמסטיגוטים בתוך התא; חיצים לבנים מייצגים hDCs F-actin; גווני אפור, DIC. (B) אחוז הזיהום והעומס הטפילי ב-400 תאים שהוערכו באופן אקראי על ידי מיקרוסקופ פלואורסצנטי (נותח באמצעות Anova). פסי קנה מידה = 25 מיקרומטר. קיצורים: hDC = תא דנדריטי אנושי; DAPI = 4',6-דיאמידינו-2-פנילינדול; DIC = ניגודיות הפרעות דיפרנציאליות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מאגר MACS |
| EDTA 2 מ"מ |
| PBS 1x |
| BSA 0.5% |
| תמיסת מלח חוצצת פוספט (PBS) 1x |
| תמיסת אמוניום כלוריד: 0.134 גרם NH4Cl |
| ספונין 15% |
| 150 מ"ג ספונין ב-1 מ"ל של 1x PBS |
| 1 מ"ל של 15% ספונין ב-100 מ"ל של 1x PBS |
| 10% אלבומין סרום בקר |
| 100 מ"ג - 1 מ"ל → 10% |
| 1 גרם - 100 מ"ל → 1% |
| עבור 10% BSA - 1 גרם BSA ב-10 מ"ל של 1x PBS |
| 1x PBS / 1% BSA / 0.15% ספונין: 20 מ"ל של 1x PBS 2 מ"ל של 10% BSA 200 מיקרוליטר של 15% ספונין |
| 1x PBS / 3% BSA / 0.15% ספונין: 20 מ"ל של 1x PBS; 6 מ"ל של 10% BSA ; 200 מיקרוליטר 15% ספונין |
| 1x PBS / 0.3% BSA / 0.15% ספונין: 20 מ"ל PBS; 0.6 מ"ל של 10% BSA; 200 מיקרוליטר של 15% ספונין |
טבלה 1: קומפוזיציות של פתרונות המשמשים בפרוטוקול זה.
Discussion
לישמניאזיס היא בעיה חמורה של בריאות הציבור ברחבי העולם. הפתוגנזה של מחלה זו מורכבת למדי, והמנגנונים המעדיפים את הישרדות הטפילים במארחים של בעלי חוליות נותרו חמקמקים17. DCs הם תאים מקצועיים המציגים אנטיגן הנמצאים בכל הגוף, כולל איברי סינון ולימפה. לאחר לכידת אנטיגן ועיבודו, DCs לא בשלים עוברים תהליך התבגרות מורכב שמגיע לשיאו בנדידתם לבלוטות הלימפה, שם תאים אלה אחראים על הצגת אנטיגנים ללימפוציטיםT 18. תהליך התבגרות זה מאופיין בביטוי מולקולרי מוגבר של MHC-class II, במיוחד CD11c, CD86, CD80 ו-CD1a19. בלישמניאזיס, DCs שמקורם במונוציטים טפילי פגוציטוז ומעבירים את המטען ל-dLNs, וגורמים להצגת אנטיגן לתאי T13.
מאמר זה מתאר פרוטוקול תמציתי המאפשר לחקור את השפעת הלישמניה על התפקוד האימונוביולוגי של DCs במודל זיהום במבחנה . פרוטוקול זה כולל שימוש בטכניקות אימונולוגיות מתקדמות, כולל השגה והתמיינות של מונוציטים אנושיים ל-DCs, כמו גם אפיון DC באמצעות ציטומטריית זרימה ומיקרוסקופיה קונפוקלית14. בתחילה, מונוציטים טוהרו מ-PBMCs של תורמים בריאים. השימוש בשיטת ברירה חיובית, כגון מיקרו-חרוזי CD14 אנטי-אנושיים, מבטיח רמה גבוהה של טוהר (>95%) של moDCs מובחנים. תאים אלה מודגרים עם מיקרו-חרוזי CD14 אנטי-אנושיים הקושרים את הנוגדן לתאים חיוביים ל-CD14 בדגימה, אשר מופרדים לאחר מכן על ידי שדה מגנטי בעל שיפוע גבוה בתוך העמודה של מפריד תאים מגנטי20.
יש לציין כי ההתמיינות במבחנה של מונוציטים אנושיים ל-DCs דורשת תוספת של GM-CSF ו-IL-4. GM-CSF הוא גורם גדילה פליאוטרופי שלא רק מפחית את הביטוי של גורם מגרה מושבת מקרופאגים (M-CSF) אלא גם מעכב התמיינות הנגרמת על ידי M-CSF למקרופאגים. בנוסף, IL-4 פועל על ידי עיכוב היווצרות מושבות מקרופאגים, הנחשבת לשיטה מתאימה לתרבית moDCs במבחנה21. הפרוטוקול הנוכחי מציע שימוש בזרימה ציטומטרית כדי להעריך התמיינות DC על ידי ניתוח הביטוי של סמנים הקשורים להתבגרות, כגון CCR7, CD209, CD80, CD1a, HLA-DR ו-CD11c. בנוסף, טכניקות ציטומטריית זרימה בממדים גבוהים (למשל, t-SNE) משמשות לזיהוי מדויק של דפוסי ביטוי המושפעיםמזיהום לישמניה. חיוני לייעל את דילול הנוגדנים במהלך צביעה חיסונית.
מיקרוסקופיה קונפוקלית מהווה כלי מצוין לניתוח וכימות עוצמת הקרינה בתאים אנושיים23. חשוב לציין כי בדיקה זו דורשת מניפולציה זהירה לפני רכישת התמונה, כגון שטיפת הכיסויים בעדינות והימנעות מחשיפה לאור. המגבלה העיקרית של שיטה זו היא רכישת רזולוציית תמונה מתאימה במיקרוסקופיה קונפוקלית, הדורשת ניסיון במניפולציה של מיקרוסקופיה. עם זאת, ניתן להשתמש בשיטה זו כדי לחקור את התגובה של DCs לזיהום על ידי פתוגנים שונים. לחלופין, ניתן להוציא את השלבים המתוארים בפרוטוקול זה גם למודלים אחרים של זיהום פתוגני.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
אנו מודים למכון גונסאלו מוניז (IGM-Fiocruz) (באהיה, ברזיל) ולמחלקה למיקרוסקופיה על הסיוע. המחברים אסירי תודה לאנדריס ק. וולטר על ניתוח ביקורתי, תיקון בשפה האנגלית וסיוע בעריכת כתבי יד.
Materials
| Name | Company | Catalog Number | Comments |
| anti CCR7 | Thermo | ||
| anti CD209 | Isofarma | ||
| anti CD83 | Leica SP8 | ||
| anti HLA-DR | Gibco | ||
| Bovine serum albumin | Thermo | A2153-100G | Sigma |
| Ciprofloxacin | Gibco | ||
| confocal microscope | Thermo Fisher Scientific | ||
| Fetal bovine serum | Gibco | ||
| Flow Jo | Thermo Fisher Scientific | ||
| Gentamicin | Thermo Fisher Scientific | ||
| Glutamin | Gibco | ||
| HEPES | Thermo Fisher Scientific | ||
| phalloidin | Thermo Fisher Scientific | ||
| Phosphate buffer solution | Peprotech | ||
| prolong gold antifade kit | BD pharmigen | ||
| RPMI | BD pharmigen | ||
| Saponin | BD pharmigen | 47036 – 50G – F | Sigma |
| Schneider's insect medium | software BD biosciences |
References
- Torres-Guerrero, E., Qunitanilla-Cedillo, M. R., Ruiz-Esmenhjaud, J., Arenas, R. Leishmaniasis: a review. F1000 Research. 6, 750 (2017).
- Pace, D. Leishmaniasis. Journal of Infection. 69, 10-18 (2014).
- Reithinger, R., et al. Cutaneous leishmaniasis. Lancet. Infectious Diseases. 7 (9), 581-596 (2007).
- Kaye, P., Scott, P. Leishmaniasis: complexity at the host-pathogen interface. Nature Reviews. Microbiology. 9 (8), 604-615 (2011).
- Handman, E., Bullen, D. V. Interaction of Leishmania with the host macrophage. Trends in Parasitology. 18 (8), 332-334 (2002).
- Burza, S., Croft, S. L., Boelaert, M. Leishmaniasis. Lancet. 392 (10151), 951-970 (2018).
- Kamhawi, S. Phlebotomine sand flies and Leishmania parasites: friends or foes. Trends in Parasitology. 22 (9), 439-445 (2006).
- Guilliams, M., et al. Unsupervised high-dimensional analysis aligns dendritic cells across tissues and species. Immunity. 45 (3), 669-684 (2016).
- Moll, H. Dendritic cells and host resistance to infection. Cellular Microbiology. 5 (8), 493-500 (2003).
- Sundquist, M., Rydstrom, A., Wick, M. J. Immunity to Salmonella from a dendritic point of view. Cellular Microbiology. 6 (1), 1-11 (2004).
- Saban, D. The chemokine receptor CCR7 expressed by dendritic cells: A key player in corneal and ocular surface inflammation. Ocular Surface Journal. 12, 87-99 (2014).
- Relloso, M., et al. DC-SIGN (CD209) Expression is IL-4 dependent and it is negatively regulated by IFN, TGF and inflammatory agents. Journal of Immunology. 168 (6), 2634-2643 (2002).
- Leon, B., Lopez-Bravo, M., Ardavin, C. Monocyte-derived dendritic cells formed at the infection site control the induction of protective T helper 1 responses against Leishmania. Immunity. 26 (4), 519-531 (2007).
- Gordon, S. Phagocytosis: An immunobiologic process. Immunity. 44 (3), 463-475 (2016).
- Ashok, D., Acha-Orbea, H. Timing is everything: dendritic cell subsets in murine Leishmania infection. Trends in Parasitology. 30 (10), 499-507 (2014).
- Carvalho, A. K., et al. Leishmania (V.) braziliensis and L. (L.) amazonensis promote differential expression of dendritic cells and cellular immune response in murine model. Parasite Immunology. 34 (8-9), 395-403 (2012).
- Bates, P. A. Transmission of Leishmania metacyclic promastigotes by phlebotomine sand flies. International Journal of Parasitology. 37 (10), 1097-1106 (2007).
- Cervantes-Barragan, L., et al. Plasmacytoid dendritic cells control T-cell response to chronic viral infection. Proceedings of the National Academy of Sciences of the United States of America. 109 (8), 3012-3017 (2012).
- Caux, C., et al. Activation of human dendritic cells through CD40 cross-linking. Journal of Experimental Medicine. 180 (4), 1263-1272 (1994).
- Suzuki, H., et al. Activities of granulocyte-macrophage colony-stimulating factor and interleukin-3 on monocytes. American Journal of Hematology. 75 (4), 179-189 (2004).
- Akira, S., Takeda, K. Toll-like receptor signalling. Nature Reviews. Immunology. 4 (7), 499-511 (2004).
- McKinnon, K. M. Flow cytometry: An overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Sanderson, M. J., et al. Fluorescence microscopy. Cold Spring Harbor Protocols. 10, 1795 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved