Method Article
In vitro Diferenciação de células dendríticas humanas e seus marcadores na infecção por Leishmania
Neste Artigo
Resumo
As células dendríticas (DCs) são componentes essenciais da imunidade inata contra a infecção por Leishmania. Os mecanismos subjacentes à complexa interação entre CDs e Leishmania permanecem pouco compreendidos. Aqui, descrevemos métodos para avaliar como a infecção por Leishmania afeta a função imunobiológica de DCs humanas, como expressão de moléculas relacionadas à migração e coestimulatórias.
Resumo
A leishmaniose compreende um conjunto de manifestações clínicas associadas à infecção de protozoários intracelulares obrigatórios, Leishmania. O ciclo de vida dos parasitas Leishmania consiste em dois estágios de vida alternados (amastigotas e promastigotas), durante os quais os parasitas residem em vetores artrópodes ou hospedeiros vertebrados, respectivamente. Notavelmente, as complexas interações entre os parasitas Leishmania e várias células do sistema imunológico influenciam amplamente o resultado da infecção. É importante ressaltar que, embora os macrófagos sejam conhecidos por serem o principal nicho do hospedeiro para a replicação de Leishmania , os parasitas também são fagocitados por outras células imunes inatas, como neutrófilos e células dendríticas (DCs).
As DCs desempenham um papel importante na ponte entre os ramos inato e adaptativo da imunidade e, assim, orquestram as respostas imunes contra uma ampla gama de patógenos. Os mecanismos pelos quais Leishmania e DCs interagem permanecem obscuros e envolvem aspectos da captura de patógenos, a dinâmica de maturação e ativação de DC, migração de DC para linfonodos de drenagem (dLNs) e apresentação de antígenos para células T. Embora um grande corpo de estudos apóie a noção de que as DCs desempenham um papel duplo na modulação das respostas imunes contra Leishmania, a participação dessas células na suscetibilidade ou resistência à Leishmania permanece pouco compreendida. Após a infecção, as DCs passam por um processo de maturação associado à regulação positiva do complexo principal de histocompatibilidade de superfície (MHC) II, além de moléculas coestimulatórias (a saber, CD40, CD80 e CD86).
Compreender o papel das DCs no desfecho da infecção é crucial para o desenvolvimento de estratégias terapêuticas e profiláticas para modular a resposta imune contra Leishmania. Este artigo descreve um método para a caracterização da interação Leishmania-DC. Este protocolo detalhado fornece orientação ao longo das etapas de diferenciação DC, caracterização de moléculas de superfície celular e protocolos de infecção, permitindo que os cientistas investiguem a resposta DC à infecção por Leishmania e obtenham informações sobre os papéis desempenhados por essas células no curso da infecção.
Introdução
A leishmaniose constitui um complexo de doenças negligenciadas causadas por diferentes espécies do gênero Leishmania 1. Leishmania é um protozoário intracelular da família Trypanosomatidae que infecta humanos e outros mamíferos, causando um espectro de doenças que vão desde lesões cutâneas até formas viscerais2. As principais manifestações clínicas dessa doença são a leishmaniose tegumentar (LT) e a leishmaniose visceral (LV). A Organização Mundial da Saúde (OMS) estima que 700.000 a 1 milhão de novos casos ocorram anualmente, causando 70.000 mortes a cada ano2. Em todo o mundo, a leishmaniose afeta aproximadamente 12 a 15 milhões de pessoas, e 350 milhões estão em risco de contrair a doença3.
O gênero Leishmania apresenta duas formas evolutivas: a promastigota e a amastigota4. Os promastigotas de Leishmania são caracterizados pela presença de flagelos e alta motilidade. Essas formas são encontradas no trato digestivo do flebotomíneo, onde sofrem diferenciação para a forma infecciosa (promastigotas metacíclicos)5. Por outro lado, as amastigotas são encontradas no ambiente intracelular de células de mamíferos infectadas. Essa forma evolutiva, por sua vez, se replica nos fagolisossomos das células fagocíticas6.
O ciclo de transmissão de Leishmania spp. começa durante a alimentação sanguínea, quando os flebotomíneos inoculam promastigotas metacíclicos na pele do hospedeiro1. Logo após a inoculação de Leishmania , células imunes inatas, incluindo neutrófilos e macrófagos residentes no tecido, fagocitam os parasitas. Dentro dos vacúolos parasitóforos, Leishmania se diferencia em amastigotas e se replica, culminando na ruptura da membrana da célula hospedeira, o que permite a infecção das células vizinhas e a disseminação do parasita4. O ciclo é completado quando os flebotomíneos ingerem fagócitos contendo amastigotas, que se diferenciam em promastigotas pró-cíclicos e, posteriormente, em promastigotas metacíclicos no trato intestinal do inseto7.
As células dendríticas, células apresentadoras de antígenos profissionais encontradas em tecidos e linfonodos, atuam como sentinelas para o sistema imunológico8. Essas células são encontradas em tecidos periféricos em estágios imaturos, envolvidas principalmente na captura e processamento de antígenos. Após o contato com patógenos, as DCs passam por um processo de maturação que culmina em sua migração para os linfonodos, apresentando posteriormente antígenos para células T CD4+ virgens. Essas células também são essenciais para orquestrar as respostas imunes inatas e adaptativas que geram tolerância ou inflamação9. O processo de maturação da DC envolve vários aspectos, incluindo aumento da expressão de MHC e moléculas coestimulatórias, como CD40 e CD86, bem como aumento da secreção de citocinas. As DCs expressam diferentes marcadores, incluindo CD11b e CD11c, e, em humanos, as DCs que se originam de monócitos CD14+ (moDCs) expressam CD1a10. O CCR7 é altamente expresso em DCs e indica o complexo processo migratório dessas células12. CD209 e CD80 também desempenham um papel importante no contato inicial com DCs e linfócitos13.
Na leishmaniose, estudos sugerem que os moDCs fagocitam parasitas e os entregam aos linfonodos drenantes (dLNs), onde apresentam antígenos para as células T13. O mecanismo de captura do parasita está associado à reorganização do citoesqueleto por filamentos de actina durante a fagocitose, o que promove a internalização do parasita14. A maioria dos estudos sobre os papéis exercidos pelas CDs na leishmaniose tem se concentrado em L. major, L. amazonensis e L. braziliensis15. Curiosamente, estudos in vivo de infecção por Leishmania demonstraram que o comprometimento da função DC ocorre de maneira específica da cepa do parasita.
Foi demonstrado que durante os estágios iniciais da infecção por L. amazonensis , as DCs exibem uma capacidade diminuída de restringir a infecção do parasita. Por outro lado, em um modelo experimental de infecção por L. braziliensis , as DCs demonstraram montar respostas imunes apropriadas que restringiram a sobrevivência de Leishmania16. Os principais aspectos conhecidos por estarem associados às respostas diferenciais à infecção por Leishmania spp. são o grau de maturação e ativação da DC. Este artigo descreve um método para investigar o papel que as DCs humanas desempenham na infecção por Leishmania para entender melhor como essas células influenciam os resultados da doença.
Protocolo
NOTA: As células foram obtidas de voluntários doadores saudáveis. O procedimento aqui descrito foi aprovado pelo Comitê Nacional de Ética (número 2.751.345) - Fiocruz, Bahia, Brasil).
1. Diferenciação de células dendríticas humanas
- Pipetar 10 mL de mistura de triazoato de polissacarose e sódio em tubos cônicos de 50 mL.
- Rotule os tubos cônicos de 50 mL, respectivamente, para cada doador.
- Colete 30 mL de sangue de doadores saudáveis e execute todas as etapas subsequentes na capela de fluxo laminar.
- Transfira cuidadosamente o sangue para os tubos cônicos e dilua o sangue em solução salina (cloreto de sódio a 0,9%) na proporção de 1:1 à temperatura ambiente.
- Cubra o sangue lentamente diluído na mistura de triazoato de polissacarose e sódio nos tubos (etapa 1.1). Centrifugar os tubos uma vez a 400 × g durante 30 min a 25 °C.
NOTA: Desligue o freio antes da centrifugação para evitar a mistura de camadas de gradiente. Após a primeira centrifugação, diminuir a temperatura para 4 °C na centrífuga. - Retire cuidadosamente os tubos da centrífuga.
- Procure o anel formado por células mononucleares do sangue periférico (PBMCs) na amostra (buffy coat); aspirar cuidadosamente o plasma residual com uma pipeta.
NOTA: A centrifugação leva à formação das seguintes camadas de gradiente: eritrócitos, meio de gradiente de densidade, anel PBMC e plasma. O anel PBMC está entre o meio gradiente de densidade e as camadas de plasma. - Transfira a camada turva de PBMC para outro tubo e adicione solução salina até um volume final de 30 mL.
- Centrifugar os tubos que contêm as suspensões celulares a 250 × g durante 10 min a 4 °C. Descarte o sobrenadante e adicione 1 mL de solução salina para ressuspender o pellet.
- Colete uma alíquota para contagem de células e dilua-a 1:1.000. Use 10 μL das células diluídas para contar as células pelo método de exclusão de azul de tripano usando uma câmara de Neubauer para determinar a viabilidade celular.
- Girar novamente a suspensão a 200 × g durante 10 min a 4 °C.
- Ressuspenda o pellet no tampão de classificação de células ativadas por magnetismo (MACS). Use 80 μL do tampão por 1 × 107 células.
NOTA: Consulte a Tabela 1 para obter a composição do buffer MACS. Mantenha o tampão frio e armazene-o a 2-8 °C. - Adicione microesferas de CD14 à suspensão celular preparada na etapa 1.9. Use 20 μL de microesferas CD14 por 1 × 107 células.
NOTA: As microesferas de CD14 são usadas para selecionar positivamente monócitos humanos de PBMCs, pois as esferas contendo anti-CD14 humano se ligam a células CD14 + expressas nas superfícies da maioria dos monócitos. - Pipete para cima e para baixo para ressuspender os pellets e microesferas uniformemente. Mantenha no gelo por 15 min.
- Centrifugar a suspensão a 300 × g durante 10 min a 4 °C.
- Ressuspenda as células no buffer MACS. Use 1-2 mL por 1 × 107 células na mistura célula-microesfera.
- Centrifugar a suspensão a 300 × g durante 10 min a 4 °C.
- Remova o sobrenadante e ressuspenda o pellet em 500 μL de tampão MACS.
NOTA: Este é o volume máximo da suspensão da célula a ser processada em uma coluna. - Monte a coluna magnética.
- Lave a coluna uma vez com 500 μL de tampão MACS e deixe o tampão fluir sob gravidade através da coluna.
NOTA: Tome cuidado para não permitir que a coluna fique seca, pois o ar pode obstruir a coluna. - Adicionar 500 μL da suspensão célula-grânulo (passo 1.19) por coluna. Permita que a suspensão da célula flua sob gravidade através da coluna.
- Lave a coluna com 500 μL de tampão MACS (2x). Adicione um novo buffer somente quando o reservatório da coluna estiver vazio. Não deixe a coluna secar.
- Coloque um novo tubo embaixo da coluna, pipete 1 mL do tampão MACS na coluna e lave imediatamente as células marcadas magneticamente para fora da coluna empurrando firmemente o êmbolo.
- Centrifugar as células enriquecidas com CD14 a 300 × g durante 10 min a 4 °C.
- Conte as células usando uma câmara de Neubauer.
- Ressuspenda as células em 1 mL de RPMI completo com 100 μL / mL de interleucina-4 (IL-4) ((50 ng / mL) + fator estimulador de colônias de granulócitos-macrófagos (GM-CSF) (50 ng / mL).
- Células de sementes em uma placa de 24 poços a uma concentração de 2 × 105 células por poço em 500 μL de meio RPMI completo contendo as citocinas acima e incubar por 7 dias a 37 ° C.
2. Cultura Leishmania
NOTA: Parasitas L. amazonensis (MHOM/BR88/Ba-125) foram utilizados neste ensaio.
- Mantenha promastigotas em meio de ágar sangue Novy-Nicolle-MacNeal (NNN) com 5 mL de meio completo ou meio essencial mínimo (MEM) de Schneider em um frasco de culturade 25 cm 2 em uma incubadora de demanda de biooxigênio (DBO) a 24 ° C.
NOTA: Para o cultivo da forma promastigota da espécie L. amazonensis , foram utilizados 5 mL de meio completo de Schneider (Schneider ́s Insect Medium contendo 10% de soro fetal bovino inativado (FBS) e gentamicina na concentração de 50 μg/mL). - Incubar durante 7 dias a 24 °C na incubadora de CBO.
- Pipetar 100 μL de cultura promastigota para um novo balão de cultura de2 células de 25 cm.
- Adicione 5 mL do MEM suplementado.
- Incubar a 24 °C na incubadora BOD e contar periodicamente os promastigotas transferindo uma alíquota de suspensão de células parasitas diluídas em solução salina para uma câmara de Neubauer (ou seja, hemocitômetro) até que a fase estacionária seja atingida.
NOTA: Não use a primeira passagem pós-NNN Medium para experimentos. - Transfira 1 × 105 de promastigotas da fase de crescimento estacionário de Leishmania para um novo frasco de cultura de células2 de 25 cm e adicione 5 mL do MEM suplementado.
- Monitore periodicamente o crescimento das culturas usando uma câmara de Neubauer até que a fase estacionária seja alcançada.
NOTA: Use culturas promastigotas por até 7 passagens in vitro para evitar perda de virulência.
3. Infecção por Leishmania
- Depois de verificar o crescimento em fase estacionária dos parasitas cultivados, remova todo o conteúdo dos frascos de cultura e coloque-os em tubos cônicos de 50 mL. Adicione solução salina fria para atingir um volume final de 30 mL.
- Centrifugue por 10 min a 4 °C a 1.600 × g três vezes. Rejeitar o sobrenadante após centrifugação e ressuspender o sedimento numa solução salina fria.
- Lave as células para remover quaisquer parasitas não viáveis e ressuspenda o pellet em 1 mL de solução salina fria. Passe a suspensão 5 vezes lentamente através de uma seringa de 1 ml equipada com uma agulha de 16 G para separar os aglomerados de parasitas.
- Remover uma alíquota da amostra para contar a concentração do parasita num hemocitómetro utilizando a Eq (1).
Concentração parasitária = média dos parasitas em 4 quadrantes × factor de diluição × 104 (1) - Calcule a quantidade de Leishmania sp. necessário para o número de células hospedeiras a serem plaqueadas para manter uma proporção de 10:1 parasita: célula hospedeira (etapa 1.27).
- Lave as DCs adicionando 1 mL de solução salina e centrifugando as células três vezes a 300 × g por 10 min em temperatura ambiente.
- Coloque o volume necessário de Leishmania em cada alvéolo da placa de cultura de células de 24 poços (consulte a etapa 3.5).
- Incubar as DCs com parasitas durante 4 h numa incubadora a 37 °C numa atmosfera de CO2 a 5%.
4. Imunocoloração para análise por citometria de fluxo
- Após a infecção, lave as células duas vezes com 1 mL de solução salina para remover quaisquer parasitas não internalizados.
NOTA: O painel com clones de anticorpos e fluorocromos está listado na Tabela de Materiais. - Dilua os anticorpos (1:50) em tampão de classificação de células ativadas por fluorescência (FACS) (1x PBS com 1% de BSA) a um volume final de 50 μL por condição experimental.
NOTA: É importante titular os anticorpos antes da experimentação para garantir concentrações ideais de coloração. Neste protocolo, 1:50 foi utilizado após os experimentos de titulação. - Prepare uma mistura master (1x PBS com 1% BSA + mistura de anticorpos). Vórtice e pipeta 50 μL da mistura em poços contendo células.
- Incube brevemente as DCs com a mistura de anticorpos (anti-CD1a humano, anti-CCR7 humano, anti-CD83 humano, anti-CD11c, anti-CD209 humano, anti-HLA-DR humano) em gelo por 30 min, protegido da luz.
- Lave as células duas vezes com 1 mL de tampão de coloração a frio (1% FBS em 1x PBS) e centrifugue a 300 × g por 5 min a 4 ° C.
- Aspirar o sobrenadante e ressuspender o sedimento em 200 μl de tampão de coloração a frio.
- Prossiga com a aquisição de dados em um citômetro de fluxo.
NOTA: Para garantir as condições ideais para a análise FACS, a aquisição de dados deve ser realizada dentro de 48 h após a coloração da amostra. Os dados foram analisados por meio do software FlowJo.- Abra o programa de software FlowJo e crie um novo espaço de trabalho. Adicione os arquivos de citometria de fluxo a serem analisados arrastando-os para a janela da área de trabalho.
- Clique no nome do tubo para selecionar os parâmetros de dispersão lateral (SSC) e dispersão direta (FSC).
NOTA: A análise por citometria de fluxo da maturação DC foi baseada na expressão de CD1a, CD11c, CD80, CCR7, CD209 e HLA-DR. - Usando a ferramenta de passagem de polígonos , desenhe uma porta ao redor dos DCs. Clique duas vezes nas células fechadas selecionadas para exibir uma nova janela. Execute a limpeza dupla selecionando os parâmetros FSC-A e FSC-H. Usando a ferramenta polígono , desenhe um novo gráfico em torno de células individuais.
- Clique duas vezes nas células fechadas e selecione os parâmetros SSC e CD11c para gerar uma porta contendo células CD11c+ .
- Exporte a porta da célula CD11c+ limpa selecionando-a. Clique com o botão direito do mouse no portão e selecione a opção Selecionar nós equivalentes . Clique com o botão direito do mouse e exporte a porta junto com todos os parâmetros compensados, salvando-a em uma pasta criada recentemente.
- Crie um novo espaço de trabalho abrindo os arquivos salvos recentemente. Clique em Espaço de trabalho e selecione plugins | Redução da amostra | 30.000 a 50.000 eventos; pressione OK.
NOTA: Como o TSNE é um processo demorado e computacionalmente exigente, esta etapa é recomendada para reduzir o número total de eventos analisados. - Clique com o botão direito do mouse em um arquivo com resolução reduzida e selecione nós equivalentes.
- Clique com o botão direito do mouse em um arquivo com resolução reduzida e selecione Exportar/concatenar.
- Clique na janela de concatenação e selecione todos os parâmetros compensados. Selecione os arquivos concatenados e clique em workspace | plugin | tSNE.
- Selecione os parâmetros desejados (CD1a, HLA-DR, CCR7, CD80, CD209 e CD11c) para criar clusters. Pressione OK.
- Clique no arquivo concatenado para visualizar os parâmetros tSNE1 e tSNE2.
5. Imunomarcação de actina
- DCs infectadas com placas em lamínulas colocadas em placas de 24 poços. Centrifugar as placas a 300 × g a 4 °C durante 10 min. Lave as células 3x com solução salina estéril após a infecção em temperatura ambiente para remover quaisquer parasitas extracelulares.
- Incube as DCs com 500 μL de paraformaldeído a 4% por 15 min em temperatura ambiente. Remova o paraformaldeído e adicione 1 mL de solução salina (ver Tabela 1).
6. Imunomarcação
NOTA: Execute as etapas a seguir sob agitação.
- Lave as lamínulas com 1x PBS por 5 min; repita 3x. Adicionar 500 μL de solução de cloreto de amônio por poço; Incube por 10 min em temperatura ambiente.
- Lave as lamínulas com 1x PBS por 5 min; repita 3x.
- Permeabilize a membrana com saponina a 0,15% por 15 min.
- Bloqueie por 1 h com 1x PBS 1x/3% BSA/0,15% saponina. Lave as lamínulas com 1x PBS/0,15% de saponina por 5 min; repita 3x.
- Incubar as células por 1 h com faloidina (1:1.200) diluída em 1x PBS/1% BSA/0,15% saponina. Lave as lamínulas com 1x PBS/0,15% de saponina por 5 min; repita 3x.
- Coloque as lamínulas com as células voltadas para baixo no meio de montagem com 4',6-diamidino-2-fenilindol (DAPI). Cubra as lâminas com papel alumínio para protegê-las da luz.
- Adquira imagens usando um microscópio de fluorescência confocal com uma objetiva de 63x/1,4.
7. Aquisição de microscopia confocal e quantificação de Fiji
- Capture imagens de imunofluorescência usando um microscópio confocal de varredura a laser (consulte a Tabela de Materiais).
NOTA: Para obter a melhor resolução, use uma lente objetiva de imersão em óleo de 63x. - Proteja as lamínulas da luz e deixe-as em temperatura ambiente por pelo menos 30 minutos antes da aquisição.
- Use lenço absorvente para limpar as lamínulas. Adicione uma gota de óleo de imersão à objetiva e coloque a lâmina no microscópio stage. Selecione a objetiva 63x com óleo, levante a plataforma até que o óleo toque a lâmina e ajuste o foco no microscópio.
- Abra o programa e ative os comprimentos de onda do laser de 488, 552 e 405 nm.
- Defina a resolução da imagem para 1024 x 1024 pixels.
- Clique na parte inferior ao vivo, defina a pilha Z e pressione Iniciar. Repita esse processo e pressione o botão Terminar .
- Aguarde a conclusão da aquisição da imagem e selecione a opção Projeção máxima nas ferramentas.
- Salve o experimento e exporte as imagens no formato .lif para um computador.
- Abra o programa FIJI, abra o experimento em FIJI e defina a pilha de exibição como Hyperstack.
- Selecione abrir arquivos de imagem individualmente | costurar ladrilhos.
- Selecione a ferramenta mão livre na barra de ferramentas Fiji e trace cada célula cuidadosamente à mão. Pressione analyze | measure para visualizar a intensidade da fluorescência. Repita esse processo para cada tipo de célula por grupo.
- Salve as medidas e exporte-as para uma planilha. Abra o arquivo que contém os dados usando o software de análise estatística (consulte a Tabela de Materiais) para realizar a análise estatística.
8. Análise estatística
- Abra um novo projeto no software.
- Para dados com distribuição normal, use o teste t de Student; para dados não paramétricos, use o teste U de Mann-Whitney.
- Cole os valores obtidos dos resultados experimentais na tabela.
- Selecione estatísticas descritivas e escolha a opção estatísticas de coluna [todos os testes] para analisar a distribuição de dados.
NOTA: Se os dados seguirem a distribuição gaussiana, escolha o teste t para examinar amostras comparando dois pares. Se a distribuição for não gaussiana, analise os dados usando o teste U de Mann-Whitney com medidas de tendência central (médias ou medianas) e medidas de variação. - Escolha a melhor opção de gráfico para uma representação de dados ideal.
Resultados
Este relatório investiga o papel das DCs na infecção por Leishmania usando citometria de fluxo e microscopia confocal. Inicialmente, foi estabelecido o perfil fenotípico da DC derivada de monócitos humanos. Notavelmente, as populações de células dendríticas CD11c+ obtidas foram positivas para CCR7, CD209, CD80, CD1a e HLA-DR. Os resultados indicam que a expressão desses marcadores em populações DC é profundamente impactada pela infecção por Leishmania. DCs infectadas exibiram expressão aumentada de CD80, CD209, CCR7 e HLA-DR. No entanto, a regulação negativa de CD1a também foi observada em DCs infectadas por L. amazonensis. Além disso, a análise de componentes principais revelou diferenças substanciais na expressão dessas moléculas (Figura 1B-D). O algoritmo T-Distributed Stochastic Neighbor Embedding (t (tSNE), uma técnica de redução de dimensionalidade, foi empregado para visualizar melhor como a infecção por Leishmania afeta a expressão de moléculas relacionadas à maturação.
É importante notar que os gráficos de densidade de tSNE mostram que DCs infectadas apresentam expressão diferencial de HLA-DR e CD80, o que sugere ainda mais a regulação positiva de moléculas envolvidas na apresentação do antígeno (Figura 2). Para visualizar DCs, a imunomarcação de F-actina foi realizada marcando as células com faloidina fluorescente. Para observar a infecção por L. amazonensis dentro das DCs, a coloração nuclear (DAPI) foi usada para comparar células infectadas por Leishmania com células não infectadas (Figura 3). A análise cinética da infecção por hDC envolvendo promastigotas de L. amazonensis (10:1) indica a porcentagem de células infectadas e o número de parasitas por célula infectada 4 h após a infecção. As células foram então lavadas e reincubadas por 6, 12 ou 24h. Em média, 4-5 parasitas foram observados por DC em ~ 55% das células infectadas.

Figura 1: Caracterização de DC humana baseada em marcadores após infecção por Leishmania amazonensis; estratégia de gating para seleção de CD11c+. (A) Avaliação da molécula coestimulatória MFI. (B) Mapa de calor e (C) análise de componentes principais dos valores de MFI da molécula coestimulatória. (D) Histogramas representativos e gráficos de dispersão representando MFI para cada molécula. Abreviaturas: DC = célula dendrítica; IFM = intensidade de fluorescência mediana; SSC-A = área de dispersão lateral; FSC-A = área de dispersão direta; FSC-H = altura de dispersão para frente. Clique aqui para ver uma versão maior desta figura.
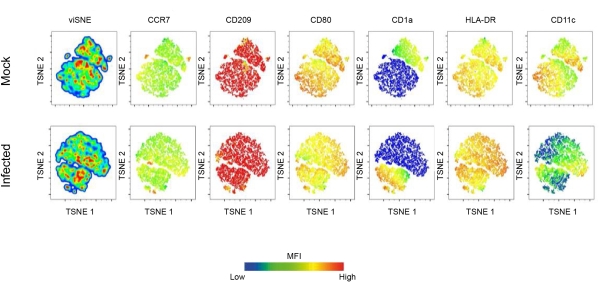
Figura 2: Expressão molecular de superfície DC induzida por Leishmania.Caracterização aprofundada da paisagem de maturação DC induzida pela infecção por Leishmania. Resumidamente, DCs derivadas de monócitos foram obtidas após 7 dias de diferenciação com GM-CSF e IL-4. DCs totalmente diferenciadas foram infectadas com L. amazonensis e depois coradas com um painel de anticorpos FACS de maturação. O TSNE, uma técnica de redução de dimensionalidade, foi empregado para realizar uma análise de alta dimensão dos dados de citometria de fluxo. Abreviaturas: DC = célula dendrítica; GM-CSF = fator estimulador de colônias de granulócitos-macrófagos; FACS = classificação de células ativadas por fluorescência; IL-4 = interleucina-4; TSNE = incorporação de vizinhos estocásticos distribuídos em T. Clique aqui para ver uma versão maior desta figura.

Figura 3: Infecção por hDC com Leishmania amazonensis. As células dendríticas humanas foram infectadas com L. amazonensis (10:1) por 4 h, lavadas e marcadas com faloidina. (A) Fluorescência da marcação de F-actina em hDCs infectadas ou não infectadas. Verde, F-actina; azul, DAPI para coloração nuclear de hDCs e núcleos de parasitas Leishmania ; setas amarelas representam amastigotas dentro da célula; setas brancas representam hDCs F-actina; escala de cinza, DIC. (B) Porcentagem de infecção e carga parasitária em 400 células avaliadas aleatoriamente por microscopia de fluorescência (analisadas usando Anova). Barras de escala = 25 μm. Abreviaturas: hDC = célula dendrítica humana; DAPI = 4',6-diamidino-2-fenilindol; CID = contraste de interferência diferencial. Clique aqui para ver uma versão maior desta figura.
| Buffer MACS |
| EDTA 2 mM |
| PBS 1x |
| BSA 0,5% |
| Solução salina tamponada com fosfato (PBS) 1x |
| Solução de cloreto de amônio: 0,134 g de NH4Cl |
| Saponina 15% |
| 150 mg de saponina em 1 mL de 1x PBS |
| 1 mL de saponina a 15% em 100 mL de 1x PBS |
| 10% de albumina de soro bovino |
| 100 mg – 1 mL → 10% |
| 1 g – 100 mL → 1% |
| Para 10% de BSA - 1 g de BSA em 10 mL de 1x PBS |
| 1x PBS/ 1% BSA / 0,15% Saponina: 20 mL de 1x PBS 2 mL de BSA a 10% 200 μL de saponina a 15% |
| 1x PBS/ 3% BSA / 0,15% Saponina: 20 mL de 1x PBS; 6 mL de 10% de BSA; 200 μL 15% Saponina |
| 1x PBS / 0,3% BSA / 0,15% Saponina: 20 mL PBS; 0,6 mL de 10% de BSA; 200 μL de saponina a 15% |
Tabela 1: Composições das soluções utilizadas neste protocolo.
Discussão
A leishmaniose é um grave problema de saúde pública em todo o mundo. A patogênese dessa doença é bastante complexa, e os mecanismos que favorecem a sobrevivência do parasita em hospedeiros vertebrados permanecem indescritíveis17. DCs são células apresentadoras de antígenos profissionais encontradas em todo o corpo, incluindo órgãos filtrantes e linfóides. Após a captura e processamento do antígeno, as DCs imaturas passam por um complexo processo de maturação que culmina em sua migração para os linfonodos, onde essas células são responsáveis por apresentar antígenos aos linfócitos T18. Esse processo de maturação é caracterizado pelo aumento da expressão molecular de MHC classe II, notadamente CD11c, CD86, CD80 e CD1a19. Na leishmaniose, as DCs derivadas de monócitos fagocitam parasitas e entregam a carga aos dLNs, induzindo a apresentação de antígenos às células T13.
Este artigo descreve um protocolo conciso que permite investigar o impacto da Leishmania no funcionamento imunobiológico das DCs em um modelo in vitro de infecção. Esse protocolo engloba o uso de técnicas imunológicas de última geração, incluindo a obtenção e diferenciação de monócitos humanos em DCs, bem como a caracterização de DC por citometria de fluxo e microscopia confocal14. Inicialmente, os monócitos foram purificados a partir das PBMCs de doadores saudáveis. O uso de um método de seleção positiva, como microesferas CD14 anti-humanas, garante um alto grau de pureza (>95%) de moDCs diferenciados. Essas células são incubadas com microesferas anti-CD14 humanas que ligam o anticorpo às células CD14-positivas na amostra, que são então separadas por um campo magnético de alto gradiente dentro da coluna de um separador de células magnéticas20.
Notavelmente, a diferenciação in vitro de monócitos humanos em DCs requer a adição de GM-CSF e IL-4. GM-CSF é um fator de crescimento pleiotrópico que não apenas regula negativamente a expressão do fator estimulador de colônias de macrófagos (M-CSF), mas também inibe a diferenciação induzida por M-CSF em macrófagos. Além disso, a IL-4 atua inibindo a formação de colônias de macrófagos, considerado um método adequado para o cultivo de moDCs in vitro21. O presente protocolo propõe o uso de citometria de fluxo para avaliar a diferenciação de DC analisando a expressão de marcadores relacionados à maturação, como CCR7, CD209, CD80, CD1a, HLA-DR e CD11c. Além disso, técnicas de citometria de fluxo de alta dimensão (por exemplo, t-SNE) são usadas para identificar com precisão os padrões de expressão influenciados pela infecção por Leishmania 22. É crucial otimizar a diluição do anticorpo durante a imunocoloração.
A microscopia confocal constitui uma excelente ferramenta para analisar e quantificar a intensidade de fluorescência em células humanas23. É importante notar que este ensaio requer manipulação cuidadosa antes da aquisição da imagem, como lavar as lamínulas suavemente e evitar a exposição à luz. A principal limitação deste método é a aquisição de resolução de imagem adequada em microscopia confocal, o que requer experiência com manipulação de microscopia. No entanto, este método pode ser usado para estudar a resposta das DCs à infecção por diferentes patógenos. Alternativamente, as etapas descritas neste protocolo também podem ser extrapoladas para outros modelos de infecção por patógenos.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Agradecemos ao Instituto Gonçalo Moniz (IGM-Fiocruz) (Bahia, Brasil) e ao departamento de microscopia pelo auxílio. Os autores agradecem a Andris K. Walter pela análise crítica, revisão da língua inglesa e assistência na edição de manuscritos.
Materiais
| Name | Company | Catalog Number | Comments |
| anti CCR7 | Thermo | ||
| anti CD209 | Isofarma | ||
| anti CD83 | Leica SP8 | ||
| anti HLA-DR | Gibco | ||
| Bovine serum albumin | Thermo | A2153-100G | Sigma |
| Ciprofloxacin | Gibco | ||
| confocal microscope | Thermo Fisher Scientific | ||
| Fetal bovine serum | Gibco | ||
| Flow Jo | Thermo Fisher Scientific | ||
| Gentamicin | Thermo Fisher Scientific | ||
| Glutamin | Gibco | ||
| HEPES | Thermo Fisher Scientific | ||
| phalloidin | Thermo Fisher Scientific | ||
| Phosphate buffer solution | Peprotech | ||
| prolong gold antifade kit | BD pharmigen | ||
| RPMI | BD pharmigen | ||
| Saponin | BD pharmigen | 47036 – 50G – F | Sigma |
| Schneider's insect medium | software BD biosciences |
Referências
- Torres-Guerrero, E., Qunitanilla-Cedillo, M. R., Ruiz-Esmenhjaud, J., Arenas, R. Leishmaniasis: a review. F1000 Research. 6, 750 (2017).
- Pace, D. Leishmaniasis. Journal of Infection. 69, 10-18 (2014).
- Reithinger, R., et al. Cutaneous leishmaniasis. Lancet. Infectious Diseases. 7 (9), 581-596 (2007).
- Kaye, P., Scott, P. Leishmaniasis: complexity at the host-pathogen interface. Nature Reviews. Microbiology. 9 (8), 604-615 (2011).
- Handman, E., Bullen, D. V. Interaction of Leishmania with the host macrophage. Trends in Parasitology. 18 (8), 332-334 (2002).
- Burza, S., Croft, S. L., Boelaert, M. Leishmaniasis. Lancet. 392 (10151), 951-970 (2018).
- Kamhawi, S. Phlebotomine sand flies and Leishmania parasites: friends or foes. Trends in Parasitology. 22 (9), 439-445 (2006).
- Guilliams, M., et al. Unsupervised high-dimensional analysis aligns dendritic cells across tissues and species. Immunity. 45 (3), 669-684 (2016).
- Moll, H. Dendritic cells and host resistance to infection. Cellular Microbiology. 5 (8), 493-500 (2003).
- Sundquist, M., Rydstrom, A., Wick, M. J. Immunity to Salmonella from a dendritic point of view. Cellular Microbiology. 6 (1), 1-11 (2004).
- Saban, D. The chemokine receptor CCR7 expressed by dendritic cells: A key player in corneal and ocular surface inflammation. Ocular Surface Journal. 12, 87-99 (2014).
- Relloso, M., et al. DC-SIGN (CD209) Expression is IL-4 dependent and it is negatively regulated by IFN, TGF and inflammatory agents. Journal of Immunology. 168 (6), 2634-2643 (2002).
- Leon, B., Lopez-Bravo, M., Ardavin, C. Monocyte-derived dendritic cells formed at the infection site control the induction of protective T helper 1 responses against Leishmania. Immunity. 26 (4), 519-531 (2007).
- Gordon, S. Phagocytosis: An immunobiologic process. Immunity. 44 (3), 463-475 (2016).
- Ashok, D., Acha-Orbea, H. Timing is everything: dendritic cell subsets in murine Leishmania infection. Trends in Parasitology. 30 (10), 499-507 (2014).
- Carvalho, A. K., et al. Leishmania (V.) braziliensis and L. (L.) amazonensis promote differential expression of dendritic cells and cellular immune response in murine model. Parasite Immunology. 34 (8-9), 395-403 (2012).
- Bates, P. A. Transmission of Leishmania metacyclic promastigotes by phlebotomine sand flies. International Journal of Parasitology. 37 (10), 1097-1106 (2007).
- Cervantes-Barragan, L., et al. Plasmacytoid dendritic cells control T-cell response to chronic viral infection. Proceedings of the National Academy of Sciences of the United States of America. 109 (8), 3012-3017 (2012).
- Caux, C., et al. Activation of human dendritic cells through CD40 cross-linking. Journal of Experimental Medicine. 180 (4), 1263-1272 (1994).
- Suzuki, H., et al. Activities of granulocyte-macrophage colony-stimulating factor and interleukin-3 on monocytes. American Journal of Hematology. 75 (4), 179-189 (2004).
- Akira, S., Takeda, K. Toll-like receptor signalling. Nature Reviews. Immunology. 4 (7), 499-511 (2004).
- McKinnon, K. M. Flow cytometry: An overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Sanderson, M. J., et al. Fluorescence microscopy. Cold Spring Harbor Protocols. 10, 1795 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados