Method Article
체외(In Vitro ) Differentiation of Human Dendritic Cells and their Markers in Leishmania Infection(리슈마니아 감염에서 인간 수지상 세포와 그 마커의 분화)
요약
수지상 세포(DC)는 리슈마니아 감염에 대한 선천성 면역의 필수 구성 요소입니다. DC와 리슈마니아 사이의 복잡한 상호 작용의 기저에 있는 메커니즘은 잘 이해되지 않은 상태로 남아 있습니다. 여기에서는 리슈마니아 감염이 이동 관련 및 공동 자극 분자 발현과 같은 인간 DC의 면역생물학적 기능에 어떤 영향을 미치는지 평가하는 방법을 설명합니다.
초록
리슈마니아증은 의무적인 세포 내 원생동물인 리슈마 니아의 감염과 관련된 임상 증상의 집합체로 구성됩니다. 리슈마니아 기생충의 생활사는 두 개의 교대 생애 단계(amastigotes 및 promastigotes)로 구성되며, 이 기간 동안 기생충은 각각 절지동물 매개체 또는 척추동물 숙주 내에 거주합니다. 특히 리슈마니아 기생충과 면역 체계의 여러 세포 사이의 복잡한 상호 작용이 감염 결과에 큰 영향을 미칩니다. 중요한 것은 대식세포가 리슈마니아 복제의 주요 숙주 틈새 시장으로 알려져 있지만, 기생충은 호중구 및 수지상 세포(DC)와 같은 다른 선천성 면역 세포에 의해서도 식세포화된다는 것입니다.
DC는 선천성 면역 및 적응 면역 가지를 연결하는 데 중요한 역할을 하여 광범위한 병원체에 대한 면역 반응을 조율합니다. 리슈마니아 와 DC가 상호 작용하는 메커니즘은 불분명하며 병원체 포획, DC 성숙 및 활성화의 역학, 배액 림프절(dLN)로의 DC 이동, T 세포에 대한 항원 제시 등의 측면을 포함합니다. 많은 연구에서 DC가 리슈마니아에 대한 면역 반응을 조절하는 데 이중 역할을 한다는 개념을 뒷받침하고 있지만, 리슈마니아 에 대한 감수성 또는 저항에 대한 이러한 세포의 참여는 여전히 잘 이해되지 않고 있습니다. 감염 후, DC는 공동 자극 분자(즉, CD40, CD80 및 CD86) 외에도 표면 주요 조직 적합성 복합체(MHC) II의 상향 조절과 관련된 성숙 과정을 거칩니다.
감염 결과에서 DC의 역할을 이해하는 것은 리슈마니아에 대한 면역 반응을 조절하기 위한 치료 및 예방 전략을 개발하는 데 중요합니다. 이 논문은 리슈마니아-DC 상호 작용의 특성화 방법을 설명합니다. 이 상세한 프로토콜은 DC 분화, 세포 표면 분자의 특성화 및 감염 프로토콜 단계 전반에 걸쳐 지침을 제공하여 과학자들이 리슈마니아 감염에 대한 DC 반응을 조사하고 감염 과정에서 이러한 세포가 수행하는 역할에 대한 통찰력을 얻을 수 있도록 합니다.
서문
리슈 마니아 증은 리슈 마 니아 속1의 다른 종에 의해 유발되는 방치 된 질병의 복합체를 구성합니다. 리슈마니아(Leishmania )는 트리파노소마티과(Trypanosomatidae)의 세포 내 원생동물로 인간과 다른 포유류를 감염시켜 피부 병변에서 내장 형태에 이르기까지 다양한 질병을 유발합니다2. 이 질병의 주요 임상 증상은 피막성 리슈마니아증(TL)과 내장 리슈마니아증(VL)입니다. 세계보건기구(WHO)는 매년 700,000명에서 100만 명의 새로운 감염 사례가 발생하여 매년 70,000명이 사망하는 것으로 추정합니다2. 전 세계적으로 리슈마니아증은 약 1,200만 명에서 1,500만 명에게 영향을 미치며, 3억 5,000만 명이 이 질병에 걸릴 위험에 처해 있습니다3.
Leishmania 속은 promastigote와 amastigote4의 두 가지 진화 형태를 나타냅니다. Leishmania promastigotes는 편모의 존재와 높은 운동성을 특징으로합니다. 이러한 형태는 모래 파리의 소화관에서 발견되며, 감염 형태 (metacyclic promastigotes)로 분화를 거칩니다 5. 대조적으로, 아마스티고트는 감염된 포유류 세포의 세포 내 환경에서 발견됩니다. 이 진화적 형태는 차례로 식세포(phagocytic cells)의 식리소좀(phagolysosome)에서 복제됩니다6.
Leishmania spp.의 전염 주기는 혈액을 공급하는 동안 시작되며, 모래파리가 숙주의 피부에 메타고리클릭 전구물을 접종할 때1. 리슈마니아 접종 직후, 호중구와 조직에 상주하는 대식세포를 포함한 선천면역세포가 기생충을 식세포화합니다. 기생충 액포 내부에서 리슈마니아는 아마스티고트로 분화하고 복제되어 숙주 세포막의 파열로 절정에 이르며, 이로 인해 주변 세포의 감염과 기생충이 퍼질 수 있습니다4. 이 주기는 플레보토민(phlebotomines)이 아마스티고트(amastigote)를 함유한 식세포(phagocyte)를 섭취할 때 완료되며, 이 식세포는 곤충의 장관(intestinal tract)에서 프로사이클릭 프로마스티고트(procyclic promastigote)로 분화하고 나중에는 곤충의 장관(intestinal tract)에서 메타고리 프로마스티고트(metacyclic promastigote)로 분화한다7.
조직과 림프절에서 발견되는 전문 항원 제시 세포인 수지상 세포(dendritic cell)는 면역 체계의 파수꾼 역할을 합니다8. 이 세포는 미성숙 단계의 말초 조직에서 발견되며 주로 항원 포획 및 처리에 관여합니다. 병원체와 접촉한 후 DC는 림프절로 이동하는 성숙 과정을 거쳐 순진한 CD4+ T 세포에 항원을 제시합니다. 이 세포는 또한 내성 또는 염증을 유발하는 선천성 면역 반응과 적응 면역 반응을 조절하는 데 필수적입니다9. DC 성숙 과정에는 MHC 및 CD40 및 CD86과 같은 공동 자극 분자의 발현 증가, 향상된 사이토카인 분비 등 여러 측면이 포함됩니다. DC는 CD11b 및 CD11c를 포함한 다양한 마커를 발현하며, 인간의 경우 CD14+ 단핵구(moDC)에서 유래한 DC가 CD1a10을 발현합니다. CCR7은 DC에서 많이 발현되며 이러한 세포의 복잡한 이동 과정을 나타냅니다12. CD209 및 CD80은 또한 DC 및 림프구와의 초기 접촉에서 중요한 역할을 합니다13.
리슈마니아증(leishmaniasis)에서 연구에 따르면 moDC는 식세포(phagocytose) 기생충을 배출 림프절(dLN)로 전달하여 T 세포에 항원을 제시합니다13. 기생충 포획 메커니즘은 식세포작용(phagocytosis) 동안 액틴 필라멘트(actin filaments)에 의한 세포골격 재조직(cytoskeletal reorganization)과 관련이 있으며, 이는 기생충의 내재화를 촉진합니다14. 리슈마니아증에서 DC가 행사하는 역할에 관한 대부분의 연구는 L. major, L. amazonensis 및 L. braziliensis15에 초점을 맞추고 있습니다. 흥미롭게도, 리슈마니아 감염에 대한 생체 내 연구는 DC 기능의 손상이 기생충 균주 특이적 방식으로 발생한다는 것을 입증했습니다.
L. amazonensis 감염의 초기 단계에서 DC는 기생충 감염을 억제하는 능력이 감소하는 것으로 입증되었습니다. 반대로, L. braziliensis 감염의 실험 모델에서, DC는 리슈마니아의 생존을 제한하는 적절한 면역 반응을 일으키는 것으로 나타났다16. 리슈마니아 종(Leishmania spp.) 감염에 대한 감별 반응과 관련이 있는 것으로 알려진 주요 측면은 DC 성숙 및 활성화 정도입니다. 이 논문은 이러한 세포가 질병 결과에 미치는 영향을 더 자세히 이해하기 위해 리슈마니아 감염에서 인간 DC가 수행하는 역할을 조사하는 방법을 설명합니다.
프로토콜
참고: 세포는 건강한 기증자 지원자로부터 얻었습니다. 여기에 설명된 절차는 국가 윤리 위원회(번호 2.751.345)-Fiocruz, Bahia, Brazil)의 승인을 받았습니다.
1. 인간 수지상 세포의 분화
- 50mL 원뿔형 튜브에 10mL의 폴리수크로오스-나트륨 트리아조에이트 혼합물을 피펫팅합니다.
- 각 기증자에 대해 각각 50mL 원뿔형 튜브에 라벨을 붙입니다.
- 건강한 헌혈자로부터 30mL의 혈액을 수집하고 층류 후드에서 모든 후속 단계를 수행합니다.
- 혈액을 원뿔형 튜브로 조심스럽게 옮기고 실온에서 1:1의 비율로 식염수(0.9% 염화나트륨)에 혈액을 희석합니다.
- 천천히 희석된 혈액을 튜브의 폴리수크로오스-나트륨 트리아조에이트 혼합물에 오버레이합니다(단계 1.1). 튜브를 400 × g 에서 25 ° C에서 30 분 동안 한 번 원심 분리하십시오.
알림: 그라디언트 레이어의 혼합을 방지하기 위해 원심분리 전에 브레이크를 끄십시오. 첫 번째 원심분리 후 원심분리기의 온도를 4°C로 낮춥니다. - 원심분리기에서 튜브를 조심스럽게 꺼냅니다.
- 샘플(버피 코트)에서 말초 혈액 단핵 세포(PBMC)에 의해 형성된 고리를 찾습니다. 피펫으로 잔류 혈장을 조심스럽게 흡인합니다.
참고: 원심분리는 적혈구(erythrocytes), 밀도 구배 매질(density gradient medium), PBMC 고리(PBMC ring) 및 혈장(plasma)과 같은 구배층(gradient layer)의 형성으로 이어집니다. PBMC 고리는 밀도 구배 매질과 플라즈마 층 사이에 있습니다. - 탁한 PBMC 층을 다른 튜브로 옮기고 최종 부피 30mL에 식염수를 추가합니다.
- 세포 현탁액이 들어 있는 튜브를 250 × g 에서 4°C에서 10분 동안 원심분리합니다. 상등액을 버리고 식염수 1mL를 첨가하여 펠렛을 재현탁합니다.
- 세포 계수를 위해 부분 표본을 수집하고 1:1,000으로 희석합니다. 세포 생존율을 결정하기 위해 Neubauer 챔버를 사용하는 trypan blue exclusion 방법으로 세포 계수를 위해 10μL의 희석된 세포를 사용합니다.
- 현탁액을 200 × g 에서 10 ° C에서 4 분 동안 다시 돌립니다.
- pellet를 magnetic-activated cell sorting (MACS) buffer에 재현탁시킵니다. 1 × 107 셀당 80μL의 버퍼를 사용합니다.
참고: MACS 버퍼 구성에 대해서는 표 1을 참조하십시오. 버퍼를 차갑게 유지하고 2-8 °C에서 보관하십시오. - 1.9단계에서 준비한 세포 현탁액에 CD14 마이크로비드를 추가합니다. 1 × 10 7 세포당 20 μL의 CD14 마이크로비드를 사용합니다.
참고: CD14 마이크로비드는 인간 anti-CD14를 포함하는 비드가 대부분의 단핵구 표면에서 발현되는 CD14+ 세포에 결합하기 때문에 PBMC에서 인간 단핵구를 긍정적으로 선택하는 데 사용됩니다. - 펠릿과 마이크로비즈를 균일하게 재현탁하기 위해 위아래로 피펫을 사용합니다. 15분 동안 얼음 위에 두십시오.
- 현탁액을 300 × g 에서 4 °C에서 10 분 동안 원심 분리하십시오.
- MACS 버퍼에서 셀을 다시 suspend합니다. 세포-마이크로비드 혼합물에 1 × 107 세포당 1-2 mL를 사용합니다.
- 현탁액을 300 × g 에서 4 °C에서 10 분 동안 원심 분리하십시오.
- 상층액을 제거하고 펠릿을 500μL의 MACS 완충액에 재현탁합니다.
참고: 이것은 하나의 컬럼에서 처리될 세포 현탁액의 최대 부피입니다. - 마그네틱 컬럼을 조립합니다.
- 500μL의 MACS 버퍼로 컬럼을 한 번 세척하고 버퍼가 중력 하에서 컬럼을 통해 흐르도록 합니다.
알림: 공기가 기둥을 막을 수 있으므로 기둥이 건조해지지 않도록 주의하십시오. - 컬럼당 500μL의 cell-bead 현탁액을 추가합니다(단계 1.19). 세포 현탁액이 컬럼을 통해 중력 하에서 흐르도록 합니다.
- 500μL의 MACS 버퍼(2x)로 컬럼을 세척합니다. 열 저장소가 비어 있는 경우에만 새 버퍼를 추가합니다. 기둥을 건조시키지 마십시오.
- 컬럼 아래에 새 튜브를 놓고 MACS 버퍼의 1mL를 컬럼에 피펫팅한 다음 플런저를 단단히 밀어 자기 라벨링된 셀을 컬럼 밖으로 즉시 씻어냅니다.
- CD14 농축 세포를 300 × g 에서 4 °C에서 10 분 동안 원심 분리합니다.
- Neubauer 챔버를 사용하여 세포를 계산합니다.
- 100 μL/mL의 인터루킨-4(IL-4) ((50 ng/mL) + 과립구-대식세포 집락자극인자(GM-CSF) (50 ng/mL)를 사용하여 1 mL의 완전한 RPMI로 세포를 재현탁합니다.
- 위의 사이토카인을 함유하는 500 μL의 완전한 RPMI 배지에 웰당 2 ×10 5 세포의 농도로 24-well plate에 seed cell을 하고 37 °C에서 7일 동안 배양합니다.
2. 리슈마니아 문화
참고: 이 분석에는 L. amazonensis (MHOM/BR88/Ba-125) 기생충이 사용되었습니다.
- 24°C의 생체 산소 요구량(BOD) 인큐베이터에서 25cm2 배양 병에 담긴 5mL의 Schneider's complete 배지 또는 최소 필수 배지(MEM)와 함께 Novy-Nicolle-MacNeal(NNN) 혈액 한천 배지에서 프로마스티고테를 유지합니다.
참고: L. amazonensis 종의 프로마스티고테 형태를 배양하기 위해 5mL의 Schneider의 완전 배지(10% 불활성화 소 태아 혈청(FBS) 및 50μg/mL 농도의 겐타마이신을 함유한 Schneider의 곤충 배지)를 사용했습니다. - BOD 인큐베이터에서 24 °C에서 7일 동안 배양합니다.
- 100μL의 프로마스티고테 배양을 새로운 25cm2 세포 배양 플라스크에 피펫팅합니다.
- 보충된 MEM 5mL를 추가합니다.
- BOD 인큐베이터에서 24°C로 배양하고 고정상에 도달할 때까지 식염수가 희석된 기생충 세포 현탁액의 분취액을 Neubauer 챔버(즉, 혈구계)로 옮겨 프로마스티고트를 주기적으로 계산합니다.
참고: NNN 배지 이후의 첫 번째 통로를 실험에 사용하지 마십시오. - 1 × 105 의 리슈마니아 고정 성장 단계 프로마스티고트를 새로운 25cm2 세포 배양 플라스크에 옮기고 보충된 MEM 5mL를 추가합니다.
- 고정상이 달성될 때까지 Neubauer 챔버를 사용하여 배양물의 성장을 주기적으로 모니터링합니다.
참고: 독성 손실을 방지하기 위해 in vitro 에서 최대 7개의 계대에 대해 promastigote 배양물을 사용하십시오.
3. 리슈마니아 감염
- 배양된 기생충의 고정상(stationary-phase) 성장을 확인한 후 배양병에서 모든 내용물을 제거하고 50mL 원뿔형 튜브에 넣습니다. 최종 부피 30mL를 얻기 위해 저온 식염수를 추가합니다.
- 4°C, 1,600× g 에서 10분간 원심분리기를 3회 실시합니다. 원심분리 후 상등액을 버리고 펠릿을 차가운 식염수에 재현탁합니다.
- 세포를 세척하여 생존 불가능한 기생충을 제거하고 펠릿을 1mL의 차가운 식염수에 재현탁시킵니다. 16G 바늘이 장착된 1mL 주사기에 현탁액을 천천히 5회 통과시켜 기생충 클러스터를 분리합니다.
- 샘플에서 부분 표본을 제거하여 Eq(1)를 사용하여 혈구계에서 기생충 농도를 계산합니다.
기생충 농도 = 4사분면에 있는 기생충의 평균 × 희석 계수 × 104 (1) - Leishmania sp의 양을 계산합니다.10:1의 기생충 대 숙주 세포 비율을 유지하기 위해 플레이트할 숙주 세포의 수에 필요합니다(단계 1.27).
- 식염수 1mL를 첨가하고 실온에서 300× g 으로 10분 동안 세포를 3회 원심분리하여 DC를 세척합니다.
- 24웰 세포 배양 플레이트의 각 웰에 필요한 양의 리슈마니아 를 놓습니다(3.5단계 참조).
- 5% CO2 대기에서 37°C의 인큐베이터에서 4시간 동안 기생충이 있는 DC를 배양합니다.
4. 유세포 분석을 위한 면역염색
- 감염 후 1mL의 식염수로 세포를 두 번 세척하여 내재화되지 않은 기생충을 제거합니다.
참고: 항체 클론 및 형광 색소가 있는 패널은 재료 표에 나열되어 있습니다. - 실험 조건당 50μL의 최종 부피로 형광 활성화 세포 분류(FACS) 완충액(1x PBS, 1% BSA)에서 항체를 희석합니다.
참고: 최적의 염색 농도를 보장하기 위해 실험 전에 항체를 적정하는 것이 중요합니다. 이 프로토콜에서는 적정 실험 후 1:50이 사용되었습니다. - 마스터 믹스(1% BSA + 항체 믹스가 포함된 PBS 1개)를 준비합니다. 와류 및 피펫 50 μL를 세포를 포함하는 웰에서 혼합합니다.
- 항체 혼합물(항-인간 CD1a, 항-인간 CCR7, 항-인간 CD83, 항-CD11c, 항-인간 CD209, 항-인간 HLA-DR)과 함께 DC를 빛으로부터 보호된 얼음 위에서 30분 동안 잠시 배양합니다.
- 1mL의 저온 염색 완충액(1x PBS 중 1% FBS)으로 세포를 2회 세척하고 4°C에서 5 분 동안 300×g의 원심분리를 합니다.
- 상층액을 흡입하고 펠릿을 200μL의 저온 염색 완충액에 재현탁합니다.
- 유세포 분석기에서 데이터 수집을 진행합니다.
참고: FACS 분석을 위한 최적의 조건을 보장하려면 샘플 염색 후 48시간 이내에 데이터 수집을 수행해야 합니다. 데이터는 FlowJo 소프트웨어를 사용하여 분석되었습니다.- FlowJo 소프트웨어 프로그램을 열고 새 작업 공간을 만듭니다. 분석할 유세포 분석 파일을 작업 공간 창으로 끌어다 놓아 추가합니다.
- 튜브 이름을 클릭하여 측면 산란(SSC) 및 전방 산란(FSC) 매개변수를 선택합니다.
참고: DC 성숙의 유세포 분석은 CD1a, CD11c, CD80, CCR7, CD209 및 HLA-DR의 발현을 기반으로 했습니다. - 다각형 게이팅 도구를 사용하여 DC 주위에 게이트를 그립니다. 선택한 게이트 셀을 두 번 클릭하여 새 창을 표시합니다. FSC-A 및 FSC-H 매개변수를 선택하여 이중선 정리를 수행합니다. 다각형 도구를 사용하여 개별 셀 주위에 새 플롯을 그립니다.
- 게이트된 셀을 두 번 클릭하고 SSC 및 CD11c 매개변수를 선택하여 CD11c+ 셀을 포함하는 게이트를 생성합니다.
- 청소된 CD11c+ 셀 게이트를 선택하여 내보냅니다. 게이트를 마우스 오른쪽 버튼으로 클릭하고 Select equivalent nodes 옵션을 선택합니다. 마우스 오른쪽 버튼을 클릭하고 보정된 모든 매개변수와 함께 게이트를 최근에 생성된 폴더에 저장하여 내보냅니다.
- 최근에 저장된 파일을 열어 새 작업 공간을 만듭니다. Workspace 를 클릭하고 plugins | 다운샘플링 | 30,000 - 50,000 이벤트; 확인을 누릅니다.
참고: TSNE는 시간이 많이 걸리고 계산이 많이 필요한 프로세스이므로 이 단계는 분석된 이벤트의 총 수를 줄이기 위해 권장됩니다. - 다운샘플링된 파일을 마우스 오른쪽 버튼으로 클릭하고 해당 노드를 선택합니다.
- 다운샘플링된 파일을 마우스 오른쪽 버튼으로 클릭하고 Export/concatenate를 선택합니다.
- 연결 창을 클릭하고 보정된 모든 파라미터를 선택합니다. 연결된 파일을 선택하고 workspace | plugin | tSNE를 클릭합니다.
- 원하는 매개변수(CD1a, HLA-DR, CCR7, CD80, CD209 및 CD11c)를 선택하여 클러스터를 생성합니다. OK를 누릅니다.
- 연결된 파일을 클릭하여 tSNE1 및 tSNE2 매개변수를 시각화합니다.
5. 액틴 면역 염색
- 24웰 플레이트에 배치된 커버슬립에 플레이트에 감염된 DC를 감염시켰습니다. 플레이트를 300 × g 에서 4 ° C에서 10 분 동안 원심 분리하십시오. 감염 후 실온에서 멸균 식염수로 세포를 3회 세척하여 세포 외 기생충을 제거합니다.
- 실온에서 15분 동안 500μL의 4% 파라포름알데히드로 DC를 배양합니다. 파라포름알데히드를 제거하고 식염수 1mL를 추가합니다( 표 1 참조).
6. 면역 라벨링
참고: 교반 상태에서 다음 단계를 수행합니다.
- 1x PBS로 커버 슬립을 5 분 동안 씻습니다. 3번 반복합니다. 웰당 500μL의 염화암모늄 용액을 추가합니다. 실온에서 10분 동안 배양합니다.
- 1x PBS로 커버 슬립을 5 분 동안 씻습니다. 3번 반복합니다.
- 0.15% 사포닌으로 멤브레인을 15분 동안 투과시킵니다.
- 1x PBS 1x/3% BSA/0.15% 사포닌으로 1시간 동안 차단합니다. 1x PBS/0.15% 사포닌으로 커버슬립을 5분 동안 세척합니다. 3번 반복합니다.
- 1x PBS/1% BSA/0.15% 사포닌에 희석된 팔로이딘(1:1,200)으로 세포를 1시간 동안 배양합니다. 1x PBS/0.15% 사포닌으로 커버슬립을 5분 동안 세척합니다. 3번 반복합니다.
- 세포가 아래를 향하도록 커버슬립을 4',6-디아미디노-2-페닐린돌(DAPI)이 있는 장착 매체에 놓습니다. 슬라이드를 알루미늄 호일로 덮어 빛으로부터 보호하십시오.
- 63x/1.4 대물렌즈가 장착된 컨포칼 형광 현미경을 사용하여 이미지를 획득합니다.
7. 공초점 현미경 획득 및 피지 정량화
- 컨포칼 레이저 스캐닝 현미경을 사용하여 면역형광 이미지를 캡처합니다( 재료 표 참조).
알림: 최상의 해상도를 위해 63x 대물렌즈 오일 이멀젼 렌즈를 사용하십시오. - 커버슬립을 빛으로부터 보호하고 구입하기 전에 최소 30분 동안 실온에 두십시오.
- 흡수성 티슈를 사용하여 커버슬립을 청소하십시오. 대물렌즈에 이멀젼 오일 한 방울을 넣고 슬라이드를 현미경 스테이지에 놓습니다. 오일이 있는 63x 대물렌즈를 선택하고 오일이 슬라이드에 닿을 때까지 플랫폼을 올린 다음 현미경의 초점을 조정합니다.
- 프로그램을 열고 488, 552 및 405nm의 레이저 파장을 활성화합니다.
- 이미지 해상도를 1024 x 1024 픽셀로 설정합니다.
- 라이브 바텀을 클릭하고, Z 스택을 설정하고, Begin을 누릅니다. 이 과정을 반복한 다음 종료 버튼을 누릅니다.
- 이미지 획득이 완료될 때까지 기다린 다음 도구에서 최대 프로젝션 옵션을 선택합니다.
- 실험을 저장하고 .lif 형식 이미지를 컴퓨터로 내보냅니다.
- FIJI 프로그램을 열고, FIJI에서 실험을 열고, 뷰 스택 을 하이퍼스택으로 설정합니다.
- 열린 이미지 파일을 개별적으로 선택 | 스티치 타일을 선택합니다.
- 피지 도구 모음에서 자유형 도구를 선택하고 각 셀을 손으로 조심스럽게 추적합니다. 분석 | 측정을 눌러 형광 강도를 시각화합니다. 그룹당 각 셀 유형에 대해 이 프로세스를 반복합니다.
- 측정값을 저장하고 스프레드시트로 내보냅니다. 통계 분석 소프트웨어( 재료 표 참조)를 사용하여 데이터가 포함된 파일을 열어 통계 분석을 수행합니다.
8. 통계 분석
- 소프트웨어에서 새 프로젝트를 엽니다.
- 정규 분포가 있는 데이터의 경우 스튜던트 t-검정을 사용합니다. 비모수 데이터의 경우 Mann-Whitney U 검정을 사용합니다.
- 실험 결과에서 얻은 값을 표에 붙여넣습니다.
- 기술 통계량을 선택하고 옵션 column statistics [all tests]를 선택하여 데이터 분포를 분석합니다.
참고: 데이터가 가우스 분포를 따르는 경우 t-검정을 선택하여 두 쌍을 비교하여 표본을 검사합니다. 분포가 가우스가 아닌 경우 중심 경향 측도(평균 또는 중위수) 및 변동 측도와 함께 Mann-Whitney U 검정을 사용하여 데이터를 분석합니다. - 최적의 데이터 표현을 위한 최상의 그래프 옵션을 선택합니다.
결과
이 보고서는 유세포 분석 및 컨포칼 현미경을 사용하여 리슈마니아 감염에서 DC의 역할을 조사합니다. 초기에는 인간 단핵구 유래 DC의 표현형 프로파일이 확립되었습니다. 특히, 얻어진 CD11c+ 수지상 세포 집단은 CCR7, CD209, CD80, CD1a 및 HLA-DR에 대해 양성이었습니다. 결과는 DC 집단에서 이러한 마커의 발현이 리슈마니아 감염에 의해 큰 영향을 받는다는 것을 나타냅니다. 감염된 DC는 증강된 CD80, CD209, CCR7 및 HLA-DR 발현을 보였습니다. 그러나 CD1a의 하향 조절은 L .amazonensis에 감염된 DC에서도 관찰되었습니다. 또한 주성분 분석을 통해 이러한 분자의 발현에 상당한 차이가 있는 것으로 나타났습니다(그림 1B-D). 차원 축소 기법인 t-Distributed Stochastic Neighbor Embedding(t(tSNE) 알고리즘을 사용하여 리슈마니아 감염이 성숙 관련 분자의 발현에 미치는 영향을 더 잘 시각화했습니다.
주목할 점은 tSNE 밀도 플롯은 감염된 DC가 차등 HLA-DR 및 CD80 발현을 나타내고 있음을 보여주며, 이는 항원 발현에 관여하는 분자의 상향 조절을 시사합니다(그림 2). DC를 시각화하기 위해 F-actin 면역 염색은 형광 팔로이딘으로 세포를 라벨링하여 수행되었습니다. DC 내에서 L. amazonensis 감염을 관찰하기 위해 핵 염색(DAPI)을 사용하여 리슈마니아에 감염된 세포와 감염되지 않은 세포를 비교했습니다(그림 3). L. amazonensis promastigotes와 관련된 hDC 감염의 동역학 분석(10:1)은 감염 후 4시간 시점에 감염된 세포의 비율과 감염된 세포당 기생충의 수를 나타냅니다. 그런 다음 세포를 세척하고 6, 12 또는 24시간 동안 재배양했습니다. 평균적으로 감염된 세포의 ~55%에서 DC당 4-5개의 기생충이 관찰되었습니다.

그림 1: Leishmania amazonensis 감염 후 마커 기반 인간 DC 특성화; CD 11c+ 선택을 위한 게이팅 전략. (A) 공동자극 분자 MFI의 평가. (B) 히트맵 및 (C) 공동자극 분자 MFI 값의 주성분 분석. (D) 각 분자에 대한 MFI를 나타내는 대표 히스토그램 및 산점도. 약어: DC = 수지상 세포; MFI = 형광 강도 중앙값; SSC-A = 측면 산란 영역; FSC-A = 전방 산란 영역; FSC-H = 전방 산란 높이. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
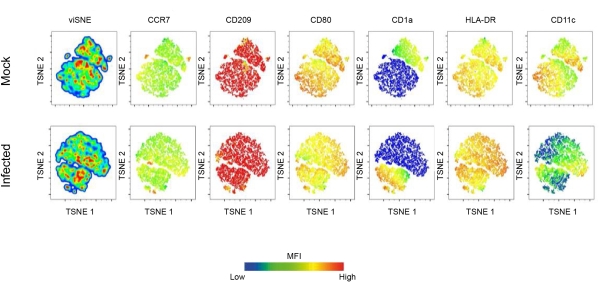
그림 2: 리슈마니아에 의해 유도된 DC 표면 분자 발현. 리슈마니아 감염에 의해 유발된 DC 성숙 경관의 심층적인 특성화. 간단히 말해서, GM-CSF 및 IL-4로 분화 7일 후에 단핵구 유래 DC를 얻었습니다. 완전히 분화된 DC를 L. amazonensis에 감염시킨 다음 성숙 FACS 항체 패널로 염색했습니다. 차원 축소 기법인 TSNE를 사용하여 유세포 분석 데이터의 고차원 분석을 수행했습니다. 약어: DC =dendritic 세포; GM-CSF = 과립구-대식세포 집락-자극 인자; FACS = 형광 활성화 세포 분류; IL-4 = 인터루킨-4; TSNE = T-Distributed Stochastic Neighbor Embedding(T-분산 확률적 이웃 임베딩). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 리슈마니아 아마조넨시스(Leishmania amazonensis)에 의한 hDC 감염. 인간 수지상 세포를 4시간 동안 L. amazonensis(10:1)에 감염시키고 세척하고 팔로이딘으로 표지했습니다. (A) 감염 또는 비감염 hDC에서 F-actin 라벨링의 형광. 녹색, F-액틴; 파란색, 리슈마니아 기생충의 hDC 및 핵의 핵 염색을 위한 DAPI; 노란색 화살표는 세포 내부의 amastigotes를 나타냅니다. 흰색 화살표는 hDC F-액틴을 나타냅니다. 그레이스케일, DIC. (B) 형광 현미경으로 무작위로 평가한 400개 세포의 감염 및 기생충 부담 비율(Anova를 사용하여 분석). 눈금자 = 25μm. 약어: hDC = 인간 수지상 세포; DAPI = 4',6-디아미디노-2-페닐린돌; DIC = 미분 간섭 대비. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| MACS 버퍼 |
| EDTA 2 mM |
| PBS 1배 |
| BSA 0.5% |
| 인산염 완충 식염수(PBS) 1x |
| 염화 암모늄 용액 : NH4Cl 0.134g |
| 사포닌 15% |
| 1x PBS 1mL에 포함된 사포닌 150mg |
| 1x PBS 100mL에 15% 사포닌 1mL |
| 10% 소 혈청 알부민 |
| 100 mg – 1 mL → 10% |
| 1g – 100mL → 1% |
| 10% BSA의 경우 - 1x PBS 10mL에 포함된 BSA 1g |
| PBS 1개/ 1% BSA / 0.15% 사포닌: PBS 1개 20mL 10% BSA 2mL 200 μL의 15% 사포닌 |
| 1x PBS/ 3% BSA / 0.15% 사포닌: 1x PBS 20mL ; 10% BSA 6mL ; 200 μL 15% 사포닌 |
| 1x PBS / 0.3% BSA / 0.15% 사포닌: 20mL PBS; 10% BSA 0.6mL; 200 μL의 15% 사포닌 |
표 1: 이 프로토콜에 사용된 솔루션의 구성.
토론
리슈마니아증은 전 세계적으로 심각한 공중 보건 문제입니다. 이 질병의 발병 기전은 매우 복잡하며, 척추동물 숙주에서 기생충의 생존을 촉진하는 메커니즘은 여전히 파악하기 어렵다17. DC는 여과 및 림프 기관을 포함하여 몸 전체에서 발견되는 전문 항원 제시 세포입니다. 항원 포획 및 처리 후, 미성숙 DC는 림프절로 이동하는 복잡한 성숙 과정을 거치며, 림프절로 이동하는 이 세포는 T 림프구에 항원을 제시하는 역할을 합니다18. 이 성숙 과정은 증가된 MHC-class II 분자 발현, 특히 CD11c, CD86, CD80 및 CD1a19를 특징으로 합니다. 리슈마니아증(leishmaniasis)에서는 단핵구 유래 DC가 식세포(phagocytose) 기생충을 식세포로 전달하고 화물을 dLN으로 전달하여 T세포에 항원 발현을 유도한다13.
이 논문은 체외 감염 모델에서 DC의 면역생물학적 기능에 대한 리슈마니아의 영향을 조사할 수 있는 간결한 프로토콜에 대해 설명합니다. 이 프로토콜은 인간 단핵구를 얻어 DC로 분화하는 것뿐만 아니라 유세포 분석 및 컨포칼 현미경 검사를 통한 DC 특성화를 포함한 최첨단 면역학 기술의 사용을 포함합니다14. 초기에는 건강한 기증자의 PBMC에서 단핵구를 정제했습니다. anti-human CD14 마이크로비드와 같은 positive selection 방법을 사용하면 분화된 moDC의 높은 순도(>95%)를 보장할 수 있습니다. 이러한 세포는 항체를 샘플의 CD14 양성 세포에 결합하는 항인간 CD14 마이크로비드와 함께 배양된 다음, 자기 세포 분리기(20)의 컬럼 내부에서 높은 구배 자기장에 의해 분리됩니다.
특히, 인간 단핵구를 DC로 체 외 에서 분화하려면 GM-CSF와 IL-4를 추가해야 합니다. GM-CSF는 대식세포 집락자극인자(M-CSF)의 발현을 하향 조절할 뿐만 아니라 M-CSF에 의한 대식세포로의 분화를 억제하는 다발성 성장 인자입니다. 또한, IL-4는 대식세포 집락 형성을 억제함으로써 작용하며, 이는 in vitro21 moDC를 배양하는 데 적합한 방법으로 간주됩니다. 본 프로토콜은 CCR7, CD209, CD80, CD1a, HLA-DR 및 CD11c와 같은 성숙 관련 마커의 발현을 분석하여 DC 분화를 평가하기 위해 유세포 분석법을 사용할 것을 제안합니다.또한 고차원 유세포 분석 기술(예: t-SNE)을 사용하여 리슈마니아 감염의 영향을 받는 발현 패턴을 정확하게 식별합니다22. 면역염색 중 항체 희석을 최적화하는 것이 중요합니다.
컨포칼 현미경 검사는 인간 세포의 형광 강도를 분석하고 정량화하는 훌륭한 도구입니다23. 이 분석은 커버 슬립을 부드럽게 세척하고 빛에 노출되지 않도록 하는 것과 같은 이미지 획득 전에 신중한 조작이 필요하다는 점에 유의하는 것이 중요합니다. 이 방법의 주요 한계는 컨포칼 현미경 검사에서 적절한 이미지 해상도를 획득하는 것인데, 이를 위해서는 현미경 조작에 대한 경험이 필요합니다. 그러나 이 방법은 다른 병원체에 의한 감염에 대한 DC의 반응을 연구하는 데 사용할 수 있습니다. 또는 이 프로토콜에 설명된 단계를 다른 병원체 감염 모델로 외삽할 수도 있습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
Gonçalo Moniz Institute(IGM-Fiocruz)(브라질 바이아)와 현미경 부서의 도움에 감사드립니다. 저자들은 비평적 분석, 영어 개정 및 원고 카피에디팅 지원을 해준 안드리스 K. 월터(Andris K. Walter)에게 감사를 표한다.
자료
| Name | Company | Catalog Number | Comments |
| anti CCR7 | Thermo | ||
| anti CD209 | Isofarma | ||
| anti CD83 | Leica SP8 | ||
| anti HLA-DR | Gibco | ||
| Bovine serum albumin | Thermo | A2153-100G | Sigma |
| Ciprofloxacin | Gibco | ||
| confocal microscope | Thermo Fisher Scientific | ||
| Fetal bovine serum | Gibco | ||
| Flow Jo | Thermo Fisher Scientific | ||
| Gentamicin | Thermo Fisher Scientific | ||
| Glutamin | Gibco | ||
| HEPES | Thermo Fisher Scientific | ||
| phalloidin | Thermo Fisher Scientific | ||
| Phosphate buffer solution | Peprotech | ||
| prolong gold antifade kit | BD pharmigen | ||
| RPMI | BD pharmigen | ||
| Saponin | BD pharmigen | 47036 – 50G – F | Sigma |
| Schneider's insect medium | software BD biosciences |
참고문헌
- Torres-Guerrero, E., Qunitanilla-Cedillo, M. R., Ruiz-Esmenhjaud, J., Arenas, R. Leishmaniasis: a review. F1000 Research. 6, 750 (2017).
- Pace, D. Leishmaniasis. Journal of Infection. 69, 10-18 (2014).
- Reithinger, R., et al. Cutaneous leishmaniasis. Lancet. Infectious Diseases. 7 (9), 581-596 (2007).
- Kaye, P., Scott, P. Leishmaniasis: complexity at the host-pathogen interface. Nature Reviews. Microbiology. 9 (8), 604-615 (2011).
- Handman, E., Bullen, D. V. Interaction of Leishmania with the host macrophage. Trends in Parasitology. 18 (8), 332-334 (2002).
- Burza, S., Croft, S. L., Boelaert, M. Leishmaniasis. Lancet. 392 (10151), 951-970 (2018).
- Kamhawi, S. Phlebotomine sand flies and Leishmania parasites: friends or foes. Trends in Parasitology. 22 (9), 439-445 (2006).
- Guilliams, M., et al. Unsupervised high-dimensional analysis aligns dendritic cells across tissues and species. Immunity. 45 (3), 669-684 (2016).
- Moll, H. Dendritic cells and host resistance to infection. Cellular Microbiology. 5 (8), 493-500 (2003).
- Sundquist, M., Rydstrom, A., Wick, M. J. Immunity to Salmonella from a dendritic point of view. Cellular Microbiology. 6 (1), 1-11 (2004).
- Saban, D. The chemokine receptor CCR7 expressed by dendritic cells: A key player in corneal and ocular surface inflammation. Ocular Surface Journal. 12, 87-99 (2014).
- Relloso, M., et al. DC-SIGN (CD209) Expression is IL-4 dependent and it is negatively regulated by IFN, TGF and inflammatory agents. Journal of Immunology. 168 (6), 2634-2643 (2002).
- Leon, B., Lopez-Bravo, M., Ardavin, C. Monocyte-derived dendritic cells formed at the infection site control the induction of protective T helper 1 responses against Leishmania. Immunity. 26 (4), 519-531 (2007).
- Gordon, S. Phagocytosis: An immunobiologic process. Immunity. 44 (3), 463-475 (2016).
- Ashok, D., Acha-Orbea, H. Timing is everything: dendritic cell subsets in murine Leishmania infection. Trends in Parasitology. 30 (10), 499-507 (2014).
- Carvalho, A. K., et al. Leishmania (V.) braziliensis and L. (L.) amazonensis promote differential expression of dendritic cells and cellular immune response in murine model. Parasite Immunology. 34 (8-9), 395-403 (2012).
- Bates, P. A. Transmission of Leishmania metacyclic promastigotes by phlebotomine sand flies. International Journal of Parasitology. 37 (10), 1097-1106 (2007).
- Cervantes-Barragan, L., et al. Plasmacytoid dendritic cells control T-cell response to chronic viral infection. Proceedings of the National Academy of Sciences of the United States of America. 109 (8), 3012-3017 (2012).
- Caux, C., et al. Activation of human dendritic cells through CD40 cross-linking. Journal of Experimental Medicine. 180 (4), 1263-1272 (1994).
- Suzuki, H., et al. Activities of granulocyte-macrophage colony-stimulating factor and interleukin-3 on monocytes. American Journal of Hematology. 75 (4), 179-189 (2004).
- Akira, S., Takeda, K. Toll-like receptor signalling. Nature Reviews. Immunology. 4 (7), 499-511 (2004).
- McKinnon, K. M. Flow cytometry: An overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Sanderson, M. J., et al. Fluorescence microscopy. Cold Spring Harbor Protocols. 10, 1795 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유