Method Article
インビトロリーシュマニア感染におけるヒト樹状細胞の分化とそのマーカー
要約
樹状細胞(DC)は、リーシュマニア感染に対する自然免疫の必須成分です。DCと リーシュマニア の間の複雑な相互作用の根底にあるメカニズムは、まだ十分に理解されていません。ここでは、 リーシュマニア 感染がヒトDCの免疫生物学的機能にどのように影響するかを評価する方法(遊走関連分子発現や共刺激分子発現など)について述べます。
要約
リーシュマニア症は、偏性細胞内原生動物であるリーシュマニア の感染に関連する臨床症状のコレクションで構成されています。 リーシュマニア 寄生虫のライフサイクルは、2つの交互のライフステージ(アマスチゴテスとプロマスティゴテス)で構成されており、その間、寄生虫はそれぞれ節足動物ベクターまたは脊椎動物宿主のいずれかに存在します。特に、 リーシュマニア 原虫と免疫系のいくつかの細胞との間の複雑な相互作用が、感染の結果に大きく影響します。重要なことは、マクロファージが リーシュマニア 複製の主要な宿主ニッチであることが知られていますが、寄生虫は好中球や樹状細胞(DC)などの他の自然免疫細胞によっても食作用されるということです。
DCは、免疫の自然枝と適応枝を橋渡しする主要な役割を果たし、さまざまな病原体に対する免疫応答を調整します。 リーシュマニア とDCが相互作用するメカニズムは不明のままであり、病原体の捕捉、DCの成熟と活性化のダイナミクス、DCの排出リンパ節(dLN)への移動、およびT細胞への抗原提示の側面が関与しています。DCが リーシュマニアに対する免疫応答を調節する上で二重の役割を果たすという考えは、多くの研究で支持されていますが、リー シュマニア に対する感受性や耐性にDC細胞が関与しているかどうかについては、まだ十分に理解されていません。感染後、DCは、共刺激分子(すなわち、CD40、CD80、およびCD86)に加えて、表面主要組織適合遺伝子複合体(MHC)IIのアップレギュレーションに関連する成熟プロセスを経ます。
感染結果におけるDCの役割を理解することは、 リーシュマニアに対する免疫応答を調節するための治療および予防戦略を開発するために重要です。この論文では、 リーシュマニア-DC相互作用の特性評価の方法について説明します。この詳細なプロトコルは、DC分化、細胞表面分子の特性評価、および感染プロトコルのステップ全体にわたるガイダンスを提供し、科学者が リーシュマニア 感染に対するDC応答を調査し、感染の過程でこれらの細胞が果たす役割についての洞察を得ることができます。
概要
リーシュマニア症は、 リーシュマニア 属1の異なる種によって引き起こされる顧みられない疾患の複合体を構成しています。 リーシュマニア は、ヒトや他の哺乳類に感染するトリパノソマ科の細胞内原生動物であり、皮膚病変から内臓形態2までのさまざまな疾患を引き起こします。この疾患の主な臨床症状は、被蓋リーシュマニア症(TL)と内臓リーシュマニア症(VL)です。世界保健機関(WHO)は、年間70万人から100万人の新規症例が発生し、毎年7万人が死亡していると推定しています2。リーシュマニア症は、世界中で約1,200万人から1,500万人が罹患しており、3億5,000万人が罹患するリスクがあります3。
リーシュマニア属は、プロマスタチゴートとアマスティゴート4の2つの進化形態を示します。リーシュマニア前茎動物は、べん毛の存在と高い運動性によって特徴付けられます。これらの形態は、シロチョウバエの消化管に見られ、そこで感染型(メタサイクリック前マスチゴテス)5に分化します。対照的に、アマスチゴテスは感染した哺乳類細胞の細胞内環境に見られます。この進化的形態は、次に、食細胞のファゴリソソームで複製されます6。
リーシュマニア属の感染サイクルは、サシチョウバエが宿主の皮膚にメタ環状前マスティゴットを接種する授血中に始まります1。リーシュマニアの接種後まもなく、好中球や組織常在マクロファージなどの自然免疫細胞が寄生虫を食作用させます。寄生性液胞内では、リーシュマニアはアマスチゴテスに分化して複製し、宿主の細胞膜が破裂し、隣接する細胞の感染と寄生虫の拡散が可能になります4。このサイクルは、フレボトミンがアマスチゴテを含む食細胞を摂取すると完了し、食細胞は昆虫の腸管でプロサイキングプロマスティゴテに分化し、後にメタサイキングプロマスティゴテに分化します7。
樹状細胞は、組織やリンパ節に見られる専門的な抗原提示細胞であり、免疫系のセンチネルとして機能します8。これらの細胞は、主に抗原の捕捉とプロセシングに関与する未成熟段階の末梢組織に見られます。病原体と接触した後、DCは成熟過程を経てリンパ節に移動し、その後、ナイーブCD4+ T細胞に抗原を提示します。これらの細胞は、耐性または炎症を引き起こす自然免疫応答および適応免疫応答の調整にも不可欠です9。DC成熟プロセスには、MHCやCD40やCD86などの共刺激分子の発現の増加、サイトカイン分泌の増強など、いくつかの側面が含まれます。DCはCD11bやCD11cなどの異なるマーカーを発現し、ヒトではCD14+ 単球(moDC)に由来するDCがCD1a10を発現します。CCR7はDCで高発現し、これらの細胞の複雑な移動過程を示している12。CD209およびCD80は、DCおよびリンパ球13との最初の接触においても重要な役割を果たす。
リーシュマニア症では、MoDCが寄生虫を食作用させ、それらをドレインリンパ節(dLN)に送達し、そこでT細胞に抗原を提示することが研究で示唆されています13。寄生虫捕獲機構は、食作用中のアクチンフィラメントによる細胞骨格再編成と関連しており、寄生虫の内在化を促進する14。リーシュマニア症におけるDCの役割に関するほとんどの研究は、L. major、L. amazonensis、およびL. braziliensis15に焦点を当てています。興味深いことに、リーシュマニア感染のin vivo研究では、DC機能の障害が寄生虫株特異的に発生することが示されています。
L. amazonensis感染の初期段階では、DCは寄生虫感染を抑制する能力が低下することが実証されています。逆に、L. braziliensis感染の実験モデルでは、DCはリーシュマニアの生存を制限する適切な免疫応答を開始することが示されました16。リーシュマニア属の感染に対する反応の違いと関連していることが知られている主な側面は、DCの成熟と活性化の程度です。この論文では、ヒトDCがリーシュマニア感染で果たす役割を調査し、これらの細胞が疾患の転帰にどのように影響するかをさらに理解する方法について説明します。
プロトコル
注:細胞は健康なドナーボランティアから採取されました。ここに記載されている手順は、国家倫理委員会(番号2.751.345)-Fiocruz、バイーア、ブラジル)によって承認されました。
1. ヒト樹状細胞の分化
- 50 mLの円錐形チューブに10 mLのポリスクロース-ナトリウムトリアゾエート混合物をピペットで移します。
- ドナーごとにそれぞれ50 mLコニカルチューブを標識します。
- 健康なドナーから30mLの血液を採取し、その後のすべてのステップを層流フードで実行します。
- 血液を慎重に円錐管に移し、生理食塩水(0.9%塩化ナトリウム)で室温で1:1の割合で血液を希釈します。
- ゆっくりと希釈した血液をチューブ内のポリスクロース-ナトリウムトリアゾエート混合物に重ねます(ステップ1.1)。チューブを400 × g で1回、25°Cで30分間遠心分離します。
注:グラジエント層の混合を防ぐために、遠心分離の前にブレーキをオフにしてください。最初の遠心分離後、遠心分離機内の温度を4°Cに下げます。 - チューブを遠心分離機から慎重に取り出します。
- サンプル中の末梢血単核細胞(PBMC)によって形成されたリングを探します(バフィーコート)。ピペットで残留血漿を慎重に吸引します。
注:遠心分離により、赤血球、密度勾配培地、PBMC環、および血漿の勾配層が形成されます。PBMCリングは、密度勾配媒体とプラズマ層の間にあります。 - 曇ったPBMC層を別のチューブに移し、生理食塩水を最終容量30mLまで加えます。
- 細胞懸濁液を含むチューブを250 × g で4°Cで10分間遠心分離します。 上清を捨て、生理食塩水1mLを加えてペレットを再懸濁します。
- 細胞計数用のアリコートを採取し、1:1,000に希釈します。希釈した細胞10 μLを使用して、ノイバウアーチャンバーを使用したトリパンブルー排除法による細胞のカウントを行い、細胞生存率を測定します。
- 懸濁液を再び200 × g で4°Cで10分間回転させます。
- ペレットを磁気活性化セルソーティング(MACS)バッファーに再懸濁します。1 ×10 7 セルあたり80 μLのバッファーを使用してください。
メモ: MACS バッファの構成については、 表 1 を参照してください。バッファーを冷たく保ち、2〜8°Cで保存します。 - ステップ1.9で調製した細胞懸濁液にCD14マイクロビーズを添加します。107 細胞あたり20 μLのCD14マイクロビーズ×使用します。
注:CD14マイクロビーズは、ヒト抗CD14を含むビーズがほとんどの単球の表面に発現するCD14+ 細胞に結合するため、PBMCからヒト単球を正に選択するために使用されます。 - ピペットを上下に動かして、ペレットとマイクロビーズを均一に再懸濁します。氷の上を15分間保ちます。
- 懸濁液を300 × g で4°Cで10分間遠心分離します。
- MACSバッファ内のセルを再一時停止します。細胞-マイクロビーズ混合物中の1×107細胞あたり1〜2mLを使用してください。
- 懸濁液を300 × g で4°Cで10分間遠心分離します。
- 上清を取り除き、ペレットを500 μLのMACSバッファーに再懸濁します。
注:これは、1つのカラムで処理される細胞懸濁液の最大容量です。 - 磁気カラムを組み立てます。
- 500 μLのMACSバッファーでカラムを一度洗浄し、バッファーが重力下でカラム内を流れるのを待ちます。
注意: 空気がカラムを遮る可能性があるため、カラムが乾燥しないように注意してください。 - カラムあたり500 μLの細胞ビーズ懸濁液(ステップ1.19)を添加します。セル懸濁液が重力下でカラム内を流れるようにします。
- カラムを500 μLのMACSバッファー(2x)で洗浄します。新しいバッファーは、カラムリザーバーが空の場合にのみ追加してください。カラムを乾かさないでください。
- 新しいチューブをカラムの下に置き、MACSバッファー1 mLをカラムにピペットで移し、プランジャーをしっかりと押して磁気標識細胞をカラムからすぐに洗い流します。
- CD14に富んだ細胞を300 × g で4°Cで10分間遠心分離します。
- ノイバウアーチャンバーを使用して細胞をカウントします。
- 100 μL/mLのインターロイキン-4 (IL-4) ( (50 ng/mL) + 顆粒球マクロファージコロニー刺激因子 (GM-CSF) (50 ng/mL) を含む1 mLの完全RPMIに細胞を再懸濁します。
- 上記のサイトカインを含む500 μLの完全RPMI培地にウェルあたり2×10個の5細胞の濃度で24ウェルプレート上の細胞を播種し、37°Cで7日間インキュベートします。
2. リーシュマニア 文化
注:このアッセイでは 、L. amazonensis (MHOM/BR88/Ba-125)寄生虫を使用しました。
- Novy-Nicolle-MacNeal(NNN)血液寒天培地で、25 cm2 培養ボトルにシュナイダーの完全培地5 mLまたはMinimum Essential Medium(MEM)を入れ、24°Cのバイオ酸素要求量(BOD)インキュベーターで前胸炎を維持します。
注: L. amazonensis 種の前マスティゴテ型を培養するために、5 mLのシュナイダー完全培地(10%の不活化ウシ胎児血清(FBS)とゲンタマイシンを50 μg / mLの濃度で含有するシュナイダー昆虫培地)を使用しました。 - BODインキュベーターで24°Cで7日間インキュベートします。
- 100 μLの前マスティゴート培養液を新しい25 cm2 細胞培養フラスコにピペットで移します。
- サプリメントのMEMを5mL加えます。
- BODインキュベーターで24°Cでインキュベートし、生理食塩水で希釈した寄生虫細胞懸濁液のアリコートをノイバウアーチャンバー(すなわち、血球計算盤)に移すことにより、固定相に達するまで定期的に前胸茎をカウントします。
注:NNN培地後の最初のパッセージを実験に使用しないでください。 - リーシュマニア固定成長期前乳房の1×105を新しい25 cm2細胞培養フラスコに移し、補充したMEMを5 mL加えます。
- ノイバウアーチャンバーを使用して、固定相が達成されるまで培養物の成長を定期的に監視します。
注:原性の損失を避けるために、 in vitro で最大7継代の前長茎培養物を使用してください。
3. リーシュマニア 感染症
- 培養寄生虫の固定相増殖を確認した後、培養ボトルから内容物をすべて取り出し、50mLのコニカルチューブに入れます。冷たい生理食塩水を加えて、最終容量を30mLにします。
- 1,600 × g で4°Cで10分間3回遠心分離します。遠心分離後に上清を捨て、ペレットを冷たい生理食塩水に再懸濁します。
- 細胞を洗浄して生存不能な寄生虫を取り除き、ペレットを1 mLの冷たい生理食塩水に再懸濁します。懸濁液を16Gの針を取り付けた1mLシリンジに5回ゆっくりと通し、寄生虫クラスターを分離します。
- サンプルからアリコートを取り出し、式(1)を使用して血球計算盤の寄生虫濃度をカウントします。
寄生虫濃度 = 4 象限の寄生虫の平均 × 希釈係数 ×10 4 (1) - Leishmania sp.の量を計算します。寄生虫:宿主細胞の比率を10:1に維持するためにプレーティングする宿主細胞の数に必要です(ステップ1.27)。
- 1 mLの生理食塩水を加え、細胞を室温で300 × g で10分間3回遠心分離してDCを洗浄します。
- 24ウェル細胞培養プレートの各ウェルに必要量の リーシュマニア を入れます(ステップ3.5を参照)。
- DCを寄生虫と寄生虫とインキュベートし、インキュベーター内で37°C、5%CO2 雰囲気で4時間インキュベートします。
4. フローサイトメトリー解析のための免疫染色
- 感染後、細胞を生理食塩水1mLで2回洗浄し、非内在化寄生虫を除去します。
注:抗体クローンと蛍光色素を含むパネルは 、材料表に記載されています。 - 抗体を蛍光活性化セルソーティング(FACS)バッファー(1x PBSと1% BSA)で、実験条件ごとに最終容量50 μLで希釈(1:50)します。
注:最適な染色濃度を確保するために、実験前に抗体を滴定することが重要です。このプロトコルでは、滴定実験後に1:50を使用しました。 - マスターミックス(1% BSAと1% BSA+抗体ミックスを含む1x PBS)を調製します。ボルテックスとピペットで50μLの混合物を細胞を含むウェルに入れます。
- 抗体混合物(抗ヒトCD1a、抗ヒトCCR7、抗ヒトCD83、抗CD11c、抗ヒトCD209、抗ヒトHLA-DR)とDCを氷上で30分間、光から保護して短時間インキュベートします。
- 細胞を1 mLの冷間染色バッファー(1x PBS中の1% FBS)で2回洗浄し、300 × g で4°Cで5分間遠心分離します。
- 上清を吸引し、ペレットを200 μLの冷染色バッファーに再懸濁します。
- フローサイトメーターでデータ取得を進めます。
注:FACS分析の最適な条件を確保するために、サンプル染色後48時間以内にデータ取得を行う必要があります。データはFlowJoソフトウェアを使用して分析されました。- FlowJoソフトウェアプログラムを開き、新しいワークスペースを作成します。解析するフローサイトメトリーファイルをワークスペースウィンドウにドラッグして追加します。
- チューブ名をクリックして、サイドスキャッター(SSC)とフォワードスキャッター(FSC)のパラメーターを選択します。
注:DC成熟のフローサイトメトリー解析は、CD1a、CD11c、CD80、CCR7、CD209、およびHLA-DRの発現に基づいていました。 - ポリゴン ゲーティング ツールを使用して、DC の周囲にゲートを描画し、選択したゲート セルをダブルクリックして新しいウィンドウを表示します。FSC-AおよびFSC-Hパラメータを選択して、ダブレットクリーンアップを実行します。ポリゴンツールを使用して、個々のセルの周りに新しいプロットを描画します。
- ゲートされた細胞をダブルクリックし、SSCおよびCD11cパラメータを選択して、CD11c+ 細胞を含むゲートを生成します。
- クリーニングしたCD11c+ セルゲートを選択してエクスポートします。ゲートを右クリックし、[ Select equivalent nodes ] オプションを選択します。ゲートを右クリックし、最近作成したフォルダに保存して、補正されたすべてのパラメータとともにゲートをエクスポートします。
- 最近保存したファイルを開いて、新しいワークスペースを作成します。 [ワークスペース ] をクリックし、 プラグイン |ダウンサンプル |30,000〜50,000のイベント。 OKを押します。
注: TSNE は時間がかかり、計算負荷の高いプロセスであるため、分析されるイベントの総数を減らすためにこの手順をお勧めします。 - ダウンサンプリングされたファイルを右クリックし、 同等のノードを選択します。
- ダウンサンプリングされたファイルを右クリックし、[ エクスポート/連結] を選択します。
- 連結ウィンドウをクリックし、補正されたすべてのパラメータを選択します。連結されたファイルを選択し、workspace | plugin | tSNEをクリックします。
- 必要なパラメータ(CD1a、HLA-DR、CCR7、CD80、CD209、CD11c)を選択してクラスターを作成します。 OKを押します。
- 連結されたファイルをクリックして、tSNE1およびtSNE2パラメータを視覚化します。
5. アクチン免疫染色
- 24ウェルプレートに入れたカバースリップ上のプレート感染DC。プレートを300 × g 、4°Cで10分間遠心分離します。感染後、室温で滅菌生理食塩水で細胞を3回洗浄し、細胞外寄生虫を除去します。
- DCを500 μLの4%パラホルムアルデヒドと室温で15分間インキュベートします。パラホルムアルデヒドを除去し、生理食塩水1mLを加えます( 表1を参照)。
6. 免疫標識
注意: 攪拌しながら次の手順を実行します。
- カバースリップを1x PBSで5分間洗浄します。3回繰り返します。ウェルあたり500μLの塩化アンモニウム溶液を添加します。室温で10分間インキュベートします。
- カバースリップを1x PBSで5分間洗浄します。3回繰り返します。
- 0.15%サポニンでメンブレンを15分間透過処理します。
- 1x PBS 1x/3% BSA/0.15% サポニンで 1 時間ブロックします。カバースリップを1x PBS/0.15%サポニンで5分間洗浄します。3回繰り返します。
- 1x PBS/1% BSA/0.15%サポニンで希釈したファロイジン(1:1,200)と1時間細胞をインキュベートします。カバースリップを1x PBS/0.15%サポニンで5分間洗浄します。3回繰り返します。
- 4',6-ジアミジノ-2-フェニルインドール(DAPI)を封入した封入剤に、セルを下に向けてカバースリップを置きます。スライドをアルミホイルで覆い、光から保護します。
- 63x/1.4対物レンズを備えた共焦点蛍光顕微鏡を使用して画像を取得します。
7. 共焦点顕微鏡法による取得とフィジー定量
- 共焦点レーザー走査型顕微鏡を使用して免疫蛍光画像を撮影します( 材料表を参照)。
注意: 最高の解像度を得るには、63倍の対物レンズ油浸レンズを使用してください。 - カバーガラスを光から保護し、取得する前に少なくとも30分間室温に置いてください。
- カバースリップを清掃するには、吸収性ティッシュを使用してください。対物レンズに液浸油を一滴加え、スライドを顕微鏡ステージに置きます。オイル入りの63倍対物レンズを選択し、オイルがスライドに触れるまでプラットフォームを持ち上げ、顕微鏡の焦点を調整します。
- プログラムを開き、488、552、および405nmのレーザー波長をアクティブにします。
- 画像の解像度を 1024 x 1024 ピクセルに設定します。
- ライブボトムをクリックし、Zスタックを設定して、Beginを押します。このプロセスを繰り返してから、終了ボタンを押します。
- 画像取得が完了するのを待ってから、ツールで[最大投影]オプションを選択します。
- 実験を保存し、.lif 形式の画像をコンピューターにエクスポートします。
- FIJI プログラムを開き、FIJI で実験を開き、 ビュー スタック を Hyperstack に設定します。
- 開いている画像ファイルを個別に選択 | タイルをステッチします。
- フィジーのツールバーでフリーハンドツールを選択し、各セルを手で注意深くトレースします。プレス解析|蛍光強度を可視化する測定。グループごとに各セルタイプについてこのプロセスを繰り返します。
- 測定値を保存し、スプレッドシートにエクスポートします。統計解析ソフトウェア( 資料表参照)でデータを含むファイルを開き、統計解析を行います。
8. 統計分析
- ソフトウェアで新しいプロジェクトを開きます。
- 正規分布のデータには、スチューデントの t 検定を使用します。ノンパラメトリックデータの場合は、マンホイット ニーU 検定を使用します。
- 実験結果から得られた値を表に貼り付けます。
- 記述統計量を選択し、データ分布を分析するために列統計量 [すべての検定]オプションを選択します。
注:データがガウス分布に従う場合は、 t検定を選択して、2つのペアを比較してサンプルを調べます。分布が非ガウス分布の場合は、中心傾向測度(平均または中央値)と変動の測度を指定したマンホイット ニーU 検定を使用してデータを分析します。 - 最適なデータ表現のために 、最適なグラフ オプションを選択します。
結果
このレポートでは、フローサイトメトリーと共焦点顕微鏡を使用して、リーシュマニア感染におけるDCの役割を調査します。最初に、ヒト単球由来DCの表現型プロファイルが確立されました。特に、得られたCD11c+樹状細胞集団は、CCR7、CD209、CD80、CD1a、およびHLA-DRに対して陽性でした。この結果は、DC集団におけるこれらのマーカーの発現がリーシュマニア感染によって深く影響を受けることを示しています。感染したDCは、CD80、CD209、CCR7、およびHLA-DRの発現増強を示しました。しかし、CD1aのダウンレギュレーションは、L.amazonensisに感染したDCでも観察され、さらに、主成分分析により、これらの分子の発現に実質的な違いが明らかになりました(図1B-D)。次元削減技術であるt-Distributed Stochastic Neighbor Embedding(t(tSNE)アルゴリズムを使用して、リーシュマニア感染が成熟関連分子の発現にどのように影響するかをよりよく視覚化しました。
注目すべきは、tSNE密度プロットは、感染したDCがHLA-DRとCD80の発現が異なることを示しており、これは抗原提示に関与する分子のアップレギュレーションをさらに示唆しています(図2)。DCを可視化するために、細胞を蛍光ファロイジンで標識することにより、F-アクチン免疫染色を行いました。DC内で のL. amazonensis 感染を観察するために、核染色(DAPI)を使用して 、リーシュマニア感染細胞と非感染細胞を比較しました(図3)。 L. amazonensis promastigotes(10:1)が関与するhDC感染の動態解析は、感染後4時間における感染細胞の割合と感染細胞あたりの寄生虫数を示しています。その後、細胞を洗浄し、6時間、12時間、または24時間再インキュベートしました。平均して、感染細胞の~55%でDCあたり4〜5個の寄生虫が観察されました。

図1:リーシュマニア・アマゾネンシス感染後のマーカーベースのヒトDC特性評価;CD 11c+選択のためのゲーティング戦略。 (A)共刺激分子MFIの評価。(B)共刺激分子MFI値のヒートマップおよび(C)主成分分析。(D)各分子のMFIを示す代表的なヒストグラムと散布図。略語:DC =樹状細胞;MFI = 蛍光強度の中央値。SSC-A = 側方散乱面積;FSC-A = 前方散乱面積;FSC-H = 前方散乱高さ。この図の拡大版を表示するには、ここをクリックしてください。
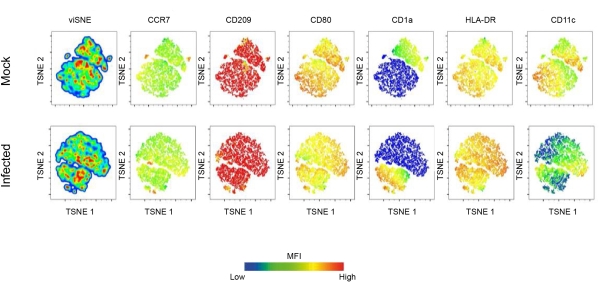
図2:リーシュマニアによるDC表面分子発現。 リーシュマニア感染によって引き起こされるDC成熟ランドスケープの詳細な特性評価。簡単に言うと、単球由来のDCは、GM-CSFおよびIL-4との7日間の分化後に得られました。完全分化型DCをL. amazonensisに感染させ、その後、成熟FACS抗体のパネルで染色しました。次元削減技術であるTSNEを使用して、フローサイトメトリーデータの高次元分析を実行しました。略語:DC =樹状細胞;GM-CSF = 顆粒球マクロファージコロニー刺激因子;FACS = 蛍光活性化細胞ソーティング;IL-4 =インターロイキン-4;TSNE = t-distributed stochastic neighbor embedding(t-分布確率的近傍埋め込み)。この図の拡大版を表示するには、ここをクリックしてください。

図3:Leishmania amazonensisによるhDC感染。ヒト樹状細胞をL. amazonensis(10:1)に4時間感染させ、洗浄し、ファロイジンで標識しました。(A)感染または非感染のhDCにおけるF-アクチン標識の蛍光。グリーン、F-アクチン;青、hDCおよびリーシュマニア原虫の核の核染色のためのDAPI。黄色の矢印は、セル内のアマスティゴテスを表しています。白い矢印はhDCのF-アクチンを表します。グレースケール、DIC。(B)蛍光顕微鏡法で無作為に評価された400細胞の感染率と寄生負荷(Anovaを使用して分析)。スケールバー = 25 μm。略語:hDC =ヒト樹状細胞;DAPI=4',6-ジアミジノ-2-フェニルインドール;DIC = 微分干渉コントラスト。この図の拡大版を表示するには、ここをクリックしてください。
| MACSバッファ |
| EDTAの2 mM |
| PBSの1x |
| BSAの0.5% |
| リン酸緩衝生理食塩水(PBS)1x |
| 塩化アンモニウム溶液:0.134gのNH4Cl |
| サポニン 15% |
| 1x PBSの1 mLに150 mgのサポニンを |
| 15% サポニン 1 mL を 1x PBS 100 mL に |
| 10%ウシ血清アルブミン |
| 100 mg – 1 mL → 10% |
| 1 g – 100 mL → 1% |
| 10% BSA の場合 - 1x PBS 10 mL 中の BSA 1 g |
| 1x PBS/ 1% BSA / 0.15% サポニン: 20 mL 1x PBS 10% BSA 2 mL 200 μL の 15% サポニン |
| 1x PBS/ 3%BSA / 0.15%サポニン:1x PBSの20mL;6mLの10%BSA;200 μL 15% サポニン |
| 1x PBS / 0.3%BSA / 0.15%サポニン:20mL PBS;0.6mLの10%BSA;200 μL の 15% サポニン |
表1:このプロトコルで使用される溶液の組成。
ディスカッション
リーシュマニア症は、世界中で深刻な公衆衛生上の問題となっています。この疾患の病因は非常に複雑であり、脊椎動物の宿主における寄生虫の生存を促進するメカニズムは依然としてとらえどころのないままです17。DCは、濾過器官やリンパ器官など、全身に見られる専門的な抗原提示細胞です。抗原の捕捉およびプロセシングに続いて、未成熟DCは複雑な成熟過程を経、リンパ節への移動で最高潮に達し、これらの細胞が抗原をTリンパ球に提示する役割を担っている18。この成熟過程は、MHCクラスII分子発現の増加、特にCD11c、CD86、CD80、およびCD1a19によって特徴付けられる。リーシュマニア症では、単球由来のDCが寄生虫を食作用させ、その貨物をdLNに送達し、T細胞に抗原提示を誘導する13。
この論文では、in vitro感染モデルにおけるリーシュマニアがDCの免疫生物学的機能に及ぼす影響を調査することを可能にする簡潔なプロトコルについて説明します。このプロトコールは、ヒト単球のDCへの取得および分化、ならびにフローサイトメトリーおよび共焦点顕微鏡によるDC特性評価を含む、最先端の免疫学的技術の使用を包含する14。最初に、単球は健康なドナーのPBMCから精製されました。抗ヒトCD14マイクロビーズなどのポジティブセレクション法の使用により、分化したmoDCの高純度(>95%)が保証されます。これらの細胞は、抗体をサンプル中のCD14陽性細胞に結合する抗ヒトCD14マイクロビーズと共にインキュベートされ、次いで、磁気細胞セパレータ20のカラム内の高勾配磁場によって分離される。
特に、ヒト単球をDCにin vitroで分化させるには、GM-CSFとIL-4の添加が必要です。GM-CSFは、マクロファージコロニー刺激因子(M-CSF)の発現をダウンレギュレートするだけでなく、M-CSFによるマクロファージへの分化を阻害する多面的成長因子です。さらに、IL-4はマクロファージコロニー形成を阻害することにより作用し、in vitroでmoDCを培養するための適切な方法と考えられている21。本プロトコルは、CCR7、CD209、CD80、CD1a、HLA-DR、およびCD11cなどの成熟関連マーカーの発現を分析することにより、DC分化を評価するためのフローサイトメトリーの使用を提案している。さらに、高次元フローサイトメトリー技術(例えば、t-SNE)を使用して、リーシュマニア感染22の影響を受けた発現パターンを正確に同定する。免疫染色中の抗体希釈を最適化することが重要です。
共焦点顕微鏡は、ヒト細胞の蛍光強度を分析および定量化するための優れたツールである23。このアッセイでは、画像取得前にカバースリップを優しく洗う、光にさらされないようにするなど、慎重な操作が必要であることに注意することが重要です。この方法の主な制限は、共焦点顕微鏡で適切な画像解像度を取得することであり、これには顕微鏡操作の経験が必要です。ただし、この方法は、さまざまな病原体による感染に対するDCの応答を研究するために使用できます。あるいは、このプロトコルに記載されているステップは、病原体感染の他のモデルに外挿することもできます。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
Gonçalo Moniz Institute(IGM-Fiocruz)(ブラジル、バイーア)と顕微鏡部門の支援に感謝します。著者らは、Andris K. Walterの批判的分析、英語の校正、原稿の編集支援に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| anti CCR7 | Thermo | ||
| anti CD209 | Isofarma | ||
| anti CD83 | Leica SP8 | ||
| anti HLA-DR | Gibco | ||
| Bovine serum albumin | Thermo | A2153-100G | Sigma |
| Ciprofloxacin | Gibco | ||
| confocal microscope | Thermo Fisher Scientific | ||
| Fetal bovine serum | Gibco | ||
| Flow Jo | Thermo Fisher Scientific | ||
| Gentamicin | Thermo Fisher Scientific | ||
| Glutamin | Gibco | ||
| HEPES | Thermo Fisher Scientific | ||
| phalloidin | Thermo Fisher Scientific | ||
| Phosphate buffer solution | Peprotech | ||
| prolong gold antifade kit | BD pharmigen | ||
| RPMI | BD pharmigen | ||
| Saponin | BD pharmigen | 47036 – 50G – F | Sigma |
| Schneider's insect medium | software BD biosciences |
参考文献
- Torres-Guerrero, E., Qunitanilla-Cedillo, M. R., Ruiz-Esmenhjaud, J., Arenas, R. Leishmaniasis: a review. F1000 Research. 6, 750 (2017).
- Pace, D. Leishmaniasis. Journal of Infection. 69, 10-18 (2014).
- Reithinger, R., et al. Cutaneous leishmaniasis. Lancet. Infectious Diseases. 7 (9), 581-596 (2007).
- Kaye, P., Scott, P. Leishmaniasis: complexity at the host-pathogen interface. Nature Reviews. Microbiology. 9 (8), 604-615 (2011).
- Handman, E., Bullen, D. V. Interaction of Leishmania with the host macrophage. Trends in Parasitology. 18 (8), 332-334 (2002).
- Burza, S., Croft, S. L., Boelaert, M. Leishmaniasis. Lancet. 392 (10151), 951-970 (2018).
- Kamhawi, S. Phlebotomine sand flies and Leishmania parasites: friends or foes. Trends in Parasitology. 22 (9), 439-445 (2006).
- Guilliams, M., et al. Unsupervised high-dimensional analysis aligns dendritic cells across tissues and species. Immunity. 45 (3), 669-684 (2016).
- Moll, H. Dendritic cells and host resistance to infection. Cellular Microbiology. 5 (8), 493-500 (2003).
- Sundquist, M., Rydstrom, A., Wick, M. J. Immunity to Salmonella from a dendritic point of view. Cellular Microbiology. 6 (1), 1-11 (2004).
- Saban, D. The chemokine receptor CCR7 expressed by dendritic cells: A key player in corneal and ocular surface inflammation. Ocular Surface Journal. 12, 87-99 (2014).
- Relloso, M., et al. DC-SIGN (CD209) Expression is IL-4 dependent and it is negatively regulated by IFN, TGF and inflammatory agents. Journal of Immunology. 168 (6), 2634-2643 (2002).
- Leon, B., Lopez-Bravo, M., Ardavin, C. Monocyte-derived dendritic cells formed at the infection site control the induction of protective T helper 1 responses against Leishmania. Immunity. 26 (4), 519-531 (2007).
- Gordon, S. Phagocytosis: An immunobiologic process. Immunity. 44 (3), 463-475 (2016).
- Ashok, D., Acha-Orbea, H. Timing is everything: dendritic cell subsets in murine Leishmania infection. Trends in Parasitology. 30 (10), 499-507 (2014).
- Carvalho, A. K., et al. Leishmania (V.) braziliensis and L. (L.) amazonensis promote differential expression of dendritic cells and cellular immune response in murine model. Parasite Immunology. 34 (8-9), 395-403 (2012).
- Bates, P. A. Transmission of Leishmania metacyclic promastigotes by phlebotomine sand flies. International Journal of Parasitology. 37 (10), 1097-1106 (2007).
- Cervantes-Barragan, L., et al. Plasmacytoid dendritic cells control T-cell response to chronic viral infection. Proceedings of the National Academy of Sciences of the United States of America. 109 (8), 3012-3017 (2012).
- Caux, C., et al. Activation of human dendritic cells through CD40 cross-linking. Journal of Experimental Medicine. 180 (4), 1263-1272 (1994).
- Suzuki, H., et al. Activities of granulocyte-macrophage colony-stimulating factor and interleukin-3 on monocytes. American Journal of Hematology. 75 (4), 179-189 (2004).
- Akira, S., Takeda, K. Toll-like receptor signalling. Nature Reviews. Immunology. 4 (7), 499-511 (2004).
- McKinnon, K. M. Flow cytometry: An overview. Current Protocols in Immunology. 120, 1-11 (2018).
- Sanderson, M. J., et al. Fluorescence microscopy. Cold Spring Harbor Protocols. 10, 1795 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved