Method Article
Выделение эмбриональных клетках эндотелия желудочков
В этой статье
Резюме
Первичные культуры клеток является полезным методом для анализа конкретных популяций клеток, в частности из трансгенных эмбрионов мыши на определенных этапах своего развития. При этом эмбриональная желудочков расчленены и диссоциированных и антител конъюгированных бисера признать и выделить эндотелиальные клетки для дальнейшего анализа.
Аннотация
Клеточные культуры в значительной степени повысить нашу способность оценивать отдельных популяций клеток в культуре множества условий. В то время как увековечены клеточных линий предлагают значительные преимущества для их простоту использования, эти клеточные линии недоступны для всех потенциальных типов клеток. При изоляции первичных элементов из определенной области интересов, в частности, от трансгенных мышей, больше нюансов исследования могут быть выполнены. Основной метод предполагает рассечение органа или частичном орган интерес (например, сердце или конкретной области сердца) и диссоциации органа отдельные клетки. Затем эти клетки инкубировали с магнитными шариками конъюгированным с антителом, которое распознает тип клеток, представляющих интерес. Интерес клетки могут быть затем выделена с использованием магнита, с короткой инкубации трипсин диссоциации клеток из шариков. Эти изолированные клетки могут быть затем культивировали и анализировали, как хотелось бы. Этот метод был первоначально разработан для взрослого органа мышис, но может быть легко уменьшено для использования с эмбриональных органов, как показано здесь. Поскольку наш интерес в развивающихся коронарных артерий, мы хотели изучить эту популяцию клеток в течение определенных эмбриональных стадиях. Таким образом, исходный протокол должен быть изменен, чтобы быть совместимым с небольшим размером эмбриональных желудочков и низким потенциалом выход эндотелиальных клеток на этих стадиях развития. Используя эту уменьшенную подход, мы оценили ремоделирования коронарных сплетения в трансгенных эмбриональных желудочка эндотелиальных клеток.
Введение
Появление увековечены клеточных линиях революции основная клеточная биология 1. В настоящее время доступные клеточные линии, полученные из широкого круга органов и охватывает все основные типы клеток. Тем не менее, установлено клеточные линии имеют некоторые ограничения. Процесс иммортализацией очевидно изменяет поведение клеток, в частности в отношении продолжительности жизни и пролиферацию, но также может влиять на экспрессию неожиданный белки, такие как белки цитоскелета 2. Кроме того, хотя различные клеточные линии, которые доступны, существуют значительные различия между даже одного типа клеток в течение всего организма. Эндотелиальные клетки, в частности, разнообразные шоу поведения, на основании их линии артерий или вен и какой поток присутствует в емкости 3. Еще более актуальным с точки зрения развития, однако, является то, что подавляющее большинство из доступных клеточных линий, полученных из взрослых тканей (см., например TОн коллекции доступны через АТСС). Эти взрослые клеточные линии, вероятно, не повторять динамический характер их эмбриональные предшественники. Быстро меняется пространственно-временной экспрессии генов наблюдалось во время разработки также показывают, что эндотелиальные клетки от одного органа в данной стадии развития не может вести себя так же, как эндотелиальные клетки от одного органа на другой стадии развития.
В качестве альтернативы с использованием коммерчески доступных иммортализованных линий клеток, первичные элементы могут быть изолированы от конкретной ткани, представляющих интерес. Среди преимуществ этой техники, эти первичные клетки могут быть выделены из конкретного органа или части органа в любой конкретной стадии развития. Кроме того, эти первичные клетки могут быть выделены из широкого спектра доступных трансгенных животных, позволяя в пробирке изучение нокаут гена и нокаут в избегая при этом другие проблемы, такие как эффективность трансфекции. Неудивительно, что многиеметодов были опубликованы подробно, как изолировать специфические типы клеток 4,5. В общем, эти методы включают сбор области, представляющей интерес, диссоциации клеток, пометки конкретного типа клеток интереса, и выделение этих клеток для дальнейшего анализа.
Для изучения раннего эмбрионального населения коронарных эндотелиальных клеток, мы уменьшено ранее опубликованных методика 4 для использования с меньшим органа. С этим уменьшенную процедуру, мы можем изолировать коронарных эндотелиальных клеток из эмбрионального сердца в определенных эмбриональных стадиях. Эти клетки могут быть затем использованы в традиционных эндотелиальных анализов, таких как миграция анализов. До начала линий эмбриональных не стала более распространенной, работа с первичными клетками является бесценным технику.
протокол
1. Подготовьте антителами конъюгированных Бисер
- За один день до вскрытия, комбинировать антитела по выбору с соответствующим Dynabeads (например, IgG крысы Dynabeads на антителе, выработанном в крыса, 4 × 10 8 бисер / мл) в соответствии с инструкциями производителя. Для крыс BD анти-CD31 антителами (0,5 мкг / мл, использовали для выделения эндотелиальных клеток), 3 мкл антител добавляется на каждые 25 мкл шариков, для конечной концентрации 1,5 мкг анти-CD31 антитело и 1 × 10 7 бисер / 25 мкл буфера.
- Выдержите бисером и антител в течение ночи при 4 ° С.
2. Подготовка Коллаген Plate
- Изолированные клетки образуют канальцев быстрее при выращивании на коллагеновый гель в противоположность простому покрытых коллагеном пластины. Поэтому, коллаген гели сделаны в ночь перед рассечение, как описано в 6. На льду в капюшоне культуры ткани, объединить следующие реагенты (достаточно для 19 скважин): 206,4 мкл стерильной H <суб> 2 O, 140,4 мкл коллагена типа I (4,08 мг / мл), 38,4 мкл 10х M199 и 1,15 мкл 5 М NaOH.
- Пипеткой 20 мкл этого коллагеновый гель в лунки 384-луночный планшет для тканевых культур. Место пластины в 37 ° C культуре ткани инкубаторе в течение 30 мин.
- Добавить 80 мкл DMEM в каждую лунку и инкубировать в течение 15 мин при 37 ° C. Удалить культуральной среды и повторите еще два раза.
- По завершении последней промывки, добавьте 80 мкл 10% ФТС / DMEM в каждую лунку и инкубировать в течение ночи при 37 ° С. Удалить культуральной среде перед добавлением изолированных клеток.
3. Акцизные и переварить сердца
- Усыпить тайм-беременные мыши на нужной день эмбрионального развития с использованием утвержденной эвтаназии технику. Все эксперименты были одобрены Институциональные уходу и использованию животных комитета в Университете Северной Каролины в Чапел-Хилл.
- С помощью мыши в лежачем положении, обильно распылить вентральной стороне женщин с 70% этанолом дорассечение. Использование щипцов для подъема нижней части живота, кожа и мышцы от внутренних органов, разрезать нижнюю брюшную полость самки для визуализации внутренних органов.
- Холдинг шейки матки щипцами, аккуратно вырезать каудальнее щипцов и начать подъема рога матки из брюшной полости. Поднимая рога матки, срежьте любой соединительной ткани, которая держит рог на месте. Чтобы закончить вырезания рога матки, вырезать стыке рога матки с яйцевода освободить рога матки.
- Поместите рога матки в чашку Петри, содержащую холодный 1х забуференный фосфатом физиологический раствор (PBS) и полоскание по мере необходимости. Разрезать рог матки через среднюю линию, чтобы открыть прилагаемый эмбриональных мешков.
- Разрежьте зародышевого мешка на стыке плаценты и эмбриона, чтобы избежать случайного резки эмбриона и получения эмбриона. Поместите эмбриона во второй чашке Петри с холодным PBS. Вернуться чашки Петри с роге матки в лед.
- Реecapitate эмбриона для улучшения доступа к грудной стенке. Если генотипирования необходимо, отрежьте хвост, чтобы удалить его и сохранить в трубке Эппендорф помещают на лед.
- С эмбрионом на спине, разрезать грудную стенку для визуализации сердца и легких. Чтобы предотвратить выпадение сердца, чтобы вертикальный разрез вдоль боковой части грудной клетки, вблизи передних конечностей, а затем горизонтальный разрез в нижней части ребра, затем осторожно тянуть грудной стенки вверх и в сторону. Вплоть до примерно 13,5 дня эмбрионального развития, грудная стенка прозрачная, пособничество в визуализации.
- Осторожно поднимите сердца с помощью щипцов и перерезал сосуды ниже. Затем на голову выше магистральных сосудах, чтобы освободить сердце. Если легочные сосуды не обрезаются, легкие могут быть удалены с сердцем. Таким образом, удаления посторонних тканей, например, легких, если это необходимо.
- Отделить и отбросить предсердия и магистральных сосудах из желудочков. Используя ножницы, пропустить через мясорубку желудочков на мелкие кусочки (примерно 1 мм 3 </ Вир>) и место в приблизительно 500 мкл коллагеназы (1 мг / мл в стерильном PBS). Хранить образцы на льду, пока все желудочков не было измельчают и помещают в коллагеназы.
- Повторите предыдущие шаги, пока желудочки не был вырезан из всех эмбрионов, собирая каждое сердце в отдельную пробирку Эппендорф. Если все эмбрионы имеют одинаковый генотип, сердца, могут объединяться в одну трубу Эппендорф. Количество образцов обработанных за один раз может быть ограничено на основе магнита используется для изоляции; DynaMag (123-21D), используемый здесь помещается не более 16 труб Эппендорф.
- Положите фарш желудочков при 37 ° С с качания в течение 45 мин. Каждые 15 мин, осторожно удалить образцы и пипетку вверх и вниз для механической диссоциации клеток.
4. Изоляция эндотелиальных клеток
- Проход желудочка раствор коллагеназы через 70 мкм фильтр для удаления оставшегося группы клеток.
- Центрифуга клетки при 400 х г в течение 10 мин. ОтбрасыватьСупернатант, замените приблизительно 200 мкл 10% FBS в DMEM и пипетку вверх и вниз для диссоциации клеток.
- Повторите предыдущий шаг один раз. Центрифуга клетки при 400 х г в течение 10 мин после стирки второго 10% FBS / DMEM. Ресуспендируют клеток в 50 мкл 10% FBS / DMEM.
- На заключительной стадии центрифугирования, готовят шариков.
- Поместить пробирку Эппендорфа, содержащие антитело и бусы на магнит в течение 1 мин.
- С трубкой на месте на магнит, удалить супернатант. Удалить трубки от магнита и добавляют приблизительно 100 мкл 10% FBS / DMEM.
- Поместите пробирку на магнит в течение 1 мин. Удалить супернатант и снова вымыть с 10% FBS / DMEM. Повторите эти действия для в общей сложности 3 стирок.
- После последней промывки, ресуспендируют антитела конъюгированы шариков в 10% FBS / DMEM (5 мкл на образец).
- Для каждого образца клеток, добавляют 5 мкл антитела конъюгированы шариков. Поместите шарик-клеточные суспензии при 4 ° С с качалки FOR 30 мин.
- В ламинарном боксе, поместите пробирки Эппендорфа, содержащие клетки и антитела, конъюгированного шариков на магнит в течение 1 мин. Удалить супернатант, удалите труб от магнита и промывали около 100 мкл 10% ФТС / DMEM. Повторите на 5 промывок.
- После последней промывки, поместить пробирки на магнит в течение 1 мин, удалить супернатант, и снимите трубки от магнита. Добавьте примерно 100 мкл DMEM.
- Место труб на магнит в течение 1 мин, удалить супернатант и удаления труб от магнита. Добавить 100-200 мкл предварительно нагретого 0,25% трипсин-ЭДТА. Инкубируйте образцы при 37 ° С и 5% СО 2 в течение 5 мин.
- Место труб на магнит в течение 2 мин. Тщательно передачи содержащие клетки супернатант в свежие пробирки Эппендорфа. Центрифуга в течение 5 мин при 400 х г.
- Удалить супернатант. Ресуспендируют клеток в 80-100 мкл среды роста и пластины в 96 - или 384-луночные культуральные чашки обрабатывали, в зависимости от ожидаемого выхода(Примерно 450-600 клеток из желудочков E14.5-E16.5 эмбрионов). Для эндотелиальные клетки, эндотелиальные использовать культуральную среду роста (как определено ниже).
Результаты
Использование эндотелиальных конкретных антитело, которое распознает CD31, эндотелиальные клетки были выделены из желудочков эмбриональных (E) 13,5 (Фиг.1А) и 18,5 (фиг. 1B-1D) эмбрионов. При выращивании на необработанную блюдо культуры, эти клетки остаются округлые и образовали бы булыжник образцу, если рядом с сливной (рис. 1А). Развести коллаген также используется для нанесения покрытия на скважинах, и в то время как эндотелиальные клетки будут прилипать к нему (фиг.1В), они образуют цепи меньше, чем при посеве на коллагеновый гель (фиг. 1C и 1D). Эндотелиальные клетки, выращенные в лунке, содержащей коллаген гель (рис. 1C и 1D) форма межклеточных взаимодействий и образуют цепочки, которые начинают отходить при выращивании на коллаген, и этот процесс происходит быстрее при выращивании на коллагеновый гель по сравнению с покрытых коллагеном пластину. Эти цепи эндотелиальных маркировать положительно с маркером эндотелиальной ISO-лектинов ( Рис. 1D). Выделенные клетки выживают до 1 недели в культуре, но оказались устойчивыми к трипсином (даже после 1 часа при 37 ° С), поэтому они лучше всего подходят для терминала экспериментов.
Эндотелиальные клетки, выделенные из E18.5 желудочков маркировать положительно PECAM (рис. 2а) и Flk1 (рис. 2В). Кроме того, жить изолированной эндотелиальные клетки могут быть помечены с использованием эндотелиальных-специфический флуоресцентный краситель Сыто-16. Рисунок 2D показывает эндотелиальных клеток, которые были выделены из желудочков E14.5 эмбриона и помечены с Сыто-16.
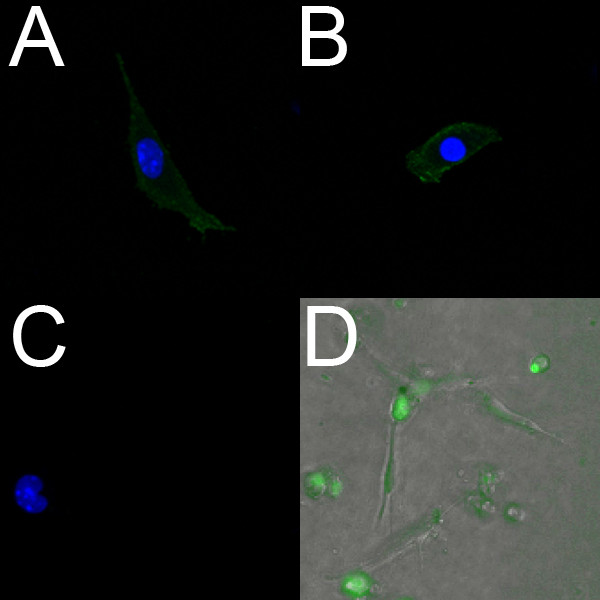
Рисунок 1. Эндотелиальные клетки, выделенные из эмбриональных желудочков мышь образовывать цепочки при выращивании на коллагеновый гель. (A) Светлое 10x изображение живого изолированного желудочка эндотелиальных клеток из Е13.5 сердце гrown на необработанной блюдо культуры, даже после 48 часов, клетки остаются округлыми (B) Светлое 10x изображение основных изолированного желудочка эндотелиальных клеток из E18.5 сердце, выращенных на покрытые коллагеном блюдо;. после 24 часов, некоторые клетки начали удлинения (стрелка), но большинство из них остаются округлыми (стрелка). (C, D) конфокальной изображения основных изолированного желудочка эндотелиальных клеток из E18.5 сердца, выращенные на коллагеновый гель, показанный на светлое (C) и помечены с ISO -лектинов (красный). Стрелки показывают некоторые из лектин-позитивных клеток. Шкала бары в CD = 50 мкм.
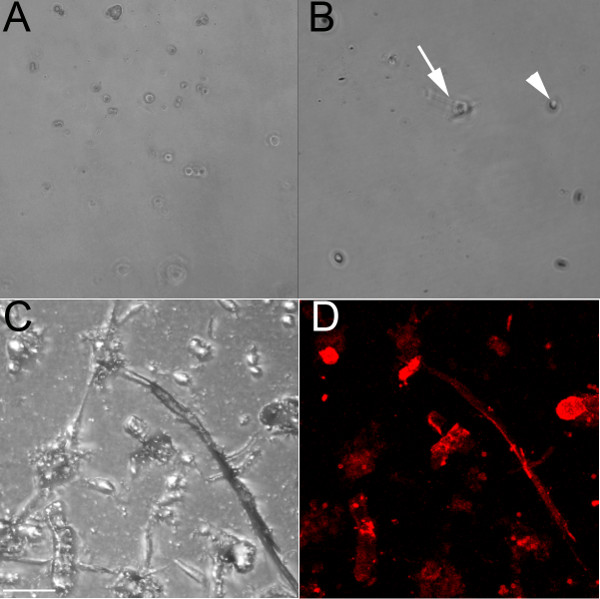
Рисунок 2. Эндотелиальных клеток, выделенных из эмбриональных желудочков мышью маркировать положительно для эндотелиальных маркеров. (AC) конфокальной изображений (40x) основных изолированного желудочка эндотелиальных клеток из E18.5 сердца, выращенные напокрытые коллагеном блюда. Эти клетки маркировать положительно для РЕСАМ (А) и Flk-1 (В); отрицательный контроль (С) не содержит флуоресценции. В переменного тока, ядра помечены DAPI (синий). (D) Флуоресцентные наложения (10x) живых изолированных желудочков эндотелиальных клеток из E14.5 сердца, выращенные на коллагеновый гель. Клетки инкубировали с живой эндотелиальный маркер Сыто-16 (зеленый) и миграции наблюдали с использованием покадровой микроскопии.
Обсуждение
Работа с первичной эмбриональных клеток позволяет разрабатывать новые эксперименты, чтобы обратиться в пробирке важных шагов развития. Тем не менее, процедуры выделения не является тривиальной. Критические шаги выделения любого типа клеток, включают обеспечение того, чтобы клетки хорошо разделены на коллагеназой и затем что они хорошо приостановлено во время промывания. Механическое вскрытие с помощью пипетки очень помогает отделения клеток в течение коллагеназы шаг и этап фильтрации удаляет скопления клеток. Эти шаги улучшения населения чистоты и выхода.
Покрытие плотность также значительное беспокойство, когда выделения клеток из небольшой орган. Потому что эндотелиальные трубки-образование зависит от плотности клеток 7, мы опирались на 384-луночных культуральных планшетах увеличить наше покрытие плотность. Даже при таком рассмотрении, мы были вынуждены изменить некоторые анализы для размещения низкой плотности клеток (Dyer и Паттерсон, в ProГресс). Таким образом, если количество клеток имеет значение, меньшего размера культуры также может уменьшить эту проблему.
Другим ограничением выделения первичных элементов является специфичность антитела. Даже признанные эндотелиальных-специфического белка, такие как CD31 Иногда это выражается фибробластов 8. Если собранного количества клеток позволяет FAC вместо сортировки, то эндотелиальные клетки и фибробласты могут быть отделены друг от интенсивности флуоресценции. Однако, недавнее сортировка FAC анализ эмбриональных клеток эндотелия требуется целых четыре эмбриона E10.5 производить достаточно эндотелиальных клетках мРНК для добычи, предполагая, что этот метод, хотя и мощный, возможно, не подходит для небольших органов 9.
Таким образом, если FAC сортировки невозможно, другие методы могут быть использованы для улучшения население чистоты. Двухступенчатого процесса отбора, в которой эти клетки были положительно выбран одно антитело, а затем отрицательно SELected неудачи связывать второе антитело, является одним альтернативный подход. Фибробластов-специфический маркер FSP-1 будет одним из кандидатов 10. Кроме того, в культуральную среду могут быть заказаны без L-валин и D-валин можно добавить вместо; фибробластов не способны использовать D-валин и, следовательно, не выживают 11,12.
Несмотря на эти ограничения и проблемы, изучение первичных эмбриональных клеточных популяций позволяет подробно в пробирке анализ процессов развития. Этот метод может быть применен к любой орган или области эмбриона и позволяет типа клеток в сравнении различных эмбриональной стадии. При соответствующем масштабирования, даже очень небольших популяций первичных клеток могут быть получены и проанализированы. Эти анализы обеспечит значительные понимание того, как определенные подмножества клетки ведут себя и меняться со временем.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Мы хотели бы поблагодарить Андреа Портбери за критическое прочтение рукописи, лабораторный микроскоп службы UNC за помощь в заданный промежуток времени, и НИЗ (грант № R01HL061656) для финансовой поддержки.
Материалы
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Timed-pregnant mice | To be dissected at the embryonic stage of interest | ||
| Anti-mouse CD31 | BD Bioscience | 553370 | |
| Rat IgG Dynabeads | Invitrogen | 110-35 | |
| Collagen | BD Bioscience | 354236 | |
| PBS (1x) | |||
| Collagenase, type I | Worthington Biochemical | LS004196 | |
| DMEM | Cellgro | ||
| FBS | Sigma-Aldrich | F2442 | |
| Endothelial cell growth medium | (made in lab as described in notes) | DMEM containing 20% FBS, 5 μM β-mercapt–thanol, 50 μg/ml ECG, and 1x penicillin/streptomycin | |
| β-mercapt–thanol | Sigma-Aldrich | M6250 | |
| ECGS | Biomedical Technologies, Inc. | BT-203 | |
| Penicillin-Streptomycin | Gibco | 15140 | |
| Trypsin-EDTA | Gibco | 25300 | |
| 384-well culture plate | Greiner | T-3037-6 | Plate was prepared with a thin collagen gel, as described in 6; working surface area 10 mm2 |
| Collagen type I | BD | 354236 | Use at a final concentration of 1.5 mg/ml |
| M199, 10x | Invitrogen | 11825-015 | |
| Syto-16 | Invitrogen | S7578 | Used as directed in 13 |
| EQUIPMENT | |||
| Stereoscopic microscope | Nikon | SMZ645 | |
| Cell culture incubator | Thermo | 3110 | |
| DynaMag | Invitrogen | 123-21D | |
| Table-top centrifuge | Thermo | 75002430 | |
Ссылки
- Landecker, H. . Culturing Life: How Cells Became Technologies. , (2007).
- Kan, C. Y., Wen, V. W., et al. Endothelial cell dysfunction and cytoskeletal changes associated with repression of p16(INK4a) during immortalization. Oncogene. , (2012).
- Dyer, L. A., Patterson, C. Development of the endothelium: an emphasis on heterogeneity. Semin. Thromb. Hemost. 36, 227-235 (2010).
- Dong, Q. G., Bernasconi, S., et al. A general strategy for isolation of endothelial cells from murine tissues. Characterization of two endothelial cell lines from the murine lung and subcutaneous sponge implants. Arteriosclerosis, Thrombosis, and Vascular Biology. 17, 1599-1604 (1997).
- van Beijnum, J. R., Rousch, M., Castermans, K., vander Linden, E., Griffioen, A. W. Isolation of endothelial cells from fresh tissues. Nat. Protoc. 3, 1085-1091 (2008).
- Runyan, R. B., Markwald, R. R. Invasion of mesenchyme into three-dimensional collagen gels: a regional and temporal analysis of interaction in embryonic heart tissue. Dev. Biol. 95, 108-114 (1983).
- Arnaoutova, I., Kleinman, H. K. In vitro angiogenesis: endothelial cell tube formation on gelled basement membrane extract. Nat. Protoc. 5, 628-635 (2010).
- Zeisberg, E. M., Potenta, S. E., Sugimoto, H., Zeisberg, M., Kalluri, R. Fibroblasts in kidney fibrosis emerge via endothelial-to-mesenchymal transition. Journal of the American Society of Nephrology : JASN. 19, 2282-2287 (2008).
- Chang, L., Noseda, M. Differentiation of vascular smooth muscle cells from local precursors during embryonic and adult arteriogenesis requires Notch signaling. PNAS. 109, 5993-6998 (2012).
- Fehrenbach, M. L., Cao, G., Williams, J. T., Finklestein, J. M., DeLisser, H. M. Isolation of murine lung endothelial cells. American Journal of Physiology: Lung Cellular and Molecular Physiology. 296, L1095-L1103 (2009).
- Frauli, M., Ludwig, H. Inhibition of fibroblast proliferation in a culture of human endometrial stromal cells using a medium containing D-valine. Archives of Gynecology and Obstetrics. , 241-96 (1987).
- Lazzaro, V. A., Walker, R. J., et al. Inhibition of fibroblast proliferation in L-valine reduced selective media. Research communications in chemical pathology and pharmacology. 75, 39-48 (1992).
- Arima, S., Nishiyama, K., et al. Angiogenic morphogenesis driven by dynamic and heterogeneous collective endothelial cell movement. Development. 138, 4763-4776 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены