Method Article
عزلة الجنينية البطيني الخلايا البطانية
In This Article
Summary
ثقافة الخلية الأولية هي تقنية مفيدة لتحليل فئات معينة من السكان من الخلايا، لا سيما من أجنة الفئران المعدلة وراثيا في مراحل نمو محددة. هنا، يتم تشريح البطينين الجنينية وفصلها، والخرز الأجسام المضادة، مترافق الاعتراف وفصل الخلايا البطانية لمزيد من التحليل.
Abstract
ثقافة الخلية عززت بشكل كبير من قدرتنا على تقييم السكان من الخلايا الفردية في ظل ظروف ثقافة لا تعد ولا تحصى. بينما خطوط الخلايا خلد توفر مزايا كبيرة لسهولة استخدامها، وهذه خطوط الخلايا غير متوفرة لجميع أنواع الخلايا المحتملة. من خلال عزل الخلايا الأولية من منطقة محددة من الفائدة، ولا سيما من الماوس المعدلة وراثيا، ودراسات أكثر دقة لا يمكن أن يؤديها. الأسلوب الذي ينطوي على تشريح الأساسية للجهاز أو الجهاز الجزئي للاهتمام (مثل القلب أو منطقة محددة من القلب) والفصل بين الجهاز إلى الخلايا واحد. ثم يتم تحضين هذه الخلايا مع حبات مغناطيسية مترافق إلى الأجسام المضادة التي تعترف نوع من الخلايا في المصالح. الخلايا من الفائدة يمكن أن ثم تكون معزولة مع استخدام المغناطيس، مع التربسين الحضانة قصيرة الانفصال الخلايا من الخرز. ويمكن بعد هذه الخلايا المعزولة يكون مثقف وتحليلها كما تريد. وقد تم تصميم هذه التقنية في الأصل لجهاز الماوس الكبارو لكن يمكن زيادتها بسهولة إلى أسفل للاستخدام مع أجهزة الجنينية، كما هو موضح هنا. لأن مصلحتنا هي في الأوعية الدموية التاجية النامية، أردنا أن دراسة هذه الفئة من السكان من الخلايا الجنينية خلال مراحل محددة. وهكذا، فإن البروتوكول الأصلي إلى تعديل لتكون متوافقة مع صغر حجم البطينين الجنينية والعائد قدرة منخفضة من الخلايا البطانية في هذه المراحل التنموية. الاستفادة من هذا النهج تحجيم، قمنا بتقييم التاجي الضفيرة إعادة عرض في المعدلة وراثيا الجنينية الخلايا البطانية البطين.
Introduction
ظهور خطوط الخلايا خلد قد أحدثت ثورة بيولوجيا الخلية الأساسية 1. وتستمد خطوط الخلايا المتوفرة حاليا من مجموعة واسعة من الأجهزة وتشمل جميع أنواع الخلايا الرئيسية. ومع ذلك، خطوط الخلايا التي أنشئت لديها بعض القيود. من الواضح أن عملية تخليد تغيير سلوك الخلايا، وتحديدا فيما يتعلق مدى الحياة والانتشار، ولكن يمكن أن تؤثر أيضا على التعبير عن البروتينات غير متوقعة، مثل البروتينات هيكل الخلية 2. وبالإضافة إلى ذلك، على الرغم من أن العديد من خطوط الخلايا المختلفة المتاحة، وهناك تنوع كبير بين حتى نوع خلية واحدة داخل الكائن الحي بأكمله. الخلايا البطانية على وجه الخصوص تظهر السلوكيات المتنوعة سواء كانت تقوم على خط الشرايين أو الأوردة وأي نوع من تدفق موجود في السفينة 3. حتى أكثر إلحاحا من منظور إنمائي، ومع ذلك، هو أن الغالبية العظمى من خطوط الخلايا المتاحة مستمدة من أنسجة البالغين (انظر، على سبيل المثال خميسوقال انه جمع متاحة عبر آي تي سي سي). هذه خطوط الخلايا الكبار الأرجح لا ألخص الطبيعة الديناميكية لسلائفها الجنينية. ويتغير بسرعة الزمانية المكانية أنماط التعبير الجيني لوحظت خلال تطوير تشير أيضا إلى أن خلية البطانية من جهاز واحد في كل مرحلة تنموية معينة قد لا تتصرف بنفس الطريقة باعتبارها الخلية البطانية من نفس الجهاز في مرحلة تنموية مختلفة.
كبديل لاستخدام المتاحة تجاريا خطوط الخلايا خلده، الخلايا الأولية يمكن أن تكون معزولة عن الأنسجة محددة من الفائدة. من بين مزايا هذه التقنية، وهذه الخلايا الأولية يمكن أن تكون معزولة عن جهاز معين أو حتى جزء من الجهاز في أي مرحلة تنموية محددة. وعلاوة على ذلك، فإن هذه الخلايا الأولية يمكن أن تكون معزولة عن مجموعة واسعة من الحيوانات المعدلة وراثيا المتوفرة، مما يتيح دراسة في المختبر من خروج المغلوب الجينات والضربة القاضية في حين تجنب مشاكل أخرى مثل كفاءة ترنسفكأيشن للفي. ليس من المستغرب، وكثيروقد نشرت تقنيات بالتفصيل كيفية عزل أنواع معينة من الخلايا 4،5. بشكل عام، هذه التقنيات تشمل جمع المنطقة من الفائدة، وعدم الربط بين الخلايا، ووضع علامات على نوع من الخلايا محددة من الفائدة، وعزل تلك الخلايا لمزيد من التحليل.
لدراسة السكان الجنينية المبكرة من الخلايا البطانية التاجي، ان قلصنا تقنية 4 التي تم نشرها مسبقا للاستخدام مع جهاز أصغر. مع هذا الإجراء تحجيم، يمكننا عزل الخلايا البطانية التاجية من القلب الجنينية في مراحل جنينية محددة. ويمكن بعد هذه الخلايا يمكن استخدامها في المقايسات البطانية التقليدية، مثل تحليلات الهجرة. حتى أوائل خطوط الخلايا الجنينية تصبح أكثر انتشارا، والعمل مع الخلايا الأولية هي تقنية لا تقدر بثمن.
Protocol
1. إعداد الخرز الضد مترافق
- يوم واحد قبل تشريح، والجمع بين الأضداد من خيار مع Dynabeads المناسبة (مثل الفئران Dynabeads مفتش للجسم التي أثيرت في الفئران، 4 × 10 8 حبات / مل) في تعليمات الشركة الصانعة. لBD الفئران مكافحة CD31 الأجسام المضادة (0.5 ميكروغرام / ميكرولتر، وتستخدم لعزل الخلايا البطانية)، يتم إضافة 3 ميكرولتر الضد لكل ميكرولتر 25 حبات، لتركيز النهائي من 1.5 ميكروغرام الأجسام المضادة لمكافحة CD31 و 1 × 10 7 حبات / 25 ميكرولتر العازلة.
- احتضان حبات والأضداد بين عشية وضحاها في 4 درجات مئوية.
2. إعداد لوحة الكولاجين
- خلايا معزولة تشكيل الأنابيب بسرعة أكبر عندما نمت على هلام الكولاجين بدلا من مجرد لوحة الكولاجين المغلفة. لذلك، مصنوعة المواد الهلامية الكولاجين في الليلة التي سبقت تشريح، كما هو موضح في 6. على الجليد في نسيج الثقافة هود، والجمع بين الكواشف التالية (ما يكفي لمدة 19 بئرا): 206.4 ميكرولتر H العقيمة <الفرعية> 2 O، 140.4 ميكرولتر نوع الكولاجين الأول (4.08 ملغ / مل)، 38.4 ميكرولتر 10X M199، و 1.15 ميكرولتر 5 M هيدروكسيد الصوديوم.
- ماصة 20 ميكرولتر من هذا الجل الكولاجين في الآبار من 384 جيدا نسيج لوحة الثقافة. وضع لوحة في 37 درجة مئوية نسيج الثقافة الحاضنة لمدة 30 دقيقة.
- إضافة 80 ميكرولتر DMEM إلى كل بئر واحتضان لمدة 15 دقيقة عند 37 درجة مئوية. إزالة مستنبت وكرر مرتين أكثر من ذلك.
- بعد شطف النهائي، إضافة 80 ميكرولتر 10٪ FBS / DMEM إلى كل بئر واحتضان بين عشية وضحاها في 37 درجة مئوية. إزالة مستنبت قبل إضافة الخلايا المعزولة.
3. المكوس وهضم القلب
- الموت ببطء الماوس توقيت الحوامل في اليوم الجنينية المطلوب باستخدام تقنية القتل الرحيم المعتمدة. تمت الموافقة على جميع التجارب من قبل لجنة استخدام المؤسسات ورعاية الحيوان في جامعة ولاية كارولينا الشمالية في تشابل هيل.
- مع الماوس في موقف ضعيف، رش تحرري الجانب البطني من الأنثى مع الايثانول 70٪ قبلتشريح. باستخدام ملقط لرفع الجلد أسفل البطن والعضلات بعيدا عن الأعضاء الداخلية، وقطع فتح تجويف الأنثى في أسفل البطن لتصور أعضائه الداخلية.
- عقد عنق الرحم مع ملقط، وقطع بعناية الذيلية إلى ملقط والبدء في رفع قرن الرحم من تجويف البطن. في حين رفع قرن الرحم، وقطع بعيدا أي النسيج الضام الذي يحمل قرن في المكان. لإنهاء استئصال قرن الرحم، وقطع تقاطع قرن الرحم مع قناة البيض لتحرير قرن الرحم.
- ضع قرن الرحم في طبق بتري تحتوي الباردة 1X الفوسفات مخزنة المالحة (PBS) وشطف حسب الحاجة. خفض فتح قرن الرحم عن طريق خط الوسط لفضح الحويصلات الجنينية المرفقة.
- خفض فتح الكيس الجنيني عند تقاطع المشيمة والجنين لتجنب قصد قطع الجنين واسترجاع الجنين. وضع الجنين في طبق بيتري الثانية مع برنامج تلفزيوني الباردة. العودة طبق بيتري مع قرن الرحم إلى جليد.
- Decapitate الجنين لتحسين الوصول إلى جدار الصدر. إذا التنميط الجيني هو ضروري، وقطع الذيل لإزالته وحفظ في أنبوب إيبندورف وضعت على الجليد.
- مع الجنين على ظهرها، وقطع فتح جدار الصدر لتصور القلب والرئتين. لتجنب قطع القلب، وجعل قطع عمودي على طول الجانب من القفص الصدري، بالقرب من forelimb، تليها قطع أفقي عبر الجزء السفلي من الأضلاع، ثم، وسحب بلطف جدار الصدر صعودا وللخروج من الطريق. من خلال ما يقرب من 13.5 يوم الجنينية، جدار الصدر هو شفاف، والمساعدة في التصور.
- رفع بعناية القلب باستخدام ملقط وقطع الأوعية أدناه. ثم، وقطع فوق سفن كبيرة للافراج عن القلب. إذا لم يتم قطع الأوعية الرئوية، قد تتم إزالة الرئتين مع القلب. وهكذا، وإزالة أنسجة غريبة، مثل الرئتين، إذا لزم الأمر.
- فصل وتجاهل السفن الأذينين والبطينين كبيرة من. باستخدام مقص، اللحم المفروم البطينين إلى قطع صغيرة (حوالي 1 ملم 3 </ سوب>) ووضعت في ما يقرب من 500 ميكرولتر كولاجيناز (1 ملغ / مل في برنامج تلفزيوني العقيمة). الاحتفاظ بعينات على الجليد حتى تم مفروم جميع البطينين ووضعها في كولاجيناز.
- كرر الخطوات السابقة حتى يتم رفعه البطينين من جميع الأجنة، وجمع كل قلب في أنبوب إيبندورف منفصلة. إذا كان كل الأجنة لديها نفس التركيب الوراثي، قد يتم تجميع قلوب في أنبوب إيبندورف واحد. عدد العينات معالجتها في وقت واحد قد تكون محدودة استنادا إلى مغناطيس تستخدم لعزل، وDynaMag (123-21D) تستخدم هنا يحمل بحد أقصى 16 أنابيب إيبندورف.
- وضع البطينين المفروم عند 37 درجة مئوية مع هزاز لمدة 45 دقيقة. كل 15 دقيقة، وإزالة بلطف العينات وماصة صعودا وهبوطا لفصل ميكانيكيا الخلايا.
4. عزل الخلايا البطانية
- تمرير حل البطين للكولاجيناز خلال 70 ميكرون فلتر لإزالة كتل المتبقية من الخلايا.
- الطرد المركزي الخلايا في 400 x ج لمدة 10 دقيقة. نبذطاف، مع استبدال ما يقرب من 200 ميكرولتر FBS 10٪ في DMEM، وماصة صعودا وهبوطا لفصل الخلايا.
- كرر الخطوة السابقة مرة واحدة. الطرد المركزي الخلايا في 400 x ج لمدة 10 دقيقة بعد الثانية 10٪ FBS / DMEM غسل. resuspend الخلايا في 50 ميكرولتر 10٪ FBS / DMEM.
- أثناء خطوة الطرد المركزي النهائية، وإعداد الخرز.
- وضع أنبوب إيبندورف التي تحتوي على الأجسام المضادة والخرز على مغناطيس لمدة 1 دقيقة.
- مع الأنبوب في مكان على المغناطيس، وإزالة طاف. إزالة أنبوب من المغناطيس وإضافة ما يقرب من 100 ميكرولتر 10٪ FBS / DMEM.
- وضع أنبوب على مغناطيس لمدة 1 دقيقة. إزالة طاف، ويغسل مرة أخرى مع 10٪ FBS / DMEM. تكرار لما مجموعه 3 يغسل.
- بعد غسل النهائي، resuspend والخرز الأجسام المضادة، مترافق في 10٪ FBS / DMEM (5 ميكرولتر لكل عينة).
- إلى كل عينة الخلية، إضافة 5 ميكرولتر من الخرز الأجسام المضادة، مترافق. ضع تعليق حبة خلية في 4 درجات مئوية مع هزاز FOR 30 دقيقة.
- في تدفق الصفحي هود، ووضع أنابيب إيبندورف تحتوي على خلايا والخرز الأجسام المضادة، مترافق على مغناطيس لمدة 1 دقيقة. إزالة طاف، وإزالة أنابيب من المغناطيس، ويغسل مع ما يقرب من 100 ميكرولتر 10٪ FBS / DMEM. كرر لمدة 5 يغسل.
- بعد غسل الماضي، وضع أنابيب على مغناطيس لمدة 1 دقيقة، وإزالة طاف، وإزالة أنابيب من المغناطيس. إضافة ما يقرب من 100 DMEM ميكرولتر.
- وضع أنابيب على مغناطيس لمدة 1 دقيقة، وإزالة طاف، وإزالة أنابيب من المغناطيس. prewarmed إضافة 100-200 ميكرولتر 0.25٪ التربسين EDTA-. احتضان العينات عند 37 درجة مئوية و 5٪ CO 2 لمدة 5 دقائق.
- وضع أنابيب على مغناطيس لمدة 2 دقيقة. نقل بعناية طاف تحتوي الخلية الى أنابيب إيبندورف الطازجة. أجهزة الطرد المركزي لمدة 5 دقائق في 400 ز س.
- إزالة طاف. resuspend الخلايا في 80-100 ميكرولتر متوسطة النمو وطبق في 96 - 384 أو جيدا طبق ثقافة المعالجة، اعتمادا على العائد المتوقع(حوالي 450-600 الخلايا من البطينين من E14.5-E16.5 الأجنة). لخلايا بطانة الأوعية الدموية، واستخدام البطانية نمو الثقافة المتوسطة (المعرف أدناه).
النتائج
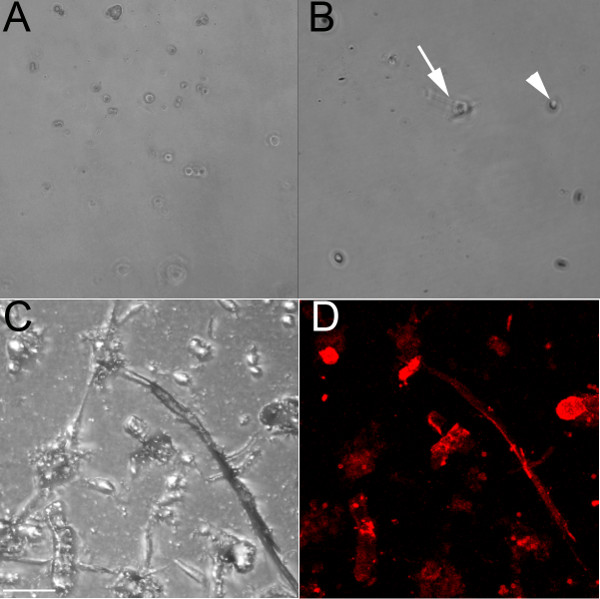
استخدام أجسام مضادة محددة البطانية التي تعترف CD31، تم عزل الخلايا البطانية من البطينين من الجنينية (E) 13.5 (الشكل 1A) و 18.5 (أرقام 1B-1D) الأجنة. عندما نمت على طبق ثقافة غير المعالجة، تبقى هذه الخلايا تقريب وسوف تشكل نمطا حصوه إذا قرب متموجة (الشكل 1A). كما تم استخدام تمييع الكولاجين لمعطف الآبار، وبينما الخلايا البطانية والتمسك به (الشكل 1B)، فإنها تشكل أقل من السلاسل عندما مطلي على هلام الكولاجين (أرقام 1C و1D). الخلايا البطانية نمت في تحتوي على هلام جيدا الكولاجين (أرقام 1C و1D) شكل التفاعلات خلية خلية وسلاسل النموذج الذي يبدأ في التفرع عندما نمت على الكولاجين، وهذه العملية تحدث بشكل أسرع عندما نمت على هلام الكولاجين مقارنة مع الكولاجين المغلفة لوحة. تسمية هذه السلاسل البطانية بإيجابية مع علامة البطانية ISO-كتين ( 1D الشكل). الخلايا المعزولة البقاء على قيد الحياة حتى 1 أسبوع في الثقافة ولكن أثبتت المقاومة للtrypsinization (حتى بعد 1 ساعة عند 37 درجة مئوية)، وبالتالي، فهي الأنسب لمحطة التجارب.
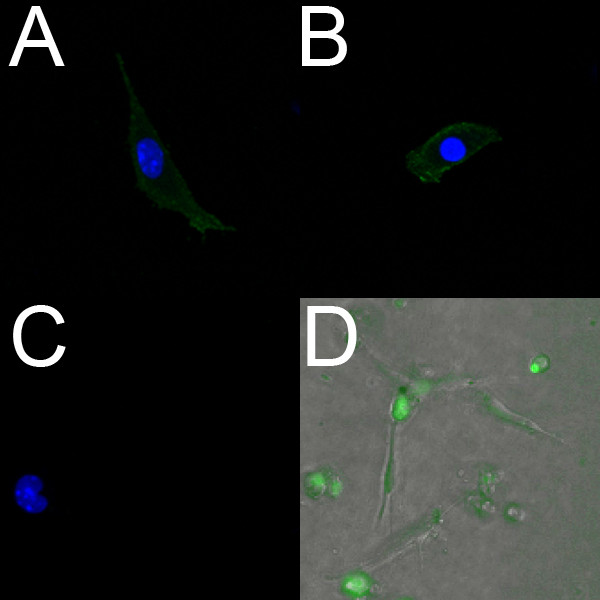
الخلايا البطانية المعزولة من E18.5 البطينين تسمية بإيجابية مع PECAM (الشكل 2A) وFlk1 (الشكل 2B). علاوة على ذلك، تعيش الخلايا البطانية المعزولة يمكن أن توصف باستخدام صبغة الفلورسنت البطانية محددة Syto-16. الشكل 2D يبين الخلايا البطانية التي تم عزلها من البطينين من E14.5 الجنين والمسمى مع Syto-16.
الشكل 1. الخلايا البطانية المعزولة من البطينين الماوس الجنينية شكل سلاسل عندما نمت على هلام الكولاجين. (A) Brightfield صورة 10X من العيش عزل الخلايا البطانية البطين من E13.5 القلب زrown على طبق ثقافة غير المعالجة، وحتى بعد 48 ساعة، تبقى خلايا مدورة (B) Brightfield صورة 10X من ثابت عزل الخلايا البطانية البطين من القلب E18.5 نمت على طبق الكولاجين المغلفة؛. بعد 24 ساعة، وقد بدأت بعض الخلايا التمطيط (السهم)، ولكن معظمها لا تزال تقريب (رأس السهم). (C، D) متحد البؤر الصور الثابتة من عزل الخلايا البطانية البطين من القلب E18.5 نمت على هلام الكولاجين، كما هو موضح في brightfield (C) والمسمى مع ISO -كتين (الحمراء). السهام تشير بعض الخلايا إيجابية كتين. أشرطة النطاق في CD = 50 ميكرون.
الشكل 2. الخلايا البطانية المعزولة من البطينين الماوس الجنينية تسمية إيجابيا لعلامات البطانية. (AC) الصور متحد البؤر (40X) من ثابت عزل الخلايا البطانية البطين من القلب E18.5 نمت علىطبق الكولاجين المغلفة. تسمية هذه الخلايا بشكل إيجابي لPECAM (A) وFLK-1 (B)، والسيطرة السلبية (C) لا يظهر أي مضان. في AC، وصفت نوى مع دابي (الأزرق). (D) نيون تراكب (10X) من حي عزل الخلايا البطانية البطين من القلب E14.5 نمت على هلام الكولاجين. وحضنت الخلايا مع علامة البطانية لايف Syto-16 (الأخضر)، ولوحظ هجرة باستخدام المجهر مرور الزمن.
Discussion
العمل مع الخلايا الجنينية الأولية يسمح التجارب رواية لمعالجة في المختبر الخطوات الحاسمة للتنمية. ومع ذلك، فإن إجراء العزل ليست تافهة. وتشمل الخطوات الحاسمة لعزل أي نوع من الخلايا ضمان أن يتم فصل الخلايا بشكل جيد على الهضم كولاجيناز ثم أنهم علقت جيدا خلال خطوات الغسيل. تشريح الميكانيكية من قبل pipetting يساعد كثيرا فصل الخلايا أثناء الخطوة كولاجيناز، والخطوة تصفية يزيل كتل من الخلايا. هذه الخطوات تحسين نقاء السكان والإنتاج.
كثافة الطلاء هو أيضا مصدر قلق كبير عندما عزل الخلايا من جهاز صغير. لأن البطانية أنبوب تشكيل يعتمد على كثافة الخلية 7، اعتمدنا على 384 جيدا لوحات زراعة الأنسجة لزيادة كثافة الطلاء لدينا. حتى مع هذا الاعتبار، كان لدينا لتعديل بعض التحليلات لاستيعاب كثافة الخلية السفلى (داير وباترسون، في بروغريس). وبالتالي، إذا كان عدد الخلايا هو مصدر قلق، ثقافة صغيرة الحجم بشكل جيد قد يقلل من المشكلة.
قيود أخرى لعزل الخلايا الأولية هو خصوصية الأضداد. وأعرب أحيانا حتى بروتين غشائي محددة معترف بها مثل CD31 بواسطة الخلايا الليفية 8. إذا كان عدد الخلايا التي تحصد يسمح لFAC الفرز بدلا من ذلك، ثم الخلايا البطانية والخلايا الليفية يمكن أن تكون مفصولة كثافة مضان. ومع ذلك، يلزم إجراء تحليل الفرز FAC الأخيرة من الخلايا البطانية الجنينية أربعة أجنة E10.5 كامل لإنتاج ما يكفي من الخلايا البطانية لاستخراج مرنا، مما يوحي بأن هذه التقنية، على الرغم من قوة، قد لا يكون مناسبا لأجهزة أصغر 9.
وهكذا، إذا FAC الفرز غير مجدية، ويمكن استخدام تقنيات أخرى لتحسين نقاء السكان. A عملية الاختيار على مرحلتين، حيث يتم تحديد الخلايا بشكل إيجابي عن طريق الأجسام المضادة واحدة ثم SEL سلباected عن عدم ربط الأجسام المضادة الثاني، هو نهج بديل واحد. ان علامة الليفية محددة FSP-1 تكون واحدة خاصة مرشح 10. بدلا من ذلك، يمكن أن يؤمر ثقافة المتوسط دون L-حمض أميني أساسي، ويمكن أن تضاف D-حمض أميني أساسي بدلا من ذلك؛ الليفية غير قادرين على الاستفادة من D-حمض أميني أساسي، وبالتالي لا البقاء على قيد الحياة 11،12.
على الرغم من هذه القيود والمخاوف، ودراسة الابتدائية السكان الخلية الجنينية يسمح لمفصل في تحليل المختبر من العمليات التنموية. ويمكن تطبيق هذه التقنية إلى أي جهاز أو المنطقة من الجنين ويسمح نوع من الخلايا يمكن مقارنتها عبر مراحل جنينية مختلفة. مع التحجيم المناسب، حتى السكان صغيرة جدا من الخلايا الأولية ويمكن الحصول على وتحليلها. وهذه التحليلات تعطي تفسيرا واضحا في كيفية مجموعات فرعية معينة من الخلايا تتصرف وتتغير بمرور الوقت.
Disclosures
يعلن الكتاب أنه ليس لديهم مصالح مالية المتنافسة.
Acknowledgements
ونود أن نشكر اندريا بورتبري لقراءة نقدية للمخطوطة، ومختبر خدمة مجهر UNC للحصول على المساعدة مع الوقت الفاصل بين التصوير، والمعاهد الوطنية للصحة (منحة # R01HL061656) لدعم التمويل.
Materials
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Timed-pregnant mice | To be dissected at the embryonic stage of interest | ||
| Anti-mouse CD31 | BD Bioscience | 553370 | |
| Rat IgG Dynabeads | Invitrogen | 110-35 | |
| Collagen | BD Bioscience | 354236 | |
| PBS (1x) | |||
| Collagenase, type I | Worthington Biochemical | LS004196 | |
| DMEM | Cellgro | ||
| FBS | Sigma-Aldrich | F2442 | |
| Endothelial cell growth medium | (made in lab as described in notes) | DMEM containing 20% FBS, 5 μM β-mercapt–thanol, 50 μg/ml ECG, and 1x penicillin/streptomycin | |
| β-mercapt–thanol | Sigma-Aldrich | M6250 | |
| ECGS | Biomedical Technologies, Inc. | BT-203 | |
| Penicillin-Streptomycin | Gibco | 15140 | |
| Trypsin-EDTA | Gibco | 25300 | |
| 384-well culture plate | Greiner | T-3037-6 | Plate was prepared with a thin collagen gel, as described in 6; working surface area 10 mm2 |
| Collagen type I | BD | 354236 | Use at a final concentration of 1.5 mg/ml |
| M199, 10x | Invitrogen | 11825-015 | |
| Syto-16 | Invitrogen | S7578 | Used as directed in 13 |
| EQUIPMENT | |||
| Stereoscopic microscope | Nikon | SMZ645 | |
| Cell culture incubator | Thermo | 3110 | |
| DynaMag | Invitrogen | 123-21D | |
| Table-top centrifuge | Thermo | 75002430 | |
References
- Landecker, H. Culturing Life: How Cells Became Technologies. , Presidents and Fellows of Harvard College. (2007).
- Kan, C. Y., Wen, V. W., et al. Endothelial cell dysfunction and cytoskeletal changes associated with repression of p16(INK4a) during immortalization. Oncogene. , (2012).
- Dyer, L. A., Patterson, C. Development of the endothelium: an emphasis on heterogeneity. Semin. Thromb. Hemost. 36, 227-235 (2010).
- Dong, Q. G., Bernasconi, S., et al. A general strategy for isolation of endothelial cells from murine tissues. Characterization of two endothelial cell lines from the murine lung and subcutaneous sponge implants. Arteriosclerosis, Thrombosis, and Vascular Biology. 17, 1599-1604 (1997).
- van Beijnum, J. R., Rousch, M., Castermans, K., vander Linden, E., Griffioen, A. W. Isolation of endothelial cells from fresh tissues. Nat. Protoc. 3, 1085-1091 (2008).
- Runyan, R. B., Markwald, R. R. Invasion of mesenchyme into three-dimensional collagen gels: a regional and temporal analysis of interaction in embryonic heart tissue. Dev. Biol. 95, 108-114 (1983).
- Arnaoutova, I., Kleinman, H. K. In vitro angiogenesis: endothelial cell tube formation on gelled basement membrane extract. Nat. Protoc. 5, 628-635 (2010).
- Zeisberg, E. M., Potenta, S. E., Sugimoto, H., Zeisberg, M., Kalluri, R. Fibroblasts in kidney fibrosis emerge via endothelial-to-mesenchymal transition. Journal of the American Society of Nephrology : JASN. 19, 2282-2287 (2008).
- Chang, L., Noseda, M. Differentiation of vascular smooth muscle cells from local precursors during embryonic and adult arteriogenesis requires Notch signaling. PNAS. 109, 5993-6998 (2012).
- Fehrenbach, M. L., Cao, G., Williams, J. T., Finklestein, J. M., DeLisser, H. M. Isolation of murine lung endothelial cells. American Journal of Physiology: Lung Cellular and Molecular Physiology. 296, L1095-L1103 (2009).
- Frauli, M., Ludwig, H. Inhibition of fibroblast proliferation in a culture of human endometrial stromal cells using a medium containing D-valine. Archives of Gynecology and Obstetrics. , 241-96 (1987).
- Lazzaro, V. A., Walker, R. J., et al. Inhibition of fibroblast proliferation in L-valine reduced selective media. Research communications in chemical pathology and pharmacology. 75, 39-48 (1992).
- Arima, S., Nishiyama, K., et al. Angiogenic morphogenesis driven by dynamic and heterogeneous collective endothelial cell movement. Development. 138, 4763-4776 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved