Method Article
בידוד של תאי האנדותל חדרית עובריים
In This Article
Summary
תרבית תאים העיקרית היא טכניקה שימושית לניתוח אוכלוסיות מסוימות של תאים, במיוחד מעוברי עכבר מהונדסים בשלבי התפתחות ספציפיים. בזאת, חדרי לב עובריים הם גזורים וניתקו, וחרוזים נוגדנים מצומדות לזהות ולהפריד את תאי האנדותל לניתוח נוסף.
Abstract
תרבית תאים שיפרה באופן משמעותי את היכולת שלנו להעריך אוכלוסיות בודדות של תאים בתנאי התרבות עצום. בעוד שורות תאים הנציחו מציעות יתרונות משמעותיים לנוחות השימוש שלהם, שורות תאים אלה אינן זמינות לכל סוגי התאים הפוטנציאליים. על ידי בידוד תאים ראשוניים מאזור מסוים של עניין, במיוחד מעכבר מהונדס, ניתן לבצע מחקרים מורכבים יותר. הטכניקה הבסיסית כרוכה לנתח איבר או איברים חלקיים של עניין (למשל לב או באזור מסוים של הלב) וdissociating האיברים לתאים בודדים. תאים אלה מודגרת מכן עם חרוזים מגנטיים מצומדות לנוגדן שמזהה את סוג התא של עניין. התאים של עניין אז יכולים להיות מבודדים עם השימוש במגנט, עם דגירה קצרה טריפסין dissociating תאים מאת החרוזים. אז יכולים להיות מתורבתים תאים מבודדים אלה וניתח המועדפים. טכניקה זו תוכננה במקור עבור איבר עכבר בוגראבל ים וניתן לשנות בקלות את לשימוש עם איברים עובריים, כפי שמודגם במסמך זה. כי האינטרס שלנו הוא בכלי הדם כליליים פיתוח, אנחנו רוצים ללמוד אוכלוסייה של תאים זה בשלבים עובריים ספציפיים. לפיכך, פרוטוקול המקורי היה צריך להיות שונה כדי להיות תואם עם הגודל הקטן של החדרים העובריים והתשואה הפוטנציאלית הנמוכה של תאי האנדותל בשלבי התפתחותיים אלה. ניצול גישה מוקטנת זה, יש לנו להעריך שיפוץ מקלעת כלילית בתאי אנדותל חדריות עובריים מהונדסים.
Introduction
כניסתו של שורות תאים הנציחו יש מהפכה ביולוגיה של תא בסיסית 1. שורות התאים הקיימים כיום נגזרות ממגוון רחב של איברים ולהקיף את כל סוגי התאים העיקריים. עם זאת, יש לי שורות תאים הוקמו כמה מגבלות. תהליך ההנצחה ברור שמשנה את אופן הפעולה של התאים, במיוחד ביחס לתוחלת חיים והתפשטות, אלא גם יכול להשפיע על הביטוי של חלבונים בלתי צפויים, כגון חלבוני cytoskeletal 2. בנוסף, למרות ששורות תאים רבות ושונות זמינות, יש גיוון משמעותי בקרב אפילו סוג תא בודד בתוך כל אורגניזם. תאי אנדותל בהתנהגויות מגוונות מופע מסוימות המבוססים על אם הם קו עורקים או ורידים ואיזה סוג של זרימה הוא הווה בכלי 3. ועוד יותר דחוף מבחינה התפתחותית, לעומת זאת, הוא שהרוב המכריע של שורות התאים הזמינות נגזרים מרקמות בוגרת (ראה, למשל tהוא אוסף זמין דרך ATCC). שורות תאי בוגרים אלה עשויים לא לשחזר את האופי הדינמי של המבשרים העובריים שלהם. את דפוסי ביטוי גנים spatiotemporal המשתנים במהירות שנצפו במהלך פיתוח גם מצביעים על כך שתא האנדותל מאיבר אחד בכל שלב התפתחותי נתון לא יכול להתנהג באותה הצורה כמו תא האנדותל מאותו איבר בשלב התפתחותי שונה.
כחלופה לשימוש בשורות תאים הנציחו זמינות מסחרי, ניתן לבודד תאים ראשוניים מהרקמה הספציפית של עניין. בין היתרונות של טכניקה זו, ניתן לבודד תאים הראשוניים אלה מאיבר מסוים או אפילו חלק מאיבר בכל שלב התפתחותי מסוים. יתר על כן, ניתן לבודד תאים הראשוניים אלה ממגוון הרחב של בעלי חיים מהונדסים זמינים, המאפשרים במחקר במבחנה של נוקאאוט הגן ודפיקה ב, תוך הימנעות בעיות אחרות כגון יעילות transfection. באופן לא מפתיע, רביםטכניקות כבר פורסם מפרטות כיצד לבודד סוגי תאים מסוימים 4,5. באופן כללי, טכניקות אלה כרוכים באיסוף באזור של עניין, dissociating תאים, תיוג סוג התא המסוים של עניין, ומבודד את התאים הללו לניתוח נוסף.
ללמוד אוכלוסייה עוברית מוקדמת של תאי האנדותל הכליליים, אנו scaled למטה 4 טכניקה שפורסמו בעבר לשימוש עם איבר קטן יותר. עם הליך מוקטן זה, אנו יכולים לבודד את תאי האנדותל הכליליים מהלב העוברי בשלבים עובריים ספציפיים. תאים אלה לאחר מכן ניתן להשתמש במבחני אנדותל מסורתיים, כגון ניתוחי הגירה. עד שורות תאים עובריים מוקדמות הפכו נפוצות יותר, עבודה עם התאים הראשוניים היא טכניקה לא יסולא בפז.
Protocol
1. הכן את חרוזים נוגדנים מצומדות
- יום אחד לפני לנתיחה, לשלב את הנוגדן של בחירה עם Dynabeads המתאים (כגון חולדת Dynabeads IgG לנוגדנים גדלו בחולדה, 4 x 10 8 חרוזים / מ"ל) להוראות היצרן. לנוגדן אנטי CD31 חולדת BD (0.5 מיקרוגרם / μl, המשמש לבודד תאי אנדותל), 3 נוגדן μl מתווסף לכל 25 חרוזים μl, לריכוז סופי של 1.5 מיקרוגרם נוגדן אנטי-CD31 ו1 x 10 7 / חרוזים 25 חיץ μl.
- דגירה חרוזים ונוגדני לילה בשעה 4 ° C.
2. הכנת פלייט קולגן
- תאים מבודדים יוצרים צינוריות במהירות רבות יותר כאשר גדלו על ג'ל קולגן בניגוד לסתם צלחת קולגן מצופה. לכן, ג'ל קולגן נעשים בלילה שלפני הניתוח, כפי שתואר ב6. על קרח במכסת מנוע בתרבית רקמה, לשלב את ריאגנטים הבאים (מספיק 19 בארות): 206.4 H סטרילי μl <תת> 2 O, 140.4 סוג קולגן μl אני (4.08 מ"ג / מ"ל), 38.4 M199 10x μl, ו1.15 μl 5 M NaOH.
- פיפטה μl 20 של ג'ל קולגן זה לתוך הבארות של צלחת תרבית רקמת 384 גם. מניחים את הצלחת 37 ° C תרבות רקמות חממה למשך 30 דקות.
- הוסף 80 DMEM μl לכל היטב דגירה במשך 15 דקות ב 37 ° C. הסר את התרבות בינונית ולחזור פעמיים נוספות.
- לאחר השטיפה הסופית, להוסיף 80% 10 μl FBS / DMEM זה היטב דגירה הלילה בשעה 37 ° C. הסר את התרבות בינונית לפני הוספת התאים הבודדים.
3. בלו ולעכל לב
- להרדים את העכבר מתוזמן בהריון ביום העוברי הרצוי באמצעות טכניקת המתת חסד מאושרת. כל הניסויים אושרו על ידי הטיפול בבעלי החיים המוסדיים ועדת שימוש באוניברסיטת צפון קרוליינה בצ'אפל היל.
- עם העכבר במצב שכיבה, בנדיבות לרסס את צד הגחון של הנקבה עם אתנול 70% לפנינתיחה. בעזרת מלקחיים כדי להרים את עור הבטן התחתון ושריר מהאיברים הפנימיים, לחתוך לפתוח חלל הבטן התחתונה של הנקבה כדי להמחיש את האיברים הפנימיים.
- מחזיק את צוואר הרחם עם מלקחיים, לחתוך בזהירות הזנב למלקחיים ולהתחיל להרים את קרן הרחם מחלל הבטן. תוך הרמת קרן הרחם, חתך את כל רקמת חיבור שמחזיקה את הקרן במקום. כדי לסיים מוציא את קרן הרחם, חתך את הצומת של קרן הרחם עם oviduct לשחרר את קרן הרחם.
- הנח את קרן הרחם בצלחת פטרי שמכילה תמיסת מלח קר 1x פוספט שנאגרו (PBS) ולשטוף במידת הצורך. גזור לפתוח קרן הרחם דרך קו האמצע לחשוף את שקי העובריים המצורפים.
- גזור לפתוח השק עוברי בצומת של השליה ואת העובר, כדי למנוע טעות חיתוך העובר ולאחזר עובר. הנח את העובר בצלחת פטרי שנייה עם PBS הקר. להחזיר את צלחת פטרי עם קרן הרחם לקרח.
- Decapitate העובר כדי לשפר את הגישה לקיר החזה. אם genotyping הוא צורך, לחתוך את הזנב כדי להסיר אותו ולשמור בצינור Eppendorf מונח על קרח.
- עם העובר על הגב שלה, לחתוך לפתוח את דופן בית החזה כדי להמחיש את הלב וריאות. כדי להימנע מחיתוך הלב, לעשות חתך אנכי בצד של כלוב הצלעות, ליד forelimb, ואחריו חתך אופקי לרוחב החלק התחתון של הצלעות, ולאחר מכן משוך בעדינות את בית החזה ואת הדרך. דרך כ יום עוברי 13.5, קיר החזה הוא שקוף, בסיוע בהדמיה.
- רם בזהירות את הלב באמצעות מלקחיים ולחתוך את כלי בהמשך. לאחר מכן, לחתוך מעל כלי הגדול כדי לשחרר את הלב. אם כלי ריאתי לא נחתכים, הריאות ניתן להסיר עם הלב. לפיכך, להסיר רקמות זרות, כמו הריאות, במידת צורך.
- להפריד ולהשליך את כלי הפרוזדורים וגדולים מהחדרים. בעזרת מספריים, ברר את החדרים לחתיכות קטנות (כ 1 מ"מ 3 </ Sup>) ומקום בכ -500 collagenase μl (1 מ"ג / מ"ל בPBS סטרילי). שמור דגימות על קרח עד שכל חדרי לב טחון והניח בcollagenase.
- חזרו על השלבים הקודמים עד שכבר נכרת מכל העוברים את החדרים, איסוף כל לב בצינור Eppendorf נפרד. אם יש לי כל העוברים באותו גנוטיפ, לב עשוי להיות נקווה בצינור Eppendorf אחת. מספר הדגימות שעובדו בכל פעם אחת עלול להיות מוגבל המבוסס על המגנט משמש לבידוד; DynaMag (123-21D) משמש כאן מחזיק מקסימום של 16 צינורות Eppendorf.
- מקם את החדרים הטחונים ב 37 ° C עם הנדנדה למשך 45 דקות. בכל 15 דקות, להסיר בעדינות את הדגימות ו פיפטה מעלה ומטה כדי לנתק מכאני את התאים.
4. בידוד תאי האנדותל
- לעבור את פתרון חדר-collagenase דרך 70 מיקרומטר סינון כדי להסיר גושים הנותרים של תאים.
- צנטריפוגה התאים ב XG 400 במשך 10 דקות. להשליךsupernatant, להחליף עם כ 200 FBS 10% μl בDMEM, ופיפטה מעלה ומטה כדי לנתק את התאים.
- חזור על השלב הקודם ועונה אחת. צנטריפוגה התאים ב XG 400 במשך 10 דקות אחרי השני 10% לשטוף FBS / DMEM. Resuspend התאים 50 FBS 10% / DMEM μl.
- במהלך השלב הסופי צנטריפוגה, להכין את החרוזים.
- מניחים את צינור Eppendorf המכיל נוגדנים וחרוזים על מגנט דקות 1.
- עם הצינור במקום על המגנט, להסיר את supernatant. הסר את הצינור מהמגנט ולהוסיף כ 100 FBS 10% / DMEM μl.
- מניחים את הצינור על מגנט דקות 1. הסר את supernatant, ולשטוף שוב עם FBS 10% / DMEM. חזור על פעולה עבור סכום כולל של 3 שוטף.
- לאחר לשטוף הסופי, resuspend את חרוזי נוגדנים מצומדות בFBS 10% / DMEM (5 μl לדגימה).
- לכל דגימה של תאים, מוסיף 5 μl של חרוזי נוגדנים מצומדות. מניחים את השעיות חרוז הסלולריים על 4 מעלות צלזיוס עם נדנדה עבורדקות R 30.
- במכסת מנוע זרימה למינרית, למקם את צינורות Eppendorf המכילים תאים וחרוזים נוגדנים מצומדות על מגנט דקות 1. הסר את supernatant, הסר את הצינורות מהמגנט, ולשטוף עם FBS כ 100 μl 10% / DMEM. חזור על פעולה עבור 5 שוטף.
- לאחר השטיפה האחרונה, מניח את הצינורות על מגנט דקות 1, להסיר את supernatant, והסר את הצינורות מהמגנט. הוסף כ 100 DMEM μl.
- מניחים את הצינורות על מגנט דקות 1, להסיר את supernatant, והסר את הצינורות מהמגנט. הוסף 100-200 μl prewarmed 0.25% טריפסין-EDTA. דגירה הדגימות ב 37 מעלות צלזיוס, 5% CO 2 למשך 5 דקות.
- מניחים את הצינורות על המגנט במשך 2 דקות. להעביר את supernatant המכיל תא בזהירות לצינורות Eppendorf טריים. צנטריפוגה במשך 5 דקות ב 400 x גרם.
- הסר את supernatant. Resuspend התאים בינוני 80-100 μl צמיחה וצלחת ב96 - או 384 היטב צלחת תרבות מטופלים, בהתאם לתשואה הצפויה(כ 450-600 תאים מהחדרים של E14.5-E16.5 עוברים). לתאי אנדותל, השתמש במדיום תרבות צמיחת אנדותל (מוגדר להלן).
תוצאות
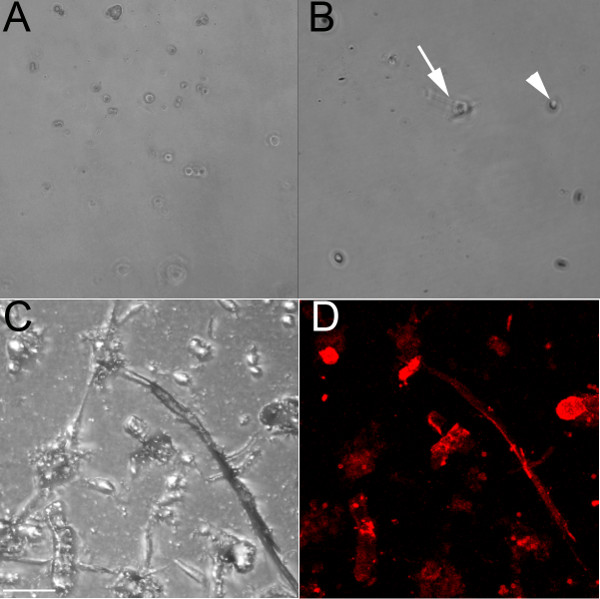
באמצעות נוגדן ספציפי לאנדותל שמכיר CD31, תאי האנדותל בודדו מהחדרים של (E) 13.5 (איור 1 א) ו 18.5 (איורים 1 ב-1D) עוברים עובריים. כאשר גדלו על צלחת תרבות מטופל, התאים אלה יישארו מעוגלים והיינו ליצור דפוס מרוצף אם מחוברות קרובים (איור 1 א). קולגן לדלל שימש גם למעייל הבארות, ואילו תאי אנדותל ידבק אליו (איור 1), הם יוצרים פחות מאשר כאשר שרשרות מצופים בג'ל קולגן (1C 1D ואיורים). תאי האנדותל גדלו הבמכילים גם ג'ל קולגן (1C 1D ואיורים) תאי תאי אינטראקציות טופס וליצור שרשרות שמתחילות להתרחב כאשר גדלו על קולגן, ותהליך זה מתרחש מהר יותר כאשר גדל על ג'ל קולגן לעומת קולגן המצופה צלחת. שרשרות אנדותל אלה תווית חיובית עם הסמן האנדותל ISO-לקטינים ( 1D איור). התאים המבודדים לשרוד עד שבוע 1 בתרבות, אבל הוכיחו עמיד לtrypsinization (גם לאחר שעה 1 ב 37 ° C), ולכן הם מתאימים ביותר לניסויים סופניים.
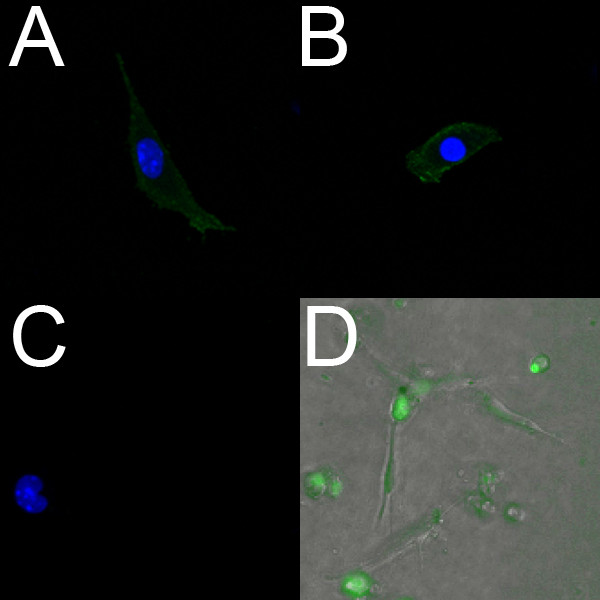
תאי אנדותל שבודדו מחדרי הלב E18.5 תווית חיובי עם PECAM (איור 2 א) וFlk1 (איור 2). יתר על כן, חיים יכולים להיות מתויגים תאי אנדותל מבודדים באמצעות הצבע האנדותל ספציפי ניאון Syto-16. איור 2D מציג תאי אנדותל שבודדו מהחדרים של עובר E14.5 ומסומן עם Syto-16.
איור 1. תאי אנדותל שבודדו מחדרי לב עכבר עובריים ליצור שרשרות כאשר גדלו על ג'ל קולגן. (א) תמונת 10x Brightfield של תאי האנדותל חיות מבודדים חדרית מE13.5 לב גרםrown על צלחת תרבות מטופל; גם לאחר 48 שעות, תאים נשארים מעוגלים (ב ') תמונת 10x Brightfield של תאי האנדותל קבועים מבודדים חדרית מלב E18.5 גדלה על צלחת קולגן מצופה;. לאחר 24 שעות, כמה תאים החלו מתארך (חץ), אבל רובם נשארים מעוגל (ראש חץ). (C, D) תמונות Confocal של תאי האנדותל קבועים מבודדים חדרית מלב E18.5 גדל על ג'ל קולגן, המוצג בbrightfield (ג) ושכותרתו עם ISO -לקטינים (אדום). חצים מצביעים על חלק מהתאים לקטינים-החיוביים. סולם ברים בCD = 50 מיקרומטר.
איור 2. תאי אנדותל שבודדו מחדרי לב עכבר עובריים תווית חיובית לסמני אנדותל. (AC) תמונות confocal (40X) של תאי האנדותל קבועים מבודדים חדרית מלב E18.5 גדל עלמנה קולגן מצופה. תאים אלה תווית חיובית לPECAM () וFLK-1 (ב); הביקורת השלילית (ג) לא מראה שום הקרינה. בAC, הגרעינים מסומנים עם DAPI (כחול). (ד ') כיסוי פלורסנט (10x) של תאי האנדותל חיות מבודדים חדרית מלב E14.5 גדל על ג'ל קולגן. התאים הודגרו עם הסמן האנדותל החי Syto-16 (ירוק), והגירה נצפתה באמצעות מיקרוסקופ זמן לשגות.
Discussion
עבודה עם תאים עובריים ראשוניים מאפשרת ניסויים חדשניים לטיפול בשלבים קריטיים של פיתוח במבחנה. עם זאת, הליך הבידוד הוא לא טריוויאלי. שלבים קריטיים לבידוד כל סוג של תאים כוללים הבטחה כי התאים מופרדים היטב על עיכול collagenase ולאחר מכן שהם הושעו גם במהלך השלבים לשטוף. נתיחה מכאנית על ידי pipetting מאוד עוזרת להפריד את התאים במהלך שלב collagenase, וצעד הסינון מסיר גושים של תאים. צעדים אלה ישפרו את הטוהר האוכלוסייה ואת התשואה.
ציפוי הצפיפות היא גם דאגה משמעותית כאשר מבודדים את התאים מאיבר קטן. בגלל צינור היווצרות אנדותל תלוי בצפיפות תאי 7, אנחנו הסתמכנו על צלחות תרבית רקמת 384 גם להגדיל את צפיפות הציפוי שלנו. אפילו עם שיקול זה, יש לנו היה צריך לשנות כמה ניתוחים כדי להכיל את צפיפות תא נמוכה יותר (דייר ופטרסון, בפרוגרס). לכן, אם מספר התא הוא דאגה, תרבות בגודל קטנה יותר גם עשויה להפחית את הבעיה.
מגבלה נוספת של בידוד תאים ראשוניים היא את הספציפיות של הנוגדן. אפילו זיהה חלבון האנדותל ספציפי כגון CD31 לעתים בא לידי ביטוי על ידי fibroblasts 8. אם מספר התא נקטף מאפשר FAC מיון במקום, ולאחר מכן את תאי האנדותל וfibroblasts יכולים להיות מופרדים על ידי עוצמת הקרינה. עם זאת, ניתוח מיון FAC האחרון של תאי האנדותל עובריים נדרש ארבעה עוברי E10.5 שלמים כדי לייצר תאי אנדותל מספיק למיצוי mRNA, טוען כי טכניקה זו, אם כי עוצמה, לא יכולה להיות מתאימה לקטנים יותר איברים 9.
לכן, אם מיון FAC הוא לא ריאלי, יכולות להיות מועסקות בטכניקות אחרות לשיפור טוהר אוכלוסייה. תהליך בחירה בשני שלבים, שבו התאים שנבחרו באופן חיובי על ידי נוגדן אחד ולאחר מכן שלילי selected על ידי אי ספיקה להיקשר לנוגדנים שני, היא גישה חלופית אחת. סמן פיברובלסטים הספציפי FSP-1 יהיה מועמד אחד 10 בפרט. לחלופין, ניתן להזמין מדיום התרבות בלי L-לין, וניתן להוסיף D-valine במקום; fibroblasts אינם מסוגל לנצל D-valine ולכן אינו שורד 11,12.
למרות המגבלות וחששות הללו, לומדים אוכלוסיות תאים עובריים ראשוניות מאפשר ניתוח מפורט במבחנה של תהליכים התפתחותיים. טכניקה זו יכולה להיות מיושמת על כל איבר או אזור של העובר ומאפשרת לסוג תא להשוואה על פני שלבים עובריים שונים. עם קנה המידה המתאימה, ניתן להשיג גם אוכלוסיות קטנות מאוד של תאים ראשוניים ונותחו. ניתוחים אלה יספקו תובנה משמעותית לכמה תת קבוצות מסוימות של תאים להתנהג ולהשתנות עם הזמן.
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
ברצוננו להודות לאנדראה Portbury לקריאה ביקורתית של כתב היד, מעבדת השירות של מיקרוסקופ UNC לקבלת סיוע בזמן לשגות ההדמיה, ו-NIH (מענק # R01HL061656) לתמיכה במימון.
Materials
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Timed-pregnant mice | To be dissected at the embryonic stage of interest | ||
| Anti-mouse CD31 | BD Bioscience | 553370 | |
| Rat IgG Dynabeads | Invitrogen | 110-35 | |
| Collagen | BD Bioscience | 354236 | |
| PBS (1x) | |||
| Collagenase, type I | Worthington Biochemical | LS004196 | |
| DMEM | Cellgro | ||
| FBS | Sigma-Aldrich | F2442 | |
| Endothelial cell growth medium | (made in lab as described in notes) | DMEM containing 20% FBS, 5 μM β-mercapt–thanol, 50 μg/ml ECG, and 1x penicillin/streptomycin | |
| β-mercapt–thanol | Sigma-Aldrich | M6250 | |
| ECGS | Biomedical Technologies, Inc. | BT-203 | |
| Penicillin-Streptomycin | Gibco | 15140 | |
| Trypsin-EDTA | Gibco | 25300 | |
| 384-well culture plate | Greiner | T-3037-6 | Plate was prepared with a thin collagen gel, as described in 6; working surface area 10 mm2 |
| Collagen type I | BD | 354236 | Use at a final concentration of 1.5 mg/ml |
| M199, 10x | Invitrogen | 11825-015 | |
| Syto-16 | Invitrogen | S7578 | Used as directed in 13 |
| EQUIPMENT | |||
| Stereoscopic microscope | Nikon | SMZ645 | |
| Cell culture incubator | Thermo | 3110 | |
| DynaMag | Invitrogen | 123-21D | |
| Table-top centrifuge | Thermo | 75002430 | |
References
- Landecker, H. . Culturing Life: How Cells Became Technologies. , (2007).
- Kan, C. Y., Wen, V. W., et al. Endothelial cell dysfunction and cytoskeletal changes associated with repression of p16(INK4a) during immortalization. Oncogene. , (2012).
- Dyer, L. A., Patterson, C. Development of the endothelium: an emphasis on heterogeneity. Semin. Thromb. Hemost. 36, 227-235 (2010).
- Dong, Q. G., Bernasconi, S., et al. A general strategy for isolation of endothelial cells from murine tissues. Characterization of two endothelial cell lines from the murine lung and subcutaneous sponge implants. Arteriosclerosis, Thrombosis, and Vascular Biology. 17, 1599-1604 (1997).
- van Beijnum, J. R., Rousch, M., Castermans, K., vander Linden, E., Griffioen, A. W. Isolation of endothelial cells from fresh tissues. Nat. Protoc. 3, 1085-1091 (2008).
- Runyan, R. B., Markwald, R. R. Invasion of mesenchyme into three-dimensional collagen gels: a regional and temporal analysis of interaction in embryonic heart tissue. Dev. Biol. 95, 108-114 (1983).
- Arnaoutova, I., Kleinman, H. K. In vitro angiogenesis: endothelial cell tube formation on gelled basement membrane extract. Nat. Protoc. 5, 628-635 (2010).
- Zeisberg, E. M., Potenta, S. E., Sugimoto, H., Zeisberg, M., Kalluri, R. Fibroblasts in kidney fibrosis emerge via endothelial-to-mesenchymal transition. Journal of the American Society of Nephrology : JASN. 19, 2282-2287 (2008).
- Chang, L., Noseda, M. Differentiation of vascular smooth muscle cells from local precursors during embryonic and adult arteriogenesis requires Notch signaling. PNAS. 109, 5993-6998 (2012).
- Fehrenbach, M. L., Cao, G., Williams, J. T., Finklestein, J. M., DeLisser, H. M. Isolation of murine lung endothelial cells. American Journal of Physiology: Lung Cellular and Molecular Physiology. 296, L1095-L1103 (2009).
- Frauli, M., Ludwig, H. Inhibition of fibroblast proliferation in a culture of human endometrial stromal cells using a medium containing D-valine. Archives of Gynecology and Obstetrics. , 241-96 (1987).
- Lazzaro, V. A., Walker, R. J., et al. Inhibition of fibroblast proliferation in L-valine reduced selective media. Research communications in chemical pathology and pharmacology. 75, 39-48 (1992).
- Arima, S., Nishiyama, K., et al. Angiogenic morphogenesis driven by dynamic and heterogeneous collective endothelial cell movement. Development. 138, 4763-4776 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved