Method Article
Isolierung von embryonalen ventrikuläre Endothelzellen
In diesem Artikel
Zusammenfassung
Primäre Zellkultur ist eine nützliche Technik für die Analyse von spezifischen Populationen von Zellen, insbesondere von transgenen Maus-Embryonen in bestimmten Entwicklungsstadien. Hierin werden embryonalen Ventrikel seziert und distanziert, und Antikörper-konjugierten Perlen erkennen und trennen die Endothelzellen für die weitere Analyse.
Zusammenfassung
Zellkultur hat unsere Fähigkeit, einzelne Populationen von Zellen unter Kulturbedingungen unzähligen beurteilen verbessert. Während immortalisierten Zelllinien signifikante Vorteile für ihre Benutzerfreundlichkeit bieten, sind diese Zelllinien nicht für alle möglichen Zelltypen. Durch die Isolierung primärer Zellen aus einer bestimmten Region von Interesse, insbesondere aus einer transgenen Maus, können nuancierter Untersuchungen durchgeführt werden. Die grundlegende Technik beinhaltet Sezieren des Organs oder teilweise Organ von Interesse (zB das Herz oder einen bestimmten Bereich des Herzens) und Dissoziation des Organs, um einzelne Zellen. Diese Zellen werden dann mit magnetischen Kügelchen, konjugiert mit einem Antikörper, der interessierenden Zelltyp erkennt inkubiert. Die Zellen von Interesse kann dann mit Hilfe eines Magneten getrennt werden, mit einer kurzen Inkubation Trypsin Dissoziation der Zellen von den Kügelchen. Diese isolierten Zellen können dann gezüchtet und analysiert werden, wie gewünscht. Diese Technik wurde ursprünglich für erwachsene Maus Orgel konzipierts, kann aber leicht nach unten skaliert werden für die Verwendung mit embryonalen Organe, wie hier gezeigt. Denn unser Interesse ist in der Entwicklung einer koronaren Gefäßsystem, wollten wir diese Population von Zellen in bestimmten embryonalen Stadien zu studieren. Somit hatte die ursprüngliche Protokoll geändert werden, um die Kompatibilität mit der geringen Größe der embryonalen Ventrikel und der geringen Ertragspotenzial von Endothelzellen in diesen Entwicklungsstadien werden. Mit Hilfe dieser abgespeckte Ansatz haben wir koronaren Plexus Umbau in transgenen embryonalen ventrikuläre Endothelzellen beurteilt.
Einleitung
Das Aufkommen der immortalisierten Zelllinien revolutioniert hat grundlegende zellbiologische 1. Die derzeit verfügbaren Zelllinien werden aus einer Vielzahl von Organen abgeleitet und sind alle wichtigen Zelltypen. Allerdings haben etablierte Zelllinien einige Einschränkungen. Verfahren nach Immortalisierung offensichtlich verändert das Verhalten der Zellen, insbesondere in Bezug auf Lebensdauer und Proliferation, kann aber auch Einfluss auf die Expression von unerwarteten Proteine wie Zytoskelettproteinen 2. Darüber hinaus, obwohl viele verschiedene Zelllinien zur Verfügung stehen, gibt es erhebliche Vielfalt selbst unter einem Zelltyp in einem gesamten Organismus. Endothelzellen zeigen insbesondere diverse Verhaltensweisen, ob sie Linie Arterien oder Venen und welche Art von Flow ist in dem Gefäß 3 basierend. Noch Pressen aus einer Entwicklungsstörung Sicht ist jedoch, dass die überwiegende Mehrheit der verfügbaren Zelllinien aus adultem Gewebe abgeleitet sind (siehe zB ter Sammlung via ATCC). Diese Erwachsenen Zelllinien wahrscheinlich nicht rekapitulieren die dynamische Natur von ihrer embryonalen Vorstufen. Die sich rasch verändernden Raumzeit Genexpression während der Entwicklung beobachtet auch darauf hin, dass ein Endothelzellen von einem Organ in einem bestimmten Entwicklungsstadium verhalten sich möglicherweise nicht auf die gleiche Weise als Endothelzellen von demselben Organ in einem anderen Entwicklungsstadium.
Als Alternative zur Verwendung von kommerziell erhältlichen immortalisierten Zelllinien können primäre Zellen aus dem spezifischen Gewebe von Interesse isoliert werden. Zu den Vorteilen dieser Technik können diese primären Zellen aus einem bestimmten Organ oder Teil eines Organs zu einem bestimmten Entwicklungsstadium isoliert werden. Weiterhin können diese primären Zellen aus der Vielzahl der verfügbaren transgenen Tieren isoliert werden, so dass die in-vitro-Studie von Gen-Knockout-und Knock-in werden, ohne andere Probleme wie Transfektionseffizienz. Nicht überraschend, vieleTechniken wurden veröffentlicht detailliert, wie zu isolieren spezifischen Zelltypen 4,5. Im Allgemeinen beinhalten diese Verfahren das Sammeln der Region von Interesse, dissoziieren die Zellen, Markieren des spezifischen Zelltyp von Interesse und das Isolieren die Zellen zur weiteren Analyse.
Um einen frühen embryonalen Population von koronarer Endothelzellen zu untersuchen, haben wir unten skaliert eine zuvor veröffentlichte Verfahren 4 zur Verwendung mit einem kleineren Organ. Mit diesem verkleinerten Verfahren können wir die koronare Endothelzellen aus dem embryonalen Herzen zu bestimmten embryonalen Stadien isolieren. Diese Zellen können dann in herkömmlichen Assays Endothelzellen wie Migration Analysen verwendet werden. Bis frühen embryonalen Zelllinien häufiger geworden, die Arbeit mit den primären Zellen ist ein unschätzbares Technik.
Protokoll
1. Bereiten Antikörper-konjugierten Beads
- Einen Tag vor der Dissektion, kombinieren die Antikörper der Wahl mit den entsprechenden Dynabeads (zB Ratte IgG Dynabeads für einen Antikörper bei Ratten erhöht, 4 x 10 8 Perlen / ml) pro Anweisungen des Herstellers. Für die BD Ratte anti-CD31-Antikörper (0,5 ug / ul, verwendet werden, um Endothelzellen isolieren), wird 3 ul Antikörper für jeweils 25 ul Perlen hinzugefügt, für eine endgültige Konzentration von 1,5 ug anti-CD31-Antikörper und 1 x 10 7 Perlen / 25 ul Puffer.
- Inkubieren Perlen und Antikörper über Nacht bei 4 ° C.
2. Vorbereitung der Collagen Teller
- Isolierte Zellen bilden Tubuli schneller als auf einem Kollagen-Gel gewachsen als lediglich eine Kollagen-beschichtete Platte entgegen. Daher sind Kollagengelen machte die Nacht vor der Dissektion, wie in 6 beschrieben. Auf dem Eis in einer Gewebekultur Kapuze, kombinieren Sie die folgenden Reagenzien (ausreichend für 19 Wells): 206,4 ul sterilem H 2 O, 140,4 ul Kollagen Typ I (4,08 mg / ml), 38,4 ul 10x M199 und 1,15 ul 5 M NaOH.
- Pipette 20 ul dieses Kollagen-Gel in die Vertiefungen einer 384-well Gewebekulturplatten. Legen Sie die Platte in einem 37 ° C Gewebekulturinkubator für 30 min.
- In 80 ul DMEM in jede Vertiefung und Inkubation für 15 min bei 37 ° C Entfernen Sie das Kulturmedium und wiederholen Sie noch zweimal.
- Nach dem letzten Spülgang, fügen Sie 80 ul 10% FBS / DMEM in jede Vertiefung und Inkubation über Nacht bei 37 ° C. Entfernen des Kulturmediums vor der Zugabe der isolierten Zellen.
3. Verbrauchsteuern und die Digest Herz
- Euthanize eine Zeitfahr-schwangeren Maus an der gewünschten embryonalen Tag mit einem zugelassenen Euthanasie Technik. Alle Experimente wurden von der Institutional Animal Care und Use Committee an der University of North Carolina in Chapel Hill genehmigt.
- Mit der Maus in Rückenlage, großzügig sprühen die Bauchseite des Weibchens mit 70% Ethanol vorDissektion. Mit einer Pinzette, um den unteren Bauch-Haut und Muskeln abzuheben von den inneren Organen, aufschneiden der weiblichen unteren Bauchraum um die inneren Organe zu visualisieren.
- Halten Sie den Muttermund mit einer Pinzette vorsichtig geschnitten kaudal der Zange und beginnen die Aufhebung des Uterushorn aus der Bauchhöhle. Während die Aufhebung des Uterushorns, wegschneiden jede Bindegewebe, das Horn an ihrem Platz hält. Zum Abschluss Ausschneiden des Uterushorns, schneiden Sie die Kreuzung der Uterushorns mit den Eileiter, die Uterushorns befreien.
- Legen Sie die Uterushorns in eine Petrischale mit kaltem 1x Phosphat-gepufferte Kochsalzlösung (PBS) und spülen Sie nach Bedarf. Schneiden Sie die Uterushorns über der Mittellinie, um die angeschlossenen embryonalen Säcke freizulegen.
- Schneiden Sie einen Fruchtblase an der Kreuzung von der Plazenta und den Embryo zu vermeiden, versehentlich Schneiden der Embryo ein Embryo und abrufen. Setzen Sie den Embryo in einer zweiten Petrischale mit kaltem PBS. Bringen Sie die Petrischale mit dem Uterushorn zu Eis.
- Decapitate des Embryos, um den Zugriff auf die Brustwand zu verbessern. Wenn Genotypisierung notwendig ist, schneiden Sie den Schwanz, um es zu entfernen und speichern in ein Eppendorf-Röhrchen auf Eis gelegt.
- Mit dem Embryo auf dem Rücken, schnitt den Brustwand, um das Herz und die Lunge zu visualisieren. Um zu vermeiden, schneiden das Herz, einen vertikalen Schnitt entlang der Seite des Brustkorbs, nahe einem Vorderbein, durch einen horizontalen Schnitt über der Unterseite der Rippen gefolgt, dann, ziehen Sie die Brustwand und aus dem Weg. Bis in etwa embryonalen Tag 13,5, ist die Brustwand transparent, Unterstützung in der Visualisierung.
- Heben Sie das Herz mit einer Pinzette und schneiden Sie die Schiffe unten. Dann, vor den großen Gefäßen geschnitten, um das Herz zu befreien. Wenn die Lungengefäße nicht geschnitten werden, kann die Lunge mit dem Herzen entfernt werden. So entfernen fremden Gewebe wie Lunge, falls erforderlich.
- Trennen und entsorgen Sie die Vorhöfe und der großen Gefäße aus den Herzkammern. Mit einer Schere zerkleinern die Ventrikel in kleine Stücke (ca. 1 mm 3 </ Sup>) und in etwa 500 ul Kollagenase (1 mg / ml in sterilem PBS). Die Proben auf Eis, bis alle Kammern haben gehackt worden und in Kollagenase.
- Wiederholen Sie die vorherigen Schritte, bis die Ventrikel aus allen Embryonen herausgeschnitten haben, sammeln jedes Herz in einem separaten Eppendorf-Röhrchen. Wenn alle Embryonen die gleiche Genotyp haben, können in einem einzigen Herzen Eppendorf-Röhrchen gepoolt werden. Die Anzahl der Proben zu einem einzigen Zeitpunkt verarbeitet werden, können auf der Grundlage der Magnet für die Isolierung verwendet beschränkt werden, die Dynamag (123-21D) verwendet hier hält maximal 16 Eppendorf-Röhrchen.
- Legen Sie die gehackte Ventrikel bei 37 ° C unter Schütteln für 45 min. Alle 15 min, entfernen Sie vorsichtig die Proben und Pipette auf und ab, um mechanisch distanzieren die Zellen.
4. Isolierung der Endothelzellen
- Führen Sie das Ventrikel-Kollagenaselösung durch ein 70 um-Filter, um weitere Klumpen von Zellen zu entfernen.
- Zentrifugieren Sie die Zellen bei 400 g für 10 min. Verwerfender Überstand mit rund 200 ul 10% FBS in DMEM ersetzen und Pipette auf und ab, um die Zellen zu distanzieren.
- Wiederholen Sie den vorherigen Schritt einmal. Zentrifugieren Sie die Zellen bei 400 g für 10 min nach der zweiten 10% FBS / DMEM waschen. Die Zellen in 50 ul 10% FBS / DMEM.
- Während der letzten Zentrifugationsschritt, bereiten Sie die Perlen.
- Legen Sie die Eppendorf-Röhrchen, die den Antikörper und Perlen auf einem Magneten für 1 min.
- Mit dem Rohr an Ort und Stelle auf dem Magneten, entfernen Sie den Überstand. Entfernen Sie den Schlauch vom Magneten und fügen etwa 100 ul 10% FBS / DMEM.
- Legen Sie das Rohr auf der Magnet für 1 min. Entfernen Sie den Überstand und wäscht nochmals mit 10% FBS / DMEM. Wiederholen für insgesamt 3 wäscht.
- Nach dem letzten Waschen, resuspendieren Antikörper-konjugierten Perlen in 10% FBS / DMEM (5 ul pro Probe).
- Zu jeder Zelle Probe 5 ul der Antikörper-konjugierten Perlen. Legen Sie die Perlen-Zell-Suspensionen bei 4 ° C unter Schütteln for 30 min.
- In einer Laminarströmungshaube, legen Sie die Eppendorf-Röhrchen, die Zellen und Antikörper-konjugierten Perlen auf dem Magneten für 1 min. Entfernen Sie den Überstand, entfernen Sie die Rohre aus dem Magneten und waschen mit ca. 100 ul 10% FBS / DMEM. Wiederholen Sie dies für 5 Wäschen.
- Nach dem letzten Waschen, legen Sie die Rohre auf der Magnet für 1 min, den Überstand entfernen, und entfernen Sie die Rohre von dem Magneten. In etwa 100 ul DMEM.
- Legen Sie die Rohre auf der Magnet für 1 min, den Überstand entfernen, und entfernen Sie die Rohre von dem Magneten. 100-200 ul vorgewärmt 0,25% Trypsin-EDTA. Inkubieren der Proben bei 37 ° C und 5% CO 2 für 5 min.
- Legen Sie die Rohre auf den Magneten für 2 min. Sorgfältig übertragen die Zellen enthaltende Überstand in frische Eppendorf-Röhrchen. Zentrifugieren für 5 min bei 400 x g.
- Entfernen Sie den Überstand. Die Zellen in 80-100 ul Wachstumsmedium und Platte in einer 96 - oder 384-Well-Kulturschale behandelt, abhängig von der erwarteten Ausbeute(Ca. 450-600 Zellen aus den Herzkammern E14.5-E16.5 Embryonen). Für Endothelzellen, verwenden endothelial growth Kulturmedium (nachstehend definiert).
Ergebnisse
Verwendung eines Endothelzellen-spezifischen Antikörper, der CD31 erkennt, wurden Endothelzellen aus den Ventrikeln des embryonalen (E) 13,5 (1A) und 18,5 (1B-1D) Embryonen isoliert. Wenn auf einer unbehandelten Kulturschale gezüchtet, diese Zellen bleiben gerundet und würde eine Kopfsteinpflaster-Muster bilden, wenn in der Nähe konfluent (Abb. 1A). Verdünnen Kollagen hat auch zur Beschichtung verwendet die Vertiefungen, und während die Endothelzellen an (Abbildung 1B) haften, bilden sie weniger Ketten als wenn überzogenen auf einem Kollagengel (1C und 1D). Endothelzellen in einen Brunnen mit einem Kollagen-Gel (1C und 1D) Form Zell-Zell-Interaktionen und bilden Ketten, die zu verzweigen, wenn sie auf Kollagen wachsen beginnen und diesen Prozess erfolgt schneller, wenn auf der Kollagen-Gel im Vergleich mit dem Kollagen-beschichteten gewachsen gewachsen Platte. Diese endothelialen Ketten bezeichnen positiv mit der Endothelmarker iso-Lectin ( 1D). Die isolierten Zellen überleben bis zu 1 Woche in Kultur, sondern haben sich als resistent gegen Trypsinierung (auch nach 1 Stunde bei 37 ° C), daher werden sie am besten an Klemme Experimente geeignet.
Endothelzellen aus E18.5 Ventrikel isoliert beschriften positiv mit PECAM (2A) und Flk1 (2B). Ferner leben isolierten Endothelzellen markiert werden können mit dem Endothel-spezifischen Fluoreszenzfarbstoff Syto-16 werden. 2D zeigt Endothelzellen, die von den Herzkammern eines E14.5 Embryo isoliert und markiert mit Syto-16.
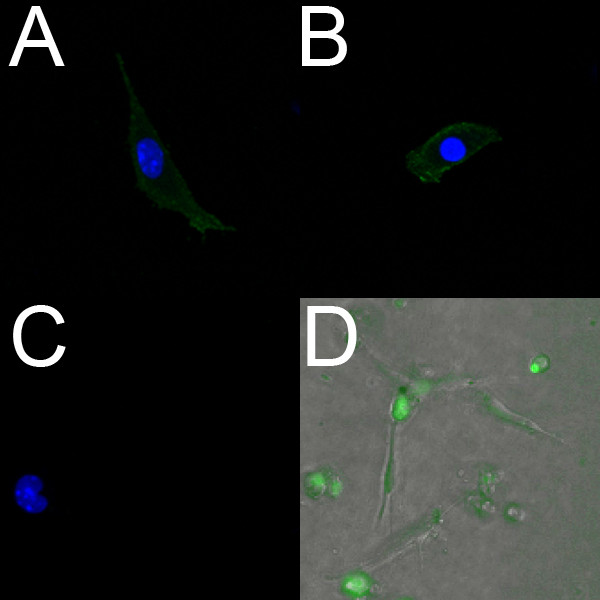
Abbildung 1. Endothelzellen aus embryonalen Maus Ventrikel isoliert bilden Ketten, wenn auf einem Kollagen-Gel gewachsen. (A) Hellfeld 10x Live-Bild von isolierten ventrikulären Endothelzellen aus einer E13.5 heart gRown auf einer unbehandelten Kulturschale, auch nach 48 Stunden, bleiben Zellen abgerundet (B) 10x Hellfeld Bild der festen isolierte ventrikuläre Endothelzellen aus einer E18.5 Herz auf einem Kollagen-beschichtete Schale gewachsen;. nach 24 Stunden, einige Zellen haben begonnen Verlängern (Pfeil), aber die meisten von ihnen bleiben gerundet (Pfeilspitze). (C, D) Konfokale Bilder von festen isolierten ventrikulären Endothelzellen aus einer E18.5 Herz auf einem Kollagen-Gel gewachsen, im Hellfeld (C) gezeigt und mit dem iso -Lectin (rot). Die Pfeile zeigen einige der Lektin-positiven Zellen. Maßstab Bars in CD = 50 um.
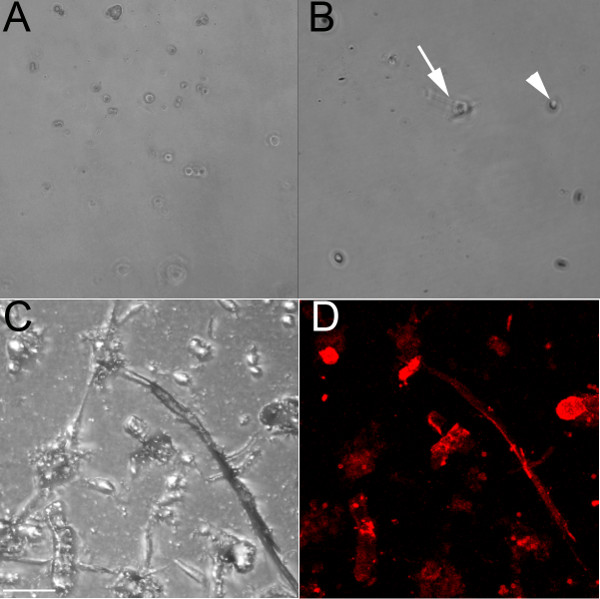
Abbildung 2. Endothelzellen aus embryonalen Maus Ventrikel isoliert beschriften positiv für endotheliale Marker. (AC) Konfokale Bilder (40x) fester isolierte ventrikuläre Endothelzellen aus einer E18.5 Herz gewachsen aufein Collagen-beschichteten Schale. Diese Zellen kennzeichnen positiv für PECAM (A) und Flk-1 (B), wobei die negative Kontrolle (C) weist keine Fluoreszenz. In AC sind die Zellkerne mit DAPI (blau) markiert. (D) Fluorescent Overlay (10x) von lebenden isolierte ventrikuläre Endothelzellen aus einer E14.5 Herz auf einem Kollagen-Gel gewachsen. Die Zellen wurden mit dem Live-endothelialen Marker Syto-16 (grün) inkubiert und Migration wurde unter Verwendung Zeitraffer-Mikroskopie.
Diskussion
Arbeiten mit primären embryonalen Zellen ermöglicht neuartige Experimente in vitro kritischen Schritte der Entwicklung zu befassen. Allerdings ist das Verfahren zur Isolierung nicht trivial. Kritische Schritte zur Isolierung jede Art von Zellen auch gewährleistet, dass die Zellen gut auf Kollagenaseverdau getrennt und dann, dass sie gut in den Waschschritten suspendiert. Mechanische Präparation durch Pipettieren sehr hilft Trennung der Zellen während der Kollagenase Schritt, und der Schritt des Filterns entfernt Klumpen von Zellen. Diese Schritte zur Verbesserung der Bevölkerung Reinheit und Ausbeute.
Die Beschichtungs-Dichte ist auch ein wesentliches Anliegen bei der Isolierung von Zellen aus einer kleinen Orgel. Da Endothelzellen Rohr-Bildung ist abhängig von der Zelldichte 7 verließen wir uns auf 384-Well-Zellkulturplatten unserer Beschichtungs-Dichte zu erhöhen. Auch bei dieser Betrachtung, mussten wir einige Analysen zu modifizieren, um eine geringere Zelldichte (Dyer und Patterson, in pro PlatzGress). Wenn also Zellzahl ist ein Anliegen, eine kleinere Kultur kann auch das Problem zu verringern.
Eine weitere Einschränkung der Isolierung primären Zellen ist die Spezifität des Antikörpers. Selbst ein anerkannter endothelial-spezifische Protein wie CD31 wird manchmal von Fibroblasten 8 ausgedrückt. Wenn die Anzahl von Zellen geerntet ermöglicht FAC Sortierung anstelle, dann die Endothelzellen und Fibroblasten konnte durch die Fluoreszenzintensität getrennt werden. Allerdings benötigt ein aktuelles FAC Sortierung Analyse der embryonalen Endothelzellen vier ganze E10.5 Embryonen genug Endothelzellen für die mRNA-Extraktion zu erzeugen, was darauf hindeutet, dass diese Technik, obwohl mächtig, möglicherweise nicht geeignet für kleinere Organe 9.
Wenn also FAC Sortierung nicht möglich ist, können auch andere Techniken zur Verbesserung der Bevölkerung Reinheit eingesetzt werden. Ein zweistufiges Auswahlverfahren, in dem die Zellen positiv durch einen Antikörper ausgewählt und dann negativ selektiert durch Nichtbeantwortung einer zweiten Antikörper zu binden, ist ein alternativer Ansatz. Die Fibroblasten-spezifische Marker FSP-1 würde einen bestimmten Kandidaten 10 sein. Alternativ kann das Kulturmedium ohne L-Valin zu bestellen, und D-Valin anstelle hinzugefügt werden, Fibroblasten sind nicht imstande, D-Valin zu nutzen und somit nicht überleben 11,12.
Trotz dieser Einschränkungen und Bedenken, Studium primären embryonalen Zellpopulationen ermöglicht eine detaillierte in vitro Analyse von Entwicklungsprozessen. Diese Technik kann auf jedem Organ oder Region des Embryos aufgebracht werden und ermöglicht ein Zelltyp in verschiedenen embryonalen Stadien verglichen werden. Mit der entsprechenden Skalierung können auch sehr kleine Populationen von primären Zellen gewonnen und analysiert werden. Diese Analysen werden wichtige Einblicke in wie bestimmte Untergruppen von Zellen verhalten und verändern im Laufe der Zeit zu stellen.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Danksagungen
Wir möchten Andrea Portbury für die kritische Durchsicht des Manuskripts, das Mikroskop Service Labor von UNC für die Unterstützung bei der Zeitraffer-Bildgebung und die NIH (grant # R01HL061656) für finanzielle Unterstützung danken.
Materialien
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Timed-pregnant mice | To be dissected at the embryonic stage of interest | ||
| Anti-mouse CD31 | BD Bioscience | 553370 | |
| Rat IgG Dynabeads | Invitrogen | 110-35 | |
| Collagen | BD Bioscience | 354236 | |
| PBS (1x) | |||
| Collagenase, type I | Worthington Biochemical | LS004196 | |
| DMEM | Cellgro | ||
| FBS | Sigma-Aldrich | F2442 | |
| Endothelial cell growth medium | (made in lab as described in notes) | DMEM containing 20% FBS, 5 μM β-mercapt–thanol, 50 μg/ml ECG, and 1x penicillin/streptomycin | |
| β-mercapt–thanol | Sigma-Aldrich | M6250 | |
| ECGS | Biomedical Technologies, Inc. | BT-203 | |
| Penicillin-Streptomycin | Gibco | 15140 | |
| Trypsin-EDTA | Gibco | 25300 | |
| 384-well culture plate | Greiner | T-3037-6 | Plate was prepared with a thin collagen gel, as described in 6; working surface area 10 mm2 |
| Collagen type I | BD | 354236 | Use at a final concentration of 1.5 mg/ml |
| M199, 10x | Invitrogen | 11825-015 | |
| Syto-16 | Invitrogen | S7578 | Used as directed in 13 |
| EQUIPMENT | |||
| Stereoscopic microscope | Nikon | SMZ645 | |
| Cell culture incubator | Thermo | 3110 | |
| DynaMag | Invitrogen | 123-21D | |
| Table-top centrifuge | Thermo | 75002430 | |
Referenzen
- Landecker, H. . Culturing Life: How Cells Became Technologies. , (2007).
- Kan, C. Y., Wen, V. W., et al. Endothelial cell dysfunction and cytoskeletal changes associated with repression of p16(INK4a) during immortalization. Oncogene. , (2012).
- Dyer, L. A., Patterson, C. Development of the endothelium: an emphasis on heterogeneity. Semin. Thromb. Hemost. 36, 227-235 (2010).
- Dong, Q. G., Bernasconi, S., et al. A general strategy for isolation of endothelial cells from murine tissues. Characterization of two endothelial cell lines from the murine lung and subcutaneous sponge implants. Arteriosclerosis, Thrombosis, and Vascular Biology. 17, 1599-1604 (1997).
- van Beijnum, J. R., Rousch, M., Castermans, K., vander Linden, E., Griffioen, A. W. Isolation of endothelial cells from fresh tissues. Nat. Protoc. 3, 1085-1091 (2008).
- Runyan, R. B., Markwald, R. R. Invasion of mesenchyme into three-dimensional collagen gels: a regional and temporal analysis of interaction in embryonic heart tissue. Dev. Biol. 95, 108-114 (1983).
- Arnaoutova, I., Kleinman, H. K. In vitro angiogenesis: endothelial cell tube formation on gelled basement membrane extract. Nat. Protoc. 5, 628-635 (2010).
- Zeisberg, E. M., Potenta, S. E., Sugimoto, H., Zeisberg, M., Kalluri, R. Fibroblasts in kidney fibrosis emerge via endothelial-to-mesenchymal transition. Journal of the American Society of Nephrology : JASN. 19, 2282-2287 (2008).
- Chang, L., Noseda, M. Differentiation of vascular smooth muscle cells from local precursors during embryonic and adult arteriogenesis requires Notch signaling. PNAS. 109, 5993-6998 (2012).
- Fehrenbach, M. L., Cao, G., Williams, J. T., Finklestein, J. M., DeLisser, H. M. Isolation of murine lung endothelial cells. American Journal of Physiology: Lung Cellular and Molecular Physiology. 296, L1095-L1103 (2009).
- Frauli, M., Ludwig, H. Inhibition of fibroblast proliferation in a culture of human endometrial stromal cells using a medium containing D-valine. Archives of Gynecology and Obstetrics. , 241-96 (1987).
- Lazzaro, V. A., Walker, R. J., et al. Inhibition of fibroblast proliferation in L-valine reduced selective media. Research communications in chemical pathology and pharmacology. 75, 39-48 (1992).
- Arima, S., Nishiyama, K., et al. Angiogenic morphogenesis driven by dynamic and heterogeneous collective endothelial cell movement. Development. 138, 4763-4776 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten