Method Article
胚心室内皮細胞の単離
要約
初代細胞培養物は、特に、特定の発達段階におけるトランスジェニックマウス胚からの細胞の特定の集団を分析するのに有用な技術である。ここでは、胚の心室を切開し、解離、および抗体結合ビーズを認識し、さらなる分析のために内皮細胞を分離しています。
要約
細胞培養が大幅無数培養条件下で細胞の個々の集団を評価するために我々の能力を強化しています。不死化細胞株の使用の容易さのために重要な利点を提供するが、これらの細胞株は、すべての潜在的な細胞タイプでは使用できない。特にトランスジェニックマウスからの関心の特定の領域から一次細胞を単離することにより、より微妙な研究を行うことができる。基本的なテクニックは、臓器や、興味のある部分的器官(心臓や心臓の特定の領域など )を解剖し、単一細胞に臓器を解離が含まれます。これらの細胞は、その後、その他の細胞型を認識する抗体に結合した磁気ビーズと共にインキュベートする。関心のある細胞を、次いで、ビーズから細胞をトリプシン解離短いインキュベーションでは、磁石を用いて単離することができる。これらの単離された細胞は、次いで培養し、必要に応じて分析することができる。この手法はもともと成体マウスオルガンのために設計されましたsがなく、簡単にここに実証されるように、胚の器官で使用するために縮小することができます。我々の関心は、途上冠状血管系であるため、我々は特定胚の段階で細胞のこの集団を勉強したかった。従って、オリジナルのプロトコルは、胚心室のサイズが小さく、これらの発達段階における内皮細胞の低電位収率と互換性を持つように変更しなければならなかった。このスケールダウンのアプローチを利用して、我々は、トランスジェニック胚心室内皮細胞における冠状動脈神経叢リモデリングを評価しました。
概要
不死化細胞株の出現は、基本的な細胞生物学1に革命をもたらした。現在入手可能な細胞株は広範囲の器官に由来し、すべての主要な細胞型を包含している。しかし、確立された細胞株はいくつかの制限があります。不死化の方法は、具体的に明らかに寿命および増殖に関して、細胞の挙動を変化させるだけでなく、例えば2細胞骨格タンパク質などの予期しないタンパク質の発現に影響を与えることができる。多くの異なる細胞株が利用可能であるが、さらに、全体生物内であっても単一の細胞型間に有意な多様性がある。特定の番組多様な行動の内皮細胞は、動脈や静脈と流れの種類、容器3に存在している、彼らはラインかどうかに基づいて。発達の観点から、さらに押圧しかしながら、(参照、 例えば、t利用できる細胞株の大部分は、成体組織から誘導されるということであるATCCから入手彼がコレクション)。これらの成人の細胞株は、おそらく彼らの胚性前駆体の動的な性質を要約するしないでください。開発中に観測された、急速に変化する時空間的遺伝子発現パターンはまた、与えられた発達段階で1つの器官からの内皮細胞は、異なる発達段階で、同じ臓器の内皮細胞と同じように動作しない可能性を示唆している。
市販の不死化細胞株を使用する代わりに、一次細胞は、関心のある特定の組織から単離することができる。この手法の利点の中に、これらの一次電池であっても、特定の器官または任意の特定の発生段階における臓器の一部から分離することができる。さらに、これらの一次細胞は、遺伝子ノックアウトのインビトロ試験で 、そのようなトランスフェクション効率のような他の問題を回避しながら、ノックインできるよう、利用可能なトランスジェニック動物の様々から単離することができる。驚くことではないが、多くの技術は、特定の細胞型は4,5単離する方法を詳細に公開されている。一般に、これらの技術は、タグ付け、細胞を解離、関心領域を収集する関心のある特定の細胞型を含む、そして更なる分析のために、これらの細胞を単離する。
冠状動脈の内皮細胞の初期胚人口を研究するために、我々は小さい臓器で使用するために以前に発行された技法4を縮小。このスケールダウン手順により、我々は特定胚の段階で胚心臓から冠動脈内皮細胞を分離することができます。これらの細胞は、その後、マイグレーション分析などの伝統的な内皮細胞アッセイで使用することができる。初期胚細胞株は、より一般的になるまで、一次細胞での作業は非常に重要な技術である。
プロトコル
1。抗体結合ビーズを準備
- 前解剖へある日、製造元の指示に従って適切なダイナビーズ(ラットで育った抗体について例えばラットIgGダイナ、4×10 8ビーズ/ ml)で選択した抗体を兼ね備えています。 BDのラット抗CD31抗体(0.5μgの/μL、内皮細胞を分離するために使用される)の場合は、3μlの抗体は、最終1.5μgの抗CD31抗体の濃度及び/ 1×10 7ビーズのため、すべての25μlのビーズのために追加されます25μlのバッファー。
- 4℃でビーズと一晩抗体をインキュベート
2。コラーゲンプレートの準備
- 単にコラーゲンコートプレートとは対照的に、コラーゲンゲル上で増殖させたときに単離された細胞は、より迅速に細管を形成する。 6で説明したようにそのため、コラーゲンゲルは、解剖前の晩に行われる。組織培養フード内で氷の上で、以下の試薬(十分に19の井戸のために)結合:206.4μlの滅菌Hを<サブ> 2 O、140.4μlのコラーゲンタイプI(4.08 mg / ml)で、38.4μlの10倍M199、及び1.15μlの5 MのNaOH。
- 384ウェル組織培養プレートのウェル減らすこのコラーゲンゲルのピペットを20μl。 30分間37℃の組織培養インキュベーターでプレートを置きます。
- 各ウェルに80μlのDMEMを加え、37℃で15分間インキュベート℃、培地を削除し、さらに2回繰り返す。
- 最終的には、すすぎ各ウェルに80μlの10%FBS / DMEMを加え、37℃で一晩インキュベートした後、℃、単離した細胞を追加する前に培地を取り除きます。
3。物品税とハートを消化
- 承認された安楽死法を用いて、所望の胎生で時限妊娠マウスを安楽死させる。全ての実験は、ノースカロライナ大学チャペルヒル校で制度動物実験委員会によって承認された。
- 仰臥位でマウスを使って、自由に前に70%エタノールで雌の腹側をスプレー解剖。内臓から下腹部の皮膚や筋肉を持ち上げるために鉗子を使用して、内臓を可視化するために女性の下腹部空洞を切り開く。
- 鉗子で子宮頸部を持って、慎重に鉗子に尾カットし、腹腔からの子宮角を持ち上げ始める。子宮角を持ち上げながら、所定の位置にホーンを保持している任意の結合組織を切り取る。子宮角を切除終了するには、子宮角を解放するために卵管と子宮角の接合部をカット。
- コールド1Xリン酸緩衝生理食塩水(PBS)表示し、必要に応じてすすぎを含むペトリ皿に子宮角に置きます。添付された胚嚢を露出する正中線を経由して子宮角を切り開く。
- 胚を切断誤っ避け、胚を取得するために胎盤の接合部で胚嚢と胚を開いてカットします。冷PBSで二ペトリ皿に胚を置きます。氷に子宮角とペトリ皿を返します。
- D胸壁へのアクセスを改善するために胚をecapitate。ジェノタイピングが必要な場合、それを削除し、氷上に置いたエッペンドルフチューブに保存する尾を切った。
- その背中に胚では、心臓や肺を可視化するために胸壁を開いてカット。心臓を切断回避するために、肋骨の下部に水平カットに続いて前肢近く胸郭の側面に沿って垂直方向のカットを、確認してから、静かに道を持ち上げて胸壁を引っ張る。最大約胎生13.5を通じて、胸壁は、視覚化を助ける、透明になります。
- 慎重にピンセットを用いて心臓を持ち上げ、下に血管を切った。その後、心を解放するために大血管の上にカット。肺血管が切断されていない場合は、肺、心臓を除去することができる。必要であればこのように、肺のように、余分な組織を除去する。
- 心室から心房と大血管を分離して捨てる。はさみを使用して、小片(約1mm 3 <に心室をミンチ/>をSUP)、約500μlのコラゲナーゼ(滅菌PBSで1 mg / mlの)で開催。すべての心室がミンチとコラゲナーゼに配置されるまでサンプルを氷上で保管してください。
- 心室が別々のエッペンドルフチューブにそれぞれの心を集め、すべての胚から摘出されるまで、上記の手順を繰り返します。すべての胚は同じ遺伝子型を持っている場合、心は単一のエッペンドルフチューブにプールすることもできる。単一一度に処理サンプルの数は、分離に使用される磁石に基づいて制限することができ、ここで使用DynaMag(123-21D)は、16エッペンドルフチューブの最大値を保持する。
- 45分間ロッキングと37℃でみじん切り心室を置きます。 15分毎に、そっとサンプルを削除して、機械的に細胞を解離するために上下にピペッティングし。
4。内皮細胞を単離
- 細胞の残りの塊を除去するためにフィルターが70μmを通して心室-コラゲナーゼ溶液を渡します。
- 10分間400 xgで細胞を遠心分離。捨てる上清は、DMEMで約200μlの10%FBSと交換し、細胞を解離する上下ピペット。
- 一度前のステップを繰り返します。第二10%FBS / DMEM洗浄後10分間400 xgで細胞を遠心分離。 50μlの10%FBS / DMEMで細胞を再懸濁します。
- 最後の遠心分離工程の間に、ビーズを準備します。
- 1分間磁石上に抗体やビーズを含むエッペンドルフチューブを置きます。
- 磁石の代わりにチューブで、上清を除去します。磁石からチューブを取り外し、約100μlの10%FBS / DMEMを追加します。
- 1分間磁石上にチューブを置きます。上清を除去し、10%FBS / DMEMでもう一度洗う。 3回洗浄の合計に対して、この手順を繰り返します。
- 最終洗浄後、10%FBS / DMEM(サンプルあたり5μL)で抗体結合ビーズを再懸濁します。
- 各細胞試料に、抗体結合ビーズを5μlを追加します。ロッキングFOで4℃でビーズ細胞懸濁液を置きrは30分。
- 層流フード中で、1分間マグネットに細胞および抗体結合ビーズを含むエッペンドルフチューブを置く。上清を取り除き、磁石からチューブを取り外し、約100μlの10%FBS / DMEMで洗浄する。 5回の洗浄のために繰り返します。
- 最後の洗浄の後、1分間磁石上にチューブを置き、上清を除去し、磁石からチューブを取り外します。約100μlのDMEMを追加。
- 1分間磁石上にチューブを置き、上清を除去し、磁石からチューブを取り外します。 0.25%トリプシン-EDTAを温め100-200μLを加える。 37℃でサンプルをインキュベート℃、5分間、5%CO 2。
- 2分間磁石上にチューブを置きます。新鮮なエッペンドルフチューブに細胞を含む上清を慎重に移す。 400×gで5分間遠心分離します。
- 上清を取り除きます。予想される収量に応じて、または384ウェル扱わ培養皿 - 80-100μlの成長培地とプレート96で細胞を再懸濁し(E14.5-E16.5胚の心室から約450〜600細胞)。内皮細胞は、内皮細胞増殖培地(以下に定義)を使用します。
結果
CD31を認識する内皮細胞特異的抗体を使用して、内皮細胞が胚(E)13.5( 図1A)および18.5( 図1B-1D)の心室胚から単離した。未処理の培養皿で増殖させた場合、これらの細胞は丸められたままと近コンフルエント( 図1A)場合、石畳のパターンを形成するであろう。希薄コラーゲンはまた、ウェルコーティングするために使用されており、内皮細胞が( 図1B)に付着するが、それらはより少ない鎖を形成する際コラーゲンゲル上にめっき( 図1Cおよび1D)。ウェルコラーゲンゲルを含有する中で増殖させた内皮細胞( 図1Cおよび1D)フォーム細胞-細胞相互作用およびコラーゲンコートと比較して、コラーゲン上に成長したときに分岐するように開始し、コラーゲンゲル上に成長したときに、このプロセスがより速く発生するフォーム鎖プレート。これらの内皮鎖は血管内皮マーカーISO-レクチンと正のラベル( 図1D)。単離された細胞は培養液中で1週間まで生き延びるが、(でも37℃で1時間後)トリプシン処理に耐性が証明されている、したがって、彼らは最高の端末の実験に適しています。
E18.5心室から分離された内皮細胞はPECAM( 図2A)とFLK1( 図2B)で積極的にラベルを付けます。さらに、単離された内皮細胞は血管内皮特異的な蛍光色素SYTO-16を用いて標識することができます住んでいます。 図2Dは 、E14.5胚の心室から単離され、SYTO-16で標識した内皮細胞を示す。
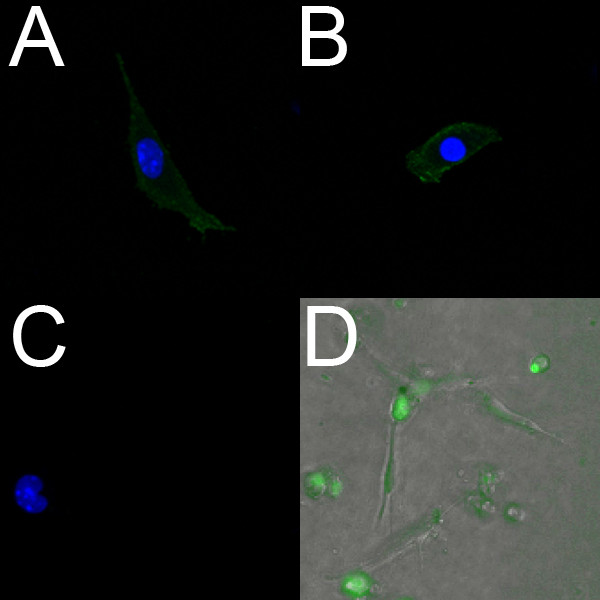
図1。コラーゲンゲル上に成長したときにマウス胎児脳室から分離された内皮細胞は鎖を形成。E13.5心Gからライブ孤立心室内皮細胞の(A)明10xの画像未処理の培養皿上rown;。でも48時間後、細胞はコラーゲンコートディッシュ上に成長E18.5心臓から固定孤立心室内皮細胞の丸みを帯びた(B)明10倍の画像のまま、24時間後に、いくつかの細胞が始まっている(矢印)が伸長し、それらのほとんどは、(矢印)丸みを帯びたままである。(C、D)コラーゲンゲル上に成長E18.5心臓から単離された固定心室内皮細胞の共焦点画像は、明視野(C)に示し、イソで標識レクチン(赤)。矢印はレクチン陽性細胞の一部を示す。 CDでのスケールバー=50μmである。
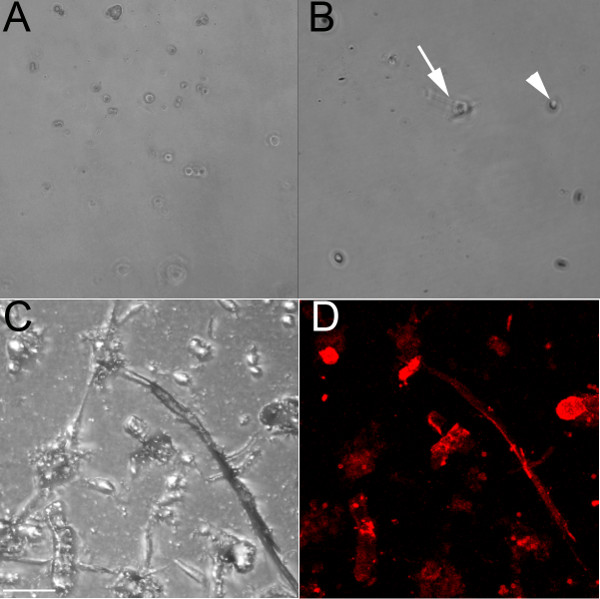
図2。上に成長E18.5心臓から血管内皮マーカーの積極マウス胎児脳室のラベルから分離された内皮細胞固定孤立心室内皮細胞の。(AC)共焦点画像(40倍)コラーゲンコートディッシュ。これらの細胞は、PECAM(A)及びFLK-1(B)に対して積極的に標識する;陰性対照(C)は 、蛍光を示さない。 ACで、核はDAPI(青)で標識されています。(D)E14.5心からのライブ孤立心室内皮細胞の蛍光オーバーレイ(10倍)コラーゲンゲル上に成長。細胞を生きた内皮マーカーSYTO-16(緑色)と共にインキュベートし、そして移行がタイムラプス顕微鏡を用いて観察した。
ディスカッション
プライマリー胚細胞での作業小説実験は、開発のin vitro重要なステップに対処することができます。しかし、単離手順は簡単ではありません。細胞はどのような種類の単離するための重要なステップは、細胞が十分にコラゲナーゼ消化により分離されていること、およびそれらがよく洗浄工程中に懸濁されることを確実に挙げられる。ピペッティングによる機械的切開が大幅コラゲナーゼステップ中に細胞を分離するのに役立ち、そしてフィルタリングステップは、細胞の塊を除去します。これらの手順では、人口の純度を向上させ、得られます。
播種密度も小さく器官からの細胞を単離する重要な関心事である。チューブの形成は、内皮細胞密度7に依存するため、我々は播種密度を高めるために384ウェル組織培養プレートに依存していた。これさえ考慮して、私達はより低い細胞密度(ダイアーとパターソン、プロでに対応するために、いくつかの分析を修正しなければならなかったグレス)。細胞数が懸念される場合にこのように、より小さいサイズの文化はよく問題を軽減することがあります。
初代細胞を単離する別の制限は、抗体の特異性である。例えばCD31でさえ認識内皮細胞特異的タンパク質は、しばしば線維芽8で表される。収穫された細胞数ではなくソーティングFACを可能にした場合は、内皮細胞および線維芽細胞を蛍光強度により分離することができた。しかし、胚内皮細胞の最近のFACソート分析は、この手法は、強力なものの、小さい器官9は適切でないかもしれないことを示唆している4つの全体E10.5胚は、mRNAの抽出のための十分な内皮細胞を生成するために必要。
FACソートが不可能な場合はしたがって、他の技術集団純度を向上させるために用いることができる。細胞は正につの抗体によって選択された2段階の選択プロセス、次いで負SEL二次抗体と結合する障害によってected、一つの代替アプローチです。線維芽細胞特異的マーカーFSP-1つの特定の候補者10となります。また、培地をL-バリンせずに注文することができ、かつ、D-バリンを代わりに追加することができます。線維芽細胞は、D-バリンを利用することができませんので、11,12に耐えません。
これらの制限や懸念にもかかわらず、主要な胚細胞集団を研究する発達過程のin vitroでの詳細な分析が可能になります。この技術は、胚の任意の器官または領域に適用され、細胞型が異なる胚の段階間で比較することができることができる。適切なスケーリング、一次電池であっても非常に小さな集団が得られ、分析することができる。これらの分析は、細胞の特定のサブセットの動作時間の経過とともにどのように変化するかに重要な洞察を提供する。
開示事項
著者は、彼らが競合する経済的利益を持っていないことを宣言します。
謝辞
我々は、重要な原稿の読み取り、タイムラプスイメージングの支援のためのUNCの顕微鏡サービス研究所、および資金調達をサポートするためのNIH(助成金#R01HL061656)がアンドレアPortburyのに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Timed-pregnant mice | To be dissected at the embryonic stage of interest | ||
| Anti-mouse CD31 | BD Bioscience | 553370 | |
| Rat IgG Dynabeads | Invitrogen | 110-35 | |
| Collagen | BD Bioscience | 354236 | |
| PBS (1x) | |||
| Collagenase, type I | Worthington Biochemical | LS004196 | |
| DMEM | Cellgro | ||
| FBS | Sigma-Aldrich | F2442 | |
| Endothelial cell growth medium | (made in lab as described in notes) | DMEM containing 20% FBS, 5 μM β-mercapt–thanol, 50 μg/ml ECG, and 1x penicillin/streptomycin | |
| β-mercapt–thanol | Sigma-Aldrich | M6250 | |
| ECGS | Biomedical Technologies, Inc. | BT-203 | |
| Penicillin-Streptomycin | Gibco | 15140 | |
| Trypsin-EDTA | Gibco | 25300 | |
| 384-well culture plate | Greiner | T-3037-6 | Plate was prepared with a thin collagen gel, as described in 6; working surface area 10 mm2 |
| Collagen type I | BD | 354236 | Use at a final concentration of 1.5 mg/ml |
| M199, 10x | Invitrogen | 11825-015 | |
| Syto-16 | Invitrogen | S7578 | Used as directed in 13 |
| EQUIPMENT | |||
| Stereoscopic microscope | Nikon | SMZ645 | |
| Cell culture incubator | Thermo | 3110 | |
| DynaMag | Invitrogen | 123-21D | |
| Table-top centrifuge | Thermo | 75002430 | |
参考文献
- Landecker, H. . Culturing Life: How Cells Became Technologies. , (2007).
- Kan, C. Y., Wen, V. W., et al. Endothelial cell dysfunction and cytoskeletal changes associated with repression of p16(INK4a) during immortalization. Oncogene. , (2012).
- Dyer, L. A., Patterson, C. Development of the endothelium: an emphasis on heterogeneity. Semin. Thromb. Hemost. 36, 227-235 (2010).
- Dong, Q. G., Bernasconi, S., et al. A general strategy for isolation of endothelial cells from murine tissues. Characterization of two endothelial cell lines from the murine lung and subcutaneous sponge implants. Arteriosclerosis, Thrombosis, and Vascular Biology. 17, 1599-1604 (1997).
- van Beijnum, J. R., Rousch, M., Castermans, K., vander Linden, E., Griffioen, A. W. Isolation of endothelial cells from fresh tissues. Nat. Protoc. 3, 1085-1091 (2008).
- Runyan, R. B., Markwald, R. R. Invasion of mesenchyme into three-dimensional collagen gels: a regional and temporal analysis of interaction in embryonic heart tissue. Dev. Biol. 95, 108-114 (1983).
- Arnaoutova, I., Kleinman, H. K. In vitro angiogenesis: endothelial cell tube formation on gelled basement membrane extract. Nat. Protoc. 5, 628-635 (2010).
- Zeisberg, E. M., Potenta, S. E., Sugimoto, H., Zeisberg, M., Kalluri, R. Fibroblasts in kidney fibrosis emerge via endothelial-to-mesenchymal transition. Journal of the American Society of Nephrology : JASN. 19, 2282-2287 (2008).
- Chang, L., Noseda, M. Differentiation of vascular smooth muscle cells from local precursors during embryonic and adult arteriogenesis requires Notch signaling. PNAS. 109, 5993-6998 (2012).
- Fehrenbach, M. L., Cao, G., Williams, J. T., Finklestein, J. M., DeLisser, H. M. Isolation of murine lung endothelial cells. American Journal of Physiology: Lung Cellular and Molecular Physiology. 296, L1095-L1103 (2009).
- Frauli, M., Ludwig, H. Inhibition of fibroblast proliferation in a culture of human endometrial stromal cells using a medium containing D-valine. Archives of Gynecology and Obstetrics. , 241-96 (1987).
- Lazzaro, V. A., Walker, R. J., et al. Inhibition of fibroblast proliferation in L-valine reduced selective media. Research communications in chemical pathology and pharmacology. 75, 39-48 (1992).
- Arima, S., Nishiyama, K., et al. Angiogenic morphogenesis driven by dynamic and heterogeneous collective endothelial cell movement. Development. 138, 4763-4776 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved