Method Article
Aislamiento de células endoteliales embrionarias ventriculares
En este artículo
Resumen
Cultivo celular primaria es una técnica útil para el análisis de poblaciones específicas de células, en particular a partir de embriones de ratones transgénicos en etapas de desarrollo específicas. En esto, los ventrículos embrionarias se disecan y se disociaron, y los granos de anticuerpos conjugados reconocen y se separan las células endoteliales para su posterior análisis.
Resumen
Cultivo celular ha mejorado en gran medida nuestra capacidad para evaluar las poblaciones individuales de las células bajo condiciones de cultivo innumerables. Mientras que las líneas celulares inmortalizadas ofrecen ventajas significativas para su facilidad de uso, estas líneas celulares no están disponibles para todos los tipos de células potenciales. Al aislar las células primarias de una región específica de interés, en particular de un ratón transgénico, se pueden realizar estudios más matizadas. La técnica básica consiste en la disección del órgano u órgano parcial de interés (por ejemplo, el corazón o de una región específica del corazón) y disociar el órgano a las células individuales. Estas células se incuban a continuación con perlas magnéticas conjugadas con un anticuerpo que reconoce el tipo de célula de interés. Las células de interés se pueden aislar con el uso de un imán, con una breve incubación con tripsina disociar las células de las perlas. Estas células aisladas pueden cultivarse a continuación, y se analizaron como se desee. Esta técnica fue diseñada originalmente para órgano ratón adultos pero se puede escalar fácilmente hacia abajo para su uso con órganos embrionarios, como se demuestra en este documento. Debido a que nuestro interés se centra en el desarrollo de la vasculatura coronaria, queríamos estudiar esta población de células durante las fases embrionarias específicas. Por lo tanto, el protocolo original tuvo que ser modificado para ser compatible con el pequeño tamaño de los ventrículos embrionarias y el bajo rendimiento potencial de las células endoteliales en estas etapas de desarrollo. Utilizando este enfoque a escala reducida, hemos evaluado la remodelación del plexo coronaria en las células endoteliales ventriculares embrionarias transgénicas.
Introducción
La llegada de las líneas celulares inmortalizadas ha revolucionado la biología celular básica 1. Las líneas celulares disponibles en la actualidad son derivados de una amplia gama de órganos y abarcan todos los tipos de células principales. Sin embargo, las líneas celulares establecidas tienen algunas limitaciones. El proceso de inmortalización, obviamente, cambia el comportamiento de las células, específicamente con respecto a la duración de la vida y la proliferación, sino que también puede afectar a la expresión de las proteínas inesperados, tales como las proteínas del citoesqueleto 2. Además, aunque muchos diferentes líneas celulares están disponibles, existe una diversidad significativa entre incluso un solo tipo de células dentro de un organismo entero. Las células endoteliales, en particular, muestran diversos comportamientos en función de si se alinean las arterias o las venas y el tipo de flujo está presente en el recipiente 3. Incluso más apremiante de una perspectiva de desarrollo, sin embargo, es que la gran mayoría de las líneas celulares disponibles se derivan de tejido adulto (ver, por ejemplo, tque de recogida disponible a través de ATCC). Estas líneas de células adultas probablemente no recapitulan la naturaleza dinámica de sus precursores embrionarios. El rápido cambio espacio-temporales patrones de expresión génica observados durante el desarrollo también sugieren que una célula endotelial de un órgano a la etapa de desarrollo determinado puede no comportarse de la misma manera que una célula endotelial a partir de ese mismo órgano en una etapa de desarrollo diferente.
Como una alternativa al uso de líneas celulares inmortalizadas disponibles comercialmente, las células primarias pueden ser aislados a partir del tejido específico de interés. Entre las ventajas de esta técnica, estas células primarias se pueden aislar a partir de un órgano específico o incluso parte de un órgano en cualquier etapa de desarrollo específico. Además, estas células primarias se pueden aislar a partir de la amplia variedad de animales transgénicos disponibles, lo que permite el estudio in vitro del gen knockout y knock-in evitando al mismo tiempo otros problemas tales como la eficiencia de transfección en. No es sorprendente que muchostécnicas se han publicado que detalla cómo aislar determinados tipos de células 4,5. En general, estas técnicas implican la recogida de la región de interés, disociar las células de marcado, el tipo específico de célula de interés, y el aislamiento de las células para su posterior análisis.
Para estudiar una población embrionario temprano de las células endoteliales coronarias, que en escala una técnica publicada previamente 4 para su uso con un órgano más pequeño. Con este procedimiento a escala reducida, podemos aislar las células endoteliales coronarias del corazón embrionario en las etapas embrionarias específicas. Estas células pueden entonces ser usados en ensayos de endoteliales tradicionales, tales como los análisis de migración. Hasta que las líneas de células embrionarias tempranas cada vez más frecuentes, en colaboración con las pilas es una técnica muy valiosa.
Protocolo
1. Prepare los granos de anticuerpos conjugados
- Un día antes de la disección, se combinan el anticuerpo de elección con los Dynabeads apropiadas (por ejemplo, rata Dynabeads IgG para un anticuerpo producido en la rata, 4 x 10 8 cuentas / ml) según las instrucciones del fabricante. Para la rata anti-CD31 anticuerpo BD (0,5 g / l, que se utiliza para aislar las células endoteliales), se añadió 3 l de anticuerpo por cada 25 l perlas, para una concentración final de 1,5 mg anticuerpo anti-CD31 y 1 x 10 7 / perlas 25 l de tampón.
- Incubar los granos y de anticuerpos durante la noche a 4 ° C.
2. Preparación de la placa de colágeno
- Células aisladas forman túbulos más rápidamente cuando se cultivan en un gel de colágeno en comparación con simplemente una placa recubierta con colágeno. Por lo tanto, los geles de colágeno se hizo la noche antes de la disección, como se describe en 6. En el hielo en una campana de cultivo de tejidos, se combinan los siguientes reactivos (suficiente para 19 pozos): 206,4 l estéril H 2 S, 140,4 l de colágeno tipo I (4,08 mg / ml), 38,4 l 10x M199, y 1,15 l de NaOH 5 M.
- Pipetear 20 l de este gel de colágeno en los pocillos de una placa de cultivo de tejidos de 384 pocillos. Colocar la placa en un 37 ° C incubadora de cultivo de tejido durante 30 min.
- Añadir 80 l de DMEM a cada pocillo e incubar durante 15 min a 37 ° C. Retire el medio de cultivo y repetir dos veces más.
- Después del enjuague final, añadir 80 l 10% de FBS / DMEM a cada pocillo e incubar durante la noche a 37 ° C. Retirar el medio de cultivo antes de la adición de las células aisladas.
3. Impuestos y digerir el Corazón
- La eutanasia a un ratón de disolución-embarazada en el día embrionario deseado usando una técnica de eutanasia aprobada. Todos los experimentos fueron aprobados por el Cuidado de Animales institucional y el empleo Comisión de la Universidad de Carolina del Norte en Chapel Hill.
- Con el ratón en una posición supina, liberalmente rociar el lado ventral de la hembra con etanol al 70% antes de ladisección. Con unas pinzas para levantar la piel del abdomen inferior y el músculo fuera de los órganos internos, a cielo abierto la cavidad abdominal de la hembra para visualizar los órganos internos.
- Sosteniendo el cuello uterino con una pinza, corta cuidadosamente caudal a los fórceps y comenzar el levantamiento de la trompa uterina de la cavidad abdominal. Mientras levanta el cuerno uterino, cortar cualquier tejido conectivo que sostiene el cuerno en su lugar. Para terminar de extirpar el cuerno uterino, corte la unión del cuello uterino con el oviducto para liberar el cuerno uterino.
- Coloque el cuerno uterino en una placa de Petri que contiene frío 1x solución salina tamponada con fosfato (PBS) y enjuague según sea necesario. Cortar el cuello uterino a través de la línea media para exponer los sacos embrionarios adjuntos.
- Cortar un saco embrionario en la unión de la placenta y el embrión para evitar que accidentalmente cortar el embrión y recuperar un embrión. Coloque el embrión en una segunda placa de Petri con PBS frío. Devuelva la placa de Petri con el cuerno uterino en hielo.
- Decapitate el embrión para mejorar el acceso a la pared torácica. Si genotipado es necesario, cortar la cola a quitar y guardar en un tubo Eppendorf se coloca en hielo.
- Con el embrión en su parte posterior, cortar y abrir la pared torácica para visualizar el corazón y los pulmones. Para evitar que se corte el corazón, hacer un corte vertical a lo largo del lado de la caja torácica, cerca de una extremidad anterior, seguido de un corte horizontal a través de la parte inferior de las costillas y, a continuación, tire suavemente de la pared del pecho hacia arriba y fuera del camino. Up hasta aproximadamente el día embrionario 13.5, la pared torácica es transparente, ayudando en la visualización.
- Levante con cuidado el corazón con las pinzas y cortar los vasos a continuación. Luego, corte por encima de los grandes vasos para liberar el corazón. Si los vasos pulmonares no se cortan, los pulmones se pueden eliminar con el corazón. Por lo tanto, eliminar los tejidos extraños, como los pulmones, si es necesario.
- Separar y desechar los vasos aurículas y grande de los ventrículos. Con unas tijeras, picar los ventrículos en trozos pequeños (aproximadamente 1 mm 3 </ Sup>) y el lugar en aproximadamente 500 l de colagenasa (1 mg / ml en PBS estéril). Mantener las muestras en hielo hasta que los ventrículos se han picado y se coloca en la colagenasa.
- Repetir los pasos anteriores hasta que los ventrículos se han extirpado de todos los embriones, la recogida de cada corazón en un tubo Eppendorf separado. Si todos los embriones tienen el mismo genotipo, corazones puedan ser agrupados en un solo tubo Eppendorf. El número de muestras procesadas en un solo tiempo puede ser limitado con base en el imán utilizado para el aislamiento, la dynamag (123-21D) que se utiliza aquí tiene un máximo de 16 tubos Eppendorf.
- Coloque los ventrículos picada a 37 ° C con agitación durante 45 min. Cada 15 minutos, retire suavemente las muestras y la pipeta hacia arriba y abajo para disociar mecánicamente las células.
4. Aislamiento de las células endoteliales
- Pasar la solución ventrículo-colagenasa a través de un filtro de 70 micras para eliminar grupos restantes de las células.
- Centrifugar las células a 400 xg durante 10 min. Descartarel sobrenadante, reemplace con aproximadamente 200 l FBS al 10% en DMEM, y la pipeta hacia arriba y abajo para disociar las células.
- Repita el paso anterior una vez. Centrifugar las células a 400 xg durante 10 min después de la segunda 10% de FBS / DMEM lavado. Resuspender las células en 50 l 10% de FBS / DMEM.
- Durante el paso final de la centrifugación, preparar las perlas.
- Colocar el tubo Eppendorf que contiene el anticuerpo y perlas en un imán durante 1 min.
- Con el tubo en su lugar en el imán, eliminar el sobrenadante. Retire el tubo del imán y añadir aproximadamente 100 l 10% FBS / DMEM.
- Colocar el tubo en el imán durante 1 min. Eliminar el sobrenadante, y se lava de nuevo con 10% de FBS / DMEM. Repita para un total de 3 lavados.
- Después del último lavado, resuspender las perlas de anticuerpo-conjugados en 10% de FBS / DMEM (5 l por muestra).
- Para cada muestra de células, añadir 5 l de las perlas de anticuerpo-conjugados. Coloque las suspensiones del grano de células a 4 º C con balanceo FOr 30 min.
- En una campana de flujo laminar, colocar los tubos Eppendorf que contienen las células y los granos de anticuerpos conjugados en el imán durante 1 min. Eliminar el sobrenadante, retirar los tubos del imán, y se lava con aproximadamente 100 l 10% FBS / DMEM. Repita por 5 lavados.
- Después del último lavado, se colocan los tubos en el imán durante 1 min, eliminar el sobrenadante, y quitar los tubos del imán. Añadir aproximadamente 100 l de DMEM.
- Colocar los tubos en el imán durante 1 min, eliminar el sobrenadante, y quitar los tubos del imán. Añadir 100-200 l precalentado 0,25% de tripsina-EDTA. Incubar las muestras a 37 ° C y CO2 al 5% durante 5 min.
- Colocar los tubos en el imán durante 2 min. Transferir con cuidado el sobrenadante que contiene células a tubos Eppendorf frescos. Centrifugar durante 5 min a 400 x g.
- Eliminar el sobrenadante. Resuspender las células en 80-100 l de medio de crecimiento y la placa en un 96 - o 384 pocillos placa de cultivo tratadas, dependiendo del rendimiento esperado(Aproximadamente 450-600 células de los ventrículos de embriones E14.5-E16.5). Para las células endoteliales, utilizar medio de cultivo de crecimiento endotelial (definido a continuación).
Resultados
Uso de un anticuerpo endotelial-específico que reconoce CD31, las células endoteliales se aislaron de los ventrículos del embrionarias (E) 13,5 (Figura 1A) y 18.5 (Figuras 1B-1D) embriones. Cuando se cultiva en una placa de cultivo sin tratar, estas células siguen siendo redondeadas y formarían un patrón de adoquines si confluente cerca (Figura 1A). Diluir colágeno también se ha utilizado para recubrir los pozos, y mientras que las células endoteliales se adherirá a la misma (Figura 1B), que forman un menor número de cadenas que cuando se colocaron en placas sobre un gel de colágeno (Figuras 1C y 1D). Las células endoteliales cultivadas en un pocillo que contiene un gel de colágeno (Figuras 1C y 1D) interacciones célula-célula de formulario y cadenas de forma que comienzan a expandirse cuando se cultiva en el colágeno, y este proceso se produce más rápido cuando se cultivan en el gel de colágeno en comparación con el colágeno recubierto plato. Estas cadenas endoteliales etiquetar positivamente con el marcador endotelial iso-lectina ( Figura 1D). Las células aisladas sobreviven hasta 1 semana en cultivo, pero han demostrado ser resistentes a la tripsinización (incluso después de 1 hora a 37 ° C), por lo que son los más adecuados para experimentos terminales.
Las células endoteliales aisladas a partir de E18.5 ventrículos etiquetar positivamente con PECAM (Figura 2A) y Flk1 (Figura 2B). Además, en vivo las células endoteliales aisladas pueden ser etiquetados utilizando el tinte fluorescente endotelial específico de Syto-16. Figura 2D muestra células endoteliales que fueron aisladas de los ventrículos de un embrión E14.5 y se marcaron con Syto-16.
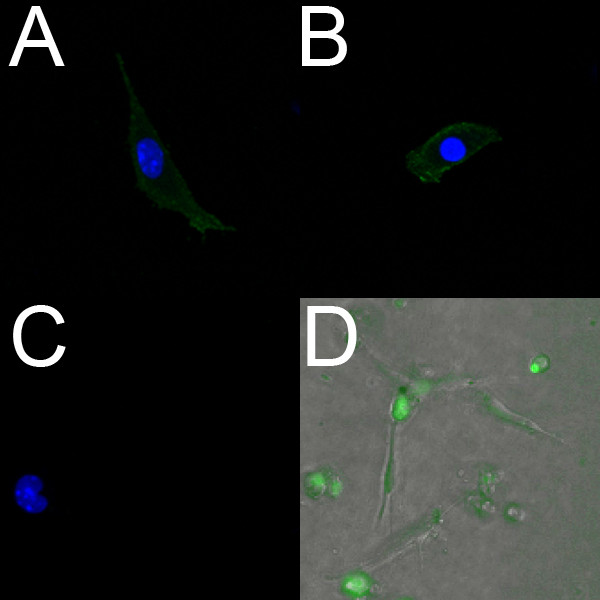
Figura 1. Las células endoteliales aisladas de embriones de ratón ventrículos forman cadenas cuando se cultivan en un gel de colágeno. (A) Campo claro la imagen de 10x aisladas células endoteliales ventriculares en vivo de un corazón g E13.5Rown en una placa de cultivo sin tratamiento, incluso después de 48 horas, las células permanecen redondeadas (B) Campo claro la imagen 10 veces de las células endoteliales ventriculares aislados fijos de un corazón E18.5 cultivado en una placa recubierta con colágeno,. después de 24 horas, algunas células han comenzado alargando (flecha), pero la mayoría de ellos siendo redondeado (punta de flecha). (C, D) Las imágenes confocales de células endoteliales ventriculares aisladas fijas de un corazón E18.5 crecido en un gel de colágeno, se muestra en campo claro (C) y se marcaron con iso -lectina (rojo). Las flechas indican algunas de las células lectina-positivos. Las barras de escala en CD = 50 micras.
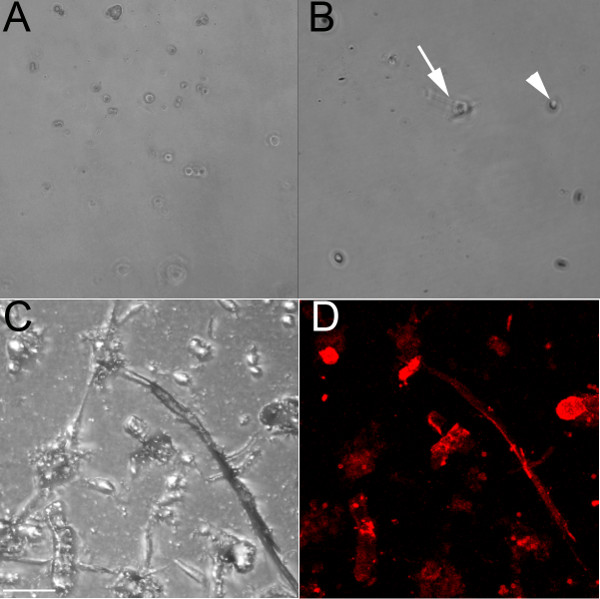
Figura 2. Las células endoteliales aisladas de ventrículos embrionarias de ratón etiqueta positiva para los marcadores endoteliales. (AC) Confocal imágenes (40x) de las células endoteliales ventriculares aislados fijos de un corazón E18.5 crecido enun plato revestido con colágeno. Estas células etiquetar positivamente para PECAM (A) y Flk-1 (B), el control negativo (C) no muestra ninguna fluorescencia. En AC, los núcleos están etiquetados con DAPI (azul). (D) superposición fluorescente (10x) de células endoteliales aisladas ventriculares en vivo de un corazón E14.5 cultiva en un gel de colágeno. Se incubaron las células con el marcador endotelial vivo Syto-16 (verde), y la migración se observó mediante microscopía de lapso de tiempo.
Discusión
La investigación con células embrionarias primarias permite experimentos novedosos para abordar en etapas críticas del desarrollo in vitro. Sin embargo, el procedimiento de aislamiento no es trivial. Los pasos críticos para el aislamiento de cualquier tipo de células incluyen asegurar que las células están bien separados tras la digestión de colagenasa y luego de que están bien suspendidos durante los pasos de lavado. Disección mecánica mediante pipeteo en gran medida ayuda a separar las células durante la etapa de colagenasa, y la etapa de filtración elimina los grupos de células. Estas medidas mejoran la pureza y el rendimiento de la población.
La densidad de placas es también una preocupación significativa cuando se aíslan células de un órgano pequeño. Debido a la formación de tubo endotelial es dependiente de la densidad celular 7, que se basó en placas de cultivo tisular de 384 pocillos para aumentar nuestra densidad de placas. A pesar de esta consideración, hemos tenido que modificar algunos análisis para adaptarse a una menor densidad celular (Dyer y Patterson, en proGress). Por lo tanto, si el número de células es una preocupación, una cultura de tamaño más pequeño bien contribuir a reducir el problema.
Otra limitación de aislamiento de células primarias es la especificidad del anticuerpo. Incluso un endotelial de la proteína-específico reconocido como el CD31 se expresa a veces por los fibroblastos 8. Si el número de células cosechadas permite la clasificación FAC lugar, a continuación, las células endoteliales y los fibroblastos podrían estar separados por la intensidad de fluorescencia. Sin embargo, un reciente análisis de clasificación FAC de células endoteliales embrionarias requiere cuatro embriones E10.5 enteras para producir suficientes células endoteliales para la extracción de ARNm, lo que sugiere que esta técnica, aunque potente, puede no ser apropiado para los órganos más pequeños 9.
Por lo tanto, si la clasificación FAC no es factible, otras técnicas se pueden emplear para mejorar la pureza de la población. Un proceso de selección de dos etapas, en el que las células se seleccionan positivamente por un anticuerpo y, a continuación negativamente selejadas por el fracaso para unirse a un segundo anticuerpo, es un enfoque alternativo. El marcador de fibroblastos específica FSP-1 sería un candidato en particular 10. Alternativamente, el medio de cultivo se puede ordenar sin L-valina, y D-valina se puede agregar en su lugar; fibroblastos son incapaces de utilizar D-valina y por lo tanto no sobreviven 11,12.
A pesar de estas limitaciones y preocupaciones, el estudio de las poblaciones de células embrionarias primarias permite un detallado análisis in vitro de los procesos de desarrollo. Esta técnica se puede aplicar a cualquier órgano o región del embrión y permite un tipo de célula a ser comparado a través de diferentes etapas embrionarias. Con la escala apropiada, incluso muy pequeñas poblaciones de células primarias pueden ser obtenidos y analizados. Estos análisis proporcionan información valiosa sobre la forma en subconjuntos específicos de células se comportan y cambian con el tiempo.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Nos gustaría dar las gracias a Andrea Portbury para la lectura crítica del manuscrito, el Laboratorio de Servicio de microscopio de UNC para obtener ayuda con el time-lapse y el NIH (subvención # R01HL061656) de apoyo financiero.
Materiales
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Timed-pregnant mice | To be dissected at the embryonic stage of interest | ||
| Anti-mouse CD31 | BD Bioscience | 553370 | |
| Rat IgG Dynabeads | Invitrogen | 110-35 | |
| Collagen | BD Bioscience | 354236 | |
| PBS (1x) | |||
| Collagenase, type I | Worthington Biochemical | LS004196 | |
| DMEM | Cellgro | ||
| FBS | Sigma-Aldrich | F2442 | |
| Endothelial cell growth medium | (made in lab as described in notes) | DMEM containing 20% FBS, 5 μM β-mercapt–thanol, 50 μg/ml ECG, and 1x penicillin/streptomycin | |
| β-mercapt–thanol | Sigma-Aldrich | M6250 | |
| ECGS | Biomedical Technologies, Inc. | BT-203 | |
| Penicillin-Streptomycin | Gibco | 15140 | |
| Trypsin-EDTA | Gibco | 25300 | |
| 384-well culture plate | Greiner | T-3037-6 | Plate was prepared with a thin collagen gel, as described in 6; working surface area 10 mm2 |
| Collagen type I | BD | 354236 | Use at a final concentration of 1.5 mg/ml |
| M199, 10x | Invitrogen | 11825-015 | |
| Syto-16 | Invitrogen | S7578 | Used as directed in 13 |
| EQUIPMENT | |||
| Stereoscopic microscope | Nikon | SMZ645 | |
| Cell culture incubator | Thermo | 3110 | |
| DynaMag | Invitrogen | 123-21D | |
| Table-top centrifuge | Thermo | 75002430 | |
Referencias
- Landecker, H. . Culturing Life: How Cells Became Technologies. , (2007).
- Kan, C. Y., Wen, V. W., et al. Endothelial cell dysfunction and cytoskeletal changes associated with repression of p16(INK4a) during immortalization. Oncogene. , (2012).
- Dyer, L. A., Patterson, C. Development of the endothelium: an emphasis on heterogeneity. Semin. Thromb. Hemost. 36, 227-235 (2010).
- Dong, Q. G., Bernasconi, S., et al. A general strategy for isolation of endothelial cells from murine tissues. Characterization of two endothelial cell lines from the murine lung and subcutaneous sponge implants. Arteriosclerosis, Thrombosis, and Vascular Biology. 17, 1599-1604 (1997).
- van Beijnum, J. R., Rousch, M., Castermans, K., vander Linden, E., Griffioen, A. W. Isolation of endothelial cells from fresh tissues. Nat. Protoc. 3, 1085-1091 (2008).
- Runyan, R. B., Markwald, R. R. Invasion of mesenchyme into three-dimensional collagen gels: a regional and temporal analysis of interaction in embryonic heart tissue. Dev. Biol. 95, 108-114 (1983).
- Arnaoutova, I., Kleinman, H. K. In vitro angiogenesis: endothelial cell tube formation on gelled basement membrane extract. Nat. Protoc. 5, 628-635 (2010).
- Zeisberg, E. M., Potenta, S. E., Sugimoto, H., Zeisberg, M., Kalluri, R. Fibroblasts in kidney fibrosis emerge via endothelial-to-mesenchymal transition. Journal of the American Society of Nephrology : JASN. 19, 2282-2287 (2008).
- Chang, L., Noseda, M. Differentiation of vascular smooth muscle cells from local precursors during embryonic and adult arteriogenesis requires Notch signaling. PNAS. 109, 5993-6998 (2012).
- Fehrenbach, M. L., Cao, G., Williams, J. T., Finklestein, J. M., DeLisser, H. M. Isolation of murine lung endothelial cells. American Journal of Physiology: Lung Cellular and Molecular Physiology. 296, L1095-L1103 (2009).
- Frauli, M., Ludwig, H. Inhibition of fibroblast proliferation in a culture of human endometrial stromal cells using a medium containing D-valine. Archives of Gynecology and Obstetrics. , 241-96 (1987).
- Lazzaro, V. A., Walker, R. J., et al. Inhibition of fibroblast proliferation in L-valine reduced selective media. Research communications in chemical pathology and pharmacology. 75, 39-48 (1992).
- Arima, S., Nishiyama, K., et al. Angiogenic morphogenesis driven by dynamic and heterogeneous collective endothelial cell movement. Development. 138, 4763-4776 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados