Method Article
Isolement des cellules endothéliales embryonnaires ventriculaires
Dans cet article
Résumé
La culture de la cellule primaire est une technique utile pour l'analyse de populations spécifiques de cellules, en particulier à partir d'embryons de souris transgéniques à des stades spécifiques du développement. Ici, ventricules embryonnaires sont disséqués et dissociées, et des perles anticorps conjugués à reconnaître et séparer les cellules endothéliales pour une analyse ultérieure.
Résumé
La culture cellulaire a grandement amélioré notre capacité à évaluer les différentes populations de cellules dans des conditions de culture innombrables. Alors que des lignées cellulaires immortalisées offrent des avantages significatifs pour leur facilité d'utilisation, ces lignées cellulaires ne sont pas disponibles pour tous les types cellulaires potentiels. En isolant les cellules primaires à partir d'une région d'intérêt, en particulier à partir d'une souris transgénique, des études plus nuancées peuvent être effectuées. La technique de base consiste à disséquer l'organe ou partielle d'intérêt (par exemple le cœur ou une région spécifique du cœur) et dissocier l'organe de cellules individuelles. Ces cellules sont ensuite incubées avec des billes magnétiques conjuguées avec un anticorps qui reconnaît le type de cellule d'intérêt. Les cellules d'intérêt peuvent alors être isolées à l'aide d'un aimant, par une courte incubation de la trypsine dissocier les cellules à partir des perles. Ces cellules isolées peuvent alors être cultivées et analysées comme vous le souhaitez. Cette technique a été conçu à l'origine pour orgue de souris adultes, mais peut être facilement réduite pour une utilisation avec les organes embryonnaires, comme le démontre le présent document. Parce que notre intérêt est dans le système vasculaire coronarien développement, nous avons voulu étudier cette population de cellules embryonnaires au cours des étapes spécifiques. Ainsi, le protocole initial a dû être modifié pour être compatible avec la petite taille des ventricules embryonnaires et le faible rendement potentiel des cellules endothéliales à ces stades de développement. En utilisant cette approche à échelle réduite, nous avons évalué coronaire remodelage plexus dans les cellules endothéliales transgéniques ventriculaires embryonnaires.
Introduction
L'avènement de lignées cellulaires immortalisées a révolutionné la biologie cellulaire de base 1. Les lignées cellulaires actuellement disponibles sont issus d'un large éventail d'organes et englobent tous les principaux types de cellules. Cependant, les lignées cellulaires établies ont certaines limites. Le processus d'immortalisation change évidemment le comportement des cellules, en particulier en ce qui concerne la durée de vie et la prolifération, mais peut également affecter l'expression des protéines inattendus, tels que les protéines du cytosquelette 2. En outre, bien que de nombreuses lignées cellulaires différentes sont disponibles, il ya une diversité importante chez un même type de cellule unique dans un organisme entier. Les cellules endothéliales en particulier montrent divers comportements selon qu'elles ligne artères ou des veines et quel type de flux est présent dans la cuve 3. Encore plus pressant dans une perspective développementale, cependant, est que la grande majorité des lignées cellulaires disponibles sont dérivées de tissus adultes (voir, par exemple til collecte disponible via ATCC). Ces lignées de cellules adultes susceptibles ne récapitulent la nature dynamique de leurs précurseurs embryonnaires. L'évolution rapide des modes d'expression des gènes au cours du développement spatio-temporelles observées suggèrent également qu'une cellule endothéliale d'un organe à un stade de développement donné peut ne pas se comporter de la même manière qu'une cellule endothéliale de ce même organe à un stade de développement différent.
Comme alternative à l'utilisation de lignées cellulaires immortalisées disponibles dans le commerce, les cellules primaires peuvent être isolées à partir du tissu d'intérêt spécifique. Parmi les avantages de cette technique, ces cellules primaires peuvent être isolés à partir d'un organe spécifique ou même une partie d'un organe à n'importe quel stade de développement spécifique. En outre, ces cellules primaires peuvent être isolés de la grande variété d'animaux transgéniques disponibles, permettant l'étude in vitro des huitièmes de finale de gènes et knock-in tout en évitant d'autres problèmes tels que l'efficacité de la transfection in. Sans surprise, de nombreuxtechniques ont été publiés en détail comment isoler des types cellulaires spécifiques 4,5. En général, ces techniques consistent à recueillir la région d'intérêt, dissocier les cellules, le marquage du type de cellule spécifique d'intérêt, et d'isoler ces cellules pour une analyse ultérieure.
Pour étudier une population embryonnaire précoce des cellules endothéliales coronaires, on ramenait une technique 4 précédemment publié pour être utilisé avec un organe plus petit. Avec cette procédure allégée, nous pouvons isoler les cellules endothéliales coronaires du cœur embryonnaire à des stades embryonnaires spécifiques. Ces cellules peuvent ensuite être utilisés dans des essais endothéliales traditionnelles, telles que les analyses de migration. Jusqu'à ce que les lignées cellulaires embryonnaires deviennent plus nombreux, en collaboration avec les cellules primaires est une technique précieuse.
Protocole
1. Préparer Perles anticorps conjugués
- Un jour avant la dissection, mélanger l'anticorps de choix avec les Dynabeads appropriées (par exemple Dynabeads IgG de rat pour un anticorps dirigé chez le rat, 4 x 10 8 perles / ml) selon les instructions du fabricant. Pour l'anticorps anti-CD31 anticorps de rat BD (0,5 pg / pl, utilisé pour isoler des cellules endothéliales), trois anticorps pi est ajouté pour 25 perles pl, pour une concentration finale de 1,5 mg d'anticorps anti-CD31 et 1 x 10 7 perles / 25 pi de tampon.
- Incuber des perles et des anticorps nuit à 4 ° C.
2. Préparation de la plaque de collagène
- Cellules isolées forment tubules plus rapidement lorsqu'il est cultivé sur un gel de collagène au lieu de simplement une plaque revêtue de collagène. Par conséquent, des gels de collagène sont effectués la nuit avant la dissection, comme décrit dans 6. Sur la glace dans une hotte de culture de tissus, mélanger les réactifs suivants (assez pour 19 puits): 206,4 pi H stérile 2 O, 140,4 pi de collagène de type I (4,08 mg / ml), 38,4 ul 10x M199, et 1,15 pi 5 M NaOH.
- Pipeter 20 ul de ce gel de collagène dans les puits d'une plaque de culture tissulaire à 384 puits. Placer la plaque dans un 37 ° C incubateur de culture tissulaire pendant 30 min.
- Ajouter 80 ul DMEM à chaque puits et incuber pendant 15 min à 37 ° C. Retirez le milieu de culture et répéter deux fois plus.
- Après le rinçage final, ajouter 80 ul 10% de FBS / DMEM à chaque puits et incuber pendant la nuit à 37 ° C. Supprimer le milieu de culture avant l'addition des cellules isolées.
3. Accise et de digérer le Cœur
- Euthanasier une souris timed-enceinte au jour embryonnaire désirée à l'aide d'une technique d'euthanasie approuvé. Toutes les expériences ont été approuvées par le soin des animaux et du Comité institutionnel d'utilisation à l'Université de Caroline du Nord à Chapel Hill.
- Avec la souris en position couchée, généreusement pulvériser la face ventrale de la femelle à l'éthanol 70% avantdissection. En utilisant une pince pour soulever la peau de l'abdomen inférieur et le muscle à l'écart des organes internes, coupé ouvrir la cavité abdominale inférieure de la femelle de visualiser les organes internes.
- En tenant le col de l'utérus avec une pince, découpez soigneusement caudale à la pince de levage et de commencer la corne utérine de la cavité abdominale. Tout en soulevant la corne utérine, couper n'importe quel tissu conjonctif qui tient la corne en place. Pour finir exciser la corne utérine, couper la jonction de la corne utérine avec l'oviducte pour libérer la corne utérine.
- Placez la corne utérine dans une boîte de Pétri contenant froid 1x saline tamponnée au phosphate (PBS) et rincer si nécessaire. Couper la corne utérine via la ligne médiane pour exposer les sacs embryonnaires joints.
- Couper un sac embryonnaire à la jonction du placenta et de l'embryon pour éviter de couper accidentellement l'embryon et récupérer un embryon. Placez l'embryon dans une seconde boîte de Pétri avec du PBS froid. Retourner la boîte de Pétri avec la corne utérine à la glace.
- Decapitate l'embryon pour améliorer l'accès à la paroi thoracique. Si génotypage est nécessaire, couper la queue pour enlever et sauver dans un tube Eppendorf placé sur la glace.
- Avec l'embryon sur le dos, couper ouvrir la cage thoracique pour visualiser le cœur et les poumons. Pour éviter de couper le cœur, faire une coupe verticale sur le côté de la cage thoracique, près d'une patte avant, suivi par une coupe horizontale à travers le bas des côtes, puis tirez doucement sur la paroi thoracique et hors de la voie. Up par jour environ 13,5 embryonnaire, la paroi thoracique est transparent, facilitant la visualisation.
- Soulevez délicatement le cœur à l'aide des pinces et couper les vaisseaux ci-dessous. Ensuite, coupez au-dessus des grands vaisseaux de libérer le cœur. Si les vaisseaux pulmonaires ne sont pas coupés, les poumons peuvent être enlevées avec le coeur. Ainsi, enlever les tissus extérieurs, comme les poumons, le cas échéant.
- Séparez et jeter les vaisseaux oreillettes et des ventricules grand. Avec des ciseaux, émincer les ventricules en petits morceaux (environ 1 mm 3 </ Sup>) et placer dans environ 500 pi collagénase (1 mg / ml dans du PBS stérile). Conserver les échantillons sur la glace jusqu'à ce que toutes les ventricules ont été hachées et placées dans la collagénase.
- Répétez les étapes précédentes jusqu'à ce que les ventricules ont été supprimés de tous les embryons, la collecte de chaque cœur dans un tube Eppendorf séparé. Si tous les embryons ont le même génotype, coeurs peuvent être regroupés dans un seul tube Eppendorf. Le nombre d'échantillons traités en une seule fois peut être limité en fonction de l'aimant utilisé pour l'isolation, la DynaMag (123-21D) utilisé ici est titulaire d'un maximum de 16 tubes Eppendorf.
- Placez les ventricules hachés à 37 ° C avec des rocking pendant 45 min. Toutes les 15 min, retirez délicatement les échantillons et la pipette de haut en bas de dissocier mécaniquement les cellules.
4. Isoler les cellules endothéliales
- Faire passer la solution ventricule collagénase travers un filtre pour éliminer les agrégats de cellules restantes 70 um.
- Centrifuger les cellules à 400 g pendant 10 min. Jeterle surnageant, remplacer avec environ 200 pi 10% de FBS dans DMEM, et la pipette de haut en bas pour dissocier les cellules.
- Répétez l'étape précédente fois. Centrifuger les cellules à 400 g pendant 10 min après le second 10% de FBS / DMEM laver. Reprendre les cellules dans 50 ul 10% de FBS / DMEM.
- Pendant l'étape de centrifugation finale, préparer les perles.
- Placer le tube Eppendorf contenant l'anticorps et des perles sur un aimant pendant 1 min.
- Avec le tube en place sur l'aimant, éliminer le surnageant. Retirer le tube de l'aimant et ajouter environ 100 pi 10% de FBS / DMEM.
- Placer le tube sur l'aimant pendant 1 min. Retirer le surnageant et laver de nouveau avec 10% de FBS / DMEM. Répétez l'opération pour un total de 3 lavages.
- Après le lavage final, remettre en suspension les perles d'anticorps conjugués à 10% de FBS / DMEM (5 pi par exemple).
- Pour chaque échantillon de cellules, ajouter 5 pi des perles d'anticorps conjugués. Placez les suspensions de billes cellules à 4 ° C avec bascule foR 30 min.
- Sous une hotte à flux laminaire, placer les tubes Eppendorf contenant des cellules et des billes-anticorps conjugués sur l'aimant pendant 1 min. Retirer le surnageant, retirez les tubes de l'aimant, et laver avec environ 100 pi 10% de FBS / DMEM. Répétez l'opération pour 5 lavages.
- Après le dernier lavage, placez les tubes sur l'aimant pendant 1 minute, retirer le surnageant, et retirez les tubes de l'aimant. Ajouter environ 100 ul DMEM.
- Placer les tubes sur l'aimant pendant 1 minute, retirer le surnageant, et retirez les tubes de l'aimant. Ajouter 100-200 ul préchauffé 0,25% de trypsine-EDTA. Incuber les échantillons à 37 ° C et 5% CO2 pendant 5 min.
- Placer les tubes sur l'aimant pendant 2 min. Soigneusement transférer le surnageant contenant les cellules dans des tubes Eppendorf. Centrifuger pendant 5 min à 400 x g.
- Eliminer le surnageant. Resuspendre les cellules dans 80 à 100 ul de milieu de croissance et de la plaque dans un 96 - ou 384 puits boîte de culture traitée, en fonction du rendement attendu(Environ 450-600 cellules des ventricules E14.5-E16.5 embryons). Pour les cellules endothéliales, en utilisant un milieu de culture de croissance de l'endothélium (défini ci-après).
Résultats
En utilisant un anticorps spécifique de l'endothélium qui reconnaît CD31, les cellules endothéliales ont été isolés à partir des ventricules embryonnaires (E) 13,5 (figure 1A) et 18.5 (figures 1B-1D) embryons. Lorsqu'il est cultivé sur une boîte de culture traitée, ces cellules restent arrondis et pourraient former un motif de pavés si près de confluence (figure 1A). Diluer collagène a également été utilisé pour recouvrir les puits, et tandis que les cellules endothéliales adhèrent à celle-ci (figure 1B), ils forment moins de chaînes que lorsque plaqué sur un gel de collagène (figures 1C et 1D). Les cellules endothéliales cultivées dans un puits contenant un gel de collagène (figures 1C et 1D) interactions cellule-cellule forme et forment des chaînes qui commencent à se ramifier lorsqu'elles sont cultivées sur du collagène, et ce processus se produit plus rapidement lorsqu'elle est cultivée sur du gel de collagène par rapport à l'enduit de collagène plaque. Ces chaînes endothéliales marquent positivement avec le marqueur endothélial iso-lectine ( Figure 1D). Les cellules isolées survivent jusqu'à 1 semaine de culture, mais se sont avérés résistants à la trypsine (même après 1 heure à 37 ° C); par conséquent, ils sont les mieux adaptés à des expériences de terminaux.
Les cellules endothéliales isolées de -18,5 ventricules marquent positivement avec PECAM (figure 2A) et Flk1 (figure 2B). En outre, vivent les cellules endothéliales isolées peuvent être identifiés à l'aide du colorant fluorescent spécifique de l'endothélium Syto-16. Figure 2D montre des cellules endothéliales qui ont été isolés à partir des ventricules d'un embryon E14.5 et étiquetés avec Syto-16.
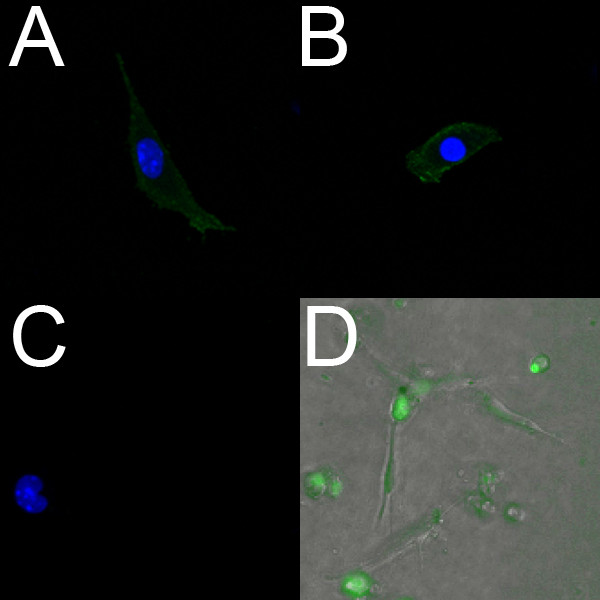
Figure 1. Les cellules endothéliales isolées des ventricules embryonnaires de souris forment des chaînes lorsqu'elles sont cultivées sur un gel de collagène. (A) Brightfield l'image 10x des cellules endothéliales ventriculaires isolées en direct à partir d'un cœur g E13.5ROWN sur une boîte de culture traitée, même après 48 heures, les cellules restent arrondis (B) Brightfield l'image 10x des cellules endothéliales ventriculaires isolés fixes à partir d'un cœur -18,5 cultivé sur un plat enduit de collagène;. après 24 heures, certaines cellules ont commencé allongement (flèche), mais la plupart d'entre eux restent arrondis (pointe de flèche). (C, D) images confocale de cellules endothéliales ventriculaires isolés fixes à partir d'un cœur -18,5 cultivé sur un gel de collagène, montré en fond clair (C) et étiquetés avec iso lectine (rouge). Les flèches indiquent certaines des cellules lectine positifs. Barres d'échelle en cd = 50 um.
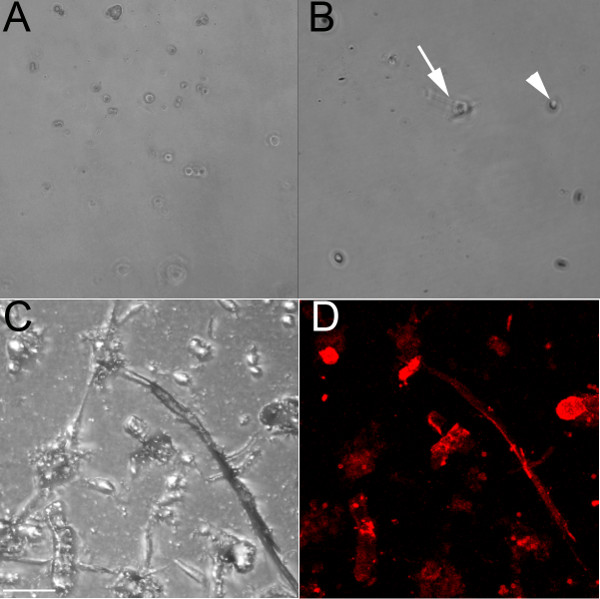
Figure 2. Les cellules endothéliales isolées des ventricules embryonnaires de souris marquent positivement pour marqueurs endothéliaux. (AC) images confocale (40x) des cellules endothéliales ventriculaires isolés fixes à partir d'un cœur -18,5 cultivé surun plat revêtu de collagène. Ces cellules marquent positivement pour PECAM (A) et Flk-1 (B), le contrôle négatif (C) ne montre aucune fluorescence. En courant alternatif, les noyaux sont marqués au DAPI (bleu). (D) Fluorescent overlay (10x) des cellules endothéliales ventriculaires isolées en direct à partir d'un cœur E14.5 cultivé sur un gel de collagène. Les cellules ont été incubées avec le marqueur endothélial direct Syto-16 (vert), et la migration a été observée en microscopie time-lapse.
Discussion
Travailler avec des cellules embryonnaires primaires permet des expériences nouvelles pour traiter in vitro étapes critiques du développement. Toutefois, la procédure d'isolement n'est pas anodin. Les étapes critiques pour isoler un type de cellules comprennent veillant à ce que les cellules sont bien séparés par digestion par la collagénase, puis qu'ils sont bien en suspension au cours des étapes de lavage. Dissection mécanique par pipetage contribue grandement séparer les cellules lors de l'étape de la collagénase, et l'étape de filtrage élimine les amas de cellules. Ces mesures améliorent la pureté de la population et le rendement.
La densité de placage est aussi une préoccupation importante lors de l'isolement des cellules à partir d'un petit orgue. Parce endothéliale tube formation dépend de la densité cellulaire 7, nous nous sommes appuyés sur des plaques de culture tissulaire de 384 puits pour augmenter notre densité de placage. Même avec cette considération, nous avons dû modifier certaines analyses pour accueillir une densité cellulaire inférieure (Dyer et Patterson, en proGress). Ainsi, si le nombre de cellules est une préoccupation, une culture de plus petite taille et peut atténuer le problème.
Une autre limitation de l'isolement des cellules primaires est la spécificité de l'anticorps. Même une protéine endothéliale spécifique reconnue comme CD31 est parfois exprimée par les fibroblastes 8. Si le nombre de cellules récoltées permet de FAC tri à la place, puis les cellules endothéliales et les fibroblastes peuvent être séparés par l'intensité de fluorescence. Toutefois, une analyse de tri FAC récente des cellules endothéliales embryonnaires nécessaire entières quatre embryons E10.5 pour produire des cellules endothéliales assez pour l'extraction de l'ARNm, ce qui suggère que cette technique, bien que puissant, peut ne pas être appropriée pour les petits organes 9.
Ainsi, si FAC tri n'est pas possible, d'autres techniques peuvent être utilisées pour améliorer la pureté de la population. Procédé de sélection en deux étapes, dans lequel les cellules sont choisies de manière positive par un anticorps, puis négativement SELète par le défaut de se lier à un second anticorps, est une approche alternative. Le marqueur fibroblastes spécifique FSP-1 serait un candidat en particulier 10. Alternativement, le milieu de culture peut être commandé sans L-valine, et D-valine peut être ajouté à la place; fibroblastes sont incapables d'utiliser D-valine et donc ne survivent 11,12.
Malgré ces limites et leurs préoccupations, l'étude des populations de cellules embryonnaires primaires permet une analyse détaillée dans l'analyse in vitro des processus de développement. Cette technique peut être appliquée à n'importe quel organe ou d'une région de l'embryon et permet un type de cellule à comparer entre les différents stades embryonnaires. Avec la mise à l'échelle appropriée, même de très petites populations de cellules primaires peuvent être obtenues et analysées. Ces analyses fourniront un aperçu significatif de la façon dont des sous-ensembles spécifiques de cellules se comportent et évoluent avec le temps.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
Nous tenons à remercier Andrea Portbury pour la lecture critique du manuscrit, le Laboratoire des services de microscope de l'UNC pour l'aide à la imagerie time-lapse, et le NIH (subvention n R01HL061656) pour le soutien financier.
matériels
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Timed-pregnant mice | To be dissected at the embryonic stage of interest | ||
| Anti-mouse CD31 | BD Bioscience | 553370 | |
| Rat IgG Dynabeads | Invitrogen | 110-35 | |
| Collagen | BD Bioscience | 354236 | |
| PBS (1x) | |||
| Collagenase, type I | Worthington Biochemical | LS004196 | |
| DMEM | Cellgro | ||
| FBS | Sigma-Aldrich | F2442 | |
| Endothelial cell growth medium | (made in lab as described in notes) | DMEM containing 20% FBS, 5 μM β-mercapt–thanol, 50 μg/ml ECG, and 1x penicillin/streptomycin | |
| β-mercapt–thanol | Sigma-Aldrich | M6250 | |
| ECGS | Biomedical Technologies, Inc. | BT-203 | |
| Penicillin-Streptomycin | Gibco | 15140 | |
| Trypsin-EDTA | Gibco | 25300 | |
| 384-well culture plate | Greiner | T-3037-6 | Plate was prepared with a thin collagen gel, as described in 6; working surface area 10 mm2 |
| Collagen type I | BD | 354236 | Use at a final concentration of 1.5 mg/ml |
| M199, 10x | Invitrogen | 11825-015 | |
| Syto-16 | Invitrogen | S7578 | Used as directed in 13 |
| EQUIPMENT | |||
| Stereoscopic microscope | Nikon | SMZ645 | |
| Cell culture incubator | Thermo | 3110 | |
| DynaMag | Invitrogen | 123-21D | |
| Table-top centrifuge | Thermo | 75002430 | |
Références
- Landecker, H. . Culturing Life: How Cells Became Technologies. , (2007).
- Kan, C. Y., Wen, V. W., et al. Endothelial cell dysfunction and cytoskeletal changes associated with repression of p16(INK4a) during immortalization. Oncogene. , (2012).
- Dyer, L. A., Patterson, C. Development of the endothelium: an emphasis on heterogeneity. Semin. Thromb. Hemost. 36, 227-235 (2010).
- Dong, Q. G., Bernasconi, S., et al. A general strategy for isolation of endothelial cells from murine tissues. Characterization of two endothelial cell lines from the murine lung and subcutaneous sponge implants. Arteriosclerosis, Thrombosis, and Vascular Biology. 17, 1599-1604 (1997).
- van Beijnum, J. R., Rousch, M., Castermans, K., vander Linden, E., Griffioen, A. W. Isolation of endothelial cells from fresh tissues. Nat. Protoc. 3, 1085-1091 (2008).
- Runyan, R. B., Markwald, R. R. Invasion of mesenchyme into three-dimensional collagen gels: a regional and temporal analysis of interaction in embryonic heart tissue. Dev. Biol. 95, 108-114 (1983).
- Arnaoutova, I., Kleinman, H. K. In vitro angiogenesis: endothelial cell tube formation on gelled basement membrane extract. Nat. Protoc. 5, 628-635 (2010).
- Zeisberg, E. M., Potenta, S. E., Sugimoto, H., Zeisberg, M., Kalluri, R. Fibroblasts in kidney fibrosis emerge via endothelial-to-mesenchymal transition. Journal of the American Society of Nephrology : JASN. 19, 2282-2287 (2008).
- Chang, L., Noseda, M. Differentiation of vascular smooth muscle cells from local precursors during embryonic and adult arteriogenesis requires Notch signaling. PNAS. 109, 5993-6998 (2012).
- Fehrenbach, M. L., Cao, G., Williams, J. T., Finklestein, J. M., DeLisser, H. M. Isolation of murine lung endothelial cells. American Journal of Physiology: Lung Cellular and Molecular Physiology. 296, L1095-L1103 (2009).
- Frauli, M., Ludwig, H. Inhibition of fibroblast proliferation in a culture of human endometrial stromal cells using a medium containing D-valine. Archives of Gynecology and Obstetrics. , 241-96 (1987).
- Lazzaro, V. A., Walker, R. J., et al. Inhibition of fibroblast proliferation in L-valine reduced selective media. Research communications in chemical pathology and pharmacology. 75, 39-48 (1992).
- Arima, S., Nishiyama, K., et al. Angiogenic morphogenesis driven by dynamic and heterogeneous collective endothelial cell movement. Development. 138, 4763-4776 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon