Method Article
Oral β-Aminopropionitril ve Subkütan Anjiyotensin II İnfüzyonu ile İndüklenen Torasik Aort Diseksiyonunun Murin Modeli
Bu Makalede
Özet
Bu protokol, farelerde torasik aort diseksiyonunun indüksiyonu için ayrıntılı, adım adım bir prosedür sağlar. Spesifik olarak, gerekli β-aminopropionitril ve anjiyotensin II dozlarının kesin hesaplamasını, ozmotik pompa doldurma prosedürünü ve ozmotik pompanın implantasyon tekniğini içerir.
Özet
Torasik aort diseeksiyonu (TAD), etkin medikal tedavisi olmayan, oldukça ölümcül bir kardiyovasküler hastalıktır. TAD patofizyolojisinin hayvan modellerinin replikasyonu, TAD'nin içsel mekanizmalarını incelemek için esastır. Farelerde β-aminopropionitril (BAPN, geri dönüşümsüz ve oral olarak aktif bir lizil oksidaz inhibitörü) tarafından indüklenen yaygın olarak kullanılan TAD modeli, tutarsız bir başarı oranı sınırlamasına sahiptir. Bu protokol, subkütan anjiyotensin II (Ang II) infüzyonu ile kombine edilmiş oral BAPN ile indüklenen TAD'nin bildirilen modifiye edilmiş bir murin modelini ayrıntılı olarak açıklamaktadır. Dört haftalık BAPN uygulamasından ve ardından 24 saatlik Ang II infüzyonundan sonra, insan TAD'sine benzer özelliklere sahip bir murin modeli güvenilir bir şekilde indüklendi ve TAD model yapımının başarı oranı önemli ölçüde iyileştirildi. Oral BAPN, elastin ve kollajenin çapraz bağlanmasını inhibe ederek aort duvarı yapısının tahrip olmasına ve aort dilatasyonu ve diseksiyon oluşumuna bir dereceye kadar indüklenmesine neden olur. Ang II'nin müteakip indüksiyonu, aort duvarının dejenerasyonunu daha da şiddetlendirir ve böylece TAD oluşumunu teşvik eder. Sonuç olarak, BAPN ve Ang II'nin kombinasyonu, TAD için patogenezi ve potansiyel terapötik yaklaşımları keşfetmek için değerli bir araç sunan bir murin TAD modeli oluşturmak için rafine bir yaklaşımı temsil eder.
Giriş
Torasik aort diseksiyonu (TAD), torakal aort duvarı içinde kanamaya bağlı intimal yırtık sonucu oluşan, aort duvarı tabakalarının ayrılması, kanın aort duvarının ortamına girmesi, yanlış bir lümen oluşturması ve gerçek lümen üzerinde baskı oluşturması ile sonuçlanan ciddi bir aort hastalığıdır 1,2,3. Epidemiyolojik çalışmalar, TAD insidansının yılda 100.000 kişi başına 7 ila 9 vaka arasında olduğunu göstermektedir4. Şu anda, TAD patogenezinin aort mediasının anormal yapısı ve hemodinamiğinden kaynaklandığına ve hipertansiyon, dislipidemi ve kalıtsal vasküler hastalık gibi faktörlerin TAD5 riskini artırdığına inanılmaktadır. Cerrahi girişim TAD için birincil tedavi seçeneği olmaya devam etmektedir. Bununla birlikte, yüksek perioperatif riskler nedeniyle, TAD'ın patogenezinin araştırılması ve ilerlemesini geciktirmek için erken müdahale yöntemlerinin kullanılması TAD'ın prognozunun iyileştirilmesi açısından büyük önem taşımaktadır. İnsan örnekleri elde etmek ve doğrudan insanlarda deney yapmak çok zor olduğundan, insan TAD'nin özelliklerini taklit eden TAD hayvan modellerinin oluşturulması gerekmektedir.
Son birkaç on yılda, aort anevrizmasının (AA) birçok hayvan modeli yaygın olarak bildirilmiştir. Bununla birlikte, TAD modellerinin kurulması ile ilgili hala az sayıda çalışma bulunmaktadır; hatta bazı araştırmacılar TAD'yi AA hayvan modeli6'nın bir yan ürünü olarak görmüşlerdir. Aslında, TAD'nin torasik aortun ilk intimal yırtılması ve ardından yalancı lümenin hızlı bir şekilde genişlemesi sonucu ortaya çıktığı göz önüne alındığında, mekanizmadaki bu önemli farklılık TAD'yi aort anevrizmasından ayırır7. Bugüne kadar, β-aminopropionitril (BAPN) ile indüklenen kemirgen aort diseksiyonu TAD'nin en çok kullanılan modelidir. Lizil oksidazın spesifik ve geri dönüşümsüz bir inhibitörü olan BAPN, aort duvarındaki elastik liflerin ve kollajen liflerinin çapraz bağlanmasını inhibe eder ve aort diseksiyonunun hayvan modellerinde yaygın olarak kullanılır 8,9,10. Çoğu durumda, TAD modelleri oluşturmak için farelerin içme suyuna BAPN eklenmiştir ve OSMOTIK pompa yoluyla BAPN ve anjiyotensin II'nin (Ang II) bir kombinasyonunun TAD modellerini oluşturduğu bildirilmiştir11,12. Ancak, TAD modelleri oluşturmak için bu yöntemler ayrıntılı olarak açıklanmamıştır. Fare suşları, BAPN uygulaması ve Ang II'nin konsantrasyonu ve süresindeki farklılıklar nedeniyle, TAD lezyonlarının insidansı ve kapsamı farklı deneylerde kararsız olmuştur. Bu nedenle, fare TAD modelleri oluşturmak için kararlı bir yönteme acil ihtiyaç vardır.
Burada, bu protokol, bir fare TAD modeli oluşturmak için BAPN takviyeli su ve Ang II ozmotik pompanın bir kombinasyonunu kullanan basit ve oldukça başarılı bir yöntemi adım adım ayrıntılı olarak açıklamaktadır. Bu protokol çoğu laboratuvar için geçerlidir ve öğrenmesi kolaydır, bu da fare modeli yapımında deneyimi olmayan araştırmacıların bile bunu tutarlı bir şekilde gerçekleştirmesine olanak tanır.
Protokol
Hayvan protokolleri, Tianjin Tıp Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır (Onay Numarası TMUaMEC 2022036). Bu çalışmada üç haftalık C57BL / 6J erkek fareler kullanıldı. Kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Hayvan bakımı ve gruplandırma
- Fareleri standart bakım yemeğinde kaldırın. Bu çalışma için üç haftalık fareler kullanın.
- Fareleri rastgele olarak kontrol grubuna (Kontrol), oral BAPN grubuna (BAPN), oral BAPN ve salin infüzyon grubuna (BAPN + Salin) ve oral BAPN ve Ang II infüzyon grubuna (BAPN + Ang II) atayın (Şekil 1). Kontrol grubu farelerine normal içme suyu sağlayın.
- BAPN grubu farelere 4 hafta boyunca 1 mg / g / gün dozunda BAPN ile takviye edilmiş içme suyu sağlayın. BAPN + Ang II grubundaki fareleri Ang II (1 ng / g / dak) ile ve BAPN + Salin grubundaki fareleri 4 haftalık oral BAPN uygulamasından sonra 24 saat boyunca eşdeğer miktarda salin ile infüze edin.
2. BAPN takviyeli içme suyu için hazırlık
- Farelere 3 günlük adaptif beslemeden sonra art arda 4 hafta boyunca BAPN takviyeli içme suyu sağlayın ve 1 günü indüksiyon döngüsü olarak ayarlayın.
- İçme suyunda gereken BAPN miktarını hesaplamak için her kafesteki fareleri tartın.
- Geçen gün boyunca her kafesin su hacmini (hacim) kaydedin.
- Yeterli su alımını sağlamak için, bir indüksiyon döngüsü için su miktarı olarak günlük su hacminin (1,3 x hacim) 1,3 katını kullanın. Buna göre, hesaplanan içme suyu hacminde gerekli BAPN ağırlığının 1,3 katını çözün. Ayrıntılı hesaplama yöntemi ve bir örnek Tablo 1'de gösterilmiştir.
NOT: Bu yaştaki fareler hala hızlı bir büyüme dönemindedir. Farelerin su alım hacminin model indüksiyon periyodu boyunca günlük olarak kaydedilmesi ve kafesteki BAPN takviyeli içme suyunun her gün değiştirilmesi önerilir. BAPN'nin ayrışmasını önlemek için, şişeyi ışıktan korumak için alüminyum folyoya sarın.
3. Ang II kütlesinin hesaplanması
- Her fareyi tartın ve maksimum vücut ağırlığına göre deney için gereken Ang II kütlesini hesaplayın.
- Deney için gereken Ang II kütlesini hesaplamak için hesaplama şablonunu (Tablo 2) kullanın.
- Her pompa yaklaşık 100 μL gerektirdiğinden, fare başına 130 μL Ang II çözeltisi için gereken Ang II kütlesini hesaplayın.
- Deney için gereken Ang II çözeltisinin ve tuzlu suyun doldurma hacmini hesaplamak için hesaplama şablonunu (Tablo 3) kullanın.
4. Ang II çözünmesi
- Liyofilize Ang II tozunu kapalı bir şişede -80 ° C'de saklayın. Nem yoğunlaşmasını önlemek için, Ang II'nin oda sıcaklığına dengelenmesine izin verin ve ardından açmadan önce santrifüjleyin.
- Hesaplanan Ang II miktarını analitik bir terazi kullanarak steril bir mikrotüpte tartın.
- Hesaplanan normal salin hacmini liyofilize Ang II içeren mikrotüpe ekleyin ve tamamen eriyene kadar iyice girdaplayın.
- Gerekli Ang II solüsyonunu vücut ağırlığına göre temiz bir tezgah üzerinde her fare için ayrı ayrı hazırlayın. Çözeltinin iyice karıştığından emin olmak için mikrotüpü ters çevirin.
5. Ozmotik pompa dolumu
- Ozmotik pompanın iki parçasını paketinden temin edin ve enfeksiyon riskini önlemek için steril aletler kullanarak pompayı hazırlayın.
- Pompa gövdesi ve akış moderatörü de dahil olmak üzere her pompayı analitik bir terazi ile tartın. Verileri kaydedin ve doldurma oranını hesaplamak için kullanın.
- Doldurma tüpünü yeni açılmış 1 mL'lik steril bir şırıngaya takın ve hava kabarcıklarını aspire etmemeye dikkat ederek yukarıda açıklanan hazırlanmış Ang II solüsyonunu dikkatlice aspire edin.
- Doldurma tüpünü yukarı konumda tutun ve şırıngadaki hava kabarcıklarını dikkatlice çıkarın. Doldurma borusuna hava kabarcıklarının girmesini önlemek için bu konumu koruyun.
- Doldurma borusunun ucunu, daha fazla yerleştirilemeyecek duruma gelene kadar ozmotik pompanın üst kısmındaki açıklığa yavaşça sokun.
- Ozmotik pompayı dik tutun ve şırınga pistonunu yavaşça sıkın. Ang II çözeltisi çıkışta göründüğünde, hemen durun ve doldurma tüpünü dikkatlice çıkarın.
- Akış moderatörünü, akış moderatörü ile pompanın üst kısmı arasında hiçbir boşluk görünmeyene kadar ozmotik pompanın açıklığına dikkatlice ve yavaşça sokun. Fazla Ang II solüsyonunu steril emici kağıtla silin.
- Yüklü pompayı analitik terazide tartın ve kaydedin. İnfüzyondan önce ve sonra pompa ağırlığındaki fark, yüklenen Ang II çözeltisinin kütlesidir.
- Aşağıdaki formülü kullanarak doldurma oranını hesaplayın:
Dolum hızı = (dolu pompanın kütlesi - boş pompanın kütlesi) / (standart hacim) x %100
NOT: Doldurma hacmi, talimat sayfasında belirtilen standart hacmin %90'ından fazla olmalıdır. Bu durumda, doldurma başarılıdır. Değilse, pompa boşaltılmalı ve yeniden doldurulmalıdır. - Doldurulmuş pompaları, implantasyona kadar en az 6 saat boyunca moderatör başlığı yukarıda olacak şekilde 37 °C'de steril tuzlu suya yerleştirin.
6. Pompa implantasyonu için cerrahi prosedür
- Makas, kanama durdurucular, cımbız, iğne forsepsleri ve dikiş iğneleri dahil olmak üzere tüm cerrahi aletleri pompa implantasyonundan 24 saat önce otoklavlayın.
- Fareyi 2 L/dk akış hızında %1,5 -% 2 izofluran içeren bir anestezik indüksiyon odasına yerleştirin ve fareyi 2 dakika stabilize edin. Fare kılını orta kürek kemiği derisinde yaklaşık 2 cm × 1 cm'lik bir alanda tıraş edin.
NOT: Farenin izoflurana tepkisi değişken olduğundan, stabil anesteziyi sürdürmek için konsantrasyonun ayarlanması gerekebilir. - Fareyi, izofluran anestezik makinesine bağlı burun konisinde burun konisi olacak şekilde yüzüstü pozisyona getirin. Anestezi altındayken kuruluğu önlemek için gözlere veteriner merhemi sürün. Farenin pompa implantasyonu öncesinde ve sırasında ağrılı uyaranlara yanıt vermediğinden emin olun.
- Sırt derisini tıbbi iyodofor ile üç kez dezenfekte edin.
- Bir neşter kullanarak cilt üzerinde yaklaşık 1 cm'lik enine bir kesi yapın.
- İnsizal kenarı kavisli forseps ile nazikçe kavrayın ve pompa için bir cep oluşturmak için deri altı dokuyu başka bir çift kavisli forseps ile kör bir şekilde inceleyin. Cebin, pompanın serbestçe hareket etmesine izin verecek kadar büyük olduğundan emin olun.
- Doldurulmuş pompayı, akış moderatörü kafası farenin kaudal ucuna doğru konumlandırılmış olarak deri altı cebe yerleştirin. Kesiği kapatmak için yeterli boşluk bırakın ve cildi aşırı germekten kaçının.
- Pompa implante edildikten sonra, insizal kenarı düzgün bir şekilde hizalayın ve cildi 6-0 emilemeyen dikişlerle kapatın.
NOT: Yaranın tamamen kapalı olduğundan ve pompanın doğrudan kesiye baskı yapmadığından emin olmak için kesi bölgesini dikkatlice inceleyin. - Kesiği tekrar iyodofor ile temizleyin ve steril bir pamuklu çubuk kullanarak topikal olarak% 5 lidokain anestezik jel uygulayın. İzofluranı kapatın (% 0).
7. Ameliyat sonrası hayvan bakımı
- Pompa implantasyonundan sonra fareleri yakından izleyin ve onları elektrikli ısıtmalı bir battaniyeyle birlikte bir kurtarma kafesine yerleştirin.
- Farelerin uyanana kadar en az 20 dakika boyunca ılık bir kafeste tek başlarına iyileşmelerine izin verin ve ardından onları orijinal muhafaza kafeslerine geri koyun.
- Ameliyattan sonraki ilk 6 saat boyunca fareleri saatlik olarak gözlemleyin. Sonraki 18 saat boyunca, fareleri 6 saatlik aralıklarla gözlemleyin. Fareler can çekişiyorsa veya Ang II uygulaması sırasında ölürse hemen numune toplayın.
8. Aortların toplanması, sabitlenmesi, temizlenmesi ve görüntülenmesi
- Tüm deney gruplarından fareleri izofluran ile uyuşturun ve daha sonra çalışmanın sonunda servikal çıkık ile sakrifiye edin.
- Fareleri sırtüstü pozisyona getirin ve bir fare tabağına sabitleyin. Daha düşük bir karın kesisi yapın ve göğüs ve karın boşlukları tamamen ortaya çıkana kadar göğüs duvarı boyunca uzatın.
- Hemen sağ atriyumda küçük bir kesi yapın, sol ventriküle steril bir şırınga yerleştirin ve akciğerler ve karaciğer beyazlaşana kadar sol ventrikülden yaklaşık 10 mL buz gibi soğuk fosfat tamponlu salin (PBS) enjekte edin.
- Daha sonra akciğerlerin, karaciğerin, dalağın ve bağırsakların rezeksiyonunu gerçekleştirin. Tüm aortu tamamen açığa çıkarın ve dijital bir kumpas kullanarak torasik aortun maksimum çapını ölçün. Aortu kalpten diseke edin ve tüm aortu çıkarmak için tüm arteriyel dalları ve ortak iliak arterleri kesin.
- Aortu bir dijital kamera ile görüntüleyin, 24-48 saat boyunca% 4 paraformaldehit içinde koruyun ve kesit almak için parafine gömün.
NOT: Doku analizine müdahale edebileceği için bağırsak sisteminin zarar görmesini önlemeye dikkat edin. - Bir mikrotom kullanarak aort parafin bölümlerini 3-5 μm kalınlığında kesin, ardından mum alma ve hidrasyon gerçekleştirin. Üreticinin talimatlarına göre ilgili boyama kitlerini kullanarak bölümleri hematoksilen ve eozin (H & E) ve Elastic-Van Gieson (EVG) ile boyayın.
Sonuçlar
Bu çalışmaya 3 haftalık toplam 70 erkek C57BL / 6J faresi dahil edildi ve rastgele dört gruba ayrıldı: Kontrol (n = 10), BAPN (n = 20), BAPN + Salin (n = 20) ve BAPN + Ang II (n = 20). BAPN grubunda, 20 fareden 11'inde BAPN uygulamasından 28 gün sonra torasik aort diseksiyonu (TAD) gelişti ve 4 fare aort yırtılmasından öldü. BAPN + Salin grubunda, 20 fareden 12'sinde TAD gelişti ve yırtılma nedeniyle 4 ölüm gerçekleşti. Özellikle, BAPN + Ang II grubunda, 20 farenin tümü TAD geliştirdi ve bunların 7'si aort yırtılmasından öldü. Kontrol grubunda TAD oluşumu gözlenmedi (Şekil 2A). Her gruptan temsili aort görüntüleri Şekil 2B'de gösterilmiştir.
Ortalama maksimum aort çapları 1.00 ± 0.09 mm (Kontrol), 2.57 ± 0.22 mm (BAPN), 2.57 ± 0.33 mm (BAPN + Salin) ve 2.78 ± 0.23 mm (BAPN + Ang II) idi (Şekil 2C). Kontrol grubu ile karşılaştırıldığında, her üç model grubu da önemli ölçüde artmış maksimum aort çapları gösterdi; Bununla birlikte, model gruplarının kendi aralarında anlamlı bir fark gözlenmemiştir.
H&E boyaması kullanılarak yapılan histolojik analiz, Kontrol grubuna göre BAPN, BAPN + Salin ve BAPN + Ang II gruplarında kalınlaşmış aort duvarları ve belirgin inflamatuar hücre infiltrasyonu ortaya çıkardı. EVG boyaması bu gruplarda daha fazla parçalanma ve elastik lif kaybı göstermiştir (Şekil 3).

Şekil 1: Torasik aort diseksiyonu indüksiyonu için şematik protokol. Aort diseksiyonu, 3 haftalık C57BL / 6J farelerde oral β-aminopropionitril (BAPN) veya ardından anjiyotensin II (Ang II) infüzyonu yoluyla indüklendi. Kontrol ve BAPN gruplarındaki farelere 4 hafta boyunca sırasıyla normal içme suyu veya BAPN takviyeli içme suyu (1 mg / g / gün) verildi. BAPN + Ang II grubundaki veya BAPN + salin grubundaki farelere, dört haftalık BAPN tedavisi tamamlandıktan sonra 24 saat boyunca Ang II (1 ng / g / dak) veya eşdeğer bir hacimde salin infüze edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
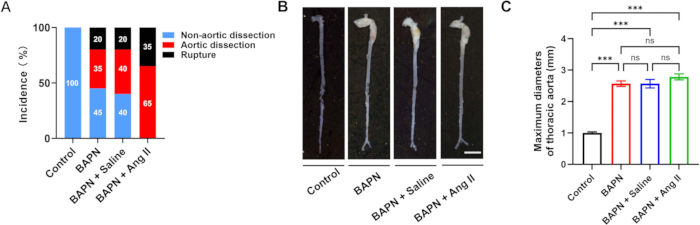
Şekil 2: Gruplar arasında aort diseksiyonu insidansı ve morfolojisi. (A) Her grupta aort diseksiyonu ve rüptürü oranları. (B) Her gruptan aortların temsili brüt morfolojisi; ölçek çubuğu = 5 mm. (C) Aort diseksiyonu olan farelerde maksimal aort çaplarının ölçülmesi (grup başına n = 6); p < 0.001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
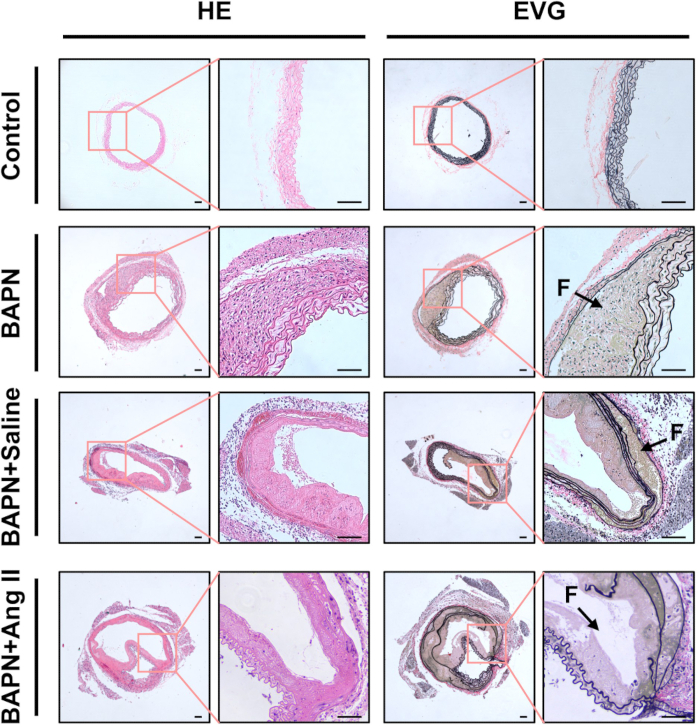
Şekil 3: Diseke aortların histolojik karakterizasyonu. Temsili hematoksilen ve eozin (HE) ve elastin van Gieson (EVG) her gruptan aort dokusunun kesitlerini boyadı. Siyah oklar yanlış lümenleri (F) gösterir; ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| BAPN Tutarının Hesaplanması | |
| Doz | 1 mg / g / gün |
| Toplam vücut ağırlığı | x g |
| Bir indüksiyon döngüsü için dozaj | Y mg = 1.3 x (x g x 1 mg/g/d x1 gün) |
| Su hacminin hesaplanması | |
| Su alımı (son bir gün içinde) | bir mL |
| Bir indüksiyon döngüsü için su hacmi | b mL = 1.3 x a mL |
Tablo 1: BAPN dozajı ve su hacminin hesaplanması. Gerekli BAPN miktarı, kafes başına farelerin toplam vücut ağırlığına ve ortalama günlük su alımına dayanıyordu. Yeterli alımı sağlamak için, hesaplanan su hacmi 1.3 faktörü ile çarpıldı. Örneğin, toplam vücut ağırlığı 72.1 g ve günlük su alımı 10.9 mL olan dört fare için, bir indüksiyon döngüsü için 14.17 mL içme suyunda 93.7 mg BAPN çözüldü.
| Ang II Miktarının Hesaplanması | ||
| Genel Şart | Doz | 1 ng/g/dk |
| Vücut ağırlığı (En ağır) | x g | |
| Serbest bırakma oranı | 1 μL/saat | |
| Fare sayısı | b | |
| Fare başına | Saatlik dozaj | y ng/h = x g × 60 dk × 1 ng/g/dk |
| Çözelti konsantrasyonu | z ng/μL = (y ng/h) / (1 μL/h) | |
| Fare başına gerekli çözüm hacmi | 130 μL | |
| Fare başına gerekli Ang II kütlesi | a ng = z ng/μL × 130 μL | |
| Tüm fare | Toplam Ang II gereksinimi | m mg = bir ng x 10-6 x b |
| Çözünen hacim | n μL = 130 μL x b | |
Tablo 2: Ozmotik pompa infüzyonu için Ang II miktarının hesaplanması. Gerekli Ang II kütlesi, pompa başına 130 μL çözelti olduğu varsayılarak her fare için 1 ng/g/dk'lık bir dağıtım hızı elde etmek için hesaplandı. Örneğin, 23.5 g'lık bir fare için gerekli çözelti konsantrasyonu 1410 ng / μL idi, bu da 10 fare için toplam 1.833 mg'lık bir Ang II kütlesi ile sonuçlandı. Bu miktar 1300 μL tuzlu su içinde çözüldü.
| Dolum hacminin hesaplanması | ||||
| Vücut ağırlığı | Ang II Cilt | Tuzlu Hacim | Toplam Hacim | |
| Fare 1# | 23,5 gr | 100 μL | 0 μL | 100 μL |
| Fare 2# | x g | bir μL | b μL | 100 μL |
Tablo 3: Fare başına Ang II ve tuzlu su doldurma hacimlerinin hesaplanması. Doldurma hacimleri, pompa başına maksimum 100 μL olacak şekilde bireysel fare vücut ağırlığına göre ayarlandı. Örneğin, 22 g ağırlığındaki bir fareye 93.6 μL Ang II çözeltisi verildi ve kalan 6.4 μL, toplam 100 μL hacme ulaşmak için tuzlu su ile dolduruldu.
Tartışmalar
Hayatı tehdit eden torasik aort diseksiyonu (TAD) ile ilgili sınırlı bilgi nedeniyle, TAD başlangıcı ve ilerlemesinin altında yatan moleküler mekanizmaları araştırmak için stabil hayvan modellerinin oluşturulması esastır. Bir lizil oksidaz inhibitörü olan β-Aminopropionitril (BAPN), kollajen ve elastinin çapraz bağlanmasını bozduğu, böylece aort duvarını zayıflattığı ve mekanik strese duyarlılığını artırdığı için TAD'nin kemirgen modellerinde yaygın olarak kullanılmaktadır13. Bununla birlikte, BAPN uygulaması tek başına sıklıkla çalışmalar arasında tutarsız TAD insidansına neden olur.
Bir lizil oksidaz inhibitörü olarak BAPN, elastin ve kollajen10'un çapraz bağlanmasını geri dönüşümsüz olarak inhibe eder. Genel olarak, gençlik fazı sırasında, bu hücre dışı matris bileşenlerinin çapraz bağlanmasının hala devam ettiğine inanılmaktadır14. Bu nedenle, bu kritik gelişimsel pencere sırasında BAPN'yi uygulamak, matris olgunlaşmasını bozmada özellikle etkili olabilir ve başarılı TAD indüksiyonu olasılığını artırabilir. Birkaç çalışma, BAPN'nin tek başına genç farelerde TAD'yi indükleyebileceğini göstermiştir, ancak bildirilen insidans, BAPN uygulamasından 4 haftalık sonra %9 ila %91 arasında değişmekle birlikte büyük ölçüde değişmektedir 12,15,16.
Özellikle, insanlarda TAD'nin başlangıcı son yıllarda daha genç yaşlara doğru bir eğilim göstermiştir ve bazı çalışmalar aort komplikasyonlarının ortalama yaşının 30 ila 40 yıl arasında gerçekleştiğini göstermektedir17,18. BAPN, hücre dışı matris gelişimi sırasında elastin ve kollajen çapraz bağlanmasını bozarak 3 ila 4 haftalık farelerde TAD'yi indüklediğinden, bu model insanlarda erken başlangıçlı TAD'nin patofizyolojisini ve moleküler özelliklerini daha iyi yansıtabilir19.
Buna karşılık, BAPN tek başına yetişkin farelerde TAD'yi indüklemek için yetersizdir 9,20. Bunu ele almak için, çeşitli çalışmalar BAPN'yi ek müdahalelerle birleştirmiştir. Örneğin, NG-nitro-L-arginin metil ester (L-NAME), BAPN ve anjiyotensin II'nin (Ang II) birlikte uygulanmasının yetişkin farelerde TAD'yi indüklediği gösterilmiştir21. Bunlar arasında, BAPN ve Ang II kombinasyonu TAD insidansını artırmak için en sık kullanılan stratejidir. Ren ve ark. 4 haftalık bir BAPN rejimini takiben 24 saat boyunca Ang II infüze edildiğinde% 100 TAD insidansı bildirmiştir, bu çalışmanın bulgularıyla tutarlı bir sonuç12. Ayrıca, Ang II uygulaması, 12 saat, 24 saat ve 48 saat infüzyondan sonra sırasıyla% 14,% 39 ve% 67'lik doza bağlı mortalite oranları ile ilişkilendirilmiştir, bu da deneysel modelimizde gözlenen mortalite oranlarıyla uyumludur.
İçme suyu, ozmotik pompalar, mide tüpü, diyet ve intraperitoneal enjeksiyon 21,22,23,24 yoluyla dağıtım dahil olmak üzere çeşitli BAPN uygulama modları vardır. Bunlar arasında, içme suyu ile uygulama, genç fareler için en yaygın kullanılan yöntemdir. Öte yandan ozmotik pompalar, bileşiklerin tutarlı ve sürekli bir şekilde salınmasını sağlamak için iyi bir şekilde kurulmuştur ve aort anevrizmalarının25 fare modellerinde Ang II infüzyonu için sıklıkla kullanılır. Pompalar yoluyla deri altı infüzyon, BAPN uygulaması için en uygun yöntem olarak kabul edilebilse de, BAPN'nin çözünürlüğü ve pompanın kapasitesi fizibilitesini sınırlar. BAPN'nin sudaki maksimum çözünürlüğü yaklaşık 50 mg/mL'dir ve bu, etkili pompa bazlı dağıtım için konsantrasyon gereksinimlerini karşılamak için yetersizdir. Bu nedenle, yüksek konsantrasyonlu bir BAPN çözeltisi gerekli olacaktır. Bu çalışmaya benzer şekilde, son protokoller, içme suyunda BAPN'yi yöneten ve Ang II'yi ozmotik pompalar 26 aracılığıyla veren birleşik bir yaklaşım benimsemiştir. Bu yöntem, BAPN'yi genç farelere vermek için en uygun görünmektedir.
Şu anda, literatürde BAPN uygulamasının optimal dozu ve süresi ile ilgili standart bir fikir birliği yoktur. Birçok çalışmada BAPN içme suyu yoluyla verildiğinde 1 mg / g / gün dozu kullanılırken, diğerleri BAPN konsantrasyonlarını 1-3 mg / mL veya% 0.2 ila% 0.6 (wt / vol) olarak tanımlamıştır27,28,29,30,31. BAPN'nin içme suyuna eklenmesi, fareler tarafından tüketilen su miktarını değiştirebilir ve su alımı vücut ağırlığı ile doğrusal olarak ilişkili olmayabilir. Sonuç olarak, sabit bir BAPN konsantrasyonu, fare başına gerçek BAPN alımında değişkenliğe neden olabilir. Bunu ele almak için, mevcut çalışma, BAPN takviyeli içme suyunu hem vücut ağırlığına hem de su alımına göre günlük olarak ayarladı ve 1 mg / g / gün'lük tutarlı bir dozu korumayı amaçladı.
Bununla birlikte, bu protokolün çeşitli sınırlamaları vardır. Birincisi, ara zaman noktalarında TAD'nin insidansı ve patolojik ilerlemesi ile ilgili temel verilerden yoksundur. İkincisi, bu çalışmada sadece erkek fareler kullanıldı. TAD erkeklerde daha yaygın olmakla birlikte, dişilerde cerrahi tedaviyi takiben daha yüksek mortalite ve azalmış uzun süreli sağkalım dahil olmak üzere daha kötü sonuçlara sahip olduğu bildirilmektedir32,33. İlginç bir şekilde, bazı çalışmalarda BAPN ve Ang II26,34 ile tedavi edilen dişi farelerde daha düşük bir aort diseksiyonu insidansı gözlemlenmiştir ve bu da daha fazla araştırmayı garanti etmektedir. Üçüncüsü, TAD indüksiyonunun 3 haftalıkken başlatılması (insan ergenliğine benzer şekilde), erişkin başlangıçlı TAD'nin altında yatan patofizyolojik mekanizmaları tam olarak yakalayamayabilir. Son olarak, BAPN uygulama süresi boyunca grup konutları (kafes başına 4 fare), bireysel su alımında değişkenlik yaratır ve bu da BAPN maruziyeti ve semptom şiddetindeki farklılıklara katkıda bulunabilir.
Sonuç olarak, bu protokol, insan TAD'nin patolojik özelliklerini yakından taklit eden kararlı, yüksek insidanslı ve tekrarlanabilir bir TAD fare modelini ana hatlarıyla belirtir. Basitliği ve güvenilirliği sayesinde bu model, TAD başlangıcı ve ilerlemesinin altında yatan moleküler mekanizmaların araştırılması ve potansiyel terapötik stratejilerin değerlendirilmesi için değerli bir yardımcı program sunmaktadır.
Açıklamalar
Bu makalenin yazarlarının beyan edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (82370299) ve Tianjin Anahtar Tıp Disiplini (Uzmanlık) İnşaat Projesi'nden (TJYXZDXK-060B) bir hibe ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3-Aminopropionitrile Fumarate salt | Sigma-Aldrich | A3134 | |
| Analytical balance | Radwag | AS 220.R2 | |
| Anesthesia Machine | Shanghai Renyi Biological Technology Co. Ltd. | MSS-3 | |
| Angiotensin II | MCE | HY-13948 | |
| C57BL/6J Male Mice | GemPharmatech | N000013 | |
| Chow Diet | Sibeifu Beijing Biotechnology Co. Ltd | SPF-F02-002 | |
| Electrothermal constant temperature water tank | Yiheng Technical Co. Ltd. | DK-8D | |
| EVG Staining Kit | Solarbio | G1590 | |
| GraphPad Prism | Graphpad | Ver 10.0.2 | |
| H&E Staining Kit | Servicebio | G1076 | |
| Hemostat | Shinva Medical Instrument Co. Ltd. | ZH240RN | |
| Isoflurane | RWD | R510-22-10 | |
| Microtube | Axygen Scientific, Inc. | MCT-150-C | |
| Needle forcep | Shinva Medical Instrument Co. Ltd. | ZM234R/RN/RB | |
| Osmotic pump | Alzet | 1003D | |
| Paraformaldehyde | Servicebio | G1101 | |
| PBS, 1x | Servicebio | G4202 | |
| Saline | Servicebio | G4702 | |
| Scalpel | Shinva Medical Instrument Co. Ltd. | ZB084R/RN | |
| Scissor | Shinva Medical Instrument Co. Ltd. | ZC480RN/RB/RNj/RNh | |
| Stereo microscope | Leica | EZ4 | |
| Suture | Jinhuan Medical Supplies Co. Ltd. | F604 | |
| Tweezer | Shinva Medical Instrument Co. Ltd. | ZO022RB |
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır