Method Article
מודל עכברי של דיסקציה של אבי העורקים החזי המושרה על ידי עירוי β-אמינופרופיוניטריל דרך הפה ואנגיוטנסין II תת עורי
In This Article
Summary
פרוטוקול זה מספק הליך מפורט, שלב אחר שלב, לאינדוקציה של דיסקציה של אבי העורקים החזי בעכברים. באופן ספציפי, הוא כולל חישוב מדויק של המינונים הנדרשים של β-אמינופרופיוניטריל ואנגיוטנסין II, הליך מילוי המשאבה האוסמוטית וטכניקת ההשתלה של המשאבה האוסמוטית.
Abstract
דיסקציה של אבי העורקים החזי (TAD) היא מחלת לב וכלי דם קטלנית ביותר שחסרה טיפול רפואי יעיל. שכפול מודלים של בעלי חיים של פתופיזיולוגיה של TAD חיוני לחקר המנגנונים הפנימיים של TAD. למודל ה-TAD הנפוץ המושרה על ידי β-aminopropionitrile (BAPN, מעכב ליזיל אוקסידאז בלתי הפיך ופעיל דרך הפה) בעכברים יש מגבלה של שיעור הצלחה לא עקבי. פרוטוקול זה מתאר בפירוט מודל עכברי שונה מדווח של TAD המושרה על ידי BAPN דרך הפה בשילוב עם עירוי אנגיוטנסין II תת עורי (Ang II). לאחר ארבעה שבועות של מתן BAPN ואחריו 24 שעות של עירוי Ang II, מודל עכברי עם מאפיינים דומים ל-TAD אנושי הושרה באופן מהימן, ושיעור ההצלחה של בניית מודל TAD השתפר משמעותית. BAPN אוראלי מעכב את הקישור הצולב של אלסטין וקולגן, וכתוצאה מכך הרס מבנה דופן אבי העורקים וגורם להתרחבות אבי העורקים והיווצרות דיסקציה במידה מסוימת. האינדוקציה הבאה של Ang II מחמירה עוד יותר את הניוון של דופן אבי העורקים, ובכך מקדמת את הופעת TAD. כתוצאה מכך, השילוב של BAPN ו-Ang II מייצג גישה מעודנת לבניית מודל TAD של עכברים, המציע כלי רב ערך לחקר הפתוגנזה והגישות הטיפוליות הפוטנציאליות ל-TAD.
Introduction
דיסקציה של אבי העורקים החזי (TAD) היא מחלה חמורה של אבי העורקים הנגרמת על ידי קרע אינטימי עקב דימום בתוך דופן אבי העורקים החזי, וכתוצאה מכך היפרדות של שכבות דופן אבי העורקים, כניסת דם למדיה של דופן אבי העורקים, יצירת לומן כוזב וגרימת לחץ על הלומן האמיתי 1,2,3. מחקרים אפידמיולוגיים מצביעים על כך ששכיחות TAD היא בין 7 ל-9 מקרים לכל 100,000 אנשים בשנה4. נכון לעכשיו, מאמינים כי הפתוגנזה של TAD נגרמת על ידי המבנה וההמודינמיקה הלא תקינים של התקשורת האאורטלית, וגורמים כמו יתר לחץ דם, דיסליפידמיה ומחלות כלי דם תורשתיות מגבירים את הסיכון ל-TAD5. התערבות כירורגית נותרה אפשרות הטיפול העיקרית עבור TAD. עם זאת, בשל הסיכונים הגבוהים סביב הניתוח, לחקר הפתוגנזה של TAD ושיטות התערבות מוקדמות לעיכוב התקדמותו יש חשיבות משמעותית לשיפור הפרוגנוזה של TAD. מכיוון שקשה מאוד להשיג דגימות אנושיות ולבצע ניסויים ישירות בבני אדם, יש צורך לבסס מודלים של TAD בבעלי חיים המחקים את המאפיינים של TAD אנושי.
במהלך העשורים האחרונים, מודלים רבים של בעלי חיים של מפרצת אבי העורקים (AA) דווחו באופן נרחב. עם זאת, ישנם עדיין מעט מחקרים על הקמת מודלים של TAD; חלק מהחוקרים אפילו ראו ב-TAD תוצר לוואי של מודל בעלי חיים AA6. למעשה, בהתחשב בכך ש-TAD נובע מקרע אינטימי ראשוני של אבי העורקים החזי ואחריו התרחבות מהירה של הלומן הכוזב, הבדל משמעותי זה במנגנון מבדיל בין TAD למפרצת אבי העורקים7. נכון להיום, דיסקציה של אבי העורקים של מכרסמים המושרה על ידי β-aminopropionitrile (BAPN) היא המודל הנפוץ ביותר של TAD. BAPN, מעכב ספציפי ובלתי הפיך של ליזיל אוקסידאז, מעכב את הקישור הצולב של סיבים אלסטיים וסיבי קולגן בדופן אבי העורקים, ונמצא בשימוש נרחב במודלים של בעלי חיים של דיסקציה של אבי העורקים 8,9,10. ברוב המקרים, BAPN נוסף למי השתייה של עכברים כדי לבנות מודלים של TAD, ודווח על שילוב של BAPN ואנגיוטנסין II (Ang II) באמצעות משאבה אוסמוטית לבניית דגמי TAD11,12. עם זאת, שיטות אלה לבניית מודלים של TAD אינן מתוארות בפירוט. בגלל הבדלים בזני עכברים, מתן BAPN והריכוז ומשך הזמן של Ang II, השכיחות וההיקף של נגעי TAD לא היו יציבים בניסויים שונים. לכן, יש צורך דחוף בשיטה יציבה לבניית דגמי TAD של עכברים.
כאן, פרוטוקול זה מתאר בפירוט, צעד אחר צעד, שיטה פשוטה ומוצלחת ביותר המשתמשת בשילוב של מים בתוספת BAPN ומשאבה אוסמוטית Ang II לבניית מודל TAD של עכבר. פרוטוקול זה ישים לרוב המעבדות וקל ללמידה, ומאפשר אפילו לחוקרים ללא ניסיון בבניית מודלים של עכברים לבצע אותו באופן עקבי.
Protocol
פרוטוקולים לבעלי חיים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של האוניברסיטה הרפואית של טיאנג'ין (מספר אישור TMUaMEC 2022036). במחקר זה נעשה שימוש בעכברים זכרים בני שלושה שבועות C57BL/6J. פרטים על הריאגנטים והציוד המשמשים מפורטים בטבלת החומרים.
1. תחזוקה וקיבוץ בעלי חיים
- מגדלים את העכברים על תחזוקה סטנדרטית. השתמש בעכברים בני שלושה שבועות למחקר זה.
- הקצו באופן אקראי את העכברים לקבוצת הביקורת (Control), לקבוצת BAPN האוראלי (BAPN), לקבוצת BAPN ועירוי מי מלח (BAPN + Saline), ולקבוצת עירוי BAPN ו-Ang II דרך הפה (BAPN + Ang II) (איור 1). ספקו לעכברי קבוצת הביקורת מי שתייה רגילים.
- ספקו לעכברים מקבוצת BAPN מי שתייה בתוספת BAPN במינון של 1 מ"ג/גרם/יום למשך 4 שבועות. יש להחדיר לעכברים בקבוצת BAPN + Ang II Ang II (1 ננוגרם/גרם/דקה) ולעכברים בקבוצת BAPN + מי מלח כמות שווה של מי מלח למשך 24 שעות לאחר 4 שבועות של מתן BAPN דרך הפה.
2. הכנה למי שתייה בתוספת BAPN
- ספק לעכברים מי שתייה בתוספת BAPN במשך 4 שבועות רצופים לאחר 3 ימים של הזנה אדפטיבית, תוך הגדרת יום אחד כמחזור אינדוקציה.
- שקלו את העכברים בכל כלוב כדי לחשב את כמות ה-BAPN הנדרשת במי השתייה.
- רשום את נפח המים (נפח) של כל כלוב במהלך היממה האחרונה.
- כדי להבטיח צריכת מים מספקת, השתמש פי 1.3 מנפח המים היומי (1.3 x נפח) ככמות המים למחזור אינדוקציה. בהתאם, יש להמיס פי 1.3 מהמשקל הנדרש של BAPN בנפח המחושב של מי השתייה. שיטת חישוב מפורטת ודוגמה מוצגות בטבלה 1.
הערה: עכברים בגיל זה עדיין נמצאים בתקופה של גדילה מהירה. מומלץ לרשום את נפח צריכת המים של העכברים מדי יום לאורך כל תקופת האינדוקציה של המודל ולהחליף את מי השתייה בתוספת BAPN בכלוב מדי יום. כדי למנוע פירוק של BAPN, עטפו את הבקבוק בנייר אלומיניום כדי להגן עליו מפני אור.
3. חישוב מסת אנג 2
- שקלו כל עכבר וחשבו את מסת ה-Ang II הנדרשת לניסוי על סמך משקל הגוף המרבי.
- השתמש בתבנית החישוב (טבלה 2) כדי לחשב את מסת Ang II הדרושה לניסוי.
- חשב את המסה של Ang II הנדרשת עבור 130 מיקרוליטר של תמיסת Ang II לעכבר, מכיוון שכל משאבה דורשת כ-100 מיקרוליטר.
- השתמש בתבנית החישוב (טבלה 3) כדי לחשב את נפח המילוי של תמיסת Ang II ומי מלח הדרושים לניסוי.
4. פירוק אנג 2
- אחסן אבקת Ang II שעברה ליופיליזציה בבקבוקון אטום בטמפרטורה של -80 מעלות צלזיוס. כדי למנוע עיבוי לחות, אפשר ל-Ang II להתאזן לטמפרטורת החדר ולאחר מכן לצנטריפוגה לפני הפתיחה.
- שקלו את הכמות המחושבת של Ang II במיקרו-שפופרת סטרילית באמצעות איזון אנליטי.
- הוסף את הנפח המחושב של מי מלח רגילים לתוך המיקרו-צינור המכיל את ה-Ang II הליופילי והמערבולת היטב עד להמסה מלאה.
- הכן את תמיסת Ang II הנדרשת בנפרד לכל עכבר על ספסל נקי בהתאם למשקל הגוף. הפוך את המיקרו-צינור כדי להבטיח שהתמיסה מעורבבת היטב.
5. מילוי משאבה אוסמוטית
- השג את שני חלקי המשאבה האוסמוטית מהאריזה והכן את המשאבה באמצעות מכשירים סטריליים כדי למנוע את הסיכון לזיהום.
- שקלו כל משאבה, כולל גוף המשאבה ומנחה הזרימה, עם איזון אנליטי. רשום את הנתונים והשתמש בהם כדי לחשב את יחס המילוי.
- חבר את צינור המילוי למזרק סטרילי שנפתח לאחרונה בנפח 1 מ"ל ושאף בזהירות את תמיסת Ang II המוכנה שתוארה לעיל, תוך הקפדה לא לשאוב בועות אוויר.
- החזק את צינור המילוי במצב כלפי מעלה והסר בזהירות את בועות האוויר מהמזרק. שמור על עמדה זו כדי למנוע כניסת בועות אוויר לצינור המילוי.
- הכנס בעדינות את קצה צינור המילוי לתוך הפתח בחלק העליון של המשאבה האוסמוטית עד שלא ניתן להכניס אותו יותר.
- החזק את המשאבה האוסמוטית זקופה וסחט לאט את בוכנת המזרק. לאחר שתמיסת Ang II מופיעה ביציאה, עצור מיד והסר בזהירות את צינור המילוי.
- הכנס בזהירות ובאטיות את מנחה הזרימה לפתח המשאבה האוסמוטית עד שלא נראה פער בין מנחה הזרימה לחלק העליון של המשאבה. נגב את כל תמיסת Ang II העודפת עם נייר סופג סטרילי.
- שקלו את המשאבה העמוסה על איזון אנליטי ורשמו אותה. ההבדל במשקל המשאבה לפני ואחרי העירוי הוא המסה של תמיסת Ang II העמוסה.
- חשב את קצב המילוי באמצעות הנוסחה הבאה:
קצב מילוי = (מסת משאבה מלאה - מסת משאבה ריקה) / (נפח סטנדרטי) x 100%
הערה: נפח המילוי צריך להיות יותר מ-90% מהנפח הסטנדרטי המצוין בגיליון ההוראות. אם כן, המילוי הצליח. אם לא, יש לנקז את המשאבה ולמלא אותה מחדש. - הנח את המשאבות המלאות במי מלח סטריליים בטמפרטורה של 37 מעלות צלזיוס כשראש המנחה כלפי מעלה למשך 6 שעות לפחות עד ההשתלה.
6. הליך כירורגי להשתלת משאבה
- חיטוי כל המכשירים הכירורגיים, כולל מספריים, המוסטטים, פינצטה, מלקחיים מחטים ומחטי תפרים, 24 שעות לפני השתלת המשאבה.
- הנח את העכבר בתא אינדוקציה להרדמה עם 1.5%-2% איזופלורן בקצב זרימה של 2 ליטר לדקה וייצב את העכבר למשך 2 דקות. לגלח את שיער העכבר באזור של כ -2 ס"מ × 1 ס"מ על עור אמצע עצם השכם.
הערה: מכיוון שתגובת העכבר לאיזופלורן משתנה, ייתכן שיהיה צורך להתאים את הריכוז כדי לשמור על הרדמה יציבה. - הנח את העכבר במצב שכיבה כשהאף בקונוס האף מחובר למכונת ההרדמה איזופלורן. מרחו משחה וטרינרית על העיניים למניעת יובש בזמן ההרדמה. ודא שהעכבר אינו מגיב לגירויים כואבים לפני ובמהלך השתלת המשאבה.
- לחטא את עור הגב שלוש פעמים עם יודופור רפואי.
- בצע בזהירות חתך רוחבי של כ -1 ס"מ על העור בעזרת אזמל.
- אחזו בעדינות בשולי החתך בעזרת מלקחיים מעוקלים ונתחו בבוטות את הרקמה התת עורית עם זוג נוסף של מלקחיים מעוקלים כדי ליצור כיס למשאבה. ודא שהכיס גדול מספיק כדי לאפשר למשאבה לנוע בחופשיות.
- הכנס את המשאבה המלאה לכיס התת עורי כשראש מנחה הזרימה ממוקם לכיוון הקצה הזנבי של העכבר. השאירו מספיק מקום לסגירת החתך והימנעו ממתיחת יתר של העור.
- לאחר השתלת המשאבה, יישר בצורה מסודרת את שולי החתך וסגור את העור עם 6-0 תפרים שאינם נספגים.
הערה: בדוק היטב את מקום החתך כדי לוודא שהפצע סגור לחלוטין ושהמשאבה אינה לוחצת ישירות על החתך. - נקו את החתך שוב עם יודופור ומרחו ג'ל הרדמה 5% לידוקאין באופן מקומי באמצעות צמר גפן סטרילי. כבה את האיזופלורן (0%).
7. טיפול בבעלי חיים לאחר הניתוח
- עקוב אחר עכברים מקרוב לאחר השתלת המשאבה והנח אותם בכלוב התאוששות יחד עם שמיכה מחוממת חשמלית.
- אפשרו לעכברים להתאושש לבד בכלוב חם למשך 20 דקות לפחות עד שהם מתעוררים, ואז החזירו אותם לכלוב הדיור המקורי שלהם.
- התבונן בעכברים מדי שעה במשך 6 השעות הראשונות לאחר הניתוח. במשך 18 השעות הבאות, התבוננו בעכברים במרווחים של 6 שעות. אסוף דגימות מיד אם עכברים במצב גוסס או מתים במהלך מתן Ang II.
8. קציר, קיבוע, ניקוי והדמיה של אבי העורקים
- להרדים עכברים מכל קבוצות הניסוי עם איזופלורן ואז להקריב אותם על ידי פריקת צוואר הרחם בסוף המחקר.
- הניחו את העכברים במצב שכיבה ואבטחו אותם על צלחת עכבר. בצע חתך בבטן התחתונה והאריך אותו על פני דופן החזה עד שחללי בית החזה והבטן נחשפים במלואם.
- בצע מיד חתך קטן באטריום הימני, הכנס מזרק סטרילי לחדר השמאלי והזריק לאט כ-10 מ"ל של מי מלח קרים כקרח (PBS) דרך החדר השמאלי עד שהריאות והכבד הופכים לבנים.
- לאחר מכן, בצע כריתה של הריאות, הכבד, הטחול והמעיים. חשוף את כל אבי העורקים במלואו ומדוד את הקוטר המרבי של אבי העורקים החזי באמצעות קליפר דיגיטלי. נתח את אבי העורקים מהלב וחצה את כל ענפי העורקים ועורקי הכסל הנפוצים כדי לקצור את אבי העורקים כולו.
- דמיין את אבי העורקים במצלמה דיגיטלית, שמור אותו ב-4% פרפורמלדהיד למשך 24-48 שעות, והטמיע אותו בפרפין לחתך.
הערה: הקפד להימנע מפגיעה בדרכי המעי, מכיוון שהיא עלולה להפריע לניתוח הרקמות. - חותכים קטעי פרפין אבי העורקים בעובי של 3-5 מיקרומטר באמצעות מיקרוטום, ואז מבצעים הסרת שעווה ולחות. צבעו את החלקים בהמטוקסילין ואאוזין (H&E) ו-Elastic-Van Gieson (EVG) באמצעות ערכות הצביעה המתאימות בהתאם להוראות היצרן.
תוצאות
בסך הכל נכללו במחקר זה 70 עכברי C57BL/6J זכרים, בני 3 שבועות, והוקצו באופן אקראי לארבע קבוצות: ביקורת (n = 10), BAPN (n = 20), BAPN + מי מלח (n = 20) ו- BAPN + Ang II (n = 20). בקבוצת BAPN, 11 מתוך 20 עכברים פיתחו דיסקציה של אבי העורקים החזה (TAD) 28 ימים לאחר מתן BAPN, כאשר 4 עכברים מתו מקרע באבי העורקים. בקבוצת BAPN + Saline, 12 מתוך 20 עכברים פיתחו TAD, עם 4 מקרי מוות כתוצאה מקרע. יש לציין כי בקבוצת BAPN + Ang II, כל 20 העכברים פיתחו TAD, ו-7 מהם מתו מקרע באבי העורקים. לא נצפתה היווצרות TAD בקבוצת הביקורת (איור 2A). תמונות אבי העורקים מייצגות מכל קבוצה מוצגות באיור 2B.
קוטר אבי העורקים המקסימלי הממוצע היה 1.00 ± 0.09 מ"מ (בקרה), 2.57 ± 0.22 מ"מ (BAPN), 2.57 ± 0.33 מ"מ (BAPN + מי מלח) ו-2.78 ± 0.23 מ"מ (BAPN + Ang II) (איור 2C). בהשוואה לקבוצת הביקורת, כל שלוש קבוצות המודל הראו עלייה משמעותית בקוטר אבי העורקים המקסימלי; עם זאת, לא נצפו הבדלים משמעותיים בין קבוצות המודל עצמן.
ניתוח היסטולוגי באמצעות צביעת H&E חשף דפנות אבי העורקים מעובות וחדירת תאים דלקתיים ניכרת בקבוצות BAPN, BAPN + מלח ו-BAPN + Ang II, ביחס לקבוצת הביקורת. צביעת EVG הדגימה עוד פיצול ואובדן של סיבים אלסטיים בקבוצות אלה (איור 3).

איור 1: פרוטוקול סכמטי עבור השראת דיסקציה של אבי העורקים החזי. דיסקציה של אבי העורקים הושרה בעכברי C57BL/6J בני 3 שבועות באמצעות מתן פומי של β-aminopropionitrile (BAPN) או עירוי לאחר מכן של אנגיוטנסין II (Ang II). עכברים בקבוצות הביקורת וה-BAPN קיבלו מי שתייה רגילים או מי שתייה בתוספת BAPN (1 מ"ג/גרם/יום) במשך 4 שבועות, בהתאמה. עכברים בקבוצת BAPN + Ang II או בקבוצת BAPN + מי מלח קיבלו Ang II (1 ננוגרם/גרם/דקה) או נפח שווה ערך של מי מלח למשך 24 שעות לאחר השלמת ארבעה שבועות של טיפול ב-BAPN. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
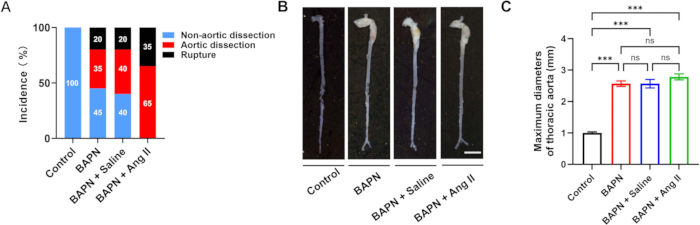
איור 2: שכיחות דיסקציה של אבי העורקים ומורפולוגיה בין קבוצות. (A) שיעורי דיסקציה וקרע של אבי העורקים בכל קבוצה. (ב) מורפולוגיה ברוטו מייצגת של אבי העורקים מכל קבוצה; סרגל קנה מידה = 5 מ"מ. (C) כימות של קוטר אבי העורקים המקסימלי בעכברים עם דיסקציה של אבי העורקים (n = 6 לקבוצה); עמ' < 0.001. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
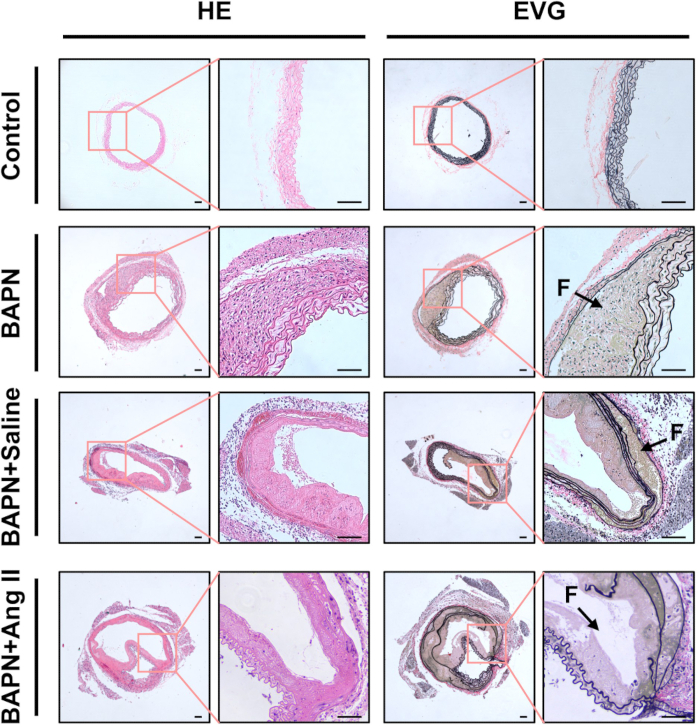
איור 3: אפיון היסטולוגי של אבי העורקים המנותחים. המטוקסילין ואאוזין מייצגים (HE) ואלסטין ואן גיסון (EVG) הכתים חלקים של רקמת אבי העורקים מכל קבוצה. חיצים שחורים מצביעים על לומן כוזב (F); סרגל קנה מידה = 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| חישוב סכום BAPN | |
| מנה | 1 מ"ג/גרם/יום |
| משקל גוף כולל | X G |
| מינון למחזור אינדוקציה | y מ"ג = 1.3 x (x גרם x 1 מ"ג/גרם/ד x1 ד') |
| חישוב נפח המים | |
| צריכת מים (במהלך היממה האחרונה) | מ"ל |
| נפח מים למחזור אינדוקציה | b מ"ל = 1.3 x a מ"ל |
טבלה 1: חישוב מינון BAPN ונפח המים. כמות ה-BAPN הנדרשת התבססה על משקל הגוף הכולל של עכברים לכלוב וצריכת המים היומית הממוצעת. כדי להבטיח צריכה מספקת, נפח המים המחושב הוכפל בפקטור של 1.3. לדוגמה, עבור ארבעה עכברים עם משקל גוף כולל של 72.1 גרם וצריכת מים יומית של 10.9 מ"ל, 93.7 מ"ג BAPN מומס ב-14.17 מ"ל מי שתייה למחזור אינדוקציה אחד.
| חישוב סכום Ang II | ||
| מצב כללי | מנה | 1 נ"ג/גרם/דקה |
| משקל גוף (הכבד ביותר) | X G | |
| קצב שחרור | 1 מיקרוליטר לשעה | |
| מספר העכברים | b | |
| לכל עכבר | מינון לשעה | y ng/h = x g × 60 דקות × 1 ng/g/min |
| ריכוז תמיסה | z ng/μL = (y ng/h) / (1 μL/h) | |
| נפח פתרון נדרש לכל עכבר | 130 מיקרוליטר | |
| מסת Ang II נדרשת לכל עכבר | a ng = z ng/μL × 130 μL | |
| כל העכבר | סה"כ דרישת Ang II | m mg = a ng x 10-6 x b |
| נפח מומס | n μL = 130 μL x b | |
טבלה 2: חישוב כמות Ang II לעירוי משאבה אוסמוטית. מסת ה-Ang II הנדרשת חושבה כדי להשיג קצב אספקה של 1 ננוגרם/גרם/דקה לכל עכבר, בהנחה של 130 מיקרוליטר של תמיסה לכל משאבה. לדוגמה, עבור עכבר של 23.5 גרם, ריכוז התמיסה הנדרש היה 1410 ננוגרם/מיקרוליטר, וכתוצאה מכך מסת Ang II כוללת של 1.833 מ"ג עבור 10 עכברים. כמות זו הומסת ב -1300 מיקרוליטר מי מלח.
| חישוב נפח המילוי | ||||
| משקל גוף | אנג 2 כרך | נפח מי מלח | נפח כולל | |
| עכבר 1# | 23.5 גרם | 100 מיקרוליטר | 0 מיקרוליטר | 100 מיקרוליטר |
| עכבר 2# | X G | מיקרוליטר | b מיקרוליטר | 100 מיקרוליטר |
טבלה 3: חישוב נפחי מילוי Ang II ומי מלח לעכבר. נפחי המילוי הותאמו בהתאם למשקל גוף העכבר הבודד, עם מקסימום של 100 מיקרוליטר לכל משאבה. לדוגמה, עכבר במשקל 22 גרם קיבל 93.6 מיקרוליטר של תמיסת Ang II, ו-6.4 מיקרוליטר הנותרים מולאו במי מלח כדי להגיע לנפח הכולל של 100 מיקרוליטר.
Discussion
בשל ההבנה המוגבלת של דיסקציה מסכנת חיים של אבי העורקים החזי (TAD), הקמת מודלים יציבים של בעלי חיים חיונית לחקר המנגנונים המולקולריים העומדים בבסיס הופעת והתקדמות TAD. β-Aminopropionitrile (BAPN), מעכב ליזיל אוקסידאז, נמצא בשימוש נרחב במודלים של מכרסמים של TAD מכיוון שהוא משבש את הקישור הצולב של קולגן ואלסטין, ובכך מחליש את דופן אבי העורקים ומגביר את רגישותו ללחץ מכני13. עם זאת, מתן BAPN לבדו מביא לעתים קרובות לשכיחות TAD לא עקבית במחקרים.
כמעכב ליזיל אוקסידאז, BAPN מעכב באופן בלתי הפיך את הקישור הצולב של אלסטין וקולגן10. בדרך כלל מאמינים כי במהלך שלב הנעורים, הקישור הצולב של רכיבי המטריצה החוץ-תאיים הללו עדיין נמשך14. לכן, מתן BAPN במהלך חלון התפתחותי קריטי זה עשוי להיות יעיל במיוחד בשיבוש הבשלת המטריצה, ולהגדיל את הסבירות לאינדוקציה מוצלחת של TAD. מספר מחקרים הראו כי BAPN לבדו יכול לגרום ל-TAD בעכברים צעירים, אם כי השכיחות המדווחת משתנה מאוד, ונעה בין 9% ל-91% לאחר 4 שבועות של מתן BAPN 12,15,16.
יש לציין כי הופעת TAD בבני אדם הראתה מגמה לגיל צעיר יותר בעשורים האחרונים, כאשר כמה מחקרים מצביעים על כך שהגיל הממוצע של סיבוכים באבי העורקים מתרחש בין 30 ל-40 שנים17,18. מכיוון ש-BAPN גורם ל-TAD בעכברים בני 3 עד 4 שבועות על ידי פגיעה בקישור צולב של אלסטין וקולגן במהלך התפתחות מטריצה חוץ-תאית, מודל זה עשוי לשקף טוב יותר את הפתופיזיולוגיה והמאפיינים המולקולריים של TAD מוקדם בבני אדם19.
לעומת זאת, BAPN לבדו אינו מספיק כדי לגרום ל-TAD בעכברים בוגרים 9,20. כדי לטפל בכך, מחקרים שונים שילבו BAPN עם התערבויות נוספות. לדוגמה, הוכח כי מתן משותף של NG-nitro-L-ארגינין מתיל אסטר (L-NAME), BAPN ואנגיוטנסין II (Ang II) גורם ל-TAD בעכברים בוגרים21. בין אלה, השילוב של BAPN ו-Ang II הוא האסטרטגיה הנפוצה ביותר לשיפור שכיחות TAD. רן ועמיתיו דיווחו על שכיחות של 100% של TAD כאשר Ang II הוזרק במשך 24 שעות לאחר משטר BAPN של 4 שבועות, תוצאה העולה בקנה אחד עם ממצאי מחקר זה12. יתר על כן, מתן Ang II נקשר לשיעורי תמותה תלויי מינון של 14%, 39% ו-67% לאחר 12 שעות, 24 שעות ו-48 שעות של עירוי, בהתאמה22, מה שגם תואם את שיעורי התמותה שנצפו במודל הניסיוני שלנו.
ישנם מספר מצבים של מתן BAPN, כולל אספקה באמצעות מי שתייה, משאבות אוסמוטיות, צינור קיבה, דיאטה והזרקה תוך צפקית 21,22,23,24. בין אלה, מתן באמצעות מי שתייה הוא השיטה הנפוצה ביותר עבור עכברים צעירים. משאבות אוסמוטיות, לעומת זאת, מבוססות היטב במתן שחרור עקבי ומתמשך של תרכובות ומשמשות לעתים קרובות לעירוי Ang II במודלים של עכברים של מפרצת אבי העורקים25. למרות שעירוי תת עורי באמצעות משאבות עשוי להיחשב כשיטה אופטימלית לאספקת BAPN, המסיסות של BAPN וקיבולת המשאבה מגבילים את היתכנותה. המסיסות המקסימלית של BAPN במים היא כ-50 מ"ג/מ"ל, וזה לא מספיק כדי לעמוד בדרישות הריכוז לאספקה יעילה מבוססת משאבה. לכן, יהיה צורך בפתרון BAPN מרוכז מאוד. בדומה למחקר הנוכחי, הפרוטוקולים האחרונים אימצו גישה משולבת של מתן BAPN במי שתייה ואספקת Ang II באמצעות משאבות אוסמוטיות26. נראה כי שיטה זו אופטימלית להעברת BAPN לעכברים צעירים.
נכון לעכשיו, אין קונצנזוס סטנדרטי בספרות לגבי המינון ומשך הזמן האופטימליים של מתן BAPN. בעוד שמחקרים רבים השתמשו במינון של 1 מ"ג/גרם/יום כאשר BAPN מועבר דרך מי שתייה, אחרים תיארו את ריכוזי ה-BAPN במונחים של 1-3 מ"ג/מ"ל או 0.2% עד 0.6% (משקל/נפח)27,28,29,30,31. הוספת BAPN למי שתייה יכולה לשנות את כמות המים הנצרכת על ידי עכברים, וצריכת מים עשויה שלא להיות בקורלציה ליניארית עם משקל הגוף. כתוצאה מכך, ריכוז BAPN קבוע עלול לגרום לשונות בצריכת ה-BAPN בפועל לעכבר. כדי לטפל בכך, המחקר הנוכחי התאים את מי השתייה בתוספת BAPN מדי יום על סמך משקל הגוף וצריכת המים, במטרה לשמור על מינון עקבי של 1 מ"ג/גרם ליום.
עם זאת, לפרוטוקול זה יש מספר מגבלות. ראשית, חסרים לו נתונים בסיסיים על השכיחות וההתקדמות הפתולוגית של TAD בנקודות זמן ביניים. שנית, רק עכברים זכרים שימשו במחקר זה. בעוד ש-TAD שכיח יותר בקרב גברים, נשים מדווחות על תוצאות גרועות יותר, כולל תמותה גבוהה יותר והישרדות מופחתת לטווח ארוך לאחר טיפול כירורגי32,33. מעניין לציין שכמה מחקרים הבחינו בשכיחות נמוכה יותר של דיסקציה של אבי העורקים בעכברים נקבות שטופלו ב-BAPN ו-Ang II26,34, מה שמצדיק חקירה נוספת. שלישית, התחלת השראת TAD בגיל 3 שבועות (אנלוגית לגיל ההתבגרות האנושית) עשויה שלא ללכוד באופן מלא את המנגנונים הפתופיזיולוגיים העומדים בבסיס TAD במבוגרים. לבסוף, דיור קבוצתי במהלך תקופת מתן BAPN (4 עכברים לכלוב) מציג שונות בצריכת המים האישית, מה שעשוי לתרום להבדלים בחשיפה ל-BAPN ובחומרת התסמינים.
לסיכום, פרוטוקול זה מתאר מודל עכבר יציב, בעל שכיחות גבוהה וניתן לשחזור של TAD המחקה מקרוב את המאפיינים הפתולוגיים של TAD אנושי. בשל פשטותו ואמינותו, מודל זה מציע תועלת רבת ערך לחקירת המנגנונים המולקולריים העומדים בבסיס הופעת והתקדמות TAD, כמו גם להערכת אסטרטגיות טיפוליות פוטנציאליות.
Disclosures
למחברי כתב היד הזה אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
עבודה זו נתמכה על ידי מענק מהקרן הלאומית למדעי הטבע של סין (82370299) ופרויקט הבנייה של משמעת רפואית מרכזית (התמחות) בטיאנג'ין (TJYXZDXK-060B).
Materials
| Name | Company | Catalog Number | Comments |
| 3-Aminopropionitrile Fumarate salt | Sigma-Aldrich | A3134 | |
| Analytical balance | Radwag | AS 220.R2 | |
| Anesthesia Machine | Shanghai Renyi Biological Technology Co. Ltd. | MSS-3 | |
| Angiotensin II | MCE | HY-13948 | |
| C57BL/6J Male Mice | GemPharmatech | N000013 | |
| Chow Diet | Sibeifu Beijing Biotechnology Co. Ltd | SPF-F02-002 | |
| Electrothermal constant temperature water tank | Yiheng Technical Co. Ltd. | DK-8D | |
| EVG Staining Kit | Solarbio | G1590 | |
| GraphPad Prism | Graphpad | Ver 10.0.2 | |
| H&E Staining Kit | Servicebio | G1076 | |
| Hemostat | Shinva Medical Instrument Co. Ltd. | ZH240RN | |
| Isoflurane | RWD | R510-22-10 | |
| Microtube | Axygen Scientific, Inc. | MCT-150-C | |
| Needle forcep | Shinva Medical Instrument Co. Ltd. | ZM234R/RN/RB | |
| Osmotic pump | Alzet | 1003D | |
| Paraformaldehyde | Servicebio | G1101 | |
| PBS, 1x | Servicebio | G4202 | |
| Saline | Servicebio | G4702 | |
| Scalpel | Shinva Medical Instrument Co. Ltd. | ZB084R/RN | |
| Scissor | Shinva Medical Instrument Co. Ltd. | ZC480RN/RB/RNj/RNh | |
| Stereo microscope | Leica | EZ4 | |
| Suture | Jinhuan Medical Supplies Co. Ltd. | F604 | |
| Tweezer | Shinva Medical Instrument Co. Ltd. | ZO022RB |
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved