Method Article
Мышиная модель расслоения грудной аорты, индуцированного пероральной инфузией β-аминопропионитрила и подкожного ангиотензина II
В этой статье
Резюме
Этот протокол предусматривает подробную пошаговую процедуру индукции расслоения грудного отдела аорты у мышей. В частности, он включает в себя точный расчет необходимых доз β-аминопропионитрила и ангиотензина II, процедуру наполнения осмотическим насосом и технику имплантации осмотического насоса.
Аннотация
Расслоение грудной аорты (ТАД) является смертельным сердечно-сосудистым заболеванием, которое не поддается эффективному лечению. Воспроизведение животных моделей патофизиологии ТАД имеет важное значение для изучения внутренних механизмов ТАД. Широко используемая модель TAD, индуцированная β-аминопропионитрилом (BAPN, необратимый и перорально активный ингибитор лизилоксидазы) у мышей, имеет ограничение, заключающееся в непостоянной частоте успеха. В этом протоколе подробно описана модифицированная мышиная модель ТАД, индуцированной пероральным приемом БАТН в сочетании с подкожной инфузией ангиотензина II (Ang II). После четырех недель введения БАТН с последующей инфузией Ang II в течение 24 ч была надежно индуцирована мышиная модель с характеристиками, аналогичными человеческому ТАД, и вероятность успешного построения модели ТАД значительно улучшилась. Пероральный прием BAPN ингибирует сшивку эластина и коллагена, что приводит к разрушению структуры стенки аорты и в определенной степени индуцирует образование дилатации и расслоения аорты. Последующая индукция Ang II еще больше усугубляет дегенерацию стенки аорты, тем самым способствуя возникновению ТАД. Следовательно, комбинация BAPN и Ang II представляет собой усовершенствованный подход к построению мышиной модели TAD, предлагая ценный инструмент для изучения патогенеза и потенциальных терапевтических подходов к TAD.
Введение
Расслоение грудной аорты (ТАД) – это серьезное заболевание аорты, вызванное разрывом интимы из-за кровотечения в стенке грудной аорты, в результате которого слои стенки аорты отрываются, кровь попадает в среду стенки аорты, образуя ложный просвет и вызывая давление на истинный просвет 1,2,3. Эпидемиологические исследования показывают, что заболеваемость ТАД составляет от 7 до 9 случаев на 100 000 человек вгод4. В настоящее время считается, что патогенез ТАД обусловлен аномальной структурой и гемодинамикой среднего звена аорты, а такие факторы, как гипертония, дислипидемия и наследственные сосудистые заболевания, увеличивают риск развития ТАД5. Хирургическое вмешательство остается основным вариантом лечения ТАД. Тем не менее, в связи с высокими периоперационными рисками, изучение патогенеза ТАД и методы раннего вмешательства для задержки его прогрессирования имеют существенное значение для улучшения прогноза ТАД. Поскольку получить человеческие образцы и провести эксперименты непосредственно на людях очень сложно, необходимо создать животные модели ТАД, которые имитируют характеристики человеческого ТАД.
За последние несколько десятилетий было широко известно о многих животных моделях аневризмы аорты (АА). Тем не менее, до сих пор существует мало исследований по созданию моделей TAD; некоторые исследователи даже считают ТАД побочным продуктом животной моделиАА 6. Фактически, учитывая, что ТАД возникает в результате первоначального интимального разрыва грудной аорты с последующим быстрым расширением ложного просвета, это значительное различие в механизме отличает ТАД от аневризмыаорты 7. На сегодняшний день наиболее часто используемой моделью ТАД является индуцированная β-аминопропионитрилом (BAPN) расслоением аорты у грызунов. БАПН, специфический и необратимый ингибитор лизилоксидазы, ингибирует сшивание эластических волокон и коллагеновых волокон в стенке аорты и широко используется на животных моделях расслоения аорты 8,9,10. В большинстве случаев BAPN добавляли в питьевую воду мышей для построения моделей TAD, а комбинацию BAPN и ангиотензина II (Ang II) с помощью осмотического насоса использовали для построения моделей TAD11,12. Однако эти методы построения ТАД-моделей подробно не описаны. Из-за различий в линиях мышей, введении BAPN, а также концентрации и продолжительности Ang II, частота и степень поражения TAD были нестабильными в разных экспериментах. Поэтому существует острая потребность в стабильном методе построения мышиных ТАД-моделей.
В данном протоколе подробно и шаг за шагом описывается простой и весьма успешный метод с использованием комбинации воды, обогащенной BAPN, и осмотического насоса Ang II для построения мышиной модели TAD. Этот протокол применим к большинству лабораторий и прост в освоении, что позволяет даже исследователям, не имеющим опыта в создании мышиных моделей, выполнять его последовательно.
протокол
Протоколы содержания животных были одобрены Комитетом по уходу за животными и их использованию Тяньцзиньского медицинского университета (номер одобрения TMUaMEC 2022036). В этом исследовании использовались трехнедельные самцы мышей C57BL/6J. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Содержание и группировка животных
- Выращивайте мышей на стандартном поддерживающем корме. Для этого исследования используйте трехнедельных мышей.
- Случайным образом распределите мышей по контрольной группе (контроль), группе перорального приема BAPN (BAPN), группе перорального приема BAPN и инфузии физиологического раствора (BAPN + физиологический раствор) и группе перорального приема BAPN и инфузии Ang II (BAPN + Ang II) (рис. 1). Обеспечьте мышей контрольной группы обычной питьевой водой.
- Обеспечьте мышей группы БАТН питьевой водой с добавлением БАТН в дозе 1 мг/г/сут в течение 4 недель. Вводите мышам в группе BAPN + Ang II Ang II (1 нг/г/мин) и мышам в группе BAPN + физиологический раствор эквивалентное количество физиологического раствора в течение 24 часов после 4 недель перорального приема BAPN.
2. Подготовка к питьевой воде с добавлением БАТН
- Обеспечьте мышей питьевой водой с добавлением BAPN в течение 4 недель подряд после 3 дней адаптивного кормления, установив 1 день в качестве индукционного цикла.
- Взвесьте мышей в каждой клетке, чтобы рассчитать необходимое количество BAPN в питьевой воде.
- Запишите объем воды (объем) каждой клетки за последние сутки.
- Чтобы обеспечить достаточное потребление воды, используйте в 1,3 раза больше суточного объема воды (1,3 x объем) в качестве количества воды для индукционного цикла. Соответственно, растворяют в 1,3 раза больше необходимого веса БАПН в расчетном объеме питьевой воды. Подробный метод расчета и пример приведены в таблице 1.
ПРИМЕЧАНИЕ: Мыши в этом возрасте все еще находятся в периоде быстрого роста. Рекомендуется ежедневно регистрировать объем потребления воды мышами в течение модельного периода индукции, а питьевую воду с добавлением BAPN в клетке менять каждый день. Чтобы предотвратить разложение БАПН, оберните бутылку алюминиевой фольгой, чтобы защитить ее от света.
3. Расчет массы Ang II
- Взвесьте каждую мышь и рассчитайте необходимую для эксперимента массу Ang II, исходя из максимальной массы тела.
- Используйте шаблон расчета (Таблица 2) для вычисления массы Ang II, необходимой для эксперимента.
- Рассчитайте массу Ang II, необходимую для 130 μL раствора Ang II на мышь, так как для каждого насоса требуется примерно 100 μL.
- Используйте шаблон расчета (Таблица 3) для расчета объема заполнения раствора Ang II и физиологического раствора, необходимого для эксперимента.
4. Роспуск Ang II
- Хранить лиофилизированный порошок Ang II в герметичном флаконе при температуре -80 °C. Чтобы предотвратить конденсацию влаги, дайте Ang II уравновеситься до комнатной температуры, а затем центрифугируйте его перед открытием.
- Взвесьте рассчитанное количество Ang II в стерильной микропробирке с помощью аналитических весов.
- Добавьте рассчитанный объем нормального физиологического раствора в микротрубку, содержащую лиофилизированный Ang II, и тщательно перемешайте до полного растворения.
- Приготовьте необходимый раствор Ang II отдельно для каждой мыши на чистом стенде в зависимости от массы тела. Переверните микропробирку вверх дном, чтобы раствор хорошо перемешался.
5. Наполнение осмотического насоса
- Достаньте две части осмотического насоса из упаковки и подготовьте насос с помощью стерильных инструментов, чтобы избежать риска инфицирования.
- Взвесьте каждый насос, включая корпус насоса и замедлитель потока, с помощью аналитических весов. Запишите данные и используйте их для расчета коэффициента заполнения.
- Приложите наполнительную трубку к только что открытому стерильному шприцу объемом 1 мл и осторожно отсасывайте приготовленный раствор Ang II, описанный выше, стараясь не аспирировать пузырьки воздуха.
- Удерживайте заправочную трубку в вертикальном положении и осторожно удалите из шприца все пузырьки воздуха. Сохраняйте это положение, чтобы пузырьки воздуха не попали внутрь заливной трубки.
- Аккуратно вставьте конец заправочной трубки в отверстие в верхней части осмотического насоса до тех пор, пока его нельзя будет вставлять дальше.
- Держите осмотический насос вертикально и медленно сожмите поршень шприца. Как только раствор Ang II появится на выходе, немедленно остановитесь и осторожно снимите заливную трубку.
- Осторожно и медленно вставьте замедлитель потока в отверстие осмотического насоса до тех пор, пока не останется видимого зазора между замедлителем потока и верхней частью насоса. Сотрите излишки раствора Ang II стерильной абсорбирующей бумагой.
- Взвесьте загруженный насос на аналитических весах и запишите это. Разница в весе насоса до и после инфузии — это масса загруженного раствора Ang II.
- Рассчитайте норму заполнения по следующей формуле:
Скорость наполнения = (масса заполненного насоса - масса пустого насоса) / (стандартный объем) x 100%
ПРИМЕЧАНИЕ: Объем наполнения должен составлять более 90% от стандартного объема, указанного в инструкции по эксплуатации. Если это так, заливка выполнена успешно. Если нет, насос следует слить и снова залить. - Поместите наполненные насосы в стерильный физиологический раствор при температуре 37 °C с поднятой головой замедлителя не менее чем на 6 часов до имплантации.
6. Хирургическая процедура по имплантации помпы
- Автоклавирование всех хирургических инструментов, включая ножницы, гемостатики, пинцеты, игольчатые щипцы и иглы для наложения швов, проводится за 24 ч до имплантации помпы.
- Поместите мышь в анестезиологическую индукционную камеру с 1,5%-2% изофлураном со скоростью потока 2 л/мин и стабилизируйте мышь в течение 2 минут. Сбрейте шерсть мыши на участке около 2 см × 1 см на средней части лопаточной кожи.
Примечание: Поскольку реакция мыши на изофлуран вариабельна, может потребоваться корректировка концентрации для поддержания стабильной анестезии. - Поместите мышь в положение лежа так, чтобы носик находился в носовом конусе, подключенном к аппарату для анестетика изофлурана. Нанесите ветеринарную мазь на глаза, чтобы предотвратить сухость во время пребывания под анестезией. Следите за тем, чтобы мышь не реагировала на болезненные раздражители до и во время имплантации помпы.
- Продезинфицируйте спинную кожу трижды медицинским йодофором.
- Аккуратно сделайте поперечный разрез около 1 см на коже с помощью скальпеля.
- Аккуратно захватите край резца изогнутыми щипцами и тупо рассеките подкожную клетчатку еще одной парой изогнутых щипцов, чтобы создать карман для помпы. Убедитесь, что карман достаточно большой, чтобы насос мог свободно перемещаться.
- Вставьте наполненный насос в подкожный карман так, чтобы головка замедлителя потока располагалась ближе к каудальному концу мыши. Оставьте достаточно места для закрытия разреза и не допускайте перерастяжения кожи.
- После того, как насос будет имплантирован, аккуратно выровняйте режущий край и закройте кожу нерассасывающимися швами 6-0.
ПРИМЕЧАНИЕ: Внимательно осмотрите место разреза, чтобы убедиться, что рана полностью закрыта и что насос не давит непосредственно на разрез. - Снова очистите разрез йодофором и нанесите 5% лидокаиновый обезболивающий гель местно с помощью стерильного ватного тампона. Выключите изофлуран (0%).
7. Послеоперационный уход за животными
- Внимательно наблюдайте за мышами после имплантации насоса и поместите их в клетку для восстановления вместе с электрическим одеялом с подогревом.
- Дайте мышам восстановиться в одиночестве в теплой клетке в течение как минимум 20 минут, пока они не проснутся, а затем верните их в исходную клетку.
- Наблюдайте за мышами ежечасно в течение первых 6 ч после операции. В течение следующих 18 ч наблюдайте за мышами с интервалом в 6 ч. Немедленно собирайте образцы, если мыши находятся в умирающем состоянии или умирают во время введения Ang II.
8. Забор, фиксация, очистка и визуализация аорты
- Обезболивайте мышей из всех экспериментальных групп изофлураном, а затем принесите их в жертву путем вывиха шейки матки в конце исследования.
- Поместите мышей в лежачее положение и закрепите их на мышиной пластине. Сделайте разрез в нижней части живота и протяните его через стенку грудной клетки до полного обнажения грудной и брюшной полостей.
- Немедленно сделайте небольшой разрез в правом предсердии, введите стерильный шприц в левый желудочек и медленно вводите примерно 10 мл ледяного фосфатно-солевого буфера (PBS) через левый желудочек, пока легкие и печень не станут белыми.
- Впоследствии проводят резекцию легких, печени, селезенки, кишечника. Полностью обнажите всю аорту и измерьте максимальный диаметр грудной аорты с помощью цифрового штангенциркуля. Рассеките аорту от сердца и пересеките все артериальные ветви и общие подвздошные артерии, чтобы собрать всю аорту.
- Сфотографируйте аорту с помощью цифровой камеры, законсервируйте ее в 4% параформальдегиде в течение 24-48 часов и заделайте в парафин для разрезания.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не травмировать кишечный тракт, так как это может помешать анализу тканей. - Срезы парафина аорты толщиной 3-5 мкм с помощью микротома, затем проводят депарафинизацию и гидратацию. Окрашивайте срезы гематоксилином и эозином (H&E) и Elastic-Van Gieson (EVG) с помощью соответствующих наборов для окрашивания в соответствии с инструкциями производителя.
Результаты
В общей сложности 70 самцов мышей C57BL/6J в возрасте 3 недель были включены в это исследование и случайным образом распределены в четыре группы: контрольная (n = 10), BAPN (n = 20), BAPN + физиологический раствор (n = 20) и BAPN + Ang II (n = 20). В группе BAPN у 11 из 20 мышей развилось расслоение грудной аорты (TAD) через 28 дней после введения BAPN, при этом 4 мыши умерли от разрыва аорты. В группе BAPN + физиологический раствор у 12 из 20 мышей развился TAD, 4 из которых умерли из-за разрыва. Примечательно, что в группе BAPN + Ang II у всех 20 мышей развился TAD, и 7 из них умерли от разрыва аорты. В контрольной группе образования ТАД не наблюдалось (рис. 2А). Репрезентативные изображения аорты из каждой группы показаны на рисунке 2B.
Средние максимальные диаметры аорты составляли 1,00 ± 0,09 мм (контроль), 2,57 ± 0,22 мм (BAPN), 2,57 ± 0,33 мм (BAPN + физиологический раствор) и 2,78 ± 0,23 мм (BAPN + Ang II) (рис. 2C). По сравнению с контрольной группой, все три модельные группы показали значительно увеличенный максимальный диаметр аорты; Тем не менее, существенных различий между самими модельными группами не наблюдалось.
Гистологический анализ с использованием H&E окрашивания выявил утолщение стенок аорты и выраженную воспалительную инфильтрацию клеток в группах BAPN, BAPN + Физиологический раствор и BAPN + Ang II по сравнению с контрольной группой. Окрашивание EVG также продемонстрировало фрагментацию и потерю эластичных волокон в этих группах (рис. 3).

Рисунок 1: Схематический протокол для индукции расслоения грудного отдела аорты. Расслоение аорты индуцировали у 3-недельных мышей C57BL/6J путем перорального введения β-аминопропионитрила (BAPN) или последующей инфузии ангиотензина II (Ang II). Мыши в контрольной группе и группе БАТН получали обычную питьевую воду или питьевую воду с добавлением БАТН (1 мг/г/день) в течение 4 недель соответственно. Мышам в группе BAPN + Ang II или в группе BAPN + физиологический раствор вводили Ang II (1 нг/г/мин) или эквивалентный объем физиологического раствора в течение 24 ч после завершения четырехнедельного лечения BAPN. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
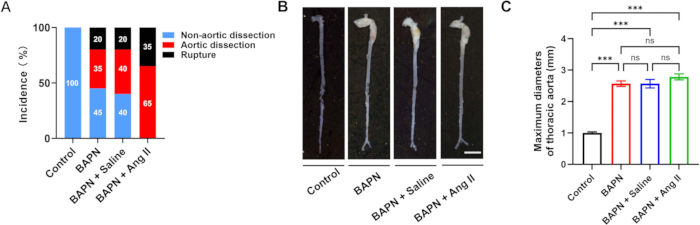
Рисунок 2: Частота и морфология расслоения аорты в каждой группе. (A) Частота расслоения и разрыва аорты в каждой группе. (B) Репрезентативная общая морфология аорты из каждой группы; масштабная линейка = 5 мм. (C) Количественная оценка максимальных диаметров аорты у мышей с расслоением аорты (n = 6 в группе); p < 0,001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
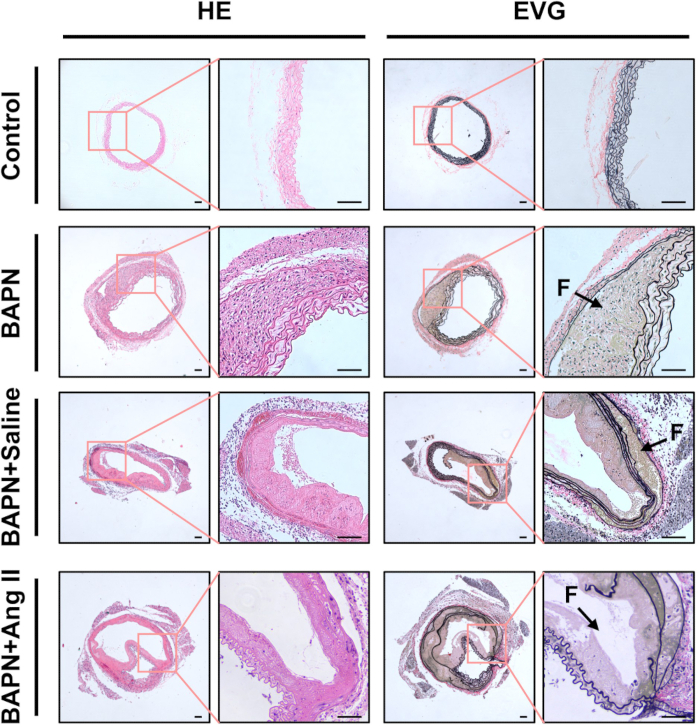
Рисунок 3: Гистологическая характеристика расслоенных аорт . Репрезентативные гематоксилин и эозин (ПЭ) и эластин ван Гизон (ЭВГ) окрашивали участки аортальной ткани из каждой группы. Черные стрелки указывают на ложные просветы (F); масштабная линейка = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Расчет суммы BAPN | |
| Доза | 1 мг/г/сут |
| Общая масса тела | х г |
| Дозировка для индукционного цикла | y мг = 1,3 x (x g x 1 мг/г/d x1 d) |
| Расчет объема воды | |
| Потребление воды (за последние сутки) | мл |
| Объем воды для индукционного цикла | b мл = 1,3 x a мл |
Таблица 1: Расчет дозировки БАТН и объема воды. Необходимое количество BAPN основывалось на общей массе тела мышей в клетке и среднесуточном потреблении воды. Чтобы обеспечить достаточный забор, расчетный объем воды был умножен на коэффициент 1,3. Например, для четырех мышей с общей массой тела 72,1 г и суточной нормой воды 10,9 мл 93,7 мг БАТН растворяли в 14,17 мл питьевой воды в течение одного индукционного цикла.
| Расчет суммы Ang II | ||
| Общее состояние | Доза | 1 нг/г/мин |
| Масса тела (самая тяжелая) | х г | |
| Скорость выпуска | 1 мкл/ч | |
| Количество мышей | b | |
| На мышь | Дозировка в час | y нг/ч = x г × 60 мин × 1 нг/г/мин |
| Концентрация раствора | z нг/мкл = (y нг/ч) / (1 мкл/ч) | |
| Требуемый объем раствора на одну мышь | 130 мкл | |
| Требуемая масса Ang II на одну мышь | a ng = z ng/μL × 130 μL | |
| Все мыши | Общее требование Ang II | m mg = a ng x 10-6 x b |
| Объем растворенного вещества | n μL = 130 μL x b | |
Таблица 2: Расчет количества Ang II для инфузии осмотическим насосом. Требуемая масса Ang II была рассчитана для достижения скорости подачи 1 нг/г/мин для каждой мыши, исходя из расчета 130 мкл раствора на насос. Например, для мыши массой 23,5 г требуемая концентрация раствора составляла 1410 нг/мкл, в результате чего общая масса Ang II составила 1,833 мг для 10 мышей. Это количество растворяли в 1300 мкл физиологического раствора.
| Расчет объема наполнения | ||||
| Масса тела | Том Ang II | Объем солевого раствора | Общий объем | |
| Мышь 1# | 23,5 г | 100 мкл | 0 μл | 100 мкл |
| Мышь 2# | х г | μЛ | b μL | 100 мкл |
Таблица 3: Расчет объемов наполнения Ang II и солевым раствором на одну мышь. Объемы наполнения регулировались в соответствии с массой тела индивидуальной мыши, максимум 100 μл на насос. Например, мышь весом 22 г получала 93,6 мкл раствора Ang II, а оставшиеся 6,4 мкл заполняли физиологическим раствором для достижения общего объема в 100 мкл.
Обсуждение
Из-за ограниченного понимания угрожающего жизни расслоения грудного отдела аорты (ТАД) создание стабильных животных моделей имеет важное значение для изучения молекулярных механизмов, лежащих в основе возникновения и прогрессирования ТАД. β-аминопропионитрил (БАПН), ингибитор лизилоксидазы, широко используется в моделях ТАД у грызунов, поскольку он нарушает сшивание коллагена и эластина, тем самым ослабляя стенку аорты и повышая ее восприимчивость к механическимнагрузкам13. Тем не менее, применение только БАТН часто приводит к непоследовательной заболеваемости ТАД в разных исследованиях.
Являясь ингибитором лизилоксидазы, BAPN необратимо ингибирует сшивание эластина и коллагена10. Принято считать, что во время ювенильной фазы сшивание этих компонентов внеклеточного матрикса все ещепродолжается14. Таким образом, введение БАПН в течение этого критического окна развития может быть особенно эффективным для нарушения созревания матрицы, увеличивая вероятность успешной индукции ТАД. Несколько исследований показали, что БАТН сам по себе может индуцировать ТАД у молодых мышей, хотя зарегистрированная частота варьирует в широких пределах, варьируясь от 9% до 91% после 4 недель введения БАТН 12,15,16.
Примечательно, что в последние десятилетия возникновение ТАД у людей показало тенденцию к более молодому возрасту, при этом некоторые исследования показывают, что средний возраст осложнений аорты приходится на период от 30 до 40 лет17,18. Поскольку BAPN индуцирует TAD у мышей в возрасте от 3 до 4 недель, нарушая поперечное сшивание эластина и коллагена во время развития внеклеточного матрикса, эта модель может лучше отражать патофизиологию и молекулярные особенности раннего начала TAD у людей.
Напротив, одного БАТН недостаточно для индуцирования ТАД у взрослых мышей 9,20. Чтобы решить эту проблему, различные исследования сочетали BAPN с дополнительными вмешательствами. Например, было показано, что одновременное введение метилового эфира NG-нитро-L-аргинина (L-NAME), BAPN и ангиотензина II (Ang II) индуцирует TAD у взрослых мышей21. Среди них комбинация BAPN и Ang II является наиболее часто используемой стратегией для повышения заболеваемости TAD. Ren et al. сообщили о 100% частоте ТАД при введении Ang II в течение 24 ч после 4-недельного режима приема БАТН, что согласуется с результатами данного исследования12. Кроме того, введение Ang II было связано с дозозависимыми показателями смертности 14%, 39% и 67% после 12 ч, 24 ч и 48 ч инфузии, соответственно,22, что также согласуется с показателями смертности, наблюдаемыми в нашей экспериментальной модели.
Существует несколько режимов введения БАТН, включая доставку через питьевую воду, осмотические насосы, желудочный зонд, диету и внутрибрюшинную инъекцию 21,22,23,24. Среди них введение через питьевую воду является наиболее часто используемым методом для молодых мышей. Осмотические насосы, с другой стороны, хорошо зарекомендовали себя для обеспечения последовательного и устойчивого высвобождения соединений и часто используются для инфузии Ang II на мышиных моделях аневризмы аорты25. Несмотря на то, что подкожная инфузия с помощью насосов может считаться оптимальным методом доставки БАТН, растворимость БАТН и производительность насоса ограничивают его осуществимость. Максимальная растворимость БАТН в воде составляет примерно 50 мг/мл, что недостаточно для удовлетворения требований к концентрации для эффективной доставки с помощью насоса. Следовательно, необходим высококонцентрированный раствор БАТН. Как и в настоящем исследовании, в последних протоколах принят комбинированный подход, предусматривающий введение BAPN в питьевую воду и доставку Ang II с помощью осмотических насосов26. Этот метод представляется оптимальным для доставки БАТН молодым мышам.
В настоящее время в литературе не существует стандартизированного консенсуса относительно оптимальной дозы и продолжительности введения БАТН. В то время как во многих исследованиях использовалась доза 1 мг/г/день, когда БАТН поступает через питьевую воду, другие описывали концентрации БАТН в терминах 1-3 мг/мл или от 0,2% до 0,6% (масс./об.)27,28,29,30,31. Добавление БАТН в питьевую воду может изменить количество воды, потребляемой мышами, а потребление воды может не коррелировать линейно с массой тела. Следовательно, фиксированная концентрация БАТН может привести к изменчивости фактического потребления БАТН на одну мышь. Чтобы решить эту проблему, текущее исследование скорректировало ежедневную дозу питьевой воды с добавлением BAPN в зависимости от массы тела и потребления воды, стремясь поддерживать постоянную дозу 1 мг/г/день.
Однако этот протокол имеет несколько ограничений. Во-первых, в нем отсутствуют исходные данные о частоте и патологическом прогрессировании ТАД в промежуточные временные точки. Во-вторых, в этом исследовании использовались только самцы мышей. В то время как ТАД более распространен среди мужчин, сообщается, что у женщин наблюдаются худшие исходы, включая более высокую смертность и снижение долгосрочной выживаемости после хирургического лечения32,33. Интересно, что в некоторых исследованиях наблюдалась более низкая частота расслоения аорты у самок мышей, получавших BAPN и Ang II26,34, что требует дальнейшего изучения. В-третьих, начало индукции ТАД в возрасте 3 недель (аналогично подростковому возрасту человека) может не полностью отражать патофизиологические механизмы, лежащие в основе ТАД у взрослых. Наконец, групповое содержание в период введения БАТН (4 мыши в клетке) приводит к вариабельности индивидуального потребления воды, что может способствовать различиям в воздействии БАТН и тяжести симптомов.
В заключение, этот протокол описывает стабильную, высокочастотную и воспроизводимую мышиную модель ТАД, которая точно имитирует патологические особенности ТАД человека. Благодаря своей простоте и надежности, эта модель представляет собой ценную полезность для исследования молекулярных механизмов, лежащих в основе возникновения и прогрессирования ТАД, а также для оценки потенциальных терапевтических стратегий.
Раскрытие информации
Авторы данной рукописи не могут заявить об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана грантом Национального фонда естественных наук Китая (82370299) и Тяньцзиньским проектом строительства ключевой медицинской дисциплины (специальности) (TJYXZDXK-060B).
Материалы
| Name | Company | Catalog Number | Comments |
| 3-Aminopropionitrile Fumarate salt | Sigma-Aldrich | A3134 | |
| Analytical balance | Radwag | AS 220.R2 | |
| Anesthesia Machine | Shanghai Renyi Biological Technology Co. Ltd. | MSS-3 | |
| Angiotensin II | MCE | HY-13948 | |
| C57BL/6J Male Mice | GemPharmatech | N000013 | |
| Chow Diet | Sibeifu Beijing Biotechnology Co. Ltd | SPF-F02-002 | |
| Electrothermal constant temperature water tank | Yiheng Technical Co. Ltd. | DK-8D | |
| EVG Staining Kit | Solarbio | G1590 | |
| GraphPad Prism | Graphpad | Ver 10.0.2 | |
| H&E Staining Kit | Servicebio | G1076 | |
| Hemostat | Shinva Medical Instrument Co. Ltd. | ZH240RN | |
| Isoflurane | RWD | R510-22-10 | |
| Microtube | Axygen Scientific, Inc. | MCT-150-C | |
| Needle forcep | Shinva Medical Instrument Co. Ltd. | ZM234R/RN/RB | |
| Osmotic pump | Alzet | 1003D | |
| Paraformaldehyde | Servicebio | G1101 | |
| PBS, 1x | Servicebio | G4202 | |
| Saline | Servicebio | G4702 | |
| Scalpel | Shinva Medical Instrument Co. Ltd. | ZB084R/RN | |
| Scissor | Shinva Medical Instrument Co. Ltd. | ZC480RN/RB/RNj/RNh | |
| Stereo microscope | Leica | EZ4 | |
| Suture | Jinhuan Medical Supplies Co. Ltd. | F604 | |
| Tweezer | Shinva Medical Instrument Co. Ltd. | ZO022RB |
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены