Method Article
Modelo murino de dissecção da aorta torácica induzida por infusão oral de β-aminopropionitrila e angiotensina II subcutânea
Neste Artigo
Resumo
Este protocolo fornece um procedimento detalhado e passo a passo para a indução de dissecção da aorta torácica em camundongos. Especificamente, inclui o cálculo preciso das doses necessárias de β-aminopropionitrila e angiotensina II, o procedimento para enchimento da bomba osmótica e a técnica de implantação da bomba osmótica.
Resumo
A dissecção da aorta torácica (DAT) é uma doença cardiovascular altamente fatal que carece de tratamento médico eficiente. A replicação de modelos animais da fisiopatologia do TAD é essencial para o estudo dos mecanismos intrínsecos do TAD. O modelo TAD amplamente utilizado induzido por β-aminopropionitrila (BAPN, um inibidor irreversível e ativo da lisil oxidase por via oral) em camundongos tem a limitação de uma taxa de sucesso inconsistente. Este protocolo descreve em detalhes um modelo murino modificado relatado de TAD induzido por BAPN oral combinado com infusão subcutânea de angiotensina II (Ang II). Após quatro semanas de administração de BAPN seguidas de 24 h de infusão de Ang II, um modelo murino com características semelhantes ao TAD humano foi induzido de forma confiável, e a taxa de sucesso da construção do modelo TAD foi significativamente melhorada. O BAPN oral inibe a reticulação da elastina e do colágeno, resultando na destruição da estrutura da parede aórtica e induzindo a dilatação aórtica e a formação de dissecção até certo ponto. A indução subsequente de Ang II exacerba ainda mais a degeneração da parede aórtica, promovendo assim a ocorrência de TAD. Consequentemente, a combinação de BAPN e Ang II representa uma abordagem refinada para a construção de um modelo TAD murino, oferecendo uma ferramenta valiosa para explorar a patogênese e possíveis abordagens terapêuticas para TAD.
Introdução
A dissecção da aorta torácica (TAC) é uma doença aórtica grave causada por uma ruptura intimal devido ao sangramento dentro da parede da aorta torácica, resultando na separação das camadas da parede aórtica, entrada de sangue na média da parede aórtica, formação de uma falsa luz e pressão sobre a luz verdadeira 1,2,3. Estudos epidemiológicos sugerem que a incidência de TAD está entre 7 e 9 casos por 100.000 pessoas por ano4. Atualmente, acredita-se que a patogênese do TAD seja causada pela estrutura e hemodinâmica anormais da média aórtica, e fatores como hipertensão, dislipidemia e doença vascular hereditária aumentam o risco de TAD5. A intervenção cirúrgica continua sendo a principal opção de tratamento para TAD. No entanto, devido aos altos riscos perioperatórios, explorar a patogênese do TAD e métodos de intervenção precoce para retardar sua progressão é de importância significativa para melhorar o prognóstico do TAD. Como é muito difícil obter amostras humanas e realizar experimentos diretamente em humanos, é necessário estabelecer modelos animais de TAD que mimetizem as características do TAD humano.
Nas últimas décadas, muitos modelos animais de aneurisma da aorta (AA) têm sido amplamente relatados. No entanto, ainda existem poucos estudos sobre o estabelecimento de modelos TAD; alguns pesquisadores até consideraram o TAD um subproduto do modelo animal AA6. De fato, dado que o TAD resulta de uma ruptura intimal inicial da aorta torácica seguida de rápida expansão da falsa luz, essa diferença significativa no mecanismo distingue o TAD do aneurisma da aorta7. Até o momento, a dissecção aórtica de roedor induzida por β-aminopropionitrila (BAPN) é o modelo mais utilizado de TAD. O BAPN, um inibidor específico e irreversível da lisil oxidase, inibe a reticulação de fibras elásticas e fibras colágenas na parede aórtica, sendo amplamente utilizado em modelos animais de dissecção aórtica 8,9,10. Na maioria dos casos, o BAPN foi adicionado à água potável de camundongos para construir modelos TAD, e uma combinação de BAPN e angiotensina II (Ang II) via bomba osmótica foi relatada para construir modelos TAD11,12. No entanto, esses métodos para construir modelos TAD não são descritos em detalhes. Devido às diferenças nas cepas de camundongos, administração de BAPN e concentração e duração de Ang II, a incidência e a extensão das lesões de TAD têm sido instáveis em diferentes experimentos. Portanto, há uma necessidade urgente de um método estável para construir modelos TAD de camundongos.
Aqui, este protocolo descreve em detalhes, passo a passo, um método simples e altamente bem-sucedido usando uma combinação de água suplementada com BAPN e bomba osmótica Ang II para construir um modelo TAD de camundongo. Este protocolo é aplicável à maioria dos laboratórios e é fácil de aprender, permitindo que até mesmo pesquisadores sem experiência na construção de modelos de camundongos o executem de forma consistente.
Protocolo
Os protocolos de animais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade Médica de Tianjin (Número de Aprovação TMUaMEC 2022036). Camundongos machos C57BL/6J com três semanas de idade foram usados neste estudo. Os detalhes dos reagentes e equipamentos usados estão listados na Tabela de Materiais.
1. Manutenção e agrupamento de animais
- Crie os ratos com ração de manutenção padrão. Use camundongos de três semanas para este estudo.
- Atribua aleatoriamente os camundongos ao grupo controle (Controle), ao grupo BAPN oral (BAPN), ao grupo BAPN oral e infusão salina (BAPN + solução salina) e ao grupo BAPN oral e infusão de Ang II (BAPN + Ang II) (Figura 1). Forneça água potável normal aos ratos do grupo controle.
- Forneça aos camundongos do grupo BAPN água potável suplementada com BAPN na dose de 1 mg / g / dia por 4 semanas. Infundir os camundongos do grupo BAPN + Ang II com Ang II (1 ng / g / min) e os camundongos do grupo BAPN + solução salina com uma quantidade equivalente de solução salina por 24 h após 4 semanas de administração oral de BAPN.
2. Preparação para água potável suplementada com BAPN
- Forneça aos camundongos água potável suplementada com BAPN por 4 semanas consecutivas após 3 dias de alimentação adaptativa, definindo 1 dia como um ciclo de indução.
- Pese os camundongos em cada gaiola para calcular a quantidade de BAPN necessária na água potável.
- Registre o volume de água (vol) de cada gaiola no último dia.
- Para garantir a ingestão adequada de água, use 1,3 vezes o volume diário de água (1,3 x vol) como a quantidade de água para um ciclo de indução. Assim, dissolver 1,3 vezes o peso necessário de BAPN no volume calculado de água potável. O método de cálculo detalhado e um exemplo são mostrados na Tabela 1.
NOTA: Os camundongos nessa idade ainda estão em um período de rápido crescimento. Recomenda-se que o volume de ingestão de água dos camundongos seja registrado diariamente durante todo o período de indução do modelo e que a água potável suplementada com BAPN na gaiola seja trocada todos os dias. Para evitar a decomposição do BAPN, embrulhe a garrafa em papel alumínio para protegê-la da luz.
3. Cálculo da massa de Ang II
- Pese cada camundongo e calcule a massa de Ang II necessária para o experimento com base no peso corporal máximo.
- Use o modelo de cálculo (Tabela 2) para calcular a massa Ang II necessária para o experimento.
- Calcule a massa de Ang II necessária para 130 μL de solução de Ang II por camundongo, uma vez que cada bomba requer aproximadamente 100 μL.
- Use o modelo de cálculo (Tabela 3) para calcular o volume de enchimento da solução de Ang II e solução salina necessária para o experimento.
4. Dissolução de Ang II
- Conservar o pó liofilizado de Ang II num frasco para injetáveis selado a -80 °C. Para evitar a condensação de umidade, deixe o Ang II atingir a temperatura ambiente e centrifugue-o antes de abrir.
- Pesar a quantidade calculada de Ang II em um microtubo estéril usando uma balança analítica.
- Adicione o volume calculado de solução salina normal no microtubo contendo a Ang II liofilizada e vore completamente até dissolver completamente.
- Prepare a solução de Ang II necessária separadamente para cada rato numa bancada limpa com base no peso corporal. Vire o microtubo de cabeça para baixo para garantir que a solução esteja bem misturada.
5. Enchimento da bomba osmótica
- Retirar da embalagem as duas partes da bomba osmótica e preparar a bomba com instrumentos estéreis para evitar o risco de infecção.
- Pese cada bomba, incluindo o corpo da bomba e o moderador de fluxo, com uma balança analítica. Registre os dados e use-os para calcular a taxa de preenchimento.
- Conecte o tubo de enchimento a uma seringa estéril de 1 mL recém-aberta e aspire cuidadosamente a solução preparada de Ang II descrita acima, tomando cuidado para não aspirar bolhas de ar.
- Segure o tubo de enchimento na posição para cima e remova cuidadosamente quaisquer bolhas de ar da seringa. Mantenha esta posição para evitar que bolhas de ar entrem no tubo de enchimento.
- Insira cuidadosamente a extremidade do tubo de enchimento na abertura na parte superior da bomba osmótica até que não possa mais ser inserida.
- Segure a bomba osmótica na vertical e aperte lentamente o êmbolo da seringa. Assim que a solução de Ang II aparecer na saída, pare imediatamente e remova cuidadosamente o tubo de enchimento.
- Insira cuidadosa e lentamente o moderador de fluxo na abertura da bomba osmótica até que nenhuma lacuna seja visível entre o moderador de fluxo e a parte superior da bomba. Limpe qualquer excesso de solução de Ang II com papel absorvente estéril.
- Pesar a bomba carregada numa balança analítica e registá-la. A diferença no peso da bomba antes e depois da infusão é a massa da solução de Ang II carregada.
- Calcule a taxa de enchimento usando a seguinte fórmula:
Taxa de enchimento = (massa da bomba cheia - massa da bomba vazia) / (volume padrão) x 100%
NOTA: O volume de enchimento deve ser superior a 90% do volume padrão indicado na folha de instruções. Nesse caso, o preenchimento é bem-sucedido. Caso contrário, a bomba deve ser drenada e reabastecida. - Coloque as bombas cheias em solução salina estéril a 37 °C com a cabeça do moderador levantada por pelo menos 6 h até a implantação.
6. Procedimento cirúrgico para implantação da bomba
- Autoclave todos os instrumentos cirúrgicos, incluindo tesouras, hemostáticos, pinças, pinças de agulha e agulhas de sutura, 24 horas antes do implante da bomba.
- Coloque o camundongo em uma câmara de indução anestésica com isoflurano a 1,5% -2% a uma taxa de fluxo de 2 L / min e estabilize o camundongo por 2 min. Raspe o cabelo do rato em uma área de cerca de 2 cm × 1 cm na pele do meio da escápula.
NOTA: Como a resposta do camundongo ao isoflurano é variável, a concentração pode precisar ser ajustada para manter a anestesia estável. - Coloque o mouse em decúbito ventral com o nariz no cone do nariz conectado à máquina anestésica de isoflurano. Aplique pomada veterinária nos olhos para evitar o ressecamento durante a anestesia. Certifique-se de que o mouse não responda a estímulos dolorosos antes e durante a implantação da bomba.
- Desinfete a pele dorsal três vezes com iodóforo médico.
- Faça cuidadosamente uma incisão transversal de cerca de 1 cm na pele usando um bisturi.
- Segure suavemente a margem incisal com uma pinça curva e disseque sem corte o tecido subcutâneo com outro par de pinças curvas para criar um bolso para a bomba. Certifique-se de que o bolso seja grande o suficiente para permitir que a bomba se mova livremente.
- Insira a bomba cheia na bolsa subcutânea com a cabeça do moderador de fluxo posicionada em direção à extremidade caudal do mouse. Deixe espaço suficiente para fechar a incisão e evite esticar demais a pele.
- Uma vez implantada a bomba, alinhe perfeitamente a margem incisal e feche a pele com suturas não absorvíveis 6-0.
NOTA: Inspecione cuidadosamente o local da incisão para garantir que a ferida esteja completamente fechada e que a bomba não esteja pressionando diretamente contra a incisão. - Limpe a incisão novamente com iodóforo e aplique o gel anestésico de lidocaína a 5% topicamente usando um cotonete estéril. Desligue o isoflurano (0%).
7. Cuidados com animais pós-operatórios
- Monitore os ratos de perto após a implantação da bomba e coloque-os em uma gaiola de recuperação junto com um cobertor aquecido elétrico.
- Permita que os ratos se recuperem sozinhos em uma gaiola quente por pelo menos 20 minutos até acordarem e, em seguida, devolva-os à gaiola original.
- Observe os camundongos de hora em hora durante as primeiras 6 horas após a cirurgia. Nas próximas 18 h, observe os camundongos em intervalos de 6 h. Colete amostras imediatamente se os camundongos estiverem moribundos ou morrerem durante a administração de Ang II.
8. Coleta, fixação, limpeza e imagem de aortas
- Anestesiar camundongos de todos os grupos experimentais com isoflurano e depois sacrificá-los por luxação cervical no final do estudo.
- Coloque os ratos em decúbito dorsal e prenda-os em uma placa de rato. Faça uma incisão abdominal inferior e estenda-a pela parede torácica até que as cavidades torácica e abdominal estejam totalmente expostas.
- Faça imediatamente uma pequena incisão no átrio direito, insira uma seringa estéril no ventrículo esquerdo e injete lentamente aproximadamente 10 mL de solução salina tamponada com fosfato (PBS) gelada através do ventrículo esquerdo até que os pulmões e o fígado fiquem brancos.
- Posteriormente, realize a ressecção dos pulmões, fígado, baço e intestinos. Exponha totalmente toda a aorta e meça o diâmetro máximo da aorta torácica usando um paquímetro digital. Disseque a aorta do coração e faça o transecto de todos os ramos arteriais e artérias ilíacas comuns para colher toda a aorta.
- Fotografe a aorta com uma câmera digital, preserve-a em paraformaldeído a 4% por 24-48 h e incorpore-a em parafina para seccionamento.
NOTA: Tome cuidado para evitar lesões no trato intestinal, pois isso pode interferir na análise do tecido. - Corte seções de parafina aórtica com uma espessura de 3-5 μm usando um micrótomo e, em seguida, execute a desparafinação e a hidratação. Manchar as secções com hematoxilina e eosina (H&E) e Elastic-Van Gieson (EVG) utilizando os respetivos kits de coloração de acordo com as instruções do fabricante.
Resultados
Um total de 70 camundongos C57BL/6J machos, com 3 semanas de idade, foram incluídos neste estudo e distribuídos aleatoriamente em quatro grupos: Controle (n = 10), BAPN (n = 20), BAPN + Solução salina (n = 20) e BAPN + Ang II (n = 20). No grupo BAPN, 11 dos 20 camundongos desenvolveram dissecção da aorta torácica (TAD) 28 dias após a administração do BAPN, com 4 camundongos morrendo de ruptura da aorta. No grupo BAPN + solução salina, 12 dos 20 camundongos desenvolveram TAD, com 4 mortes por ruptura. Notavelmente, no grupo BAPN + Ang II, todos os 20 camundongos desenvolveram TAD, e 7 deles morreram de ruptura da aorta. Não foi observada formação de TAD no grupo Controle (Figura 2A). Imagens aórticas representativas de cada grupo são mostradas na Figura 2B.
Os diâmetros aórticos máximos médios foram de 1,00 ± 0,09 mm (Controle), 2,57 ± 0,22 mm (BAPN), 2,57 ± 0,33 mm (BAPN + Solução salina) e 2,78 ± 0,23 mm (BAPN + Ang II) (Figura 2C). Em comparação com o grupo Controle, todos os três grupos de modelos mostraram diâmetros máximos aórticos significativamente aumentados; no entanto, não foram observadas diferenças significativas entre os próprios grupos de modelos.
A análise histológica usando coloração H&E revelou espessamento das paredes da aorta e acentuada infiltração de células inflamatórias nos grupos BAPN, BAPN + solução salina e BAPN + Ang II, em relação ao grupo Controle. A coloração de EVG demonstrou ainda fragmentação e perda de fibras elásticas nesses grupos (Figura 3).

Figura 1: Protocolo esquemático para indução de dissecção da aorta torácica. A dissecção da aorta foi induzida em camundongos C57BL/6J com 3 semanas de idade por meio da administração oral de β-aminopropionitrila (BAPN) ou subsequente infusão de angiotensina II (Ang II). Os camundongos dos grupos Controle e BAPN receberam água potável normal ou água potável suplementada com BAPN (1 mg / g / dia) por 4 semanas, respectivamente. Os camundongos do grupo BAPN + Ang II ou do grupo BAPN + solução salina foram infundidos com Ang II (1 ng / g / min) ou um volume equivalente de solução salina por 24 horas após completar quatro semanas de tratamento com BAPN. Clique aqui para ver uma versão maior desta figura.
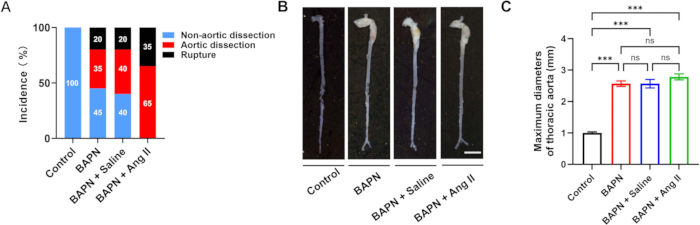
Figura 2: Incidência e morfologia da dissecção da aorta entre os grupos. (A) Taxas de dissecção e ruptura da aorta em cada grupo. (B) Morfologia macroscópica representativa das aortas de cada grupo; barra de escala = 5 mm. (C) Quantificação dos diâmetros máximos da aorta em camundongos com dissecção da aorta (n = 6 por grupo); p < 0,001. Clique aqui para ver uma versão maior desta figura.
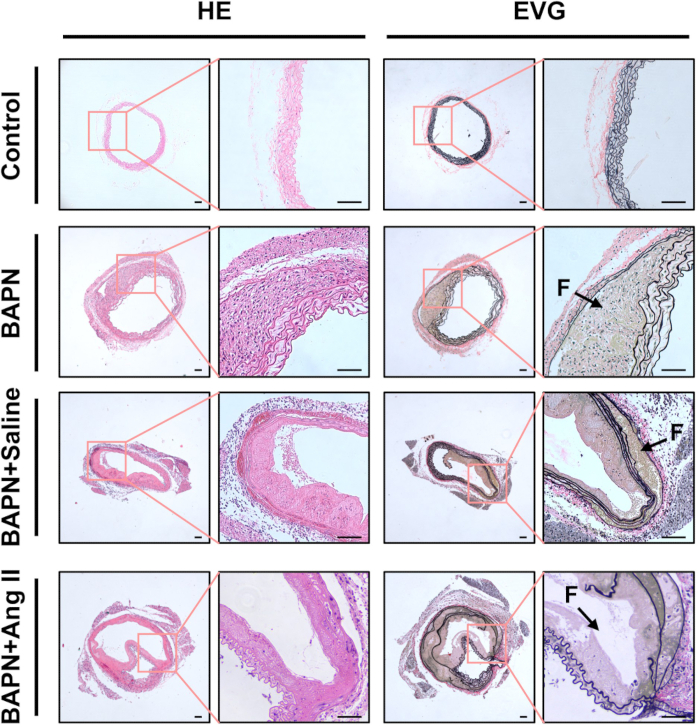
Figura 3: Caracterização histológica das aortas dissecadas. Hematoxilina e eosina (HE) e elastina van Gieson (EVG) representativas coraram cortes de tecido aórtico de cada grupo. Setas pretas indicam lúmens falsos (F); barra de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
| Cálculo do valor do BAPN | |
| Dose | 1 mg/g/d |
| Peso corporal total | x g |
| Dosagem para um ciclo de indução | y mg = 1,3 x (x g x 1 mg/g/d x1 d) |
| Cálculo do volume de água | |
| Ingestão de água (no último dia) | um mL |
| Volume de água para um ciclo de indução | b mL = 1,3 x a mL |
Tabela 1: Cálculo da dosagem de BAPN e volume de água. A quantidade de BAPN necessária foi baseada no peso corporal total dos camundongos por gaiola e na ingestão média diária de água. Para garantir a ingestão adequada, o volume de água calculado foi multiplicado por um fator de 1,3. Por exemplo, para quatro camundongos com peso corporal total de 72,1 g e ingestão diária de água de 10,9 mL, 93,7 mg de BAPN foram dissolvidos em 14,17 mL de água potável por um ciclo de indução.
| Cálculo do valor de Ang II | ||
| Condição geral | Dose | 1 ng/g/min |
| Peso corporal (mais pesado) | x g | |
| Taxa de liberação | 1 μL/h | |
| Número de ratos | b | |
| Por mouse | Dosagem por hora | y ng/h = x g × 60 min × 1 ng/g/min |
| Concentração da solução | z ng/μL = (y ng/h) / (1 μL/h) | |
| Volume de solução necessário por mouse | 130 μL | |
| Massa de Ang II necessária por mouse | a ng = z ng/μL × 130 μL | |
| Todos os mouses | Requisito total de Ang II | m mg = a ng x 10-6 x b |
| Volume de soluto | n μL = 130 μL x b | |
Tabela 2: Cálculo da quantidade de Ang II para infusão de bomba osmótica. A massa de Ang II necessária foi calculada para atingir uma taxa de entrega de 1 ng/g/min para cada camundongo, assumindo 130 μL de solução por bomba. Por exemplo, para um camundongo de 23,5 g, a concentração necessária da solução era de 1410 ng/μL, resultando em uma massa total de Ang II de 1,833 mg para 10 camundongos. Essa quantidade foi dissolvida em 1300 μL de soro fisiológico.
| Cálculo do volume de enchimento | ||||
| Peso corporal | Ang II Volume | Volume de solução salina | Total Volume | |
| Rato 1# | 23,5 gramas | 100 μL | 0 μL | 100 μL |
| Rato 2# | x g | um μL | b μL | 100 μL |
Tabela 3: Cálculo dos volumes de Ang II e enchimento salino por camundongo. Os volumes de enchimento foram ajustados de acordo com o peso corporal individual do camundongo, com um máximo de 100 μL por bomba. Por exemplo, um camundongo pesando 22 g recebeu 93,6 μL de solução de Ang II, e os 6,4 μL restantes foram preenchidos com solução salina para atingir o volume total de 100 μL.
Discussão
Devido à compreensão limitada da dissecção da aorta torácica (TAD) com risco de vida, o estabelecimento de modelos animais estáveis é essencial para explorar os mecanismos moleculares subjacentes ao início e progressão do TAD. A β-aminopropionitrila (BAPN), um inibidor da lisil oxidase, é amplamente utilizada em modelos de TAD em roedores, pois interrompe a reticulação do colágeno e da elastina, enfraquecendo a parede aórtica e aumentando sua suscetibilidade ao estresse mecânico13. No entanto, a administração de BAPN sozinha geralmente resulta em incidência inconsistente de TAD entre os estudos.
Como inibidor da lisil oxidase, o BAPN inibe irreversivelmente a reticulação da elastina e do colágeno10. Acredita-se geralmente que, durante a fase juvenil, a reticulação desses componentes da matriz extracelular ainda esteja em andamento14. Portanto, a administração de BAPN durante esta janela crítica de desenvolvimento pode ser particularmente eficaz para interromper a maturação da matriz, aumentando a probabilidade de indução bem-sucedida de TAD. Vários estudos mostraram que o BAPN sozinho pode induzir TAD em camundongos juvenis, embora a incidência relatada varie amplamente, variando de 9% a 91% após 4 semanas de administração do BAPN 12,15,16.
Notavelmente, o aparecimento de TAD em humanos tem mostrado uma tendência de idade mais jovem nas últimas décadas, com alguns estudos indicando que a idade média das complicações aórticas ocorre entre 30 e 40 anos17,18. Uma vez que o BAPN induz TAD em camundongos de 3 a 4 semanas de idade, prejudicando a reticulação de elastina e colágeno durante o desenvolvimento da matriz extracelular, este modelo pode refletir melhor a fisiopatologia e as características moleculares do TAD de início precoce em humanos19.
Em contraste, o BAPN sozinho é insuficiente para induzir TAD em camundongos adultos 9,20. Para resolver isso, vários estudos combinaram o BAPN com intervenções adicionais. Por exemplo, a administração concomitante de NG-nitro-L-arginina metil éster (L-NAME), BAPN e angiotensina II (Ang II) demonstrou induzir TAD em camundongos adultos21. Dentre estas, a combinação de BAPN e Ang II é a estratégia mais comumente usada para aumentar a incidência de TAD. Ren et al. relataram uma incidência de 100% de TAD quando a Ang II foi infundida por 24 h após um regime de BAPN de 4 semanas, um resultado consistente com os achados deste estudo12. Além disso, a administração de Ang II foi associada a taxas de mortalidade dose-dependentes de 14%, 39% e 67% após 12 h, 24 h e 48 h de infusão, respectivamente22, o que também se alinha com as taxas de mortalidade observadas em nosso modelo experimental.
Existem vários modos de administração do BAPN, incluindo administração via água potável, bombas osmóticas, sonda gástrica, dieta e injeção intraperitoneal 21,22,23,24. Entre estes, a administração através da água potável é o método mais comumente usado para camundongos juvenis. As bombas osmóticas, por outro lado, estão bem estabelecidas para fornecer uma liberação consistente e sustentada de compostos e são frequentemente usadas para infusão de Ang II em modelos de camundongos de aneurismas da aorta25. Embora a infusão subcutânea via bombas possa ser considerada um método ideal para a administração do BAPN, a solubilidade do BAPN e a capacidade da bomba limitam sua viabilidade. A solubilidade máxima do BAPN em água é de aproximadamente 50 mg/mL, o que é insuficiente para atender aos requisitos de concentração para uma administração eficaz baseada em bomba. Portanto, uma solução BAPN altamente concentrada seria necessária. Semelhante ao presente estudo, protocolos recentes adotaram uma abordagem combinada - administração de BAPN em água potável e fornecimento de Ang II via bombas osmóticas26. Este método parece ser ideal para administrar BAPN a camundongos juvenis.
Atualmente, não há consenso padronizado na literatura sobre a dose ideal e a duração da administração do BAPN. Enquanto muitos estudos usaram uma dose de 1 mg/g/dia quando o BAPN é administrado através da água potável, outros descreveram as concentrações de BAPN em termos de 1-3 mg/mL ou 0,2% a 0,6% (peso/vol)27,28,29,30,31. A adição de BAPN à água potável pode alterar a quantidade de água consumida pelos camundongos, e a ingestão de água pode não se correlacionar linearmente com o peso corporal. Consequentemente, uma concentração fixa de BAPN pode resultar em variabilidade na ingestão real de BAPN por camundongo. Para resolver isso, o presente estudo ajustou a água potável suplementada com BAPN diariamente com base no peso corporal e na ingestão de água, com o objetivo de manter uma dose consistente de 1 mg / g / dia.
Este protocolo, no entanto, tem várias limitações. Primeiro, faltam dados basais sobre a incidência e progressão patológica do TAD em pontos intermediários. Em segundo lugar, apenas camundongos machos foram usados neste estudo. Embora o TAD seja mais prevalente em homens, as mulheres apresentam piores resultados, incluindo maior mortalidade e redução da sobrevida em longo prazo após o tratamento cirúrgico32,33. Curiosamente, alguns estudos observaram uma menor incidência de dissecção da aorta em camundongos fêmeas tratados com BAPN e Ang II26,34, o que justifica uma investigação mais aprofundada. Em terceiro lugar, o início da indução do TAD às 3 semanas de idade (análogo à adolescência humana) pode não capturar totalmente os mecanismos fisiopatológicos subjacentes ao TAD de início na idade adulta. Por fim, o alojamento em grupo durante o período de administração do BAPN (4 camundongos por gaiola) introduz variabilidade na ingestão individual de água, o que pode contribuir para diferenças na exposição ao BAPN e na gravidade dos sintomas.
Em conclusão, este protocolo descreve um modelo de camundongo estável, de alta incidência e reprodutível de TAD que imita de perto as características patológicas do TAD humano. Devido à sua simplicidade e confiabilidade, este modelo oferece utilidade valiosa para investigar os mecanismos moleculares subjacentes ao início e progressão do TAD, bem como para avaliar possíveis estratégias terapêuticas.
Divulgações
Os autores deste manuscrito declaram não ter conflitos de interesse.
Agradecimentos
Este trabalho foi apoiado por uma doação da Fundação Nacional de Ciências Naturais da China (82370299) e do Projeto de Construção da Disciplina Médica Chave de Tianjin (Especialidade) (TJYXZDXK-060B).
Materiais
| Name | Company | Catalog Number | Comments |
| 3-Aminopropionitrile Fumarate salt | Sigma-Aldrich | A3134 | |
| Analytical balance | Radwag | AS 220.R2 | |
| Anesthesia Machine | Shanghai Renyi Biological Technology Co. Ltd. | MSS-3 | |
| Angiotensin II | MCE | HY-13948 | |
| C57BL/6J Male Mice | GemPharmatech | N000013 | |
| Chow Diet | Sibeifu Beijing Biotechnology Co. Ltd | SPF-F02-002 | |
| Electrothermal constant temperature water tank | Yiheng Technical Co. Ltd. | DK-8D | |
| EVG Staining Kit | Solarbio | G1590 | |
| GraphPad Prism | Graphpad | Ver 10.0.2 | |
| H&E Staining Kit | Servicebio | G1076 | |
| Hemostat | Shinva Medical Instrument Co. Ltd. | ZH240RN | |
| Isoflurane | RWD | R510-22-10 | |
| Microtube | Axygen Scientific, Inc. | MCT-150-C | |
| Needle forcep | Shinva Medical Instrument Co. Ltd. | ZM234R/RN/RB | |
| Osmotic pump | Alzet | 1003D | |
| Paraformaldehyde | Servicebio | G1101 | |
| PBS, 1x | Servicebio | G4202 | |
| Saline | Servicebio | G4702 | |
| Scalpel | Shinva Medical Instrument Co. Ltd. | ZB084R/RN | |
| Scissor | Shinva Medical Instrument Co. Ltd. | ZC480RN/RB/RNj/RNh | |
| Stereo microscope | Leica | EZ4 | |
| Suture | Jinhuan Medical Supplies Co. Ltd. | F604 | |
| Tweezer | Shinva Medical Instrument Co. Ltd. | ZO022RB |
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados