Method Article
Modèle murin de dissection aortique thoracique induite par perfusion orale de β-aminopropionitrile et d’angiotensine II par voie sous-cutanée
Dans cet article
Résumé
Ce protocole fournit une procédure détaillée, étape par étape, pour l’induction de la dissection de l’aorte thoracique chez la souris. Plus précisément, il comprend le calcul précis des doses requises de β-aminopropionitrile et d’angiotensine II, la procédure de remplissage de la pompe osmotique et la technique d’implantation de la pompe osmotique.
Résumé
La dissection de l’aorte thoracique (TAD) est une maladie cardiovasculaire très mortelle qui manque de traitement médical efficace. La réplication de modèles animaux de la physiopathologie de la TAD est essentielle pour étudier les mécanismes intrinsèques de la TAD. Le modèle TAD largement utilisé induit par le β-aminopropionitrile (BAPN, un inhibiteur irréversible et actif de la lysyl oxydase par voie orale) chez la souris présente la limitation d’un taux de réussite inégal. Ce protocole décrit en détail un modèle murin modifié de TAD induit par BAPN oral associé à une perfusion sous-cutanée d’angiotensine II (Ang II). Après quatre semaines d’administration de BAPN suivies de 24 h de perfusion d’Ang II, un modèle murin avec des caractéristiques similaires à celles du TAD humain a été induit de manière fiable, et le taux de réussite de la construction du modèle TAD a été significativement amélioré. Le BAPN oral inhibe la réticulation de l’élastine et du collagène, ce qui entraîne la destruction de la structure de la paroi aortique et induit une dilatation de l’aorte et la formation d’une dissection dans une certaine mesure. L’induction ultérieure de l’Ang II exacerbe encore la dégénérescence de la paroi aortique, favorisant ainsi l’apparition de la TAD. Par conséquent, la combinaison de BAPN et d’Ang II représente une approche raffinée de la construction d’un modèle murin de TAD, offrant un outil précieux pour explorer la pathogenèse et les approches thérapeutiques potentielles de la TAD.
Introduction
La dissection aortique thoracique (TAD) est une maladie aortique grave causée par une déchirure intimale due à un saignement dans la paroi de l’aorte thoracique, entraînant la séparation des couches de la paroi aortique, le sang pénétrant dans le milieu de la paroi aortique, formant une fausse lumière et provoquant une pression sur la vraie lumière 1,2,3. Des études épidémiologiques suggèrent que l’incidence de la TAD se situe entre 7 et 9 cas pour 100 000 personnes par an4. À l’heure actuelle, on pense que la pathogenèse du TAD est causée par la structure anormale et l’hémodynamique du milieu aortique, et que des facteurs tels que l’hypertension, la dyslipidémie et les maladies vasculaires héréditaires augmentent le risque de TAD5. L’intervention chirurgicale reste la principale option de traitement du TAD. Cependant, en raison des risques périopératoires élevés, l’exploration de la pathogenèse de la TAD et des méthodes d’intervention précoce pour retarder sa progression est d’une importance significative pour améliorer le pronostic de la TAD. Comme il est très difficile d’obtenir des échantillons humains et de réaliser des expériences directement chez l’homme, il est nécessaire d’établir des modèles animaux de TAD qui imitent les caractéristiques de la TAD humaine.
Au cours des dernières décennies, de nombreux modèles animaux d’anévrisme de l’aorte (AA) ont été largement rapportés. Cependant, il existe encore peu d’études sur l’établissement de modèles TAD ; certains chercheurs ont même considéré le TAD comme un sous-produit du modèle animal AA6. En fait, étant donné que le TAD résulte d’une déchirure initiale de l’antine thoracique suivie d’une expansion rapide de la fausse lumière, cette différence significative de mécanisme distingue le TAD de l’anévrisme de l’aorte7. À ce jour, la dissection aortique de rongeur induite par le β-aminopropionitrile (BAPN) est le modèle le plus utilisé de TAD. BAPN, un inhibiteur spécifique et irréversible de la lysyl oxydase, inhibe la réticulation des fibres élastiques et des fibres de collagène dans la paroi aortique, et est largement utilisé dans les modèles animaux de dissection aortique 8,9,10. Dans la plupart des cas, le BAPN a été ajouté à l’eau potable de souris pour construire des modèles TAD, et une combinaison de BAPN et d’angiotensine II (Ang II) via une pompe osmotique a été signalée pour construire des modèles TAD11,12. Cependant, ces méthodes de construction de modèles TAD ne sont pas décrites en détail. En raison des différences dans les souches de souris, l’administration de BAPN et la concentration et la durée de l’Ang II, l’incidence et l’étendue des lésions TAD ont été instables dans différentes expériences. Par conséquent, il est urgent de disposer d’une méthode stable pour construire des modèles TAD chez la souris.
Ici, ce protocole décrit en détail, étape par étape, une méthode simple et très réussie utilisant une combinaison d’eau enrichie en BAPN et de pompe osmotique Ang II pour construire un modèle TAD de souris. Ce protocole est applicable à la plupart des laboratoires et est facile à apprendre, ce qui permet même aux chercheurs sans expérience dans la construction de modèles de souris de l’exécuter de manière cohérente.
Protocole
Les protocoles pour les animaux ont été approuvés par le Comité institutionnel de soin et d’utilisation des animaux de l’Université de médecine de Tianjin (numéro d’approbation TMUaMEC 2022036). Des souris mâles C57BL/6J âgées de trois semaines ont été utilisées dans cette étude. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans la table des matériaux.
1. Entretien et regroupement des animaux
- Élevez les souris sur la nourriture d’entretien standard. Utilisez des souris âgées de trois semaines pour cette étude.
- Répartissez au hasard les souris dans le groupe témoin (contrôle), le groupe BAPN oral (BAPN), le groupe BAPN oral et perfusion saline (BAPN + saline) et le groupe de perfusion orale BAPN et Ang II (BAPN + Ang II) (Figure 1). Fournissez aux souris du groupe témoin de l’eau potable normale.
- Fournir aux souris du groupe BAPN de l’eau potable complétée par du BAPN à une dose de 1 mg/g/jour pendant 4 semaines. Perfuser les souris du groupe BAPN + Ang II avec de l’Ang II (1 ng/g/min) et les souris du groupe BAPN + Saline avec une quantité équivalente de solution saline pendant 24 h après 4 semaines d’administration orale de BAPN.
2. Préparation pour l’eau potable enrichie en BAPN
- Fournissez aux souris de l’eau potable enrichie en BAPN pendant 4 semaines consécutives après 3 jours d’alimentation adaptative, en fixant 1 jour comme cycle d’induction.
- Pesez les souris dans chaque cage pour calculer la quantité de BAPN nécessaire dans l’eau de boisson.
- Notez le volume d’eau (vol) de chaque cage au cours de la dernière journée.
- Pour assurer un apport adéquat en eau, utilisez 1,3 fois le volume d’eau quotidien (1,3 x vol) comme quantité d’eau pour un cycle d’induction. En conséquence, dissoudre 1,3 fois le poids requis de BAPN dans le volume calculé d’eau potable. La méthode de calcul détaillée et un exemple sont présentés dans le tableau 1.
REMARQUE : Les souris de cet âge sont encore dans une période de croissance rapide. Il est recommandé d’enregistrer quotidiennement le volume d’eau consommée par les souris pendant toute la durée de la période d’induction du modèle et de changer tous les jours l’eau de boisson alimentée en BAPN dans la cage. Pour éviter la décomposition du BAPN, enveloppez la bouteille dans du papier d’aluminium pour la protéger de la lumière.
3. Calcul de la masse de l’Ang II
- Pesez chaque souris et calculez la masse Ang II requise pour l’expérience en fonction du poids corporel maximal.
- Utilisez le modèle de calcul (Tableau 2) pour calculer la masse de l’Ang II nécessaire à l’expérience.
- Calculez la masse d’Ang II nécessaire pour 130 μL de solution d’Ang II par souris, car chaque pompe nécessite environ 100 μL.
- À l’aide du modèle de calcul (tableau 3), calculer le volume de remplissage de la solution d’Ang II et de la solution saline nécessaire à l’expérience.
4. Dissolution de l’Ang II
- Conserver la poudre d’Ang II lyophilisée dans un flacon scellé à -80 °C. Pour éviter la condensation d’humidité, laissez l’Ang II s’équilibrer à température ambiante, puis centrifugez-le avant de l’ouvrir.
- Peser la quantité calculée d’Ang II dans un microtube stérile à l’aide d’une balance analytique.
- Ajoutez le volume calculé de solution saline normale dans le microtube contenant l’Ang II lyophilisé et tourbillonnez complètement jusqu’à dissolution complète.
- Préparez la solution d’Ang II requise séparément pour chaque souris sur un banc propre en fonction du poids corporel. Retournez le microtube pour vous assurer que la solution est bien mélangée.
5. Remplissage de la pompe osmotique
- Prélevez les deux parties de la pompe osmotique dans l’emballage et préparez la pompe à l’aide d’instruments stériles pour éviter tout risque d’infection.
- Pesez chaque pompe, y compris le corps de la pompe et le modérateur de débit, à l’aide d’une balance analytique. Enregistrez les données et utilisez-les pour calculer le taux de remplissage.
- Fixez le tube de remplissage à une seringue stérile de 1 ml fraîchement ouverte et aspirez soigneusement la solution d’Ang II préparée décrite ci-dessus, en prenant soin de ne pas aspirer de bulles d’air.
- Tenez le tube de remplissage en position ascendante et retirez soigneusement toutes les bulles d’air de la seringue. Maintenez cette position pour éviter que des bulles d’air ne pénètrent dans le tube de remplissage.
- Insérez doucement l’extrémité du tube de remplissage dans l’ouverture située en haut de la pompe osmotique jusqu’à ce qu’elle ne puisse plus être insérée.
- Tenez la pompe osmotique à la verticale et pressez lentement le piston de la seringue. Une fois que la solution Ang II apparaît à la sortie, arrêtez-vous immédiatement et retirez délicatement le tube de remplissage.
- Insérez soigneusement et lentement le modérateur de débit dans l’ouverture de la pompe osmotique jusqu’à ce qu’aucun espace ne soit visible entre le modérateur de débit et le haut de la pompe. Essuyez tout excès de solution d’Ang II avec du papier absorbant stérile.
- Pesez la pompe chargée sur une balance analytique et enregistrez-la. La différence de poids de la pompe avant et après perfusion est la masse de la solution chargée d’Ang II.
- Calculez le taux de remplissage à l’aide de la formule suivante :
Taux de remplissage = (masse de la pompe remplie - masse de la pompe vide) / (volume standard) x 100 %
REMARQUE : Le volume de remplissage doit être supérieur à 90 % du volume standard indiqué sur la feuille d’instructions. Si c’est le cas, le remplissage est réussi. Sinon, la pompe doit être vidangée et remplie. - Placez les pompes remplies dans une solution saline stérile à 37 °C avec la tête modératrice vers le haut pendant au moins 6 h jusqu’à l’implantation.
6. Procédure chirurgicale pour l’implantation de la pompe
- Autoclavez tous les instruments chirurgicaux, y compris les ciseaux, les hémostatiques, les pinces à épiler, les pinces à aiguille et les aiguilles de suture, 24 heures avant l’implantation de la pompe.
- Placez la souris dans une chambre d’induction anesthésique avec de l’isoflurane à 1,5 % à 2 % à un débit de 2 L/min et stabilisez la souris pendant 2 min. Rasez les poils de souris sur une zone d’environ 2 cm × 1 cm sur la peau mi-scapulaire.
REMARQUE : Étant donné que la réponse de la souris à l’isoflurane est variable, la concentration peut devoir être ajustée pour maintenir une anesthésie stable. - Placez la souris en position couchée avec le nez dans le cône nasal relié à l’appareil d’anesthésie à l’isoflurane. Appliquez une pommade vétérinaire sur les yeux pour prévenir la sécheresse sous anesthésie. Assurez-vous que la souris ne répond pas à des stimuli douloureux avant et pendant l’implantation de la pompe.
- Désinfectez la peau dorsale trois fois avec de l’iodophore médical.
- Faites soigneusement une incision transversale d’environ 1 cm sur la peau à l’aide d’un scalpel.
- Saisissez doucement le bord incisif à l’aide d’une pince incurvée et disséquez brutalement le tissu sous-cutané avec une autre paire de pinces incurvées pour créer une poche pour la pompe. Assurez-vous que la poche est suffisamment grande pour permettre à la pompe de se déplacer librement.
- Insérez la pompe remplie dans la poche sous-cutanée avec la tête du modérateur de débit positionnée vers l’extrémité caudale de la souris. Laissez suffisamment d’espace pour fermer l’incision et évitez de trop étirer la peau.
- Une fois la pompe implantée, alignez soigneusement le bord incisif et fermez la peau avec 6-0 sutures non résorbables.
REMARQUE : Inspectez soigneusement le site de l’incision pour vous assurer que la plaie est complètement fermée et que la pompe n’appuie pas directement contre l’incision. - Nettoyez à nouveau l’incision avec de l’iodophore et appliquez localement un gel anesthésique à 5 % de lidocaïne à l’aide d’un coton-tige stérile. Éteignez l’isoflurane (0 %).
7. Soins postopératoires aux animaux
- Surveillez de près les souris après l’implantation de la pompe et placez-les dans une cage de récupération avec une couverture chauffante électrique.
- Laissez les souris se rétablir seules dans une cage chaude pendant au moins 20 minutes jusqu’à ce qu’elles se réveillent, puis retournez-les dans leur cage d’hébergement d’origine.
- Observez les souris toutes les heures pendant les 6 premières heures après la chirurgie. Pendant les 18 prochaines heures, observez les souris à des intervalles de 6 heures. Prélever des échantillons immédiatement si les souris sont dans un état moribond ou meurent pendant l’administration d’Ang II.
8. Prélèvement, fixation, nettoyage et imagerie des aortes
- Anesthésie les souris de tous les groupes expérimentaux avec de l’isoflurane, puis sacrifie-les par luxation cervicale à la fin de l’étude.
- Placez les souris en position couchée et fixez-les sur une plaque de souris. Faites une incision abdominale inférieure et étendez-la sur la paroi thoracique jusqu’à ce que les cavités thoracique et abdominale soient complètement exposées.
- Faites immédiatement une petite incision dans l’oreillette droite, insérez une seringue stérile dans le ventricule gauche et injectez lentement environ 10 ml de solution saline tamponnée au phosphate (PBS) glacée dans le ventricule gauche jusqu’à ce que les poumons et le foie deviennent blancs.
- Par la suite, effectuez une résection des poumons, du foie, de la rate et des intestins. Exposez entièrement l’aorte entière et mesurez le diamètre maximal de l’aorte thoracique à l’aide d’un pied à coulisse numérique. Disséquez l’aorte à partir du cœur et transectez toutes les branches artérielles et les artères iliaques communes pour prélever l’aorte entière.
- Imagez l’aorte avec un appareil photo numérique, conservez-la dans du paraformaldéhyde à 4 % pendant 24 à 48 h et intégrez-la dans de la paraffine pour la section.
REMARQUE : Veillez à éviter de blesser le tractus intestinal, car cela pourrait interférer avec l’analyse des tissus. - Coupez des sections de paraffine aortique à une épaisseur de 3 à 5 μm à l’aide d’un microtome, puis effectuez le déparaffinage et l’hydratation. Teindre les sections avec de l’hématoxyline et de l’éosine (H&E) et de l’Elastic-Van Gieson (EVG) à l’aide des kits de coloration respectifs selon les instructions du fabricant.
Résultats
Un total de 70 souris mâles C57BL/6J, âgées de 3 semaines, ont été incluses dans cette étude et réparties au hasard en quatre groupes : contrôle (n = 10), BAPN (n = 20), BAPN + salin (n = 20) et BAPN + Ang II (n = 20). Dans le groupe BAPN, 11 souris sur 20 ont développé une dissection de l’aorte thoracique (TAD) 28 jours après l’administration du BAPN, et 4 souris sont mortes d’une rupture aortique. Dans le groupe BAPN + Saline, 12 souris sur 20 ont développé un TAD, avec 4 décès dus à une rupture. Notamment, dans le groupe BAPN + Ang II, les 20 souris ont développé un TAD, et 7 d’entre elles sont mortes d’une rupture aortique. Aucune formation de TAD n’a été observée dans le groupe témoin (figure 2A). Des images aortiques représentatives de chaque groupe sont présentées à la figure 2B.
Les diamètres aortiques maximaux moyens étaient de 1,00 ± 0,09 mm (témoin), 2,57 ± 0,22 mm (BAPN), 2,57 ± 0,33 mm (BAPN + salin) et 2,78 ± 0,23 mm (BAPN + Ang II) (figure 2C). Par rapport au groupe témoin, les trois groupes modèles ont montré une augmentation significative des diamètres aortiques maximaux ; Cependant, aucune différence significative n’a été observée entre les groupes modèles eux-mêmes.
L’analyse histologique à l’aide de la coloration H&E a révélé des parois aortiques épaissies et une infiltration de cellules inflammatoires marquée dans les groupes BAPN, BAPN + Saline et BAPN + Ang II, par rapport au groupe témoin. La coloration EVG a également mis en évidence la fragmentation et la perte de fibres élastiques dans ces groupes (Figure 3).

Figure 1 : Protocole schématique pour l’induction de la dissection aortique thoracique. La dissection aortique a été induite chez des souris C57BL/6J âgées de 3 semaines par l’administration orale de β-aminopropionitrile (BAPN) ou une perfusion ultérieure d’angiotensine II (Ang II). Les souris des groupes témoin et BAPN ont reçu de l’eau potable normale ou de l’eau potable supplémentée en BAPN (1 mg/g/jour) pendant 4 semaines, respectivement. Des souris du groupe BAPN + Ang II ou du groupe BAPN + solution saline ont reçu une perfusion d’Ang II (1 ng/g/min) ou d’un volume équivalent de solution saline pendant 24 h après quatre semaines de traitement au BAPN. Veuillez cliquer ici pour voir une version agrandie de cette figure.
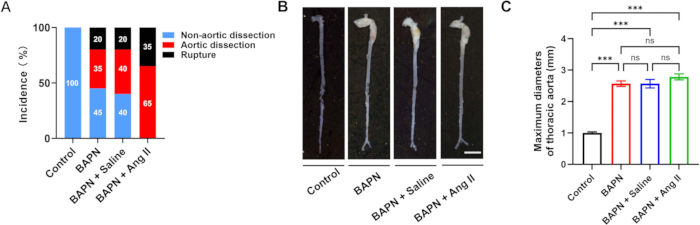
Figure 2 : Incidence et morphologie de la dissection aortique dans les groupes. (A) Taux de dissection aortique et de rupture dans chaque groupe. (B) Morphologie macroscopique représentative des aortes de chaque groupe ; barre d’échelle = 5 mm. (C) Quantification des diamètres aortiques maximaux chez les souris avec dissection aortique (n = 6 par groupe) ; p < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
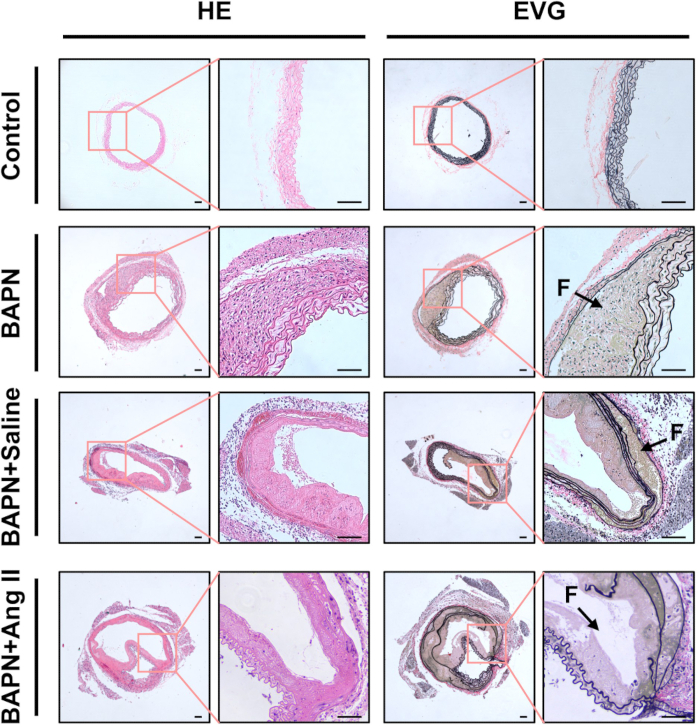
Figure 3 : Caractérisation histologique des aortes disséquées. Des sections représentatives de tissu aortique colorées à l’hématoxyline et à l’éosine (HE) et à l’élastine de van Gieson (EVG) de chaque groupe. Les flèches noires indiquent de fausses lumières (F) ; barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Calcul du montant BAPN | |
| Dose | 1 mg/g/j |
| Poids total du corps | x g |
| Dosage pour un cycle d’induction | y mg = 1,3 x (x g x 1 mg/g/j x1 j) |
| Calcul du volume d’eau | |
| Consommation d’eau (au cours de la dernière journée) | un mL |
| Volume d’eau pour un cycle d’induction | b mL = 1,3 x a mL |
Tableau 1 : Calcul de la dose de BAPN et du volume d’eau. La quantité de BAPN requise était basée sur le poids corporel total des souris par cage et l’apport quotidien moyen en eau. Pour assurer un apport adéquat, le volume d’eau calculé a été multiplié par un facteur de 1,3. Par exemple, chez quatre souris ayant un poids corporel total de 72,1 g et un apport quotidien en eau de 10,9 ml, 93,7 mg de BAPN ont été dissous dans 14,17 ml d’eau potable pendant un cycle d’induction.
| Calcul du montant de l’Ang II | ||
| État général | Dose | 1 ng/g/min |
| Poids corporel (le plus lourd) | x g | |
| Taux de libération | 1 μL/h | |
| Nombre de souris | b | |
| Par souris | Dosage par heure | y ng/h = x g × 60 min × 1 ng/g/min |
| Concentration de la solution | z ng/μL = (y ng/h) / (1 μL/h) | |
| Volume de solution requis par souris | 130 μL | |
| Masse d’Ang II requise par souris | a ng = z ng/μL × 130 μL | |
| Toutes les souris | Exigence totale d’Ang II | m mg = a ng x 10-6 x b |
| Volume de soluté | n μL = 130 μL x b | |
Tableau 2 : Calcul de la quantité d’Ang II pour l’infusion par pompe osmotique. La masse d’Ang II requise a été calculée pour obtenir un débit de 1 ng/g/min pour chaque souris, en supposant 130 μL de solution par pompe. Par exemple, pour une souris de 23,5 g, la concentration de solution requise était de 1410 ng/μL, ce qui a donné une masse totale d’Ang II de 1,833 mg pour 10 souris. Cette quantité a été dissoute dans 1300 μL de solution saline.
| Calcul du volume de remplissage | ||||
| Poids corporel | Volume de l’Ang II | Volume salin | Total Volume | |
| Souris 1# | 23,5 grammes | 100 μL | 0 μL | 100 μL |
| Souris 2# | x g | a μL | b μL | 100 μL |
Tableau 3 : Calcul des volumes de remplissage d’Ang II et de solution saline par souris. Les volumes de remplissage ont été ajustés en fonction du poids corporel de chaque souris, avec un maximum de 100 μL par pompe. Par exemple, une souris pesant 22 g a reçu 93,6 μL de solution d’Ang II, et les 6,4 μL restants ont été remplis de solution saline pour atteindre le volume total de 100 μL.
Discussion
En raison de la compréhension limitée de la dissection de l’aorte thoracique (TAD) potentiellement mortelle, l’établissement de modèles animaux stables est essentiel pour explorer les mécanismes moléculaires sous-jacents à l’apparition et à la progression de la TAD. Le β-aminopropionitrile (BAPN), un inhibiteur de la lysyl oxydase, est largement utilisé dans les modèles de TAD chez les rongeurs, car il perturbe la réticulation du collagène et de l’élastine, affaiblissant ainsi la paroi aortique et augmentant sa sensibilité aux contraintes mécaniques13. Cependant, l’administration de BAPN seule entraîne souvent une incidence incohérente de TAD d’une étude à l’autre.
En tant qu’inhibiteur de la lysyl oxydase, le BAPN inhibe de manière irréversible la réticulation de l’élastine et du collagène10. On pense généralement que pendant la phase juvénile, la réticulation de ces composants de la matrice extracellulaire est toujours en cours14. Par conséquent, l’administration de BAPN pendant cette fenêtre de développement critique peut être particulièrement efficace pour perturber la maturation matricielle, augmentant ainsi la probabilité d’une induction réussie du TAD. Plusieurs études ont montré que le BAPN seul peut induire le TAD chez les souris juvéniles, bien que l’incidence rapportée varie considérablement, allant de 9 % à 91 % après 4 semaines d’administration de BAPN 12,15,16.
Notamment, l’apparition du TAD chez l’homme a montré une tendance vers un âge plus jeune au cours des dernières décennies, certaines études indiquant que l’âge moyen des complications aortiques se situe entre 30 et 40 ans17,18. Étant donné que BAPN induit la TAD chez les souris âgées de 3 à 4 semaines en altérant la réticulation de l’élastine et du collagène pendant le développement de la matrice extracellulaire, ce modèle pourrait mieux refléter la physiopathologie et les caractéristiques moléculaires de la TAD précoce chez l’homme19.
En revanche, le BAPN seul est insuffisant pour induire la TAD chez les souris adultes 9,20. Pour y remédier, diverses études ont combiné le BAPN avec des interventions supplémentaires. Par exemple, il a été démontré que l’administration concomitante d’ester méthylique de NG-nitro-L-arginine (L-NAME), BAPN et d’angiotensine II (Ang II) induit la TAD chez les souris adultes21. Parmi celles-ci, la combinaison de BAPN et d’Ang II est la stratégie la plus couramment utilisée pour améliorer l’incidence des TAD. Ren et coll. ont signalé une incidence de 100 % de TAD lorsque l’Ang II a été perfusé pendant 24 heures après un régime BAPN de 4 semaines, un résultat conforme aux résultats de cette étude12. De plus, l’administration d’Ang II a été associée à des taux de mortalité dose-dépendants de 14 %, 39 % et 67 % après 12 h, 24 h et 48 h de perfusion, respectivement22, ce qui correspond également aux taux de mortalité observés dans notre modèle expérimental.
Il existe plusieurs modes d’administration du BAPN, notamment l’administration par l’eau potable, les pompes osmotiques, la sonde gastrique, l’alimentation et l’injection intrapéritonéale 21,22,23,24. Parmi celles-ci, l’administration par l’eau de boisson est la méthode la plus couramment utilisée pour les souris juvéniles. Les pompes osmotiques, en revanche, sont bien établies pour fournir une libération constante et soutenue de composés et sont fréquemment utilisées pour la perfusion d’Ang II dans des modèles murins d’anévrismes de l’aorte25. Bien que la perfusion sous-cutanée à l’aide de pompes puisse être considérée comme une méthode optimale pour l’administration de BAPN, la solubilité de BAPN et la capacité de la pompe limitent sa faisabilité. La solubilité maximale du BAPN dans l’eau est d’environ 50 mg/mL, ce qui est insuffisant pour répondre aux exigences de concentration pour une administration efficace par pompe. Par conséquent, une solution BAPN hautement concentrée serait nécessaire. À l’instar de la présente étude, des protocoles récents ont adopté une approche combinée : l’administration de BAPN dans l’eau potable et l’administration d’Ang II par des pompes osmotiques26. Cette méthode semble être optimale pour administrer le BAPN aux souris juvéniles.
À l’heure actuelle, il n’existe pas de consensus normalisé dans la littérature concernant la dose et la durée optimales d’administration du BAPN. Bien que de nombreuses études aient utilisé une dose de 1 mg/g/jour lorsque le BAPN est délivré par l’eau potable, d’autres ont décrit les concentrations de BAPN en termes de 1 à 3 mg/mL ou de 0,2 % à 0,6 % (poids/vol)27,28,29,30,31. L’ajout de BAPN à l’eau potable peut modifier la quantité d’eau consommée par les souris, et la consommation d’eau peut ne pas être corrélée linéairement avec le poids corporel. Par conséquent, une concentration fixe de BAPN peut entraîner une variabilité de l’apport réel de BAPN par souris. Pour remédier à ce problème, l’étude actuelle a ajusté l’eau de boisson supplémentée quotidiennement en BAPN en fonction du poids corporel et de l’apport en eau, dans le but de maintenir une dose constante de 1 mg/g/jour.
Ce protocole présente toutefois plusieurs limites. Premièrement, il manque des données de base sur l’incidence et la progression pathologique de la TAD à des moments intermédiaires. Deuxièmement, seules des souris mâles ont été utilisées dans cette étude. Bien que le TAD soit plus répandu chez les hommes, les femmes auraient de moins bons résultats, notamment une mortalité plus élevée et une survie à long terme réduite après un traitement chirurgical32,33. Il est intéressant de noter que certaines études ont observé une incidence plus faible de dissection aortique chez les souris femelles traitées avec BAPN et Ang II26,34, ce qui justifie une enquête plus approfondie. Troisièmement, le déclenchement de l’induction du TAD à l’âge de 3 semaines (analogue à l’adolescence humaine) peut ne pas saisir pleinement les mécanismes physiopathologiques sous-jacents au TAD à l’âge adulte. Enfin, l’hébergement en groupe pendant la période d’administration du BAPN (4 souris par cage) introduit une variabilité dans la consommation d’eau individuelle, ce qui peut contribuer à des différences dans l’exposition au BAPN et la gravité des symptômes.
En conclusion, ce protocole décrit un modèle murin stable, à forte incidence et reproductible de TAD qui imite étroitement les caractéristiques pathologiques de la TAD humaine. En raison de sa simplicité et de sa fiabilité, ce modèle offre une utilité précieuse pour l’étude des mécanismes moléculaires sous-jacents à l’apparition et la progression de la TAD, ainsi que pour l’évaluation de stratégies thérapeutiques potentielles.
Déclarations de divulgation
Les auteurs de ce manuscrit n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Ce travail a été soutenu par une subvention de la Fondation nationale des sciences naturelles de Chine (82370299) et du projet de construction de la discipline médicale clé (spécialité) de Tianjin (TJYXZDXK-060B).
matériels
| Name | Company | Catalog Number | Comments |
| 3-Aminopropionitrile Fumarate salt | Sigma-Aldrich | A3134 | |
| Analytical balance | Radwag | AS 220.R2 | |
| Anesthesia Machine | Shanghai Renyi Biological Technology Co. Ltd. | MSS-3 | |
| Angiotensin II | MCE | HY-13948 | |
| C57BL/6J Male Mice | GemPharmatech | N000013 | |
| Chow Diet | Sibeifu Beijing Biotechnology Co. Ltd | SPF-F02-002 | |
| Electrothermal constant temperature water tank | Yiheng Technical Co. Ltd. | DK-8D | |
| EVG Staining Kit | Solarbio | G1590 | |
| GraphPad Prism | Graphpad | Ver 10.0.2 | |
| H&E Staining Kit | Servicebio | G1076 | |
| Hemostat | Shinva Medical Instrument Co. Ltd. | ZH240RN | |
| Isoflurane | RWD | R510-22-10 | |
| Microtube | Axygen Scientific, Inc. | MCT-150-C | |
| Needle forcep | Shinva Medical Instrument Co. Ltd. | ZM234R/RN/RB | |
| Osmotic pump | Alzet | 1003D | |
| Paraformaldehyde | Servicebio | G1101 | |
| PBS, 1x | Servicebio | G4202 | |
| Saline | Servicebio | G4702 | |
| Scalpel | Shinva Medical Instrument Co. Ltd. | ZB084R/RN | |
| Scissor | Shinva Medical Instrument Co. Ltd. | ZC480RN/RB/RNj/RNh | |
| Stereo microscope | Leica | EZ4 | |
| Suture | Jinhuan Medical Supplies Co. Ltd. | F604 | |
| Tweezer | Shinva Medical Instrument Co. Ltd. | ZO022RB |
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon