Method Article
口服 β-氨基丙腈和皮下注射血管紧张素 II 诱导的胸主动脉夹层小鼠模型
摘要
该协议为小鼠胸主动脉夹层的诱导提供了详细的分步程序。具体来说,它包括精确计算所需剂量的 β-氨基丙腈和血管紧张素 II,渗透泵填充的程序以及渗透泵的植入技术。
摘要
胸主动脉夹层 (TAD) 是一种高度致命的心血管疾病,缺乏有效的药物治疗。TAD 病理生理学动物模型的复制对于研究 TAD 的内在机制至关重要。β-氨基丙腈 (BAPN,一种不可逆且具有口服活性的赖氨酰氧化酶抑制剂) 在小鼠中诱导的广泛使用的 TAD 模型具有成功率不一致的局限性。该方案详细描述了已报道的口服 BAPN 联合皮下血管紧张素 II (Ang II) 输注诱导的 TAD 的改良小鼠模型。BAPN 给药 4 周后,Ang II 输注 24 小时后,可靠地诱导了具有与人 TAD 相似特性的小鼠模型,TAD 模型构建成功率显著提高。口服 BAPN 抑制弹性蛋白和胶原蛋白的交联,导致主动脉壁结构的破坏,并在一定程度上诱导主动脉扩张和夹层形成。随后的 Ang II 诱导进一步加剧了主动脉壁的退化,从而促进了 TAD 的发生。因此,BAPN 和 Ang II 的组合代表了构建小鼠 TAD 模型的改进方法,为探索 TAD 的发病机制和潜在治疗方法提供了有价值的工具。
引言
胸主动脉夹层 (TAD) 是一种严重的主动脉疾病,由胸主动脉壁内出血引起的内膜撕裂引起,导致主动脉壁层分离,血液进入主动脉壁中层,形成假腔,并对真腔造成压力 1,2,3。流行病学研究表明,TAD 的发病率为每年每 100,000 人 7 至 9 例4。目前认为 TAD 的发病机制是由主动脉中层的异常结构和血流动力学引起的,高血压、血脂异常和遗传性血管疾病等因素增加了 TAD5 的风险。手术干预仍然是 TAD 的主要治疗选择。然而,由于围手术期风险高,探索 TAD 的发病机制和早期干预方法以延缓其进展对于改善 TAD 的预后具有重要意义。由于获取人体样本并直接在人体中进行实验非常困难,因此有必要建立模仿人类 TAD 特征的 TAD 动物模型。
在过去的几十年里,许多主动脉瘤 (AA) 的动物模型已被广泛报道。然而,关于建立 TAD 模型的研究仍然很少;一些研究人员甚至认为 TAD 是 AA 动物模型的副产品6。事实上,鉴于 TAD 是由胸主动脉最初的内膜撕裂随后假腔的快速扩张引起的,这种机制的显着差异将 TAD 与主动脉瘤区分开来7。迄今为止,β-氨基丙腈 (BAPN) 诱导的啮齿动物主动脉夹层是最常用的 TAD 模型。BAPN 是一种特异性且不可逆的赖氨酰氧化酶抑制剂,可抑制主动脉壁中弹性纤维和胶原纤维的交联,广泛用于主动脉夹层的动物模型 8,9,10。在大多数情况下,BAPN 已被添加到小鼠的饮用水中以构建 TAD 模型,据报道,通过渗透泵将 BAPN 和血管紧张素 II (Ang II) 组合可构建 TAD 模型11,12。但是,这些构建 TAD 模型的方法没有详细描述。由于小鼠品系、 BAPN 给药以及 Ang II 的浓度和持续时间的差异,TAD 病变的发生率和范围在不同实验中一直不稳定。因此,迫切需要一种稳定的方法来构建小鼠 TAD 模型。
在这里,该协议逐步详细描述了一种简单且非常成功的方法,该方法使用 BAPN 补充水和 Ang II 渗透泵的组合来构建小鼠 TAD 模型。该协议适用于大多数实验室,并且易于学习,即使是没有小鼠模型构建经验的研究人员也可以始终如一地执行它。
研究方案
动物方案由天津医科大学机构动物护理和使用委员会批准(批准号 TMUaMEC 2022036)。本研究使用 3 周龄的 C57BL/6J 雄性小鼠。所用试剂和设备的详细信息列在 材料表中。
1. 动物维护和分组
- 在标准维护食物上饲养老鼠。使用三周龄的小鼠进行这项研究。
- 将小鼠随机分配到对照组(Control),口服BAPN组(BAPN),口服BAPN和生理盐水输注组(BAPN +生理盐水)以及口服BAPN和Ang II输注组(BAPN + Ang II)(图1)。为对照组小鼠提供正常的饮用水。
- 为 BAPN 组小鼠提供补充 BAPN 的饮用水,剂量为 1 mg/g/天,持续 4 周。口服 BAPN 给药 4 周后,用 Ang II (1 ng/g/min) 注入 BAPN + Ang II 组的小鼠,用等量的盐水注入 BAPN + 盐水组的小鼠 24 小时。
2. 补充 BAPN 的饮用水的准备
- 适应性喂养 3 天后,连续 4 周为小鼠提供补充 BAPN 的饮用水,将 1 天设置为诱导周期。
- 称量每个笼子中的小鼠,以计算饮用水中所需的 BAPN 量。
- 记录过去一天每个笼子的水量 (vol)。
- 为确保足够的水摄入量,请使用 1.3 倍于每日水量 (1.3 x vol) 的水量作为诱导循环的水量。因此,将所需重量的 BAPN 的 1.3 倍溶解在计算体积的饮用水中。详细的计算方法和示例如 表 1 所示。
注意:这个年龄的小鼠仍处于快速生长期。建议在整个模型诱导期间每天记录小鼠的饮水量,并且每天更换笼中补充 BAPN 的饮用水。为防止 BAPN 分解,请用铝箔包裹瓶子以避光。
3. Ang II 质量的计算
- 称量每只小鼠,并根据最大体重计算实验所需的 Ang II 质量。
- 使用计算模板(表 2)计算实验所需的 Ang II 质量。
- 计算每只小鼠 130 μL Ang II 溶液所需的 Ang II 质量,因为每个泵大约需要 100 μL。
- 使用计算模板(表 3)计算实验所需的 Ang II 溶液和盐水的填充体积。
4. Ang II 溶解
- 将冻干的 Ang II 粉末储存在 -80 °C 的密封小瓶中。 为防止水分凝结,请让 Ang II 平衡至室温,然后在打开前离心。
- 使用分析天平称量无菌微管中计算出的 Ang II 量。
- 将计算体积的生理盐水加入含有冻干 Ang II 的微管中,并彻底涡旋直至完全溶解。
- 根据体重在干净的工作台上为每只小鼠分别准备所需的 Ang II 溶液。将微管倒置以确保溶液充分混合。
5. 渗透泵填充
- 从包装中取出渗透泵的两部分,并使用无菌器械准备泵,以避免感染风险。
- 使用分析天平称量每个泵,包括泵体和流量调节剂。记录数据并使用它来计算填充率。
- 将填充管连接到新打开的 1 mL 无菌注射器上,小心吸出上述准备好的 Ang II 溶液,注意不要吸入气泡。
- 将填充管保持在向上位置,小心地去除注射器中的任何气泡。保持此位置以防止气泡进入填充管。
- 轻轻地将填充管的末端插入渗透泵顶部的开口中,直到无法进一步插入。
- 直立握住渗透泵,然后慢慢挤压注射器柱塞。一旦 Ang II 溶液出现在出口处,请立即停止并小心地取出填充管。
- 小心地缓慢地将慢流剂插入渗透泵的开口中,直到慢流剂和泵顶部之间看不到间隙。用无菌吸水纸擦去任何多余的 Ang II 溶液。
- 在分析天平上称量加载的泵并记录。输注前后泵重量的差异是负载的 Ang II 溶液的质量。
- 使用以下公式计算填充率:
填充率 =(填充泵的质量 - 空泵的质量)/(标准体积)x 100%
注意: 填充体积应大于说明书上标明的标准体积的 90%。如果是这样,则填充成功。如果没有,应排空泵并重新注满。 - 将装满的泵置于 37 °C 的无菌盐水中,调节剂头向上至少 6 小时,直至植入。
6. 泵植入手术
- 在泵植入前 24 小时对所有手术器械进行高压灭菌,包括剪刀、止血钳、镊子、针镊和缝合针。
- 将鼠标以 2 L/min 的流速放入含有 1.5%-2% 异氟醚的麻醉诱导室中,并稳定鼠标 2 分钟。在肩胛中部皮肤上剃掉约 2 厘米× 1 厘米区域的小鼠毛发。
注意:由于小鼠对异氟醚的反应是可变的,因此可能需要调整浓度以维持稳定的麻醉。 - 将鼠标置于俯卧位置,鼻子位于连接到异氟醚麻醉机的鼻锥中。在麻醉下将兽药膏涂抹在眼睛上以防止干燥。确保小鼠在泵植入之前和期间对疼痛刺激没有反应。
- 用医用碘伏对背部皮肤消毒 3 次。
- 用手术刀小心地在皮肤上做一个约 1 厘米的横向切口。
- 用弯曲的镊子轻轻抓住切口边缘,然后用另一对弯曲的镊子钝地解剖皮下组织,为泵创建一个口袋。确保腔体足够大,以便泵能够自由移动。
- 将装满的泵插入皮下袋,使流量调节器头朝向鼠标的尾端。留出足够的空间来闭合切口,避免过度拉伸皮肤。
- 植入泵后,整齐地对齐切口边缘,并用 6-0 根不可吸收的缝合线缝合皮肤。
注意:仔细检查切口部位,确保伤口完全闭合,并且泵没有直接压在切口上。 - 再次用碘伏清洁切口,并使用无菌棉签局部涂抹 5% 利多卡因麻醉凝胶。关闭异氟醚 (0%)。
7. 术后动物护理
- 泵植入后密切监测小鼠,并将它们与电加热毯一起放入恢复笼中。
- 让小鼠在温暖的笼子中单独恢复至少 20 分钟,直到它们醒来,然后将它们放回原来的笼子里。
- 在手术后的前 6 小时内每小时观察小鼠。在接下来的 18 小时内,以 6 小时的间隔观察小鼠。如果小鼠在 Ang II 给药期间处于垂死状态或死亡,请立即收集样品。
8. 主动脉的采集、固定、清洁和成像
- 用异氟醚麻醉来自所有实验组的小鼠,然后在研究结束时通过颈椎脱位处死它们。
- 将小鼠置于仰卧位并将它们固定在小鼠板上。做一个下腹部切口并将其延伸到胸壁上,直到胸腔和腹腔完全暴露。
- 立即在右心房做一个小切口,将无菌注射器插入左心室,然后通过左心室缓慢注入约 10 mL 冰冷的磷酸盐缓冲盐水 (PBS),直到肺和肝脏变白。
- 随后,进行肺、肝、脾和肠的切除。完全暴露整个主动脉,并使用数字卡尺测量胸主动脉的最大直径。从心脏解剖主动脉,横切所有动脉分支和髂总动脉,以收获整个主动脉。
- 用数码相机对主动脉成像,将其在 4% 多聚甲醛中保存 24-48 小时,并将其包埋在石蜡中进行切片。
注意:注意避免损伤肠道,因为它可能会干扰组织分析。 - 使用切片机以 3-5 μm 的厚度切割主动脉石蜡切片,然后进行脱蜡和水合。根据制造商的说明,使用相应的染色试剂盒,用苏木精和伊红 (H&E) 和 Elastic-Van Gieson (EVG) 对切片进行染色。
结果
本研究共纳入 70 只 3 周龄的雄性 C57BL/6J 小鼠,并随机分为四组:对照组 (n = 10)、BAPN (n = 20)、BAPN + 生理盐水 (n = 20) 和 BAPN + Ang II (n = 20)。在 BAPN 组中,20 只小鼠中有 11 只在 BAPN 给药后 28 天发生胸主动脉夹层 (TAD),其中 4 只小鼠死于主动脉破裂。在 BAPN + Saline 组中,20 只小鼠中有 12 只发生 TAD,其中 4 只因破裂而死亡。值得注意的是,在 BAPN + Ang II 组中,所有 20 只小鼠都发生了 TAD,其中 7 只死于主动脉破裂。在对照组中没有观察到 TAD 形成(图 2A)。每组的代表性主动脉图像如图 2B 所示。
平均最大主动脉直径为 1.00 ± 0.09 毫米(对照)、2.57 ± 0.22 毫米 (BAPN)、2.57 ± 0.33 毫米(BAPN + 生理盐水)和 2.78 ± 0.23 毫米(BAPN + Ang II)(图 2C)。与对照组相比,所有三个模型组均显示最大主动脉直径显著增加;然而,在模型组本身之间没有观察到显着差异。
使用 H&E 染色的组织学分析显示,相对于对照组,BAPN 、 BAPN + 盐水和 BAPN + Ang II 组主动脉壁增厚,炎症细胞浸润明显。EVG 染色进一步显示这些组中弹性纤维的碎裂和丢失(图 3)。

图 1:胸主动脉夹层诱导方案示意图。 通过口服 β-氨基丙腈 (BAPN) 或随后输注血管紧张素 II (Ang II) 诱导 3 周龄 C57BL/6J 小鼠主动脉夹层。对照组和 BAPN 组小鼠分别接受正常饮水或补充 BAPN 的饮水 (1 mg/g/d),持续 4 周。BAPN + Ang II 组或 BAPN + 生理盐水组的小鼠在完成 4 周的 BAPN 治疗后,用 Ang II (1 ng/g/min) 或同等体积的生理盐水输注 24 小时。 请单击此处查看此图的较大版本。
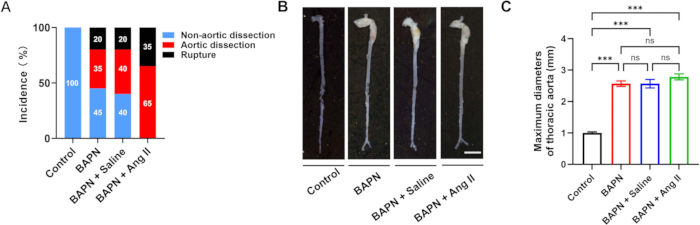
图 2:各组的主动脉夹层发生率和形态。 (A) 每组的主动脉夹层和破裂率。(B) 每组主动脉的代表性大体形态;比例尺 = 5 mm。(C) 主动脉夹层小鼠最大主动脉直径的定量 (每组 n = 6);p < 0.001。 请单击此处查看此图的较大版本。
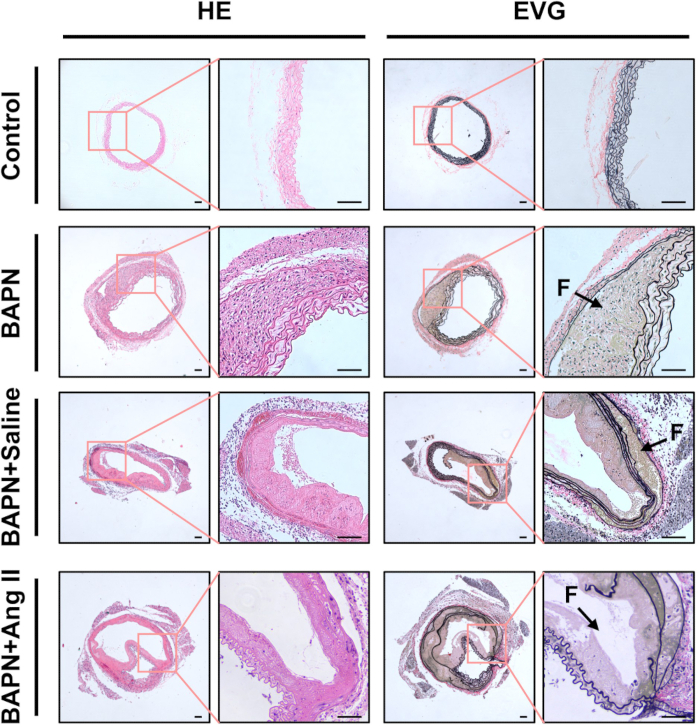
图 3:夹层主动脉的组织学特征。 代表性苏木精和伊红 (HE) 和弹性蛋白 van Gieson (EVG) 对每组主动脉组织的切片进行染色。黑色箭头表示假流明 (F);比例尺 = 100 μm。 请点击此处查看此图的较大版本。
| BAPN 金额的计算 | |
| 剂量 | 1 毫克/克/天 |
| 总体重量 | x g |
| 诱导循环的剂量 | Y 毫克 = 1.3 x (x g x 1 毫克/g/d x1 d) |
| 水量的计算 | |
| 饮水量(过去一天) | 一 毫升 |
| 诱导循环的水量 | b mL = 1.3 x a mL |
表 1:BAPN 剂量和水量的计算。 所需的 BAPN 量基于每个笼子小鼠的总体重和平均每日饮水量。为了确保足够的进水量,将计算出的水量乘以 1.3 倍。例如,对于四只总体重为 72.1 g、每日饮水量为 10.9 mL 的小鼠,将 93.7 mg BAPN 溶解在 14.17 mL 饮用水中,进行一个诱导循环。
| Ang II 金额的计算 | ||
| 一般条件 | 剂量 | 1 纳克/克/分钟 |
| 体重(最重) | x g | |
| 释放速率 | 1 微升/小时 | |
| 小鼠数量 | b | |
| 每只鼠标 | 每小时剂量 | Y ng/h = x g × 60 min × 1 ng/g/min |
| 溶液浓度 | z ng/μL = (y ng/h) / (1 μL/h) | |
| 每只鼠标所需的溶液体积 | 130 微升 | |
| 每只小鼠所需的 Ang II 质量 | a ng = z ng/μL × 130 μL | |
| 所有鼠标 | 总 Ang II 需求 | m 毫克 = 一 ng x 10-6 x b |
| 溶质体积 | n μL = 130 μL x b | |
表 2:渗透泵输注的 Ang II 量的计算。 假设每次泵 130 μL 溶液,计算所需的 Ang II 质量为每只小鼠 1 ng/g/min 的输送速率。例如,对于一只 23.5 g 小鼠,所需的溶液浓度为 1410 ng/μL,因此 10 只小鼠的 Ang II 总质量为 1.833 mg。将该量溶于 1300 μL 生理盐水中。
| 填充量的计算 | ||||
| 体重 | Ang II 卷 | 盐水量 | 总体积 | |
| 鼠标 1# | 23.5 克 | 100 微升 | 0 μL | 100 微升 |
| 鼠标 2# | x g | 一 微升 | b μL | 100 微升 |
表 3:每只小鼠的 Ang II 和盐水填充体积的计算。 根据小鼠个体体重调整填充体积,每次泵的最大填充量为 100 μL。例如,一只体重为 22 g 的小鼠接受 93.6 μL Ang II 溶液,剩余的 6.4 μL 加入盐水以达到 100 μL 的总体积。
讨论
由于对危及生命的胸主动脉夹层 (TAD) 的了解有限,建立稳定的动物模型对于探索 TAD 发生和进展的分子机制至关重要。β-氨基丙腈 (BAPN) 是一种赖氨酰氧化酶抑制剂,广泛用于 TAD 的啮齿动物模型,因为它破坏了胶原蛋白和弹性蛋白的交联,从而削弱了主动脉壁并增加了其对机械应力的敏感性13。然而,单独的 BAPN 给药通常会导致不同研究的 TAD 发生率不一致。
作为赖氨酰氧化酶抑制剂,BAPN 不可逆地抑制弹性蛋白和胶原蛋白10 的交联。人们普遍认为,在幼年期,这些细胞外基质成分的交联仍在进行中 14。因此,在这个关键的发育窗口期施用 BAPN 可能特别有效地破坏基质成熟,增加 TAD 诱导成功的可能性。几项研究表明,单独使用 BAPN 可以在幼年小鼠中诱导 TAD,尽管报告的发生率差异很大,BAPN 给药 4 周后从 9% 到 91% 不等 12,15,16。
值得注意的是,近几十年来,人类 TAD 的发病呈年轻化趋势,一些研究表明,主动脉并发症的平均年龄在 30 至 40 岁之间17,18。由于 BAPN 通过损害细胞外基质发育过程中的弹性蛋白和胶原蛋白交联在 3 至 4 周龄小鼠中诱导 TAD,因此该模型可能更好地反映人类早发性 TAD 的病理生理学和分子特征19。
相比之下,单独的 BAPN 不足以在成年小鼠中诱导 TAD 9,20。为了解决这个问题,各种研究将 BAPN 与其他干预措施相结合。例如,NG-硝基-L-精氨酸甲酯 (L-NAME)、BAPN 和血管紧张素 II (Ang II) 的共同给药已被证明可在成年小鼠中诱导 TAD21。其中,BAPN 和 Ang II 的组合是提高 TAD 发病率最常用的策略。任 等人报道,在 4 周的 BAPN 方案后输注 Ang II 24 小时时,TAD 的发生率为100%,这一结果与本研究的结果一致 12。此外,Ang II 给药与输注 12 小时、24 小时和 48 小时后 14% 、 39% 和 67% 的剂量依赖性死亡率相关,分别为22,这也与我们的实验模型中观察到的死亡率一致。
BAPN 给药有多种方式,包括通过饮用水、渗透泵、胃管、饮食和腹膜内注射给药 21,22,23,24。其中,通过饮水给药是幼年小鼠最常用的方法。另一方面,渗透泵在提供一致和持续释放化合物方面已得到广泛认可,并经常用于主动脉瘤小鼠模型中的 Ang II 输注25。尽管通过泵皮下输注可能被认为是 BAPN 输送的最佳方法,但 BAPN 的溶解度和泵的容量限制了其可行性。BAPN 在水中的最大溶解度约为 50 mg/mL,不足以满足基于泵的有效输送的浓度要求。因此,需要高度浓缩的 BAPN 溶液。与本研究类似,最近的方案采用了一种组合方法——在饮用水中管理 BAPN 并通过渗透泵输送 Ang II26。这种方法似乎是向幼年小鼠递送 BAPN 的最佳选择。
目前,文献中关于 BAPN 给药的最佳剂量和持续时间没有标准化的共识。虽然许多研究在通过饮用水输送 BAPN 时使用 1 mg/g/天的剂量,但其他研究将 BAPN 浓度描述为 1-3 mg/mL 或 0.2% 至 0.6% (wt/vol)27,28,29,30,31。在饮用水中添加 BAPN 会改变小鼠的饮水量,并且饮水量可能与体重不呈线性关系。因此,固定的 BAPN 浓度可能导致每只小鼠实际 BAPN 摄入量的变化。为了解决这个问题,目前的研究根据体重和水摄入量调整了每天补充 BAPN 的饮用水,旨在保持 1 毫克/克/天的一致剂量。
但是,此协议有几个限制。首先,它缺乏关于中间时间点 TAD 发病率和病理进展的基线数据。其次,本研究仅使用雄性小鼠。虽然 TAD 在男性中更普遍,但据报道女性的结局更差,包括更高的死亡率和手术治疗后的长期生存率降低32,33。有趣的是,一些研究观察到接受 BAPN 和 Ang II 治疗的雌性小鼠主动脉夹层的发生率较低26,34,这值得进一步研究。第三,在 3 周龄时开始诱导 TAD (类似于人类青春期)可能无法完全捕捉成人发病 TAD 的病理生理机制。最后,BAPN 给药期间的群养(每个笼 4 只小鼠)引入了个体饮水量的变化,这可能导致 BAPN 暴露和症状严重程度的差异。
总之,该方案概述了一种稳定、高发生率和可重复的 TAD 小鼠模型,该模型与人类 TAD 的病理特征非常相似。由于其简单性和可靠性,该模型为研究 TAD 发生和进展的分子机制以及评估潜在的治疗策略提供了有价值的实用性。
披露声明
本手稿的作者无需声明任何利益冲突。
致谢
这项工作得到了中国国家自然科学基金 (82370299) 和天津市重点医学学科(专科)建设项目 (TJYXZDXK-060B) 的资助。
材料
| Name | Company | Catalog Number | Comments |
| 3-Aminopropionitrile Fumarate salt | Sigma-Aldrich | A3134 | |
| Analytical balance | Radwag | AS 220.R2 | |
| Anesthesia Machine | Shanghai Renyi Biological Technology Co. Ltd. | MSS-3 | |
| Angiotensin II | MCE | HY-13948 | |
| C57BL/6J Male Mice | GemPharmatech | N000013 | |
| Chow Diet | Sibeifu Beijing Biotechnology Co. Ltd | SPF-F02-002 | |
| Electrothermal constant temperature water tank | Yiheng Technical Co. Ltd. | DK-8D | |
| EVG Staining Kit | Solarbio | G1590 | |
| GraphPad Prism | Graphpad | Ver 10.0.2 | |
| H&E Staining Kit | Servicebio | G1076 | |
| Hemostat | Shinva Medical Instrument Co. Ltd. | ZH240RN | |
| Isoflurane | RWD | R510-22-10 | |
| Microtube | Axygen Scientific, Inc. | MCT-150-C | |
| Needle forcep | Shinva Medical Instrument Co. Ltd. | ZM234R/RN/RB | |
| Osmotic pump | Alzet | 1003D | |
| Paraformaldehyde | Servicebio | G1101 | |
| PBS, 1x | Servicebio | G4202 | |
| Saline | Servicebio | G4702 | |
| Scalpel | Shinva Medical Instrument Co. Ltd. | ZB084R/RN | |
| Scissor | Shinva Medical Instrument Co. Ltd. | ZC480RN/RB/RNj/RNh | |
| Stereo microscope | Leica | EZ4 | |
| Suture | Jinhuan Medical Supplies Co. Ltd. | F604 | |
| Tweezer | Shinva Medical Instrument Co. Ltd. | ZO022RB |
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。