Method Article
Modelo murino de disección aórtica torácica inducida por infusión oral de β-aminopropionitrilo y angiotensina II subcutánea
En este artículo
Resumen
Este protocolo proporciona un procedimiento detallado, paso a paso, para la inducción de la disección aórtica torácica en ratones. En concreto, incluye el cálculo preciso de las dosis necesarias de β-aminopropionitrilo y angiotensina II, el procedimiento de llenado de la bomba osmótica y la técnica de implantación de la bomba osmótica.
Resumen
La disección aórtica torácica (DAT) es una enfermedad cardiovascular altamente mortal que carece de un tratamiento médico eficaz. La replicación de modelos animales de fisiopatología de TAD es esencial para estudiar los mecanismos intrínsecos de TAD. El modelo de TAD ampliamente utilizado inducido por el β-aminopropionitrilo (BAPN, un inhibidor irreversible y oralmente activo de la lisil oxidasa) en ratones tiene la limitación de una tasa de éxito inconsistente. Este protocolo describe en detalle un modelo murino modificado de TAD inducido por BAPN oral combinado con infusión subcutánea de angiotensina II (Ang II). Después de cuatro semanas de administración de BAPN seguidas de 24 h de infusión de Ang II, se indujo de forma fiable un modelo murino con características similares al TAD humano y la tasa de éxito de la construcción del modelo TAD mejoró significativamente. La BAPN oral inhibe la reticulación de la elastina y el colágeno, lo que resulta en la destrucción de la estructura de la pared aórtica e induce la dilatación aórtica y la formación de disección hasta cierto punto. La inducción posterior de Ang II exacerba aún más la degeneración de la pared aórtica, favoreciendo así la aparición de TAD. En consecuencia, la combinación de BAPN y Ang II representa un enfoque refinado para construir un modelo murino de TAD, que ofrece una valiosa herramienta para explorar la patogénesis y los posibles enfoques terapéuticos para el TAD.
Introducción
La disección aórtica torácica (DAT) es una enfermedad aórtica grave causada por un desgarro de la íntima debido a un sangrado dentro de la pared de la aorta torácica, lo que resulta en la separación de las capas de la pared aórtica, la sangre ingresa a los medios de la pared aórtica, formando una luz falsa y causando presión sobre la luz verdadera 1,2,3. Los estudios epidemiológicos sugieren que la incidencia de TAD es de entre 7 y 9 casos por 100.000 personas al año4. En la actualidad, se cree que la patogenia de la TAD está causada por la estructura y hemodinámica anormales del medio aórtico, y factores como la hipertensión, la dislipidemia y la enfermedad vascular hereditaria aumentan el riesgo de TAD5. La intervención quirúrgica sigue siendo la principal opción de tratamiento para la TAD. Sin embargo, debido a los altos riesgos perioperatorios, es de gran importancia explorar la patogénesis de la TAD y los métodos de intervención temprana para retrasar su progresión para mejorar el pronóstico de la TAD. Dado que es muy difícil obtener muestras humanas y realizar experimentos directamente en humanos, es necesario establecer modelos animales de TAD que imiten las características del TAD humano.
En las últimas décadas, se han descrito ampliamente muchos modelos animales de aneurisma aórtico (AA). Sin embargo, todavía hay pocos estudios sobre el establecimiento de modelos TAD; algunos investigadores incluso han considerado que el TAD es un subproducto del modelo animal AA6. De hecho, dado que el TAD es el resultado de un desgarro inicial de la íntima de la aorta torácica seguido de una rápida expansión de la falsa luz, esta diferencia significativa en el mecanismo distingue el TAD del aneurisma aórtico7. Hasta la fecha, la disección aórtica de roedores inducida por β-aminopropionitrilo (BAPN) es el modelo más utilizado de TAD. La BAPN, un inhibidor específico e irreversible de la lisil oxidasa, inhibe la reticulación de las fibras elásticas y las fibras de colágeno en la pared aórtica, y es ampliamente utilizada en modelos animales de disección aórtica 8,9,10. En la mayoría de los casos, se ha añadido BAPN al agua potable de ratones para construir modelos de TAD, y se ha descrito una combinación de BAPN y angiotensina II (Ang II) a través de una bomba osmótica para construir modelos de TAD11,12. Sin embargo, estos métodos para construir modelos TAD no se describen en detalle. Debido a las diferencias en las cepas de ratones, la administración de BAPN y la concentración y duración de Ang II, la incidencia y el alcance de las lesiones de TAD han sido inestables en diferentes experimentos. Por lo tanto, existe una necesidad urgente de un método estable para construir modelos TAD de ratón.
Aquí, este protocolo describe en detalle, paso a paso, un método simple y altamente exitoso que utiliza una combinación de agua suplementada con BAPN y bomba osmótica Ang II para construir un modelo TAD de ratón. Este protocolo es aplicable a la mayoría de los laboratorios y es fácil de aprender, lo que permite que incluso los investigadores sin experiencia en la construcción de modelos de ratón lo realicen de manera consistente.
Protocolo
Los protocolos para animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Médica de Tianjin (Número de Aprobación TMUaMEC 2022036). En este estudio se utilizaron ratones machos C57BL/6J de tres semanas de edad. Los detalles de los reactivos y el equipo utilizado se enumeran en la Tabla de Materiales.
1. Mantenimiento y agrupamiento de animales
- Cría a los ratones en comida de mantenimiento estándar. Utilice ratones de tres semanas de edad para este estudio.
- Asigne aleatoriamente los ratones al grupo control (Control), al grupo BAPN oral (BAPN), al grupo de BAPN oral e infusión salina (BAPN + solución salina), y al grupo de BAPN oral e infusión de Ang II (BAPN + Ang II) (Figura 1). Proporcione a los ratones del grupo de control agua potable normal.
- Proporcionar a los ratones del grupo BAPN agua potable suplementada con BAPN a una dosis de 1 mg/g/día durante 4 semanas. Infundir a los ratones del grupo BAPN + Ang II con Ang II (1 ng/g/min) y a los ratones del grupo BAPN + solución salina con una cantidad equivalente de solución salina durante 24 h después de 4 semanas de administración oral de BAPN.
2. Preparación para agua potable suplementada con BAPN
- Proporcione a los ratones agua potable suplementada con BAPN durante 4 semanas consecutivas después de 3 días de alimentación adaptativa, estableciendo 1 día como ciclo de inducción.
- Pesa los ratones en cada jaula para calcular la cantidad de BAPN requerida en el agua potable.
- Registre el volumen de agua (vol) de cada jaula durante el día anterior.
- Para asegurar una ingesta adecuada de agua, use 1,3 veces el volumen de agua diario (1,3 x vol) como la cantidad de agua para un ciclo de inducción. En consecuencia, disuelva 1,3 veces el peso requerido de BAPN en el volumen calculado de agua potable. En la Tabla 1 se muestra un método de cálculo detallado y un ejemplo.
NOTA: Los ratones a esta edad todavía se encuentran en un período de rápido crecimiento. Se recomienda que el volumen de ingesta de agua de los ratones se registre diariamente durante todo el período de inducción del modelo y que el agua potable suplementada con BAPN en la jaula se cambie todos los días. Para evitar la descomposición del BAPN, envuelva la botella en papel de aluminio para protegerla de la luz.
3. Cálculo de la masa de Ang II
- Pesa cada ratón y calcula la masa de Ang II necesaria para el experimento en función del peso corporal máximo.
- Utilice la plantilla de cálculo (Tabla 2) para calcular la masa de Ang II necesaria para el experimento.
- Calcule la masa de Ang II requerida para 130 μL de solución de Ang II por ratón, ya que cada bomba requiere aproximadamente 100 μL.
- Utilice la plantilla de cálculo (Tabla 3) para calcular el volumen de llenado de la solución de Ang II y la solución salina necesaria para el experimento.
4. Disolución de Ang II
- Almacene el polvo liofilizado de Ang II en un vial sellado a -80 °C. Para evitar la condensación de humedad, deje que el Ang II se equilibre a temperatura ambiente y luego centrifurícelo antes de abrirlo.
- Pesar la cantidad calculada de Ang II en un microtubo estéril utilizando una balanza analítica.
- Agregue el volumen calculado de solución salina normal en el microtubo que contiene el Ang II liofilizado y el vórtice completamente hasta que se disuelva por completo.
- Prepare la solución de Ang II requerida por separado para cada ratón en un banco limpio en función del peso corporal. Dale la vuelta al microtubo para asegurarte de que la solución esté bien mezclada.
5. Llenado de la bomba osmótica
- Obtenga las dos partes de la bomba osmótica del paquete y prepare la bomba con instrumentos estériles para evitar el riesgo de infección.
- Pese cada bomba, incluido el cuerpo de la bomba y el moderador de flujo, con una balanza analítica. Registre los datos y utilícelos para calcular la relación de llenado.
- Conecte el tubo de llenado a una jeringa estéril de 1 ml recién abierta y aspire cuidadosamente la solución de Ang II preparada descrita anteriormente, teniendo cuidado de no aspirar burbujas de aire.
- Sostenga el tubo de llenado en la posición hacia arriba y retire con cuidado las burbujas de aire de la jeringa. Mantenga esta posición para evitar que entren burbujas de aire en el tubo de llenado.
- Inserte suavemente el extremo del tubo de llenado en la abertura en la parte superior de la bomba osmótica hasta que no se pueda insertar más.
- Sostenga la bomba osmótica en posición vertical y apriete lentamente el émbolo de la jeringa. Una vez que aparezca la solución de Ang II en la salida, deténgase inmediatamente y retire con cuidado el tubo de llenado.
- Inserte con cuidado y lentamente el moderador de flujo en la abertura de la bomba osmótica hasta que no quede ningún espacio visible entre el moderador de flujo y la parte superior de la bomba. Limpie el exceso de solución de Ang II con papel absorbente estéril.
- Pese la bomba cargada en una balanza analítica y regístrese. La diferencia en el peso de la bomba antes y después de la infusión es la masa de la solución de Ang II cargada.
- Calcule la tasa de llenado utilizando la siguiente fórmula:
Tasa de llenado = (masa de la bomba llena - masa de la bomba vacía) / (volumen estándar) x 100%
NOTA: El volumen de llenado debe ser más del 90% del volumen estándar indicado en la hoja de instrucciones. Si es así, el relleno se ha realizado correctamente. De lo contrario, la bomba debe vaciarse y volver a llenarse. - Coloque las bombas llenas en solución salina estéril a 37 °C con la cabeza del moderador hacia arriba durante al menos 6 h hasta la implantación.
6. Procedimiento quirúrgico para la implantación de la bomba
- Autoclave todos los instrumentos quirúrgicos, incluidas tijeras, hemostáticos, pinzas, pinzas de aguja y agujas de sutura, 24 horas antes de la implantación de la bomba.
- Coloque el ratón en una cámara de inducción anestésica con isoflurano al 1,5%-2% a un caudal de 2 L/min y estabilice el ratón durante 2 min. Afeita el pelo del ratón en un área de aproximadamente 2 cm × 1 cm en la piel media del escapulario.
NOTA: Debido a que la respuesta del ratón al isoflurano es variable, es posible que sea necesario ajustar la concentración para mantener una anestesia estable. - Coloque el ratón en posición prona con la nariz en el cono de la nariz conectado a la máquina de anestesia de isoflurano. Aplique ungüento veterinario en los ojos para evitar la sequedad mientras está bajo anestesia. Asegúrese de que el ratón no responda a estímulos dolorosos antes y durante la implantación de la bomba.
- Desinfectar la piel dorsal tres veces con yodóforo médico.
- Realice con cuidado una incisión transversal de aproximadamente 1 cm en la piel con un bisturí.
- Sujete suavemente el margen incisal con pinzas curvas y diseccione sin rodeos el tejido subcutáneo con otro par de pinzas curvas para crear un bolsillo para la bomba. Asegúrese de que el bolsillo sea lo suficientemente grande como para permitir que la bomba se mueva libremente.
- Inserte la bomba llena en la bolsa subcutánea con el cabezal moderador de flujo colocado hacia el extremo caudal del ratón. Deje suficiente espacio para cerrar la incisión y evite estirar demasiado la piel.
- Una vez implantada la bomba, alinear cuidadosamente el margen incisal y cerrar la piel con suturas 6-0 no absorbibles.
NOTA: Inspeccione cuidadosamente el sitio de la incisión para asegurarse de que la herida esté completamente cerrada y que la bomba no esté presionando directamente contra la incisión. - Limpie la incisión nuevamente con yodoforo y aplique gel anestésico de lidocaína al 5% por vía tópica con un hisopo de algodón estéril. Apague el isoflurano (0%).
7. Cuidados postoperatorios de los animales
- Monitoree de cerca a los ratones después de la implantación de la bomba y colóquelos en una jaula de recuperación junto con una manta térmica eléctrica.
- Permita que los ratones se recuperen solos en una jaula cálida durante al menos 20 minutos hasta que se despierten y luego devuélvalos a su jaula de alojamiento original.
- Observe a los ratones cada hora durante las primeras 6 horas después de la cirugía. Durante las siguientes 18 horas, observe a los ratones a intervalos de 6 horas. Recoja muestras inmediatamente si los ratones están en un estado moribundo o mueren durante la administración de Ang II.
8. Extracción, fijación, limpieza y obtención de imágenes de aortas
- Anestesiar ratones de todos los grupos experimentales con isoflurano y luego sacrificarlos por luxación cervical al final del estudio.
- Coloque los ratones en posición supina y asegúrelos en una placa de ratón. Haga una incisión en la parte inferior del abdomen y extiéndala a través de la pared torácica hasta que las cavidades torácica y abdominal estén completamente expuestas.
- Inmediatamente haga una pequeña incisión en la aurícula derecha, inserte una jeringa estéril en el ventrículo izquierdo e inyecte lentamente aproximadamente 10 ml de solución salina tamponada con fosfato (PBS) helada a través del ventrículo izquierdo hasta que los pulmones y el hígado se vuelvan blancos.
- Posteriormente, realizar la resección de los pulmones, el hígado, el bazo y los intestinos. Exponga completamente toda la aorta y mida el diámetro máximo de la aorta torácica con un calibrador digital. Diseccionar la aorta desde el corazón y seccionar todas las ramas arteriales y las arterias ilíacas comunes para extraer toda la aorta.
- Tome imágenes de la aorta con una cámara digital, consérvela en paraformaldehído al 4% durante 24-48 h e insértela en parafina para la sección.
NOTA: Tenga cuidado de evitar lesiones en el tracto intestinal, ya que puede interferir con el análisis de tejidos. - Corte secciones de parafina aórtica con un grosor de 3-5 μm con un micrótomo, luego realice el desparafinado y la hidratación. Teñir las secciones con hematoxilina y eosina (H&E) y Elastic-Van Gieson (EVG) utilizando los respectivos kits de tinción de acuerdo con las instrucciones del fabricante.
Resultados
Un total de 70 ratones machos C57BL/6J, de 3 semanas de edad, fueron incluidos en este estudio y asignados aleatoriamente a cuatro grupos: Control (n = 10), BAPN (n = 20), BAPN + Salina (n = 20) y BAPN + Ang II (n = 20). En el grupo de BAPN, 11 de 20 ratones desarrollaron disección aórtica torácica (TAD) 28 días después de la administración de BAPN, y 4 ratones murieron por ruptura aórtica. En el grupo BAPN + solución salina, 12 de 20 ratones desarrollaron TAD, con 4 muertes por ruptura. En particular, en el grupo BAPN + Ang II, los 20 ratones desarrollaron TAD y 7 de ellos murieron por ruptura aórtica. No se observó formación de TAD en el grupo control (Figura 2A). En la Figura 2B se muestran imágenes aórticas representativas de cada grupo.
Los diámetros aórticos máximos promedio fueron 1,00 ± 0,09 mm (Control), 2,57 ± 0,22 mm (BAPN), 2,57 ± 0,33 mm (BAPN + Suero Fisiológico) y 2,78 ± 0,23 mm (BAPN + Ang II) (Figura 2C). En comparación con el grupo control, los tres grupos de modelos mostraron un aumento significativo de los diámetros aórticos máximos; sin embargo, no se observaron diferencias significativas entre los propios grupos del modelo.
El análisis histológico mediante tinción con H&E reveló paredes aórticas engrosadas y marcada infiltración de células inflamatorias en los grupos BAPN, BAPN + solución salina y BAPN + Ang II, en relación con el grupo control. La tinción con EVG demostró además la fragmentación y pérdida de fibras elásticas en estos grupos (Figura 3).

Figura 1: Protocolo esquemático para la inducción de la disección aórtica torácica. Se indujo disección aórtica en ratones C57BL/6J de 3 semanas de edad mediante la administración oral de β-aminopropionitrilo (BAPN) o la infusión posterior de angiotensina II (Ang II). Los ratones de los grupos Control y BAPN recibieron agua potable normal o agua potable suplementada con BAPN (1 mg/g/día) durante 4 semanas, respectivamente. Los ratones del grupo BAPN + Ang II o del grupo BAPN + solución salina se infundieron con Ang II (1 ng/g/min) o un volumen equivalente de solución salina durante 24 h después de completar cuatro semanas de tratamiento con BAPN. Haga clic aquí para ver una versión más grande de esta figura.
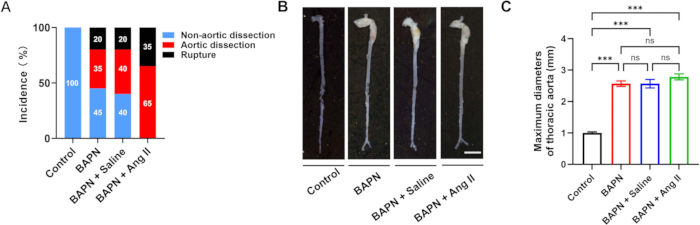
Figura 2: Incidencia y morfología de la disección aórtica en todos los grupos. (A) Tasas de disección y ruptura aórtica en cada grupo. (B) Morfología macroscópica representativa de las aortas de cada grupo; barra de escala = 5 mm. (C) Cuantificación de diámetros aórticos máximos en ratones con disección aórtica (n = 6 por grupo); p < 0,001. Haga clic aquí para ver una versión más grande de esta figura.
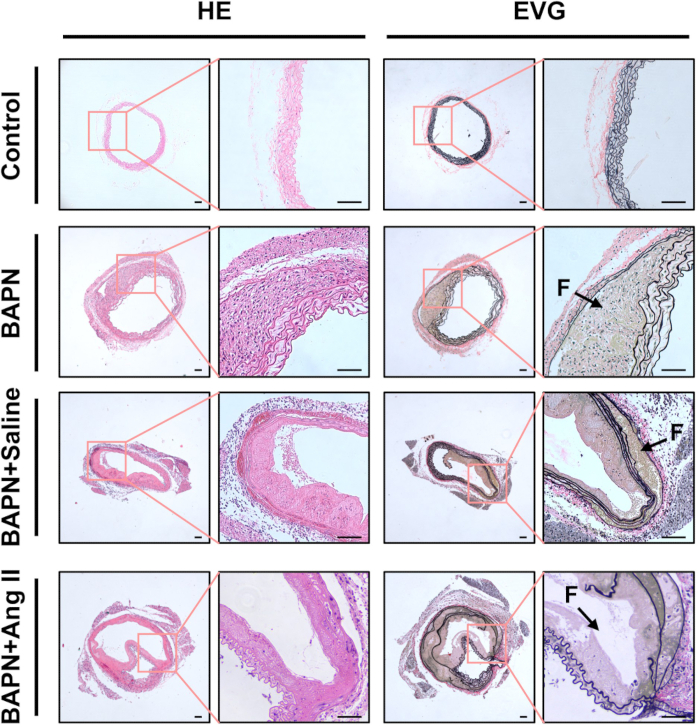
Figura 3: Caracterización histológica de las aortas disecadas. Secciones representativas de tejido aórtico teñidas con hematoxilina y eosina (HE) y elastina van Gieson (EVG) de cada grupo. Las flechas negras indican lúmenes falsos (F); barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
| Cálculo del importe de la BAPN | |
| Dosis | 1 mg/g/d |
| Peso corporal total | x g |
| Dosificación para un ciclo de inducción | y mg = 1,3 x (x g x 1 mg/g/d x1 d) |
| Cálculo del volumen de agua | |
| Ingesta de agua (durante el último día) | un mL |
| Volumen de agua para un ciclo de inducción | b mL = 1.3 x a mL |
Tabla 1: Cálculo de la dosis de BAPN y el volumen de agua. La cantidad de BAPN requerida se basó en el peso corporal total de los ratones por jaula y la ingesta diaria promedio de agua. Para asegurar una ingesta adecuada, el volumen de agua calculado se multiplicó por un factor de 1,3. Por ejemplo, para cuatro ratones con un peso corporal total de 72,1 g y una ingesta diaria de agua de 10,9 mL, se disolvieron 93,7 mg de BAPN en 14,17 mL de agua potable durante un ciclo de inducción.
| Cálculo de la cantidad de Ang II | ||
| Estado general | Dosis | 1 ng/g/min |
| Peso corporal (más pesado) | x g | |
| Tasa de liberación | 1 μL/h | |
| Número de ratones | b | |
| Por ratón | Dosis por hora | y ng/h = x g × 60 min × 1 ng/g/min |
| Concentración de la solución | z ng/μL = (y ng/h) / (1 μL/h) | |
| Volumen de solución requerido por ratón | 130 μL | |
| Masa requerida de Ang II por ratón | a ng = z ng/μL × 130 μL | |
| Todos los ratones | Requerimiento total de Ang II | m mg = a ng x 10-6 x b |
| Volumen de soluto | n μL = 130 μL x b | |
Tabla 2: Cálculo de la cantidad de Ang II para la infusión con bomba osmótica. La masa de Ang II requerida se calculó para lograr una tasa de entrega de 1 ng/g/min para cada ratón, suponiendo 130 μL de solución por bomba. Por ejemplo, para un ratón de 23,5 g, la concentración de solución requerida fue de 1410 ng/μL, lo que resultó en una masa total de Ang II de 1,833 mg para 10 ratones. Esta cantidad se disolvió en 1300 μL de solución salina.
| Cálculo del volumen de llenado | ||||
| Peso corporal | Ang II Volumen | Volumen salino | Volumen total | |
| Ratón 1# | 23,5 g | 100 μL | 0 μL | 100 μL |
| Ratón 2# | x g | a μL | b μL | 100 μL |
Tabla 3: Cálculo de los volúmenes de llenado de Ang II y solución salina por ratón. Los volúmenes de llenado se ajustaron de acuerdo con el peso corporal individual del ratón, con un máximo de 100 μL por bomba. Por ejemplo, un ratón que pesaba 22 g recibió 93,6 μL de solución de Ang II, y los 6,4 μL restantes se llenaron con solución salina para alcanzar el volumen total de 100 μL.
Discusión
Debido a la comprensión limitada de la disección aórtica torácica (DAT) potencialmente mortal, el establecimiento de modelos animales estables es esencial para explorar los mecanismos moleculares que subyacen a la aparición y progresión de la TAD. β-aminopropionitrilo (BAPN), un inhibidor de la lisil oxidasa, es ampliamente utilizado en modelos de TAD en roedores porque interrumpe la reticulación del colágeno y la elastina, debilitando así la pared aórtica y aumentando su susceptibilidad al estrés mecánico13. Sin embargo, la administración de BAPN por sí sola a menudo da lugar a una incidencia inconsistente de TAD en todos los estudios.
Como inhibidor de la lisil oxidasa, BAPN inhibe irreversiblemente la reticulación de la elastina y el colágeno10. En general, se cree que durante la fase juvenil, el entrecruzamiento de estos componentes de la matriz extracelular aún está en curso14. Por lo tanto, la administración de BAPN durante este período crítico de desarrollo puede ser particularmente eficaz para interrumpir la maduración de la matriz, lo que aumenta la probabilidad de una inducción exitosa de TAD. Varios estudios han demostrado que la BAPN sola puede inducir TAD en ratones jóvenes, aunque la incidencia reportada varía ampliamente, oscilando entre el 9% y el 91% después de 4 semanas de administración de BAPN 12,15,16.
Cabe destacar que el inicio de la TAD en humanos ha mostrado una tendencia hacia una edad más temprana en las últimas décadas, con algunos estudios que indican que la edad promedio de las complicaciones aórticas ocurre entre los 30 y 40 años17,18. Dado que la BAPN induce TAD en ratones de 3 a 4 semanas de edad al alterar la reticulación de elastina y colágeno durante el desarrollo de la matriz extracelular, este modelo puede reflejar mejor la fisiopatología y las características moleculares de la TAD de inicio temprano en humanos19.
Por el contrario, la BAPN por sí sola es insuficiente para inducir TAD en ratones adultos 9,20. Para abordar esto, varios estudios han combinado BAPN con intervenciones adicionales. Por ejemplo, se ha demostrado que la administración conjunta de NG-nitro-L-arginina metil éster (L-NAME), BAPN y angiotensina II (Ang II) induce TAD en ratones adultos21. Entre ellas, la combinación de BAPN y Ang II es la estrategia más utilizada para aumentar la incidencia de TAD. Ren et al. reportaron una incidencia del 100% de TAD cuando se infundió Ang II durante 24 h después de un régimen de BAPN de 4 semanas, un resultado consistente con los hallazgos de este estudio12. Además, la administración de Ang II se ha asociado con tasas de mortalidad dependientes de la dosis del 14%, 39% y 67% después de 12 h, 24 h y 48 h de infusión, respectivamente22, lo que también se alinea con las tasas de mortalidad observadas en nuestro modelo experimental.
Existen varios modos de administración de BAPN, incluyendo la administración a través de agua potable, bombas osmóticas, sonda gástrica, dieta e inyección intraperitoneal 21,22,23,24. Entre estos, la administración a través del agua potable es el método más utilizado para los ratones jóvenes. Las bombas osmóticas, por otro lado, están bien establecidas para proporcionar una liberación constante y sostenida de compuestos y se utilizan con frecuencia para la infusión de Ang II en modelos murinos de aneurismas aórticos25. Aunque la infusión subcutánea a través de bombas puede considerarse un método óptimo para la administración de BAPN, la solubilidad de la BAPN y la capacidad de la bomba limitan su viabilidad. La solubilidad máxima de BAPN en agua es de aproximadamente 50 mg/mL, lo que es insuficiente para cumplir con los requisitos de concentración para un suministro efectivo basado en bombas. Por lo tanto, sería necesaria una solución BAPN altamente concentrada. Al igual que en el presente estudio, los protocolos recientes han adoptado un enfoque combinado: la administración de BAPN en el agua potable y la administración de Ang II a través de bombas osmóticas26. Este método parece ser óptimo para administrar BAPN a ratones jóvenes.
En la actualidad, no existe un consenso estandarizado en la literatura sobre la dosis óptima y la duración de la administración de BAPN. Mientras que muchos estudios han utilizado una dosis de 1 mg/g/día cuando la BAPN se administra a través del agua potable, otros han descrito concentraciones de BAPN en términos de 1-3 mg/mL o 0,2% a 0,6% (peso/vol)27,28,29,30,31. La adición de BAPN al agua potable puede alterar la cantidad de agua consumida por los ratones, y la ingesta de agua puede no correlacionarse linealmente con el peso corporal. En consecuencia, una concentración fija de BAPN puede dar lugar a variabilidad en la ingesta real de BAPN por ratón. Para abordar esto, el estudio actual ajustó el agua potable suplementada con BAPN diariamente en función del peso corporal y la ingesta de agua, con el objetivo de mantener una dosis constante de 1 mg / g / día.
Este protocolo, sin embargo, tiene varias limitaciones. En primer lugar, carece de datos de referencia sobre la incidencia y la progresión patológica de la TAD en momentos intermedios. En segundo lugar, solo se utilizaron ratones machos en este estudio. Si bien la TAD es más prevalente en los hombres, se ha informado que las mujeres tienen peores resultados, incluida una mayor mortalidad y una menor supervivencia a largo plazo después del tratamiento quirúrgico32,33. Curiosamente, algunos estudios han observado una menor incidencia de disección aórtica en ratones hembra tratados con BAPN y Ang II26,34, lo que amerita más investigación. En tercer lugar, el inicio de la inducción de TAD a las 3 semanas de edad (análogo a la adolescencia humana) puede no capturar completamente los mecanismos fisiopatológicos subyacentes al TAD de inicio en la edad adulta. Por último, el alojamiento en grupo durante el período de administración de BAPN (4 ratones por jaula) introduce variabilidad en la ingesta individual de agua, lo que puede contribuir a las diferencias en la exposición a BAPN y la gravedad de los síntomas.
En conclusión, este protocolo describe un modelo de ratón estable, de alta incidencia y reproducible de TAD que imita de cerca las características patológicas de la TAD humana. Debido a su simplicidad y fiabilidad, este modelo ofrece una valiosa utilidad para investigar los mecanismos moleculares que subyacen a la aparición y progresión de la TAD, así como para evaluar posibles estrategias terapéuticas.
Divulgaciones
Los autores de este manuscrito no tienen conflictos de intereses que declarar.
Agradecimientos
Este trabajo contó con el apoyo de una subvención de la Fundación Nacional de Ciencias Naturales de China (82370299) y el Proyecto de Construcción de la Disciplina Médica Clave (Especialidad) de Tianjin (TJYXZDXK-060B).
Materiales
| Name | Company | Catalog Number | Comments |
| 3-Aminopropionitrile Fumarate salt | Sigma-Aldrich | A3134 | |
| Analytical balance | Radwag | AS 220.R2 | |
| Anesthesia Machine | Shanghai Renyi Biological Technology Co. Ltd. | MSS-3 | |
| Angiotensin II | MCE | HY-13948 | |
| C57BL/6J Male Mice | GemPharmatech | N000013 | |
| Chow Diet | Sibeifu Beijing Biotechnology Co. Ltd | SPF-F02-002 | |
| Electrothermal constant temperature water tank | Yiheng Technical Co. Ltd. | DK-8D | |
| EVG Staining Kit | Solarbio | G1590 | |
| GraphPad Prism | Graphpad | Ver 10.0.2 | |
| H&E Staining Kit | Servicebio | G1076 | |
| Hemostat | Shinva Medical Instrument Co. Ltd. | ZH240RN | |
| Isoflurane | RWD | R510-22-10 | |
| Microtube | Axygen Scientific, Inc. | MCT-150-C | |
| Needle forcep | Shinva Medical Instrument Co. Ltd. | ZM234R/RN/RB | |
| Osmotic pump | Alzet | 1003D | |
| Paraformaldehyde | Servicebio | G1101 | |
| PBS, 1x | Servicebio | G4202 | |
| Saline | Servicebio | G4702 | |
| Scalpel | Shinva Medical Instrument Co. Ltd. | ZB084R/RN | |
| Scissor | Shinva Medical Instrument Co. Ltd. | ZC480RN/RB/RNj/RNh | |
| Stereo microscope | Leica | EZ4 | |
| Suture | Jinhuan Medical Supplies Co. Ltd. | F604 | |
| Tweezer | Shinva Medical Instrument Co. Ltd. | ZO022RB |
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados