Method Article
Fare Karotis Arterine Manşet Tekniği ile Doku Mühendisliği Yapılmış Vasküler Greft İmplantasyonu
Bu Makalede
Özet
Burada, doku mühendisliği yapılmış bir vasküler greftin manşet tekniği kullanılarak fare karotis arterine implantasyonu için bir protokol sunulmakta ve vasküler doku rejenerasyon mekanizmalarının araştırılması için uygun bir hayvan modeli sağlanmaktadır.
Özet
Küçük çaplı vasküler greftlerin geliştirilmesi, bu alana katkıda bulunan çok sayıda araştırma grubu ile küresel bir çaba olmuştur. Hayvan deneyleri, özellikle klinik uygulamaların yokluğunda, vasküler greftlerin etkinliğini ve güvenliğini değerlendirmede çok önemli bir rol oynar. Alternatif hayvan modelleriyle karşılaştırıldığında, fare implantasyon modeli, iyi tanımlanmış bir genetik arka plan, hastalık modeli yapımı için olgun bir yöntem ve basit bir cerrahi prosedür dahil olmak üzere çeşitli avantajlar sunar. Bu avantajlara dayanarak, bu çalışma, fare karotis arterine doku mühendisliği yapılmış vasküler greftlerin implantasyonu için basit bir manşet tekniği geliştirmiştir. Bu teknik, elektrostatik eğirme yoluyla polikaprolakton (PCL) küçük çaplı vasküler greftlerin üretilmesi ile başladı, ardından perfüzyon adsorpsiyonu yoluyla greftler üzerine makrofajların tohumlanması ile devam etti. Daha sonra, hücreselleştirilmiş doku mühendisliği yapılmış vasküler greftler, açıklığı ve rejeneratif kabiliyeti değerlendirmek için manşet tekniği kullanılarak fare karotis arterine nakledildi. 30 günlük in vivo implantasyondan sonra, neo-doku rejenerasyonu ve greftlerin lümeni içinde bir endotel tabakasının oluşumu ile vasküler açıklığın tatmin edici olduğu bulundu. Tüm veriler istatistik ve grafik programları kullanılarak analiz edilmiştir. Bu çalışma, vasküler rejenerasyonun hücresel kaynaklarını ve aktif maddelerin etki mekanizmalarını araştırmak için kullanılabilecek bir fare karotis arter implantasyon modelini başarıyla oluşturmuştur. Ayrıca, yeni küçük çaplı vasküler greftlerin geliştirilmesi için teorik destek sağlar.
Giriş
Kardiyovasküler hastalıkların prevalansı ve mortalitesi küresel olarak artmakta ve önemli bir halk sağlığı sorununu temsil etmektedir1. Vasküler baypas greftleme, şiddetli koroner kalp hastalığı ve periferik vasküler hastalık için etkili bir müdahaledir2. Çapları 6 mm'yi aşan yapay vasküler greftlerin kullanımı klinik ortamlarda iyi belgelenmiştir. Tersine, çapı 6 mm'nin altında olanlar tromboz ve intimal hiperplaziye eğilimlidir ve bu da önemli bir restenoz riskine yol açabilir3. Son yıllarda küçük çaplı vasküler greftlerin araştırılması ve geliştirilmesindeki önemli ilerlemelere rağmen, birçok ürünün klinik uygulamaya yaklaşmasıyla birlikte, birçok zorluk devam etmektedir 4,5. Bunlar, nispeten düşük bir uzun vadeli açıklık oranı, sınırlı vasküler rejenerasyon ve rejenerasyon mekanizmasının yetersiz anlaşılmasını içerir.
Yeni küçük çaplı vasküler greftlerin klinik öncesi değerlendirmesi, çeşitli hayvan modellerinde in vivo implantasyona dayanır. En sık kullanılan modeller arasında koyun karotis arteri, köpek femoral arteri, tavşan karotis arteri ve sıçan abdominal arter implantasyon modelleribulunur 6,7,8,9. Vasküler greftlerin açıklığı koyun, domuz ve köpek gibi orta ila büyük boy hayvanlarda değerlendirilebilir. Ancak bu çalışmalar, gereken uzmanlık ve ekipman nedeniyle önemli maliyetler içermektedir. Ek olarak, teknik karmaşıklıkları uygulama için bir zorluk teşkil etmektedir. Buna karşılık, tavşanlar ve sıçanlar gibi küçük hayvan modelleri, açıkça tanımlanmış genetik geçmişlere sahip iyi kurulmuş transgenik türlerden yoksundur ve bu da vasküler rejenerasyon mekanizmalarının incelenmesinde önemli bir engel teşkil eder.
Yukarıda bahsedilen hayvan modelleriyle karşılaştırıldığında, fare modeli nispeten basit bir cerrahi prosedür, genetik olarak tasarlanmış fareler üretmek için iyi kurulmuş bir metodoloji ve açıkça tanımlanmış bir genetik arka plan sunar. Bununla birlikte, fare kan damarlarının küçük çapı, vasküler greftlemede uçtan uca anastomozu teknik olarak karmaşık hale getirir, önemli uzmanlık gerektirir ve nispeten düşük bir başarı oranı sağlar. Prosedürün karmaşıklığını azaltmak ve vasküler greft implantasyonunun başarı oranını artırmak için, bu çalışmada bir fare karotis arter implantasyon modelinde manşet tekniği kullanılmıştır.
İn vivo implantasyonu takiben, vasküler greftler, vasküler doku yenilenmesine katkıda bulunan endojen hücreleri işe alabilir. Bu hücrelerin varlığı, greftlerin düz kas tabakasının endotelizasyonunu ve rejenerasyonunu kolaylaştırır. 10. Bununla birlikte, vasküler doku rejenerasyonunda yer alan hücrelerin kaynağı ve türü belirsizliğini korumaktadır ve çok sayıda rakip teori araştırılmaktadır11. Bunlar arasında araştırmalar, enflamatuar ve kök hücrelerin rollerine odaklanmıştır. Breuer ve ark. insan kemik iliğinden türetilmiş monositleri (hBMC'ler) vasküler greftler üzerine tohumladı ve tohumlanan hücrelerin, monosit kemoatraktan protein-1'in (MCP-1) salınması yoluyla konakçı hücreleri greft duvarına aldığını ve böylece vasküler doku rejenerasyonunu desteklediğini buldu12. Bu çalışmada, makrofajları polikaprolakton (PCL) küçük çaplı vasküler greftler üzerine tohumlamak için etkili bir perfüzyon adsorpsiyon hücre tohumlama yöntemi önerilmiş ve başarıyla kullanılmıştır. İmplantasyonu takiben, bu hücreler sürekli canlılık sergiledi.
Bu makale, doku mühendisliği yapılmış vasküler greftlerin hazırlanması için metodolojiyi ve manşet tekniği kullanılarak farelerde karotis arter implantasyon prosedürünü detaylandırmaktadır. Proses, elektrostatik eğirme yoluyla tanımlanmış parametrelere sahip PCL küçük çaplı vasküler greftlerin üretilmesiyle başlar. Daha sonra implantasyon için uygun görülen greftler mekanik testlere tabi tutulur. Makrofajlar daha sonra perfüzyon adsorpsiyon yöntemi kullanılarak vasküler greftler üzerine ekilir. Son olarak, makrofaj tohumlu vasküler greftler, manşet tekniği kullanılarak fare karotis arterine implante edilir ve bir aylık in vivo implantasyondan sonra açıklık ve rejeneratif özellikler analiz edilir.
Bu teknik, fare modellerinde vasküler greftlemenin etkinliğini ve başarı oranlarını artırma potansiyeline sahiptir. Ayrıca model, yeni küçük çaplı vasküler greftlerin fonksiyonel modifikasyonu ve geliştirilmesi için teorik ve metodolojik destek sağlayarak, vasküler rejenerasyonda hücre kaynaklarının, pivotal genlerin ve aktif faktörlerin altında yatan mekanizmaları araştırmak için kullanılabilir.
Protokol
Tüm hayvan prosedürleri, Çin Tıp Bilimleri Akademisi Radyasyon Tıbbı Enstitüsü Hayvan Deneyleri Etik Komitesi tarafından onaylandı ve Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzuna uygun hale getirildi. Bu çalışmada vücut ağırlığı 25-30 g olan 6-8 haftalık erkek C57BL/6 fareler kullanıldı. Bu çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Küçük çaplı vasküler greftlerin imalatı
NOT: Elektrospinning tekniğini kullanarak küçük çaplı PCL vasküler greftlerüretin 13.
- 12 saat boyunca oda sıcaklığında (RT) heksafloroizopropanol (HFIP) içinde %10, %15 ve %20 (a/h) PCL çözeltileri hazırlayın.
- PCL solüsyonlarını 10 mL'lik bir şırıngaya yükleyin ve şırıngayı 21 G paslanmaz çelik iğne ile konumlandırın.
- Toplama aletinin üzerine tungsten çelik bir mandrel (0,7 mm çapında, 20 cm uzunluğunda) yerleştirin.
- Elektrospinning tekniğini kullanarak dokuz grup PCL vasküler greft üretin. İğneye yüksek voltajlı bir güç kaynağı bağlayın. İç çapı 0,7 mm olan bir tungsten çelik çubuğu, iğnenin önüne sabit bir mesafede alıcı cihaz olarak yerleştirin.
NOT: Vasküler greft gruplarının tanımı Tablo 1'de verilmiştir ve vasküler greftlerin parametreleri Tablo 2'de detaylandırılmıştır. - Üretilen vasküler greftleri bir tahliye işlemine tabi tutun. Kalan çözücüleri çıkarmak için vasküler greftleri 72 saat vakumlu kurutma fırınına koyun.
- Greftleri 30 dakika boyunca tıbbi alkole batırarak ve gece boyunca UV ışığına maruz bırakarak sterilize edin.
- Taramalı elektron mikroskobu (SEM) kullanarak vasküler greftlerin mikroskobik morfolojisini gözlemleyin. Vasküler greftleri iletken yapıştırıcı ile SEM numune aşamasına tutturun ve kaplama için altın püskürtme cihazına yerleştirin.
- 15 kV'luk hızlandırıcı bir voltajda SEM kullanarak vasküler greftlerin yapısını ve lif morfolojisini gözlemleyin. ImageJ yazılımını kullanarak SEM görüntülerinden (n = 5) lif çapını ve gözenek boyutunu ölçün.
- Bir çekme test makinesi kullanarak vasküler greftlerin mekanik özelliklerini (çekme ve elastik özellikler) değerlendirin. Vasküler greftin üst ve alt uçlarını 1 cm aralıklı sabit kelepçelerle kelepçeleyin.
- Vasküler grefti yırtılana kadar 10 mm / dak hızında gerin. Çekme test makinesinden gerilim-gerinim eğrisini toplayın.
- Maksimum yük (2-15 N), kopma gerilimi (5-30 MPa), kopma gerilimi (%200-%1500) ve elastik modül (1-20 MPa) dahil olmak üzere mekanik parametreleri hesaplayın14.
- İstatistik ve grafik yazılımı kullanarak istatistiksel analiz yapın. Verileri ortalama ± standart sapma olarak ifade edin. Tek yönlü ANOVA'da Tukey'in post hoc testini kullanarak birden fazla grup arasındaki tek değişkenli farkları analiz edin ve karşılaştırın. *P < 0.05, **P < 0.01, ***P < 0.001.
2. Makrofajların vasküler greftler üzerine ekilmesi
NOT: Tüm solüsyonların ve malzemelerin steril olduğundan emin olun. Tüm işlemleri hücre kültürü odası içinde gerçekleştirin.
- Yapışık koşullar altında şişelerde kültür RAW264.7 (fare monosit makrofajı) (Şekil 1A). % 1 penisilin-streptomisin ve% 10 fetal sığır serumu ile desteklenmiş Dulbecco'nun modifiye edilmiş Eagle ortamını (DMEM) kullanarak hücre kültürü ortamını hazırlayın. Şişeleri %5 karbondioksit içeren 37 °C'lik bir inkübatöre yerleştirin.
- Bir hücre kazıyıcı kullanarak makrofajları toplayın. Ortamı 1 mL'lik bir pipet kullanarak atın ve hücreleri PBS ile yıkayın.
- Kültür şişesine 2 mL taze ortam ekleyin ve yüzeyi bir hücre sıyırıcı ile nazikçe kazıyın. Toplanan hücreleri bir tüpe aktarın ve oda sıcaklığında 5 dakika boyunca 1.000 x g'da santrifüjleyin. 100 μL tam ortamda 5 ×10 6 hücreyi yeniden süspanse edin.
- DMEM ile doldurulmuş 15 mL'lik bir tüpe bir PCL vasküler greft (1 cm uzunluğunda) yerleştirin ve 5 dakika boyunca 4.000 x g'da santrifüjleyin. Greft tüpün dibine batana kadar bu işlemi birkaç kez tekrarlayın ve malzemenin DMEM ile tamamen sızmasını sağlayın.
- Bir kat filtre kağıdı ile kaplanmış 10 cm'lik bir Petri kabı hazırlayın. Nemlendirilmiş PCL vasküler grefti filtre kağıdına yerleştirin ve fazla ortamı çıkarmak için yuvarlayın.
- 10 μL'lik bir pipet kullanarak 10 μL hücre süspansiyonu alın ve vasküler greftin bir ucuna enjekte edin. Süspansiyonun eşit dağılımını kolaylaştırmak için vasküler grefti filtre kağıdı üzerinde döndürün. Toplam on enjeksiyon için her bir ucu beş kez enjekte edin (Şekil 1B, C).
- Makrofaj yüklü vasküler grefti 1 mL tam ortam içeren 24 oyuklu bir plakaya yerleştirin ve implantasyondan önce bir hücre kültürü inkübatöründe 2 saat inkübe edin.
- Greft duvarı içindeki hücrelerin dağılımını belirleyin. Makrofaj yüklü vasküler grefti kriyoseksiyon için optik koherens tomografi (OCT) bileşiğine yerleştirin. Hücre çekirdeklerini 4 ',6-diamidino-2-fenilindol (DAPI) ile boyayın ve floresan mikroskobu altında gözlemleyin.
3. Fare karotis arter implantasyon modeli
NOT: Hayvan prosedürleri için steril bir cerrahi alan sağlayın. Ameliyattan önce tüm cerrahi aletleri ve tek kullanımlık malzemeleri sterilize edin.
- Her biri 25-30 g ağırlığında üç sağlıklı erkek C57BL/6 fare seçin. Ameliyattan bir gün önce fareleri oruç tutun. Toplam üç greft için her hayvana bir vasküler greft implante edin.
- Naylon bir tüpten manşetler oluşturun (Şekil 2A) ve vasküler manşet tekniğinin şematik diyagramını Şekil 2B'de sunun.
- 50 mg / kg'lık bir konsantrasyonda intraperitoneal sodyum pentobarbital enjeksiyonu ile fareleri uyuşturun (kurumsal olarak onaylanmış protokolleri izleyerek). Kas gevşemesini ve hatta nefes almayı sağlayarak etkili anesteziyi onaylayın. Anestezi sırasında kuruluğu önlemek için gözlere vazelin oftalmik merhem sürün.
- Fareyi ameliyat masasına sırtüstü pozisyonda getirin ve boyun kıllarını alın. Cerrahi bölgeyi iyodofor ile sterilize edin. Steril bir ortam sağlamak için cerrahi olmayan alanı steril gazlı bezle örtün (Şekil 3A).
- Mandibuladan sternuma orta hat insizyonu (1.5-2 cm uzunluğunda) yapmak için oftalmik makas kullanın. Cerrahi görüş alanını artırmak için sol tükürük bezlerini yükseltin ve sol kleidomastoid kası çıkarın. Mikro cımbız kullanarak sol ana karotis arteri açığa çıkarın (Şekil 3B).
- Sol karotis arteri mikroforseps kullanarak izole edin (Şekil 3C).
- Karotis arteri 9-0 sütür kullanarak orta kısımda iki yerde bağlayın. Mikromakas kullanarak arteri iki bağ arasında geçirin. Kafı her iki uçtaki arterlerden geçirin ve arteri ve manşeti arteriyel klipsler kullanarak birbirine sabitleyin (Şekil 3D).
- Manşet gövdesini örtmek için arteri dışa doğru çevirin ve mikroforseps ile 9-0 sütür kullanarak manşete sabitleyin (Şekil 3E).
- Karotis arterin iki ucu arasına, greft uçlarını arter manşetinin üzerine kaydırarak ve 9-0 dikişle sabitleyerek bir vasküler greft implante edin (Şekil 3F).
NOT: Manşet, karotis arter ve vasküler greftin boyutsal verileri Tablo 3'te sunulmuştur. Greft ve manşetin çapları fare karotis arterlerininkilerle yakından eşleşse de, anastomoz lümen çapı ile greft çapı arasında bir uyumsuzluk vardır. Anastomoz lümen çapı, manşetin iç çapından (0,5 mm) karotis arter duvarının kalınlığının (0,1 mm) iki katı çıkarılarak hesaplanır ve bu da 0,3 mm'lik bir lümen çapı ile sonuçlanır. Vasküler greftin iç çapı 0,7 mm'dir ve yaklaşık 2,3 kat uyumsuzluğa yol açar (0,7 mm / 0,3 mm = 2,3). - Her iki uçtaki arteriyel klipsleri çıkarın ve implantasyon bölgesini tuzlu su ile yıkayın. Distal arteriyel nabzı gözlemleyerek vasküler greftin açıklığını değerlendirin (Şekil 3G).
- Sol tükürük bezini yeniden konumlandırın ve cerrahi bölgeyi 6-0 sütür kullanarak kapatın (Şekil 3H).
4. İşlem sonrası bakım ve analiz
- Fareyi 37 °C'lik bir kuvöze aktarın ve bilinci yerine gelene kadar yaşamsal belirtilerini sürekli olarak izleyin.
- Ameliyat sonrası ağrıyı gidermek için 5 mg / kg karbinol enjekte edin.
- Kurtarma süresi boyunca fareyi izleyin ve tamamen iyileşene kadar grup muhafazasına geri koymayın.
- İmplantasyondan bir ay sonra fareleri uyuşturun ve histolojik analiz için vasküler greft örneklerini toplayın9.
- CO2 boğulması yoluyla ötenazi gerçekleştirin ve ardından etik yönergeleri izleyerek servikal çıkık yapın.
Sonuçlar
Farklı parametrelere sahip küçük çaplı vasküler greftler elektrospinning ile başarılı bir şekilde hazırlandı. SEM görüntüleri, liflerin homojen bir şekilde dağıldığını ve gözenek yapılarının varlığı ile greft duvarı içinde düzensiz bir düzenleme sergilediğini ortaya koydu (Şekil 4). PCL konsantrasyonu arttıkça, hem lif çapı hem de gözenek boyutu arttı. Her vasküler greft grubu için spesifik değerler Tablo 2'de sunulmuştur. Mekanik testlerin sonuçları, tüm vasküler greftlerin gerekli mekanik standartları karşıladığını gösterdi. Kopmadaki maksimum yük ve gerinim, daha yüksek PCL konsantrasyonları ve daha büyük vasküler duvar kalınlığı ile artarken (Şekil 5A-C), elastikiyet modülü azaldı (Şekil 5D). Bu bulgulara dayanarak, PCL konsantrasyonu %15 ve duvar kalınlığı 150 μm olan küçük çaplı vasküler greftler, sonraki deneyler için en uygun greftler olarak seçildi.
Bu çalışmada, makrofajlar perfüzyon adsorpsiyon yöntemi kullanılarak vasküler greftler üzerine ekilmiştir. SEM analizi, makrofajların vasküler greftler üzerine başarılı bir şekilde tohumlandığını ve homojen bir dağılım sergilediğini doğruladı (Şekil 6A). DAPI boyamaya tabi tutulan kesitsel greftlerde, ekilen makrofajların greft lümeninden greft duvarına sızdığı görüldü (Şekil 6B).
İn vivo implantasyondan otuz gün sonra, hayvanların hayatta kalma oranı% 100 idi ve implante edilen üç vasküler greftten ikisi patent olarak kaldı, bu da fare modellerinde tatmin edici bir sonuçtu. Stereomikroskop altında greftlerde anevrizma veya fark edilebilir fibröz kapsülasyon gözlenmedi (Şekil 7A). Hücresel infiltrasyon ve doku rejenerasyonunun derecesi histolojik analiz ile daha fazla değerlendirildi. Hematoksilen ve eozin (H&E) boyamasında greft duvarında önemli hücresel infiltrasyon ve greft iç lümeninde neodoku oluşumu görüldü (Şekil 7B). CD31 immünofloresan boyama, greftlerin iç lümeni içinde, nispeten sağlam endotel hücre kaplaması ile tek bir endotel dokusu tabakasının rejenerasyonunu gösterdi (Şekil 7C).

Şekil 1: Hücre tohumlama prosedürü. (A) RAW264.7 hücrelerinin kültürü. Ölçek çubuğu: 100 μm. (B) Hücre tohumlama işleminin şeması. (C) RAW264.7 hücreleri, perfüzyon-adsorpsiyon yöntemi kullanılarak greft duvarına ekilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Manşet tekniği. (A) Vasküler manşetlerin hazırlanması. (B) Vasküler manşet tekniğinin şematik gösterimi. Bu yöntem kullanılarak karotis artere vasküler greftler implante edildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Bir fare modelinde vasküler greft implantasyonu için cerrahi prosedür. (A) Anesteziklerin enjeksiyonu, farenin sırtüstü pozisyonda konumlandırılması ve pençelerin hareketsiz hale getirilmesi. (B) Cerrahi alanın açığa çıkması. (C) Karotis arterin izolasyonu. (D) Manşetin karotis arter etrafına yerleştirilmesi. (E) Arterin manşet gövdesi üzerine ters çevrilmesi ve 9-0 sütür kullanılarak sabitlenmesi. (F) Vasküler greftin arteriyel manşet üzerine kılıflanması ve dikilmesi. (G) Vasküler klemplerin çıkarılması. (H) Cildin kapanması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Elektrospun polikaprolakton (PCL) vasküler greftlerin morfolojisi. Vasküler greftlerin iyi tanımlanmış fibröz yapısını gösteren temsili taramalı elektron mikroskobu (SEM) görüntüleri. Ölçek çubukları: 500 μm ve 50 μm (büyütülmüş görüntüler). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Elektroeğrilmiş PCL vasküler greftlerin mekanik özellikleri. Vasküler greftlerin uzunlamasına yönde, maksimum yük (A), maksimum gerilme (B), kopma gerilmesi (C) ve elastik modül (D) gösteren mekanik karakterizasyonu. Veriler ortalama ± standart sapma (SD) (n = 3) olarak ifade edilir. *P < 0.05, **P < 0.01, ***P < 0.001, tek yönlü ANOVA ve ardından Tukey'in post hoc testi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Hücre yüklü greftlerin karakterizasyonu. (A) Temsili SEM görüntüleri ve (B) hücre yüklü vasküler greftlerin 4',6-diamidino-2-fenilindol (DAPI) boyaması, başarılı makrofaj implantasyonu ve homojen dağılımı gösterir. Ölçek çubukları: 30 μm ve 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
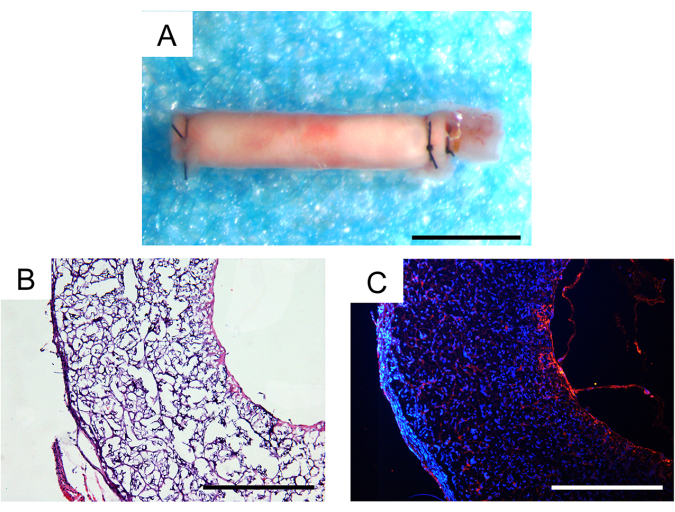
Şekil 7: İmplantasyondan bir ay sonra ekilen vasküler greftlerin histolojik analizi. (A) Anevrizma oluşumu veya fibröz kapsülleme olmadığını gösteren stereoskopik görüntü. Ölçek çubuğu: 500 μm. (B) Hematoksilen ve eozin (H & E) boyama, iyi hücreselleşme ve doku rejenerasyonunu gösterir. Ölçek çubuğu: 200 μm. (C) CD31 immünofloresan boyama, luminal yüzeyde tek bir endotel hücresi tabakasını ortaya çıkarır. Ölçek çubuğu: 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Grup | PCL konsantrasyonu Çözüm (%) | vasküler greft kalınlığı (μm) | İğne toplayıcı mesafesi (cm) | akış hızı (mL/saat) | gerilim (kV) |
| 10%-100 | 10 | 100 | 15 | 2 | 18 |
| 10%-150 | 10 | 150 | 15 | 2 | 18 |
| 10%-200 | 10 | 200 | 15 | 2 | 18 |
| 15%-100 | 15 | 100 | 15 | 2 | 18 |
| 15%-150 | 15 | 150 | 15 | 2 | 18 |
| 15%-200 | 15 | 200 | 15 | 2 | 18 |
| 20%-100 | 20 | 100 | 13 | 8 | 12 |
| 20%-150 | 20 | 150 | 13 | 8 | 12 |
| 20%-200 | 20 | 200 | 13 | 8 | 12 |
Tablo 1: Vasküler greft gruplarının tanımı. PCL, polikaprolakton.
| Grup | Lif çapı (μm) | Gözenek boyutu (μm) |
| 10%-100 | 0,51±0,12 | 2.48±1.38 |
| 10%-150 | 0,91±0,4 | 1,83±0,84 |
| 10%-200 | 0,73±0,35 | 2,24±0,83 |
| 15%-100 | 1,85±0,3 | 8.91±2.87 |
| 15%-150 | 1,82±0,34 | 8.41±2.72 |
| 15%-200 | 2.18±0.47 | 9.59±3.01 |
| 20%-100 | 3.61±1.02 | 13.95±4.7 |
| 20%-150 | 3,06±0,56 | 13.12±3.36 |
| 20%-200 | 3,46±0,66 | 13.92±4.19 |
Tablo 2: Farklı vasküler greftlerin yapısal parametreleri.
| Grup | İç Çap (mm) | Dış çap (mm) | Duvar kalınlığı (μm) | uzunluk (cm) |
| şah damarı | 0.5-0.6 | 0.6-0.7 | 100 | / |
| vasküler greft | 0.7 | 1 | 150 | 0.8 |
| manşet | 0.5 | 0.63 | 65 | / |
Tablo 3: Manşet, karotis arter ve vasküler greftin boyutsal verileri.
Tartışmalar
Fare karotis arterine doku mühendisliği yapılmış vasküler greftlerin implante edilmesi için manşet tekniğinin kullanılması, kardiyovasküler araştırmalarda önemli bir ilerlemeyi temsil etmektedir15. Bu tekniğin kritik adımları arasında hücre tohumlama ve greft implantasyonu yer alır. Bu çalışma, üniform olmayan hücre tohumlaması ve düşük hücre canlılığı ile ilgili sorunları ele almak için makrofaj tohumlama yoğunluğunu artırmak için bir perfüzyon adsorpsiyon yaklaşımı kullanmıştır. Bu yöntem, makrofajların vasküler greft duvarına sızmasına ve eşit olarak dağıtmasına izin verdi.
Vasküler implantasyon ile ilgili olarak, uçtan uca anastomoz16'nın aksine manşet tekniği, özellikle daha küçük çaplı damarlara uygulandığında daha yüksek bir darlık insidansı ile ilişkili olabilir. Bu etkiyi en aza indirmek için, fare karotis arterlerininkine yakın iç ve dış çaplara sahip manşetler seçildi. İlgili boyutlar Tablo 3'te verilmiştir.
Bu teknik, fare karotis arterinde vasküler greft implantasyonu için daha basit bir cerrahi prosedürü kolaylaştırır. Küçük çaplı vasküler greftlerin önceki çalışmalarında en sık kullanılan hayvan modelleri arasında koyun juguler arteriovenöz fistül ve sıçan abdominal arter implantasyon modelleri17,18 bulunur. Bu modeller, vasküler greftlerin mekanik mukavemetini ve doku yeniden şekillenme kapasitesini değerlendirmek için etkilidir; Bununla birlikte, altta yatan mekanizmaları açıklama yetenekleri sınırlıdır. Genetiği değiştirilmiş fareler, diğer hayvan modellerinin sınırlamalarını ele alarak vasküler rejenerasyon mekanizmalarını araştırmak için önemli bir model olarak ortaya çıkmıştır.
Örneğin, Apolipoprotein E (ApoE) nakavt fareleri kendiliğinden hiperkolesterolemi ve aterosklerotik lezyonlar19 geliştirir ve bu da onları vasküler transplantasyon gerektiren klinik durumları simüle etmek için değerli bir model haline getirir. ApoE nakavt farelerde vasküler açıklığın ve rejenerasyonun değerlendirilmesi, vasküler greftlerin klinik translasyonu için önemli referans verileri sağlar. Ek olarak, gen eksikliği olan fareler, vasküler rejenerasyonda anahtar genlerin rollerini araştırmak için kullanılabilir. Vasküler fonksiyonun kritik bir düzenleyicisi olan endotelyal nitrik oksit sentaz (eNOS), nitrik oksit20'nin birincil kaynağıdır. eNOS gen eksikliği olan fareler, bu genin vasküler yeniden şekillenmeyi etkilediği mekanizmaları aydınlatmak için bir araştırma modeli olarak hizmet eder. Ayrıca, vasküler doku rejenerasyonunda yer alan hücrelerin kökeni, raportör gen aracı fareler21,22 kullanılarak in vivo hücre etiketleme ve soy izleme yoluyla araştırılabilir.
Bu tekniğin, kullanılan hayvan sayısı ve nakil süresi ile ilgili belirli sınırlamaları vardır. Bu çalışma öncelikle kısa süreli in vivo bir yaklaşım kullanarak bu greftleme yönteminin fizibilitesini değerlendirmeye odaklanmıştır. Gelecekteki çalışmalar, bu yöntemin anevrizma oluşumu, açıklığı ve intimal hiperplazi üzerindeki etkisini kapsamlı bir şekilde değerlendirmek için örneklem büyüklüğünü artırmalı ve uzun vadeli değerlendirmeler yapmalıdır.
Ek olarak, greft açıklık oranı %66.6 idi ve bu, anastomoz bölgesindeki bir çap uyumsuzluğundan (2.3 kat) etkilenmiş olabilir. Bu uyumsuzluk, tromboz riskini artırarak lokalize kan akışı bozukluklarına yol açabilir. Çap farklılıklarını azaltmak ve açıklık oranları üzerindeki etkilerini araştırmak için manşet tasarımını optimize etmek için daha fazla çalışmaya ihtiyaç vardır.
Sonuç olarak, manşet tekniğine dayalı fare karotis arter implantasyon modeli, küçük çaplı vasküler greftlerin biyolojik değerlendirmesi için basit ve etkili bir hayvan modeli sunmaktadır. Ayrıca, vasküler doku yeniden şekillenmesinde çeşitli hücre tiplerinin rollerinin ve altta yatan rejeneratif mekanizmaların araştırılmasını sağlar.
Açıklamalar
Yazarların çatışan herhangi bir mali çıkarı yoktur.
Teşekkürler
Bu çalışmanın finansmanı, Çin Ulusal Doğa Bilimleri Vakfı projeleri (no. 32101098, 32071356 ve 82272158) ve CAMS Tıp Bilimleri İnovasyon Fonu (no. 2022-I2M-1-023) tarafından sağlanmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1% penicillin-streptomycin | Solarbio | P1400 | |
| 10% fetal bovine serum | Gibco | A5256701 | |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 4',6-Diamidino-2-Phenylindole (DAPI) | SouthernBiotech | 0100-20 | |
| Alcohol | Tianjin Chemical Reaggent Company | 1083 | |
| Anti-Mouse CD31 primary antibody | BD Bioscience | 553370 | |
| Arterial clips | RWD Life Science | R31005-06 | |
| C57BL/6 mice | Beijing Vital River Laboratory Animal Technology Company | ||
| Dulbecco's modified eagle medium (DMEM) | Gibco | 11966025 | |
| Electrostatic spinning machine | Yunfan Technology | DP30 | |
| Goat anti-rat IgG (Alexa Fluor 555) | Invitrogen | A-21434 | |
| Hematoxylin and eosin (H&E) | Solarbio | G1120 | |
| Hexafluoroisopropanol (HFIP) | McClean | H811026 | |
| Iodophor | LIRCON | V273068 | |
| Microscissors | World Precision Instruments | 14124 | |
| Microtweezers | World Precision Instruments | 500338 | |
| Normal goat serum | Boster | AR0009 | |
| Normal saline | Cisen Pharmaceutical company | H20113369 | |
| Nylon tube for cuff | Portex | ||
| Optimal cutting temperature compound (OCT) | Sakara | 4583 | |
| Pentobarbital sodium | Sigma | P3761 | |
| Phosphate Buffered Saline (PBS) | Solarbio | P1003 | |
| Poly(ε-caprolactone) (PCL) pellets (Mn = 80,000) | Sigma | 704067 | |
| RAW264.7 macrophages | Biyuntian Biotechnology | ||
| Scanning electron microscope (SEM) | Zeiss | PHENOM-XL-G2 | |
| Surgical sutures 6-0 | Ningbo Chenghe microapparatus factory | 220919 | |
| Surgical sutures 9-0 | Ningbo Chenghe microapparatus factory | 221006 | |
| Syringe | Changqiang Medical Devices | 0197 | |
| Tensile testing machine | Instron | WDW-5D |
Referanslar
- Adhikary, D., Barman, S., Ranjan, R., Stone, H. A systematic review of major cardiovascular risk factors: A growing global health concern. Cureus. 14 (10), e30119 (2022).
- Alexander, J. H., Smith, P. K. Coronary-artery bypass grafting. N Engl J Med. 374 (20), 1954-1964 (2016).
- Jeong, Y., Yao, Y., Yim, E. K. F. Current understanding of intimal hyperplasia and effect of compliance in synthetic small diameter vascular grafts. Biomater Sci. 8 (16), 4383-4395 (2020).
- Lawson, J. H., et al. Bioengineered human acellular vessels for dialysis access in patients with end-stage renal disease: Two phase 2 single-arm trials. Lancet. 387 (10032), 2026-2034 (2016).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Sci Transl Med. 11 (485), eaau6934 (2019).
- Wang, C., Li, Z., Zhang, L., Sun, W., Zhou, J. Long-term results of triple-layered small diameter vascular grafts in sheep carotid arteries. Med Eng Phys. 85, 1-6 (2020).
- Tanaka, T., et al. Evaluation of small-diameter silk vascular grafts implanted in dogs. JTCVS Open. 6, 148-156 (2021).
- Jin, X., et al. Preparation of small-diameter tissue-engineered vascular grafts electrospun from heparin end-capped PCL and evaluation in a rabbit carotid artery replacement model. Macromol Biosci. 19 (8), e1900114 (2019).
- Xiao, Y., et al. Fabrication of small-diameter in situ tissue engineered vascular grafts with core/shell fibrous structure and a one-year evaluation via rat abdominal vessel replacement model. Biomater Adv. 165, 214018 (2024).
- Wei, Y., Wang, F., Guo, Z., Zhao, Q. Tissue-engineered vascular grafts and regeneration mechanisms. J Mol Cell Cardiol. 165, 40-53 (2022).
- Cleary, M. A., et al. Vascular tissue engineering: The next generation. Trends Mol Med. 18 (7), 394-404 (2012).
- Roh, J. D., et al. Tissue-engineered vascular grafts transform into mature blood vessels via an inflammation-mediated process of vascular remodeling. Proc Natl Acad Sci U S A. 107 (10), 4669-4674 (2010).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- Wu, Y., et al. Peptide-tethered vascular grafts enable blood vessel regeneration via endogenous cell recruitment and neovascularization. Compos B Eng. 252, 110504 (2023).
- Hu, Y., Xu, Q. Vessel graft atherosclerosis in murine models. Curr Drug Targets. 9 (3), 239-250 (2008).
- Qin, K., et al. Implantation of electrospun vascular grafts with optimized structure in a rat model. J Vis Exp. (136), e57340 (2018).
- Geelhoed, W. J., et al. A novel method for engineering autologous non-thrombogenic in situ tissue-engineered blood vessels for arteriovenous grafting. Biomaterials. 229, 119577 (2020).
- Wu, P., et al. Construction of vascular graft with circumferentially oriented microchannels for improving artery regeneration. Biomaterials. 242, 119922 (2020).
- Vasquez, E. C., Peotta, V. A., Gava, A. L., Pereira, T. M., Meyrelles, S. S. Cardiac and vascular phenotypes in the apolipoprotein e-deficient mouse. J Biomed Sci. 19 (1), 22 (2012).
- Garcia, V., Sessa, W. C. Endothelial nos: Perspective and recent developments. Br J Pharmacol. 176 (2), 189-196 (2019).
- He, L., et al. Enhancing the precision of genetic lineage tracing using dual recombinases. Nat Med. 23 (12), 1488-1498 (2017).
- Wang, F., et al. Nitric oxide improves regeneration and prevents calcification in bio-hybrid vascular grafts via regulation of vascular stem/progenitor cells. Cell Rep. 39 (12), 110981 (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır