Method Article
Implantación de un injerto vascular de ingeniería tisular en la arteria carótida de ratón mediante la técnica del manguito
En este artículo
Resumen
Aquí, se presenta un protocolo para la implantación de un injerto vascular de ingeniería tisular en la arteria carótida del ratón utilizando la técnica del manguito, proporcionando un modelo animal adecuado para investigar los mecanismos de regeneración del tejido vascular.
Resumen
El desarrollo de injertos vasculares de pequeño diámetro ha sido un esfuerzo global, con numerosos grupos de investigación que han contribuido a este campo. La experimentación con animales desempeña un papel fundamental en la evaluación de la eficacia y la seguridad de los injertos vasculares, especialmente en ausencia de aplicaciones clínicas. En comparación con los modelos animales alternativos, el modelo de implantación de ratones ofrece varias ventajas, como un fondo genético bien definido, un método maduro para la construcción de modelos de enfermedad y un procedimiento quirúrgico sencillo. Sobre la base de estas ventajas, el presente estudio ideó una técnica simple de manguito para la implantación de injertos vasculares de ingeniería tisular en la arteria carótida del ratón. Esta técnica comenzó con la fabricación de injertos vasculares de pequeño diámetro de policaprolactona (PCL) mediante hilatre electrostático, seguido de la siembra de macrófagos en los injertos mediante adsorción por perfusión. Posteriormente, los injertos vasculares de ingeniería tisular celular se trasplantaron a la arteria carótida del ratón utilizando la técnica del manguito para evaluar la permeabilidad y la capacidad regenerativa. Después de 30 días de implantación in vivo , se encontró que la permeabilidad vascular era satisfactoria, con evidencia de regeneración de neotejidos y la formación de una capa endotelial dentro de la luz de los injertos. Todos los datos se analizaron mediante software estadístico y gráfico. Este estudio estableció con éxito un modelo de implante de arteria carótida de ratón que se puede utilizar para explorar las fuentes celulares de la regeneración vascular y los mecanismos de acción de las sustancias activas. Además, proporciona soporte teórico para el desarrollo de nuevos injertos vasculares de pequeño diámetro.
Introducción
La prevalencia y la mortalidad de las enfermedades cardiovasculares están aumentando en todo el mundo, lo que representa un importante problema de salud pública1. El injerto de bypass vascular es una intervención eficaz para la enfermedad coronaria grave y la enfermedad vascular periférica2. El uso de injertos vasculares artificiales con diámetros superiores a 6 mm ha sido bien documentado en entornos clínicos. Por el contrario, aquellos con un diámetro inferior a 6 mm son propensos a la trombosis y a la hiperplasia intimal, lo que puede conllevar un riesgo considerable de reestenosis3. A pesar de los avances significativos en la investigación y el desarrollo de injertos vasculares de pequeño diámetro en los últimos años, con varios productos que se acercan a la aplicación clínica, aún persisten múltiples desafíos 4,5. Estos incluyen una tasa de permeabilidad a largo plazo relativamente baja, una regeneración vascular limitada y una comprensión insuficiente del mecanismo de regeneración.
La evaluación preclínica de nuevos injertos vasculares de pequeño diámetro se basa en la implantación in vivo en varios modelos animales. Los modelos más utilizados incluyen los modelos de implante de arteria carótida de oveja, arteria femoral de perro, arteria carótida de conejo y arteria abdominal de rata 6,7,8,9. La permeabilidad de los injertos vasculares se puede evaluar en animales de tamaño mediano a grande, como ovejas, cerdos y perros. Sin embargo, estos estudios implican costos sustanciales debido a la experiencia y el equipo requeridos. Además, su complejidad técnica plantea un desafío para la implementación. Por el contrario, los modelos de animales pequeños, como los conejos y las ratas, carecen de especies transgénicas bien establecidas con antecedentes genéticos claramente definidos, lo que representa un obstáculo significativo en el estudio de los mecanismos de regeneración vascular.
En comparación con los modelos animales antes mencionados, el modelo de ratón ofrece un procedimiento quirúrgico relativamente sencillo, una metodología bien establecida para generar ratones modificados genéticamente y un trasfondo genético claramente definido. Sin embargo, el pequeño diámetro de los vasos sanguíneos del ratón hace que la anastomosis de extremo a extremo en el injerto vascular sea técnicamente compleja, ya que requiere una experiencia significativa y produce una tasa de éxito relativamente baja. Para reducir la complejidad del procedimiento y mejorar la tasa de éxito de la implantación de injertos vasculares, el presente estudio empleó la técnica del manguito en un modelo de implante de arteria carótida de ratón.
Tras la implantación in vivo , los injertos vasculares pueden reclutar células endógenas que contribuyen a la regeneración del tejido vascular. La presencia de estas células facilita la endotelización y regeneración de la capa de músculo liso de los injertos. 10. Sin embargo, la fuente y el tipo de células implicadas en la regeneración del tejido vascular siguen sin estar claros, y se están investigando múltiples teorías que compitenentre sí 11. Entre ellas, la investigación se ha centrado en el papel de las células inflamatorias y madre. Breuer et al. sembraron monocitos derivados de la médula ósea humana (hBMC) en injertos vasculares y descubrieron que las células sembradas reclutaban células huésped en la pared del injerto a través de la liberación de la proteína quimioatrayente de monocitos-1 (MCP-1), promoviendo así la regeneración del tejido vascular12. En este estudio, se propuso un método eficiente de siembra de células de adsorción por perfusión y se utilizó con éxito para sembrar macrófagos en injertos vasculares de diámetro pequeño de policaprolactona (PCL). Después de la implantación, estas células exhibieron una viabilidad sostenida.
En este artículo se detalla la metodología para la preparación de injertos vasculares de ingeniería tisular y el procedimiento de implantación de la arteria carótida en ratones mediante la técnica del manguito. El proceso comienza con la fabricación de injertos vasculares de pequeño diámetro PCL con parámetros definidos mediante hilatura electrostática. Posteriormente, los injertos considerados aptos para la implantación se someten a pruebas mecánicas. A continuación, los macrófagos se siembran en los injertos vasculares mediante el método de adsorción por perfusión. Finalmente, se implantan injertos vasculares sembrados con macrófagos en la arteria carótida del ratón mediante la técnica del manguito, y se analizan la permeabilidad y las propiedades regenerativas después de un mes de implantación in vivo .
Esta técnica tiene el potencial de mejorar la eficacia y las tasas de éxito del injerto vascular en modelos de ratón. Además, el modelo se puede utilizar para investigar los mecanismos subyacentes a las fuentes celulares, los genes fundamentales y los factores activos en la regeneración vascular, proporcionando apoyo teórico y metodológico para la modificación funcional y el desarrollo de nuevos injertos vasculares de pequeño diámetro.
Protocolo
Todos los procedimientos con animales fueron aprobados por el Comité Ético de Experimentos con Animales del Instituto de Medicina Radiológica de la Academia China de Ciencias Médicas, y cumplieron con las Directrices para el Cuidado y Uso de Animales de Laboratorio. En este estudio se utilizaron ratones machos C57BL/6, de 6-8 semanas de edad, con un peso corporal de 25-30 g. Los detalles de los reactivos y equipos utilizados en este estudio se enumeran en la Tabla de Materiales.
1. Fabricación de injertos vasculares de pequeño diámetro
NOTA: Fabricar injertos vasculares de PCL de pequeño diámetro utilizando la técnica de electrohilado13.
- Prepare soluciones de PCL al 10%, 15% y 20% (p/v) en hexafluoroisopropanol (HFIP) a temperatura ambiente (RT) durante 12 h.
- Cargue las soluciones de PCL en una jeringa de 10 ml y coloque la jeringa con una aguja de acero inoxidable de 21 g.
- Coloque un mandril de acero de tungsteno (0,7 mm de diámetro, 20 cm de longitud) sobre el instrumento de recolección.
- Fabricación de nueve grupos de injertos vasculares de PCL mediante la técnica de electrohilado. Conecte una fuente de alimentación de alto voltaje a la aguja. Coloque una varilla de acero de tungsteno con un diámetro interior de 0,7 mm a una distancia fija frente a la aguja como dispositivo receptor.
NOTA: La descripción de los grupos de injertos vasculares se proporciona en la Tabla 1, y los parámetros de los injertos vasculares se detallan en la Tabla 2. - Someter los injertos vasculares fabricados a un proceso de evacuación. Colocar los injertos vasculares en un horno de secado al vacío durante 72 h para eliminar los disolventes residuales.
- Esterilice los injertos sumergiéndolos en alcohol medicinal durante 30 minutos y exponiéndolos a la luz ultravioleta durante la noche.
- Observar la morfología microscópica de los injertos vasculares utilizando un microscopio electrónico de barrido (SEM). Fije los injertos vasculares a la etapa de muestra SEM con adhesivo conductor y colóquelos en el dispositivo de pulverización catódica de oro para el recubrimiento.
- Observar la estructura y morfología de las fibras de los injertos vasculares mediante SEM a una tensión acelerada de 15 kV. Mida el diámetro de la fibra y el tamaño de los poros a partir de imágenes SEM (n = 5) utilizando el software ImageJ.
- Evaluar las propiedades mecánicas (propiedades de tracción y elasticidad) de los injertos vasculares utilizando una máquina de ensayo de tracción. Pinzar los extremos superior e inferior del injerto vascular con pinzas fijas espaciadas 1 cm.
- Estirar el injerto vascular a una velocidad de 10 mm/min hasta la ruptura. Recoja la curva de tensión-deformación de la máquina de prueba de tracción.
- Calcule los parámetros mecánicos, incluida la carga máxima (2-15 N), la tensión a la rotura (5-30 MPa), la deformación a la rotura (200%-1500%) y el módulo elástico (1-20 MPa)14.
- Realizar análisis estadísticos utilizando software estadístico y de gráficos. Exprese los datos como media ± desviación estándar. Analice y compare las diferencias univariadas entre varios grupos utilizando la prueba post hoc de Tukey en ANOVA de un factor. *P < 0,05, **P < 0,01, ***P < 0,001.
2. Siembra de macrófagos en injertos vasculares
NOTA: Asegúrese de que todas las soluciones y materiales sean estériles. Realizar todas las operaciones dentro de la sala de cultivo celular.
- Cultivo RAW264.7 (macrófago monocitario de ratón) en matraces en condiciones adherentes (Figura 1A). Prepare el medio de cultivo celular utilizando el medio de Eagle modificado de Dulbecco (DMEM) completo suplementado con un 1% de penicilina-estreptomicina y un 10% de suero fetal bovino. Coloque los matraces en una incubadora a 37 °C que contenga un 5% de dióxido de carbono.
- Recoja macrófagos con un raspador de células. Deseche el medio con una pipeta de 1 ml y lave las células con PBS.
- Añada 2 ml de medio fresco al matraz de cultivo y raspe suavemente la superficie con un raspador de células. Transfiera las células recolectadas a un tubo y centrifugue a 1,000 x g durante 5 min a temperatura ambiente. Resuspender 5 × 106 células en 100 μL de medio completo.
- Colocar un injerto vascular de PCL (1 cm de longitud) en un tubo de 15 mL lleno de DMEM y centrifugar a 4.000 x g durante 5 min. Repita este proceso varias veces hasta que el injerto se hunda en el fondo del tubo, asegurando la infiltración completa del material con DMEM.
- Prepara una placa de Petri de 10 cm forrada con una capa de papel de filtro. Coloque el injerto vascular PCL humedecido sobre el papel de filtro y enróllelo para eliminar el exceso de medio.
- Tome 10 μL de la suspensión celular con una pipeta de 10 μL e inyéctela en un extremo del injerto vascular. Gire el injerto vascular sobre el papel de filtro para facilitar la distribución uniforme de la suspensión. Inyecte cada extremo cinco veces para un total de diez inyecciones (Figura 1B, C).
- Colocar el injerto vascular cargado de macrófagos en una placa de 24 pocillos que contenga 1 mL de medio completo e incubar durante 2 h en una incubadora de cultivo celular antes de la implantación.
- Determine la distribución de las células dentro de la pared del injerto. Incrustar el injerto vascular cargado de macrófagos en un compuesto de tomografía de coherencia óptica (OCT) para la criosección. Teñir los núcleos celulares con 4',6-diamidino-2-fenilindol (DAPI) y observar bajo un microscopio de fluorescencia.
3. Modelo de implante de arteria carótida de ratón
NOTA: Mantenga un área quirúrgica estéril para procedimientos con animales. Esterilice todos los instrumentos quirúrgicos y desechables antes de la cirugía.
- Seleccione tres ratones machos C57BL/6 sanos, cada uno con un peso de 25 a 30 g. Ayuna a los ratones el día antes de la cirugía. Implantar un injerto vascular en cada animal, para un total de tres injertos.
- Construya manguitos a partir de un tubo de nailon (Figura 2A) y presente el diagrama esquemático de la técnica del manguito vascular en la Figura 2B.
- Anestesiar a los ratones mediante inyección intraperitoneal de pentobarbital sódico a una concentración de 50 mg/kg (siguiendo protocolos aprobados institucionalmente). Confirme la eficacia de la anestesia asegurando la relajación muscular y la respiración uniforme. Aplique ungüento oftálmico de vaselina en los ojos para prevenir la sequedad durante la anestesia.
- Coloque el ratón en posición supina sobre la mesa de operaciones y retire el vello del cuello. Esterilizar la zona quirúrgica con yodóforo. Cubra el área no quirúrgica con gasa estéril para mantener un ambiente estéril (Figura 3A).
- Utilice unas tijeras oftálmicas para hacer una incisión en la línea media (de 1,5 a 2 cm de longitud) desde la mandíbula hasta el esternón. Eleve las glándulas salivales izquierdas y extirpe el músculo cleidomastoideo izquierdo para aumentar el campo de visión quirúrgico. Exponga la arteria carótida común izquierda con micropinzas (Figura 3B).
- Aislar la arteria carótida izquierda con micropinzas (Figura 3C).
- Lisea la arteria carótida en dos lugares en la porción media usando una sutura 9-0. Transecte la arteria entre las dos ligaduras con unas microtijeras. Pase el manguito a través de las arterias en cada extremo y asegure la arteria y el manguito con clips arteriales (Figura 3D).
- Gire la arteria hacia afuera para cubrir el cuerpo del manguito y asegúrela al manguito con una sutura 9-0 con micropinzas (Figura 3E).
- Implante un injerto vascular entre los dos extremos de la arteria carótida deslizando los extremos del injerto sobre el manguito de la arteria y asegurándolos con suturas 9-0 (Figura 3F).
NOTA: Los datos dimensionales del manguito, la arteria carótida y el injerto vascular se presentan en la Tabla 3. Aunque los diámetros del injerto y del manguito coinciden estrechamente con los de las arterias carótidas del ratón, existe un desajuste entre el diámetro de la luz anastomótica y el diámetro del injerto. El diámetro de la luz anastomótica se calcula restando el doble del grosor de la pared de la arteria carótida (0,1 mm) del diámetro interno del manguito (0,5 mm), lo que da como resultado un diámetro de la luz de 0,3 mm. El injerto vascular tiene un diámetro interno de 0,7 mm, lo que provoca un desajuste de aproximadamente 2,3 veces (0,7 mm / 0,3 mm = 2,3). - Retire las pinzas arteriales en ambos extremos e irrigar el sitio de implantación con solución salina. Evaluar la permeabilidad del injerto vascular mediante la observación de la pulsación arterial distal (Figura 3G).
- Reposicione la glándula salival izquierda y cierre el sitio quirúrgico con suturas 6-0 (Figura 3H).
4. Cuidados y análisis post-procedimiento
- Transfiera el ratón a una incubadora a 37 °C y controle continuamente sus signos vitales hasta que recupere la conciencia.
- Inyectar 5 mg/kg de carbinol para el alivio del dolor postoperatorio.
- Supervise el ratón durante el período de recuperación y no lo devuelva a la carcasa grupal hasta que se haya recuperado por completo.
- Anestesiar a los ratones un mes después de la implantación y recolectar las muestras de injerto vascular para su análisis histológico9.
- Realizar la eutanasia mediante asfixia por CO2 seguida de luxación cervical siguiendo las pautas éticas.
Resultados
Se prepararon con éxito injertos vasculares de pequeño diámetro con diferentes parámetros mediante electrospinning. Las imágenes SEM revelaron que las fibras estaban distribuidas uniformemente y exhibían una disposición irregular dentro de la pared del injerto, con la presencia de estructuras de poros (Figura 4). A medida que aumentaba la concentración de PCL, tanto el diámetro de la fibra como el tamaño de los poros aumentaban. Los valores específicos para cada grupo de injertos vasculares se presentan en la Tabla 2. Los resultados de las pruebas mecánicas demostraron que todos los injertos vasculares cumplían con los estándares mecánicos requeridos. La carga máxima y la deformación a la rotura aumentaron con mayores concentraciones de PCL y mayor espesor de la pared vascular (Figura 5A-C), mientras que el módulo de elasticidad disminuyó (Figura 5D). Sobre la base de estos hallazgos, se seleccionaron injertos vasculares de diámetro pequeño con una concentración de PCL del 15% y un grosor de pared de 150 μm como los injertos óptimos para experimentos posteriores.
En este estudio, los macrófagos se sembraron en injertos vasculares utilizando el método de adsorción por perfusión. El análisis SEM confirmó que los macrófagos se sembraron con éxito en los injertos vasculares y exhibieron una distribución uniforme (Figura 6A). Los injertos transversales sometidos a tinción con DAPI revelaron que los macrófagos sembrados se habían infiltrado desde la luz del injerto hacia la pared del injerto (Figura 6B).
Treinta días después de la implantación in vivo , la tasa de supervivencia de los animales fue del 100%, y dos de los tres injertos vasculares implantados permanecieron patentes, lo que fue un resultado satisfactorio en los modelos de ratón. No se observaron aneurismas ni encapsulación fibrosa discernible de los injertos bajo un microscopio estereoscópico (Figura 7A). El grado de infiltración celular y la regeneración tisular se evaluaron más a fondo mediante análisis histológico. La tinción con hematoxilina y eosina (H&E) reveló una infiltración celular sustancial dentro de la pared del injerto y formación de neotejido dentro de la luz interna del injerto (Figura 7B). La tinción con inmunofluorescencia CD31 demostró la regeneración de una sola capa de tejido endotelial dentro de la luz interna de los injertos, con una cobertura de células endoteliales relativamente intacta (Figura 7C).

Figura 1: Procedimiento de siembra de células. (A) Cultivo de células RAW264.7. Barra de escala: 100 μm. (B) Esquema del proceso de siembra de células. (C) Células RAW264.7 sembradas en la pared del injerto utilizando el método de perfusión-adsorción. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Técnica del manguito. (A) Preparación de manguitos vasculares. (B) Representación esquemática de la técnica del manguito vascular. Mediante este método, se implantaron injertos vasculares en la arteria carótida. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Procedimiento quirúrgico para la implantación de un injerto vascular en un modelo de ratón. (A) Inyección de anestésicos, colocación del ratón en posición supina e inmovilización de las patas. (B) Exposición del área quirúrgica. (C) Aislamiento de la arteria carótida. (D) Colocación del manguito alrededor de la arteria carótida. (E) Eversión de la arteria sobre el cuerpo del manguito y fijación mediante una sutura 9-0. (F) Funda del injerto vascular sobre el manguito arterial y sutura. (G) Retirada de pinzas vasculares. (H) Cierre de la piel. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Morfología de los injertos vasculares de policaprolactona (PCL) electrohilados. Imágenes representativas de microscopía electrónica de barrido (SEM) que demuestran la estructura fibrosa bien definida de los injertos vasculares. Barras de escala: 500 μm y 50 μm (imágenes ampliadas). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Propiedades mecánicas de los injertos vasculares de PCL electrohilados. Caracterización mecánica de los injertos vasculares en dirección longitudinal, mostrando la carga máxima (A), la tensión máxima (B), la deformación a la rotura (C) y el módulo elástico (D). Los datos se expresan como media ± desviación estándar (DE) (n = 3). *P < 0,05, **P < 0,01, ***P < 0,001, ANOVA de un factor seguido de la prueba post hoc de Tukey. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Caracterización de injertos cargados con células. (A) Imágenes SEM representativas y (B) tinción con 4',6-diamidino-2-fenilindol (DAPI) de injertos vasculares cargados de células, que muestran una implantación exitosa de macrófagos y una distribución uniforme. Barras de escala: 30 μm y 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
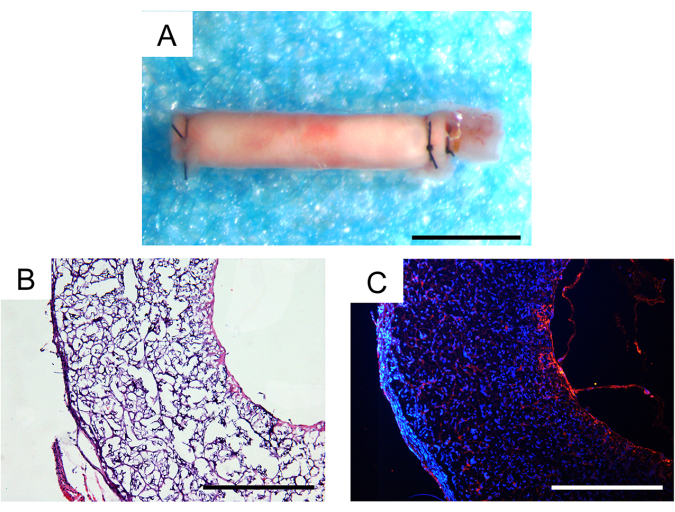
Figura 7: Análisis histológico de los injertos vasculares explantados un mes después de la implantación. (A) Imagen estereoscópica que no muestra formación de aneurisma ni encapsulación fibrosa. Barra de escala: 500 μm. (B) Tinción de hematoxilina y eosina (H&E) que demuestra buena celularización y regeneración tisular. Barra de escala: 200 μm. (C) Tinción de inmunofluorescencia CD31 que revela una monocapa de células endoteliales en la superficie luminal. Barra de escala: 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
| Grupo | Concentración de PCL solución (%) | Espesor del injerto vascular (μm) | Distancia entre la aguja y el colector (cm) | gasto (mL/h) | voltaje (kV) |
| 10%-100 | 10 | 100 | 15 | 2 | 18 |
| 10%-150 | 10 | 150 | 15 | 2 | 18 |
| 10%-200 | 10 | 200 | 15 | 2 | 18 |
| 15%-100 | 15 | 100 | 15 | 2 | 18 |
| 15%-150 | 15 | 150 | 15 | 2 | 18 |
| 15%-200 | 15 | 200 | 15 | 2 | 18 |
| 20%-100 | 20 | 100 | 13 | 8 | 12 |
| 20%-150 | 20 | 150 | 13 | 8 | 12 |
| 20%-200 | 20 | 200 | 13 | 8 | 12 |
Tabla 1: Descripción de los grupos de injertos vasculares. PCL: policaprolactona.
| Grupo | Diámetro de la fibra (μm) | Tamaño de poro (μm) |
| 10%-100 | 0,51±0,12 | 2.48±1.38 |
| 10%-150 | 0,91±0,4 | 1,83±0,84 |
| 10%-200 | 0,73±0,35 | 2,24±0,83 |
| 15%-100 | 1,85±0,3 | 8,91±2,87 |
| 15%-150 | 1,82±0,34 | 8,41±2,72 |
| 15%-200 | 2,18±0,47 | 9.59±3.01 |
| 20%-100 | 3.61±1.02 | 13,95±4,7 |
| 20%-150 | 3,06±0,56 | 13.12±3.36 |
| 20%-200 | 3,46±0,66 | 13.92±4.19 |
Tabla 2: Parámetros estructurales de diferentes injertos vasculares.
| Grupo | Diámetro interno (mm) | Diámetro externo (mm) | Espesor de la pared (μm) | longitud (cm) |
| carótida | 0.5-0.6 | 0.6-0.7 | 100 | / |
| Injerto vascular | 0.7 | 1 | 150 | 0.8 |
| puño | 0.5 | 0.63 | 65 | / |
Tabla 3: Datos dimensionales del manguito, arteria carótida e injerto vascular.
Discusión
El uso de la técnica del manguito para implantar injertos vasculares de ingeniería tisular en la arteria carótida del ratón representa un avance significativo en la investigación cardiovascular15. Los pasos críticos de esta técnica incluyen la siembra de células y la implantación del injerto. Este estudio empleó un enfoque de adsorción por perfusión para mejorar la densidad de siembra de macrófagos para abordar problemas relacionados con la siembra celular no uniforme y la baja viabilidad celular. Este método permitió a los macrófagos infiltrarse en la pared del injerto vascular y distribuirla uniformemente.
Con respecto a la implantación vascular, la técnica del manguito, a diferencia de la anastomosis de extremo a extremo16, puede estar asociada a una mayor incidencia de estenosis, particularmente cuando se aplica a vasos con diámetros más pequeños. Para minimizar este efecto, se seleccionaron manguitos con diámetros internos y externos muy similares a los de las arterias carótidas del ratón. Las dimensiones relevantes se proporcionan en la Tabla 3.
Esta técnica facilita un procedimiento quirúrgico más sencillo para la implantación de un injerto vascular en la arteria carótida del ratón. Los modelos animales más frecuentemente utilizados en estudios previos de injertos vasculares de pequeño diámetro incluyen la fístula arteriovenosa yugular de oveja y los modelos de implante de arteria abdominal de rata17,18. Estos modelos son efectivos para evaluar la resistencia mecánica y la capacidad de remodelación tisular de los injertos vasculares; sin embargo, su capacidad para dilucidar los mecanismos subyacentes es limitada. Los ratones modificados genéticamente se han convertido en un modelo importante para investigar los mecanismos de regeneración vascular, abordando las limitaciones de otros modelos animales.
Por ejemplo, los ratones knockout de apolipoproteína E (ApoE) desarrollan espontáneamente hipercolesterolemia y lesiones ateroscleróticas19, lo que los convierte en un modelo valioso para simular condiciones clínicas que requieren trasplante vascular. La evaluación de la permeabilidad vascular y la regeneración en ratones knockout de ApoE proporciona datos de referencia importantes para la traducción clínica de injertos vasculares. Además, los ratones con deficiencia de genes se pueden utilizar para investigar el papel de genes clave en la regeneración vascular. La óxido nítrico sintasa endotelial (eNOS), un regulador crítico de la función vascular, es una fuente primaria de óxido nítrico20. Los ratones con deficiencia del gen eNOS sirven como modelo de investigación para dilucidar los mecanismos por los cuales este gen influye en la remodelación vascular. Además, el origen de las células implicadas en la regeneración del tejido vascular puede explorarse mediante el marcaje celular in vivo y el rastreo del linaje utilizando ratones herramienta de genes reporteros21,22.
Esta técnica tiene ciertas limitaciones en cuanto al número de animales utilizados y la duración del trasplante. El presente estudio se centró principalmente en evaluar la viabilidad de este método de injerto utilizando un enfoque in vivo a corto plazo. Los estudios futuros deben aumentar el tamaño de la muestra y realizar evaluaciones a largo plazo para evaluar de manera integral el impacto de este método en la formación de aneurismas, la permeabilidad y la hiperplasia intimal.
Además, la tasa de permeabilidad del injerto fue del 66,6%, lo que puede haber sido influenciado por un desajuste de diámetro (2,3 veces) en el sitio de la anastomosis. Este desajuste puede provocar alteraciones localizadas del flujo sanguíneo, lo que aumenta el riesgo de trombosis. Se necesitan más estudios para optimizar el diseño del manguito a fin de reducir las discrepancias de diámetro e investigar sus efectos sobre las tasas de permeabilidad.
En conclusión, el modelo de implante de la arteria carótida de ratón basado en la técnica del manguito proporciona un modelo animal sencillo y eficaz para la evaluación biológica de injertos vasculares de pequeño diámetro. Además, permite investigar el papel de varios tipos de células en la remodelación del tejido vascular y los mecanismos regenerativos subyacentes.
Divulgaciones
Los autores no tienen intereses financieros contrapuestos.
Agradecimientos
La financiación de este estudio fue proporcionada por los proyectos de la Fundación Nacional de Ciencias Naturales de China (n.º 32101098, 32071356 y 82272158) y el Fondo de Innovación CAMS para las Ciencias Médicas (n.º 2022-I2M-1-023).
Materiales
| Name | Company | Catalog Number | Comments |
| 1% penicillin-streptomycin | Solarbio | P1400 | |
| 10% fetal bovine serum | Gibco | A5256701 | |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 4',6-Diamidino-2-Phenylindole (DAPI) | SouthernBiotech | 0100-20 | |
| Alcohol | Tianjin Chemical Reaggent Company | 1083 | |
| Anti-Mouse CD31 primary antibody | BD Bioscience | 553370 | |
| Arterial clips | RWD Life Science | R31005-06 | |
| C57BL/6 mice | Beijing Vital River Laboratory Animal Technology Company | ||
| Dulbecco's modified eagle medium (DMEM) | Gibco | 11966025 | |
| Electrostatic spinning machine | Yunfan Technology | DP30 | |
| Goat anti-rat IgG (Alexa Fluor 555) | Invitrogen | A-21434 | |
| Hematoxylin and eosin (H&E) | Solarbio | G1120 | |
| Hexafluoroisopropanol (HFIP) | McClean | H811026 | |
| Iodophor | LIRCON | V273068 | |
| Microscissors | World Precision Instruments | 14124 | |
| Microtweezers | World Precision Instruments | 500338 | |
| Normal goat serum | Boster | AR0009 | |
| Normal saline | Cisen Pharmaceutical company | H20113369 | |
| Nylon tube for cuff | Portex | ||
| Optimal cutting temperature compound (OCT) | Sakara | 4583 | |
| Pentobarbital sodium | Sigma | P3761 | |
| Phosphate Buffered Saline (PBS) | Solarbio | P1003 | |
| Poly(ε-caprolactone) (PCL) pellets (Mn = 80,000) | Sigma | 704067 | |
| RAW264.7 macrophages | Biyuntian Biotechnology | ||
| Scanning electron microscope (SEM) | Zeiss | PHENOM-XL-G2 | |
| Surgical sutures 6-0 | Ningbo Chenghe microapparatus factory | 220919 | |
| Surgical sutures 9-0 | Ningbo Chenghe microapparatus factory | 221006 | |
| Syringe | Changqiang Medical Devices | 0197 | |
| Tensile testing machine | Instron | WDW-5D |
Referencias
- Adhikary, D., Barman, S., Ranjan, R., Stone, H. A systematic review of major cardiovascular risk factors: A growing global health concern. Cureus. 14 (10), e30119 (2022).
- Alexander, J. H., Smith, P. K. Coronary-artery bypass grafting. N Engl J Med. 374 (20), 1954-1964 (2016).
- Jeong, Y., Yao, Y., Yim, E. K. F. Current understanding of intimal hyperplasia and effect of compliance in synthetic small diameter vascular grafts. Biomater Sci. 8 (16), 4383-4395 (2020).
- Lawson, J. H., et al. Bioengineered human acellular vessels for dialysis access in patients with end-stage renal disease: Two phase 2 single-arm trials. Lancet. 387 (10032), 2026-2034 (2016).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Sci Transl Med. 11 (485), eaau6934 (2019).
- Wang, C., Li, Z., Zhang, L., Sun, W., Zhou, J. Long-term results of triple-layered small diameter vascular grafts in sheep carotid arteries. Med Eng Phys. 85, 1-6 (2020).
- Tanaka, T., et al. Evaluation of small-diameter silk vascular grafts implanted in dogs. JTCVS Open. 6, 148-156 (2021).
- Jin, X., et al. Preparation of small-diameter tissue-engineered vascular grafts electrospun from heparin end-capped PCL and evaluation in a rabbit carotid artery replacement model. Macromol Biosci. 19 (8), e1900114 (2019).
- Xiao, Y., et al. Fabrication of small-diameter in situ tissue engineered vascular grafts with core/shell fibrous structure and a one-year evaluation via rat abdominal vessel replacement model. Biomater Adv. 165, 214018 (2024).
- Wei, Y., Wang, F., Guo, Z., Zhao, Q. Tissue-engineered vascular grafts and regeneration mechanisms. J Mol Cell Cardiol. 165, 40-53 (2022).
- Cleary, M. A., et al. Vascular tissue engineering: The next generation. Trends Mol Med. 18 (7), 394-404 (2012).
- Roh, J. D., et al. Tissue-engineered vascular grafts transform into mature blood vessels via an inflammation-mediated process of vascular remodeling. Proc Natl Acad Sci U S A. 107 (10), 4669-4674 (2010).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- Wu, Y., et al. Peptide-tethered vascular grafts enable blood vessel regeneration via endogenous cell recruitment and neovascularization. Compos B Eng. 252, 110504 (2023).
- Hu, Y., Xu, Q. Vessel graft atherosclerosis in murine models. Curr Drug Targets. 9 (3), 239-250 (2008).
- Qin, K., et al. Implantation of electrospun vascular grafts with optimized structure in a rat model. J Vis Exp. (136), e57340 (2018).
- Geelhoed, W. J., et al. A novel method for engineering autologous non-thrombogenic in situ tissue-engineered blood vessels for arteriovenous grafting. Biomaterials. 229, 119577 (2020).
- Wu, P., et al. Construction of vascular graft with circumferentially oriented microchannels for improving artery regeneration. Biomaterials. 242, 119922 (2020).
- Vasquez, E. C., Peotta, V. A., Gava, A. L., Pereira, T. M., Meyrelles, S. S. Cardiac and vascular phenotypes in the apolipoprotein e-deficient mouse. J Biomed Sci. 19 (1), 22 (2012).
- Garcia, V., Sessa, W. C. Endothelial nos: Perspective and recent developments. Br J Pharmacol. 176 (2), 189-196 (2019).
- He, L., et al. Enhancing the precision of genetic lineage tracing using dual recombinases. Nat Med. 23 (12), 1488-1498 (2017).
- Wang, F., et al. Nitric oxide improves regeneration and prevents calcification in bio-hybrid vascular grafts via regulation of vascular stem/progenitor cells. Cell Rep. 39 (12), 110981 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados